51.氯化钠( )53.氯化钾( )54.氯化镁( )55.氯化钙( )56.氯化锌( )57.氯化钡( )
 1862162022-10-04 11:39:541条回答
1862162022-10-04 11:39:541条回答58.氯化银( )59.氯化铜( )60.氯化亚铜( )61.氯化铁( )62.氯化亚铁( )
63.氯化铵( )64.氯化铝( )
硫酸盐
65.硫酸钠( )66.硫酸钾( )67.硫酸铜( )68.硫酸镁( )69.硫酸钙( )70.硫酸铁( )
71.硫酸亚铁( )72.硫酸铝( )73.硫酸锌( )74.硫酸钡( )75.硫酸铵( )
碳酸盐
76.碳酸钠(纯碱)( )77.碳酸钾( )78.碳酸钙(石灰石)79.碳酸钡( )80.碳酸铵( )
81.碳酸铜( )82.碳酸银( )
硝酸盐
83.硝酸钠( )84.硝酸钾(复合肥)( )85.硝酸铜( )86.硝酸铁( )87.硝酸亚铁( )
88.硝酸钙( )89.硝酸银( )90.硝酸镁( )91.硝酸铵( )92.硝酸铝( )
其它盐类
93.高锰酸钾( )94.锰酸钾( )95.碱式碳酸铜(铜绿)( )96.碳酸氢钠(小苏打)( )

已提交,审核后显示!提交回复
共1条回复
 e2453d0c8e054ada 共回答了20个问题
e2453d0c8e054ada 共回答了20个问题 |采纳率85%- 51.NaCl 53.KCl 54.MgCl2 55.CaCl2 56.ZnCl2 57.BaCl2 58.AgCl 59.CuCl2 60.CuCl 61.FeCl3 62FeCl2 63.NH4Cl 64.AlCl3 65.Na2SO4 66.K2SO4 67.CuSO4 68.MgSO4 69.CaSO4 70.Fe2(SO4)3 71.FeSO4 72.Al2(SO4)3 73.ZnSO4 74.BaSO4 75.(NH4)2SO4 76.Na2CO3 77.K2CO3 78.CaCO3 79.BaCO3 80.(NH4)2CO3 81.CuCO3 82.CO3 2- 83.NaNO3 84.KNO3 85.Cu(NO3)2 86.Fe(NO3)3 87.Fe(NO3)2
88.Ca(NO3)2 89.AgNO3 90.Mg(NO3)2 91.NH4NO3 92.Al(NO3)3 93.KMnO4 94.K2MnO4 95.Cu2(OH)2CO3 96.NaHCO3 - 1年前
相关推荐
- 生产加碘盐通常是在氯化钠中加入碘酸钾(KIO3).为检验某食用盐样品中是否含有碘元素,某同学采用以下反应进行实验:KIO
生产加碘盐通常是在氯化钠中加入碘酸钾(KIO3).为检验某食用盐样品中是否含有碘元素,某同学采用以下反应进行实验:KIO3+5KI+3H2SO4═3K2SO4+3H2O+3X,则物质X的化学式为下列的( )
A. O2
B. H2
C. I2
D. I2O5 qzhq8171年前1
qzhq8171年前1 -
 88006044 共回答了15个问题
88006044 共回答了15个问题 |采纳率86.7%解题思路:根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式.根据质量守恒定律和化学方程式可得,X的化学式中含有K的个数为:(1+5-3×2)÷3=0,含有I的个数为:(1+5)÷3=2,含有O的个数为:(3+3×4-3×4-3)÷3=0,含有H的个数为:(3×2-3×2)÷3=0,含有S的个数为:(3-3)÷3=0;则X的化学式为:I2.
故选C.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力.利用质量守恒定律可以计算出元素的原子个数,据此推断出化学式.1年前查看全部
- (2005•崇明县一模)20℃时,氯化钠的溶解度为36克/100克水.在20℃时,将20克氯化钠放入50克水中,充分溶解
(2005•崇明县一模)20℃时,氯化钠的溶解度为36克/100克水.在20℃时,将20克氯化钠放入50克水中,充分溶解后所得溶液的质量是______克.
 孤星魂1年前1
孤星魂1年前1 -
 spring226 共回答了22个问题
spring226 共回答了22个问题 |采纳率77.3%解题思路:根据溶解度的含义进行解答.20℃时,氯化钠的溶解度为36g,即20℃时,在100g水中最多溶解36g氯化钠.所以在20℃时,将20克氯化钠放入50克水中,只有18g氯化钠溶解,所得溶液的质量是50g+18g=68g.
故答案为:68.点评:
本题考点: 固体溶解度的概念;溶液、溶质和溶剂的相互关系与判断.
考点点评: 将一定质量物质溶于水中所得溶液质量,要先根据溶解度算出能够溶解多少,不溶解的不能算溶液质量.1年前查看全部
- 氯化钠、硝酸钾、氯化铵、碳酸铵、尿素、属于盐类的是什么
氯化钠、硝酸钾、氯化铵、碳酸铵、尿素、属于盐类的是什么
如题 牛肉兔九1年前1
牛肉兔九1年前1 -
 天地无心 共回答了16个问题
天地无心 共回答了16个问题 |采纳率87.5%氯化钠、硝酸钾、氯化铵、碳酸铵属于盐类1年前查看全部
- 根据氯化钠和硝酸钾的溶解度表,回答下列问题:
根据氯化钠和硝酸钾的溶解度表,回答下列问题:
(1)写出KNO3和NaCl具有相同溶解度时的温度范围:______;(限表中相邻两个温度之间);项目 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃ NaCl 35.8g 36.0g 36.3g 36.6g 37.0g 37.3g 37.8g KNO3 20.9g 31.6g 45.8g 63.9g 85.5g 110g 138g
(2)在60℃时,向50g水中加入60g KNO3,充分搅拌后所得溶液质量为多少?
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量. 苦咖啡11年前1
苦咖啡11年前1 -
 pzhjcqx 共回答了23个问题
pzhjcqx 共回答了23个问题 |采纳率91.3%解题思路:(1)硝酸钾和氯化钠溶解度相同的温度即是判断该段中溶解度的数值是否存在相等的可能.
(2)查原题表格数据知:在60℃时,硝酸钾的溶解度为110g,求向50g水中加入60g KNO3,据题意要求计算既得结果.
(3)对溶解度随温度变化明显与不明显的混合物,可采用冷却热饱和溶液的方式进行.根据溶解度概念和溶质质量分数概念计算即可.(1)硝酸钾和氯化钠溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能,经分析知在20~30℃时这两种物质存在溶解度相同的可能;
(2)查原题表格数据知:在60℃时,硝酸钾的溶解度为110g,求向50g水中加入60gKNO3,充分搅拌后所得溶液质量为:50+55=105g.
(3)对溶解度随温度变化明显与不明显的混合物,可采用冷却热饱和溶液的方式进行,由表格分析知氯化钠的溶解度随温度变化很不明显.20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量.
设析出氯化钠晶体的质量为xg则
[36/100+36]=[200×20%-x/200-60-x],
解得x=4g
答:析出氯化钠晶体的质量为4g.
故答案为:(1)20℃--30℃;(2)105g;(3)4g点评:
本题考点: 固体溶解度的影响因素.
考点点评: 此题考查溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.1年前查看全部
- (2013•丹东)用固体氯化钠和水配制100g溶质质量分数为12%的氯化钠溶液.
(2013•丹东)用固体氯化钠和水配制100g溶质质量分数为12%的氯化钠溶液.
(1)量取所需水的体积.最好选用______(填“50mL”、“100mL”或“500mL”)的量筒.
(2)用量筒量水时,若俯视,则量取水的体积会______(填“偏大”、“偏小”或“不变”).
(3)规范的溶解操作,用到的仪器有______. 朱霖臻朱朱1年前1
朱霖臻朱朱1年前1 -
 LLY大hh1 共回答了29个问题
LLY大hh1 共回答了29个问题 |采纳率89.7%解题思路:(1)100g 12%的氯化钠溶液所需溶质的质量为100g×12%=12g,需要水的质量为100g-12g=88g,其体积为88mL,量筒量程的选取方法是比所量液体多,并最接近的;
(2)根据取用定量液体视线与刻度线及量筒内液体凹液面的最低点保持水平的原则,仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以俯视量取水的实际体积会比读数偏小;
(3)用固体和水配制溶液时,先用天平称取一定质量的药品,放入烧杯中,然后用量筒量取一定体积的水,加入烧杯中,用玻璃棒搅拌以加速溶解,配成溶液.(1)100g 12%的氯化钠溶液所需溶质的质量为100g×12%=12g,需要水的质量为100g-12g=88g,其体积为88mL,量筒量程的选取方法是比所量液体体积大,并最接近的,所以应选量程为100mL的量筒,
故答案为:100mL;
(2)根据取用定量液体视线与刻度线及量筒内液体凹液面的最低点保持水平的原则,仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以俯视量取水的实际体积会比读数偏小,
故答案为:偏小;
(3)规范的溶解操作,用到的玻璃仪器有量筒、烧杯、玻璃棒,
故答案为:量筒、烧杯、玻璃棒.点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;物质的溶解.
考点点评: 本题主要通过氯化钠溶液配制方法及注意事项,考查相关的基础知识.1年前查看全部
- 在水,铜,和氯化钠三种物质中,由离子构成的是 ( )
 cksoly1年前1
cksoly1年前1 -
 ttBOBO 共回答了12个问题
ttBOBO 共回答了12个问题 |采纳率91.7%氯化钠1年前查看全部
- (2008•塘沽区一模)将氯化镁和氯化钠的固体混合物25g,加入密度为1.2g/cm3、溶质的质量分数为20%的氢氧化钠
(2008•塘沽区一模)将氯化镁和氯化钠的固体混合物25g,加入密度为1.2g/cm3、溶质的质量分数为20%的氢氧化钠溶液50mL,充分反应后,过滤;所得滤液显碱性,在此碱性滤液中加入73g溶质的质量分数为5%的盐酸,恰好完全反应.求恰好完全反应时,滤液的溶质质量分数.
 luo_76611年前1
luo_76611年前1 -
 vcitorwoo520 共回答了19个问题
vcitorwoo520 共回答了19个问题 |采纳率84.2%50mL氢氧化钠溶液中NaOH的质量为:50mL×1.2g/cm3×20%=12g;盐酸中HCl的质量为:73g×5%=3.65g(1分)
设与盐酸反应的NaOH的质量为x,生成的氯化钠质量为m1;与NaOH反应的氯化镁的质量为y,生成的氢氧化镁沉淀质量为z,生成的氯化钠质量为m2.
NaOH+HCl═NaCl+H2O
4036.5 58.5
x 3.65g m1
40:x=36.5:3.65g
解之得x=4g(1分)
58.5:m1=36.5:3.65g
解之得 m1=5.85g
与氯化镁反应的NaOH的质量为:12g-4g=8g
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 8058 117
y 8gz m2
95:y=80:8g
解得y=9.5g
58:z=80:8g
解得z=5.8g
117:m2=80:8g
解得 m2=11.7g
则原混合物中氯化钠的质量为25g-9.5g=15.5g
最后得到的溶液中的氯化钠的质量为15.5g+5.85g+11.7g=33.05g
滤液的溶质质量分数为[33.05g/60g+73g+25g−5.8g]×100%≈21.7%
答:恰好完全反应时,滤液的溶质质量分数为:21.7%.1年前查看全部
- (2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
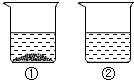 (2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
(2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
(1)医疗上,氯化钠常用于配制0.9%的生理盐水,生理盐水中溶质为______.温度/℃ 0 20 40 60 80 100 溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8 NH4Cl 29.4 37.2 45.8 55.2 65.6 77.3
(2)从海水中提取食盐通常采取晾晒海水的方法,这是因为随温度升高氯化钠的溶解度变化______(填“大”或“小”).
(3)20℃时,向100g水中加入25g氯化钠,充分溶解后,溶液中溶质质量分数为______.
(4)现有200g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一倍,应该蒸发掉______ g水.
(5)30℃时,向两个分别盛有相同质量的氯化钠和氯化铵的烧杯中,各加入100g水,充分溶解后,恢复至30℃,其结果如图所示.有关下列说法中,正确的是______(填字母序号).
A.烧杯②中溶液是不饱和溶液
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
D.将得到的烧杯②中溶液降温至0℃时,溶液中溶质质量分数一定减小. airaaaa1年前1
airaaaa1年前1 -
 sy182838 共回答了12个问题
sy182838 共回答了12个问题 |采纳率83.3%解题思路:(1)根据溶质的判断方法考虑;(2)根据氯化钠的溶解度数值变化考虑;(3)根据溶质质量分数的计算考虑;(4)根据蒸发水溶质不变列等式;(5)根据饱和溶液和不饱和溶液的判断和相互转化方法,溶质质量分数的计算方法考虑.(1)0.9%的生理盐水,是氯化钠溶于水形成的,溶质是氯化钠,溶剂是水;(2)由表中氯化钠溶解度数值的变化可知温度对氯化钠的溶解度的影响较小;(3)在20℃时,氯化钠的溶解度为36g,所以向100g水中加入25g氯化钠...
点评:
本题考点: 固体溶解度的影响因素;结晶的原理、方法及其应用;溶液、溶质和溶剂的相互关系与判断;饱和溶液和不饱和溶液;有关溶质质量分数的简单计算.
考点点评: 解答本题的关键是要通过表中数据分析出有晶体析出的是氯化钠,再根据溶解度可知它们放入的质量大于36g,再进行分析.1年前查看全部
- 怎样鉴别硫酸钠碳酸钠氯化钠求大神帮助
怎样鉴别硫酸钠碳酸钠氯化钠求大神帮助
加一种溶液 知道我在等你吗1年前4
知道我在等你吗1年前4 -
 hechec 共回答了19个问题
hechec 共回答了19个问题 |采纳率84.2%可以加入硝酸银,硝酸银跟氯化钠反应生成氯化银和硝酸,将生成的硝酸滴入剩余的两种物质中,有气泡生成的是碳酸钠,无现象的是硫酸钠.1年前查看全部
- 常温常压下58.5g氯化钠固体含na个氯化钠分子 句话错哪了
 抬头看烟花灿烂1年前2
抬头看烟花灿烂1年前2 -
 d020402061 共回答了13个问题
d020402061 共回答了13个问题 |采纳率84.6%常温常压下58.5g氯化钠固体的物质的量是1mol.但是由于氯化钠固体是离子晶体,是由钠离子和氯离子构成的,没有氯化钠分子.所以常温常压下58.5g氯化钠固体含NA个氯化钠分子是错的.正确的说法是常温常压下58.5g氯化钠固体含NA个钠离子和NA个氯离子.1年前查看全部
- 1.蔗糖由蔗糖( )构成2.铜由铜( )构成 3.氧气有氧( )构成 4.氧分子由氧( )构成 5.氯化钠由( )构成将
1.蔗糖由蔗糖( )构成
2.铜由铜( )构成 3.氧气有氧( )构成 4.氧分子由氧( )构成 5.氯化钠由( )构成
将分子、原子或离子填入下列空格 hh军事迷1年前1
hh军事迷1年前1 -
 chenwww 共回答了15个问题
chenwww 共回答了15个问题 |采纳率66.7%铜是原子,氧是分子,氧分子由氧原子构成,氯化钠由离子构成.1年前查看全部
- 在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
①用量筒量取水时俯视读数
②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯.
A. ①②③④⑤
B. 只有①②④⑤
C. 只有①②③
D. 只有②③④⑤ whitebread181年前1
whitebread181年前1 -
 因为青春所以骚动 共回答了17个问题
因为青春所以骚动 共回答了17个问题 |采纳率88.2%解题思路:由公式:溶质质量分数=[溶质质量/溶质质量+溶剂质量]×100%可以看出,若溶质质量偏小,将导致溶质质量分数偏小;若溶剂质量偏大也会导致溶质质量分数偏小.针对每项操作分析,将导致溶质或溶剂的质量如何改变,最后作出正确判断.①用量筒量取水时俯视读数,将导致所取水体积偏小,导致溶质质量分数偏大;
②配制溶液的烧杯用少量蒸馏水润洗会使所取水质量增加,导致溶质质量分数偏小;
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数,使读数中增加了开始游码所处位置质量,从而导致所得氯化钠质量偏小,最终溶质质量分数偏小;
④盛装溶液的试剂瓶用蒸馏水润洗,会使溶剂质量偏大,导致溶质质量分数偏小;
⑤氯化钠晶体不纯,会使所得溶质质量中一部分为杂质质量,所得氯化钠质量偏小,导致溶质质量分数偏小.
所以②③④⑤正确,
故选:D.点评:
本题考点: 实验数据处理或者误差分析的探究;一定溶质质量分数的溶液的配制.
考点点评: 该题以溶液配制为载体,考查了错误或不规范操作引起的溶质质量分数变化的问题,解答时要认真分析错误操作导致的溶质或溶剂质量的改变,再结合溶质质量分数的计算公式,最后作出正确判断.1年前查看全部
- (2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气
(2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气加热,氯化钠不分解,硝酸铵能分解.硝酸铵分解得到的气体不可能是( )
A.NH3
B.SO2
C.NO2
D.N2 Lydia_t1年前1
Lydia_t1年前1 -
 uu觅者 共回答了15个问题
uu觅者 共回答了15个问题 |采纳率93.3%解题思路:根据质量守恒定律,化学反应前后,元素的种类不变进行分析.化学反应前后元素的种类不变,硝酸铵中有氮元素、氢元素、氧元素三种元素,故分解后得到的气体中只能含有这三种元素.
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律,明白元素的种类在化学反应前后不变是解决本题的关键.1年前查看全部
- 在2008年春节期间,许多遭受雪灾的地区使用氯化钠、氯化镁等融雪盐除雪.下列有关说法正确的是( )
在2008年春节期间,许多遭受雪灾的地区使用氯化钠、氯化镁等融雪盐除雪.下列有关说法正确的是( )
A.撒了融雪盐的积雪融化后对周边的植被及河流没有影响
B.融雪盐能与冰反应生成水
C.应大力推广使用融雪盐去除道路积雪
D.过量使用融雪盐会加速钢铁桥梁的腐蚀 留在唐朝1年前1
留在唐朝1年前1 -
 微笑的真诚 共回答了15个问题
微笑的真诚 共回答了15个问题 |采纳率100%解题思路:A.融雪盐会污染绿地河流;
B.对根据融雪盐的成分来确定其性质;
C.根据融雪盐的使用产生的危害来回答判断;
D.原电池能加快化学反应的速率.A.融雪盐会污染绿地河流,撒了融雪盐的积雪不宜往绿地、河流中倾倒,故A错误.
B.融雪盐氯化钠、氯化镁都不能与冰反应,故B错误;
C.融雪盐会污染绿地河流,不大力推广使用融雪盐去除道路积雪,故C错误;
D.融雪盐作为电解质,与钢铁中的铁和碳构成原电池,原电池能加快化学反应的速率,会加速钢铁桥梁的腐蚀,故D正确;
故选D.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查融雪盐及它产生的污染,难度不大,注意目前世界上使用的融雪盐主要有四种,包括氯化钠、氯化钙、氯化镁和氯化钾,统称作“融雪盐”.1年前查看全部
- 20℃时,向71克溶质的质量分数为20%的硫酸钠溶液中加入氯化钠和氯化钡的混合物30.6克,搅拌后恰好完全反应.过滤.
20℃时,向71克溶质的质量分数为20%的硫酸钠溶液中加入氯化钠和氯化钡的混合物30.6克,搅拌后恰好完全反应.过滤.
⑴求所得滤液中溶质的质量分数.
⑵求过滤后所得滤渣的质量.(20℃氯化钠的溶解度为36克,保留一位小数) 泡泡33661年前1
泡泡33661年前1 -
 八月妖儿 共回答了22个问题
八月妖儿 共回答了22个问题 |采纳率81.8%71g*20%=14.2g 71g-14.2g=56.8g
Na2SO4+BaCl2=BaSO4+2NaCl
142 208 233 117
14.2g x y z
142/14.2g=208/x=233/y=117/z
x=20.8g
y=23.3g
z=11.7g
氯化钠质量 11.7g+(30.6g-20.8g)=21.5g
反应后氯化钠有析出,形成饱和溶液.
所得滤液中溶质的质量 56.8g*36g/100g=20.448g1年前查看全部
- 为解压过滤举几个例子,2.纸层析法分离铁离子和铜离子实验中,展开剂的成分为丙酮。为什么?3.如何分离硝酸钾和氯化钠?
 wzsisgood1231年前1
wzsisgood1231年前1 -
 本-科尔 共回答了18个问题
本-科尔 共回答了18个问题 |采纳率72.2%第一个我看不太懂你的意思,其实很多都可以减压过滤的,特别是在强调得到干燥固体和速率方面,优先选择减压过滤第二个因为丙酮是有机物,不溶于水,所以在上升的过程中不会留在底部,同时由于两种离子在其中的溶解度不同,...1年前查看全部
- 如何鉴别碳酸钠,碳酸钾,氯化钠,硫酸钾?写出有关反应的化学方程式和离子反应式.
 海曼与人鱼1年前2
海曼与人鱼1年前2 -
 ylindi 共回答了12个问题
ylindi 共回答了12个问题 |采纳率91.7%先加AgNO3溶液碳酸钠:2AgNO3+Na2CO3=Ag2CO3↓+2NaNO32Ag+ +CO3-=Ag2CO3↓碳酸钾:2AgNO3+K2CO3=Ag2CO3↓+2KNO32Ag+ +CO3-=Ag2CO3↓氯化钠:AgNO3+NaCl=AgCl↓+NaNO3Ag+ +Cl-=AgCl↓硫酸钾无明显反应接着加HNO3碳酸钠和...1年前查看全部
- (2009•崇明县二模)实验室用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;
(2009•崇明县二模)实验室用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③计算;④量取水;⑤装瓶贴标签.正确的操作顺序是( )
A.①②③④⑤
B.③②④①⑤
C.①③⑤②④
D.③②④⑤① intria1年前1
intria1年前1 -
 startle 共回答了19个问题
startle 共回答了19个问题 |采纳率89.5%解题思路:根据配制溶质质量分数一定的溶液的基本步骤考虑;配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.
故选B.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 通过回答本题知道了配制溶质质量分数一定的溶液的基本步骤,要熟记它们并能灵活运用.1年前查看全部
- 固体氯化钠是由离子组成的吗?
 zwp30311年前1
zwp30311年前1 -
 gyj6868 共回答了23个问题
gyj6868 共回答了23个问题 |采纳率82.6%离子化合物,由氯化钠分子组成1年前查看全部
- “只有百分之百共价键,没有百分之百离子键”这句话是对的吗(如正确,请以氯化钠说明)
 gyzhong1年前3
gyzhong1年前3 -
 梦中回 共回答了19个问题
梦中回 共回答了19个问题 |采纳率89.5%其实严格意义上来说,离子键和共价键是没有严格的区分的.
离子键是两种电负性相差较大的元素形成的价键,而非极性共价键是相同元素之间形成的价键.所以说,非极性共价键是共价键缩小到的极限,而相反的,离子键就是共价键增大到的极限.如果两种元素的电负性相差值为1.7以上,一般都是形成离子键,反之就是共价键.氯化钠是一种离子化合物,因为钠元素和氯元素的电负性相差大,所以两种元素形成的化合物是离子化合物.1年前查看全部
- 氧化镁,氧气,二氧化碳,水,钙,氢氧化钙,氯化钠,碳酸钙,氯化氢
氧化镁,氧气,二氧化碳,水,钙,氢氧化钙,氯化钠,碳酸钙,氯化氢
哪些属于金属单质_____________
哪些是所含氧元素的存在状态为游离态的物质______-- fuliangfuliang1年前1
fuliangfuliang1年前1 -
 金星vince 共回答了17个问题
金星vince 共回答了17个问题 |采纳率94.1%金属单质:钙
氧元素游离态即氧单质:氧气1年前查看全部
- 氯化钠 溶液的电解怎样恢复原来的状态
 素心若雪1231年前3
素心若雪1231年前3 -
 天黑拉 共回答了18个问题
天黑拉 共回答了18个问题 |采纳率88.9%看走了什么呀!阳极走氯气 阴极走氢气 所以在电解后溶液里加氯化氢就可以了哈1年前查看全部
- 有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透
有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透明溶液的,最多有( )
A. 2组
B. 3组
C. 4组
D. 5组 gy8efhsb1年前1
gy8efhsb1年前1 -
 亦霖 共回答了14个问题
亦霖 共回答了14个问题 |采纳率107.1%解题思路:若物质之间相互交换成分,能结合成沉淀的则不能得到透明的溶液;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.物质加到水中得到无色澄清溶液,说明彼此之间不能生成沉淀,且不存在有色离子.
氯化铁加入蒸馏水形成g溶液呈黄色,不能形成无色透明溶液;氯化钠与硝酸银溶液反应生成氯化银白色沉淀,碳酸钙不溶于水,加入蒸馏水,均能够得到无色透明溶液.
氯化钠与硝酸钠、硝酸银与硝酸钠之间不反应,符合无色透明g要求.
故选:v.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题难度不是很大,对于能否得到无色透明的溶液,要注意彼此之间不能生成沉淀,还要注意特定离子的颜色.1年前查看全部
- 氯化钠溶于水中得到的溶液中含有的微粒有(些符号)
 a5040110561年前1
a5040110561年前1 -
 dicysong140 共回答了13个问题
dicysong140 共回答了13个问题 |采纳率92.3%分子:H2O
离子:Na+ Cl- H+ OH-
望采纳o亲!1年前查看全部
- 碳酸钠和盐酸反应生成氯化钠,二氧化碳和水 的符号表达式
 laogoo12101年前5
laogoo12101年前5 -
 天色微蓝 共回答了18个问题
天色微蓝 共回答了18个问题 |采纳率94.4%Na2CO3+2HCI=2NaCI+H2O+CO21年前查看全部
- 盐(氯化钠)的熔点和沸点分别是多少?
 hanyu_20061年前1
hanyu_20061年前1 -
 海色海洋 共回答了15个问题
海色海洋 共回答了15个问题 |采纳率100%化学式NaCl,食盐和石盐的主要成分,离子型化合物.无色透明的立方晶体,熔点为801 ℃,沸点为1413 ℃,相对密度为2.165.有咸味,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性.在水中的溶解度随着温度的升高略有增大.当温度低于0.15 ℃时可获得二水合物NaCl·2H2O.氯化钠大量存在于海水和天然盐湖中,可用来制取氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉及金属钠等,是重要的化工原料;可用于食品调味和腌鱼肉蔬菜,以及供盐析肥皂和鞣制皮革等;经高度精制的氯化钠可用来制生理食盐水,用于临床治疗和生理实验,如失钠、失水、失血等情况.可通过浓缩结晶海水或天然的盐湖或盐井水来制取氯化钠.1年前查看全部
- 硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
氯化钙 氯化镁 氯化锌 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铜 氯化亚铜 氯化钡 sp_zy1年前3
sp_zy1年前3 -
 江薇cc 共回答了16个问题
江薇cc 共回答了16个问题 |采纳率87.5%H2SO4
HCl
HNO3
KClO3
KMnO4
K2MnO4
KMnO3
NaCl
NaCl
KCl
CaCl2
MgCl2
ZnCl2
AlCl3
AgCl
FeCl3
FeCl2
CuCl2
CuCl
BaCl2
Cu(OH)2CO31年前查看全部
- 哪些是分子晶体:氯化钠、二氧化硅、氟化铵、硫酸钾、冰醋酸、硫单质
 zps_zps1年前2
zps_zps1年前2 -
 uywhs 共回答了16个问题
uywhs 共回答了16个问题 |采纳率100%氯化钠,离子晶体
氟化铵 ,离子晶体
SiO2 原子晶体
硫酸铵 离子晶体
冰醋酸和S是分子晶体.1年前查看全部
- 用氯化钠制成一百毫升溶液时,为什么量筒不需要洗涤?
用氯化钠制成一百毫升溶液时,为什么量筒不需要洗涤?
这样不会造成配成的溶液物质的量浓度偏小吗 无刀71年前2
无刀71年前2 -
 野鹤zaihu 共回答了19个问题
野鹤zaihu 共回答了19个问题 |采纳率94.7%量筒是量出式的容器,在设计时已经考虑到可能会在边上粘一部分,倒出的就是所需要的体积.量筒是量出式容器,倒入液体 后不需要用蒸馏水洗涤量筒,若洗涤量筒,取液体偏 多,配制溶液浓度偏大1年前查看全部
- 食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水.下列分析不正确的是
食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水.下列分析不正确的是( )
A. “双吸剂”中的生石灰有吸水作用
B. “双吸剂”吸收氧气时,发生了原电池反应
C. 吸收氧气的过程中,铁作原电池的负极
D. 炭粉上发生的反应为:O2+4e-+4H+=2H2O 大梦敦煌1年前3
大梦敦煌1年前3 -
 闪亮的星陈 共回答了19个问题
闪亮的星陈 共回答了19个问题 |采纳率89.5%解题思路:A.氧化钙能与水反应生成氢氧化钙,从而可以作干燥剂;
B.在食品包装中加入铁粉,与碳粉、氯化钠溶液可构成原电池;
C.Fe为活泼金属,易失去电子;
D.正极上氧气得到电子.A.氧化钙能与水反应生成氢氧化钙,具有吸水性,从而可以作干燥剂,则“双吸剂”中的生石灰有吸水作用,故A正确;
B.在食品包装中加入铁粉,与碳粉、氯化钠溶液可构成原电池,正极上氧气得到电子,发生了原电池反应,故B正确;
C.Fe为活泼金属,易失去电子,铁作原电池的负极,故C正确;
D.由选项BC可知,正极上氧气得到电子,电极反应为O2+4e-+2H2O=4OH-,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,为高频考查,把握习题中的信息及电化学腐蚀中的吸氧腐蚀原理为解答的关键,注意中性溶液中正极上氧气得到电子,题目难度不大.1年前查看全部
- 在生理盐水中氯化钠含量的测定中可不可以用荧光黄来代替k2cro4作指示剂
 xujiahaocn1年前1
xujiahaocn1年前1 -
 教主最经典 共回答了20个问题
教主最经典 共回答了20个问题 |采纳率95%肯定不可以了,是化学反应,是跟物质本身相关的,颜色只是一个表象.1年前查看全部
- 一道有关饱和食盐水的题目在饱和食盐水中存在的离子有 通电时向阴极的离子是用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳
一道有关饱和食盐水的题目
在饱和食盐水中存在的离子有 通电时向阴极的离子是
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是()
a.氢气和氯气 b,氢气和氧气c.铜和氯气 d.铜和氧气 xueliqin1年前2
xueliqin1年前2 -
 d3221837 共回答了18个问题
d3221837 共回答了18个问题 |采纳率100%在饱和食盐水中存在的离子有(H+,OH-,Na+,Cl-)( 电离方程式为2NaCl+2H2O===电解====2NaOH+H2+Cl2 )通电时向阴极(得电子)的离子是H+
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是
当电解质中含氯化铜,氯化钠两种物质时析出的物质是c.铜(阴)和氯气(阳)
又当电解完氯化铜(由阳离子析出顺序可知氯化铜首先被电离完),剩氯化钠时析出的物质是a.氢气(阴)和氯气(阳),当氯化钠被电解完后电解质中剩下氢氧化钠和水,电解的实质就是电解水,此时析出物为b,氢气(阴)和氧气(阳)
1.要注意水的电离中H+,OH-对电解的影响
2.要熟记电离中阳离子析出的先后顺序Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+1年前查看全部
- 粗食盐中的硫酸钠.氯化镁等可溶性杂质,应用化学方法使其转化为氯化钠.试剂的加入顺序可以是什么?【两种
 超级Q版yy1年前1
超级Q版yy1年前1 -
 水土流失s 共回答了17个问题
水土流失s 共回答了17个问题 |采纳率82.4%先加入过量氢氧化钡,再加入过量碳酸钠,再加入足量的盐酸1年前查看全部
- 在硝酸钠溶液中混有少量的氯化钡、氯化钠杂质,用下列那种方法既能除杂又不引进新的杂质
在硝酸钠溶液中混有少量的氯化钡、氯化钠杂质,用下列那种方法既能除杂又不引进新的杂质
A 先加硝酸银 再加稀硫酸
B 先加稀硫酸 再加硝酸银
C 先加硫酸钠 再加硝酸银
D 先加硝酸银 再加碳酸钾
最好过程也给我,不给也OK 7baopa1年前1
7baopa1年前1 -
 所有的垃圾 共回答了22个问题
所有的垃圾 共回答了22个问题 |采纳率104.5%d会引入k
a会引入硫酸根
b会引入银
所以选c1年前查看全部
- 准确称取8.2420gNaCl.用纯水定溶至1000ml.求此氯化钠标准溶液每毫升相当于多少克氯离子
 当时临风在1年前1
当时临风在1年前1 -
 平山雾罩 共回答了14个问题
平山雾罩 共回答了14个问题 |采纳率71.4%m(Cl-)=8.2420*35.5/58.5=5g
0.005g1年前查看全部
- 有哪一种试剂能鉴别碳酸氢钠,碳酸钾,硅酸钠,硫化钾,氯化钠和硝酸钾的吗?
 tangjason20041年前1
tangjason20041年前1 -
 彭欣欣 共回答了17个问题
彭欣欣 共回答了17个问题 |采纳率100%氯化氢气体1年前查看全部
- 为什么滴加浓盐酸可鉴别饱和碳酸氢钠,碳酸钾,亚硫酸钠,氯化钠,硝酸钾五种无色溶液
 xiangxcy1年前1
xiangxcy1年前1 -
 2068963 共回答了26个问题
2068963 共回答了26个问题 |采纳率88.5%解析:
浓盐酸滴加饱和碳酸氢钠,反应式:NaHCO3+HCl = NaCl + CO2(气体) + H2O 现象为:有无色无味的气体生成.
浓盐酸滴加饱和碳酸钾溶液中,反应式:K2CO3 + HCl = KCl + KHCO3 ,KHCO3+HCl=KCl + CO2(气体) + H2O 现象为:先没有气体,后产生无色无味的气体.
浓盐酸滴加饱和亚硫酸钠溶液中,反应式:Na2SO3 + HCl = NaCl + NaHSO3 ,NaHSO3+HCl=NaCl + SO2(气体) + H2O 现象为:先没有气体,后产生无色有刺激性气味的气体.
浓盐酸滴加饱和NaCl溶液中,同离子效应,NaCl = Na+ + Cl- HCl=Cl- +H+ 饱和NaCl中C(Cl-)浓度增大,使饱和NaCl溶液有晶体析出.现象为:有晶体析出.
浓盐酸滴加饱和硝酸钾溶液中,只吸收HCl.无明显现象.1年前查看全部
- 为什么吸收二氧化碳中的盐酸用碳酸氢钠,氯气中的盐酸用氯化钠?
 哼马1年前3
哼马1年前3 -
 人生如雾吗 共回答了19个问题
人生如雾吗 共回答了19个问题 |采纳率100%CO2在饱和的碳酸氢钠溶液中的溶解度特别小,减少CO2的损失.同理,C|2在饱和的NaCl溶液中的溶解度很小很小的,这样是避免Cl损失1年前查看全部
- 16.为了鉴别氯化镁、硫酸钾、氯化钠三瓶无色溶液,依下表进行实验,试推断加入试剂①,②,③各是什么物质?图在
16.为了鉴别氯化镁、硫酸钾、氯化钠三瓶无色溶液,依下表进行实验,试推断加入试剂①,②,③各是什么物质?图在
①是______,②是______,③是______.
请说明是怎么判断的 苏祁1年前1
苏祁1年前1 -
 lingerwang 共回答了18个问题
lingerwang 共回答了18个问题 |采纳率83.3%1是硝酸银,2是硝酸钡,3是氢氧化钠或者氢氧化钾.
加入1后出现沉淀,沉淀加入2后出现出了钡粒子和硝酸根和氯粒子,那么加入1产生的沉淀应该是氯化银,那么再往下推2肯定就是硝酸钡了.再看加入1后的氯液加入3以后出现氢氧化镁沉淀,那么加入的3肯定是碱.再看下面的阳离子只有钾粒子跟钠粒子,那么应该是氢氧化钾或者氢氧化钾.
再将1、2、3带入去看,发现结果相同,所以应该是他们.1年前查看全部
- 关于铜片和稀硫酸的反应铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?氯化钠
关于铜片和稀硫酸的反应
铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?
氯化钠 硝酸钾 硫酸钠 碳酸钠? 长青131年前2
长青131年前2 -
 korla31g 共回答了21个问题
korla31g 共回答了21个问题 |采纳率81%硝酸钾
NO3-在酸性环境下具有硝酸性质,具有强氧化性
故加入硝酸钾后,会发生氧化还原反应
3Cu+8H+ +3NO3-=2Cu2+ +2NO+4H2O1年前查看全部
- 有一个包粉末,可能由氯化钠、硫酸铁、氯化镁、硝酸钠、碳酸钠中的一种或几种组成.
有一个包粉末,可能由氯化钠、硫酸铁、氯化镁、硝酸钠、碳酸钠中的一种或几种组成.
现做下列实验:①取少量粉末,加水溶解得无色透明溶液;②在上述溶液里,加氢氧化钠溶液,无明显变化;③另取少量固体,加稀盐酸,无明显变化.
根据上述实验,试回答:
(1)从实验①推断,不可能存在______(填化学式),原因是_________.
从实验②推断,不可能存在______(填化学式),原因是_________.
从实验③推断,不可能存在______(填化学式),原因是_________.
(2)根据上述实验,可得出初步结论,该粉末中可能含有_________.
(3)若该白色粉末只有一种物质,要证明是什么物质,则需取少量原粉末,装入试管
再加入少量水溶解,然后加入_____试剂,根据____________现象进行判断. 王佳年12041年前3
王佳年12041年前3 -
 小蛋113 共回答了13个问题
小蛋113 共回答了13个问题 |采纳率84.6%①取少量粉末,加水溶解得无色透明溶液;--------没有Fe2(SO4)3,它的溶液是黄色的,另外注意MgCl2与Na2CO3不能共存
②在上述溶液里,加氢氧化钠溶液,无明显变化;-----------没有MgCl2
③另取少量固体,加稀盐酸,无明显变化.----------没有Na2CO3
可能存在NaCl、NaNO3中的1种或2种
(1)从实验①推断,不可能存在___Fe2(SO4)3___(填化学式),原因是____它的溶液显黄色_____.
从实验②推断,不可能存在___MgCl2___(填化学式),原因是_____会与NaOH生成Mg(OH)2白色沉淀____.
从实验③推断,不可能存在___Na2CO3___(填化学式),原因是____会与盐酸反应生成CO2气体_____.
(2)根据上述实验,可得出初步结论,该粉末中可能含有____NaCl和NaNO3中的1种或者2种_____.
(3)若该白色粉末只有一种物质,要证明是什么物质,则需取少量原粉末,装入试管
再加入少量水溶解,然后加入__AgNO3溶液___试剂,根据_____有无白色沉淀_______现象进行判断.1年前查看全部
- 2NaCl表示什么?为什么将燃着的木条伸入集气瓶内不能检验二氧化碳?第一个错 氯化钠是由离子构成的啊!我知道我还问?
 黑眼睛阿义1年前1
黑眼睛阿义1年前1 -
 赠之以芍药 共回答了11个问题
赠之以芍药 共回答了11个问题 |采纳率100%2NaCl表示两个氯化钠分子,你认为氯化钠是由离子构成的,没错,但是钠的化合价为+1价,氯的化合价为-1价,钠离子在氯气中燃烧反应生成氯化钠(不带电),化合价的总和为0,所以2NaCl表示两个氯化钠分子.
将燃着的木条伸入集气瓶内,若木条熄灭,只能证明集气瓶内的气体不支持燃烧,而不支持燃烧的气体有很多,所以要想用燃着的木条伸入集气瓶检验二氧化碳,则要在一定的范围内,例如:在氧气,空气,二氧化碳三者中辨别出二氧化碳则可采用此方法.
另外,检验二氧化碳的方法为:
将二氧化碳通入澄清的石灰水中反应生成碳酸钙沉淀和水
(此答案仅供参考)1年前查看全部
- 写写这两题(化学)1.将硝酸银溶液小心地涂在纸上,硝酸银溶液就跟汗水中的氯化钠作用,生成氯化银和硝酸钠,其化学反应方程式
写写这两题(化学)
1.将硝酸银溶液小心地涂在纸上,硝酸银溶液就跟汗水中的氯化钠作用,生成氯化银和硝酸钠,其化学反应方程式是( ),氯化银在光照条件下分解,生成银粒和另一单质,其化学反应方程式是( ).
2.煤与天然气都是常用的能源.它们的主要成分分别是C和CH4.12克碳充分燃烧放出44克二氧化碳.请通过化学反应方程式计算比较相同质量的C和CH4充分燃烧后产生的二氧化碳的量. 中鹅1年前2
中鹅1年前2 -
 SY_Yin 共回答了15个问题
SY_Yin 共回答了15个问题 |采纳率93.3%AgNO3+NaCl=AgCl(沉淀)+NaNO3
2AgCl=(hv写在等号上面)2Ag+Cl2(气体)
C+O2=CO2
CH4+2O2=CO2+2H2O 11:31年前查看全部
- 怎样除去碳酸钠中的氯化钠?我们老师说是加盐酸,得到二氧化碳,然后再什么什么的……老师说的后面的内容补充一下可以吗?
 dynatron1年前1
dynatron1年前1 -
 sinsil 共回答了13个问题
sinsil 共回答了13个问题 |采纳率69.2%加盐酸,得到二氧化碳 把二氧化碳通入氢氧化钠溶液中.
待反应完成.向氢氧化钠溶液中滴加适量盐酸中和酸性.
再蒸发即可1年前查看全部
- 氯化钠晶体中钠离子与氯离子个数是怎么查的
氯化钠晶体中钠离子与氯离子个数是怎么查的
老师是这么计算的 顶点1/8 棱 1/4 面1/2 体心1
然后Na+:1/8 * 8 + 1/4 *0 + 1/2 *6 + 1*0
棱不就是边吗 可是边上是有钠离子的呀 怎么能是0呢 hu_is_un1年前0
hu_is_un1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 现有25%的氯化钠溶液 5%的氯化钠溶液 氯化钠固体和水.请用上述四种中的两种配制10%的氯化钠溶液,将用量的质量最简整
现有25%的氯化钠溶液 5%的氯化钠溶液 氯化钠固体和水.请用上述四种中的两种配制10%的氯化钠溶液,将用量的质量最简整数比填入下表相应的位置.
25%氯化钠溶液 5%氯化钠溶液 氯化钠固体 水
示例 1 3
方案1
方案2
方案3 kenow1年前3
kenow1年前3 -
 mmlanmei 共回答了19个问题
mmlanmei 共回答了19个问题 |采纳率84.2%25%氯化钠溶液 5%氯化钠溶液 氯化钠固体 水
示例 1 3
方案1 1 9
方案2 10 10 1 19
方案3 4 1 151年前查看全部
- 取含氯化钠和碳酸钠的混合物4.24g溶于27.54g水中,待全部溶解后,加入质量分数为10%的盐酸14.6g与碳酸钠完全
取含氯化钠和碳酸钠的混合物4.24g溶于27.54g水中,待全部溶解后,加入质量分数为10%的盐酸14.6g与碳酸钠完全反应,求:
(1)样品中氯化钠的质量分数;
(2)反应后所得溶液中溶质的质量分数. 唧咕阿几1年前1
唧咕阿几1年前1 -
 aiyasigh 共回答了15个问题
aiyasigh 共回答了15个问题 |采纳率93.3%解题思路:(1)利用碳酸钠与盐酸反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出原样品中的碳酸钠的质量和生成氯化钠的质量;
(2)所得滤液中溶质的质量=碳酸钠与盐酸反应生成氯化钠的质量+纯碱样品中氯化钠,所得滤液的质量=纯碱样品质量+水+盐酸溶液质量-气体质量,然后根据“溶质质量分数=[溶质质量/溶液质量]×100%”计算即可.(1)设混合物中碳酸钠的质量是x,生成氯化钠的质量是y,二氧化碳的质量是z Na2CO3+2HCl═2NaCl+CO2↑+H2O 106 73 117 44x&nbs...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 求Na质量Na2CO3+CaCl2=CaCO3+2NaCl,Na2CO3和氯化钠22.3g-加100克水完全溶解-加86
求Na质量Na2CO3+CaCl2=CaCO3+2NaCl,Na2CO3和氯化钠22.3g-加100克水完全溶解-加86.1氯化钙恰好反应-198.4g
 rchentl1年前1
rchentl1年前1 -
 wolker 共回答了23个问题
wolker 共回答了23个问题 |采纳率87%根据质量守恒:22.3+100+86.1-198.4=10 这10g就是CaCO3的质量
Na2CO3+CaCl2=CaCO3+2NaCl
106 100
x 10
x=10.6
所以原混合物中有10.6gNa2CO3 有22.3-10.6=11.7gNaCl
10.6gNa2CO3中有Na4.6g 11.7gNaCl中有Na 4.6g
所以总共Na有9.2g1年前查看全部
- 配置100mL0.1mol/L的NaCl溶液 由于天平会多称量0.05g 氯化钠 那会改变其浓度,这怎么办呢?
 雪里蕻20081年前1
雪里蕻20081年前1 -
 52154sg 共回答了16个问题
52154sg 共回答了16个问题 |采纳率93.8%使用分析天平称量NaCl,分析天平精确到0.0001g.1年前查看全部
大家在问
- 1一杯水和杯子共重910克,倒出一半后连水杯重510克,问杯子多重?
- 2八年级寒假园地青岛出版社英语填空题答案
- 3补画三视图,并在( )内填写出物体的方位关系.
- 4I give my full love to you!
- 5紫藤萝瀑布线索是什么,划分文章结构层次
- 6从B处看山顶A的仰角为45°,向前100米,在D处看山顶A的仰角为60°,求:山AC的高
- 7曹刿论战中操岁为什么登轼而忘之
- 83又1/2减去5.1除以17的商,再乘以3又1/3,积是几
- 9克隆殃及人类 作文100字
- 10如图,在四边形ABCD中,AB=DC,AC=BD,AD≠CB.求证:四边形ABCD是等腰梯形.
- 11求估分 10年6月六级神呐 我觉得这次考的很难啊啊啊.听力选择15个 单词3个 句子1个吧 快速阅读5个 仔细阅读2个
- 1220字以上的节约用水的宣传语.拜托了各位 谢谢
- 13帮我估分啊 10年6月的六级听力选择对16个,填词对6个 句子算一个吧 快速阅读对4个,主观阅读对4个,客观阅读对7个,
- 14请问德语的动词为什么要加介词啊?
- 15MNO2中M的化合价 MNCL2中M的化合价 Mn中M的化合价 KMnO4中M的化合价 H的氧化物和名称 Na的氧化物和
