饲料添加剂中的四季红指的是什么成分?
 我来看骂朱军的帖2022-10-04 11:39:541条回答
我来看骂朱军的帖2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 卡诺循环 共回答了22个问题
卡诺循环 共回答了22个问题 |采纳率90.9%- 又名头花蓼,多年生草本,10月开花,11月结果,株高10-15厘米.叶先端急尖,叶绿色,有青铜色“V”型斑纹,花小,密集成头状花序,花粉红色,花期夏秋季.
其实就是一种植物性饲料 - 1年前
相关推荐
- 饲料中的石粉饲料添加剂中的石粉是哪一种,哪有出售的?
 Rymond1年前1
Rymond1年前1 -
 DerekThun 共回答了23个问题
DerekThun 共回答了23个问题 |采纳率95.7%饲料中添加的石粉,即石灰石矿石粉,简称石粉.含钙量32%(市场上销售的石粉,有的地方也叫重钙,为浅灰色或灰白色).
如将石灰石矿石原料煅烧,则生成生石灰和二氧化碳,再加水消化石灰,便生成石灰乳则主要成分为氢氧化钙,又叫熟石灰,然后通入二氧化碳碳化石灰乳,生成碳酸钙沉淀,经脱水、干燥和粉碎所制得的产品叫轻钙.色雪白,含钙量39.2%,也是补钙饲料原料,但贵一点.1年前查看全部
- 硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO 4 •X
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO 4 •X H 2 O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe 2 O 3 •a H 2 O )对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO 4 在不同温度下溶解度如下表所示:
由于铁屑中含有C、Si等杂质,为了使FeSO 4 溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止______.你认为实验时的水浴温度最好控制在______℃左右.从滤液中获得FeSO 4 •xH 2 O,下列操作中不需要的是______;温度/℃ 0 10 20 30 40 50 60 70 80 溶解度/g/100g水 18.5 20.8 26.3 32.8 40.1 48.4 52.4 50.9 43.7
(A)冷却(B)蒸发
(C)结晶(D)洗涤(E)过滤
(3)以下是测定FeSO 4 •xH 2 O中结晶水含量的实验流程.(称量仪器为电子天平)
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO 4 •xH 2 O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______. dennis1091年前1
dennis1091年前1 -
 jim893 共回答了12个问题
jim893 共回答了12个问题 |采纳率83.3%(1)少量的铁锈和铁屑反应生成二价铁离子,所以对制取硫酸亚铁无影响,但必须是铁屑过量,保证溶液中三价铁离子完全转化为二价铁离子,
故答案为:无;生成的少量Fe 3+ 与铁屑反应转化为Fe 2+ ;铁屑;
(2)根据图表分析知,0~60℃,温度越高硫酸亚铁的溶解性越大;60~80℃,温度越高溶解度反而减小;所以采取了水浴加热和趁热过滤的方法防止硫酸亚铁晶体析出;60℃时硫酸亚铁的溶解度最大,所以实验时的水浴温度最好控制在60℃左右;从滤液中获取硫酸亚铁晶体不需要蒸发,故选B.
故答案为:硫酸亚铁晶体析出;60℃;B;
(3)①测定FeSO 4 •xH 2 O中结晶水含量的实验中必须在坩埚中加热,装置应选C,故答案为:C;
②重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g,故答案为:0.001;
③为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:干燥器;
(4)A、加热时,晶体溅出坩埚,应重新做实验,故A错误;
B、加热时,先用小火,后用大火加热,至恒重,故B错误;
C、加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅,故C正确;
D、恒重操作是指两次称重之差不大于0.0003g,故D错误;
故答案为:C;
(5)灼烧时有黑色固体出现,说明硫酸亚铁分解生成气体,所以m(H 2 O)偏大;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气,则结晶水合物中m(H 2 O)偏小,
故答案为:偏大;偏小.1年前查看全部
- (2013•江苏模拟)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
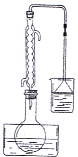 (2013•江苏模拟)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
(2013•江苏模拟)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
几种盐的溶解度(g/100g水)
(1)实验室制备碘酸钙的实验步骤如下:温 度/℃
物质0 10 20 40 60 80 KIO3 4.60 6.27 8.08 12.6 18.3 24.8 KCl 28.1 31.2 34.2 40.1 45.8 51.3 CaCl2 59.5 64.7 74.5 128 137 147 Ca(IO3)2 0.119(5℃) 0.195(15℃) 0.307(25℃) 0.520 0.621 0.669
步骤1:在100mL圆底烧瓶中依次加入2.20g 碘、2.00g 氯酸钾和45mL水,加热、搅拌,使氯酸钾溶解.
步骤2:滴加6mol/L盐酸至pH=1,按如图所示组装仪器,保持水浴温度85℃左右,发生反应:
I2+2KClO3+HCl═KIO3+HIO3+KCl+Cl2↑
步骤3:将反应液转入150mL 烧杯中,加入A溶液,调节溶液pH=10.
步骤4:用滴定管加10mL 1mol/L CaCl2溶液,并不断搅拌.
步骤5:反应混合物先用水冷却,再在冰水中静置10分钟,过滤,用少量冰水洗三次,再用少量无水乙醇洗涤一次,抽干后,将产品转移到滤纸上,晾数分钟,得碘酸钙产品.
①步骤2中反应温度不能太高的原因是______.
②步骤3中A溶液是______.
③步骤4中实验现象是____________.
④步骤5中在冰水中冷却静置的目的是______.再用无水乙醇洗涤的目的是______.
(2)测定产品中碘酸钙含量的实验步骤如下:
准确称取产品a g(约0.6g),置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入250mL 容量瓶中,用水稀释至刻度,摇匀,得试液.
准确量取所得试液50.00mL 置于250mL 碘量瓶中,加入1:1高氯酸2mL,3g 碘化钾,盖上瓶塞,在暗处放置3 分钟,加50mL 水,用浓度为0.1000mol/L Na2S2O3标准溶液滴定至浅黄色,加入 2mL 0.5%淀粉溶液,继续滴定至终点,读数.
滴定过程中发生的反应如下:
Ca(IO3)2+2HClO4═2HIO3+Ca(ClO4)2,IO3-+5I-+6H+═3I2+3H2O,I2+2S2O32-═2I-+S4O62-
①准确量取50.00mL试液的玻璃仪器是______.
②滴定至终点的现象是______.
③为准确获得样品中Ca(IO3)2的含量,还需补充的实验是______. qaz20051年前1
qaz20051年前1 -
 颜糖糖 共回答了22个问题
颜糖糖 共回答了22个问题 |采纳率90.9%解题思路:(1)①碘易升华,碘酸钾受热易分解;
②制备碘酸钙的实验中间产物为碘酸氢钾,将反应液转入150mL 烧杯中,加入A溶液,调节溶液pH=10,“调pH至10”的目的是加入氢氧化钾或氢氧化钙和碘酸氢钾反应生成KIO3或碘酸钙,不引入新的杂质;
③碘酸钙是微溶于水的白色结晶或结晶性粉末,向PH=10的溶液,加入氯化钙可以生成碘酸钙沉淀;
④物质溶解度随温度升高增大,随温度降低减小,冰水中冷却有利于碘酸钙析出晶体;乙醇易挥发可加快干燥;
(2)①准确量取50.00mL试液,滴定管或移液管可精确到0.01ml,据此即可解答;
②根据碘的性质,碘与淀粉作用显蓝色,滴定至终点碘全部消耗,溶液蓝色消失;
③重复测定两次,减少实验误差.(1)①步骤2发生I2+2KClO3+HCl═KIO3+HIO3+KCl+Cl2↑,反应物中碘易升华,反应温度过高,碘和KClO3、HCl反应不充分,生成物中碘酸钾受热易分解,所以温度过高,产率低,
故答案为:温度过高,碘升华,KIO3分解,影响产率;
②制备碘酸钙的实验中间产物为碘酸氢钾,I2+2KClO3+HCl
△
.
KH(IO3)2+KCl+Cl2↑,步骤3中A溶液是KOH溶液或Ca(OH)2 溶液,目的是加入氢氧化钾或氢氧化钙和碘酸氢钾反应生成KIO3或生成碘酸钙沉淀,不引入新的杂质,
故答案为:KOH溶液或Ca(OH)2 溶液;
③碘酸钙是微溶于水的白色结晶或结晶性粉末,向PH=10的溶液,加入氯化钙,氯化钙会和碘酸钾发生反应生成碘酸钙,发生的反应为:KIO3+CaCl2=Ca(IO3)2↓+2KCl,
故答案为:出现浑浊,有沉淀生成;
④Ca(IO3)2溶解度随温度升高增大,随温度降低减小,步骤5中在冰水中冷却静置,使Ca(IO3)2沉淀完全;乙醇是易挥发的物质,Ca(IO3)2沉淀表面有水需干燥,可用无水乙醇洗涤,乙醇易挥发可加快干燥,
故答案为:乙醇易挥发可加快干燥;
(2)①50.00mL试液呈酸性,要求精确到0.01ml,酸式滴定管或移液管可精确到0.01ml,所以准确量取50.00mL试液的玻璃仪器是酸式滴定管或移液管,
故答案为:酸式滴定管或移液管;
②碘与淀粉作用显蓝色,滴定过程中发生的反应如下:Ca(IO3)2+2HClO4═2HIO3+Ca(ClO4)2,IO3-+5I-+6H+═3I2+3H2O,I2+2S2O32-═2I-+S4O62-,依据反应可知当达到滴定终点时,碘单质反应完全后生成无色物质,所以当反应后溶液变化为无色即可证明反应完全,现象为:溶液蓝色消失,且半分钟内不恢复,
故答案为:溶液蓝色消失,且半分钟内不恢复;
③为了减少实验误差,准确获得样品中Ca(IO3)2的含量,需重复测定两次,故答案为:重复测定两次.点评:
本题考点: 制备实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质制备实验操作的分析判断,掌握碘酸钙的性质、准确分析流程图是解题关键,题目难度中等.1年前查看全部
- AA级绿色蔬菜严格地要求在生产过程中不使用化学合成的肥料、农药、兽药、饲料添加剂、食品添加剂和其他有害于环境和健康的物质
AA级绿色蔬菜严格地要求在生产过程中不使用化学合成的肥料、农药、兽药、饲料添加剂、食品添加剂和其他有害于环境和健康的物质。它的生产属于 [ ]A.生态农业
B.观光农业
C.精确农业
D.外向型农业 ninghua6661年前1
ninghua6661年前1 -
 sh2004 共回答了20个问题
sh2004 共回答了20个问题 |采纳率95%A1年前查看全部
- 经营范围里的“化工产品”,都包括哪些?饲料添加剂,多晶硅,硒土算化工产品吗?木材应该算哪类?
 忘了该干吗1年前1
忘了该干吗1年前1 -
 NZHJ 共回答了15个问题
NZHJ 共回答了15个问题 |采纳率86.7%添加剂那些都属于化工产品,但木材我也不清楚是那一类,我觉得有点像建材类.1年前查看全部
- 英语翻译本产品只用于工业类,非用于人类食品和动物饲料添加剂及原料等.我司特此证明!
 爱兔兔1年前1
爱兔兔1年前1 -
 赵啸波 共回答了11个问题
赵啸波 共回答了11个问题 |采纳率90.9%This product only used in industrial class, not for human food and animal feed additive and raw materials, etc.
We hereby certify!1年前查看全部
- 已知一包15%的饲料添加剂重量是75斤,价格是206.5元/包.100斤饲料添加剂中要混合玉米65斤、豆粕15斤、麦皮5
已知一包15%的饲料添加剂重量是75斤,价格是206.5元/包.100斤饲料添加剂中要混合玉米65斤、豆粕15斤、麦皮5斤才能成为真正的饲料.又已知玉米1.4元/斤、豆粕2.1元/斤、麦皮1.2元/斤,请问1斤成品饲料是多少钱一斤?怎么算?
 丑样王子1年前1
丑样王子1年前1 -
 xudingbang 共回答了16个问题
xudingbang 共回答了16个问题 |采纳率93.8%﹙1.4×65+2.1×15+1.2×5+206.5﹚÷﹙75+65+15+5﹚
=﹙91+31.5+6+206.5﹚÷160
=335÷160
≈2.09元.每斤成品饲料的价钱是2.09元.
标准的得数是,2.09375元/斤.按生活习惯四舍五入保留了两位小数.1年前查看全部
- (2014•无锡)FeSO4•7H2O是一种重要的食品和饲料添加剂.某工业废渣主要成分是Fe2O3,还含有CaCO3和S
(2014•无锡)FeSO4•7H2O是一种重要的食品和饲料添加剂.某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4•7H2O的流程如图1:

请根据流程图回答下列问题:
(1)稀硫酸与粉末中的氧化铁反应的化学方程式为______
(2)操作②所需要的玻璃仪器是:烧杯、玻璃棒和______.
(3)经测定,滤渣中只含有CaSO4和SiO2,你认为实验室______(填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳.
(4)Fe与Fe2(SO4)3反应的化学方程式为______.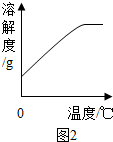
(5)硫酸亚铁的溶解度曲线如图2.待结晶完毕后,滤除晶体,用少量冰水洗涤2-3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;
Ⅱ______. 你就是我的天使1年前1
你就是我的天使1年前1 -
 woaihuoxing 共回答了18个问题
woaihuoxing 共回答了18个问题 |采纳率88.9%解题思路:(1)从稀硫酸与粉末中的氧化铁反应,生成硫酸铁和水去分析解答;
(2)从过滤时需用到的仪器有:烧杯、玻璃棒和漏斗去分析解答;
(3)从粉末状石灰石虽然能够和稀硫酸反应,且能产生二氧化碳,但反应太快不便于收集,因此实验室不能用粉末状的石灰石与稀硫酸反应制二氧化碳去分析解答;
(4)从图可知:Fe与Fe2(SO4)3反应生成FeSO4,反应物是Fe和Fe2(SO4)3,生成物是FeSO4去分析解答;
(5)从硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失去分析解答.(1)稀硫酸与粉末中的氧化铁反应,生成硫酸铁和水,其反应的化学方程式为:Fe2O3+2H2SO4═Fe2(SO4)3+3H2O;故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)由题目中图可以看出步骤②用来分离固体和液体,获得滤液和滤渣,所以这个步骤是过滤;过滤时需用到的仪器有:烧杯、玻璃棒和漏斗;故答案为:漏斗;
(3)粉末状石灰石虽然能够和稀硫酸反应,且能产生二氧化碳,但反应太快不便于收集,因此实验室不能用粉末状的石灰石与稀硫酸反应制二氧化碳,故答案为:不能;
(4)由图可知:Fe与Fe2(SO4)3反应生成FeSO4,反应物是Fe和Fe2(SO4)3,生成物是FeSO4,故反应的化学方程式为:Fe+Fe2(SO4)3═3FeSO4;
故答案为:Fe+Fe2(SO4)3═3FeSO4;
(5)硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,用冰水洗涤的目的是一、除去晶体表面附着的溶于水杂质,二、冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失.
故答案为:用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;固体溶解度曲线及其作用;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 块状的石灰石和稀硫酸反应时,由于生成的硫酸钙微溶于水,附着在碳酸钙的表面,阻止了碳酸钙与稀硫酸的进一步接触,使反应停止;而用碳酸钙粉末则增大了与稀硫酸的接触面积,避免上述现象,反应得以进行,故可用碳酸钙粉末和稀硫酸制取二氧化碳气体.1年前查看全部
- 硫酸亚铁(FeSO4.7H2O)是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO4.7H2O晶体
硫酸亚铁(FeSO4.7H2O)是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO4.7H2O晶体
最多追加120,求大虾
硫酸亚铁(FeSO4.7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4.7H2O晶体:
(1)将5%碳酸钠溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用段析法除去碳酸钠溶液,然后将废铁屑用水洗涤2~3遍;
(2)向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80摄氏度之间至铁屑耗尽;
(3)趁热过滤,将滤液转入密闭容器中,静置、冷却结晶;
(4)待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
(5)将制得的FeSO4.7H2O晶体放在一个小广口瓶中,密封保存。
请回答下列问题:(1)实验1为了—— 加热作用——,(2)2不合理,理由——,(3)实验中加入了少量兵水为了?(1)—— (2)—— 也许我会选择眼泪1年前3
也许我会选择眼泪1年前3 -
 goloti 共回答了25个问题
goloti 共回答了25个问题 |采纳率92%各操作目的:
(1)洗去其他有机杂质.
(2)FeSO4生成反应.
(3)滤去无机不溶杂质,结晶得到目标产物.
(4)洗涤晶体,确保结晶水的饱和度.
(5)将产品转移到储存设备.
(1)实验1为了洗去其他有机杂质 ,加热作用:让有机物尽可能溶解(增大溶解度),
(2)2不合理,理由产物是Fe2(SO4)3,不是FeSO4
(3)实验中加入了少量兵水为了?
(1)让FeSO4充分冷却结晶.
(2)防止FeSO4在常温下被O2氧化.1年前查看全部
- 硫酸亚铁(FeSO4•7H2O)是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:①
硫酸亚铁(FeSO4•7H2O)是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)写出Fe2+的核外电子排布式______;
(2)用轨道表示式表示Fe3+的3d电子的排布情况______;
(3)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,其化学方程式为______;
(4)硫酸亚铁制备中实验步骤①的目的是______. zmy1101201年前0
zmy1101201年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 食品安全问题越来越引起人们的关注,下列做法中不会危及人体健康的是 A.用“瘦肉精”做饲料添加剂 B.食品包装时充入氮气以
食品安全问题越来越引起人们的关注,下列做法中不会危及人体健康的是
A.用“瘦肉精”做饲料添加剂 B.食品包装时充入氮气以防腐 C.用甲醛溶液浸泡海产品以保鲜 D.用含亚硝酸钠的工业用盐腌制食品  无患子1211年前1
无患子1211年前1 -
 凝望kkm 共回答了21个问题
凝望kkm 共回答了21个问题 |采纳率95.2%B
A、“瘦肉精”中含有致癌物,不能作为添加剂使用,所以错误.
B、氮气的化学性质不活泼,食品包装时充入氮气,能防止食品缓慢氧化而变质,所以正确.
C、甲醛有毒,能破坏人体蛋白质的结构,使之失去生理功能,不能食用,所以错误.
D、亚硝酸钠有毒性,不能食用,所以错误.
故选B1年前查看全部
- 硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4•X H
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4•X H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3•a H2O )对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止______.你认为实验时的水浴温度最好控制在______℃左右.从滤液中获得FeSO4•xH2O,下列操作中不需要的是______;温度/℃ 0 10 20 30 40 50 60 70 80 溶解度/g/100g水 18.5 20.8 26.3 32.8 40.1 48.4 52.4 50.9 43.7
(A)冷却(B)蒸发
(C)结晶(D)洗涤(E)过滤
(3)以下是测定FeSO4•xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4•xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______. littlestoneshg1年前1
littlestoneshg1年前1 -
 幸福在等我 共回答了17个问题
幸福在等我 共回答了17个问题 |采纳率94.1%解题思路:(1)根据生成物的成分判断是否有影响;三价铁离子能和铁单质 反应生成二价铁离子;
(2)根据硫酸亚铁的溶解度与温度的关系分析判断,在60℃时溶解度最大,温度越低溶解度越小,高于60℃温度越高溶解度越小;
(3)①加热结晶水固体所用仪器为坩埚;
②重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g;
③为防止空气中的物质和其反应应在干燥器中冷却;
(4)根据操作是否引起误差判断;
(5)根据减少的质量是小于实际结晶水的质量还是大于结晶水的含量判断.(1)少量的铁锈和铁屑反应生成二价铁离子,所以对制取硫酸亚铁无影响,但必须是铁屑过量,保证溶液中三价铁离子完全转化为二价铁离子,
故答案为:无;生成的少量Fe3+ 与铁屑反应转化为Fe2+;铁屑;
(2)根据图表分析知,0~60℃,温度越高硫酸亚铁的溶解性越大;60~80℃,温度越高溶解度反而减小;所以采取了水浴加热和趁热过滤的方法防止硫酸亚铁晶体析出;60℃时硫酸亚铁的溶解度最大,所以实验时的水浴温度最好控制在60℃左右;从滤液中获取硫酸亚铁晶体不需要蒸发,故选B.
故答案为:硫酸亚铁晶体析出;60℃;B;
(3)①测定FeSO4•xH2O中结晶水含量的实验中必须在坩埚中加热,装置应选C,故答案为:C;
②重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g,故答案为:0.001;
③为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:干燥器;
(4)A、加热时,晶体溅出坩埚,应重新做实验,故A错误;
B、加热时,先用小火,后用大火加热,至恒重,故B错误;
C、加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅,故C正确;
D、恒重操作是指两次称重之差不大于0.0003g,故D错误;
故答案为:C;
(5)灼烧时有黑色固体出现,说明硫酸亚铁分解生成气体,所以m(H2O)偏大;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气,则结晶水合物中m(H2O)偏小,
故答案为:偏大;偏小.点评:
本题考点: 硫酸亚铁的制备;探究物质的组成或测量物质的含量.
考点点评: 本题考查了硫酸亚铁结晶水的测定,难度不大,注意灼烧固体必须在坩埚中进行.1年前查看全部
- 饲料添加剂名词解释
 zxf7012211年前2
zxf7012211年前2 -
 zhouruiyi 共回答了27个问题
zhouruiyi 共回答了27个问题 |采纳率96.3%饲料添加剂是指在饲料生产加工、使用过程中添加的少量或微量物质,在饲料中用量很少但作用显著.饲料添加剂是现代饲料工业必然使用的原料,对强化基础饲料营养价值,提高动物生产性能,保证动物健康,节省饲料成本,改善畜产品品质等方面有明显的效果.1年前查看全部
- (2011•丹徒区模拟)硫酸亚铁晶体是一种重要的食品和饲料添加剂.某化学兴趣小组的学生打算用化工厂里的含有少量铜的废铁屑
(2011•丹徒区模拟)硫酸亚铁晶体是一种重要的食品和饲料添加剂.某化学兴趣小组的学生打算用化工厂里的含有少量铜的废铁屑来制取硫酸亚铁晶体:
收集资料:①硫酸亚铁晶体易溶于水,难溶于酒精 ②硫酸亚铁晶体强热能分解③硫酸亚铁在不同温度下的溶解度如下表所示:
实验方案:温度/℃ 0 10 30 50 60 70 80 90 溶解度/g 14.0 17.0 25.0 33.0 35.3 33.0 30.5 27.0 
问题讨论:
(1)步骤①得到的固体中一定含有的金属单质的化学式为______.步骤①的温度控制在50℃至80℃的目的是______.
(2)步骤②适宜用______结晶法.
(3)洗涤干燥时,设计以下三种方案:
A.用水洗涤后再用滤纸吸干表面的水 B.使用无水酒精洗涤快速晾干 C.用水洗涤后,放在蒸发皿中烘干
上述方案中你认为:最好的方案是______,理由是______. ydj0071年前1
ydj0071年前1 -
 伤心雨1987 共回答了18个问题
伤心雨1987 共回答了18个问题 |采纳率100%解题思路:(1)铜不会和硫酸反应,所以可以过滤出来;根据硫酸亚铁的溶解性表格可知.
(2)根据硫酸亚铁的溶解性表格可知.
(3)硫酸亚铁难溶于酒精可知.(1)加入稀硫酸后,铁可以和硫酸反应生成硫酸亚铁和氢气,但铜不会和硫酸反应,因此铜就被过滤出来;根据硫酸亚铁的溶解表格可知,硫酸亚铁在50℃到80℃时溶解度是比较大的;故答案为:Cu,增大硫酸亚铁的溶解度.
(2)根据溶解性表格可知,随着温度的降低,硫酸亚铁的溶解度也随之降低,从而结晶析出.故答案为:冷却.
(3)根据题目信息可知,硫酸亚铁晶体易溶于水,说明A方法硫酸亚铁损耗较大;难溶于酒精,说明B方法较合适;硫酸亚铁晶体强热能分解,说明C方法也有较大的损耗.故答案为:B,硫酸亚铁的损耗较少.点评:
本题考点: 物质的相互转化和制备;化学实验方案设计与评价;金属活动性顺序及其应用.
考点点评: 通过这个题培养学生观察视图的能力,以及比较分析的能力.1年前查看全部
大家在问
- 1托盘天平测100g的水 步骤用托盘天平称取100g水的 详细步骤 明早我就要急用,请会的朋友帮一下,谢谢!!
- 2与世界名城雅典、开罗、罗马齐名,被誉为世界四大文明古都。翻译成英文
- 3将NH4Cl固体溶解在重水(D2O)中,反应的离子方程式
- 4____you ____[plan]a business trip to New Year from 8 to 9 ye
- 5老爸生日快乐我们永远爱你翻译成英文版的
- 6What is Mary going to be when she
- 7那家联合基因的少儿潜能测评中心在哪儿阿?
- 8用动词的适当形式填空.His parents _____(go) to Beijing last week.We lik
- 9非常急 非常急 一篇英语作文 假设你是学生会主席
- 10抛物线y=(x+2)²关于x轴对称的抛物线的解析式是
- 11饱和溶液是什么意思?怎样去除自来水中的氯离子?
- 12六年级课文林海的中心思想
- 13请问:怎样用手表与太阳位置判断方向?
- 14半命题作文假如我是——求一个文艺点的题目
- 15高数的题 判定无穷大、无穷小lim(x→1-)ln(1-x)判定无穷大、无穷小
