反应器是什么
 西贡之狼2022-10-04 11:39:542条回答
西贡之狼2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 一切都有可能 共回答了24个问题
一切都有可能 共回答了24个问题 |采纳率87.5%- 反应器 (reactor)实现反应过程的设备,广泛应用于化工、炼油、冶金、轻工等工业部门.化学反应工程以工业反应器中进行的反应过程为研究对象,运用数学模型方法建立反应器数学模型,研究反应器传递过程对化学反应的影响以及反应器动态特性和反应器参数敏感性,以实现工业反应器的可靠设计和操作控制.
- 1年前
 renzai 共回答了2个问题
renzai 共回答了2个问题 |采纳率- 反应器是指容纳反应物质在一定的压力、温度和流速的条件反应的器物。如合成塔、反应釜等等。
- 1年前
相关推荐
- 硫酸最古老的生产方法是:把绿矾(FeSO 4 •7H 2 O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气
硫酸最古老的生产方法是:把绿矾(FeSO 4 •7H 2 O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO 2 ),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
(1)______.
(2)______. dzt0611791年前1
dzt0611791年前1 -
 julia20060511 共回答了24个问题
julia20060511 共回答了24个问题 |采纳率91.7%由题意,则反应物为:绿矾(FeSO 4 •7H 2 O);生成物为:二氧化硫、三氧化硫、氧化铁、水;而三氧化硫与水反应生成硫酸.
故化学方程式为:2FeSO 4 •7H 2 O
△
.
Fe 2 O 3 +SO 2 ↑+SO 3 +14H 2 O;SO 3 +H 2 O═H 2 SO 41年前
41年前查看全部
- 某熟石灰久置于空气中.取样品10g置于反应器中,加入100g某浓度的盐酸恰好完全反应.将生成的气体全部通
某熟石灰久置于空气中.取样品10g置于反应器中,加入100g某浓度的盐酸恰好完全反应.将生成的气体全部通
熟石灰久置于空气中已部分变质,某同学为了测定它的纯度做如下实验:取样品10g置于反应器中,加入100g某浓度的盐酸恰好完全反应.将生成的气体全部通入足量的装有50g氢氧化钠溶液的烧杯中,反应后溶液增重到50.88g.试计算:
(1)该样品的纯度.
(2)所用盐酸中溶质的物质的量(精确到0.01mol) llxxrr1年前1
llxxrr1年前1 -
 lokeve 共回答了20个问题
lokeve 共回答了20个问题 |采纳率95%(1)mCO2=0.88g
所以mCaCO3=2g
所以样品纯度为(10-2)/10*100%=80%
(2)2nCaCO3=nHCl=2/100*2=0.04mol1年前查看全部
- 关于动物和反应器
 猫-妙妙1年前1
猫-妙妙1年前1 -
 赝品复制 共回答了16个问题
赝品复制 共回答了16个问题 |采纳率75%动物生物反应器是利用转基因活体动物,高效表达某种外源蛋白的器官或组织,进行工业化生产功能蛋白质的技术.动物生物反应器的研究开发重点是动物乳腺反应器和动物血液反应器.即,把人体相关基因整合到动物胚胎里,使生出的转基因动物血液中,或长大后产生的奶汁中,含有人类所需要的不同蛋白质.这是当前生物技术的尖端和前沿研究项目.1年前查看全部
- 在A20法处理工艺中缺氧反应器与好氧反应器怎样内循环?
 普通心情1年前1
普通心情1年前1 -
 BS郎一纯泉小 共回答了17个问题
BS郎一纯泉小 共回答了17个问题 |采纳率94.1%工艺流程如图所示.二、各反应器单元功能 1、厌氧反应器,原污水与从沉淀厌氧-厌氧-好氧处理1年前查看全部
- 大学无机化学题!(将 SO3 固体置于一反应器内,加热使...)
大学无机化学题!(将 SO3 固体置于一反应器内,加热使...)
将 SO3 固体置于一反应器内,加热使 SO3
气化并令其分解,测得温度为 900K ,总压为 pθ
时 ,气体混合物得密度为 ρ=0.925g/dm3 ,求 SO3 的(平衡)解离度 α soloidiom1年前2
soloidiom1年前2 -
 haohaoxiang 共回答了19个问题
haohaoxiang 共回答了19个问题 |采纳率84.2%M=ρRT/pθ:计算分子量;
M=80/(1+x/2):x就是解离度.1年前查看全部
- 关于温度控制系统反应器为温度控制系统,它通过调节进入反应器的冷却水的流量来保持反应器的温度恒定.麻烦各位帮我画出该系统的
关于温度控制系统
反应器为温度控制系统,它通过调节进入反应器的冷却水的流量来保持反应器的温度恒定.麻烦各位帮我画出该系统的方块图.或者告诉我应该用什么类型的控制系统.
我不是化工啊,谢谢你的回答啊. Aъоцτ1年前1
Aъоцτ1年前1 -
 viviaan 共回答了21个问题
viviaan 共回答了21个问题 |采纳率90.5%你是做什么的呀,化工的吗?我有化工冷却系统的资料.用ALP半自动控制系统.1年前查看全部
- 水处理反应器出水恶臭的原因有哪些?
 e3qx1年前2
e3qx1年前2 -
 烟雨伴风华 共回答了18个问题
烟雨伴风华 共回答了18个问题 |采纳率83.3%1,附着物太多了,每次清理下来都会有残留,长时间不清理就会恶化.
2,比如你的反应器是活性炭,砂虑啥的,每次用的时候这些垫层都在减少,到一定程度,就不起什么作用了.
3,水质恶化,进水水质恶化,刚开始的设计已经不符合要求了.
应该还有很多,欢迎楼下补充1年前查看全部
- 臭氧反应器应该在什么材料的容器中
 muziruge1年前2
muziruge1年前2 -
 jesw 共回答了20个问题
jesw 共回答了20个问题 |采纳率90%玻璃反应容器1年前查看全部
- 在标准状况下,有一密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气的混合和气体.右侧
在标准状况下,有一密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气的混合和气体.右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量的比是( )或()

 tlss8711211年前1
tlss8711211年前1 -
 Bella000 共回答了17个问题
Bella000 共回答了17个问题 |采纳率94.1%首先假设左右气体各是4V,那麼左边,H2是2V而O2也是2V.
2H2+O2=2H2O,根据方程可以知道H2和O2反应消耗的比例是2:1,所以最後只可能剩下O2,H2全部消耗完.
2H2~O2
2 1
2V V,反应消耗的O2体积是V,那麼还剩下的O2体积就是2V-V=V.
而根据反应後的图,可以知道右边气体反应後剩下的气体是左边的3倍,也就是说右边气体体积就是3V.原先是4V後来变成3V,变化的体积就是V
2CO+O2=2CO2,△V
2 1 2 1
2V V 2V V,因为只生成了2V的CO2,所以必然有体积为V的CO或者O2剩馀.
假设是CO剩馀,那麼反应消耗的2V加上剩馀的V,总共是3V,而O2是V,所以比例是3:1.
假设是O2剩馀,那麼反应消耗的V加上剩馀的V,总共是2V,而CO是2V所以比例是1:1.1年前查看全部
- 某温度下,向容积为2L的密闭反应器中充入0.10 mol SO 3 ,当反应器中的气体压强不再变化时
某温度下,向容积为2L的密闭反应器中充入0.10 mol SO 3 ,当反应器中的气体压强不再变化时测得SO 3 的转化率为20%,则该温度下反应2SO 2 (g)+O 2  2SO 3 (g)的平衡常数为 [ ]
2SO 3 (g)的平衡常数为 [ ]A.8.0×10 2 mol -1 ·L
B.1.6×10 3 mol -1 ·L
C.3.2×10 3 mol -1 ·L
D.4.0×10 2 mol -1 ·L 龟不瘦1年前1
龟不瘦1年前1 -
 yangbin888 共回答了22个问题
yangbin888 共回答了22个问题 |采纳率90.9%C1年前查看全部
- 将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热.(1)可能发生的化学反应有:1.FeO+C=Fe
将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热.(1)可能发生的化学反应有:1.FeO+C=Fe
将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热.
(1)可能发生的化学反应有:
1.FeO+C=Fe+CO 2.2FeO+C=2Fe+CO2 3.FeO+CO=Fe+CO2
4._____________
(2)若n4,充分反应后,反应器的固体物质是___,气体产物是____
(4)若反应的产物是混合物,n的取值范围是______
(5)若反应的产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为_____
(1)C+CO2=2CO
⑵若n WDG7211年前2
WDG7211年前2 -
 noodle20000 共回答了16个问题
noodle20000 共回答了16个问题 |采纳率100%(4)气体混合物为CO、CO2,即FeO完全反应生成Fe,则用极值的方法,有
FeO+C=Fe+CO
1mol nmol
可得n=1mol
2FeO+C=2Fe+CO2
2 1
1mol nmol
可得n=1/2mol
现在产物是CO、CO2的混合物,所以有:1/21年前查看全部
- 某化学课外小组用图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。 (1)
某化学课外小组用图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。 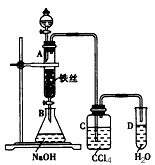
(1)A中反应的化学方程式是__________________。
(2)观察到A中的现象是______________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________________。有关的化学方程式是____________________________。
(4)C中盛放CCl 4 的作用是___________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO 3 溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是_______________________________________。 陪君醉笑1年前1
陪君醉笑1年前1 -
 爱得太累 共回答了21个问题
爱得太累 共回答了21个问题 |采纳率81%1年前查看全部
- 英语翻译本实验以250mL烧杯为反应器,阴极为石墨电极,阳极为钛基IrO2电极[10],之所以采用Ti/rO2电极是因为
英语翻译
本实验以250mL烧杯为反应器,阴极为石墨电极,阳极为钛基IrO2电极[10],之所以采用Ti/rO2电极是因为IrO2是一种活性很高且非常稳定的氧化物,IrO2涂层可大大延长电极寿命,同时可以降低析氯电位,增大析氧电位.阴阳两极的表面积均为20cm2,长宽分别为10cm、2cm,厚度可忽略不计,浸入溶液长度为8cm,未浸入长度为2cm,从而电极的有效面积为32cm2(正反两面),电极的工作电流由直流稳压电源提供,反应过程中采用磁力搅拌器进行搅拌,实验装置图如图1所示.
本实验以钛基IrO2电极作阳极,石墨作阴极,电极间距3cm,NaCl为支持电解质,在外加电场存在下分别对三种模拟染料废水进行电解实验研究.在温度20±2℃条件下,分别考察了pH值、电压、电解时间、NaCl投加量对染料(三种染料结构式见图2、图3、图4)废水脱色率及COD去除效果的影响.分别用蒸馏水配制三种染料溶液500mg/L,取已配好溶液200mL,固定三个因素,改变待研究因素,分别测定反应后的溶液色度和COD,并绘出相应的去除率曲线,以此评价染料降解效果.
在pH=3、电压20V、NaCl投加量2.5g/L的条件下,不同电解时间对染料去除效果的影响见图5.电解氧化处理时间直接影响到染料的脱色率及COD去除率,氧化时间越长,通过的电量越多,脱色率及COD去除率明显提高;对于活性橙X-GN和活性黄X-R,电解30min后染料溶液的脱色率几乎达到100%,此时COD的去除率仅有53%,对处理30min后的溶液继续电解,当处理60min后COD去除率已达到68%;对于活性黑KN-B,电解60min后染料溶液的脱色率达到100%,COD去除率达到60%.继续延长反应的时间,发现COD去除率几乎不再提升.因为随着反应的不断进行,有机物浓度逐渐降低,电流效率逐渐下降,因此,最佳电解时间为60min. mushao1231年前3
mushao1231年前3 -
 myufe 共回答了17个问题
myufe 共回答了17个问题 |采纳率82.4%中文第一句写的就有问题:“以250mL烧杯为反应器,阴极为石墨电极,阳极为钛基IrO2电极[10].”没有对应关系.应该是“以250mL烧杯为反应器,石墨电极为阴极,钛基IrO2电极[10]为阳极.”[10]是要注释的地方吧,我也不一一说明了,反正在英文里都认真的对照了文法.比如英文翻译的第二句:按传统的语法规则,The reason…is because…句型是错误的,because 应改为 that 才对.如:Wrong:The reason I was not there is because I was out of town.Right:The reason I was not there is that I was out of town.然而笔者在阅读英美报刊时却遇到了 The reason…because…句型.实际上这种句型近年来在口语中用得颇多.但是我还是按照经典的翻译方法翻译.不过中文里有疑问的地方就没有太较真.
In this experiment,use a 250mL beaker as reactor,graphite as cathode ,and the titanium-based IrO2 electrode [10] as the anode ,the reason for adopting Ti/rO2 electrode is that IrO2 is a highly active and very stable oxide,IrO2 coating electrode life can be greatly extended,while reducing chlorine evolution potential,increasing the oxygen evolution potential.The surface area of the cathode and anode are both 20cm2,length and width are 10cm,2cm,respectively,thickness can be ignored,the length submerged in the solution is 8cm,the length above the solution is 2cm,and thus the effective electrode area is 32cm2 (both sides),the Operating Current of the electrode is supplied by the DC power,during the reaction using a magnetic stirrer to stir ,the experimental device shown in Figure 1.
In this study,use titanium-based IrO2 electrode as the anode,graphite as cathode (electrode spacing is 3cm) NaCl as the supporting electrolyte,in the presence of external electric field do electrolysis experimental research on the three kinds of simulated dye wastewater .In temperature conditions 20 ± 2 ℃,investigated the impact of pH,voltage,electrolysis time,NaCl addition amount on the dyes (three dyes structure shown in Figure 2,Figure 3,Figure 4) decolorization rate and COD removal efficiency.Use distilled water to prepare three kinds of dyes solution 500mg / L,with 200mL solution has been obtained,fixed the three factors,changes the factors to be studied,then measure color and COD of the solution after the reaction,and draw the corresponding removal rate curve in order to evaluated the dye degradation.
In the conditions pH = 3,Voltage 20V,2.5g / L NaCl dosage ,the impact of different electrolysis time on the removal of dyes shown in Figure 5.Electrolytic oxidation time directly affects the decolorization rate and COD removal,the longer the oxidation time,the more electricity passed by,and the decolorization rate and COD removal significantly improved; for active orange X-GN and active yellow XR,after electrolyzing 30min the dye solution decolorization rate is almost up to 100%,while the COD removal efficiency is only 53% ,Continue to electrolyze the solution which has been handled 30min,after 60min treatment the COD remova has reached 68%; for Reactive Black KN -B,after electrolyzing 60min the dye solution decolorization rate comes to 100%,COD removal rate to 60%.Continue to extend the reaction time,COD removal rate was found almost no raise.Because as the reaction going,organic matter concentration decreased,current efficiency gradually decreased,therefore,the best electrolysis time is 60min.
辅助工具google.
翻译修改校对huayunnnn.
用时 五十分钟.
2010年6月17日12:561年前查看全部
- 化学计量在实验中运用的题实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后
化学计量在实验中运用的题
实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g则原混合气体中臭氧的体积分数为?
需详解. 小易酷1年前1
小易酷1年前1 -
 l50131 共回答了23个问题
l50131 共回答了23个问题 |采纳率91.3%由于是充分反映,所以差量法得出氧原子的摩尔数是0.1,原气体的摩尔数是0.04
设氧气xmol,臭氧ymol 2x+3y=0.1 x+y=0.04
解得x= 0.02 y=0.02
那么体积分数就是50%1年前查看全部
- 目前人们认为很理想的一种生物反应器是 A.种子 B.乳房反应器 C.肉类 D.植物体
 hydraulics1年前1
hydraulics1年前1 -
 wlfanshu 共回答了17个问题
wlfanshu 共回答了17个问题 |采纳率88.2%B
1年前查看全部
- 将1.0mol CO和1.0mol H2O(g)充入某固定容积的反应器中,在一定条件下反应:CO(g
将1.0mol CO和1.0mol H2O(g)充入某固定容积的反应器中,在一定条件下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡时有[2/3]的CO转化为CO2.在相同条件下,将1.0mol CO和2.0mol H2O(g)充入同一反应器中,在相同温度下达到平衡后,CO2的体积分数约为( )
A.22.2%
B.28.2%
C.33.3%
D.37.8% flower_lch1年前0
flower_lch1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 850K时,在一密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3浓度分别为3.0×10-3
850K时,在一密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3浓度分别为3.0×10-3mol•L-1、4.0×10-3mol•L-1和2.2×10-2mol•L-1.计算:
(1)该温度下反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数?
(2)平衡时SO2转化率? 随风vv1年前1
随风vv1年前1 -
 唯丽雅 共回答了28个问题
唯丽雅 共回答了28个问题 |采纳率100%解题思路:(1)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(2)转化率=[消耗量/起始量]×100%.850K时,在一密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3浓度分别为3.0×10-3mol•L-1、4.0×10-3mol•L-1和2.2×10-2mol•L-1,
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol/L) 2.5×10-21.5×10-2 0
变化量(mol/L)2.2×10-21.1×10-2 2.2×10-2
平衡量(mol/L)3.0×10-3 4.0×10-3 2.2×10-2
(1)该温度下反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数K=
(2.2×10−2)2
(3.0×10−3)2×4.0×10−3=1.34×105;
答:该温度下反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数为1.34×105;
(2)平衡时SO2转化率=
2.2×10−2
2.5×10−2×100%=88%,答:平衡时SO2转化率为88%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡计算应用,主要是平衡常数、转化率概念的计算,掌握基础是关键,题目较简单.1年前查看全部
- 将1mol 和1mol 充入某固定容积的反应器中,在一定条件下, +
将1mol
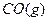 和1mol
和1mol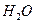 充入某固定容积的反应器中,在一定条件下,
充入某固定容积的反应器中,在一定条件下,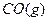 +
+ 达到一定反应限度时有2/3的
达到一定反应限度时有2/3的 转化成
转化成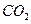 ,在相同条件下,将1mol
,在相同条件下,将1mol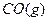 和2mol
和2mol  充入同一反应器中,当反应达到同一反应限度混合气体
充入同一反应器中,当反应达到同一反应限度混合气体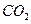 的体积分数可能是
的体积分数可能是A.22.2% B.28.2% C.33.3% D.37.8%  oirerew51年前1
oirerew51年前1 -
 daniel华 共回答了20个问题
daniel华 共回答了20个问题 |采纳率95%将1mol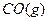 和1mol
和1mol 充入某固定容积的反应器中,在一定条件下,
充入某固定容积的反应器中,在一定条件下,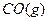 +
+ 达到一定反应限度时有2/3的
达到一定反应限度时有2/3的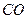 转化成
转化成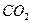 ,在相同条件下,将1mol
,在相同条件下,将1mol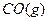 和2mol
和2mol  充入同一反应器中,当反应达到同一反应限度混合气体
充入同一反应器中,当反应达到同一反应限度混合气体 的体积分数可能是
的体积分数可能是
A.22.2% B.28.2% C.33.3% D.37.8%
B
本题考查化学平衡计算;根据三段式:将1molCO和1molH 2 O充分反应达到平衡时:
CO + H 2 O =" " CO 2 + H 2
开始:1mol 1mol 0 0
转化:
平衡:
平衡时CO 2 的体积分数为:×100%=33.3%
若充入1molCO和2molH 2 O充分反应达到平衡时,假设有的CO转化为CO 2 :
CO + H 2 O =" " CO 2 + H 2
开始:1mol 2mol 0 0
转化:
平衡:
平衡时CO 2 的体积分数为:×100%=22.2%
由于反应中充入的H 2 的量增加,故CO的转化率增大,因此CO 2 的体积分数大于22.2%,而小于33.3%,B项符合题意。1年前查看全部
- 在一恒温、恒容的密闭反应器中发生如下反应:C(s)+H 2 O⇌CO(g)+H 2 (g),为了判定该可逆反应是否达到平
在一恒温、恒容的密闭反应器中发生如下反应:C(s)+H 2 O⇌CO(g)+H 2 (g),为了判定该可逆反应是否达到平衡,没有参考价值的物理量是( ) A.反应器内气体的总压强 B.反应器内气体的总的物质的量 C.反应器内固体的总质量 D.反应器内物质的总质量  maxuegnag1年前1
maxuegnag1年前1 -
 July七 共回答了27个问题
July七 共回答了27个问题 |采纳率96.3%A.该反应是一个反应前后气体增大的可逆反应,反应前后气体的体积改变,所以能作为化学平衡状态的判断依据,故A不选;
B.该反应是一个反应前后气体的总物质的量增大的可逆反应,反应前后气体的总物质的量改变,所以能作为化学平衡状态的判断依据,故B不选;
C.该反应前后固体的质量减小,所以能作为化学平衡状态的判断依据,故C不选;
D.该反应前后物质的总质量不变,所以不能作为化学平衡状态的判断依据,故D选;
故选D.1年前查看全部
- 某温度下,向容积为2L的密闭反应器中充入0.10mol SO3,当反应器中的气体压强不再变化时测得SO3的转化
某温度下,向容积为2L的密闭反应器中充入0.10mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2⇌2SO3(g)的平衡常数为( )
A.8.0×102mol-1•L
B.1.6×103mol-1•L
C.3.2×103mol-1•L
D.4.0×102mol-1•L yaoo221年前1
yaoo221年前1 -
 pigflyer 共回答了19个问题
pigflyer 共回答了19个问题 |采纳率94.7%解题思路:根据SO3的转化率计算转化的SO3的物质的量,再计算SO3的浓度变化量,根据三段式计算平衡时各组分的浓度,计算反应2SO3⇌2SO2+O2的平衡常数,相同温度下,同一反应的正、逆反应平衡常数互为倒数,据此计算.平衡时SO3的转化率为20%,转化的SO3的物质的量为0.1mol×20%=0.02mol,SO3的浓度变化量为0.02mol2L=0.01mol/L, 2SO3...
点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查平衡常数的有关计算,难度中等,注意对平衡常数表达式的理解,确定相同温度下同一反应正、逆平衡常数互为倒数.1年前查看全部
- 加氢反应对反应器的要求?
 moluo1231年前1
moluo1231年前1 -
 hjq200 共回答了29个问题
hjq200 共回答了29个问题 |采纳率96.6%(1)耐腐蚀
(2)能使反应物料分布均匀,保证油气良好接触.
(3)能及时排除反应热,避免反应温度过高和催化剂过热,以保证最佳反应条件和延长催化剂寿命.
(4)在反应物料均匀分布的前提下,必须考虑反应器有合理压力降,以防止催化剂破碎.1年前查看全部
- 实验室制取CO2有以下几个步骤:①按要求装好仪器;②向漏斗中注入盐酸;③向反应器中加入块状石灰石;④检查装置气密性;⑤收
实验室制取CO2有以下几个步骤:①按要求装好仪器;②向漏斗中注入盐酸;③向反应器中加入块状石灰石;④检查装置气密性;⑤收集生成的气体.以上操作正确排列顺序为( )
A.①②③④⑤
B.②①④③⑤
C.①④③②⑤
D.①②④③⑤ 娱乐黑客1年前1
娱乐黑客1年前1 -
 jaf2a 共回答了16个问题
jaf2a 共回答了16个问题 |采纳率81.3%解题思路:根据实验室制取二氧化碳的实验步骤,来解答该题,要注意先连接仪器然后检查气密性,添加药品时先加固体后加液体.实验室制取二氧化碳用的药品是大理石或石灰石与稀盐酸,实验步骤是:按要求连好制取装置、检验装置的气密性、向反应器中加入石灰石、向漏斗中注入稀盐酸、收集气体然后验满即可,所以顺序为①④③②⑤与C选项相符合
故选C点评:
本题考点: 制取二氧化碳的操作步骤和注意点.
考点点评: 知道常用气体的制取方法和收集方法,能够熟练的掌握实验装置的连接及药品的添加顺序,一般是先固后液,检查气密性时要先连后验.1年前查看全部
- 如何向反应器中通入60℃的干燥空气?
 别有洞天1年前1
别有洞天1年前1 -
 dianzi1017 共回答了22个问题
dianzi1017 共回答了22个问题 |采纳率86.4%如果限制进入反应器的温度,那么肯定有一个长程的换热装置,保持这个温度就可以了,蛇形管恒温水60℃,当然之前要通一个干燥装置,比如五氧化二磷干燥器.1年前查看全部
- 玻璃和什么反应?显而易见,我们无论做什么实验、贮存什么化学药品,总是要用玻璃容器、反应器.首先,因为只有不和那些药品发生
玻璃和什么反应?
显而易见,我们无论做什么实验、贮存什么化学药品,总是要用玻璃容器、反应器.首先,因为只有不和那些药品发生反应,才能用来做容器、反应器,所以,得出结论,玻璃不和那些显而易见的发生反应.那么,玻璃和什么会发生反应呢?要所有的反应物、化学方程式.还有,和玻璃发生反应的东西,该用什么容器来贮存呢? 1伊瓜苏11年前5
1伊瓜苏11年前5 -
 cj38 共回答了16个问题
cj38 共回答了16个问题 |采纳率87.5%玻璃成分有3个.
SiO2,Na2SiO3,CaSiO3.
第一:4HF+SiO2=SiF4气体+2H2O
注意:SiF4气体有毒哦.例外,由此方程式看出,HF要保存在塑料瓶中,或者Pb(铅)瓶中.
第二:Na2SiO3的水溶液叫水玻璃.
Na2SiO3+co2+h2o==h2sio3沉淀+na2co3
由此看出,Na2SiO3久置在空气中会变浑浊.
第三:跟Na2SiO3性质差不多.
很详细吧.我最近正在高3复习.以上全是老师讲的.你可以放心参考.1年前查看全部
- 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应,CH4(g)互逆反应CO(g)+3H2(g),该反应为吸热反应
将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应,CH4(g)互逆反应CO(g)+3H2(g),该反应为吸热反应,请画出反应过程中体系的能量变化图.
详细点就好了.图不好画解释也可以的 dqchegang1年前0
dqchegang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图,将一块金属放在盛稀盐酸的反应器中,反应发生一定时间后在装置D处加热,稍后可见装置E中的白色无水硫酸铜粉末变蓝.
如图,将一块金属放在盛稀盐酸的反应器中,反应发生一定时间后在装置D处加热,稍后可见装置E中的白色无水硫酸铜粉末变蓝. 
试回答下列问题:
(1)E中白色的无水硫酸铜变蓝,说明D中反应物有______,写出E中变化的化学方程式______.
(2)从E中的变化证明装置A一定有______生成.
(3)写出装置D中发生反应的化学方程式______.
(4)A中反应发生的前提是______.
(5)B装置的作用是______C装置的作用是______. zhxfpek1年前1
zhxfpek1年前1 -
 plus9898 共回答了21个问题
plus9898 共回答了21个问题 |采纳率76.2%(1)因为硫酸铜可与水结合生成五水硫酸铜而使固体变蓝,所以可证明D装置内生成了水,其方程式为:CuSO 4 +5H 2 O=CuSO 4 ?5H 2 O;
(2)从氧化铜与气体反应生成水可知:通入的气体必是氢气,因为氢气与氧化铜反应会生成水;
(3)D装置中发生的反应是氢气还原氧化铜,其方程式为:H 2 +CuO
△
.
Cu+H 2 O;
(4)根据金属活动性顺序表的相关应用可知只有金属的活动性排在氢的前面的金属,才能和盐酸反应生成氢气;
(5)依据氢氧化钠可与盐酸发生中和反应可知B装置的作用是除掉生成气体中可能混有盐酸溶液挥发出的氯化氢气体,浓硫酸是常用的干燥剂,所以此处C装置的作用是干燥氢气.
故答案为::(1)水;CuSO 4 +5H 2 O=CuSO 4 ?5H 2 O;
(2)氢气;
(3)H 2 +CuO
△
.
Cu+H 2 O;
(4)金属的活动性必须排在氢的前面;
(5)除掉生成气体中可能混有的氯化氢气体;干燥氢气.1年前查看全部
- (6分)(2012•重庆)在一个不导热的密闭反应器中,只发生两个反应:
(6分)(2012•重庆)在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)⇌2c(g);△H 1 <0
x(g)+3y(g)⇌2z(g);△H 2 >0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )A.等压时,通入惰性气体,c的物质的量不变 B.等压时,通入z气体,反应器中温度升高 C.等容时,通入惰性气体,各反应速率不变 D.等容时,通入z气体,y的物质的量浓度增大  dubin1年前1
dubin1年前1 -
 justice_319 共回答了15个问题
justice_319 共回答了15个问题 |采纳率100%A
1年前查看全部
- 活性污泥和生物膜中微生物类群的组成对于反应器处理有机废水效率有何影响
 jerrygill1年前1
jerrygill1年前1 -
 zzgu 共回答了21个问题
zzgu 共回答了21个问题 |采纳率95.2%你这是两个问题吧,是问各自的影响还是问二者的区别呢?
不管是活性污泥法,还是生物膜法,二者在反应器中分解有机物的主体微生物是细菌如芽孢杆菌类的,只是二种反应器中微生物生长方式不一样,一种是悬浮态的,一种是固着生长的.本答案来自环保通,仅供参考1年前查看全部
- 加热电阻丝的温度控制想用电阻丝加热反应器中的溶液,只需要加热到30度然后让其一直稳定在30度,应该如何控制温度?
 大家一起来三1年前1
大家一起来三1年前1 -
 破碎红色心 共回答了18个问题
破碎红色心 共回答了18个问题 |采纳率83.3%把装有溶液的反应器放进一个大水杯里,用电阻丝加热这个大水杯中的水,同时用一台温控器来检测大水杯中的水温和控制电热丝的加热,把温控器的温度设定到30度,就ok了.
注意:
1)水杯越大,水越多越好,温度也会越稳定;2)温控器以带PID调节的为最好,时间比例调节次之,双位调节的再次之,定点调节的最次.3)温控器输出最好是无触点的.1年前查看全部
- 实验室制取CO2有以下几个步骤:①按要求装好仪器;②向漏斗中注入盐酸;③向反应器中加入块状石灰石;④检查装置气密性;⑤收
实验室制取CO2有以下几个步骤:①按要求装好仪器;②向漏斗中注入盐酸;③向反应器中加入块状石灰石;④检查装置气密性;⑤收集生成的气体.以上操作正确排列顺序为( )
A. ①②③④⑤
B. ②①④③⑤
C. ①④③②⑤
D. ①②④③⑤ cjhsleeper1年前1
cjhsleeper1年前1 -
 的的瑟瑟 共回答了22个问题
的的瑟瑟 共回答了22个问题 |采纳率100%解题思路:根据实验室制取二氧化碳的实验步骤,来解答该题,要注意先连接仪器然后检查气密性,添加药品时先加固体后加液体.实验室制取二氧化碳用的药品是大理石或石灰石与稀盐酸,实验步骤是:按要求连好制取装置、检验装置的气密性、向反应器中加入石灰石、向漏斗中注入稀盐酸、收集气体然后验满即可,所以顺序为①④③②⑤与C选项相符合
故选C点评:
本题考点: 制取二氧化碳的操作步骤和注意点.
考点点评: 知道常用气体的制取方法和收集方法,能够熟练的掌握实验装置的连接及药品的添加顺序,一般是先固后液,检查气密性时要先连后验.1年前查看全部
- 某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0.反应物A的浓
某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0.反应物A的浓度(mol•L -1 间(min)的变化情况如下表:
根据上述数据,完成下列填空:实验
序号0 10 20 30 40 50 60 1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50 2 800℃ C 2 0.60 0.50 0.50 0.50 0.50 0.50 3 800℃ C 3 0.92 0.75 0.63 0.60 0.60 0.60 4 820℃ 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(1)在实验1中,反应在10~20分钟内用A表示的平均速率为______.
(2)在实验2中,A的初始浓度C 2 =______mol•L -1 ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______.
(3)设实验3的反应速率为υ 3 ,实验1的反应速率为υ 1 ,则υ 3 ______υ 1 (填>、=、<),且C 3 =______mol•L -1 .
(4)由上述实验,可推测该反应是______反应(选填“吸热”或“放热”).理由是:______.
(5)1~4组实验中,A的平衡转化率最大的是第______组.
(6)在实验2中,50min后,若将容器体积增大1倍,则达平衡时B的浓度为______mol•L -1 ;该反应的平衡常数K______(填“不变”或“增大”或“减小”). 杀破拉拉1年前1
杀破拉拉1年前1 -
 nalanhong 共回答了17个问题
nalanhong 共回答了17个问题 |采纳率94.1%(1)反应在10~20分钟内用A表示的平均速率为v=
△C
△t =
(0.80-0.67)mol/L
(20-10)min =0.013mol/(L•min),
故答案为:0.013mol/(L•min);
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L -1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂;
故答案为:1.0;催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1的,即v 3 >v 1 ;
实验1可知40min时反应达到平衡
2A(g)⇌B(g)+D(g)
起始(mol•L -1 ) 1.00 0
反应(mol•L -1 ) 0.50 0.25 0.25
平衡(mol•L -1 ) 0.50 0.25 0.25
该温度下平衡常数K=
C(D)C(B)
C 2 (A) =
0.25×0.25
0.5 0 2 =
1
4 ;
实验3的温度与实验1的温度相同,温度不变,平衡常数不变;
2A(g)⇌B(g)+D(g)
起始(mol•L -1 ) C 3 0 0
反应(mol•L -1 ) 0.6 0.30 0.30
平衡(mol•L -1 ) C 3 -0.60 0.30 0.30
该温度下平衡常数K=
C(D)C(B)
C 2 (A) =
0.30×0.30
( C 3 -0.60 ) 2 =1;
解得:C 3 =1.2;
故答案为:>;1.2;
(4)实验4与实验1比,温度升高,达平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应;
故答案为:吸热;比较实验4与实验1,可看出升高温度,A的平衡浓度减小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应.
(5)2A(g)⇌B(g)+D(g)
起始(mo l•L -1 )C 2 0 0
反应(mol•L -1 ) 0.50 0.25 0.25
平衡(mol•L -1 ) C 2 -0.50 0.25 0.25
该温度下平衡常数K=
C(D)C(B)
C 2 (A) =
0.25×0.25
( C 2 -0.50 ) 2 =
1
4 ;
解得:C 2 =1.0;
1~4组实验中,第4组A的平衡转化率最大为
1.0-0.20
1.0 ×100%=80%,故答案为:4;
(6)由(5)知,在实验2中,平衡时B的浓度为0.25mol/L,50min后,若将容器体积增大1倍,平衡不移动,浓度为原来的一半,即0.125mol/L;由于温度不变,所以该反应的平衡常数不变,故答案为:0.125mol/L;不变.1年前查看全部
- 化学齐普反应器原理
 cat313911年前2
cat313911年前2 -
 tt保佑我 共回答了18个问题
tt保佑我 共回答了18个问题 |采纳率88.9%启普发生器,包括原型装置和简易装置……
它的原型装置,是由一个葫芦形容器和一个圆形漏斗构成的.
加入反应物反应制气,想让他停止时只需要关闭开关即可,管内气体跑不出去,气压增大,液体被压回漏斗,与葫芦形容器腰部的固体分离,反应自动停止……
常用常考的是它的简易装置,一般是一个大试管,带有多孔隔板,当然也可能是铁丝网,只要起分割作用就可以.上面是长颈漏斗,导气管连的橡胶管上一定要有止水夹.
原理和原型装置是一样的……
启普发生器的变形千奇百怪,有用烂的大试管的,有用球形干燥管的等等,不一而足……
但原理都是一样的!
只要同样的原理,都可以叫启普发生器的!
要站在一个高度看问题,不要被表象所迷惑,抓住实质(我化学老师语……)
一般人我不告诉他……1年前查看全部
- 化学热力学问题11.在绝热恒容反应器中发生如下理想气体反应H2+Cl2=2HCl(都是气态),则他们的Q,△U,△H,分
化学热力学问题1
1.在绝热恒容反应器中发生如下理想气体反应H2+Cl2=2HCl(都是气态),则他们的Q,△U,△H,分别是大于零,等于零还是小于零?为什么?做简要分析.
2.在绝热恒压反应器中发生如下理想气体反应H2+Cl2=2HCl(都是气态),则他的△U,△H,分别是大于零,等于零还是小于零?为什么?做简要分析. elliotzyb1年前3
elliotzyb1年前3 -
 majun6705 共回答了14个问题
majun6705 共回答了14个问题 |采纳率85.7%1 因为是绝热的,所以Q=0.因为是恒容,所以dV=0,即W=pdV=0.
dU=dQ+dW=0+0=0
dH=dU+pdv+vdp=0+0+vdp 因为反应前后气体分子数不变,体积不变,则压强也不变,dp=0
所以dH=0
2 因为是绝热的,所以Q=0.因为反应前后气体分子数不变,压强不变,则体积也不变,dV=0.W=pdV=0.dU=dQ+dW=0+0=0.dH=dU+pdV+Vdp=0+0+0=01年前查看全部
- (1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B
(1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0mol、D为6.5mol、F为2.0mol,设E为x mol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:

①若x=4.5,则右侧反应在起始时向______(填“正反应“或“逆反应“)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于______.
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______(填“相等“、“不相等“或“不能确定“).其理由是:______.
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g);△H<0试回答下列问题:
①若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=______;
②在相同温度下,若起始时c(CO)=2mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时v(正)______v(逆)(填“大于”“小于”或“等于”),达到平衡时CO的转化率为______;
③若降低温度,该反应的K值将______(填“增大”“减小”或“不变”,下同),该反应的化学反应速率将______. 大迦叶1年前1
大迦叶1年前1 -
 surpass617 共回答了13个问题
surpass617 共回答了13个问题 |采纳率92.3%解题思路:(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,由此判断右边反应向哪个方向进行;
令达平衡时E的消耗量为2a摩,求出平衡时各组分的物质的量,利用反应混和物总的物质的量为12mol列出等式,再利用可逆反应反应物不能完全反应列不等式,联立求解.
②这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A的物质的量也不同;
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向;据①中的平衡常数,利用三段式法计算平衡时各物质浓度,计算转化率,据此解答;
③该反应是放热反应,降低温度,平衡向着正向移动,K值增大,反应速率减小.(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,x...
点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等,(2)②中注意分析各物质的浓度变化量关系,确定概念改变的条件.难度中等,关键在于确定右侧反应到达平衡时反应混合物总的物质的量.1年前查看全部
- Aspen plus反应器设计模型中,什么叫并行反应和串联反应?
 cnsx03511年前1
cnsx03511年前1 -
 wyf2056 共回答了17个问题
wyf2056 共回答了17个问题 |采纳率88.2%所谓“并行反应”是指在同一体系中同时发生的两个或两个以上的化学反应,“连串反应”则是在同一体系或不同体系中连续发生两个或两个以上的反应.并行反应和连串反应在有关物质过量问题的讨论与计算中常因为对反应物用量与产物的区分不当给学生解题带来诸多不便,以致于得出错误的结论.
全给我 O(∩_∩)O哈哈~ 再加点给我1年前查看全部
- 用一台测量范围为1~1000摄氏度的温度仪表来测量反应器的温度,若最大允许误差为3摄氏度,试确定应选仪表的
 生活中的那丝美1年前3
生活中的那丝美1年前3 -
 许冰 共回答了20个问题
许冰 共回答了20个问题 |采纳率95%1000度,建议用非接触式,要好点.
不过这个精度还不好满足.误差要比3℃大.1年前查看全部
- 如何利用fluent求临界速度为阐述方便,先来一段原始模型的描述:旋转液膜反应器的反应区的关键部件由转子和定子两部分构成
如何利用fluent求临界速度
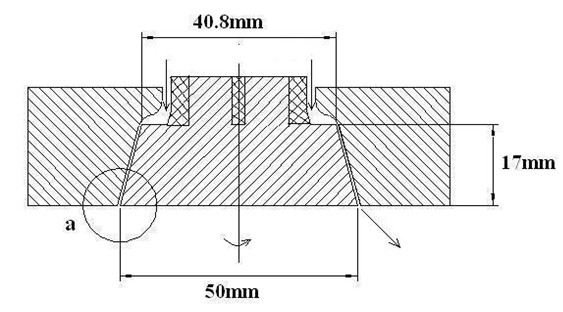
为阐述方便,先来一段原始模型的描述:旋转液膜反应器的反应区的关键部件由转子和定子两部分构成,其结构示意图如图3所示.旋转液膜反应器的入口由原来的四个液体分布叶片改为实心的圆柱体,图中单斜线阴影部分是原反应器的结构,交叉阴影部分是改进之后的旋转液膜反应器结构.反应物由连接圆柱体的两根管子加入到反应器中,改进后的旋转液膜反应器能够尽可能的减少空气被卷入到反应器中间.位于内部的转子是一个类似圆台的形状,高为17 mm,上部直径为40.8 mm,下部直径为50 mm,可以在一个1 KW的马达带动下按设定的转速旋转,转速调节范围为1000~5000 rpm.转子侧面与底面的夹角为75 ℃,可以通过外部定子的上下移动来调节反应区的间隙宽度.宽度调节范围为0.0.5 mm.
然后是最主要的问题:当流体加入速度大于一定数值时(加入速度较小时不予考虑),流体会从反应器的入口处溢流出反应器外界.
请问如何用fluent求出这个临界速度?
fluent对这一临界状态有什么判别标准吗?比如说质量通量、path-line等等
我是把网格做如下简化处理:只用两个半径不同的同轴圆台(Frustum)做差得到的区域模拟旋转区域.圆台顶面为velocity-inlet,底面为pressure-outlet(还是应该为outflow?),内壁为wall(rotating),外壁为wall.(stationary).
从现在模拟的结果来看,若加入速度相对较小得不到收敛解.若加入速度相对较大可以得到收敛解.不知道这个跟要求的临界速度有没有关系?
此外还有几个问题不太确定,该问题是定常流还是非定常流,底面的边界条件是pressure-out还是outflow?若是pressure-out,回流强度如何确定?
还有做网格处理只考虑1/4个区域,那周期边界如何设定?
当然最主要的还是这个临界速度怎么求?
这些问题困扰我好几个月了,
愿把所有积分都献出~
 劫狱者1年前1
劫狱者1年前1 -
 jennywang88 共回答了18个问题
jennywang88 共回答了18个问题 |采纳率83.3%临界速度好像求不了,只能你自己用不同速度,自己确定.
你只用旋转壁面肯定是不成都,建议你用先用简单的MRF模型来计算,这样计算就相对简单一些.如果需要精确计算还是用动网格来计算,从你的模型上来看还是比较简单的,用动网格计算应该不是问题.
边界条件的设置根据你现实情况来定即可,这要满足你的模型就没问题,不需要特殊设置.1年前查看全部
- (2013•庆阳)某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分
(2013•庆阳)某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究.
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙.但其中是否含有氯化氢需要通过实验来证明.若剩余溶液显酸性(含有H+),说明含有氯化氢.
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性.
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温.
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的______(填化学式),经______、蒸发等操作后即可完成.实验操作 实验现象 实验结论
甲同学取烧杯中溶液少许于试管中,向其中滴加______ 现象:溶液变为红色 溶液显酸性(含有H+);溶质中有氯化氢.
乙同学取烧杯中溶液少许于试管中,向其中加入少量锌粒 现象:______
反应的化学方程式是:______
丙同学取烧杯中溶液少许于试管中,向其中加入少量石灰石 现象:______  liuji1181年前1
liuji1181年前1 -
 卡人类 共回答了19个问题
卡人类 共回答了19个问题 |采纳率89.5%解题思路:【实验过程】:根据酸遇石蕊变红进行解答;
根据盐酸和锌粒反应放出氢气进行解答;
根据稀盐酸和碳酸钙反应生成二氧化碳气体进行解答;【实验过程】:甲同学:酸遇石蕊变红,所以取烧杯中溶液少许于试管中,向其中滴加紫色石蕊试液,现象:溶液变为红色;
乙同学:盐酸和锌粒反应放出氢气,取烧杯中溶液少许于试管中,向其中加入少量锌粒,现象:锌粒逐渐溶解,有气泡产生;反应的化学方程式是:Zn+2HCl=ZnCl2+H2↑;
丙同学:稀盐酸和碳酸钙反应生成二氧化碳气体,取烧杯中溶液少许于试管中,向其中加入少量石灰石,现象:石灰石逐渐溶解,有气泡产生;
【拓展提高】:因为稀盐酸和碳酸钙反应生成氯化钙、水、二氧化碳气体;所以若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的石灰石,经过滤、蒸发等操作后即可完成.
故答案为:紫色石蕊试液;锌粒逐渐溶解,有气泡产生;Zn+2HCl=ZnCl2+H2↑;石灰石逐渐溶解,有气泡产生;CaCO3;过滤.点评:
本题考点: 实验探究物质的组成成分以及含量;混合物的分离方法;酸的化学性质;溶液的酸碱性测定.
考点点评: 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答.1年前查看全部
- 在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一刺有小孔的铝箔包好,放入盛有水的反应器中.待钠块
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一刺有小孔的铝箔包好,放入盛有水的反应器中.待钠块
完全反应后,收集到0.1g氢气,测得铝箔的质量比反应前减少了0.27g,反应器内所得溶液中NaOH的质量为4g.求原钠块所含钠和氧化钠的质量. 柏林bear1年前1
柏林bear1年前1 -
 lizys 共回答了15个问题
lizys 共回答了15个问题 |采纳率93.3%整个过程中钠和铝失电子,水得电子根据电子得失守恒
3*0.27/27 + n(Na)==== 0.1
n(Na) ==0.07mol
m(Na) ==0.07* 23 == 1.61克
反应后总的Na为0.1mol
根据钠守恒可得 n(Na2O) == (0.1-0.07)/2 === 0.015 mol
氧化钠的质量为 0.015 * 62 = 0.93克1年前查看全部
- 哪位大哥能提供下二氧化氯反应器中盐酸和氯酸钠的最嘉浓度各为多少啊?
 blackbird_zgj1年前3
blackbird_zgj1年前3 -
 wwffa 共回答了20个问题
wwffa 共回答了20个问题 |采纳率90%氯酸钠33%,盐酸31%,这种浓度转化率最高1年前查看全部
- 将n摩尔木炭粉和一摩尔FeO在反应器中混合,隔绝空气加热,可能发生的化学反应
 T_zp1年前2
T_zp1年前2 -
 肖图 共回答了18个问题
肖图 共回答了18个问题 |采纳率94.4%FeO + C 2CO1年前查看全部
- 如何判断一个反应器中是否存在厌氧氨氧化反应?判定依据或标准是什么.
 纯ss1年前1
纯ss1年前1 -
 热情的灵灵 共回答了20个问题
热情的灵灵 共回答了20个问题 |采纳率100%通过进出水的氮去除率来判断吧,如果存在厌氧氨氧化反应,那么低碳高氮废水的氮去除率是明显的.1年前查看全部
- 如将二氧化碳和氢气以1:3混合,通入反应器.在适当的条件下发生反应,生成某种重要化工原料和水
如将二氧化碳和氢气以1:3混合,通入反应器.在适当的条件下发生反应,生成某种重要化工原料和水
该化工原料可能是 A烷烃 B烯烃 c炔烃 d芳香烃
要讲解 胡悠儿1年前3
胡悠儿1年前3 -
 cdfysy 共回答了22个问题
cdfysy 共回答了22个问题 |采纳率95.5%A,B,C,D 四个答案都是烃,co2和h2反应生成物含碳的只能是烃所以co2中的氧只能和H反应生成H2O,CO2中O和H生成水之比为1:4所以1MOLCO2要2MOLH2,根据比例要2molCO2和6molH2反应生成4molH2O和1molC2H4.答案选1年前查看全部
- 将n mol 木炭粉和1molFeO在反应器中混合,隔绝空气加强热.
将n mol 木炭粉和1molFeO在反应器中混合,隔绝空气加强热.
(1)可能发生的化学反应有:1 FeO+C=Fe+CO 2 2FeO+C=2Fe+CO2
3 FeO+CO=Fe+CO2 写出第四种反应?
(2)若n<1,充分反应后,反应器中的固体物质是 ,气体物质是
(3)若n>1,充分反应后,反应器中的固体物质是 ,气体物质是?
(4)若反应的气体产物是混合物,n的取值范围的?
(5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为? 82120100471年前2
82120100471年前2 -
 yh3221944 共回答了14个问题
yh3221944 共回答了14个问题 |采纳率85.7%1.C+CO2=2CO
2.Fe FeO CO
3.Fe C co
4.0.51年前查看全部
- 烧杯可以作反应器,加热时应该________加热液体不能超过容积的______配置溶液不能超过容积的__________
烧杯可以作反应器,加热时应该________加热液体不能超过容积的______配置溶液不能超过容积的_____________
横线上填答案 呀呀_鱼1年前1
呀呀_鱼1年前1 -
 gangdongl 共回答了12个问题
gangdongl 共回答了12个问题 |采纳率83.3%烧杯可以作反应器,加热时应该_垫上石棉网_加热液体不能超过容积的_1/3_配置溶液不能超过容积的__1/2__1年前查看全部
- 某反应器工作压力为15兆帕,要求测量误差不超过±0.5兆帕,现用一只2.5级,0~25兆帕的压力表进行测量,问能否对测量
某反应器工作压力为15兆帕,要求测量误差不超过±0.5兆帕,现用一只2.5级,0~25兆帕的压力表进行测量,问能否对测量误差的要求?应选几级的压力表?
 sjzerinca1年前1
sjzerinca1年前1 -
 katherinelin 共回答了20个问题
katherinelin 共回答了20个问题 |采纳率80%用2.5级,0-25兆帕的压力表不符合要求:±2.5%×25=±0.625>±0.5了,应该选1.6级,0-25兆帕的压力表:±1.6%×25=±0.4<±0.5.1年前查看全部
- 请问 老师一个化学方程式 Si 和Hcl 反应 的化学方程式是怎么样的呢 反应器是流化床
请问 老师一个化学方程式 Si 和Hcl 反应 的化学方程式是怎么样的呢 反应器是流化床
一个是Si+3Hcl -- SiHcl3+ H2 第二个是 3Si+10HCl--- 2SiHCl3+SiCl4+4H2 谢ii阳的爱1年前1
谢ii阳的爱1年前1 -
 jsblm 共回答了10个问题
jsblm 共回答了10个问题 |采纳率100%Si+3HCl→SiHCl3+H2↑,条件应该是高温1年前查看全部
- 将CH4与H2O通入聚焦太阳能反应器,发生反应CH4+H2O=(可逆)=CO+3H2,△H=+206KJ/MOL.将等物
将CH4与H2O通入聚焦太阳能反应器,发生反应CH4+H2O=(可逆)=CO+3H2,△H=+206KJ/MOL.将等物质的量
的CH4和H2O充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为0.1mol,CH4的平衡转化率为91%,此温度下的平衡常数为?(结果取整数) 侧古1年前2
侧古1年前2 -
 fishboss 共回答了20个问题
fishboss 共回答了20个问题 |采纳率85%可逆反应:CH4 + H2O = CO + 3H2
起始浓度:n n 0 0
平衡浓度:n-0.1 n-0.1 0.1 0.3
α(CH4) = 0.1/n × 100% = 91%,解得:n = 0.11
平衡浓度:0.01 0.01 0.1 0.3
K = [c(CO)·c(H2)^3]/[c(CH4)·c(H2O)] = [0.1×(0.3)^3]/(0.01×0.01) = 271年前查看全部
- 制造乙苯1,烃化反应器中,有乙烯很苯的进料.循环苯塔中有乙烯很苯进料.到底乙苯是在那里产生的?2,反烃化反应器的生成产品
制造乙苯
1,烃化反应器中,有乙烯很苯的进料.循环苯塔中有乙烯很苯进料.到底乙苯是在那里产生的?
2,反烃化反应器的生成产品,求化工高手应答
回答后可加分. 北城无知1年前1
北城无知1年前1 -
 suyonggang 共回答了16个问题
suyonggang 共回答了16个问题 |采纳率93.8%脱除丙烯后的催化干气进入烃化反应器.从分离部分来的循环苯分作两路,其中一路经反应产物-循环苯换热器换热气化,再经循环苯加热炉加热至所需温度后,进入烃化反应器顶部,与干气中的乙烯等烯烃反应.烃化反应产物与循环苯、循环苯塔进料换热后再经循环水、冷冻水冷凝冷却,冷凝冷却后的气液体进入分离部分的吸收塔底部.从分离部分来的反烃化料与从分离部分来的另一路循环苯,经换热器换热并经至反应温度后进入反烃化反应器,反烃化反应产物换热后进入循环苯塔.
自反应部分来的烃化尾气进入吸收塔底部,与自上而下的吸收剂逆向接触,将烃化尾气中绝大部分苯及重组分吸收下来,尾气从塔顶送出装置.吸收剂及吸收下来的苯等重组分一起,自吸收塔底经泵压送至循环苯塔进料罐.
循环苯塔进料、反烃化反应产物、新鲜苯各自进入循环苯塔,苯及不凝气从塔顶蒸出进入循环苯塔顶蒸汽发生器,冷凝冷却后进入循环苯塔回流罐闪蒸,闪蒸后凝液经由循环苯塔回流泵全部打入塔顶作为回流,闪蒸后气体经循环水冷却后直接送出装置.塔底物料经泵加压后送至乙苯精馏塔作为该塔进料.循环苯塔侧线抽出循环苯,泵送至反应部分.
乙苯精馏塔进料进入乙苯精馏塔后,乙苯从塔顶蒸出,进入乙苯精馏塔顶蒸汽发生器冷凝,冷凝液进入乙苯精馏塔回流罐.冷凝液经乙苯精馏塔回流泵加压后分为两路,一路打入塔顶作为回流,另一路经乙苯冷却器冷却至送至乙苯产品罐,然后泵送出装置.塔底物料送至下游,进一步分离丙苯及多乙苯,其中,多乙苯作为反烃化原料送往反应部分.
所以反烃化反应器的生成产品还是乙苯.1年前查看全部
大家在问
- 1改错.下列各句均有一处错误,指出并改正.
- 2英语翻译可以翻译成"不要跟其他人说"吧
- 3望着月下的洞庭湖我会想起什么样子的成语.
- 4要决定谁先开球,下面游戏不公平的是( ) A.抛硬币决定 B.抛矿泉水瓶盖决定 C.玩“石头、剪子、布”决定
- 5同弦或等弦所对的圆周角相等对不啊
- 6在三角形ABC中,角A等于120度,AD平分角BAC,BE平分角ABC,求角BED的度数.
- 7(2012•自贡)下列选项中物质的名称、俗名、化学式一致的是( )
- 8等差数列前n项和为40,2n项和为120,求3n项的和
- 9为什么不能用浓硫酸干燥硫化氢气体?
- 101.92g铜与100mL 1mol/L的稀硝酸溶液充分反应.假设反应后的溶液仍为 100mL ,此时硝酸根的物质的量浓度
- 11英文好的进.BBC business news里面有一句让我很困惑
- 12下面这段话中,甲、乙、丙、丁四处中的一处逗号用得不够恰当,从而产生了歧义。请删去一个逗号,使句子符合作者本意。应删去
- 13多元复合函数求导,来点思路就行傻眼了,没思路第二道是关于复合函数,隐函数求导,其中关系复杂.对于第一个求导,是不是只要用
- 14流光溢彩、眼羡、饱览、津津有味、天长日久、如醉如痴、浮想联翩、囫囵吞枣、悲欢离合、牵肠挂肚、如饥似渴、不言而喻、黯然神伤
- 15有一台风机盘管,高档风量为680m3/h,冷量为4000w,按标准测试工况估算对应的冷水流为多少?

