碳粉与14g氧气在一定条件下反应生成21g氧化物,则生成co和co2的物质的量之比为
 里裤塞磁卡2022-10-04 11:39:541条回答
里裤塞磁卡2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 purepoison 共回答了19个问题
purepoison 共回答了19个问题 |采纳率100%- 根据质量守恒,碳粉质量=7g;
设COxmol,CO2ymol;
x+y=7/12;
28x+44y=21;
求出x,y即可; - 1年前
相关推荐
- 一个简单的化学问题 为什么除去铜粉中少量碳粉不能用氧化铜进行加热
 双羽飞飞1年前5
双羽飞飞1年前5 -
 34810568 共回答了20个问题
34810568 共回答了20个问题 |采纳率90%因为碳粉是少量的,你不好好控制氧化铜的量,若过量,氧化铜就变成杂质了,你要知道目的是为了得到铜单质1年前查看全部
- 有两包黑色粉末,分别为铁粉和碳粉,请你设计实验,用两种方法鉴别两种粉末完成下表: 步骤 现象 结论 方法一 方法二
 tqzyx011年前1
tqzyx011年前1 -
 meewoo 共回答了24个问题
meewoo 共回答了24个问题 |采纳率79.2%解题思路:关于物质的鉴别,就是根据题目已知条件和要求,把几种未知的物质区别开来的一种操作.初中化学常用的鉴别方法,有物理方法和化学方法之分,还有物理方法和化学方法综合运用的鉴别.现分析几种常用的鉴别方法.根据化学性质的鉴别:①点燃法利用物质可燃、助燃、不燃等化学性质来鉴别的方法.在空气中:铁粉不可燃,碳粉可燃;②分别与酸或盐混合,看是否反应.铁粉和碳粉,用物理性质不好鉴别,可利用化学性质鉴别.
①、分别取少量加入稀硫酸,有气泡生成的是铁粉,无气泡的是碳粉.
②、分别取少量加入硫酸铜溶液,有红色固体出现的为铁粉,无明显现象得是碳粉.
步骤 现象 结论
方法一:分别取少量加入稀H2SO4
溶液 有气泡产生
无明显现象 铁粉
碳粉
方法二:分别取少量加入CuSO4溶液 有红色出现
无明显现象 铁粉
碳粉点评:
本题考点: 物质的鉴别、推断;化学性质与物理性质的差别及应用.
考点点评: 初中化学常用的鉴别方法,有物理方法和化学方法之分,还有物理方法和化学方法综合运用的鉴别.1年前查看全部
- 实验室常将氯酸钾与二氧化锰混合后制取氧气,若二氧化锰中混入了碳粉,则受热后可能引起的后果是
 栀为尧1年前3
栀为尧1年前3 -
 烟酒人味 共回答了21个问题
烟酒人味 共回答了21个问题 |采纳率90.5%碳粉与生成的氧气反应,生成CO2,致使O2不纯1年前查看全部
- 请设计实验鉴别3中黑色粉末:碳粉,二氧化锰,氧化铜
 mengluogmm1年前3
mengluogmm1年前3 -
 亲亲我宝贝123 共回答了18个问题
亲亲我宝贝123 共回答了18个问题 |采纳率100%1.取少量样品,加入稀硫酸,溶解变蓝色的为氧化铜
CuO+H2SO4===CuSO4+H2O
2.加热,减少是碳粉,不会变少的是二氧化锰
C+O2==点燃===CO21年前查看全部
- 将红金石碳粉混合并通入氯气的化学方程式
 jennymeng671年前1
jennymeng671年前1 -
 taotie0622 共回答了14个问题
taotie0622 共回答了14个问题 |采纳率85.7%应该是金红石吧,金红石主要成分是TiO2
即TiO2+2C+2Cl2=高温=TiCl4+2CO1年前查看全部
- 在侧空气中氧气的含量的实验中若将红磷换成碳粉,能否成功?为啥?应如何改进?
 阿娅爱灵1年前2
阿娅爱灵1年前2 -
 dna888 共回答了16个问题
dna888 共回答了16个问题 |采纳率81.3%不能,生成CO2为气体,压强不变,不能把水压入
加碱石灰或NaOH吸收CO21年前查看全部
- 测定空气中氧气含量的实验,若将红磷换成碳粉,则测出来的含氧量偏大还是偏小?
 wrhxosiopc1年前1
wrhxosiopc1年前1 -
 haha8861 共回答了16个问题
haha8861 共回答了16个问题 |采纳率87.5%偏小,因为C粉会生成CO2,是气体,也占体积,所以偏小1年前查看全部
- 在一固定的容器中放入适量碳粉和8g氧气,电火花点燃反应后恢复到原来的状态.测得其压强是反应前的1.2倍
在一固定的容器中放入适量碳粉和8g氧气,电火花点燃反应后恢复到原来的状态.测得其压强是反应前的1.2倍
则参加反应碳的质量为---
A.3.6gB.2.4gC.4.4gD.1.2g mengdayezaici1年前2
mengdayezaici1年前2 -
 可以炫耀的美丽 共回答了12个问题
可以炫耀的美丽 共回答了12个问题 |采纳率83.3%炭和氧气生成CO2是压强不变的,但生成CO是
2C + O2 ==== 2CO
由阿佛加德罗定律得,压强比等于物质的量之比.
原来氧气0.25mol 现在气体共0.3mol
设氧气最多反应了Xmol,生成CO
则 2X+(0.25-X)=0.3
X=0.05
所以有0.1molC反应成CO 2.4克
余下的0.15mol氧气和C反应生成CO2
所以一共耗炭 0.25molC 3克 !
选C!1年前查看全部
- 测定空气中氧气含量的实验,若将红磷换成碳粉,该实验能否成功?为啥?
 寂寂山谷1年前1
寂寂山谷1年前1 -
 单rrc 共回答了14个问题
单rrc 共回答了14个问题 |采纳率100%不能的
生成的仍然是气体,应该要是固体的才行1年前查看全部
- 下列个混合物中,可以先加水溶解,再用过滤的方法进行分离的是 A食盐和蔗糖的混合物B氧化铜和碳粉的混合物
下列个混合物中,可以先加水溶解,再用过滤的方法进行分离的是 A食盐和蔗糖的混合物B氧化铜和碳粉的混合物
C含有食盐和熟石灰的混合物D氯酸钾和二氧化锰加热好后剩余的混合物 于与1年前1
于与1年前1 -
 xijirong 共回答了20个问题
xijirong 共回答了20个问题 |采纳率90%D 二氧化锰不溶于水...但氯酸钾反应生成的氯化钾溶于水 (二氧化锰是催化剂)1年前查看全部
- 除去碳粉中的CuO,为什么要加足量的盐酸,过滤?
除去碳粉中的CuO,为什么要加足量的盐酸,过滤?
生成CuCl2不是等于又增加了杂物了吗 weidao200410051年前5
weidao200410051年前5 -
 百年普洱 共回答了12个问题
百年普洱 共回答了12个问题 |采纳率91.7%生成的Cucl2是溶质 溶解在溶液里面 被过滤了
而碳粉不可溶 所以过滤后的固体只有碳粉1年前查看全部
- 100克碳粉燃烧生成三分之一的一氧化碳和三分之二的二氧化碳 问比100克碳粉完全燃烧少放出多少热量
 janexi1年前2
janexi1年前2 -
 weizy_zq 共回答了21个问题
weizy_zq 共回答了21个问题 |采纳率90.5%要知道C燃烧分别生成CO 和CO2所放的热量才能定量求解,不然没法求,这种不符合实际毫无意义的题不会出现在中考试卷上可以放弃!1年前查看全部
- 如何证明碳粉中含有氧化铜粉?
 罗美1年前1
罗美1年前1 -
 mostranger 共回答了23个问题
mostranger 共回答了23个问题 |采纳率100%将此粉末高温煅烧如果有红色物质析出,证明有Cu,将生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明有二氧化碳,从而推出碳粉中有氧化铜粉1年前查看全部
- 除去碳粉中混有的硫粉所用的试剂和操作
 nightcannon1年前1
nightcannon1年前1 -
 cytxh 共回答了16个问题
cytxh 共回答了16个问题 |采纳率93.8%一 加入铁粉,然后加热反应.
二 产物加入盐酸加热反应,
三 过滤得到碳粉.1年前查看全部
- 除去碳粉中的二氧化锰,为什么要加浓盐酸,然后加热,过滤?
 1107496281年前1
1107496281年前1 -
 百合花盛开0 共回答了22个问题
百合花盛开0 共回答了22个问题 |采纳率90.9%二氧化锰与浓盐酸加热条件下反应生成能溶于水的氯化锰,氯气,水,碳不与浓盐酸反应,过滤得到碳1年前查看全部
- 金红石碳粉混合后通入氯气制的TiCI4和一种可燃性气体,该反应的还原剂是什么
 beijingzl20031年前1
beijingzl20031年前1 -
 feibutterfly 共回答了17个问题
feibutterfly 共回答了17个问题 |采纳率76.5%TiO2+2Cl2+2C===高温===TiCl4+2CO
还原剂是C1年前查看全部
- 金红石,碳粉混合在高温条件下,通入氯气制得TiCl4和一种可燃性气体,此反应的化学方程式是什么?
 sunny9211年前1
sunny9211年前1 -
 lkj6666 共回答了13个问题
lkj6666 共回答了13个问题 |采纳率84.6%TiO2+2C+2Cl2=TiCl4+2CO1年前查看全部
- 我想用二氧化锰和碳粉制取金属锰用酒精灯的火焰可以使温度达到反应温度吗?还有实验中要注意什么..
 海天凌风1年前1
海天凌风1年前1 -
 Black咖啡 共回答了13个问题
Black咖啡 共回答了13个问题 |采纳率92.3%达不到,你没有相关的分离装置,反应出来的锰在高温有氧状态下迅速被氧化,而且比你还原需要的条件简单多了1年前查看全部
- 将一定质量的铜粉和碳粉置于同一敞口容器中,加热使其充分反应测得反应前后容器内的固体质量不变,则放入容器中的铜粉和碳粉的质
将一定质量的铜粉和碳粉置于同一敞口容器中,加热使其充分反应测得反应前后容器内的固体质量不变,则放入容器中的铜粉和碳粉的质量比为
 风清清扬0071年前1
风清清扬0071年前1 -
 泥菩萨过河 共回答了12个问题
泥菩萨过河 共回答了12个问题 |采纳率91.7%计算题中无数据,合理数值随意取.
此题需要知道反应前容器内的固体是铜粉和碳粉,反应后容器内的固体是氧化铜,也就是说,铜变为氧化铜时结合了的氧元素的质量应该等于原来的碳粉质量,设原来有铜64克(随意取),那么它变为氧化铜时结合的氧是16克,那么原来的碳粉质量也就是16克,所以放入容器中的铜粉和碳粉的质量比为 64:16=4:11年前查看全部
- 怎样除尽黑色的二氧化锰粉末中混有的少量碳粉
怎样除尽黑色的二氧化锰粉末中混有的少量碳粉
请设计一个实验 dzs6911年前1
dzs6911年前1 -
 wg76 共回答了15个问题
wg76 共回答了15个问题 |采纳率93.3%高温加热,再通入CO2气体1年前查看全部
- 金红石,碳粉混合在高温条件下,通入氯气制得TiCl4和一种可燃性气体,此反应的化学式的方程式是什么?
 ghd877777777771年前1
ghd877777777771年前1 -
 林子8610 共回答了18个问题
林子8610 共回答了18个问题 |采纳率94.4%TiO2+2C+2Cl2==TiCl4+2CO
条件是高温1年前查看全部
- 下列物质能用作食品抗氧化剂的是A碳粉 B铁粉 C氯化钙 D生石灰 为什么呢?
 一人转1年前1
一人转1年前1 -
 e68642186 共回答了18个问题
e68642186 共回答了18个问题 |采纳率100%一般用铁粉.
碳粉没什么用
氯化钙、生石灰是干燥剂,但不是抗氧化剂
铁粉在常温下容易被氧气氧化,所以在用铁粉能有效吸收食品包装袋内的氧气,防止食物被氧化1年前查看全部
- 碳粉中混有少量的氯化铜该怎么提纯
碳粉中混有少量的氯化铜该怎么提纯
只能用的式剂 ①盐酸 ②水
只能用方法A冷却结晶 B过滤 C蒸发结晶 D分液
(各选一种)
 谷宝宝871年前1
谷宝宝871年前1 -
 baijinart 共回答了23个问题
baijinart 共回答了23个问题 |采纳率91.3%试剂:盐酸和水都行,因为盐酸和氯化铜,碳都没有反应,此处盐酸就当水用
方法:过滤.氯化铜溶于水,碳粉不溶1年前查看全部
- 如何除去杂质 碳粉中的少量氧化铜
 qblfxq1年前1
qblfxq1年前1 -
 龙巫 共回答了10个问题
龙巫 共回答了10个问题 |采纳率70%用稀盐酸洗,氧化铜溶于稀盐酸,碳不溶1年前查看全部
- 将碳酸氢铵在试管中加热,使放出的气体依次通过盛有足量灼热的碳粉、灼热的氧化铜粉末、浓硫酸的容器,最后得到的气体是()
将碳酸氢铵在试管中加热,使放出的气体依次通过盛有足量灼热的碳粉、灼热的氧化铜粉末、浓硫酸的容器,最后得到的气体是()
A 一氧化碳
B 二氧化碳
C 氨气
D 水
写明原因, 4154699281年前3
4154699281年前3 -
 阿神_ 共回答了21个问题
阿神_ 共回答了21个问题 |采纳率81%,
co是还原剂,会被氧化铜氧化为co2
NH3显碱性,与浓硫酸中和
浓硫酸是吸水剂,故不可能有水.1年前查看全部
- 氧化铜.硫粉.碳粉 加在一起加热会有什么反应?
氧化铜.硫粉.碳粉 加在一起加热会有什么反应?
硫粉和碳粉加热会发生反应吗? 爱SHAff1年前3
爱SHAff1年前3 -
 lpkegy 共回答了12个问题
lpkegy 共回答了12个问题 |采纳率91.7%C+2CuO=2Cu+CO2
这是一个还原反应,C和CO都可以做还原剂,把矿石里的金属元素还原出来.
硫粉在这里不会发生反应.1年前查看全部
- 区分铜粉和碳粉
 wxfyhopeworld1年前1
wxfyhopeworld1年前1 -
 zhcwh 共回答了20个问题
zhcwh 共回答了20个问题 |采纳率90%!看颜色,碳粉是黑的,铜是黄或红的
!同体积质量重的是铜
用火烧是化学方法,因为碳粉燃烧是化学变化,碳也能导电,所以测导电性也不行1年前查看全部
- 将足量的碳粉和氧化铜粉未混合均匀,取9g此固体加温加热,完全反应后冷却称量,剩余固体为6.8g.求:(1)原混合物中碳粉
将足量的碳粉和氧化铜粉未混合均匀,取9g此固体加温加热,完全反应后冷却称量,剩余固体为6.8g.求:(1)原混合物中碳粉和氧化铜粉末的质量比;(2)剩余固体的成分及质量;
 可爱的白白1年前3
可爱的白白1年前3 -
 tang_sz110 共回答了19个问题
tang_sz110 共回答了19个问题 |采纳率73.7%剩余固体质量减轻,减轻的生成的CO2 所以生成的CO2质量为9-6.8=2.2g
根据反应 C+2CuO=2Cu+CO2
12 160 44
2.2
按照CO2的生成量来求CuO的质量 8g, C的质量为0.6g ,那么应该生成6.4gCu ,而最终产物质量为6.8g 说明产物是混合物,有可能是铜和C,也可能是铜和CuO
分情况讨论,如果是Cu和C,那么C剩余6.8-6.4=0.4g 所以一共有C为0.6+0.4=1g
那么质量比就是1比8
如果是Cu和CuO的混合物,那么CuO剩余0.4g,共有CuO为0.4+8=8.4g C有0.6g,所以质量比为0.6比8.4=3:421年前查看全部
- 氧化铁与碳粉反应的化学方程式
 chimpanzee19791年前3
chimpanzee19791年前3 -
 cnel1ve 共回答了18个问题
cnel1ve 共回答了18个问题 |采纳率94.4%Fe2O3+3C=2Fe +3CO(不充分)
2Fe2O3+3C=4Fe+3CO2(充分)1年前查看全部
- 铜粉和碳粉的混合物在空气中充分灼烧后,最终得到的黑色物质与原混合物质量相等,则碳粉在原混合物中的质量分数为( ) 帮我将
铜粉和碳粉的混合物在空气中充分灼烧后,最终得到的黑色物质与原混合物质量相等,则碳粉在原混合物中的质量分数为( ) 帮我将清楚点 要十分清楚 求 .我化学很不好的
 kissingyou1231年前1
kissingyou1231年前1 -
 ddxywhz 共回答了21个问题
ddxywhz 共回答了21个问题 |采纳率100%由题意可知:氧化铜中氧元素的质量等于原混合物中炭粉的质量.(根据最终得到的黑色物质与原混合物质量相等)
因此原混合物中炭粉的质量分数就是氧化铜中氧元素的质量分数.
氧化铜中氧元素的质量分数为
16/80=20%
精确到每一步了 谢谢1年前查看全部
- 取一定量的碳粉和氧化铁粉的混合物高温共热恰好完全反应,求混合物含碳的质量分数.
 chwang2141年前1
chwang2141年前1 -
 ounalie 共回答了9个问题
ounalie 共回答了9个问题 |采纳率100%3C+2Fe2O3=4Fe+3CO2
(3*12)/[3*12+2*(56*2+16*3)] =10.1%1年前查看全部
- 用乙醇湿润的铁粉和碳粉 均匀混合 充有氧气 构成的原电池 应该是铁碳 还是乙醇和氧气
 无为师兄1年前3
无为师兄1年前3 -
 活着对gg去说 共回答了15个问题
活着对gg去说 共回答了15个问题 |采纳率93.3%这里有电解质溶液吗 乙醇可以导电吗 原电池的三要素可不能少呀 电极、电解质溶液和闭合回路 如果可以做原电池的话 本题应该是铁和氧气氧气吧 铁比较活泼 比较容易失去电子 氧气可以与溶液反应 乙醇的化学性质不活泼 只是回合一些活泼的金属反应的1年前查看全部
- 氧化铜和氧化锌谁的化学活性高?把氧化铜、氧化锌和碳粉混合,在高温下反应,是先生成铜还是先生成锌?因为是固态反应,有没有可
氧化铜和氧化锌谁的化学活性高?
把氧化铜、氧化锌和碳粉混合,在高温下反应,是先生成铜还是先生成锌?
因为是固态反应,有没有可能是锌先被还原,如果确定是铜先还原,有没有最直接的对这个问题的回答的出处。 shassb1年前7
shassb1年前7 -
 gity 共回答了18个问题
gity 共回答了18个问题 |采纳率77.8%锌单质比铜单质的还原性高,通俗一点也就是说锌和铜在一起,如果一个处于氧化态,一个处于还原态的话,那铜会处于还原态,这题中让你选择谁先处于还原态当然是铜啊,你想就算先生成一点点锌出来,锌也会被氧化铜氧化产生铜啊.
你可以记住:还原态锌比铜的还原性高,反过来氧化态铜的氧化性比锌高(这是普遍规律).1年前查看全部
- 怎样区别碳粉和二氧化锰
 qmj2531年前2
qmj2531年前2 -
 gogo770414 共回答了17个问题
gogo770414 共回答了17个问题 |采纳率70.6%分别加入等量过氧化氢溶液,有气泡生成的是 二氧化锰 ,没有的是碳 过氧化氢在二氧化锰的催化下会生成氧气1年前查看全部
- 有两包黑色粉末,分别为铁粉和碳粉,请你设计实验,用两种方法鉴别两种粉末完成下表:
 小妮子艾拉拉1年前0
小妮子艾拉拉1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将足量的碳粉和氧化铜粉末混合均匀,取9g此固体高温加热,充分反应后,冷却称量剩余固体为6.8g,求:原混合物中氧化铜的质
将足量的碳粉和氧化铜粉末混合均匀,取9g此固体高温加热,充分反应后,冷却称量剩余固体为6.8g,求:原混合物中氧化铜的质量(Cu的相对原子质量取64)
为啥我用CuO与Cu算出Cu为8.5g是错的?
为什么要用CO2与CuO算(这个才是重点)? fatxfat1年前1
fatxfat1年前1 -
 疼我包容我 共回答了26个问题
疼我包容我 共回答了26个问题 |采纳率92.3%C + 2CuO = CO2 + Cu
m(CO2)=9-6.8=2.2g
接下来不用讲了吧
由于不知道CuO Cu(剩余固体可能有杂质)的质量,因而不能直接用6.8g来算1年前查看全部
- 同问 将铁粉 碳粉 和少量氯化钠加入一定量的硫酸铜溶液中,充分反映后过滤,滤液中的溶质一定有---
 跳舞的琴键1年前1
跳舞的琴键1年前1 -
 ww3r 共回答了16个问题
ww3r 共回答了16个问题 |采纳率75%氯化钠、硫酸亚铁一定有.
只有一个反应 Fe+CuSO4==FeSO4+Cu
一定生成FeSO4,不知道CuSO4剩没剩,碳不溶,所以溶液一定有氯化钠、硫酸亚铁1年前查看全部
- 7g碳粉与14g氧气在一定条件下完全反应生成21g氧化物,则生成物中CO与CO2的物质的量比
7g碳粉与14g氧气在一定条件下完全反应生成21g氧化物,则生成物中CO与CO2的物质的量比
设CO与CO2的物质的量分别为x和y,其中碳都来自碳单质,x+y=7/12,氧来自氧气:x+2y=14/16,这样可以解出来,如果设CO为2x,co2为y,就无解了为什么 这不是化学方程式的比设的么
2C+O2=2CO C+O2=CO2 ddsddc1年前1
ddsddc1年前1 -
 新鱼夫 共回答了20个问题
新鱼夫 共回答了20个问题 |采纳率95%如果你设CO为2x,那么方程就变成2x+y=7/12, 2x+2y=14/16 一样可以解出来1年前查看全部
- 1.一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比是?(4:
1.一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比是?(4:1)
2.9gCaCO3和MgCO3组成混合物,与足量的盐酸反应,生成二氧化碳的质量可能是?
(4g或4.5g) wangmaomao801年前1
wangmaomao801年前1 -
 s89133765 共回答了18个问题
s89133765 共回答了18个问题 |采纳率88.9%1.开始是Cu,C
灼烧了以后变成了Cu
因为质量相同,所以原来C的质量就是后来的O的质量
即Cu:C=Cu:O=64:16=4:1
2.用极限法,设全部是CaCO3
CaCO3--CO2
100 44
9g x
解得x=3.96g
全部是MgCO3
MgCO3--CO2
84 44
9g y
解得y=4.71g
所以质量的范围是3.96-4.71g
你举出来的答案在这个范围之内,但是不全面1年前查看全部
- 将一定量的氧化铜和碳粉混合后,置于一密封容器中,隔绝空气加强热,充分反应后冷却,打开容器,若剩余固体除了红色铜外,还有黑
将一定量的氧化铜和碳粉混合后,置于一密封容器中,隔绝空气加强热,充分反应后冷却,打开容器,若剩余固体除了红色铜外,还有黑色粉末.怎样确定黑色粉末的成分?写出有关反应的化学方程式.若剩余固体全部是红色铜粉,则反应中的生成物有哪些?
 jdw08081年前1
jdw08081年前1 -
 zhuliangjian 共回答了13个问题
zhuliangjian 共回答了13个问题 |采纳率100%往黑色粉末里加酸,如果无色溶液变成蓝色,说明有氧化铜CuO+H2SO4=CuSO4+H2O;将黑色的粉末灼烧,如果能生成使澄清石灰水变浑浊的气体,说明有碳,C+O2=CO2
如果全部是铜粉,则生成物有铜、二氧化碳或者一氧化碳1年前查看全部
- 一定量的碳粉与氧气组成的混合物在一定条件下可完全反应,生成体积相等的一氧化碳和二氧化碳,求原混合物中碳粉与氧气的质量比.
 oerfi1年前1
oerfi1年前1 -
 日出水落 共回答了22个问题
日出水落 共回答了22个问题 |采纳率95.5%解题思路:根据体积相等即分个数相等,结合反应的化学方程式可以根据质量比来计算解答;根据反应的化学方程式:C+O2
点燃
.
CO2,2C+O2
点燃
.
2CO,
生成体积相等的一氧化碳和二氧化碳的方程式如下:2C+2O2
点燃
.
2CO2,2C+O2
点燃
.
2CO,
24 6424 32
故生成体积相等的一氧化碳和二氧化碳,原混合物中碳粉与氧气的质量比:(24+24):(64+32)=1:2
答:一定量的碳粉与氧气组成的混合物在一定条件下可完全反应,生成体积相等的一氧化碳和二氧化碳,原混合物中碳粉与氧气的质量比是1:2.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据体积相等即分个数相等,结合反应的化学方程式可以根据质量比来计算解答.1年前查看全部
- 除去二氧化锰中碳粉 可用什么方法?
 乒铃乓啷器1年前1
乒铃乓啷器1年前1 -
 回忆白色 共回答了15个问题
回忆白色 共回答了15个问题 |采纳率66.7%放在空气中灼烧,碳粉变为CO2散去1年前查看全部
- 如何从二氧化锰和碳粉中提前二氧化锰
 安静的石头1年前4
安静的石头1年前4 -
 绮罗火 共回答了12个问题
绮罗火 共回答了12个问题 |采纳率100%在空气中灼烧,最后剩下的就是MnO21年前查看全部
- 一定质量的氧化铜与碳粉混合高温后的产物有哪些
一定质量的氧化铜与碳粉混合高温后的产物有哪些
一定质量的氧化铜与碳粉混合高温后将产物通入稀硫酸,得到蓝色溶液和黑色固体A,将A高温后得到二氧化碳和黑色固体B,将B通入稀硫酸后得到黑色固体C,请问A,B,C三种物质是什么?
请帮忙看看,感激不尽! guhe23231年前1
guhe23231年前1 -
 ro1900 共回答了18个问题
ro1900 共回答了18个问题 |采纳率88.9%A:CU,CUO,C;
B:同A;
C:C.1年前查看全部
- 怎样从碳粉和铜粉的混合物中除去碳粉 .
 c123c1年前1
c123c1年前1 -
 羽儿菲菲 共回答了17个问题
羽儿菲菲 共回答了17个问题 |采纳率82.4%点燃,剩下的加热,通氢气1年前查看全部
- 除去氧化铜中的碳粉,在氧气流中加热混合物,发生了什么反应
除去氧化铜中的碳粉,在氧气流中加热混合物,发生了什么反应
碳直接被氧化,还是氧化铜被还原后再被氧化 海来阿衣思不模1年前2
海来阿衣思不模1年前2 -
 若存 共回答了15个问题
若存 共回答了15个问题 |采纳率73.3%.哥哥,碳很稳定的.怎么这么容易就被氧化了.是氧化铜被还原在被氧气氧化1年前查看全部
- 要除去碳粉中的氧化铜加适量盐酸搅拌过滤可以吗?如不行怎么半
 chen51chen1年前3
chen51chen1年前3 -
 jh8779 共回答了17个问题
jh8779 共回答了17个问题 |采纳率88.2%可以.
C不与盐酸反应,CuO+2HCl=CuCl2+H2O反应生成的CuCl2溶于水,过滤即可.1年前查看全部
- 2012年3月,英国科学家研发出“激光橡皮”,专门用来去除白纸上的黑色碳粉字迹.激光照射下,纸张上的黑色碳粉直接____
2012年3月,英国科学家研发出“激光橡皮”,专门用来去除白纸上的黑色碳粉字迹.激光照射下,纸张上的黑色碳粉直接______(填物态变化名称)为高温碳蒸气,同时字迹消失,这说明光具有______.
 糖丫1年前1
糖丫1年前1 -
 海南旅游互联网 共回答了13个问题
海南旅游互联网 共回答了13个问题 |采纳率92.3%解(1)激光照射下,纸张上的黑色碳粉直接变为高温碳蒸气,即物质由固态直接变为气态,也就是发生了升华现象;
(2)激光照射下,纸张上的黑色碳粉温度升高,内能增大;碳粉的内能是由光能转化而来的;
故答案为:升华;能量.1年前查看全部
- 一位同学在实验室用打点计时器研究物体作自由落体运动的实验,有下列器材可供选择:铁架台、重锤、电火花打点计时器及碳粉、纸带
一位同学在实验室用打点计时器研究物体作自由落体运动的实验,有下列器材可供选择:铁架台、重锤、电火花打点计时器及碳粉、纸带若干、220V交流电源、天平、秒表.
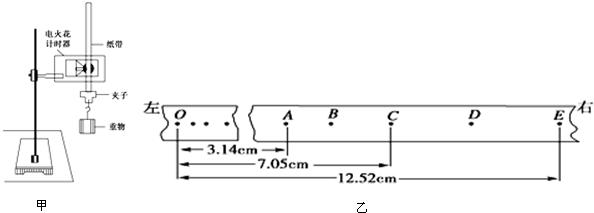
(1)其中不必要的两种器材是:______,缺少的一种器材是______.
(2)某同学用如图甲所示装置测定重力加速度(已知打点频率为50Hz),对该实验装置及其操作的要求,下列正确的是______
A.打点计时器的两个限位孔应在同一竖直线上
B.重物最好选用密度较小的材料,如泡沫塑料
C.开始时应使重物靠近打点计时器处并保持静止
D.操作时,应先放开纸带后接通电源
(3)(图乙)已知纸带上记录的点为打点计时器打的点,打点计时器在打C点时物体的瞬时速度大小为______m/s,所测得的重力加速度大小为______m/s2.(此小题两空结果均保留3位有效数字) 木慧慧1年前1
木慧慧1年前1 -
 猪小 共回答了21个问题
猪小 共回答了21个问题 |采纳率76.2%解题思路:(1)从实验目的、实验原理角度出发得到待测量,确定实验器材;
(2)根据匀变速直线运动中,平均速度等于中间时刻的瞬时速度求解B点速度;
(3)根据推论式△x=aT2求解重力加速度.(1)实验要测量重力加速度,根据公式△x=aT2,需要刻度尺测量位移,不需要测量时间和质量,所以不需要天平和秒表;
(2)A、安装打点计时器时要注意让上下限位孔在同一竖直线上,故A正确;
B.应选择密度大、体积小的重物,有利于减小空气阻力的影响,如小钢球,故B错误;
C.释放纸带时让重物靠近打点计时器,能在纸带上打出更多的点,故C正确;
D.应先接通电源后释放纸带,能在纸带上得到更多的点,有利于数据处理减小误差.故D错误;
故选:AC.
(3)匀变速直线运动中,平均速度等于中间时刻的瞬时速度,故B点速度等于AC段平均速度,故
vC=
xAE
2T=
0.1252−0.0314
0.2=1.17m/s,
根据公式△x=gT2得:g=
0.1252−0.0705−(0.0705−0.0314)
0.042=9.75m/s2.
故答案为:
(1)天平和秒表;刻度尺;(2)AC;(3)1.17;9.75点评:
本题考点: 测定匀变速直线运动的加速度.
考点点评: 本题关键是明确实验原理,会结合运动学公式求解加速度和瞬时速度,不难.1年前查看全部
大家在问
- 1生活中光沿直线传播的例子
- 2如图,△ABC的外角∠ACD的平分线CP与内角∠ABC的平分线BP交于点P,若∠BPC=40°,求∠CAP的大小.
- 3她从一个()的小姑娘,一个()的女学者,变成科学教科书里的新名词“放射线”,变成物理学的一个新的计
- 4有几题六年数学判断题长方形 正方行和平行四边形都是两组对边分别平行的四边形 长方形和正方形都是平行四边形 圆的所有直径都
- 5我要写篇作文,以执着为话题
- 6在墙面上用英语怎么说
- 7那种人造卫星能观测到地球的表面,及地层的物理变化?
- 8以“班级荣誉”做一篇小小的演讲.
- 9F是初中化学常见的物质.已知A为黑色固体单质,C为气态氧化物,F为紫红色固体单质,它们的转化如图.
- 10造句:如果说,春天是一朵含苞待放的花,包含着对生命的向往,那么,夏天是 ,着 ;秋天是 ,着 ;冬天是 ,着 .
- 11初中一用上奥数班吗,平常的数学考试中会有附加题和提高题吗
- 12春 朱自清作者用了什么感觉器官感受春天
- 13黑洞是由暗物质组成的吗?
- 14英语we shall have a food festival on the playground.对on the pl
- 15“你受够了,你很生气!”这句话包含了作者怎样的思想感情?
