冶炼厂运来100块长方体钢锭,钢锭长80cm,宽60cm,高40cm,如果用这些钢锭来拉直径是1cm的钢筋,
 一天到晚加班的鱼2022-10-04 11:39:543条回答
一天到晚加班的鱼2022-10-04 11:39:543条回答能拉出钢筋多少米?

已提交,审核后显示!提交回复
共3条回复
 懒多了 共回答了25个问题
懒多了 共回答了25个问题 |采纳率92%- 钢锭体积:
80×60×40×100
=192000×100
=19200000(立方厘米)
钢筋底面积:
3.14×(1÷2)²=0.785(平方厘米)
钢筋长:
19200000÷0.785≈24458598(厘米)=244585.98(米) - 1年前
 眉毛鱼 共回答了371个问题
眉毛鱼 共回答了371个问题 |采纳率- 理论计算——无损耗时
因 Vo=abh=80cm×60cm×40cm=192000cm^3
则 V钢=nVo=100×192000cm^3=1.92×10^7cm^3
又 V线=S线L
因 r=d/2=……=0.5 cm
则 S线=π r^2=……=0.785cm^2
又 V线=V钢
故 L=V钢/... - 1年前
 方便又好用 共回答了6个问题
方便又好用 共回答了6个问题 |采纳率- 80*60*40*100=19200000cm^3=19.2 m^3
19.2/1/π≈6 - 1年前
相关推荐
- 某金属冶炼厂用铝土矿(杂质不溶于水,也不与酸反应)炼铝,欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
 某金属冶炼厂用铝土矿(杂质不溶于水,也不与酸反应)炼铝,欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
某金属冶炼厂用铝土矿(杂质不溶于水,也不与酸反应)炼铝,欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
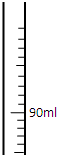
(1)若用密度为1.25g/ml 80%的浓硫酸,配置500g19.6%的稀硫酸,在量筒中画出量取浓硫酸的体积数的图形.
(2)将铝土矿碾碎,用稀硫酸溶解,写出发生反应的化学方程式______.
(3)将17g铝土矿与150g上述稀硫酸恰好完全反应,则
①求解氧化铝质量(x)的比例式[102/294=
=x 150g×19.6%] [102/294x 150g×19.6%].
②向反应后所得溶液中加入39.8g水,则最终溶液中溶质质量分数为______.
③该铝土矿中氧化铝的质量分数为______.
(4)若哈尔滨市地铁工程需要铝合金108吨(含铝95%),在炼铝过程中损失5%,则需要这种铝土矿的质量是______吨.赞
风清扬99 幼苗
共回答了22个问题采纳率:95.5% 举报
解题思路:(1)稀释前后溶质的质量不变.(2)金属氧化物与酸反应生成盐和水.(3)根据化学方程式的计算步骤进行解题.(1)稀释前后溶质的质量不变,设需浓硫酸的质量为x
500g×19.6%═x×80% x=122.5g
浓硫酸的体积为:122.5g÷1.25g/ml═98ml
故答案为:98ml
(2)氧化铝与硫酸酸反应生成硫酸铝和水;故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O
(3)①设氧化铝质量为x,生成Al2(SO4)3质量为y
Al2O3 +3H2SO4═Al2(SO4)3+3H2O
102 294342
x150g×19.6%y
[102/294=
x
150g×19.6%] [294/150g×19.6%=
342
y]
x═10.2g y=34.2g
②反应后所得溶液中加入39.8g水,则最终溶液中溶质质量分数为:[34.2g/150g+10.2g+39.8g×100%=17.1%
③该铝土矿中氧化铝的质量分数为:
10.2g
17g×100%=60%
(4)设氧化铝质量为z
z×
54
102]=108t×95%÷(1-5%)
z=204t
需要这种铝土矿的质量为:204t÷60%=340t点评:
本题考点: 根据化学反应方程式的计算;一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算;酸的化学性质.
考点点评: 本题牵扯了化学中的多种化学计算,综合性很强,计算难度很大,不适合基础知识的练习.1年前
2可能相似的问题你能帮帮他们吗
-
有一个三位数,它的个位数字是3,如果把3移到百位,其余两位依次改变,所得的新数与原数相差17l.求原来的三位数.
1年前
-
Jane has been in Shanghai for one month .She plans to stay f
1年前
-
1、一个三位数,三个数位上的数字之和是17,百位上的数字比十位上的数字打7,个位上的数字是十位上的数字的3倍,求这个三位
1年前
-
(2007•宝山区二模)在如图所示的电路中,电阻Rl、R2是______联的(选填:“串”或“并”),若电源电压保持不变
1年前
-
某公式中引用了一组单元格:(C3:D7,A2,F1 ),该公式引用的单元格总数为?具体怎么算?
1年前
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.032 s. - webmaster@yulucn.com 大伙一起上啊1年前1
大伙一起上啊1年前1 -
 风清扬99 共回答了22个问题
风清扬99 共回答了22个问题 |采纳率95.5%解题思路:(1)稀释前后溶质的质量不变.(2)金属氧化物与酸反应生成盐和水.(3)根据化学方程式的计算步骤进行解题.(1)稀释前后溶质的质量不变,设需浓硫酸的质量为x
500g×19.6%═x×80% x=122.5g
浓硫酸的体积为:122.5g÷1.25g/ml═98ml
故答案为:98ml
(2)氧化铝与硫酸酸反应生成硫酸铝和水;故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O
(3)①设氧化铝质量为x,生成Al2(SO4)3质量为y
Al2O3 +3H2SO4═Al2(SO4)3+3H2O
102 294342
x150g×19.6%y
[102/294=
x
150g×19.6%] [294/150g×19.6%=
342
y]
x═10.2g y=34.2g
②反应后所得溶液中加入39.8g水,则最终溶液中溶质质量分数为:[34.2g/150g+10.2g+39.8g×100%=17.1%
③该铝土矿中氧化铝的质量分数为:
10.2g
17g×100%=60%
(4)设氧化铝质量为z
z×
54
102]=108t×95%÷(1-5%)
z=204t
需要这种铝土矿的质量为:204t÷60%=340t点评:
本题考点: 根据化学反应方程式的计算;一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算;酸的化学性质.
考点点评: 本题牵扯了化学中的多种化学计算,综合性很强,计算难度很大,不适合基础知识的练习.1年前查看全部
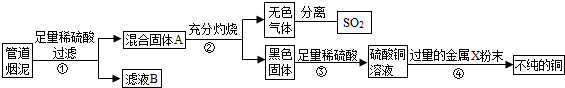
- (2013•江宁区二模)某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金
(2013•江宁区二模)某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示:
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是______;如何确定硫酸已经过量______.
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是______,有关反应的化学方程式______.
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有______(填标号).
a.磁铁b.稀盐酸c.蒸馏水d.氯化铜溶液.
(4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下:
试写出反应器、膜反应器中的化学反应方程式______、2HI
H2+I2500℃ .2HI.
H2+I2500℃ . 夜归之人1年前1
夜归之人1年前1 -
 加班不加班 共回答了19个问题
加班不加班 共回答了19个问题 |采纳率89.5%解题思路:(1)依据过滤中玻璃棒的引流作用分析判断,依据硫酸过量时滤液中会含有硫酸,再根据金属与酸反应生成氢气进行分析判断;(2)依据金属活动性顺序结合金属X具有广泛用途分析该金属是铁,并得到相关的方程式;(3)依据铁铜的性质对两者进行分离即可;(4)根据化学方程式的书写方法考虑本题.(1)在过滤操作中玻璃棒起到引流的作用,以防止液体飞溅,由于锌的活动性在氢前,铜的活动性在氢后,所以铜锌混合物与稀硫酸反应时,铜不能参与反应,碳也不能反应,而锌与稀硫酸反应会生成硫酸锌,所以过滤时滤液是硫酸锌,固体A是铜与炭黑的混合物,如果加入的硫酸过量时,滤液中会含有硫酸,所以取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量;
(2)经过步骤②碳加热生成二氧化碳,铜加热生成氧化铜,氧化铜经步骤③转化成硫酸铜的溶液,硫酸铜加过量的x铜说明x的活动性比铜强,由条件金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途知X是金属铁,反应是铁与硫酸铜发生置换反应,反应物是铁与硫酸铜写在等号的左边,生成物是铜和硫酸亚铁,写在等号的右边,所以方程式为:CuSO4+Fe═Cu+FeSO4;
(3)经过以上过程所得的不纯的铜是铜与未反应的铁粉,用磁铁吸引铁,不能吸引铜,所以能分离,铁和氯化铜反应生成铜和氯化亚铁,铜与氯化铜不反应,所以也能分离,加稀盐酸时铜不能反应而铁能,因此能分离两者,而采用蒸馏水不能分离两者;
(4)反应器中的反应物是水、二氧化硫、碘,生成物是硫酸和碘化氢,根据观察法配平即可,所以方程式是:SO2+2H2O+I2═H2SO4+2HI;膜反应器中的反应物是碘化氢生成物是碘和氢气,用观察法配平即可,所以方程式是:2HI
500℃
.
H2+I2.
故答案为:(1)引流;取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量;(2)Fe;CuSO4+Fe═Cu+FeSO4;(3)a、b、d;(4)SO2+2H2O+I2═H2SO4+2HI;2HI
500℃
.
H2+I2点评:
本题考点: 物质的相互转化和制备.
考点点评: 此题是一道常规的资源回收题,解题的方法是对设计方案所涉及的化学反应要能明确,并进而对反应物生成物作出判断,此题属基础性回收实验题.1年前查看全部
- 一道化学计算小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数
一道化学计算
小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%.
现炼铁厂利用该赤铁矿石5000t,理论上可炼出含铁
98%的生铁的质量是多少(保留整数). mynayam1年前1
mynayam1年前1 -
 woer 共回答了18个问题
woer 共回答了18个问题 |采纳率94.4%Fe2O3+3CO=高温=2Fe+3CO2
160 112
5000t*80% x*98%
160/4000t=112/0.98x
x=2857t1年前查看全部
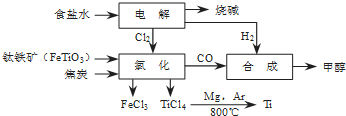
- (2013•北京模拟)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),既提高了资源利用率,又减少了
(2013•北京模拟)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),既提高了资源利用率,又减少了环境污染.

请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:______.
(2)由CO和H2合成甲醇的方程式为CO(g)+2H2(g)⇌CH3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将______(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2t甲醇,至少需额外补充H2______t.
(3)用甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图2所示),在接通电路一段时间后纯Cu质量增加3.2g.
①请写出燃料电池中的负极反应式:______.
②燃料电池正极消耗空气的体积是______(标准状况,空气中O2体积分数以20%计算). penny19711年前1
penny19711年前1 -
 huq19 共回答了21个问题
huq19 共回答了21个问题 |采纳率85.7%解题思路:(1)分析流程可知,钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳;依据原子守恒配平写出;
(2)①依据浓度商和平衡常数比较分析判断反应进行的方向;
②根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)⇌CH3OH(g)以及2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO和2NaCl+2H2O通电 .
2NaOH+H2↑+Cl2↑得到相应关系式来计算;通电 .
(3)①根据负极反应=总反应-正极反应来回答;
②根据电路中的电子守恒来计算回答.(1)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
通电
.
2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(2)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=
c(CH3OH)
c(CO)c(H2)=
2mol
2L
2mol
2L×(
3mol
2L)2=0.44>0.27,即Qc>K,所以此时反应将向逆反应方向进行,
故答案为:向逆反应方向进行;
②由方程式CO(g)+2H2(g)⇌CH3OH(g)、2FeTiO3+6C+7Cl2
通电
.
2FeCl3+2TiCl4+6CO、2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气,故答案为:1.0;
(3)甲醇-空气碱性(KOH)燃料电池的总反应为:3O2+2CH3OH+4OH-=2CO32-+6H2O,正极反应式为:3O2+12e-+6H2O=12OH-,负极反应=总反应-正极反应,即为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成3.2g纯铜,至少转移电子0.1mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.1mol,消耗氧气0.025mol,折合成空气为0.125mol,在标准状况下的体积为2.8,故答案为:2.8 L.点评:
本题考点: 化学平衡的计算;化学方程式的有关计算;化学电源新型电池.
考点点评: 本题是一道有关电解原理的应用知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风
如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风.回答下列问题.
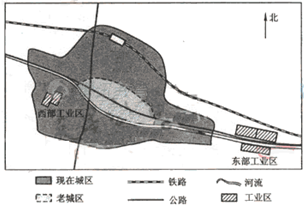
(1)判断东部工业区的选址是否合理,并说明理由.
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大.为什么? 盐城监1年前1
盐城监1年前1 -
 lightgreen 共回答了18个问题
lightgreen 共回答了18个问题 |采纳率88.9%解题思路:(1)工业区的布局要充分考虑企业对地理环境产生影响(大气污染、水污染、固体废弃物污染、噪音污染等方面)及交通通达度.(2)工业区的搬迁问题还是工业布局问题,因而考虑的重点还是这些工厂在该地可能造成的污染状况.(1)因为该工业区(三个工厂)分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.故是合理的.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区.
故答案为:
(1)合理.分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区点评:
本题考点: 工业生产活动对地理环境的影响.
考点点评: 本题难度适中.在平时的学习和生活中,要求学生关注企业的布局是否合理,结合地理学科强调大气污染、水污染和固体废弃物工业的布局原则.1年前查看全部
- 铅是一种重金属,相对原子质量为207°铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都
铅是一种重金属,相对原子质量为207°铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都是主要的铅污染源。铅一旦进入人体会累积,对人脑、肾脏和造血功能有损害。为了了解环境中的铅污染问题,小红等同学进行了如下的研究。
(1)小红查阅到下图资料,图中记录了离某公路不同距离处种植的卷心菜中铅的含量。
由图推测:卷心菜内里叶片的铅可能直接来于__________,造成卷心菜外围叶片含铅量不同的重要原因___________。
(2)在阅读资料时,小红又发现,儿童从空气中吸入的铅量是成人吸入量的1.6~ 1.7倍。为了探讨这个现象,她展开了如下的研究。利用所学知识完成以下填空。
①课题名称为:_____________
②通过取样分析,得到了以下实验数据:
分析以上实验数据,可以得出的结果是__________,造成此结果的原因可能是___________。
(3)在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,她设计了如下实验步骤:
①步骤中过滤需要的玻璃仪器是______、______和玻璃棒。
②步骤中a操作称为_______,缺少此操作,测得结果______ (填“偏离”“偏低”或“无影响”)。
(4)通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的是____。
A.使用无铅汽油
B.开发新的无铅燃料
C.倡导使用铅蓄电池作动力的电动车
D.燃煤电厂、金属冶炼厂的废气经除尘后排放 心痛依旧1年前1
心痛依旧1年前1 -
 helenyu1980 共回答了12个问题
helenyu1980 共回答了12个问题 |采纳率91.7%(1)土壤(根系吸收);汽车尾气含铅,离公路距离不同,空气中含铅量不同
(2)①近地面不同高度空气含铅量的研究;②离地面越低(高),含铅量越高(低);铅和铅化合物密度大
(3)①烧杯 ;漏斗
②烘干 ;偏高
(4)C1年前查看全部
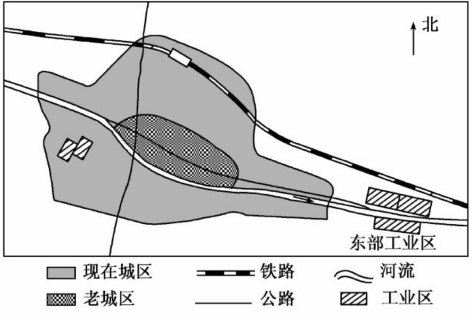
- 图19为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等, 西部工业区包括焦化厂、水泥厂等,该地盛行
图19为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等, 西部工业区包括焦化厂、水泥厂等,该地盛行南风。读图回答下列问题。(8分)
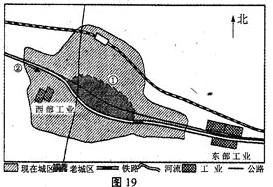
(1)如果要在该地建自来水厂,宜建在____(填①或②)处,理由是 。
(2)判断东部工业区的选址是否合理,并说明理由。
。
(3) 20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大。为什么?
。 糖糖风1年前1
糖糖风1年前1 -
 cece8701 共回答了21个问题
cece8701 共回答了21个问题 |采纳率95.2%(1)② 位于河流上游,水质清洁
(2)合理。因为该工业区(三个工厂)分布在与盛行风向垂直的郊外,废气对城市污染小;位于流经河流下游,不会对城市用水产生污染;位于主要交通线沿线,交通运输方便
(3)两厂都属于大气污染较重的工厂,位于与盛行风向垂直的老城区郊外,但现在已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区
本题考查工业的合理布局。
(1)自来水厂应布局于河流上游,水质好。
(2)影响工业区的布局主要从风向、河流的流向等对环境的影响,及交通线等方面分析。
(3)两工厂都是环境污染严重企业,原来布局于城市的边缘,对城市的环境污染小,合理,但由于城市规模的扩大,使该工业区位于城区,对城市的环境污染严重,故需要搬迁。1年前查看全部
- 某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为1
某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为160cm,80cm和40cm,求原来正方体钢锭的棱长为多少?
 ltxin1年前1
ltxin1年前1 -
 _桃之11 共回答了19个问题
_桃之11 共回答了19个问题 |采纳率94.7%解题思路:根据题意列出算式,计算即可得到结果.根据题意得:
3160×80×40÷27
=
3
512000
27
=[80/3](cm),
则原来正方体钢锭的棱长为[80/3]cm.点评:
本题考点: 立方根.
考点点评: 此题考查了立方根,熟练掌握立方根的定义是解本题的关键.1年前查看全部
- 某金属冶炼厂用铝土矿(除含氧化铝外,其余成分不溶于水也不与酸反应)冶炼金属铝,欲测定铝土矿中氧化铝的质量分数,请回答下列
 某金属冶炼厂用铝土矿(除含氧化铝外,其余成分不溶于水也不与酸反应)冶炼金属铝,欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
某金属冶炼厂用铝土矿(除含氧化铝外,其余成分不溶于水也不与酸反应)冶炼金属铝,欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
(1)将铝土矿粉碎,用稀硫酸溶解的化学方程式是______;
(2)若17g的铝土矿粉恰好与l5Og的19.6%的稀硫酸完全反应.求解17g该铝土矿中氧化铝质量(x)的比例式为[102/294]=[x/29.4g][102/294]=[x/29.4g];
(3)此铝土矿中氧化铝的质量分数为______;
(4)向反应后所得溶液中加入39.8g水,则最终所得不饱和溶液中溶质的质量分数是______;
(5)现有8.5t该铝土矿石,能够冶炼出含镁40%的铝镁合金(无其它成分)的质量为:______
(6)欲用98%的浓硫酸配制160g上述实验所用的稀硫酸,请在量筒中画出量取水的体积数的图形(水的密度为1.0g/cm3) 流浪鼠WJ1年前1
流浪鼠WJ1年前1 -
 铠子 共回答了27个问题
铠子 共回答了27个问题 |采纳率85.2%解题思路:(1)金属氧化物与酸反应生成盐和水,据此写出化学方程式;
(2)根据化学方程式的计算步骤进行解题;
(3)根据铝土矿中氧化铝的质量分数=[氧化铝的质量/铝土矿的质量]×100%进行解答;
(4)根据参加反应的硫酸计算生成的硫酸铝的质量,并据溶质的质量分数进行解答;
(5)根据元素质量守恒进行计算;
(6)依据稀释前后溶质的质量不变计算需要加入水的质量,并换算为体积.:(1)氧化铝与硫酸反应生成硫酸铝和水;故化学方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O;(2)17g的铝土矿粉恰好与l5Og的19.6%的稀硫酸完全反应,参加反应的稀硫酸中硫酸的质量为:150g×19.6%=29.4g;设氧化铝...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题牵扯了化学中的多种化学计算,综合性较强,计算难度大,作图时要注意读数与凹液面的最低处保持水平.1年前查看全部
- (2013•闸北区二模)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.
 (2013•闸北区二模)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示(锌在空气中加热会生成氧化锌,氧化锌能和稀硫酸反应生成硫酸锌和水):
(2013•闸北区二模)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示(锌在空气中加热会生成氧化锌,氧化锌能和稀硫酸反应生成硫酸锌和水):
①产生废气A的化学反应方程式是S+O2
SO2点燃 .S+O2;
SO2点燃 .
②溶液D中含有的溶质是______,甲是______,气体C是______;
③有人认为若步骤①中空气不足量,会导致锌的回收率降低,你认为是否正确?______
(填“正确”或“不正确”),理由是______. qswbs1年前1
qswbs1年前1 -
 michaelwhcn 共回答了14个问题
michaelwhcn 共回答了14个问题 |采纳率92.9%解题思路:(1)因为烟泥中含有硫的单质,故加热后会生成有毒气体二氧化硫.
(2)由于固体B中含有氧化锌与氧化铜,所以和硫酸反应会生成硫酸铜及硫酸锌两种新的溶质.
(3)通过生成物的分析可以看出甲是锌反应时会置换出铜,并消耗溶液中的剩余硫酸.
(4)空气量不足不会影响锌的回收,因为不管锌在第一步中是否被氧化,在第二步中都会完全转化为硫酸锌,不会影响锌的回收.①烟泥中存在单质硫,在空气中加热时会产生二氧化硫,二氧化硫是常见的空气污染物,化学方程式为S+O2
点燃
.
SO2
②固体B中含有氧化锌与氧化铜,两者均能和硫酸反应,生成硫酸铜及硫酸锌两种新的溶质,由于反应中硫酸过量所以溶液中还存在剩余的硫酸.故溶液D中含有的溶质有,加入甲物质后生成硫酸锌、铜,因此加入的甲物质为锌,锌与硫酸铜反应生成硫酸锌和铜,和硫酸反应生成氢气,故甲为锌,气体C为氢气.
③由分离过程可以看出,不管锌在第一步中是否被完全氧化,在第二步中都会完全转化为硫酸锌,也就是最终锌完全转化为硫酸锌,因而不会影响锌的回收.
故答案为:①S+O2
点燃
.
SO2;
②硫酸、硫酸铜、硫酸锌,锌,氢气;
③不正确;由于稀硫酸过量,Zn和ZnO都能转化为ZnSO4,不影响锌的回收率.点评:
本题考点: 物质的相互转化和制备.
考点点评: 此题是对物质分离与提纯的知识的考查,解决的重点是对每一步具体的反应做出详细的分析与判断,属基础性知识考查题.1年前查看全部
- 石英石的主要用途是什么?冶炼厂用什么样的石英石?
 痛苦的欢乐1年前3
痛苦的欢乐1年前3 -
 猴子I吃鱼 共回答了13个问题
猴子I吃鱼 共回答了13个问题 |采纳率76.9%石英砂是重要的工业矿物原料,广泛用于玻璃、铸造、陶瓷及耐火材料、冶金、建筑、化工、塑料、橡胶、磨料等工业.1年前查看全部
- 某冶炼厂日产含碳3%的生铁300t,该厂每天至少需要含氧化铁80%的赤铁矿多少吨?(保留一位小数).
 pjxektp1年前2
pjxektp1年前2 -
 半壶酒1 共回答了22个问题
半壶酒1 共回答了22个问题 |采纳率77.3%纯净的铁的质量为300t*(1-3%)=291t
.解.设要纯净的氧化铁质量为x
fe2o3+3co===2fe+3co2
160 112
x 291t
160/X=112/291t
x=160*291t/112
x=415.7t
则需要含氧化铁80%的赤铁矿质量为415.7t/80%=519.6t
答:该厂每天至少需要含氧化铁80%的赤铁矿519.6t1年前查看全部
- 小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数
小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数
(1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%.现炼铁厂利用该赤铁矿石5000t,理论上可炼出含铁98%的生铁的质量是多少(保留整数).
(2)在利用上图装置进行实验时,小强得到如下两组数据(杂质不参加反应)
反应前 反应后
A组 玻璃管和赤铁矿石样品的质量m1g 玻璃管和固体物质的质量m2g
B组 烧杯和澄清石灰水的质量m3g 烧杯和烧杯中物质的质量m4g
你认为他应该选用了_____(填“A”或“B”)组数据来计算赤铁矿石中氧化铁的质量分数;结合装置图回答他不选用另一组数据计算的原因
问题的关键在于第二小题,用A组的数据怎么计算赤铁矿石中氧化铁的质量分数 我知道B组的m4不准确,但是用A组怎么计算呢
求指教! 浪子寻情1年前1
浪子寻情1年前1 -
 abcd_hrs 共回答了14个问题
abcd_hrs 共回答了14个问题 |采纳率92.9%3CO+ Fe2O3 =高温= 2Fe + 3CO2 固体质量减少
160 112 160-112=48
x m1-m2
x=10*(m1-m2)/31年前查看全部
- 某钢铁冶炼厂进一批铁矿石Fe2O3为测定矿石中FeO3的质量分数
某钢铁冶炼厂进一批铁矿石Fe2O3为测定矿石中FeO3的质量分数
取20克 恰好与219克质量分数为10%的盐酸反应(出Fe03外 盐酸不与他成分反应) 求 1盐酸的溶质的质量是多少? 2 样品中Fe203的质量是多少? 3 这批矿石中fe203质量分数是多少? 报务员训练连1年前1
报务员训练连1年前1 -
 肥肠米线 共回答了13个问题
肥肠米线 共回答了13个问题 |采纳率92.3%1.219g*10%=21.9g
2.设Fe2O3的质量为X;
Fe2O3+6HCl==2FeCl3+6H2O
160 6*36.5
X 21.9g
解比例得:X=16g
3.矿石中氧化铁的质量分数为:16g/20g=80%1年前查看全部
- (2003•上海)某金属冶炼厂的管道烟泥中含有某些金属,随 机取样对烟泥进行分析.由右
(2003•上海)某金属冶炼厂的管道烟泥中含有某些金属,随机取样对烟泥进行分析.由右表中的数据可知,在烟泥中含有相当量的铜、锌以及能造成污染的硫.因此从效益和环保角度出发,应考虑把铜、锌回收利用,并对硫进行适当的处理.
烟泥样品中部分元素质量分数表
[设计方案]编号 Cu Zn S 1 10.3% 5.0% 1.2% 2 11.5% 4.9% 1.8% 3 12.4% 10.3% 0.9% 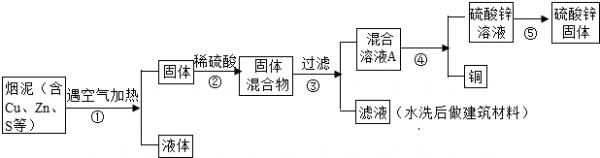
(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
①2Cu+O2
2CuO点燃 .2Cu+O2、②______.
2CuO点燃 .
(2)写出本方案中处理废气的方法(用化学方程式表示):______.
(3)步骤⑤中所用的操作方法是:______.
(4)在步骤④中,可选用试剂______从混合溶液A中得到铜. esh66301年前1
esh66301年前1 -
 vividvvv 共回答了12个问题
vividvvv 共回答了12个问题 |采纳率91.7%解题思路:(1)步骤一是空气中加热即物质与氧气的反应,步骤二中是氧化铜与硫酸的反应.
(2)此方案中硫主要以二氧化硫的形式散失,处理时可利用其能与碱反应的知识解决.
(3)从溶液中的到溶质方法均可.
(4)利用步骤四的产物进行分析解决(1)步骤①是烟泥中的物质与氧气的反应,步骤②是氧化铜与硫酸的反应.
故答案为:2Cu+O2
点燃
.
2CuO;CuO+H2SO4═CuSO4+H2O
(2)由于二氧化硫是酸性氧化物,因此可用碱来吸收处理.
故答案为:2NaOH+SO2═Na2SO3+H2O
(3)从溶液中的到溶质可以采用蒸发结晶等方式解决.
故答案为:蒸发结晶(或蒸发、浓缩、结晶)
(4)步骤④的产物是铜与硫酸锌,则反应物只能是锌与硫酸铜发生了置换反应.
故答案为:Zn点评:
本题考点: 金属的回收利用及其重要性;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是一道常规的资源回收题,解题的方法是对设计方案所涉及的化学反应要能明确,并进而对反应物生成物作出判断,此题属基础性回收实验题.1年前查看全部
- (2008•潍坊)海水中镁的含量一般为1.28g•L-1,总储量约为2×1015t某镁冶炼厂利用海水制镁,其工业流程如下
(2008•潍坊)海水中镁的含量一般为1.28g•L-1,总储量约为2×1015t某镁冶炼厂利用海水制镁,其工业流程如下:
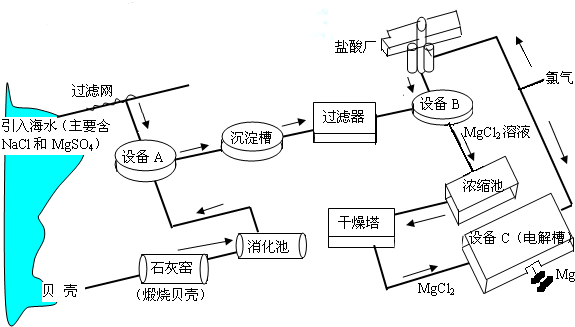
根据上述流程图,回答下列问题:
(1)石灰窑中发生反应的化学方程式为CaCO3
CaO+CO2↑高温 .CaCO3.
CaO+CO2↑高温 .
(2)消化池中发生的反应CaO+H2O═Ca(OH)2,其反应类型为______,
消化池中温度升高的原因是______.
(3)写出设备A、B和C中反应的化学方程式
A:______;
B:______;
C:MgCl2
Mg+Cl2↑通电 .MgCl2.
Mg+Cl2↑通电 .
(4)氯气不能排放到空气中,而要循环使用,其原因是:
①______;
②______. 海风11年前1
海风11年前1 -
 sieman2000 共回答了29个问题
sieman2000 共回答了29个问题 |采纳率75.9%解题思路:根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式;氧化钙溶于水能够放出大量的热;氯气的循环利用可以节约资源;由多种物质反应生成一种物质的反应属于化合反应.(1)石灰窑中发生反应的化学方程式为:CaCO3
高温
.
CaO+CO2↑.
(2)由CaO+H2O═Ca(OH)2可知,反应物是两种,生成物是一种,属于化合反应.故填:化合反应.
消化池中温度升高的原因是氧化钙溶于水放出大量的热.故填:氧化钙溶于水放出大量的热.
(3)反应的化学方程式为:
A:Ca(OH)2 +MgSO4═Mg(OH)2↓+CaSO4;
B:Mg(OH)2+2HCl═MgCl2+2H2O;
C:MgCl2
通电
.
Mg+Cl2↑.
(4)氯气不能排放到空气中,而要循环使用,其原因是:
①氯气有毒,排入空气会污染环境;
②可以节约资源.点评:
本题考点: 对海洋资源的合理开发与利用;碳酸钙、生石灰、熟石灰之间的转化;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要充分理解质量守恒定律的内容,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选( ) 名称 熔点(℃)
某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选( ) 名称 熔点(℃) 密度(kg/m 3 ) 名称 熔点(℃) 密度(kg/m 3 ) 铁 1535 7.9×10 3 铅 328 11.3×10 3 钢 1083 8.9×10 3 铝 660 2.7×10 3 金 1064 19.3×10 3 A.铅 B.铁 C.铜 D.金  ann90985481年前1
ann90985481年前1 -
 micheal2008 共回答了15个问题
micheal2008 共回答了15个问题 |采纳率100%A、铅的熔点比铝低,不符合要求.
B、铁的熔点比铝高,密度较小又便宜,符合题意.
C、铜的熔点符合,但是密度较大又比较贵,不符合题意.
D、金的熔点符合,但是密度很大,又很贵,不符合题意.
故选B.1年前查看全部
- (2014•鹰潭二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了
(2014•鹰潭二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染.
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:______.
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)⇌CH3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将______(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②下图1表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系.其中表示平衡混合物中的甲醇的含量最高的一段时间是______.图1中t3时改变的条件可能是______.
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图2:
①写出甲中通入甲醇这一极的电极反应式______.
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式______,原混合溶液中NaCl的物质的量浓度为______ mol/L.(假设溶液体积不变) prosporr1年前1
prosporr1年前1 -
 hzl5400426 共回答了15个问题
hzl5400426 共回答了15个问题 |采纳率93.3%解题思路:(1)流程中的反应物FeTiO3、C、Cl2,得到的产物是FeCl3、TiCl4、CO,据此来书写方程式;
(2)①根据Qc和K之间的关系来确定化学反应的方向;
②根据影响化学反应速率的因素:温度、浓度、压强、催化剂等知识结合图象来回答;
(3)①在燃料电池的中,负极上是燃料发生失电子的氧化反应,根据电解质环境来书写电极反应式;
②根据电解池的电极反应规律来书写电解反应,结合电子守恒和离子的量的关系进行计算.(1)根据流程图判断:反应物FeTiO3、C、Cl2,得到的产物是FeCl3、TiCl4、CO,钛铁矿经氯化得到四氯化钛的化学方程式为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(2)①该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时Qc=
c(CH3O)
c(CO)•c2(H2)=[1
1×1.52>K,所以反应向逆方向移动,故答案为:向逆反应方向进行;
②根据图象知道:化学平衡先是正向移动,所以t2~t3甲醇的含量在原平衡基础上会升高,然后是平衡逆向移动,甲醇的含量降低,所以甲醇的含量的最高点是t2~t3,在t3时刻,正逆反应速率均迅速升高,并且平衡逆向进行,所以改变的条件是升高温度,故答案为:t2~t3;升高温度;
(3)①在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②通甲醇的电极是负极,所以石墨电极是阴极,该极上发生的电极反应为:4OH--4e-=O2↑+2H2O,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224ml,物质的量为0.01mol,原溶液中氯化钠物质的量为0.02mol,氯化钠浓度=
0.02mol/0.2L]=0.1mol/L,故答案为:0.1.点评:
本题考点: 化学电源新型电池;热化学方程式;化学平衡建立的过程;化学反应速率的影响因素.
考点点评: 本题综合考查学生化学反应速率和平衡以及电化学中原电池、电解池的工作原理知识,注意知识的归纳和整理是解题关键,综合性强,难度不大.1年前查看全部
- 如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风
如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风.回答下列问题.

(1)判断东部工业区的选址是否合理,并说明理由.
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大.为什么? maomaojz1年前1
maomaojz1年前1 -
 yy_mikelee 共回答了18个问题
yy_mikelee 共回答了18个问题 |采纳率77.8%解题思路:(1)工业区的布局要充分考虑企业对地理环境产生影响(大气污染、水污染、固体废弃物污染、噪音污染等方面)及交通通达度.(2)工业区的搬迁问题还是工业布局问题,因而考虑的重点还是这些工厂在该地可能造成的污染状况.(1)因为该工业区(三个工厂)分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.故是合理的.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区.
故答案为:
(1)合理.分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区点评:
本题考点: 工业生产活动对地理环境的影响.
考点点评: 本题难度适中.在平时的学习和生活中,要求学生关注企业的布局是否合理,结合地理学科强调大气污染、水污染和固体废弃物工业的布局原则.1年前查看全部
- (2013•如东县模拟)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大提高了资源利用率,减少了
 (2013•如东县模拟)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大提高了资源利用率,减少了环境污染.请填写:
(2013•如东县模拟)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大提高了资源利用率,减少了环境污染.请填写:
(1)氯碱厂用电解饱和食盐水的方法制取烧碱,同时得到氯气和氢气.写出其化学方程式:2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .2NaCl+2H2O.
2NaOH+Cl2↑+H2↑通电 .
(2)钛酸亚铁(FeTiO3)中钛元素的化合价是______.钛冶炼厂氯化车间的氯化过程发生如下反应:2FeTiO3+6C+7Cl2═2X+2TiCl4+6CO,则X的化学式为______,其名称为______.
(3)试写出TiCl4与Mg反应生成金属Ti的化学方程式TiCl4+2Mg
Ti+2MgCl2800℃ .TiCl4+2Mg,该反应属于______反应.上述反应需在氩气环境中进行,理由是______.
Ti+2MgCl2800℃ .
(4)同温同压下,任何气体之间的体积比就是它们的分子数之比.在一定条件下用H2和CO化合生成甲醇(化学方程式是2H2+CO═CH3OH),则合成甲醇时,H2和CO两种气体的体积比应为______. 三月六月九月1年前1
三月六月九月1年前1 -
 long0333 共回答了15个问题
long0333 共回答了15个问题 |采纳率86.7%解题思路:(1)根据化学方程式的书写方法填写;
(2)根据化合物中正负化合价的代数和为零的原则计算钛元素的化合价,根据质量守恒定律推断x的化学式;
(3)根据化学方程式的书写方法填写化学方程式,根据反应类型的特点判断反应类型;
(4)根据题目给出的信息计算.(1)电解饱和食盐水,反应物是氯化钠和水,生成物是氢氧化钠、氯气和氢气.故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑
(2)设FeTiO3中P的化合价是x.FeTiO3中Fe的化合价是+2价,O的化合价是-2价,利用化合物中各元素的化合价的代数和为零的原则得到方程
(+2)+x+(-2)×3=0
解得,x=+4 所以钛酸亚铁(FeTiO3)中钛元素的化合价是+4价;
据质量守恒定律,在反应前后各元素原子的个数不变.从2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子.铁反应前共有2个,反应后只有x有,所以2x中有2个,从而x中有1个;氯原子反应前有14个,反应后x除外有8个,所以2x中有6个,因此x中有3个,因此x的化学式是FeCl3;
FeCl3中铁显+3价,读作氯化铁.
故答案为:+4价;FeCl3; 氯化铁
(3)TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,因此该反应的化学方程式是TiCl4+2Mg
800℃
.
Ti+2MgCl2;该反应中TiCl4、MgCl2是化合物,Ti、Mg是单质,属于一种单质和一种化合物反应生成另外一种单质和另外一种化合物的反应,是置换反应;反应需在氩气环境中进行,是因为氩气的化学性质稳定,可做保护气.故答案为:TiCl4+2Mg
800℃
.
Ti+2MgCl2;置换;作保护气
(4)同温同压下,任何气体之间的体积比就是它们的分子数之比,从化学方程式2H2+CO═CH3OH看,H2和CO前的化学计量数之比是2:1,即体积比.故答案为:2:1点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;反应类型的判定;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化合价的计算、化学方程式的书写以及质量守恒定律的应用,同时考查了学生从题目中获取信息并运用的能力.计算元素的化合价时一定要注意,一定不要忘记填上正号.1年前查看全部
- 某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为1
某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为160cm,80cm和40cm,求原来正方体钢锭的棱长为多少?
 訾德恒1年前1
訾德恒1年前1 -
 ieki19 共回答了20个问题
ieki19 共回答了20个问题 |采纳率90%解题思路:根据题意列出算式,计算即可得到结果.根据题意得:
3160×80×40÷27
=
3
512000
27
=[80/3](cm),
则原来正方体钢锭的棱长为[80/3]cm.点评:
本题考点: 立方根.
考点点评: 此题考查了立方根,熟练掌握立方根的定义是解本题的关键.1年前查看全部
- 图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风。
图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风。回答下列问题。 (1)判断东部工业区的选址是否合理,并说明理由。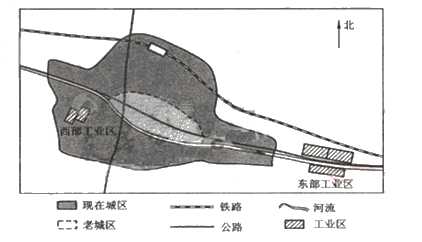
_____________________________________________________________________________
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂迁的呼声越来越大。为什么?
_____________________________________________________________________________ dd陆判1年前1
dd陆判1年前1 -
 JTPOLARIS 共回答了21个问题
JTPOLARIS 共回答了21个问题 |采纳率95.2%(1 )合理。因为该工业区(三个工厂)分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便。
(2 )两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区。1年前查看全部
- 某金属冶炼厂将一个正方体钢锭在炉中熔化后浇铸成一个长方体钢锭的长宽高分别为160cm、80cm、40cm
某金属冶炼厂将一个正方体钢锭在炉中熔化后浇铸成一个长方体钢锭的长宽高分别为160cm、80cm、40cm
求原来正方体钢锭的边长.(初一实数) wwase1年前1
wwase1年前1 -
 s碎碎 共回答了14个问题
s碎碎 共回答了14个问题 |采纳率100%融化前后体积相等
设原来正方体钢锭的边长=x
x³=160乘80乘40
x³=512000
x=80
答原来正方体钢锭的边长=80cm1年前查看全部
- 某钢铁冶炼厂购进一批铁矿石(主要成分是Fe2O3),为测定矿石中Fe2O3的质量分数,技术人员从矿石中取样品20g,恰好
某钢铁冶炼厂购进一批铁矿石(主要成分是Fe2O3),为测定矿石中Fe2O3的质量分数,技术人员从矿石中取样品20g,恰好与219g质量分数为10%的盐酸完全反应(除Fe2O3外,盐酸不与其它成分反应).计算:
(1)盐酸中溶质的质量是多少?
(2)样品中氧化铁的质量是多少?
(3)这批矿石中氧化铁的质量分数是多少? zhybz1年前1
zhybz1年前1 -
 u3oneline 共回答了14个问题
u3oneline 共回答了14个问题 |采纳率85.7%解题思路:(1)利用一定量溶液中溶质质量=溶液质量×溶液中溶质质量分数,由219g质量分数为10%的盐酸计算参加反应的HCl的质量;
(2)根据氧化铁与盐酸反应的化学方程式,由恰好完全反应时参加反应盐酸的质量计算样品中氧化铁的质量;
(3)氧化铁与所取样品质量比即可计算这批矿石中氧化铁的质量分数.(1)盐酸中溶质的质量=219g×10%=21.9g
(2)设样品中氧化铁的质量为x
Fe2O3+6HCl═2FeCl3+3H2O
160219
x 21.9g
[160/x]=[219/21.9g] x=16g
(3)这批矿石中氧化铁的质量分数=[16g/20g]×100%=80%
答:(1)盐酸中溶质的质量是21.9g;(2)样品中氧化铁的质量是16g;(3)这批矿石中氧化铁的质量分数是80%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据反应的化学方程式能表示反应中各物质的质量比,由反应中任意一物质的质量可计算出反应中其它物质的质量.1年前查看全部
- 关于烟尘排放量的计算1.某冶炼厂排气筒直径为600mm,平均气体流速为10m/s,实测得废气的 SO2平均浓度15g/m
关于烟尘排放量的计算
1.某冶炼厂排气筒直径为600mm,平均气体流速为10m/s,实测得废气的 SO2平均浓度15g/m3,含尘浓度8g/m3,求SO2和粉尘的小时排放量. 天堂冰窖1年前1
天堂冰窖1年前1 -
 打破历史的龌撮 共回答了16个问题
打破历史的龌撮 共回答了16个问题 |采纳率93.8%SO2排放量=15*10*π*0.6^2*3600=610725g/h=610.725kg/h
粉尘排放量=8*10*π*0.6^2*3600=325720g/h=325.72kg/h1年前查看全部
- (2011•香坊区二模)某金属冶炼厂用铝土矿(除含氧化铝外,其它成分不溶于水,也不与酸反应)炼铝.现欲测定铝土矿中氧化铝
(2011•香坊区二模)某金属冶炼厂用铝土矿(除含氧化铝外,其它成分不溶于水,也不与酸反应)炼铝.现欲测定铝土矿中氧化铝的质量分数,请回答下列问题:
(1)配制250g溶质质量分数为l 9.6%的稀硫酸,需要98%的浓硫酸的质量是______g;
(2)将铝土矿粉碎,用硫酸溶解的化学方程式为______;
(3)若17g的铝土矿恰好与150g的1 9.6%的稀硫酸完全反应,则:
①求解17g铝土矿中氧化铝质量(x)的比例式为[102/294=
=x 29.4g] [102/294x 29.4g];
②此铝土矿中氧化铝的质量分数为______;
③向所得滤液中加入39.8克的水后,最终所得溶液中溶质的质量分数为______;
(4)若哈尔滨地铁工程需要铝合金108吨(含铝95%),在炼铝过程中,共损失铝5%.则需要这种铝土矿的质量是______吨.赞
眼儿媚_ 幼苗
共回答了17个问题采纳率:88.2% 举报
解题思路:(1)稀释前后溶质的质量不变.
(2)金属氧化物与酸反应生成盐和水写出化学方程式
(3)根据化学方程式的计算步骤进行解题.
(4)根据元素质量守恒进行计算(1)稀释前后溶质的质量不变,设需浓硫酸的质量为x
250g×19.6%═x×98%
x=50g
(2)氧化铝与硫酸反应生成硫酸铝和水;故化学方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O
(3)①设氧化铝质量为x,生成Al2(SO4)3质量为y
Al2O3 +3H2SO4═Al2(SO4)3+3H2O
102 294342
x150g×19.6% y
[102/294=
x
29.4g] [294/29.4g=
342
y]
x═10.2gy=34.2g
②该铝土矿中氧化铝的质量分数为:[10.2g/17g]×100%=60%;
③反应后所得溶液中加入39.8g水,则最终溶液中溶质质量分数为:[34.2g/150g+10.2g+39.8g]×100%=17.1%.
(4)设氧化铝质量为z
z×[54/102]=108t×95%÷(1-5%)
z=204t
需要这种铝土矿的质量为:204t÷60%=340t
故答案为:(1)50
(2)Al2O3+3H2SO4=Al2(SO4)3+3H2O
(3)①[102/294=
x
29.4g] ②60%③17.1%
(4)340点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算.
考点点评: 本题牵扯了化学中的多种化学计算,综合性很强,计算难度很大,不适合基础知识的练习.1年前
4可能相似的问题-
(2011•香坊区二模)下列对一些事实的解释中,不合理的是( )
1年前1个回答
-
(2011•香坊区二模)下列过程中,没有发生化学变化的是( )
1年前1个回答
-
(2011•香坊区二模)如图所示物质的用途中,不正确的是( )
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.035 s. - webmaster@yulucn.com Love_Marlene1年前1
Love_Marlene1年前1 -
 眼儿媚_ 共回答了17个问题
眼儿媚_ 共回答了17个问题 |采纳率88.2%解题思路:(1)稀释前后溶质的质量不变.
(2)金属氧化物与酸反应生成盐和水写出化学方程式
(3)根据化学方程式的计算步骤进行解题.
(4)根据元素质量守恒进行计算(1)稀释前后溶质的质量不变,设需浓硫酸的质量为x
250g×19.6%═x×98%
x=50g
(2)氧化铝与硫酸反应生成硫酸铝和水;故化学方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O
(3)①设氧化铝质量为x,生成Al2(SO4)3质量为y
Al2O3 +3H2SO4═Al2(SO4)3+3H2O
102 294342
x150g×19.6% y
[102/294=
x
29.4g] [294/29.4g=
342
y]
x═10.2gy=34.2g
②该铝土矿中氧化铝的质量分数为:[10.2g/17g]×100%=60%;
③反应后所得溶液中加入39.8g水,则最终溶液中溶质质量分数为:[34.2g/150g+10.2g+39.8g]×100%=17.1%.
(4)设氧化铝质量为z
z×[54/102]=108t×95%÷(1-5%)
z=204t
需要这种铝土矿的质量为:204t÷60%=340t
故答案为:(1)50
(2)Al2O3+3H2SO4=Al2(SO4)3+3H2O
(3)①[102/294=
x
29.4g] ②60%③17.1%
(4)340点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算.
考点点评: 本题牵扯了化学中的多种化学计算,综合性很强,计算难度很大,不适合基础知识的练习.1年前查看全部
- (2009•南昌)(1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化
 (2009•南昌)(1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%.现炼铁厂利用该赤铁矿石5000t,理论上可炼出含铁98%的生铁的质量是多少(保留整数).
(2009•南昌)(1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%.现炼铁厂利用该赤铁矿石5000t,理论上可炼出含铁98%的生铁的质量是多少(保留整数).
(2)在利用如图装置进行实验时,小强得到如下两组数据(杂质不参加反应)
你认为他应该选用了______(填“A”或“B”)组数据来计算赤铁矿石中氧化铁的质量分数;结合装置图回答他不选用另一组数据计算的原因______.反应前 反应后 A组 玻璃管和赤铁矿石样品的质量m1g 玻璃管和固体物质的质量m2g B组 烧杯和澄清石灰水的质量m3g 烧杯和烧杯中物质的质量m4g  雨羽1年前1
雨羽1年前1 -
 ddgfggg 共回答了20个问题
ddgfggg 共回答了20个问题 |采纳率90%解题思路:(1)根据CO还原氧化铁的反应化学方程式可得知,反应前氧化铁中铁元素全部被还原成生铁中的铁,因此,利用反应的化学方程式由氧化铁的质量可计算出生铁中铁的质量,然后再利用生成中铁的质量分数计算出所得生铁的质量;
(2)A组实验前后的质量差为被还原的氧化铁中氧元素的质量,由此数据可准确计算出铁矿石中氧化铁的质量及质量分数;而B组实验前后的质量差为石灰水吸收二氧化碳的质量,烧杯内的石灰水可能会吸收空气中二氧化碳而使质量差出现较大偏差而影响计算结果.(1)设得到生铁的质量为x
Fe2O3+3CO
高温
.
2Fe+3CO2
160 112
5000t×80% x×98%
[160/5000t×80%]=[112/x×98%]
x=2857t
答:理论上可炼出含铁98%的生铁的质量为2857t;
(2)A组实验中反应前后的质量差为被还原的氧化铁中氧元素的质量,由A组实验数据可准确计算出铁矿石中氧化铁的质量及质量分数;而B组实验中如果澄清石灰水吸收了空气中的二氧化碳,可使得反应前后质量差增大,影响根据二氧化碳质量所计算的氧化铁的质量及其质量分数,故不宜使用该组数据进行计算;
故答案为:A,石灰水也会吸收空气中的二氧化碳,导致数据m4有误差.点评:
本题考点: 含杂质物质的化学反应的有关计算;实验数据处理或者误差分析的探究.
考点点评: 根据化学方程式进行计算时,所使用物质的质量应为纯净物的质量,含杂质的物质的质量不能直接代入方程式进行计算.1年前查看全部
- (1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80

(1)小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%.现炼铁厂利用该赤铁矿石5000t,理论上可炼出含铁98%的生铁的质量是多少(保留整数).
(2)在利用如图装置进行实验时,小强得到如下两组数据(杂质不参加反应)
你认为他应该选用了______(填“A”或“B”)组数据来计算赤铁矿石中氧化铁的质量分数;结合装置图回答他不选用另一组数据计算的原因______.反应前 反应后 A组 玻璃管和赤铁矿石样品的质量m1g 玻璃管和固体物质的质量m2g B组 烧杯和澄清石灰水的质量m3g 烧杯和烧杯中物质的质量m4g  zw98321年前1
zw98321年前1 -
 CiSun 共回答了11个问题
CiSun 共回答了11个问题 |采纳率100%解题思路:(1)根据CO还原氧化铁的反应化学方程式可得知,反应前氧化铁中铁元素全部被还原成生铁中的铁,因此,利用反应的化学方程式由氧化铁的质量可计算出生铁中铁的质量,然后再利用生成中铁的质量分数计算出所得生铁的质量;
(2)A组实验前后的质量差为被还原的氧化铁中氧元素的质量,由此数据可准确计算出铁矿石中氧化铁的质量及质量分数;而B组实验前后的质量差为石灰水吸收二氧化碳的质量,烧杯内的石灰水可能会吸收空气中二氧化碳而使质量差出现较大偏差而影响计算结果.(1)设得到生铁的质量为x
Fe2O3+3CO
高温
.
2Fe+3CO2
160 112
5000t×80% x×98%
[160/5000t×80%]=[112/x×98%]
x=2857t
答:理论上可炼出含铁98%的生铁的质量为2857t;
(2)A组实验中反应前后的质量差为被还原的氧化铁中氧元素的质量,由A组实验数据可准确计算出铁矿石中氧化铁的质量及质量分数;而B组实验中如果澄清石灰水吸收了空气中的二氧化碳,可使得反应前后质量差增大,影响根据二氧化碳质量所计算的氧化铁的质量及其质量分数,故不宜使用该组数据进行计算;
故答案为:A,石灰水也会吸收空气中的二氧化碳,导致数据m4有误差.点评:
本题考点: 含杂质物质的化学反应的有关计算;实验数据处理或者误差分析的探究.
考点点评: 根据化学方程式进行计算时,所使用物质的质量应为纯净物的质量,含杂质的物质的质量不能直接代入方程式进行计算.1年前查看全部
- 某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选: [
某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选:  [ ]
[ ]A.铅
B.铁
C.铜
D.金 神佑1年前1
神佑1年前1 -
 佑佑530 共回答了18个问题
佑佑530 共回答了18个问题 |采纳率88.9%B1年前查看全部
- 某冶炼厂每天生产含铝99%的铝锭5t,假设该厂铝土矿的利用率为90%,在各步反应中总转化率为80%,问该厂每天需购进多少
某冶炼厂每天生产含铝99%的铝锭5t,假设该厂铝土矿的利用率为90%,在各步反应中总转化率为80%,问该厂每天需购进多少吨含氧化铝60%的铝土矿?
需购进X吨含氧化铝60%的铝土矿
X*0.6*0.8*0.9/102=5*0.99/27
X=43.3t
这样对吗 3721077561年前1
3721077561年前1 -
 nell419 共回答了22个问题
nell419 共回答了22个问题 |采纳率100%且来分析一下吧,铝土矿含氧化铝60%,而铝土矿的利用率为90%,也就是说有90%*60%
的反应物,总转化率为80%,也就是说反应物没有完全参与反应,参与反应的有90%*60%*80%
剩下的就是制取铝的反应了
Al2O3 ~ 2 Al
102 54
X*90%*60%*80% 5*99%
X=1年前查看全部
- (2011•姜堰市二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少
(2011•姜堰市二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染.

请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:______.
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)⇌CH3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将______(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).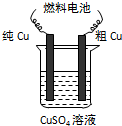
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2t甲醇,至少需额外补充H2______t.
(3)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加6.4g.
①请写出燃料电池中的负极反应式:______.
②燃料电池正极消耗空气的体积是______(标准状况,空气中O2体积分数以20%计算). 独命鸟1年前1
独命鸟1年前1 -
 梦梦飞飞 共回答了13个问题
梦梦飞飞 共回答了13个问题 |采纳率92.3%解题思路:(1)从图示可知氯化时的反应物、生成物,再根据得失电子和原子守恒即可得出该反应的方程式;
(2)①根据浓度熵数值和平衡常数的大小关系来判断;
②根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)⇌CH3OH(g)以及2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO和2NaCl+2H2O通电 .
2NaOH+H2↑+Cl2↑得到相应关系式来计算;通电 .
(3)①根据负极反应=总反应-正极反应来回答;
②根据电路中的电子守恒来计算回答.(1)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为
2FeTiO3+6C+7Cl2
通电
.
2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(2)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=
C(甲醇)
C(一氧化碳)C(氢气)2=[1
1×1.52=0.44>0.27,即Qc>K,
所以此时反应将向逆反应方向进行,故答案为:向逆反应方向进行;
②由方程式CO(g)+2H2(g)⇌CH3OH(g)、2FeTiO3+6C+7Cl2
通电
./ ]2FeCl3+2TiCl4+6CO和2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑得如下关系式:
6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气,故答案为:1.0;
(3)甲醇-空气碱性(KOH)燃料电池的总反应为:3O2+2CH3OH+4OH-=2CO32-+6H2O,正极反应式为:3O2+12e-+6H2O=12OH-,负极反应=总反应-正极反应,
即为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成6.4g纯铜,至少转移电子0.2mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.2mol,
消耗氧气0.05mol,折合成空气为0.25mol,在标准状况下的体积为5.6,故答案为:5.6 L.点评:
本题考点: 以氯碱工业为基础的化工生产简介;电极反应和电池反应方程式.
考点点评: 本题是一道有关电解原理的应用知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数, 设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%。
小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数, 设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%。现炼铁厂利用该赤铁矿石5000 t,理论上可炼出含铁98%的生铁的质量是多少(保留整数)? 
 cry_johnny1年前1
cry_johnny1年前1 -
 nyist 共回答了22个问题
nyist 共回答了22个问题 |采纳率86.4%1年前查看全部
- 下图为某城市两大工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风
下图为某城市两大工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风,回答下列问题。
(1)判断东部工业区的选址是否合理,并说明理由。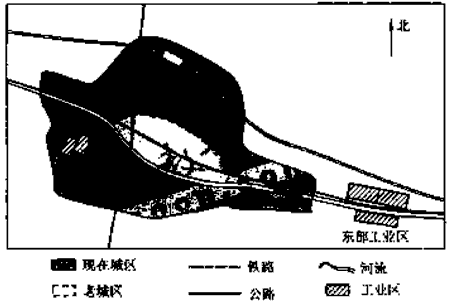
___________________________________________________________________________________________
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大。为什么?
___________________________________________________________________________________________ sailing_xie1年前1
sailing_xie1年前1 -
 百草就 共回答了22个问题
百草就 共回答了22个问题 |采纳率86.4%(1)合理。因为该工业区(三个工厂)分布在与盛行风向垂直的郊外,废气对城市污染小,位于流经河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便。
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区。1年前查看全部
- 某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为1
某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为160cm,80cm和40cm,求原来正方体钢锭的棱长为多少?
 yanl-0211年前2
yanl-0211年前2 -
 芊芊手 共回答了19个问题
芊芊手 共回答了19个问题 |采纳率84.2%解题思路:根据题意列出算式,计算即可得到结果.根据题意得:
3160×80×40÷27
=
3
512000
27
=[80/3](cm),
则原来正方体钢锭的棱长为[80/3]cm.点评:
本题考点: 立方根.
考点点评: 此题考查了立方根,熟练掌握立方根的定义是解本题的关键.1年前查看全部
- 某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选( ) 名称 熔点(℃)
某冶炼厂要制作一个轻巧、经济的炼铝熔炉,下表列出了几种物质的熔点和密度,你认为最合适的材料应选( )
名称 熔点(℃) 密度(kg/m3) 名称 熔点(℃) 密度(kg/m3) 铁 1535 7.9×103 铅 328 11.3×103 钢 1083 8.9×103 铝 660 2.7×103 金 1064 19.3×103
A.铅
B.铁
C.铜
D.金 男友比我小1年前1
男友比我小1年前1 -
 清水旦 共回答了22个问题
清水旦 共回答了22个问题 |采纳率95.5%解题思路:炼铝熔炉,熔点比铝高,铁、铜和金都可以,轻巧、经济,要求密度小且便宜的,只有铁合适.A、铅的熔点比铝低,不符合要求.
B、铁的熔点比铝高,密度较小又便宜,符合题意.
C、铜的熔点符合,但是密度较大又比较贵,不符合题意.
D、金的熔点符合,但是密度很大,又很贵,不符合题意.
故选B.点评:
本题考点: 密度及其特性;熔点和凝固点.
考点点评: 本题综合考查密度和熔点的应用,学会分析图表,并从中读取有用的信息.1年前查看全部
- 写出下列有关反应的化学方程式:①在空气中点燃氢气______.②冶炼厂排放的二氧化硫可用氢氧化钠溶液吸收______③某
写出下列有关反应的化学方程式:
①在空气中点燃氢气______.
②冶炼厂排放的二氧化硫可用氢氧化钠溶液吸收______
③某化工厂用废铁屑处理含硫酸铜的废水______.
④黑色火药是我国古代四大发明之一,它是由硝石(kno 3 )、木炭、硫粉组成的,点燃后产生比原有体积大千倍的气体,具有猛烈的***威力,反应后生成物为硫化钾(k 2 s)、氮气和二氧化碳气体______. chenjiangang0071年前1
chenjiangang0071年前1 -
 bmwjime 共回答了16个问题
bmwjime 共回答了16个问题 |采纳率87.5%①氢气和氧气在点燃的条件下生成水,故答案为:2H 2 +O 2
点燃
.
2H 2 O;
②二氧化硫和氢氧化钠反应生成亚硫酸钠和水,故答案为:SO 2 +2NaOH=Na 2 SO 3 +H 2 O;
③铁和硫酸铜反应生成用硫酸亚铁和铜,故答案为:Fe+CuSO 4 =FeSO 4 +Cu;
④硝酸钾、木炭和硫在点燃的条件下生成硫化钾、氮气和二氧化硫,故答案为:2KNO 3 +3C+S
点燃
.
K 2 S+N 2 ↑+3CO 2 ↑.1年前查看全部
- 如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风
如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风.回答下列问题.

(1)判断东部工业区的选址是否合理,并说明理由.
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大.为什么? 狐狸丫头1年前1
狐狸丫头1年前1 -
 老虎68 共回答了26个问题
老虎68 共回答了26个问题 |采纳率88.5%解题思路:(1)工业区的布局要充分考虑企业对地理环境产生影响(大气污染、水污染、固体废弃物污染、噪音污染等方面)及交通通达度.(2)工业区的搬迁问题还是工业布局问题,因而考虑的重点还是这些工厂在该地可能造成的污染状况.(1)因为该工业区(三个工厂)分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.故是合理的.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区.
故答案为:
(1)合理.分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区点评:
本题考点: 工业生产活动对地理环境的影响.
考点点评: 本题难度适中.在平时的学习和生活中,要求学生关注企业的布局是否合理,结合地理学科强调大气污染、水污染和固体废弃物工业的布局原则.1年前查看全部
- 下图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风
下图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等。该地盛行南风。回答下列问题。
(1)判断东部工业区的选址是否合理,并说明理由。
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大。为什么? ee舒荷1年前1
ee舒荷1年前1 -
 秋月孤影 共回答了23个问题
秋月孤影 共回答了23个问题 |采纳率95.7%(1)合理。因为该工业区(三个工厂)分布在与盛行风向垂直的郊外.废气对城市污染小,位于流经城市的河流下游,不会对城市用水产生污染,还位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便。
(2)两厂都属于(大气)污染较重的工厂,位于与盛行风向垂直的老城区郊外,较为合理;但现已完全被新城区包围,污染城区,影响居住环境(人们环境意识增强),需迁出城区。
第(1)题,东部工业区分布在与盛行风向垂直的郊外,并位于流经城区河流的下游,无论对城市大气污染,还是水污染都非常小,且铁路、公路、水路交通便利,有利于原料和产品的运入、运出,故此工业区位设置合理。第(2)题,西部工业区位于老城区的外围,当时区位选择是合理的,但随着城区的扩大,被包围在城区内部,对城市造成了严重的大气污染,今天看来此工业区位设置又不合理.为了减少对城市居住环境的影响,改善城市环境.需向城区外围迁出。1年前查看全部
- 如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风
如图为某城市两个工业区的分布示意图,东部工业区包括冶炼厂、钢铁厂、石化厂等,西部工业区包括焦化厂、水泥厂等.该地盛行南风.回答下列问题.

(1)判断东部工业区的选址是否合理,并说明理由.
(2)20世纪80年代以来,随着城区不断扩展,要求西部工业区中的焦化厂、水泥厂搬迁的呼声越来越大.为什么? ryuanfeng1年前1
ryuanfeng1年前1 -
 OliverBierhoff 共回答了20个问题
OliverBierhoff 共回答了20个问题 |采纳率95%解题思路:(1)工业区的布局要充分考虑企业对地理环境产生影响(大气污染、水污染、固体废弃物污染、噪音污染等方面)及交通通达度.(2)工业区的搬迁问题还是工业布局问题,因而考虑的重点还是这些工厂在该地可能造成的污染状况.(1)因为该工业区(三个工厂)分布在与盛行风向垂直的效外,废气对城市污染小;位于流经城市的河流下游,不会对城市用水产生污染;位于主要交通线(铁路、主要公路、河流)沿线,交通运输方便.故是合理的.(2)两...
点评:
本题考点: 工业生产活动对地理环境的影响.
考点点评: 本题难度适中.在平时的学习和生活中,要求学生关注企业的布局是否合理,结合地理学科强调大气污染、水污染和固体废弃物工业的布局原则.1年前查看全部
- 某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为1
某金属冶炼厂,将27个大小相同的正方体钢锭金属块在炉中熔化后烧铸成一个长方体钢锭,量得这个长方体钢锭的长,宽,高分别为160cm,80cm和40cm,求原来正方体钢锭的棱长为多少?
 遗忘的高跟鞋1年前1
遗忘的高跟鞋1年前1 -
 Asaikana 共回答了13个问题
Asaikana 共回答了13个问题 |采纳率84.6%解题思路:根据题意列出算式,计算即可得到结果.根据题意得:
3160×80×40÷27
=
3
512000
27
=[80/3](cm),
则原来正方体钢锭的棱长为[80/3]cm.点评:
本题考点: 立方根.
考点点评: 此题考查了立方根,熟练掌握立方根的定义是解本题的关键.1年前查看全部
- 某冶炼厂要把一个长为60cm,宽为50cm,高为30cm的长方体铁块锻造成2个大小一样的正方体铁块,求锻造后的两个正方体
某冶炼厂要把一个长为60cm,宽为50cm,高为30cm的长方体铁块锻造成2个大小一样的正方体铁块,求锻造后的两个正方体铁块的棱长为多少(结果精确到1cm)
请详细一点 youloveme2141年前3
youloveme2141年前3 -
 一迎 共回答了20个问题
一迎 共回答了20个问题 |采纳率95%设锻造后的正方体棱长为x
2*x^3=60*50*30
x=36cm1年前查看全部
- 非常简单的一道数学题.某金属冶炼厂将27个大小相同的立方体钢锭在炉火中融化后浇铸成一个长方体的钢锭,量得这个长方体的钢锭
非常简单的一道数学题.
某金属冶炼厂将27个大小相同的立方体钢锭在炉火中融化后浇铸成一个长方体的钢锭,量得这个长方体的钢锭的长,宽,高分别为160CM,80CM和40CM,原立方体钢锭的边长为多少厘米?
求解答 叶子的hh1年前7
叶子的hh1年前7 -
 lsyq980b 共回答了19个问题
lsyq980b 共回答了19个问题 |采纳率73.7%160*80*40/27 开3次方=80/3cm1年前查看全部
- 给我讲讲这个某钢铁冶炼厂购进一批铁矿石(主要成分是Fe2O3),为测定矿石中Fe2O3的质量分数,技术人员从矿石中取样品
给我讲讲这个
某钢铁冶炼厂购进一批铁矿石(主要成分是Fe2O3),为测定矿石中Fe2O3的质量分数,技术人员从矿石中取样品20g,恰好与足量的10%的盐酸完全反应(除Fe2O3外,盐酸不与其它成分反应).计算:
(1)样品中氧化铁的质量是多少?
(2)这批矿石中氧化铁的质量分数是多少?
如果真要那么简单我就不问了,网上有直接抄就行了
不用复制粘贴,看看,这题不一样,
是足量
求天才!
看过题了,我也觉得怪,就这样写的,开学找老师去! 翡翠冰冰1年前1
翡翠冰冰1年前1 -
 不敢轻言爱43 共回答了18个问题
不敢轻言爱43 共回答了18个问题 |采纳率94.4%某钢铁冶炼厂购进一批铁矿石(主要成分是Fe2O3),为测定矿石中Fe2O3的质量分数,技术人员从矿石中取样品20g,恰好与219g质量分数为10%的盐酸完全反应(除Fe2O3外,盐酸不与其它成分反应).计算:
(1)盐酸中溶质的质量是多少?
(2)样品中氧化铁的质量是多少?
(3)这批矿石中氧化铁的质量分数是多少?
答案:(1)盐酸中溶质的质量:
219g×10%=21.9g
(2)设样品中氧化铁的质量为
Fe2O3+6HCl=2FeCl3+3H2O
160 219
x 21.9
160/x=219/21.9
x=16g
(3)这批矿石中氧化铁的质量分数:
16/20x100%=80%1年前查看全部
大家在问
- 11.汽车从A地行驶到高速公路收费站C处的速度是?(得数保留整数)
- 2给朋友写信,关于英语最的建议的作文,至少两个建议
- 3小亚给了小巧0.25元后,还比小巧多0.75元,小亚原来比小巧多几元? 列算式
- 4学术规范中关于“综述中的引用”相关规定是什么?
- 5(2009•南通模拟)如图所示是用光照射某种金属时逸出的光电子的最大初动能随入射光频率的变化图线,(直线与横轴的交点坐标
- 6用春天的早上我看见了什么听到了什么想到了什么造句
- 7在一艘匀速向北行驶的轮船甲板上,一运动员向不同方向做立定跳远,若向各个方向起跳时情况都相同 则(无论向哪个方向都一样远)
- 850g的规格为360mm*260mm书写纸多少钱一令?
- 9my birthday is Novenber( )10th
- 10语文题型中给出一段句子叫你欣赏之类的题目怎么写?急明天考试!
- 11等腰三角形哪三线合一?我一直没弄明白~对不起~再加一点~就是,等腰三角形的对称轴是什么啊?等边三角形呢?
- 12(2005•白云区二模)图表示平行光垂直入射凸透镜,请在图中画出光通过凸透镜后的传播方向.
- 13在“用托盘天平称物体的质量”的实验中,下列哪项操作是错误的?( )
- 14350除以7等于50,当被除数增加多少?商就增加21
- 15他为他爸爸做了一个蛋糕 英文







