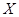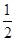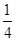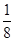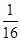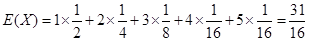研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物
 awei_kylin2022-10-04 11:39:541条回答
awei_kylin2022-10-04 11:39:541条回答A. 0.448L
B. 2.240L
C. 2.016L
D. 无法确定

已提交,审核后显示!提交回复
共1条回复
 rainbow_05 共回答了21个问题
rainbow_05 共回答了21个问题 |采纳率95.2%- 解题思路:KMnO4中Mn是+7价的Mn,具有强氧化性,锰化合物的还原产物都是MnCl2,1mol得到5mol电子,6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体为氧气,KMnO4中O为-2价,生成1个O2失去4个电子.
根据氧化还原反应的得失电子守恒规律,KMnO4中Mn得到的电子总数,等于KMnO4中O失去的电子总数与浓盐酸中氯离子失去电子变为氯气失去的电子总数之和.6.32gKMnO4的物质的量n=[m/M]═[6.32g/158g/mol]=0.04mol,0.112LO2的物质的量=[V/Vm]=[0.112L/22.4L/mol]=0.005mol
得到的电子:KMnO4~5e-~Mn2+,K2MnO4~4e-~Mn2+,MnO2~2e-~Mn2+,
失去的电子:2Cl-~2e-~Cl2,2O~4e-~O2,
根据电子守恒计算:
n(KMnO4)×5e-=n(O2)×4e-+n(Cl2)×2e-
0.04mol×5e-=0.005mol×4e-+n(Cl2)×2e-
n(Cl2)=0.09mol
所以生成的氯气标准状况下的体积V(Cl2)=n×Vm=0.09mol×22.4L/mol=2.016L.
故选C.点评:
本题考点: 氯气的实验室制法.
考点点评: 该题主要考查了氧化还原反应的电子守恒的计算应用,做题时,一定要理清化合价变化的元素,在反应物和相应产物的化合价. - 1年前
相关推荐
- 研究性学习小组同学选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究.以下是他们探究的主要过程:
研究性学习小组同学选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究.以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂有关.
【实验方案】常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间.
【进行记录】下图是他们进行实验的装置图.此实验中a处宜采用的气体收集方法是排水法,并补充完整装置图.
【实验记录】
【结论】该探究过程得出的结论是______.实验编号 1 2 反应物 6%H2O2 6%H2O2 催化剂 1g MnO2 1g 红砖粉 时间 35s 152s
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰和红砖粉是该反应的催化剂,还需增加实验来验证它们在化学反应前后的______和______是否改变.
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
【假设】______.
【实验方案】______. 地中海使者1年前1
地中海使者1年前1 -
 wantsky_bee 共回答了16个问题
wantsky_bee 共回答了16个问题 |采纳率100%解题思路:【进行记录】可以根据排水法收集气体的装置来补全装置图;
【结论】根据表格中的实验现象来分析得出结论;
【反思】根据催化剂的概念可以知道还要验证它们的质量和性质是否发生了改变;
【假设】根据能够影响化学反应速率的因素来作出假设;
【实验方案】根据作出的假设采用控制变量法来进行设计实验进行验证.【进行记录】根据实验室中收集气体的装置来补全装置图;
【结论】根据表格中的数据可以知道加入了二氧化锰和红砖粉后过氧化氢的分解速率加快,说明催化剂对反应速率有影响;
【反思】根据催化剂的概念可以知道催化剂在反应催化过程中质量和化学性质不变,所以要确定二氧化锰和红砖粉是该反应的催化剂,还需要验证红砖粉和二氧化锰的质量是否发生改变;
【假设】本题中只是设计了催化剂对反应的影响,过氧化氢溶液的浓度也可能影响反应的速率;
【实验方案】在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间,从而得出结论.
故答案为:【进行记录】
【结论】在相同条件下,过氧化氢溶液生成氧气的快慢与催化剂种类有关;
【反思】质量;化学性质;
【假设】过氧化氢溶液的浓度能够影响反应的速率;
【实验方案】在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间.点评:
本题考点: 影响化学反应速率的因素探究;实验室制取氧气的反应原理.
考点点评: 控制变量法是常用的探究问题的方法,它可以非常直观的来判断影响反应的因素,并得出结论,在解答时要注意运用该方法.1年前查看全部
- 请你参与某学习小组进行研究性学习的过程,并协助完成相关任务:
请你参与某学习小组进行研究性学习的过程,并协助完成相关任务:
【研究课题】探究热水壶底部水垢的主要成分
【查阅资料】该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质-水垢(主要成分为碳酸盐、碱等的混合物),水垢中一定含有Mg(OH)2和CaCO3.同时,他们还查阅到下列有关物质的溶解性:
【提出猜想】水垢的主要成分除一定含有Mg(OH)2和CaCO3之外,还可能含有Ca(OH)2和______.物 质 Ca(HCO3)2 Mg(HCO3)2 Ca(OH)2 Mg(OH)2 CaCO3 MgCO3 溶解性 可溶 可溶 微溶 不溶 不溶 微溶
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入______,没有白色沉淀,说明水垢中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.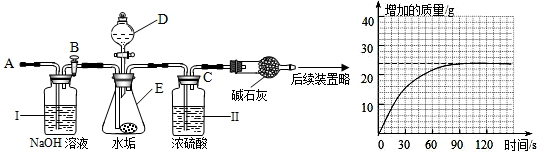
a.仪器D、E的名称分别是______、______;若要检查盛放浓硫酸的洗气瓶双孔塞上导气管与橡皮塞接触的地方(即上图装置中C处)是否漏气,应在装药品之______(填“前”或“后”)检查,请写出检查C处是否漏气的方法:______.
b.步骤①所加的酸溶液是______;请写出水垢中难溶性物质与酸反应的化学方程式:______、______;
c.装置Ⅱ的作用是______;从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是______.
d.研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是______.
【实验结论】通过上述探究可知:水垢的主要成分有______. 比没锅好五倍1年前1
比没锅好五倍1年前1 -
 岁月如诗 共回答了11个问题
岁月如诗 共回答了11个问题 |采纳率100%解题思路:【提出猜想】根据物质的溶解性,对水垢的成分进行猜想;
【设计方案】(1)根据氢氧化钙的性质,判断检验氢氧化钙是否存在所加入的试剂;
(2)a.识别装置中常用仪器,并对装置的气密性进行检查;
b.根据实验目的,判断装置中所加入的药品,并写出反应的化学方程式;
c.根据装置内所盛放的药品,判断装置的作用;
d.通过计算,分析出现质量偏大的可能原因;
【实验结论】根据探究实验,分析水垢的组成.【提出猜想】碳酸镁微溶于水,因此水垢中可能含有碳酸镁;
故答案为:MgCO3;
【设计方案】(1)由溶解性表,要检查氢氧化钙是否存在,可利用向溶液中滴加碳酸钠溶液的方法,观察反应没有出现沉淀判断氢氧化钙的不存在;
故答案为:Na2CO3溶液;
(2)a.仪器D为添加液体药品的分液漏斗;而装置E用作反应容器的锥形瓶;在向装置中加入药品进行实验前,要检查装置的气密性;装置漏气主要是出现仪器连接处,因此,可在装置连接处滴少量水,用热毛巾对锥形瓶内气体升温,若装置C处没有气泡冒出,则说明装置气密性良好;
故答案为:分液漏斗;锥形瓶;前;在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气;
b.由于水垢中碳酸钙与硫酸反应生成微溶于水的硫酸钙会造成反应中止,因此在选择酸时不能选择稀硫酸;盐酸与氢氧化镁发生中和反应生成氯化镁和水,碳酸钙与盐酸发生复分解反应生成氯化钙、水和二氧化碳;
故答案为:稀盐酸;Mg(OH)2+2HCl═MgCl2+2H2O、CaCO3+2HCl═CaCl2+CO2↑+H2O;
c.装置II中盛放的浓硫酸具有吸水性,在整个装置中起到吸收混在二氧化碳气体中的水的作用;装置I中盛放氢氧化钠溶液,可吸收空气中的二氧化碳,以除去空气二氧化碳防止对后面测定的影响;
故答案为:吸收CO2中的水;除去空气中的CO2;
d.设50g碳酸钙完全反应生成二氧化碳气体质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
50g x
100:44=50g:x
解之得 x=22g
而根据反应记录图,水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁;
故答案为:如果50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量为24g,大于了22g,故一定含有50g固体与足量的稀盐酸反应生成的CO2质量大于22g的MgCO3;
【实验结论】根据资料:水垢中一定含有Mg(OH)2和CaCO3;根据放出二氧化碳的质量为24g的实验数据,通过计算可判断水垢中一定含有碳酸镁;故水垢中含有Mg(OH)2、CaCO3、MgCO3三种物质;
故答案为:Mg(OH)2、CaCO3、MgCO3.点评:
本题考点: 实验探究物质的组成成分以及含量;猜想与事实验证;实验操作注意事项的探究;检查装置的气密性;常用仪器的名称和选用;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题涉及基础知识的仪器识别、装置气密性的检查,还涉及较为复杂的数据分析,难度跨度很大,在解答时要谨慎处理.1年前查看全部
- (2012•鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
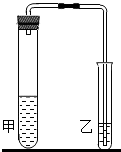 (2012•鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
(2012•鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
(1)我们在学习碳酸钠和碳酸氢钠的时候,做过如如图装置的实验.向盛有0.5g碳酸钠的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象.用碳酸氢钠代替碳酸钠进行上述实验,观察现象.
通过比较试管甲中的两次反应,填写下表:
写出乙中反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2OCO2+Ca(OH)2=CaCO3↓+H2O.碳酸钠+盐酸 碳酸氢钠+盐酸 实验现象 化学反应方程式
(2)以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度表:(g/100g水)
①静置后只析出NaHCO3晶体的原因碳酸氢钠溶解度最小碳酸氢钠溶解度最小;
温度
溶解度0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃ NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO3 11.9 15.8 21.0 27.0 - - - - NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 - NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3
②过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaClNaCl(填化学式)循环使用,回收得到NH4Cl晶体.
(3)分别取碳酸氢钠4.2g和碳酸钠5.3g放入相同大小的锥形瓶中,分别在密闭条件下加入相同质量、相同浓度的盐酸(足量).在相同的条件下,测量出生成气体的体积,得到时间-体积关系曲线图应为BB.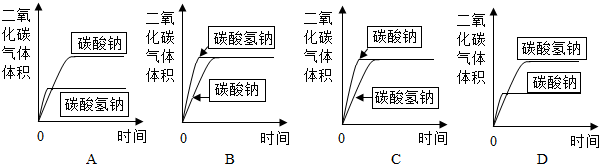
通过分析和计算说明你的理由. 沙沙的下1年前1
沙沙的下1年前1 -
 猪猪0924 共回答了21个问题
猪猪0924 共回答了21个问题 |采纳率100%解题思路:(1)根据碳酸钠和碳酸氢钠与盐酸反应的速率和生成气体的性质解答,生成的二氧化碳能与氢氧化钙溶液反应生成碳酸钙沉淀和水;
(2)对比各物质的溶解度,溶解度小的物质会析出;
(3)根据化学方程式进行计算,结合碳酸氢钠与盐酸反应速率快判断.(1)碳酸钠和碳酸氢钠都能和盐酸反应生成氯化钠、水和二氧化碳气体,不过碳酸氢钠与盐酸反应速率要快的多,故答案为:
有大量无色气泡放出,该气体能使澄清石灰水变浑 更迅速地放出大量无色气泡,该气体能使澄清石灰水变浑
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑乙中发生反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)①对比四种盐在30℃下的溶解度,发现碳酸氢钠的溶解度最小,说明溶液中的溶质达到饱和时,碳酸氢钠最先析出; ②过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,可加入适量的盐酸,碳酸氢钠和盐酸反应转换为氯化钠;氯化钠可循环使用;同时碳酸氢氨和盐酸反应也转换为氯化铵.故答案为:①碳酸氢钠溶解度最小;②NaCl.
(3)设5.3g的Na2CO3和4.2g的NaHCO3和足量的盐酸反应产生的CO2气体的质量分别为x、y
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑
10644 84 44
5.3g x 4.2g y
106
44=
5.3g
x x=2.2g
84
44=
4.2g
y y=2.2g
通过计算得知,5.3g的Na2CO3反应产生的CO2气体为2.2g,4.2g的NaHCO3反应产生的CO2气体也是2.2g.反应后生成相同体积的二氧化碳,但碳酸氢钠和盐酸反应速率更快,结合以上信息,故选B.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;纯碱的制取;根据化学反应方程式的计算.
考点点评: 本题通过对比实验,重点考查了钠的两种重要盐碳酸钠和碳酸氢钠的性质、方程式的书写以及计算等知识.要根据二者的性质和与盐酸反应的特点进行分析解答.1年前查看全部
- 王红同学在研究性学习中选择了“君主立宪制”作为研究课题,下面四部历史文献中,她必须阅读的是: [
王红同学在研究性学习中选择了“君主立宪制”作为研究课题,下面四部历史文献中,她必须阅读的是: [ ]
a.法国《******》
b.美国《******》
c.英国《权利法案》
d.***《中华***临时约法》 snoway1年前1
snoway1年前1 -
 思维方式 共回答了25个问题
思维方式 共回答了25个问题 |采纳率88%C1年前查看全部
- 研究性学习"苏轼诗词鉴赏"要求:3000字以上.{论文形式} 针对苏轼不同时期诗歌的特点,分别叙述.再总结一下.这个问题
研究性学习"苏轼诗词鉴赏"要求:3000字以上.{论文形式} 针对苏轼不同时期诗歌的特点,分别叙述.再总结一下.这个问题有点难,
 totokevin1年前1
totokevin1年前1 -
 第一uu 共回答了11个问题
第一uu 共回答了11个问题 |采纳率90.9%东坡词中,有一个或显或隐、贯穿始终的基调,我们不妨称之为“人生咏叹调”.和之相伴随的,则是作者持续不断的人生思索摘要:其广度和深度在词史上都是前无古人的.
东坡词所体现的人生思索主要有以下三对人生矛盾摘要:
一、出仕和退隐.苏轼早在26岁时即踏上仕途,长时间在宦海浮沉,反复地面临着人生抉择,尤其是在感到失落以及在政治上受挫,遭致贬窜之时.儒家入世思想本是他的“主心骨”,早年“致君尧舜,此事何难”的豪言壮语,最能代表他对事功的向往和追求.然而日久而事功无多,便渐渐倾向恬退摘要:“搔首赋归欤,自觉功名懒更疏”;“几时归去,作个闲人.对一张琴,一壶酒,一溪云”.在经历了宦海浮沉之后,词人更体悟到仕途的曲折和险恶摘要:“三十三年,飘流江海,万里烟浪云帆.”其退隐的内在要求自然格外强烈.而一旦被朝廷“放归”却又想到功业未建不由慷慨悲歌起来摘要:“老去君恩未报,空回首,弹铗悲歌.”可见词人仍在出入之间徘徊.在词人看来,解决这一矛盾最好的办法是功成身退摘要:“何日功成名遂了,还乡”.
二、理想和现实.词人尽管怀抱着“致君尧舜”的理想,但现实却难尽如人意摘要:烦冗的宦务和频繁的调动使他身不由己摘要:“长恨此身非我的,何时忘却营营”;“人生底事,来往如梭”.他的飘泊感、沦落感、厌倦感也油然而生摘要:“生人到处萍飘泊”;“天边同是伤沦落”.乌台诗案,黄州及岭海两度流贬,都曾使词人的理想破碎,“宦游处,青山白浪,万重千迭”.词句饱含曲折和难言的苦衷!词人忽而迷惘摘要:“梧桐叶上三更雨,惊破梦魂无觅处”;忽而自嘲摘要:“三入承明,四至九卿,问书生、何辱何荣”;忽而负屈摘要:“问公何事,不语书空”;忽而沉痛摘要:“珠泪溅,丹衷碎”;这些都是由仕途的升沉不定所引发的.
词人从现实出发,走向理想的步履为什么那样艰难?一是朝廷党争的存在,各派彼此掣肘,互相攻讦,争斗不休,使苏轼难以大展经纶.二是宋王朝国力的贫弱,再加上国策的保守,决定了统治者不可能有大的作为,“道大难容,才高见嫉”(薛瑞生语)的苏轼的命运不问可知.
那么,如何解决理想和现实的种种矛盾?苏轼的回答大致是摘要:淡化功名意识;守着“用舍由时,行藏在我”的随机应变的人生哲学;抱定“乐天知命”的处世态度.
三、宇宙和人生.这是一个沉重的带有根本性的课题.“阆苑先生须自责,蟠桃动是千秋.不知人生苦厌求”.苏轼在带有神话色彩的奇想中触及了宇宙无穷和人生短暂的深刻矛盾.有见于此,他对于日居月诸时不我待异常敏感摘要:“人事凄凉,回首便他年”;“此生此夜不长好,明月明年何处看”.这种对于人生短促的慨叹,和其惜花伤春之词同样表现出对生命本体的忧思.但苏轼并非一味浩叹,他在《赤壁赋》中就从宏观的角度提出了一种达观的诠释摘要:“自其不变者而观之,则物和我皆无尽也”.他在词作中经常表现出对生活、对人生的热爱就和这种达观的态度相表里.
我以为东坡词中最值得关注的,还是那些富有积极思想意义的部分.表现为摘要:
对现实人生的热爱.这在前期的名作《水调歌头·明月几时有》词中表现得十分充分.即使词人身处逆境,我们仍能看到他积极进取的态度和乐观向上的精神摘要:“谁道人生无再少,门前流水尚能西,休将白发唱黄鸡”.还有更多的作品写对自然和人生的品味,尤其是像“忽然浪起,掀舞一叶白头翁”的潇洒;“殷勤昨夜三更雨,又得浮生一日凉”的欣慰,在逆境中仍能品出生活的甘美,不是同样显示了词人对现实生活的热爱吗?
在顺境中的淡泊.元丰末年至元年间,苏轼时来运转,甚至有过“未周岁而阅三宦”的殊遇.“人在玉堂深处”时,却怀念黄州东坡雪堂“手种堂前桃李,无限绿阴青子”;他还告诫自己说摘要:“居士,居士,莫忘小桥流水”(同前).元六年三月,将自杭州知州入为翰林学士承旨时作《八声甘州·寄参廖子》词,偏要表白自己摘要:“谁似东坡老,白首忘机.”苏轼这种在顺境中淡泊自守的品格难能可贵.
在逆境中的从容.作于黄州时期的《定风波·莫听穿林打叶声》便是一个显例.上片写途中遇雨时的情景摘要:“莫听穿林打叶声,何妨吟啸且徐行.竹杖芒鞋轻胜马,谁怕?一蓑烟雨任平生.”实际上,词人用象征手法写出自己在突如其来的政治风雨面前内心的坦荡和气度的从容.作于同一时期的《念奴骄·中秋》,则有着更为浓厚的浪漫主义色彩,词人的心灵仿佛是在“万里云无留迹”的“长空”中自由翱翔,忽而天上,忽而人间,“便欲乘风,翻然归去,何用骑鹏翼”三句,可算是在想象中灵魂向着“自由王国”的飞升.所以相对说来,此词更能表现词人精神的自由.毫无疑问,词人在逆境中的这些心态,都是经过自我调节的结果摘要:他已从一次次政治斗争的噩梦中醒来,惧怕、惊惶、困惑、委屈等已消解殆尽,这种在逆境中随遇自适的生活态度和精神状态是十分难得的.
面对境遇变化时的通达.这里说的是一种人生态度,也是一种思维方法.同是境遇变化时登楼,苏轼说摘要:“见说东园好,能消北客愁.虽非吾土且登楼.行尽江南南岸、此淹留.”而建安作家王粲则说摘要:“虽信美而非吾土兮,曾何足以淹留!”假如说后者表现的是一种情感,前者则是一种理智;后者是诗人的纯真,前者则是哲人的通达.苏轼谪居黄州时,效法陶渊明,躬耕东坡,似有无限快慰和满足摘要:“昨夜东坡春雨足,乌鹊喜,报新晴”.晚年远贬海南,艰苦备尝,九死一生,而笔下春景仍富有生气和活力摘要:“春牛春杖,无限春风来海上.便丐春工,染得桃红似肉红”.即此一端,亦可见词人确实做到了“此心安处是吾乡”.
东坡词所作的人生思索超出凡俗,一个重要的原因是作者汲取了儒释道三家思想的积极因素.儒家的入世和有为,引导他热爱生活和人生;道家的无为非凡是庄子的齐物论,又使他淡泊名利,在逆境中也显得从容自如;佛家的静达圆通,则启迪他走向圆融和通达.另一个重要原因,是作者对审美的人生境界的不懈追求,企图达到对人生功利境界的超越摘要:无论是春风自得,还是身处逆境,都是如此.
苏轼在其词作中表达的有关人生哲理的沉思,无疑体现了一种深切的人文关怀,能给后人以有益的启示以至精神的滋养.1年前查看全部
- 在开展研究性学习的过程中,某同学设计了一个利用线圈测量转轮转速的装置.如图所示,在轮子的边缘贴上小磁体,将小线圈靠近轮边
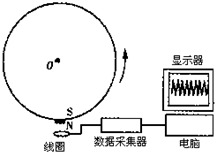 在开展研究性学习的过程中,某同学设计了一个利用线圈测量转轮转速的装置.如图所示,在轮子的边缘贴上小磁体,将小线圈靠近轮边放置,接上数据采集器和电脑(即DIS实验器材).如果小线圈的面积为S,圈数为N匝,小磁体附近的磁感应强度最大值为B,回路的总电阻为R,实验发现,轮子转过θ角,小线圈的磁感应强度由最大值变为零.因此,他说“只要测得此时感应电流的平均值I,就可以测出转轮转速的大小.”请你运用所学的知识,通过计算对该同学的结论作出评价.
在开展研究性学习的过程中,某同学设计了一个利用线圈测量转轮转速的装置.如图所示,在轮子的边缘贴上小磁体,将小线圈靠近轮边放置,接上数据采集器和电脑(即DIS实验器材).如果小线圈的面积为S,圈数为N匝,小磁体附近的磁感应强度最大值为B,回路的总电阻为R,实验发现,轮子转过θ角,小线圈的磁感应强度由最大值变为零.因此,他说“只要测得此时感应电流的平均值I,就可以测出转轮转速的大小.”请你运用所学的知识,通过计算对该同学的结论作出评价.  造孽中请勿打扰1年前1
造孽中请勿打扰1年前1 -
 冷宫雁 共回答了20个问题
冷宫雁 共回答了20个问题 |采纳率85%解题思路:由匀速圆周运动的基本性质,根据法拉第电磁感应定律,结合闭合电路欧姆定律,即可求解.该同学的结论是正确的.
设转轮的角速度、转速分别为ω、n,轮子转过θ角所需要时间为△t,通过线圈的磁通量的变化量为△∅,线圈中产生的感应电动势的平均值为E.
根据法拉第电磁感应定律,则有:E=N[△∅/△t]=N[BS/△t]
由闭合电路欧姆定律,则有:I=[E/R];
又△t=
θ
ω;
联立以上四式,解得:n=[IRθ/2πNBS];
答:由此可见,该同学的结论是正确的.点评:
本题考点: 法拉第电磁感应定律;闭合电路的欧姆定律.
考点点评: 考查匀速圆周运动的特性,掌握法拉第电磁感应定律与闭合电路欧姆定律的应用,注意转速与角速度的关系,是解题的关键.1年前查看全部
- (2012•宿州三模)某校一研究性学习小组对宿州市工薪阶层关于“楼市限购令”态度进行调查,随机抽调了50人,他们月收入频
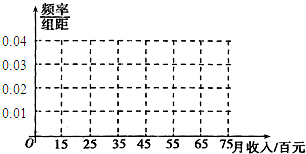 (2012•宿州三模)某校一研究性学习小组对宿州市工薪阶层关于“楼市限购令”态度进行调查,随机抽调了50人,他们月收入频数分布及对“楼市限购令”赞成人数如表:
(2012•宿州三模)某校一研究性学习小组对宿州市工薪阶层关于“楼市限购令”态度进行调查,随机抽调了50人,他们月收入频数分布及对“楼市限购令”赞成人数如表:
(Ⅰ)完成下面的月收入频率分布直方图及2×2列联表:月收入(单位:百元) [15,25) [25,35) [35,45) [45,55) [55,65) [65,75) 频数 5 10 15 10 5 5 赞成人数 4 8 12 5 3 1
(Ⅱ)若从月收入(单位:百元)在[15,25)和[65,75)内的被调查者中各随机选取1人进行跟踪调查,求选中的2人中至少有1人赞成“楼市限购令”的概率.月收入不低于55百元人数 月收入低于55百元人数 合计 赞成 a=______ c=______ ______ 不赞成 b=______ d=______ ______ 合计 ______ ______ ______  桔梗-J1年前0
桔梗-J1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高二(1)班的一个研究性学习小组在网上查知,某珍贵植物种子在一定条件下发芽成功的概率为[1/2],该研究性学习小组又分成
高二(1)班的一个研究性学习小组在网上查知,某珍贵植物种子在一定条件下发芽成功的概率为[1/2],该研究性学习小组又分成两个小组进行验证性实验.
(1)第1组做了5次这种植物种子的发芽实验(每次均种下一粒种子),求他们的实验至少有3次成功的概率;
(2)第二小组做了若干次发芽试验(每次均种下一粒种子),如果在一次实验中种子发芽成功就停止实验,否则将继续进行下次实验,直到种子发芽成功为止,但发芽实验的次数最多不超过5次,求第二小组所做种子发芽实验的次数X的概率分布列和期望. 雪花10061年前1
雪花10061年前1 -
 依依fa 共回答了21个问题
依依fa 共回答了21个问题 |采纳率85.7%解题思路:(1)由题设条件知,种下5粒种子至少有3次成功的概率相当于5次独立重复试验中恰好发生三次、四次、五次的概率.至少有3次成功的概率等于3次、4次、5次发芽成功的概率之和.
(2)ξ的所有可能值为0,1,2,3,4,5分别求其概率,列出分布列,再求期望即可.(1)至少有3次发芽成功,即有3次、4次、5次发芽成功,
所以所求概率P=
C35(
1
2)5+
C45(
1
2)5+
C55(
1
2)5=
1
2
(2)X的概率分布列为
X 1 2 3 4 5
P [1/2] [1/4] [1/8] [1/16] [1/16]所以 E(X)=1×
1
2+2×
1
4+3×
1
8+4×
1
16+5×
1
16=
31
16点评:
本题考点: 离散型随机变量的期望与方差;n次独立重复试验中恰好发生k次的概率;离散型随机变量及其分布列.
考点点评: 本题考查n次独立重复试验中恰好发生k次的概率,考查离散型随机变量的分布列、期望、独立重复试验的概率等知识,解题时要认真审题,仔细解答,注意解题公式的灵活运用.1年前查看全部
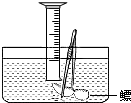
- 小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅
小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A:在水下刺破鳔,用排水集气法收集鳔内气体并测量其体积(如右图).
B:用医用注射器抽取鳔内气体,测量其体积;
你认为这两种方法中不合理的是______(填A或B),理由:______.写出与理由相关的化学方程式______.
(2)探究鳔内气体的成分.给你几瓶装有鳔内气体的集气瓶,请你帮助他设计实验验证假设.
方 法 现 象 验证鳔内含O 2 ______ ______ 
 liujin502936361年前1
liujin502936361年前1 -
 来去今生 共回答了27个问题
来去今生 共回答了27个问题 |采纳率88.9%(1)二氧化碳溶于水,不能用排水法收集.
故选A、二氧化碳可溶于水,会造成测量结果偏小、CO 2 +H 2 O═H 2 CO 3 .
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧.
故答:将燃着的木条伸入瓶内;木条能继续燃烧.1年前查看全部
- 小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅
小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占[1/4],其余主要是二氧化碳和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A:用医用注射器抽取鳔内气体,测量其体积;
B:在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
你认为这两种方法中不合理的是______,理由:______.
写出与理由相关的化学方程式______.
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设.方法 现象 验证鳔内含O2 ______ ______ 验证鳔内含CO2 ______ ______  tangqunyun1年前1
tangqunyun1年前1 -
 深圳的月影沙丘 共回答了21个问题
深圳的月影沙丘 共回答了21个问题 |采纳率95.2%解题思路:(1)熟悉一些重要气体的性质,二氧化碳溶于水,与水发生反应,产物是碳酸,不适合用排水法收集;
(2)根据氧气能助燃,可以用带火星的木条进行检验;二氧化碳可以使澄清石灰水变浑浊.(1)二氧化碳溶于水,不能用排水法收集.
故答案为:B;二氧化碳可溶于水,鳔内的二氧化碳气体能溶于水,收集的气体体积比实际体积小; CO2+H2O═H2CO3
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧;二氧化碳可以使澄清石灰水变浑浊.
故答案为:
实验目的方法现象
验证鳔内含O2将燃着的木条放入含有鱼鳔内气体的集气瓶中木条能继续燃烧
验证鳔内含CO2 在含有鱼鳔内气体的集气瓶中加入少量的澄清石灰水石灰水变浑浊点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 做有关气体方面的题时,一定要想到气体的性质.在检验气体时要注意检验气体的先后顺序,以防出错.1年前查看全部
- 某中学历史兴趣小组在进行研究性学习时,搜集到以下四幅图片。据此判断,他们研究的主题最有可能是
某中学历史兴趣小组在进行研究性学习时,搜集到以下四幅图片。据此判断,他们研究的主题最有可能是

a.“冷战”下的世界 b.***博弈下的国际关系 c.第三世界的兴起 d.***主义的发展壮大  1000亿1年前1
1000亿1年前1 -
 温柔残缺 共回答了23个问题
温柔残缺 共回答了23个问题 |采纳率87%A
1年前查看全部
- (2011•江苏一模)实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习
(2011•江苏一模)实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气.供选用的实验试剂及装置如下(部分导管、蒸馏水略):
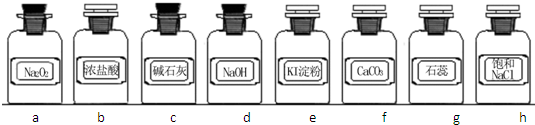
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2ONa2O2+4HCl=2NaCl+Cl2↑+2H2O.
(2)下列装置组合最合理的是DD(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑)2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑).组合 制备装置 净化装置 检验装置/试剂 尾气处理装置 A ③ ② ⑦/e ⑤ B ③、⑥ ① ⑧/g ① C ④ ① ⑤/e ② D ④、⑥ ⑤ ⑧/g ①
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济双氧水比Na2O2更经济.
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否否(填“是”或“否”);
理由是产物不纯且难以分离产物不纯且难以分离. 不可不不戒1年前1
不可不不戒1年前1 -
 容瑶 共回答了24个问题
容瑶 共回答了24个问题 |采纳率83.3%(1)过氧化钠有强氧化性能把浓盐酸氧化生成氯气,同时自身被还原生成水,结合原子守恒写出其反应方程式为:Na2O2+4HCl=2NaCl+Cl2↑+2H2O,
故答案为:Na2O2+4HCl=2NaCl+Cl2↑+2H2O;
(2)用过氧化钠和浓盐酸制取氯气,反应物状态是固液混合,所以盛放液体用分液漏斗,易控制流量,浓盐酸挥发性较强,所以要采用密封装置,防止其挥发,利用产生气体的压强时盐酸流下,所以反应装置选④⑥;
浓盐酸具有挥发性,所以产生的气体中含有氯化氢,用饱和食盐水洗气,为防止洗气瓶内压强过大,应有一个缓冲装置,故选⑤;
用淀粉碘化钾溶液检验氯气,故选⑧;
氯气有毒不能直接排空,应该用氢氧化钠溶液吸收尾气,且尾气量较少,不需要缓冲装置即可,故选①,
故答案为:D;
(3)过氧化钠极易和水反应生成氧气,过氧化钠也能把浓盐酸氧化生成氯气,自身被还原为氧气,所以制取的气体中可能含有氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑),
故答案为:2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑);
(4)从原料的利用率、成本、过氧化钠的性质及生成气体的性质来来考虑,所以其理由是:①Na2O2能与水反应,会使原料的利用率降低;②双氧水比Na2O2更经济;③产生等量的Cl2,用双氧水消耗的盐酸的量少;④Na2O2能与水反应,生成的NaOH能与盐酸反应;⑤Na2O2能与水反应,生成的NaOH吸收了Cl2,
故答案为:①Na2O2能与水反应,会使原料的利用率降低;②双氧水比Na2O2更经济;③产生等量的Cl2,用双氧水消耗的盐酸的量少;④Na2O2能与水反应,生成的NaOH能与盐酸反应;⑤Na2O2能与水反应,生成的NaOH吸收了Cl2;
(5)过氧化钠具有强氧化性,能把浓盐酸氧化生成氯气,自身被还原生成氧气,且过氧化钠和水反应也生成氧气,氯气和氧气混合后不易分离,所以得不到较纯净的氯气,故答案为:否;产物不纯且难以分离.1年前查看全部
- 大菱鲆是我国重要的海水经济鱼类.研究性学习小组尝试对大菱鲆消化道中的蛋白酶的活性进行研究.
大菱鲆是我国重要的海水经济鱼类.研究性学习小组尝试对大菱鲆消化道中的蛋白酶的活性进行研究.
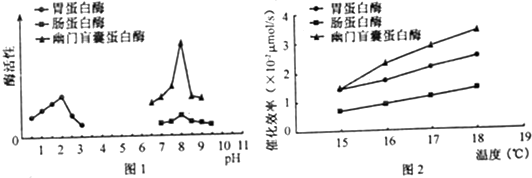
(1)查询资料得知,18℃时,在不同pH条件下大菱鲆消化道各部位蛋白酶活性如图1.由图可知,在各自最适pH下,三种蛋白酶催化效率最高的是______.
(2)资料表明大菱鲆人工养殖温度常年在15-18℃之间,学习小组假设:大菱鲆蛋白酶的最适温度在15-18℃间.他们设置15℃、16℃、17℃、18℃的实验温度,探究三种酶的最适温度.
①该实验的自变量为______,因变量是______,无关变量有______、______等.
②探究试验中以干酪素为底物.干酪素的化学本质是______,可用______试剂鉴定.
③胃蛋白酶实验组和幽门盲囊蛋白酶实验组的pH应分别控制在______.
④常用“单位时间内______”表示蛋白酶催化效率.
⑤实验结果如图2,据此能否确认该假设成立?______.理由是:______. bjpulmc20011年前1
bjpulmc20011年前1 -
 tyyjr 共回答了11个问题
tyyjr 共回答了11个问题 |采纳率81.8%解题思路:根据题意和图示分析可知:图1中:胃蛋白酶、肠蛋白酶和幽门盲囊蛋白酶的最适pH依次是2、8、8,在各自的最适pH值下,幽门盲囊蛋白酶对应的酶活性值最大,催化效率最高.
图2中:温度在15-18℃间,胃蛋白酶、肠蛋白酶和幽门盲囊蛋白酶的活性都随着温度的升高而增强.(1)从图一可以直接看出,在各自的最适pH值下,幽门盲囊蛋白酶对应的酶活性值最大,所以催化效率最高.
(2)①该实验的自变量为反应温度、蛋白酶的种类,因变量是酶活性/催化效率,无关变量有酶的剂量、反应的pH值等.
②酶具有专一性,蛋白酶只能催化蛋白质的水解,干酪素为蛋白质类化合物,可用双缩脲试剂检测.
③在研究温度对酶活性的影响的实验中,温度为自变量,pH值等位无关变量,为了使实验效果更佳明显PH值应调至最适PH值,胃蛋白酶最适PH值为2和幽门盲囊蛋白酶最适PH值为8.
④为了控制实验温度,装有酶底物的试管应置于水浴中以保持恒温.可以用单位时间内底物消耗量或产物生成量表示蛋白酶催化效率的高低.
⑤在最适温度之前酶的活性随温度提高逐步升高,超过最适温度之后酶的活性随温度提高逐步下降,而图中酶活性随温度提高逐步升高,酶活性峰值未出现,所以不能判断大菱鲆蛋白酶的最适温度在15-18℃间;大菱鲆消化道淀粉酶和脂肪酶含量少、活性低,如果饲料中含有大量的淀粉和脂肪就不能被分解,就会直接排放到海洋里,使得海洋里的有机质增加,从而造成海洋的污染.
故答案为:
(1)幽门盲囊蛋白酶
(2)①反应温度、蛋白酶的种类 酶活性/催化效率酶的剂量、反应的pH值
②蛋白质双缩脲
③2左右和8左右
④反应物的消耗量/生成物的生成量
⑤不能 据图可知酶活性随温度提高逐步升高,酶活性峰值未出现点评:
本题考点: 探究影响酶活性的因素.
考点点评: 本题主要考查酶的本质、检测和影响酶活性的因素等及探究实验中无关变量的处理、因变量的观测、实验结果和结论的处理、曲线的分析等.属于对理解、应用层次的考查.1年前查看全部
- 研究性学习小组的同学对某Cu-Zn合金中的金属含量进行实验测定.准确称取该合金10.0g 放入容器中,把45.0g
研究性学习小组的同学对某Cu-Zn合金中的金属含量进行实验测定.准确称取该合金10.0g 放入容器中,把45.0g
某稀硫酸分散系加入,使之充分反应,所得数据如下表:
序号 第一次 第二次 第三次
加入稀硫酸质量/g 15.0 15.0 15.0
剩余固体质量/g 9.2 m 8.05
(1)上表中的m的数值为____.(2)合金中铜的质量分数为_____
(3) 整个实验过程中产生了氢气多少克?
(4)稀硫酸的溶质质量分数是多少? gys20042911年前1
gys20042911年前1 -
 hxr6382525wsw 共回答了22个问题
hxr6382525wsw 共回答了22个问题 |采纳率86.4%(1)由于第一次加入稀硫酸后质量减少了10.0g-9.2g=0.8g,
第三次加入稀硫酸之后减少了10.0-8.05g=1.95g>0.8g*2
所以第二次加入稀硫酸时锌没有被完全反应完.所以第二次加入时质量应该减少两倍的0.8g
m=10.0g-0.8g*2=8.4g
由于第三次加入稀硫酸之后质量减少<0.8g*3
所以第三次加入稀硫酸时锌全部反应完,剩余固体的质量为铜
铜的质量分数为8.05g/10.0g*100%=80.5%
(2)Zn+H2SO4===ZnSO4+H2(向上箭头)
65 2
10.0g-8.05g x=0.06g
(3)Zn+H2SO4===ZnSO4+H2(向上箭头)
65 98
0.8g x*15g
x=8.04%1年前查看全部
- 下图是某同学在研究性学习中使用的一幅图片。据图片内容判断,他研究的主题是 [
下图是某同学在研究性学习中使用的一幅图片。据图片内容判断,他研究的主题是 
[ ]
A.第一次世界大战
B.第二次世界大战
C.当前世界战争形势
D.科索沃战争形势 我爱QQ秀1年前1
我爱QQ秀1年前1 -
 珊ㄡ珊 共回答了24个问题
珊ㄡ珊 共回答了24个问题 |采纳率95.8%C1年前查看全部
- 高二年级的一个研究性学习小组在网上查知,某珍贵植物种子在一定条件下发芽成功的概率为 ,该研究性学习小组又分成两个小组进行
高二年级的一个研究性学习小组在网上查知,某珍贵植物种子在一定条件下发芽成功的概率为
 ,该研究性学习小组又分成两个小组进行验证性实验.
,该研究性学习小组又分成两个小组进行验证性实验.
(1)第1组做了5次这种植物种子的发芽实验(每次均种下一粒种子),求他们的实验至少有3次成功的概率;
(2)第二小组做了若干次发芽试验(每次均种下一粒种子),如果在一次实验中种子发芽成功就停止实验,否则将继续进行下次实验,直到种子发芽成功为止,但发芽实验的次数最多不超过5次,求第二小组所做种子发芽实验的次数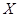 的概率分布列和期望.
的概率分布列和期望. 飘零之叶1年前1
飘零之叶1年前1 -
 asdfghejkgrth 共回答了17个问题
asdfghejkgrth 共回答了17个问题 |采纳率88.2%1年前查看全部
- 下列哪一项不是研究性学习的方法() A.分析资料法 B.调查法 C.谈话法 D.实验法
 悦月1年前1
悦月1年前1 -
 kjaux 共回答了21个问题
kjaux 共回答了21个问题 |采纳率90.5%C不是,那个叫什么忘了……1年前查看全部
- 两位同学在展开研究性学习时,做了一个十分有趣的实验,装置如右图所示,在两只烧杯A、B中分别
两位同学在展开研究性学习时,做了一个十分有趣的实验,装置如右图所示,在两只烧杯A、B中分别
盛有酱色溶液和无色溶液,小木块上各有一支点燃的蜡烛,向A杯中的酱色溶液撒入白色粉末后,发现烧杯中的蜡烛会熄灭;向B杯无色溶液中撒入黑色粉末后,发现烧杯里的蜡烛燃烧得更旺.根据上述现象,你认为A烧杯中的酱色溶液是?撒入的白色粉末是?B烧杯中的无色溶液是?撒入的黑色粉末是? 夜影魅影1年前1
夜影魅影1年前1 -
 无心喃喃 共回答了24个问题
无心喃喃 共回答了24个问题 |采纳率100%酱色溶液是食醋,
撒入的白色粉末是碳酸钠
无色溶液是过氧化氢溶液
撒入的黑色粉末是二氧化锰1年前查看全部
- 李明同学家中原来是用燃气热水器烧水,通过在学校参加“研究性学习”的活动后,在老师的指导和同学们的帮助下,制作了一台简易的
李明同学家中原来是用燃气热水器烧水,通过在学校参加“研究性学习”的活动后,在老师的指导和同学们的帮助下,制作了一台简易的太阳能热水器,在夏天,这台热水器每天可使60Kg的水温由20度升高到70度
求:①这些水在这个过程中吸收了多少热量?
②若燃气热水器所用的液化石油气的热值为8.4×10的7次方J/KG,改用太阳能热水器,每天可以节省多少KG液化石油气 易惊人1年前1
易惊人1年前1 -
 奇迹海 共回答了18个问题
奇迹海 共回答了18个问题 |采纳率94.4%①
=(70-20)× 水的比热容 × 60Kg
②
=①的答案 除于 8.4×10的7次方J/KG
初中物理?1年前查看全部
- (2012•福建)某同学在一次研究性学习中发现,以下五个式子的值都等于同一个常数.
(2012•福建)某同学在一次研究性学习中发现,以下五个式子的值都等于同一个常数.
(1)sin213°+cos217°-sin13°cos17°
(2)sin215°+cos215°-sin15°cos15°
(3)sin218°+cos212°-sin18°cos12°
(4)sin2(-18°)+cos248°-sin2(-18°)cos48°
(5)sin2(-25°)+cos255°-sin2(-25°)cos55°
(Ⅰ)试从上述五个式子中选择一个,求出这个常数
(Ⅱ)根据(Ⅰ)的计算结果,将该同学的发现推广为三角恒等式,并证明你的结论. afight1年前1
afight1年前1 -
 chenlan716 共回答了12个问题
chenlan716 共回答了12个问题 |采纳率91.7%值是3/4 从sin215°+cos215°-sin15°cos15°式子中可获得
之后把式子打开,转化为同角关系作1年前查看全部
- 在研究性学习中,某同学设计了一个测定带电粒子比荷的实验,其实验装置如图所示.abcd是一个长方形盒子,在ad边和cd边上
在研究性学习中,某同学设计了一个测定带电粒子比荷的实验,其实验装置如图所示.abcd是一个长方形盒子,在ad边和cd边上各开有小孔f和e,e是cd边上的中点,荧光屏M贴着cd放置,能显示从e孔射出的粒子落点位置.盒子内有一方向垂直于abcd平面的匀强磁场,磁感应强度大小为B.粒子源不断地发射相同的带电粒子,粒子的初速度可忽略.粒子经过电压为U的电场加速后,从f孔垂直于ad边射入盒内.粒子经磁场偏转后恰好从e孔射出.若已知fd=cd=L,不计粒子的重力和粒子之间的相互作用力.请你根据上述条件求出带电粒子的比荷q/m.
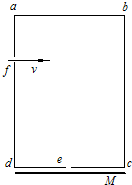
 uu光1年前0
uu光1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在研究性学习中,某同学设计了一个测定带电粒子比荷的实验,其实验装置如图所示.abcd是一个长方形盒子,在ad边和cd边上
在研究性学习中,某同学设计了一个测定带电粒子比荷的实验,其实验装置如图所示.abcd是一个长方形盒子,在ad边和cd边上各开有小孔f和e,e是cd边上的中点,荧光屏M贴着cd放置,能显示从e孔射出的粒子落点位置.盒子内有一方向垂直于abcd平面的匀强磁场,磁感应强度大小为B.粒子源不断地发射相同的带电粒子,粒子的初速度可忽略.粒子经过电压为U的电场加速后,从f孔垂直于ad边射入盒内.粒子经磁场偏转后恰好从e孔射出.若已知fd=cd=L,不计粒子的重力和粒子之间的相互作用力.请你根据上述条件求出带电粒子的比荷q/m.
 脑力劳动1年前0
脑力劳动1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 石灰石是我省的主要矿产之一.我校研究性学习小组为了测定某市矿山石灰石中碳酸钙
 p1681年前1
p1681年前1 -
 yjp309573588 共回答了29个问题
yjp309573588 共回答了29个问题 |采纳率82.8%(1)3,4反应中碳酸钙的盈余
(2)上表中的m值是4.4
==碳酸钙+2盐酸氯化钙+ H2O + CO2↑
44 > X3.52克
四十四分之一百= x/3.52g
X =8克
质量的碳酸钙石灰石部分8g/10g×100%= 80%1年前查看全部
- 研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
A. 0.448L
B. 2.240L
C. 2.016L
D. 无法确定 zewssrvi1年前1
zewssrvi1年前1 -
 hotcrazy 共回答了13个问题
hotcrazy 共回答了13个问题 |采纳率100%解题思路:KMnO4中Mn是+7价的Mn,具有强氧化性,锰化合物的还原产物都是MnCl2,1mol得到5mol电子,6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体为氧气,KMnO4中O为-2价,生成1个O2失去4个电子.根据氧化还原反应的得失电子守恒规律,KMnO4中Mn得到的电子总数,等于KMnO4中O失去的电子总数与浓盐酸中氯离子失去电子变为氯气失去的电子总数之和.6.32gKMnO4的物质的量n=[m/M]═[6.32g/158g/mol]=0.04mol,0.112LO2的物质的量=[V/Vm]=[0.112L/22.4L/mol]=0.005mol
得到的电子:KMnO4~5e-~Mn2+,K2MnO4~4e-~Mn2+,MnO2~2e-~Mn2+,
失去的电子:2Cl-~2e-~Cl2,2O~4e-~O2,
根据电子守恒计算:
n(KMnO4)×5e-=n(O2)×4e-+n(Cl2)×2e-
0.04mol×5e-=0.005mol×4e-+n(Cl2)×2e-
n(Cl2)=0.09mol
所以生成的氯气标准状况下的体积V(Cl2)=n×Vm=0.09mol×22.4L/mol=2.016L.
故选C.点评:
本题考点: 氯气的实验室制法.
考点点评: 该题主要考查了氧化还原反应的电子守恒的计算应用,做题时,一定要理清化合价变化的元素,在反应物和相应产物的化合价.1年前查看全部
- 某中学历史课在进行“古希腊民主制度产生原因”的研究性学习时,下列材料能够作为其有力证据的是
某中学历史课在进行“古希腊民主制度产生原因”的研究性学习时,下列材料能够作为其有力证据的是
①古希腊地图②爱琴海地区贸易图③雅典城邦居民的构成④刻有放逐人员名字的陶片[ ]A.①②③
B.①②④
C.①②③④
D.②③④ kanexx1年前1
kanexx1年前1 -
 shelly0809 共回答了19个问题
shelly0809 共回答了19个问题 |采纳率89.5%A1年前查看全部
- 某中学一个研究性学习小组对“一定质量的某气体在体积不变的情况下,压强随温度变化的规律”进行了研究,下表是实验的一组记录数
某中学一个研究性学习小组对“一定质量的某气体在体积不变的情况下,压强随温度变化的规律”进行了研究,下表是实验的一组记录数据,分析表中数据可知,该气体的压强与温度的关系式为 _________.
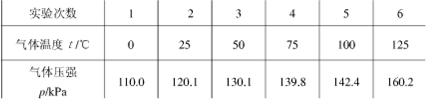
 豆豆宝1年前1
豆豆宝1年前1 -
 蜡笔小屋 共回答了10个问题
蜡笔小屋 共回答了10个问题 |采纳率90%1、以温度为x轴,压强为y轴,根据上表画出6次试验的p-t曲线,舍去偏差过大的p-t点(142.4,100)可列出关系式
p=110+0.4t(01年前查看全部
- 下图是一位同学在研究性学习中使用的一幅地图。据此图阴影部分判断,这位同学的研究课题最有可能是
下图是一位同学在研究性学习中使用的一幅地图。据此图阴影部分判断,这位同学的研究课题最有可能是

a.******道路的创立 b.敌后***根据地的发展 c.人民***战略决战 d.对外开放新格局的形成  爱为谁1年前1
爱为谁1年前1 -
 bjhjsm 共回答了16个问题
bjhjsm 共回答了16个问题 |采纳率100%A
1年前查看全部
- 根号2的产生这是我们高中新课改开研究性学习的数学调查.也就是2的平方根是怎样产生的?还有无理数是怎样产生的?
 莹雪含笑1年前4
莹雪含笑1年前4 -
 灰灰的宠物 共回答了19个问题
灰灰的宠物 共回答了19个问题 |采纳率89.5%什么叫“怎样产生的”?世界原本如此。1年前查看全部
- 研究性学习体会 作文
 join681年前1
join681年前1 -
 wwwggg68 共回答了22个问题
wwwggg68 共回答了22个问题 |采纳率95.5%我们课题组本次研究性学习的课题是——饮食与健康。
通过这次活动,我知道了许多关于偏食、偏食的成因及其纠正办法等方面的知识,更锻炼了我的组织能力和口语交际能力。我觉得学校开展此项活动很好,不仅增长了我们的课外知识、开拓了我们的视野,更使我懂得了如何与人交往、与人沟通。此次课题研究的成果是我们全体成员共同努力的结果,因此,我们更需要有良好的团队精神。本次活动还让我接触了电脑,知道了电脑具有重要的用途,比如:网上查找资料、编辑和打印文件等……偏食对人体的危害的确很多,这些危害在我们的研究成果中已经说得很具体了,我们进行这个课题研究的主要目的就是让大家充分认识到偏食对人体具有极大的危害,要求大家饮食要全面、营养要丰富,要保证我们的身体健康,为我们今后的学习创造良好的身体条件。我希望我们学校能够多开展这样的活动,让我们增长知识、开拓视野,增强认识和解决问题的能力,为我们明天的成长打下坚实的基础。
1年前查看全部
- (2005•安徽)小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的
 (2005•安徽)小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
(2005•安徽)小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A:在水下刺破鳔,用排水集气法收集鳔内气体并测量其体积(如右图).
B:用医用注射器抽取鳔内气体,测量其体积;
你认为这两种方法中不合理的是AA(填A或B),理由:二氧化碳可溶于水,会造成测量结果偏小二氧化碳可溶于水,会造成测量结果偏小.写出与理由相关的化学方程式CO2+H2O═H2CO3CO2+H2O═H2CO3.
(2)探究鳔内气体的成分.给你几瓶装有鳔内气体的集气瓶,请你帮助他设计实验验证假设.
方 法 现 象 验证鳔内含O2  朱家小妹1年前1
朱家小妹1年前1 -
 306543503 共回答了17个问题
306543503 共回答了17个问题 |采纳率100%解题思路:熟悉一些重要气体的性质,二氧化碳溶于水,不适合用排水法收集;氧气能助燃,可以用带火星的木条进行检验;二氧化碳可以使澄清石灰水变浑浊.(1)二氧化碳溶于水,不能用排水法收集.
故选A、二氧化碳可溶于水,会造成测量结果偏小、CO2+H2O═H2CO3.
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧.
故答:将燃着的木条伸入瓶内;木条能继续燃烧.点评:
本题考点: 常用气体的收集方法;化学实验方案设计与评价;氧气的检验和验满;二氧化碳的检验和验满;二氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 做有关气体方面的题时,一定要想到气体的性质.在检验气体时要注意检验气体的先后顺序,防止出现差错.1年前查看全部
- 高一数学某校学生研究性学习小组发现,学生上课的注意力指标随着听课时间的变化而变化.老
高一数学某校学生研究性学习小组发现,学生上课的注意力指标随着听课时间的变化而变化.老
某校学生研究性学习小组发现,学生上课的注意力指标随着听课时间的变化而变化.老
师讲课开始时学生的兴趣激增,接下来学生的兴趣将保持较理想的状态一段时间,随后
学生的注意力开始分散.该小组发现注意力指标
f(t)= 100a^(1/10)-60 (0 娃哈哈k171年前1
娃哈哈k171年前1 -
 小良L 共回答了15个问题
小良L 共回答了15个问题 |采纳率93.3%1.
t=5,在第一个函数中有
100*a^(1/10)-60=140
a^(1/10)=2
取对数得loga^(1/10)=log2
loga /10=log2
loga=10log2=log2^10
a=2^10=1024
2.上已经说了课前5分钟为140,下课前的为第三个函数,代入得
t=35,-15*35+640=115.所以上课前的更集中.
3.
首先,在(0,10)这10分钟都是140.然后当t>10时,它的值为340,当然也属于大于140.
然后在20-40中.我们只需要让它的值>140即可
有-15t+640>140
-15t>-500
t1年前查看全部
- (2002•呼和浩特)某课外小组为研究钢铁制品生锈的条件,进行了研究性学习.他们准备了以下实验用品:刚洗净的四只试管、3
(2002•呼和浩特)某课外小组为研究钢铁制品生锈的条件,进行了研究性学习.他们准备了以下实验用品:刚洗净的四只试管、3枚铁钉、植物油、久置的蒸馏水、镊子、滤纸,还需要的试验用品为______.
做实验时,发现铁钉上有锈,为了迅速除去铁锈,他们进行了下述实验操作:
①取一支试管,将生锈的铁钉放入试管中;②向试管中倒入2 mL稀盐酸;③用试管夹夹持试管,在酒精灯上加热;④当铁钉上的锈消失并变得光亮时,将试管中的废液倒入废液缸中;⑤用镊子夹取铁钉,并用蒸馏水冲洗干净,在酒精灯外焰上烘干铁钉.
(1)你认为上述操作中存在的问题是什么?应该怎么做?
(2)除了给铁钉除锈外,上述给出的实验用品还有哪些操作不符合实验要求?应该怎样处理? 亲亲131年前1
亲亲131年前1 -
 孤竹逸民 共回答了17个问题
孤竹逸民 共回答了17个问题 |采纳率82.4%解题思路:本题是一道研究学习性质的实验题,根据钢铁生锈的两个条件:一要有水蒸气存在;二要与氧气接触.可设计实验为:取三支试管分别放入铁钉,第一枚铁钉既与水接触,又与空气接触;第二枚只与水接触;第三枚只与空气接触.其中第二枚铁钉为隔绝空气,需要在水面上覆盖植物油,第三枚铁钉为放在干燥的试管中密封装置,因此需要橡皮塞.另外,除锈时,夹持试管需要试管夹;加热需要酒精灯、火柴.
(1)上述实验中的⑤操作不对,在烘干情况下可能会反应,影响下一步的实验分析.
(2)由于久置的蒸馏水中会溶有氧气,将影响实验效果,需煮沸除去溶解氧气.刚洗净的试管,内壁有残留水.铁钉为放在干燥的试管中密封装置,因此需要橡皮塞;除锈时,夹持试管需要试管夹;加热需要酒精灯、火柴.
故答案为:胶塞、试管夹、酒精灯、火柴
(1)除锈后用蒸馏水冲洗过的铁钉没有擦拭,直接放在酒精灯上加热为一处错误.故答案为:除锈后用蒸馏水冲洗过的铁钉,不能在酒精灯上烘干;应该用滤纸吸干铁钉表面的水.
(2)由于久置的蒸馏水中会溶有氧气,提供的试管全部是刚洗净的试管,内壁残留水分,不符合实验要求.故答案为:久置的蒸馏水中溶有氧气,应该煮沸后使用;本实验需要一支干燥的试管,刚洗净的试管应该用酒精灯烘干.点评:
本题考点: 探究金属锈蚀的条件;实验操作注意事项的探究;给试管里的液体加热.
考点点评: 本实验题要紧扣反应实质来分析,铁生锈要与空气和水接触,在探究反应实质时要特别注意排除干扰因素.如本题久置的蒸馏水(溶解了氧气)、刚洗净的试管(内壁有水)都会影响我们的实验分析.1年前查看全部
- “西气东输”工程使小军同学家里用上了清洁的天然气.最近爸爸又买回了一只电磁炉.在一次研究性学习活动中,他选择了“比较天然
“西气东输”工程使小军同学家里用上了清洁的天然气.最近爸爸又买回了一只电磁炉.在一次研究性学习活动中,他选择了“比较天然气炉与电磁炉烧水的效率”的课题.他首先收集了有关信息:天然气的热值q(单位为J/m3);电磁炉的额定电压为220V、额定功率为P(单位为w).天然气的消耗量可以从天然气表上读出(单位为m3).
(1)请你自选实验器材帮小军设计一个实验方案,比较天然气炉与电磁炉烧水的效率,
写出实验的主要步骤及需要测量的物理量(用相应的字母表示).
(2)分别写出天然气炉与电磁炉烧水效率的表达式.(假设天然气完全燃烧,且放出热量的计算公式是Q=qV,式中V表示气体燃料的体积) vivian4u4u1年前1
vivian4u4u1年前1 -
 Miss尾戒 共回答了15个问题
Miss尾戒 共回答了15个问题 |采纳率100%解题思路:此题考查学生对效率概念的理解,实验设计的能力,以及有关热量的计算.(1)①用天平分别称出两份质量、初温均相同的水,分别放到两只相同的水壶中(水的质量记为m,用温度计测出水的初温记为t0;
②把两壶水在相同环境下分别放到天然气炉和电磁炉上烧开,用温度计测出它们的末温均为t1,用计时器记录电磁炉烧开水的时间t,从天然气表上读出天然气消耗的体积V.
(2)天然气炉烧水效率的表达式是η1=
cm(t1−t0)
qV;
电磁炉烧水的效率表达式是η2=
cm(t1−t0)
Pt.点评:
本题考点: 能量利用效率.
考点点评: 本题信息量大,运用到的知识内容多,公式多,要求学生要熟练掌握并运用到具体的问题中.1年前查看全部
- (2007•上海模拟)某中学的一个研究性学习小组共有10名同学,其中男生n名(2≤n≤9),现从中选出2人参加一项调查活
(2007•上海模拟)某中学的一个研究性学习小组共有10名同学,其中男生n名(2≤n≤9),现从中选出2人参加一项调查活动,若至少有一名女生去参加的概率为[2/3],则n=______.
 无敌大飞哥1年前1
无敌大飞哥1年前1 -
 洪学远 共回答了19个问题
洪学远 共回答了19个问题 |采纳率89.5%事件“至少有一名女生参加”对立事件是“没有女生”
总的取法种数是C102=45
事件“没有女生”所包含的基本事件数是Cn2=
n(n−1)
2
又至少有一名女生参加的概率为 [2/3],
故有1-
n(n−1)
2
45=[2/3],
解得n=6
故答案为61年前查看全部
- 在研究性学习中,有一组同学设计了“测定斜面的机械效率”的实验.
在研究性学习中,有一组同学设计了“测定斜面的机械效率”的实验.
如图所示,用高为30cm的木块将带有刻度的平木板垫起,构成一个斜面,并使它固定,把小车放在斜面底端A,用弹簧测力计拉着小车从位置A沿斜面匀速上升到B位置,上升过程中弹簧测力计的示数如图所示.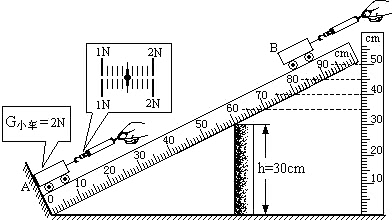
(1)根据题中提供的信息,在下面的实验记录表格中完成相关的内容:
(2)根据以上的实验记录,完成下列计算:小车的重力G/N 沿斜面的拉力F/N 小车沿斜面上升的距离L/m 小车上升高度h/m 2 0.8
拉力F在这过程中做的有用功是:______;
拉力F在这过程中做总功是:______;
该次实验的机械效率是:______. 唐朝汉朝1年前1
唐朝汉朝1年前1 -
 xiaowangchai 共回答了25个问题
xiaowangchai 共回答了25个问题 |采纳率88%(1)拉力F=1N+0.5N=1.5N,小车上升的高度就是斜面80cm处所对应的垂直高度,应为45cm;
(2)有用功:W 有 =Gh=2N×0.45m=0.9J;总功:W 总 =FL=1.5N×0.8m=1.2J;机械效率:η=
W 有
W 总 =
0.9J
1.2J =75%.
故答案为:(1)见下表.
小车的重力G/N 沿斜面的拉力F/N 小车沿斜面上升的距离L/m 小车上升高度h/m
2 1.5 0.8 0.45 (2)0.9J,1.2J,75%.1年前查看全部
- 某历史兴趣小组在开展研究性学习时收集了亚历山大东征、丝绸之路、马可·波罗来华等素材,请你判断他们的研究主题是 A.帝国的
某历史兴趣小组在开展研究性学习时收集了亚历山大东征、丝绸之路、马可·波罗来华等素材,请你判断他们的研究主题是
A.帝国的扩张与崛起 B.中外经济文化交流 C.文明的冲撞与融合 D.中华文化的吸引力  leiliangsi1年前1
leiliangsi1年前1 -
 lvzs 共回答了11个问题
lvzs 共回答了11个问题 |采纳率90.9%C
本题考查的是中外文明之间的交流和冲突,题目中的亚历山大东征是冲突的体现,丝绸之路是文化交流的产物等,所以选择C项,B不符合东征这一事件D没有侧重表现中华的文明的吸引力A不能体现丝绸之路。1年前查看全部
- 研究性学习小组就测定空气中氧气的含量进行实验探究:
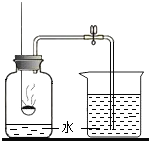 研究性学习小组就测定空气中氧气的含量进行实验探究:
研究性学习小组就测定空气中氧气的含量进行实验探究:
[集体讨论](1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体.他们应该选择______(填编号)
A.蜡烛B.红磷C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证______.
(2)小组同学共同设计了如图装置,为了确保实验的成功,在装药品之前应该______.
[分组实验]在讨论的基础上,他们分组进行了实验.
[数据分析]实验结束后,整理数据如下:(注:集气瓶容积为100mL)
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的组别 1 2 3 4 5 6 进入集气瓶中水的体积(mL) 20 21 19 20 22 18 [1/5][1/5].通过实验还可以推断集气瓶中剩余气体的性质是______.
[反思]该实验和拉瓦锡所做实验的共同原理是:在密闭容器内通过加热或燃烧某种可燃物,消耗容器内的氧气,使密闭体系内外形成______,而引起的现象差异来分析空气中氧气的含量. 我是斯文的nn1年前1
我是斯文的nn1年前1 -
 hdcl40056 共回答了15个问题
hdcl40056 共回答了15个问题 |采纳率93.3%解题思路:(1)根据题给的三种物质燃烧的产物及实验的注意事项来进行解答;
(2)在完成实验前必须检查装置的气密性,可以据此解答;
(3)根据实验结果进行解答;
[反思]根据实验的操作原理进行解答.(1)A、蜡烛燃烧产生了二氧化碳和水,故不能选择;
B、红磷在空气中可以燃烧,能够生成五氧化二磷固体,故能选择;
C、硫粉能够在空气中燃烧但是生成的二氧化硫为气体,故不能选择;
故选B;
而反应中为了使实验更准确,要保证提供过量的红磷;
(2)在完成实验前必须检查装置的气密性;
(3)根据实验结果可以知道多数同学的实验结果为氧气约占空气体积的五分之一,由于水没有全部充满广口瓶,所以可以判断剩余的气体不能溶于水;
[反思]根据实验的操作原理可以知道,水之所以进入了广口瓶中是由于氧气被消耗而使瓶中的气体压强减小,而产生了压强差,从而将水压入广口瓶中.
故答案为:【集体讨论】(1)B;足量(或过量);
(2)检查装置气密性;
(3)[1/5];难溶于水.
【反思】气压差.点评:
本题考点: 测定空气里氧气含量的探究.
考点点评: 通过回答本题知道了空气中氧气的含量测定实验的注意事项,并能推测出剩余气体的性质,分析要全面、条理,测定空气成分时所用物质燃烧时不能生成气体.1年前查看全部
- 小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料
 小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:鱼鳔内气体组成大约为氧气占四分之一,其余主要是二氧化碳和氮气.探究分两步进行.
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:鱼鳔内气体组成大约为氧气占四分之一,其余主要是二氧化碳和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下刺破鳔,用排水法收集鳔内气体并测量其体积(如图).
你认为两种方法中合理的是______(填A或B),理由是______
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮他设计实验验证假设.待验证内容 操作方法 实验现象 鳔内气体含有氧气 ______ ______ 鳔内气体含有二氧化碳 ______ ______  qlhr1年前1
qlhr1年前1 -
 清雨漫思茶 共回答了17个问题
清雨漫思茶 共回答了17个问题 |采纳率82.4%解题思路:(1)根据一些重要气体的性质,二氧化碳溶于水,不适合用排水法收集进行分析;
(2)根据氧气能助燃,可以用带火星的木条进行检验;二氧化碳可以使澄清石灰水变浑浊进行分析.(1)二氧化碳溶于水,不能用排水法收集;
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以燃烧更旺,二氧化碳可以使澄清石灰水变浑浊.
故答案为:
(1)B,二氧化碳可溶于水,鳔内的二氧化碳气体能溶于水,收集的气体体积比实际体积小;
(2)
实验目的方法现象
将燃着的木条放入含有鱼鳔内气体的集气瓶中木条燃烧更旺
在含有鱼鳔内气体的集气瓶中加入少量的澄清石灰水石灰水变浑浊点评:
本题考点: 常见气体的检验与除杂方法;量气装置.
考点点评: 在解关气体方面的题时,一定要想到气体的性质,在检验气体时要注意检验气体的先后顺序,防止出现差错.1年前查看全部
- 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br 2 的物质的量和反应后溶液中Br — 离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br 2 的物质的量为amol,若测得反应后n(Br — )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO 3 —KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr 2 。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO 3 溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH 3 COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。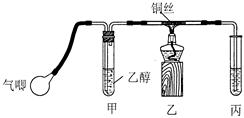
请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _ 。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________ 。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。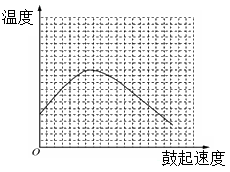
请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。 痴痴一个1年前1
痴痴一个1年前1 -
 西皮王子 共回答了11个问题
西皮王子 共回答了11个问题 |采纳率63.6%I.(1)银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀。 (2分)
(2)②溴与乙醛发生加成反应 (2分)
(3)若用pH试纸检测褪色后溶液的酸性明显增强,则猜想②不成立 (2分)
(4)a (2分) (5)CH 3 CHO+Br 2 +H 2 O→CH 3 COOH+2HBr (2分)
Cl - 、SO 4 2- 与过量的Ag + 作用也产生沉淀,干扰实验的进行。 (2分)
Ⅱ.(1)2CH 3 CH 2 OH+O 2 2CH 3 CHO+2H 2 O (2分)
2CH 3 CHO+2H 2 O (2分)
(2)使生成乙醇蒸气的速率加快且较均匀 发生倒吸 (2分)
(3)过量的气体将体系中的热量带走 (2分) 单位时间内甲中的气泡数 (1分)
<>1年前查看全部
- 新世纪学校七0五班的一个研究性学习小组对学生中午在学校食堂的就餐时间进行了调查.发现在单位时间内,每个窗口买走午餐的人数
新世纪学校七0五班的一个研究性学习小组对学生中午在学校食堂的就餐时间进行了调查.发现在单位时间内,每个窗口买走午餐的人数和因不愿长久等待而到校外就餐的人数各是一个固定数.并且发现若开1个窗口,45分钟可使等待人都能买到午餐;若同时开2个窗口,则需30分钟.还发现,若在25分钟内等待的学生都能买到午餐,在单位时间内,外出就餐的人数可减少80%.在学校学生总人数不变且人人都要就餐的情况下,为了方便学生就餐,调查小组建议学校食堂20分钟内卖完午餐.问至少要同时开多少个窗口?
 7a5b8c1年前1
7a5b8c1年前1 -
 拉开你上衣看ss 共回答了22个问题
拉开你上衣看ss 共回答了22个问题 |采纳率90.9%解题思路:设每个窗口每分钟能卖出的午餐数,每分钟外出就餐的人数,学生总数为未知数;等量关系为:45分钟一个窗口卖出的午餐数量=学生总数-45分钟外出就餐的人数;30分钟2个窗口卖出的午餐数量=学生总数-30分钟外出就餐的人数;20分钟n个窗口卖出的午餐数量≥学生总数-20分钟外出就餐的人数×(1-80%)把相关数值代入,用其中一个字母x表示出另2个字母y,z,代入第3个不等式,求得最小的整数解即可.设每个窗口每分钟能卖x人的午餐,每分钟外出就餐有y人,学生总数为z人,并设至少要同时开n个窗口,依题意有
45x=z−45y①
2×30x=z−30y②
20nx≥z−20(1−80%)y③,
由①、②得y=x,z=90x,代入③得20nx≥90x-4x,
所以n≥4.3.
因此,至少要同时开5个窗口.点评:
本题考点: 一元一次不等式组的应用.
考点点评: 考查一元一次不等式组的应用;一些必须的量没有时,应设其为未知数;当题中有多个未知数时,应利用相应的方程用其中一个未知数表示出其余未知数;得到20分钟n个窗口卖出午餐数的关系式是解决本题的关键.1年前查看全部
- 下面是某实验小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某实验小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
研究课题:探究草酸晶体受热分解的产物
查阅资料:
(1)该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
(2)白色的无水硫酸铜遇水蒸气会变蓝色名称 化学式 颜色、状态 溶解性 熔点(℃) 密度(g/cm3) 草酸 H2C2O4 - 易溶于水 189.5 1.900 草酸晶体 H2C2O4•2H2O 无色晶体 - 101.5 1.650
作出猜想:
第一种:草酸分解产物CO2和H2
第二种:草酸分解产物是CO2、CO和H2O
第三种:草酸的分解产物是CO2CO2、H2OH2O(你猜想的产物化学式)
设计实验: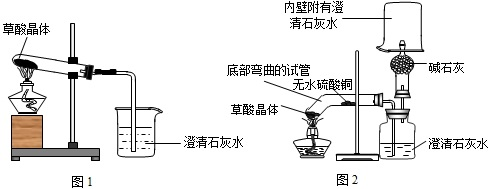
实验操作:甲同学按其设计的实验装置(如图1)实验时观察到澄清的石灰水变浑浊了乙同学按图2的装置实验也观察到澄清的石灰水变浑浊了,这些现象证明产物中一定有CO2CO2; 无水CuSO4变蓝,证明产物中还有H2OH2O若产物中有CO,则乙的对应实验现象是点燃干燥管上方的气体,可以燃烧,烧杯内壁的澄清石灰水变浑浊点燃干燥管上方的气体,可以燃烧,烧杯内壁的澄清石灰水变浑浊证明CO生成的化学反应方程式是2CO+O2
2CO22CO+O2点燃 .
2CO2、CO2+Ca(OH)2═CaCO3↓+H2OCO2+Ca(OH)2═CaCO3↓+H2O.点燃 .
得出结论:若第二种猜想是正确的,请你写出草酸分解的反应方程式H2C2O4
CO2↑+CO↑+H2OH2C2O4加热 .
CO2↑+CO↑+H2O.加热 .
反思评价:乙认为甲设计的实验装置有缺陷:由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验.请你谈谈装置2的至少两点优于装置1的优点:防止熔化的草酸流出;图2装置可以检验出生成物中是否有水蒸气防止熔化的草酸流出;图2装置可以检验出生成物中是否有水蒸气;
图2装置可以检验出生成物中是否有一氧化碳;图2装置可以检验出生成物中是否有氢气图2装置可以检验出生成物中是否有一氧化碳;图2装置可以检验出生成物中是否有氢气.
利用乙设计的装置证明产物中没有H2的方法是:在干燥管上方罩一干冷烧杯,点燃气体,观察烧杯内壁无水珠出现在干燥管上方罩一干冷烧杯,点燃气体,观察烧杯内壁无水珠出现.
交流讨论:丙同学继续查阅相关资料发现:草酸是一种酸,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物.丙同学通过进一步研究,对实验中CO2的检验提出质疑,并提出实验的改进措施,他提出的措施是在装置之间加一个冷却装置(塞有双孔橡皮塞的试管或广口瓶等)或盛有水的洗气瓶在装置之间加一个冷却装置(塞有双孔橡皮塞的试管或广口瓶等)或盛有水的洗气瓶. 1825334981年前1
1825334981年前1 -
 香缇卡39 共回答了15个问题
香缇卡39 共回答了15个问题 |采纳率93.3%【作出猜想】猜想产物的化学式要从反应前后元素的种类不变的角度考虑,不能出现新的元素.
【实验操作】:根据现象可推断生成物,石灰水变浑浊说明有二氧化碳,无水硫酸铜变蓝说明有水,验证一氧化碳时要先点燃,然后验证生成物是不是二氧化碳.书写化学方程式时不要忘记条件和配平.
【得出结论】根据所提供的反应物和生成物书写化学方程式时,化学式一定要正确,注意配平和条件.
【反思评价】评价装置要从反应物的性质和便于检验生成物入手,装置2能避免熔融的草酸流进导管而影响后续实验,并能检验水蒸气和一氧化碳等气体.
【交流讨论】为了防止草酸钙和草酸氢钙对二氧化碳检验的影响,最后在验证二氧化碳前把它们除去.
故答案为:【作出猜想】CO2、H2O(或CO、H2O等)
【实验操作】CO2; H2O,点燃干燥管上方的气体,可以燃烧,烧杯内壁的澄清石灰水变浑浊; 2CO+O2
点燃
.
2CO2、CO2+Ca(OH)2═CaCO3↓+H2O;
【得出结论】H2C2O4
加热
.
CO2↑+CO↑+H2O.
【反思评价】防止熔化的草酸流出;图2装置可以检验出生成物中是否有水蒸气;
图2装置可以检验出生成物中是否有一氧化碳;图2装置可以检验出生成物中是否有氢气.
【交流讨论】在装置之间加一个冷却装置(塞有双孔橡皮塞的试管或广口瓶等)或盛有水的洗气瓶.1年前查看全部
- 阅读下面语段,按要求回答问题:现在的“研究性学习”模式,实质上就是______将学生置于问题情景中,让学生体验、动脑、动
阅读下面语段,按要求回答问题:
现在的“研究性学习”模式,实质上就是______将学生置于问题情景中,让学生体验、动脑、动手,感受______的方案设计、现象的观察、数据的处理、结果的分析。
填入横线部分最恰当的一项是()。A.提倡试验 B.提倡实验 C.倡导试验 D.倡导实验  bterbeater1年前1
bterbeater1年前1 -
 熔石 共回答了24个问题
熔石 共回答了24个问题 |采纳率95.8%B
近义词辨析。提倡:让事物的优点鼓励大家使用或实行;倡导:带头提倡。实验:为了检验某种科学理论或假设而进行某种操作或从事某种活动;试验:为了查看某事的结果或某物的性能而从事某种活动。本题应选“实验”。1年前查看全部
- 课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题:

(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式: 。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的溶质是 (填化学式)。
(5)装置丁中的现象是 。 几度樱花开1年前1
几度樱花开1年前1 -
 gaoyen2001 共回答了18个问题
gaoyen2001 共回答了18个问题 |采纳率88.9%1年前查看全部
- 研究性学习小组同学收集硫酸型雨水V L,加入1.00 mol•L-1的Ba(OH)2溶液至不再产生沉淀时,恰
研究性学习小组同学收集硫酸型雨水V L,加入1.00 mol•L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗20.0mL Ba(OH)2溶液.请你计算:生成沉淀物的质量是多少?
34g zrrx1年前1
zrrx1年前1 -
 lhlljy 共回答了14个问题
lhlljy 共回答了14个问题 |采纳率92.9%这个题不是难在计算,而是难在分析.
我相信,如果给你方程直接带入,你肯定算的出来,你搞不清楚这个沉淀为什么会是一个范围取值.
硫酸型酸雨是指含硫的矿物燃烧之后,产生的二氧化硫,形成的酸雨.它可以是二氧化硫直接溶水形成的亚硫酸,也可以使二氧化硫被空气中的固体颗粒催化氧化,变成硫酸.
因此沉淀就是亚硫酸钡和硫酸钡的混合物.说到这里,还有什么好说的么?20ml,1Mol/L的钡离子是0.02mol.
换算成亚硫酸钡就是4.34g,换算成硫酸钡就是4.66g.
反正酸雨里就这两个东西,谁多谁少都逃不出这个范围.1年前查看全部
- 某市热电厂使用的燃料是含硫较多的煤。该厂附近一 所中学的同学经常闻到空气有异味,且空气能见度差。学校研究性学习
某市热电厂使用的燃料是含硫较多的煤。该厂附近一 所中学的同学经常闻到空气有异味,且空气能见度差。学校研究性学习小组意识到这有可能是该厂排出的废气超标造成的,于是在老师的指导下做探究实验,请你填写下列空白。
[ 提出问题] 空气里so 2 是否超标呢?
[ 查阅资料] Ⅰ.***关于so 2 在风景区、居民区、工厂区的空气质量标准分别见下表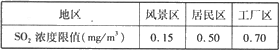
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应)。
(1)[设计实验]同学设计以下步骤来测定空气中so 2 的含量。
①采集工厂附近的空气样品250l。
②将空气样品通过naoh溶液,加入一定量氧化剂h 2 o 2 ,使其中na 2 so 3 完全转化为na 2 so 4 ,反应的化学方程式:__________。
③再加入过量的bacl 2 溶液,经过过滤、洗涤、烘干,称量固体质量为1. 2mg。
计算:250l空气样品中so 2 的质量为_________mg。由空气质最标准可得出结论:该厂排放的so 2 ___________ 。
④简述采集空气样品的方法____________。
(2)[发展新问题]考虑到空气中的各种气体成分,有同学认为该实验测得的so 2 的含量偏大,其依据及你提出的实验改进方案是_______ 。[反思与应用]为尽快改善该地区的空气质量,请你提出一条合理化建议:___________。 chmdht11年前1
chmdht11年前1 -
 gouer666 共回答了21个问题
gouer666 共回答了21个问题 |采纳率100%(1)②Na 2 SO 3 +H 2 O 2 ==Na 2 SO 4 +H 2 O
③0.33 ;超标
④用打气管注入瘪的塑料袋
(2)空气中的二氧化碳也要和氢氧化钠溶液反应,并继续与BaCl 2 溶液反应,生成碳酸钡沉淀。向沉淀中加入过量的稀硝酸后,再进行其余操作工厂废气进行治理,达标后再排放1年前查看全部
- 下表是研究性学习小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10mL 过氧化氢溶液制取150mL氧气
下表是研究性学习小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10mL 过氧化氢溶液制取150mL氧气所需的时间(秒)
(1)该研究小组在设计方案时,考虑了______、______、______等因素对过氧化氢分解速率的影响.浓度
反应条件30% H2O2 15% H2O2 10% H2O2 5% H2O2 无催化剂、不加热 几乎不反应 几乎不反应 几乎不反应 几乎不反应 无催化剂、加热 360s 480s 540s 720s MnO2催化剂、不加热 40s 60s 120s 180s MnO2催化剂、加热 10s 25s 60s 120s
(2)从上表的数据中,你能得出什么结论?
①______;
②______. qxjshr1年前1
qxjshr1年前1 -
 逐渐变黑 共回答了17个问题
逐渐变黑 共回答了17个问题 |采纳率100%解题思路:(1)根据实验中所给数据考虑;
(2)通过反应物的接触面积考虑.解(1)通过表中数字可知影响因素有浓度、温度和催化剂;
(2)通过表中数值不难看出浓度越高,过氧化氢的分解速率越快(或温度越高,过氧化氢的分解速率越快;使用催化剂,过氧化氢的分解速率越快).
故答案为:
(1)浓度、温度;催化剂;
(2)①浓度越高,过氧化氢的分解速率越快;②温度越高,过氧化氢的分解速率越快.点评:
本题考点: 影响化学反应速率的因素探究.
考点点评: 知道了影响过氧化氢反应速度的因素.1年前查看全部
- 如图是王峰同学在研究性学习的活动中为某仓库设计的一种防盗报警器,其踏板放在仓库的门口,电铃和灯泡放在值班室内,观察电路可
如图是王峰同学在研究性学习的活动中为某仓库设计的一种防盗报警器,其踏板放在仓库的门口,电铃和灯泡放在值班室内,观察电路可知,这个报警器的工作原理是:有人踩踏时,______;无人踩踏时,______. 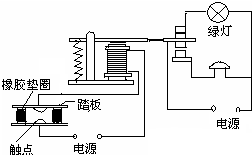
 jjj2309361年前1
jjj2309361年前1 -
 yuhan3777 共回答了20个问题
yuhan3777 共回答了20个问题 |采纳率90%当有人踩踏板时,电磁铁通电,线圈有了磁性,把衔铁吸引下来,电铃工作而报警,当无人踩踏板时,电磁铁不工作,衔铁在弹簧的作用下使电灯与电源形成通路而灯亮,表示安全.
故本题答案为:电磁铁有磁性,电铃电路工作,铃响报警;电磁铁无磁性,灯泡电路工作,灯亮安全.1年前查看全部
- 今年“五一”长假期间,小王同学所进行的研究性学习内容是“厨房中的科学”.下列是他在做饭时所联想到的科学知识,其中错误的是
今年“五一”长假期间,小王同学所进行的研究性学习内容是“厨房中的科学”.下列是他在做饭时所联想到的科学知识,其中错误的是( )
A.静止在水平桌面上的杯子受到的重力和它对桌面的压力是一对平衡力
B.使用高压锅能升高水的沸点,更快地煮熟饭菜
C.饺子皮上捏出了漂亮的花边,这是力改变了物体的形状
D.泼水时,盆留在手中.水由于惯性飞出去 浅浅的思念1年前1
浅浅的思念1年前1 -
 yanyangao 共回答了17个问题
yanyangao 共回答了17个问题 |采纳率100%解题思路:A、二力平衡的条件是大小相等、方向相反、作用在一条直线上和作用在一个物体上,根据二力平衡的条件分析支持力和压力的关系;
B、高压锅通过增大锅内气压的办法来提高水的沸点,从而缩短煮饭时间;
C、力可以改变物体的形状,也可以改变物体的运动状态;
D、先分析泼水时水和盆的运动状态,然后再根据任何物体都有惯性分析水后来的运动状态.A、因为压力和支持力是作用在两个物体上,所以支持力和压力不是一对平衡力,故A选项错误;
B、高压锅是通过增大锅内气体压强的办法来提高水的沸点,从而缩短加热时间的,所以B是正确的;
C、饺子皮上捏出了漂亮的花边,是包子皮的形状发生了改变,这是力作用的结果,所以C是正确的;
D、泼水时,水和盆一起运动,盆在手的作用下静止,而水由于惯性还要保持原来向前的运动状态,所以水被泼出去了,所以D是正确的.
故选A.点评:
本题考点: 平衡力和相互作用力的区分;沸点及沸点与气压的关系;力的作用效果;惯性.
考点点评: 综合考查了惯性定律的应用、平衡力的条件、相互作用力的条件以及杠杆的分类;特别注意在惯性现象的解释时,一定记住惯性是物体的一种性质,不是力,不能说成受到惯性的作用、受到惯性力、惯性力变大等类似的说法.1年前查看全部
- 某同学在研究性学习中,收集到某制药厂车间工人数(单位:十人)与药品产量(单位:万盒)的数据如表所示:
某同学在研究性学习中,收集到某制药厂车间工人数(单位:十人)与药品产量(单位:万盒)的数据如表所示:
(1)请画出如表数据的散点图;工人数:x(单位:十人) 1 2 3 4 药品产量:y(单位:万盒) 3 4 5 6
(2)参考公式,根据表格提供的数据,用最小二乘法求出y关于x的线性回归方程y=
x+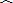
b
;(参考数据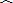
a
i2=30,4 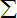
i=1
xiyi=50)4 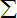
i=1
(3)试根据(2)求出的线性回归方程,预测该制药厂车间工人数为45时,药品产量是多少? 晴朗的心a1年前0
晴朗的心a1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1如图,三角形ABC内接于圆O,AH垂直BC于H,AD平分角BAC,D在圆O上 求证:AD平分HAO 向左转|向右转
- 2谁翻译一下,下面的英文。有错误帮我指出,谢谢
- 319分之3+16分之5+13分之4怎么做?
- 4如图所给的A、B、C三个几何体中,按箭头所示的方向为它们的正面,设A、B、C三个几何体的主视图分别是A 1 、B 1 、
- 5一道英语填空题(初二的)根据短文意思,选用所给词语的适当形式填空.所给词语:busy,city,easy,get,sho
- 6f(x)=ln(2-x)÷(a+x)是奇函数,求a的值?求f(x)的定义域?
- 7Help---- (you)to some potatoes
- 8在四边形ABCD中,点E,F分别在AB,CD上,DF=BE.四边形DEBF是平行四边形吗?
- 9水果店送来水果5分之4吨,已经卖出了12分之5,还剩下多少吨?
- 10I (be)kind of heavy,but my brother(be)very thin
- 11You look very nice in dark blue.
- 12任意x∈R,函数f(x)满足f(x+1)=/{f(x)-[f(x)]2}+1/2,设an=[f(n)]2-f(n),数列
- 13-NH-如何水解
- 14THE girl red is Ann'ssister中,girl和red中间填写什么介词
- 15一个数的[2/3]与60的[1/5]相等,这个数是______,列式为60×[1/5]÷[2/3]60×[1/5]÷[2