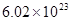气体摩尔单位中L/MOL与M3/MOL有什么区别
 yinfuzhu2022-10-04 11:39:541条回答
yinfuzhu2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 胡编滥造 共回答了13个问题
胡编滥造 共回答了13个问题 |采纳率92.3%- 1000L=1m^3,故1m^3/mol=1000L/mol
- 1年前
相关推荐
- 下列说法中不正确的是( ) A.在标准状况下,22.4升空气中所含分子数约为1mol B.在常温常压下,氧气的气体摩尔
下列说法中不正确的是( )
A.在标准状况下,22.4升空气中所含分子数约为1mol B.在常温常压下,氧气的气体摩尔体积大于22.4L/mol C.在常温常压下,1mol SO 2 的质量为64g D.不在标准状况下,1mol气体的体积就不可能为22.4L  自_由1年前1
自_由1年前1 -
 瑶而舞栖 共回答了18个问题
瑶而舞栖 共回答了18个问题 |采纳率88.9%1年前查看全部
- 测定气体摩尔常数硫酸的浓度和用量一定要准确量取++为什么
 我是kk01号1年前1
我是kk01号1年前1 -
 -飞天蛇- 共回答了23个问题
-飞天蛇- 共回答了23个问题 |采纳率87%不需要,只要保证硫酸是过量的就行了.一般实验中硫酸用量都超过200%.摩尔气体常数测定关键在于精确确定氢气的体积和物质的量,前者通过量气管测定,后者反应确定.只要硫酸是过量的,就能保证氢气物质的量等于镁条物质的量,此时硫酸具体的浓度和用量就无关紧要了.1年前查看全部
- 气体摩尔体积能不能用n=m/M来算
气体摩尔体积能不能用n=m/M来算
如题 例如常温常压下,14g氮气含有分子数为0.5NA 能不能直接用 n=m/M算
这是在选择中用的还是计算里也可以用 懒懒的贝壳11年前1
懒懒的贝壳11年前1 -
 青龙会 共回答了13个问题
青龙会 共回答了13个问题 |采纳率100%个人认为可以这么算.1年前查看全部
- 气体摩尔体积不是标准状况下怎么算?
气体摩尔体积不是标准状况下怎么算?
不是这样的,我指的是只告诉了压强,温度的情况下,通过一个公式可以算出此时的气体摩尔体积 莫名永远1年前2
莫名永远1年前2 -
 johnnylv 共回答了18个问题
johnnylv 共回答了18个问题 |采纳率94.4%1、用气态方程PV=nRT计算,因为涉及气体常数R,所以在高中阶段不太好用;
2、用22.4计算,根据气态方程可以看出一定量的气体(n一定),它的体积与温度(注意,是绝对温度,单位是开尔文.也就是摄氏温度+273 .)成正比,与压强成反比.如,计算25℃,101kPa条件下的气体摩尔体积:Vm=22.4×(25+273)÷273=24.4513L/mol .1年前查看全部
- 下列正确的是:a气体摩尔的体积就是22.4L每摩尔,b非标准情况下22.4L任何物质都含有约6.02乘以10个分子 c
下列正确的是:a气体摩尔的体积就是22.4L每摩尔,b非标准情况下22.4L任何物质都含有约6.02乘以10个分子 c 非标准状况下,1摩尔任何提提的体积都不可能是22.4升 d 1摩尔H2和O2的混合气体在标准状况下的体积约为22.4升 同文通压下,某集气瓶充满氧气时为116克,充满二氧化碳时喂122克,充满气体A时为114克,则A的试量为多少 常温常压下,1摩尔亲戚的体积为22.4L说法对吗 常温常压下,1摩尔氧气的质量为三十二克对吗 在标准状况下,氧气的气体摩尔体积约为22.4L对吗标准状况下,22.4L每摩尔就是摩尔体积 鼻癌准状况下,22.4L任何气体中都约含有6.02乘以10的23次方个分子
 maodou88001年前1
maodou88001年前1 -
 日中天六八 共回答了22个问题
日中天六八 共回答了22个问题 |采纳率100%第一题 选D 在标准状态下任何气体的体积都是22.4L/mol 那么混合气体也一样,无论多少种气体混合,只要是一摩尔混合气体在标况下就是22.4L 2题 14 3题 1.错,应在标况下 2.对 因为质量守恒 只要是一摩尔氧气就是32克 3,对 任何气体在标况下每摩尔的体积都约等于22.4L 所以是对的 4.对的,在标况下任何气体的体积都约为22.4L,那么无论是混合气还是纯净气22.4L所含的分子数是约等于6.02X10^23个1年前查看全部
- 刚性多分子气体摩尔热容比是多少,怎么计算的?
 Truqi_qu1年前0
Truqi_qu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 物质的质量,摩尔,气体摩尔,摩尔质量,都代表什么,他们之间的关系,单位.
物质的质量,摩尔,气体摩尔,摩尔质量,都代表什么,他们之间的关系,单位.
请说的详细些 ivy30011年前3
ivy30011年前3 -
 shbin713 共回答了10个问题
shbin713 共回答了10个问题 |采纳率90%物质的量指的是微粒的数量,1mol(摩尔)指的是6.02乘以10的23次方个粒子.质量是称出来的,严谨的说质量,是描述物体的惯性的物理量.而物质的摩尔质量指的是1mol该纯物质的质量,比如铝摩尔质量为27g/mol指的是每摩尔铝有27g的质量.气体一般讲摩尔体积,在0摄氏度,101KPa气压下(标准状况,简称标况,并非常温常压,气压温度改变会使气体摩尔体积改变),气体摩尔体积为22.4L/mol,指的是每摩尔气体体积为22.4L,任何气体都适用.1年前查看全部
- 【紧急+高中化学】气体摩尔一道十分简单的粒子计算题》》
【紧急+高中化学】气体摩尔一道十分简单的粒子计算题》》
在标准状况下,11.2L的SO4所含的分子数为0.5NA(NA=阿伏加德罗常数).
这是怎样计出来的?“标准情况下”的作用是什么?隐藏什么条件? ccclll09121年前1
ccclll09121年前1 -
 阳光里的果果 共回答了19个问题
阳光里的果果 共回答了19个问题 |采纳率84.2%在标准情况下 1Mol 气体的体积 可看作 22.4L
SO4 你没看错吧 !
11.2L 就是 0.5MOL 气体
1mol 气体 由 1NA个 分子组成
0.5 mol SO4(你肯定看错了 就当这个讲 明白道理就行)
就由0.5NA个分子组成1年前查看全部
- 高一学了气体摩尔之类问题请问怎么根据气体体积求其他量,麻烦把公式和中文解释发上来
 飘过1年前2
飘过1年前2 -
 pbyn 共回答了17个问题
pbyn 共回答了17个问题 |采纳率70.6%n=V/Vm 气体物质的量等于气体体积除以气体摩尔体积,在标准状况下
n=V/22.4 气体物质的量等于气体体积除以标准状况下气体摩尔体积22.4L/mol
通过物质的量就可以求出质量 m=n.M
以及一些其他的量1年前查看全部
- 高一化学气体摩尔 题目 化学高手来啊
高一化学气体摩尔 题目 化学高手来啊
有CO和O2的混合气体共10ml,点燃后充分燃烧,气体体积变为7ml,求原来CO和O2体积比
答案是3:2,求过程, 不要用什么差量法. 天极元素1年前8
天极元素1年前8 -
 Hyphen_zhf 共回答了23个问题
Hyphen_zhf 共回答了23个问题 |采纳率100%不用差量法的话只能列方程解了
V(CO) + V(O2) = 10ml
1
如果CO过量,则生成的V(CO2) = 2*V(O2)
且剩余的V'(CO) = V(CO) - 2*V(O2)
所以2*V(O2) + V(CO) - 2*V(O2) = 7ml
解得V(CO) = 7ml,V(O2) = 3ml
2
如果O2过量,则生成的V(CO2) = V(CO)
且剩余的V'(O2) = V(O2) - 0.5*V(CO)
所以V(CO) + V(O2) - 0.5*V(CO) = 7ml
解得V(CO) = 6ml,V(O2) = 4ml
有两个答案1年前查看全部
- 一道高一气体摩尔的问题同温同压下,ALCH4与H2的混合气体恰好与ALO2完全反应生成CO2和CO,则原混合气体中的平均
一道高一气体摩尔的问题
同温同压下,ALCH4与H2的混合气体恰好与ALO2完全反应生成CO2和CO,
则原混合气体中的平均相对分子质量为( B )
A.5.56 B.6.67 C.11.12 D.9 107mmm1年前1
107mmm1年前1 -
 不想错过 共回答了20个问题
不想错过 共回答了20个问题 |采纳率85%方法:
设原混合气体为xL cH4 ,yL H2
x+y=a (1)
1,假设全部生成co2:
2H2+o2=2H2o
yL y/2L
cH4 + 2o2=co2+2H2o
a/2-y/4 a-y/2
所以x=a/2-y/4 (2)
由(1)(2)得:x=a/3,y=2a/3
所以原混合气体平均摩尔质量为:(16x+2y)/a=6.67mol/L
2,假设全部生成co
2H2+o2=2H2o
yL y/2L
cH4 + 3/2o2=co2+2H2o
2a/3-y/3 a-y/2
所以x=2a/3-y/3 (3)
由(1)(3)得:x=a/2,y=a/2
所以原混合气体平均摩尔质量为:(16x+2y)/a=9mol/L
看看上面,假设全部生成二氧化碳时是6.67
生成一氧化碳时是9
所以答案应该介于6.67到9之间吧~
他选B应该有他的理由吧 看看还有没有其他条件,若是没有的话我觉得题可能有些不严密.1年前查看全部
- 化学气体摩尔一个容器,同温同压下装了氧气116克,二氧化碳122克,现有一气体X,问装入这容器中的X气体质量为多少?
 水中流泪的鱼1年前1
水中流泪的鱼1年前1 -
 wzhyt05783 共回答了24个问题
wzhyt05783 共回答了24个问题 |采纳率100%装入同一个容器,那体积肯定是相同的,也就是说,气体X体积和氧气体积加二氧化碳体积相等.算出116g氧气物质的量和122g二氧化碳物质的量,换算成体积,气体X的体积就等于二者之和.1年前查看全部
- 关于气体摩尔的.体积为1L的干燥容器中HCL的气体后,测得容器中气体对氧气的相对密度为1.082.将此气体倒扣在水中,进
关于气体摩尔的.
体积为1L的干燥容器中HCL的气体后,测得容器中气体对氧气的相对密度为1.082.将此气体倒扣在水中,进入容器中液体的体积是0.75L,为什么是0.
29是什么来的?如何求出 afei_dd1年前1
afei_dd1年前1 -
 520新加坡 共回答了14个问题
520新加坡 共回答了14个问题 |采纳率92.9%这道题是有关于平均摩尔质量的计算
首先你得知道气体的密度比就等于它们的摩尔质量的比
如果瓶中都是氯化氢的话,那么容器中气体与氧气的相对密度应为二者的摩尔质量比 即为36.5:32约为1.14,并不是1.082.所以可知瓶中的氯化氢不纯净,混有了空气
那么就要根据题中给出的相对密度去计算下瓶中混合气体中氯化氢占多少体积
可设氯化氢的体积分数为未知数,然后根据混合气体与氧气的摩尔质量比就等于其密度比即等于相对密度1.082,列方程如下:
[36.5X+29(1-X)]/32 = 1.082
解得未知数等于0.75,即混合气体中氯化氢的体积为0.75L
氯化氢极易溶于水,所以进入水的体积就是氯化氢的体积为0.75L1年前查看全部
- 关于气体摩尔公式中的V的定义可否详细地解释Vm与V的定义,两者有可分别?可具体举例!
 晖子19851年前1
晖子19851年前1 -
 onionding 共回答了22个问题
onionding 共回答了22个问题 |采纳率90.9%设有一均相多组分系统,由1,2,3,……,k个组分组成,系统的任一个容量性质Z(例:V,G,S,U等)均可以表示成T,P和系统中各组分物质的量n1、n2、…nk的函数.即
当系统的状态发生任意无限小量的变化时,容量性质Z的全微分dZ表示为
(3-1-1)
式(3-1-1)中,第一和第二项的下标n1n2...nk表示系统所有组分的物质的量都恒定;下标nB(C≠B)表示系统保持除B以外的其余组分物质的量都恒定.在定温定压条件下,dT=0,dP=0,并令
ZB称为物质B的某种容量性质Z的偏摩尔量.它的物理意义就是:在等温等压的条件下,在大量的系统中,保持除B组分以外的其它组分不变(即nC不变,C代表除B组分以外的其它组分),系统的容量性质Z随组分B的物质的量nB的变化率;相当于加入1 mol B 所引起该系统容量性质Z的改变.或者理解为是在有限量的系统中加入dnB后,系统的容量性质变化了dZ,dZ与dnB的比值就是ZB(由于只加入dnB,所以实际上系统的浓度可视为不变).由于用偏微分的形式表示,故称ZB为偏摩尔量.
则在等温等压的条件下(3-1-1)可写为
使用偏摩尔量时应注意:(1)只有容量性质才有偏摩尔量,强度性质不存在偏摩尔量.(2)必须是在等温等压条件下,保持除B组分以外的其它组分不变,系统的容量性质Z対组分B的物质的量nB的偏微分才是偏摩尔量.(3)偏摩尔量本身是强度性质.(4)纯物质的偏摩尔量就是它的摩尔量.
2 偏摩尔量的加和公式
在保持系统T,P不变时,(3-1-3)可写成
由于偏摩尔量是强度性质,与系统的总量无关.如果在恒定T,P条件下保持各种物质的比例不变,逐渐加入物质1,2,3,……,k,使系统的总量逐渐增大,直到各物质的物质的量为n1、n2、…nk,则各物质的偏摩尔量均为一个常数,在这样的条件下对上式进行积分.
上述公式称为偏摩尔量的加和公式,它为计算系统中某一个容量性质的值提供了方便.偏摩尔量的加和公式说明系统的容量性质绝不是各物质的这种性质之和.而是多组分系统中的任一容量性质的总和均等于各组分的偏摩尔量与其物质的量的乘积之和.
例如:系统只有两个组分,其物质的量和偏摩尔体积分别为nA、VA和nB、VB,则系统的总体积为:V=nAVA+nBVB
多组分系统任一容量性质(如U、H、S、A、G)偏摩尔量的加和公式为
UB是偏摩尔热力学能、HB是偏摩尔焓、SB是偏摩尔熵、AB是偏摩尔亥姆霍兹自由能、GB是偏摩尔吉布斯自由能.
3 吉布斯-杜亥姆方程
在恒定T,P条件下,対式(3-1-4)求全微分:
与式(3-1-3)相比较,必然有
对上式除以系统中总的物质的量n=∑nB,可得
以上(3-1-5) 和(3-1-6)两个公式都称为吉布斯---杜亥姆方程,它表明在温度、压力恒定下,混合物的组成发生变化时,系统中各组分偏摩尔量变化的相互依赖关系.
§3.2 化学势
1 多组分系统热力学基本方程?
一多组分均相系统中含有1,2,3,…,k种物质,其相应的物质的量分别为 ,,,…,.为系统中任一物质 的物质的量.如果 改变,则系统的各种状态函数(容量性质)也会发生相应的变化.对均相只做体积功的多组分系统,可将热力学函数表示为
当系统从一平衡态经过一个微小变化到邻近的另一平衡态时,系统的U、H、A、G的微小变化分别为下列微分:
结合第2章中的热力学基本公式可得:
(3-2-1)
(3-2-2)1年前查看全部
- 高中化学标准气体摩尔体积22.4中的气体是理想气体吗?就是把气体本身体积当做0?就考虑了分子间距
 暗域_玫瑰1年前5
暗域_玫瑰1年前5 -
 gbu123 共回答了21个问题
gbu123 共回答了21个问题 |采纳率85.7%理想气体与实际气体相比,忽略了两项:
1、分子间的作用力(假定分子间没有作用力)
2、分子的固有体积(将分子看成质点)
高中的标准摩尔体积也就是近似地将实际气体看成理想气体.1年前查看全部
- 气体摩尔体积和阿伏加德罗定律有什么区别?好像标准气体摩尔体积算了分子大小,阿福加没算分子
 vber4351年前2
vber4351年前2 -
 guw28977 共回答了15个问题
guw28977 共回答了15个问题 |采纳率93.3%不是一个概念1年前查看全部
- 置换法测定气体摩尔常数R误差分析
置换法测定气体摩尔常数R误差分析
误差产生的原因和应采取的措施 llin0451年前1
llin0451年前1 -
 xg0000 共回答了18个问题
xg0000 共回答了18个问题 |采纳率72.2%气态方程全名为理想气体状态方程,一般指克拉珀龙方程:pV=nRT.其中p为压强,V为体积,n为物质的量,R为普适气体常量,T为绝对温度(T的单位为开尔文(字母为K),数值为摄氏温度加273.15,如0℃即为273.15K).
当p,V,n,T的单位分别采用Pa(帕斯卡),m3(立方米),mol,K时,R的数值为8.31.该方程严格意义上来说只适用于理想气体,但近似可用于非极端情况(低温或高压)的真实气体(包括常温常压).
另外指的是克拉珀龙方程来源的三个实验定律:玻-马定律、盖·吕萨克定律和查理定律,以及直接结论pV/T=恒量.
波义耳-马略特定律:在等温过程中,一定质量的气体的压强跟其体积成反比.即在温度不变时任一状态下压强与体积的乘积是一常数.即p1V1=p2V2.
盖·吕萨克定律:一定质量的气体,在压强不变的条件下,
温度每升高(或降低)1℃,它的体积的增加(或减少)量等于0℃时体积的1/273.
查理定律指出,一定质量的气体,当其体积一定时,它的压强与热力学温度成正比.即
P1/P2=T1/T2 或pt=P′0(1+t/273)
式中P′0为0℃时气体的压强,t为摄氏温度.
综合以上三个定律可得pV/T=恒量,经实验可得该恒量与气体的物质的量成正比,得到克拉珀龙方程1年前查看全部
大家在问
- 1我把钥匙忘在家了用英语怎么说
- 2如果给了你个化合物的结构简图要你写出化合物的名称怎么做
- 3阅读下列材料:材 阅读下列材料:材料一:“收二川,排八阵,六出七擒,五丈原前,点四十九盏明灯,一心只为酬三顾;取西蜀,定
- 4高中英语作文120单词谁帮我写.关于理想中的大学
- 5在线求指导:What ____________ yo
- 6谁给一篇 关于 兰州牛肉面 的英语作文!不要太难的 不要很多生词
- 7图4所示是HD4609型飞利浦电热水壶,水壶底面积为0.02米²,空热水壶
- 8为什么啊,重力势能不是只和高度用关吗,为什么从不同高度将某一物体抛出,落地时重力势能相等呢?
- 9函数y=|x|+x分之根号x+3的定义域是:
- 10I will find out that what will happen.这句话对吗?
- 11(2004•广东)一个体重为500N的同学骑自行车上学,在水平路面上以4m/s的速度匀速行驶.有关数据如表所示.
- 12小学五到六年级课内和课外的必背古诗,读读背背的古诗也要,好的加分,要有诗句。
- 13【化学】几个轨道形成大π键后电子属于哪个原子?
- 14swimming 这是什么英语单词
- 15求老师解答:六(3)班音乐小组有