有银铜合金十千克,加入铜后,含银两份,含铜三份,如果加入的铜加一倍,那么含银三份,含铜七份,问每...
 McConker2022-10-04 11:39:541条回答
McConker2022-10-04 11:39:541条回答有银铜合金十千克,加入铜后,含银两份,含铜三份,如果加入的铜加一倍,那么含银三份,含铜七份,问每次加入的铜多少千克?

已提交,审核后显示!提交回复
共1条回复
 q1q2q3q4q5 共回答了12个问题
q1q2q3q4q5 共回答了12个问题 |采纳率83.3%- 设原来合金含银为x千克;第一次加入的铜为y千克.
x:(10-x+y)=2:3 ;化简:5x=20+2y;(1)
x:(10-x+2y)=3:7; 化简:10x=30+6y;(2)
y=2.5;x=5
第一次加铜2.5千克;第二次加铜5千克. - 1年前
相关推荐
- (2014•河南一模)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图:
(2014•河南一模)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图:

(1)电解精练银时,阴极反应式为______;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为______.
(2)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为______.
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为4NH3+5O2
4NO+6H2O催化剂 .△ 4NH3+5O2这个反应中会有白烟产生,该白烟为______.
4NO+6H2O催化剂 .△
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol•L-1的Al2(SO4)3溶液______L. ylz04211年前1
ylz04211年前1 -
 seahaihh 共回答了23个问题
seahaihh 共回答了23个问题 |采纳率100%解题思路:(1)根据电解原理分析判断;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Cu(OH)2分解的温度为80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)煅烧过程中生成的氧化产物是氧气,NH3在催化剂条件下和氧气反应生成NO和水;NO和氧气和水能反应生成硝酸,硝酸和氨气反应生成硝酸铵;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算.(1)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag;生成红棕色气体是N02,N02与水反应的化学方程式为:3NO2+H2O=2HNO3+NO↑,故答案为:Ag++e-=Ag;3NO2+H2O=2HNO3+NO↑;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(3)Cu化合价由+2变为+1,Al化合价没变,因此O的化合价升高,得到氧化产物是氧气,NH3在催化剂条件下和氧气反应生成NO和水,化学方程式为:4NH3+5O2
催化剂
.
△4NO+6H2O,NO和氧气和水能反应生成硝酸,硝酸和氨气反应生成硝酸铵,现象为产生白烟,
故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O;NH4NO3;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=[3000g×64%/64g/mol]=30mol,则CuAlO2为30mol,由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×[1/2]=15mol,所以需要体积为[15mol/1.0mol•L−1]=15L,
故答案为:30;15.点评:
本题考点: 金属的回收与环境、资源保护.
考点点评: 本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,难度不大.1年前查看全部
- 原油银铜合金10千克,加入铜后,其中含银2份,含铜3份,若再加入相同含量的铜,则含银3份,含铜7份.
原油银铜合金10千克,加入铜后,其中含银2份,含铜3份,若再加入相同含量的铜,则含银3份,含铜7份.
(1):第一次加入的铜是多少千克
(2):原合金中银铜所占的百分比含量是多少 RAP宝宝1年前3
RAP宝宝1年前3 -
 穿山vv 共回答了20个问题
穿山vv 共回答了20个问题 |采纳率85%假设有银铜合金中有银x千克,则有铜(10-x)千克
假设每次加入的铜质量为a千克
那么就有x/(10-x+a)=2/3、x/(10-x+2a)=3/7
化简得5x=20+2a、10x=30+6a
即2(20+2a)=30+6a 解得a=5
1、即第一次加入铜5千克
5x=20+2a=20+10=30 解得x=6
2、即原有银6千克,铜(10-6)=4千克1年前查看全部
- 我有460克银铜合金属,想把银分离出来,我需要最简单的方法,需要哪些东西多少克,
 oldfish5021年前1
oldfish5021年前1 -
 ilmyeric 共回答了14个问题
ilmyeric 共回答了14个问题 |采纳率92.9%方案1、将460克银铜合金溶于硝酸,让银铜充分反应完全,然后加入铜板,将银完全置换出来,取下铜板上附着的银,倒入坩埚中融化即得金属银.
方案2、银铜合金溶于硝酸,加盐酸过滤,使沉淀溶于浓氨水,再滴人葡萄糖溶液,水浴加热就可分离得出银.
方案3、将460克银铜合金属放入硝酸银溶液中,让铜全部发生置换反应,最后收集金属银,放入坩埚中融化成块即可.这种方案最简单.原料和用品为:硝酸银溶液、烧杯、坩埚、毛刷、酒精灯1年前查看全部
- 推荐一本有关金属液体流动性的书籍,有银铜合金液体流动性的最好!
 尘埃里的花YY1年前3
尘埃里的花YY1年前3 -
 胡桐子 共回答了13个问题
胡桐子 共回答了13个问题 |采纳率92.3%非平衡凝固理论与技术 作者王自东 金属凝固原理 作者胡汉起1年前查看全部
- (2013•通川区一模)银铜合金广泛应用于航空工业.从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:A
(2013•通川区一模)银铜合金广泛应用于航空工业.从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)

(1)铜的核外电子排布式为______.
(2)电解精炼银时,阴极反应式为______滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为______.
(3)固体混合物B的组成为______;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2,写出因NaOH过量引起的反应的离子方程式______.
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有______.
(5)完成上述煅烧过程中一个反应的化学方程式:
______CuO+______Al2O3
______Cu AlO2+______(系数1也要写).高温 .
(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol•L-1的Al2(SO4)3溶液______L. 种子160讨力1年前1
种子160讨力1年前1 -
 wuzhi850 共回答了16个问题
wuzhi850 共回答了16个问题 |采纳率75%解题思路:(1)原子或离子核外电子排布属于基态排布应满足构造原理:1s、2s2p;3s3p;4s3d4p;5s4d5p;6s4f5d6p;7s5f6d7p按此顺序填充;
(2)电解精炼银时,阳极是粗银,电极本身发生失电子的氧化反应,金属银和硝酸反应生成的是一氧化氮气体,能迅速被氧气氧化为二氧化氮;
(3)硫酸铝、氢氧化钠、硫酸铜之间发生反应会生成氢氧化铝和氢氧化铜,再煮沸时,氢氧化铜会分解为氧化铜,氢氧化铝能溶于氢氧化钠中,据此来回答;
(4)硫酸铝、氨水、硫酸铜之间发生反应会生成氢氧化铝和[Cu(NH3)4]SO4,据此回答;
(5)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平方程式;
(6)据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算.(1)铜元素的原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s2s22p63s23p63d104s1或[Ar]3d104s1;
(2)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,金属银和硝酸反应生成的是一氧化氮气体,无色的NO在常温下与空气中的O2迅速化合生成红棕色N02:2NO+O2=2NO2;故答案为:Ag-e-=Ag+;2NO+O2=2NO2;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;1O2;
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则氢氧化铜会溶于过量的氨水中,生成[Cu(NH3)4]SO4,所以滤液中的阳离子有[Cu(NH3)4]2+,故答案为:[Cu(NH3)4]2+;
(5)由关系式:Cu~CuAlO2得n(CuAlO2)=[5000g×63.5%/64g/mol]=50.0mol,则CuAlO2为50.0mol,
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×[1/2]=25.0mol,所以需要体积为[25.0mol/1.0mol/L]=25.0L,
故答案为:25.0.点评:
本题考点: 电解原理;氧化还原反应方程式的配平;铜金属及其重要化合物的主要性质.
考点点评: 本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、氧化还原反应的配平以及化学计算,难度不大.1年前查看全部
- 测定银铜合金的成分,将30g合金溶于80mL13.5mol/L的浓硝酸中,完全溶解后,收集气体6.72L(标况),并测得
测定银铜合金的成分,将30g合金溶于80mL13.5mol/L的浓硝酸中,完全溶解后,收集气体6.72L(标况),并测得溶液的PH=0.设溶液体积不变,为80mL.计算
(1)被还原的硝酸物质的量
(2)合金中银的质量分数
——————————————————————————————————
只想搞清楚一个疑问.
算银的摩尔时为什么用硝酸根来算而不用放出气体0.3mol计算?
按照方程式
设 cu=xmol ag=y mol
那么2x+y=0.3应该也没有错吧
可是这样计算到最后是错误的.
而另一种2x+y=0.7我也能理解,但就是不明白为什么会有这样的差异? _21091年前1
_21091年前1 -
 honghongahong 共回答了18个问题
honghongahong 共回答了18个问题 |采纳率83.3%问题在于气体的成分是什么?
你的,2x+y=0.3,估计是认为气体就是NO2,所以从化合价升降的角度得到的吧.
但是,气体的成分应该既有NO2,也有NO,随着反应的进行,浓硝酸变成稀硝酸,所以生成了NO,所以你的式子有问题了.
2x+y=0.7,是从电荷守恒的角度和N元素守恒的角度得到的,所以正确.
另外,这道题目,放到高三做,还存在问题,因为气体中不仅含NO2、NO,还含有N2O4,所以,数据可能还存在问题.
不过,在高一,还没学到,2NO2 = N2O4,因此这样就可以了.1年前查看全部
- 纯锡焊锡丝、锡铜合金焊锡丝、锡银铜合金焊锡丝、松香焊锡丝、免清洗焊锡丝哪个好?各有什么优缺点、熔点各是多少?
 这该nn的生活1年前1
这该nn的生活1年前1 -
 百合格格 共回答了16个问题
百合格格 共回答了16个问题 |采纳率100%我一般使用的是松香焊锡丝,这种焊锡丝是空心的里面带有助焊剂,很方便,效果也不错.
具体熔点不知道.其它类型没用过1年前查看全部
- 将银铜合金30克溶于80毫升13.5摩尔每升的硝酸溶液中合金完全溶解后收集到气体6.72升 反应后体积仍是80毫升 1求
将银铜合金30克溶于80毫升13.5摩尔每升的硝酸溶液中合金完全溶解后收集到气体6.72升 反应后体积仍是80毫升 1求被还原的硝酸的物质的量2求合金中银的质量分数
 阿飞20031年前1
阿飞20031年前1 -
 守护猫 共回答了21个问题
守护猫 共回答了21个问题 |采纳率85.7%3Cu 2NO3 -(氧化剂) 2NO
3x 2x
3Ag NO3 - NO
3y y
(1)n(HNO3还原)=n(NO)=6.72/22.4=0.3mol
(2)2x+y=0.3
3x*64+3y*108=30
所以3y=0.2*3/38,
Ag%=0.2*3*108/38/30=5.68%1年前查看全部
- (2013•广东)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如下:
(2013•广东)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如下:
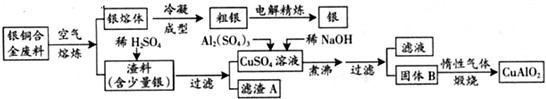
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为______;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为______.
(2)固体混合物B的组成为______;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为______.
(3)完成煅烧过程中一个反应的化学方程式:______CuO+______Al2O3
______CuAlO2+______↑高温 .
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol•L-1的Al2(SO4)3溶液______L.
(5)CuSO4溶液也可用于制备胆矾,其基本操作是______、过滤、洗涤和干燥. 相宜本草sh1年前1
相宜本草sh1年前1 -
 主演你 共回答了22个问题
主演你 共回答了22个问题 |采纳率90.9%解题思路:(1)根据电解原理分析判断;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算;
(5)根据可溶性溶质从溶液中析出晶体的方法;(1)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02:2NO+O2=2NO2;
故答案为:Ag++e-=Ag;2NO+O2=2NO2;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;O2;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=[5000g×63.5%/64g/mol]=50.0mol,则CuAlO2为50.0mol,
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×[1/2]=25.0mol,所以需要体积为
25.0mol
1.0mol•L −1=25.0L,
故答案为:50.0;25.0;
(5)由CuSO4溶液获得CuSO4•5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤等操作,故答案为:蒸发浓缩、冷却结晶.点评:
本题考点: 金属的回收与环境、资源保护;铜金属及其重要化合物的主要性质.
考点点评: 本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,难度不大.1年前查看全部
- 百分数数学题有一块银铜合金,其中含银385克,含铜115克.要是这块合金含银80%,需再加银多少克?
 无霜期1年前1
无霜期1年前1 -
 yzdkm 共回答了16个问题
yzdkm 共回答了16个问题 |采纳率100%合金含银80%,那么含铜20%,铜有115克,合金一共575克,减去铜的115克,就是银的含量460克,再减去原来的385克,得需加75克.1年前查看全部
大家在问
- 1请问下这位老师我有一道题不会写,问题是计算下面圆柱的侧面积 底面积半径是2侧面,高是5cm.请问这怎么
- 2已知在△ABC外作正方形ABDE和ACGF M是BC中点 求证AM=1/2EF
- 3智商多少才能自学成才呢?
- 4一顶点按规律S(t)=2t2+2t(位移s单位m时间t单位s)做直线运动
- 52012年6月27日截止到2014年11月6日共有多少
- 6已知圆环的外圆半径为52mm内圆半径为35mm,用计算器求圆环的面积,写出按键顺序
- 7正玄和余弦的定义
- 8行人等不得随便摘果子(在不同处加标点,使句子有不同的意思.)
- 9上联:发奋识遍天下字.上联:书搜万卷,读书求实用.这两句的下联
- 10民族精神为话题的作文不要作文 帮我取个好名字就好我的作文已经写好了 反正就是将民族精神的
- 11为什么菲涅耳半波带只考虑相邻的半波带叠加呢?
- 12求下面图形中阴影部分的周长(单位:cm)
- 13did he buy the apples 改被动
- 14多项式8x的平方-3x+5与多项式3x的立方+2mx-5x+3相加后,不含一次项.求m的值为
- 15单项式负八分之πxy平方的系数是?次数是?
