微型化录音、录像机的高性能磁带中含有的磁性材料之一是化合物CoFe2O4,其中钴(Co)和铁的化合价只有一种,可能是+2
 sstxgt3332022-10-04 11:39:541条回答
sstxgt3332022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 晋F89898 共回答了18个问题
晋F89898 共回答了18个问题 |采纳率88.9%- 解题思路:根据在化合物中正负化合价代数和为零,结合CoFe2O4的化学式进行解答本题.
若钴和铁元素的化合价相同时,即都为+2价时,则CoFe2O4中化合价的代数和为:(+2)+(+2)×2+(-2)×4≠0;都为+3价时,CoFe2O4中化合价的代数和为:(+3)+(+3)×2+(-2)×4≠0,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,CoFe2O4中化合价的代数和为:(+3)+(+2)×2+(-2)×4≠0,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,CoFe2O4中化合价的代数和为:(+2)+(+3)×2+(-2)×4=0,符合要求.
故填:+2;+3.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度较大,掌握利用化合价的原则计算指定元素的化合价的方法是正确解答的关键. - 1年前
相关推荐
- (2014•浙江模拟)电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求
 (2014•浙江模拟)电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
(2014•浙江模拟)电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(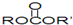 )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
A.放电时Li+移动方向与曲线①一致
B.电解质溶液不能用醋酸溶液代替碳酸酯类
C.充电时阴极反应式:Li++e-═Li
D.充电时b电极接电源的正极 我爱你颖1年前1
我爱你颖1年前1 -
 xiapengzs 共回答了18个问题
xiapengzs 共回答了18个问题 |采纳率88.9%解题思路:放电时电极反应式为:S+2Li+2e-═Li2S,应为原电池的正极,发生还原反应,则a为负极,b为正极,放电时负极反应式为Li-e-=Li+,充电时,a为阴极,b为阳极,电极方程式与原电池电极方程式相反,以此解答该题.放电时电极反应式为:S+2Li+2e-═Li2S,应为原电池的正极,发生还原反应,则a为负极,b为正极,
A.放电时Li+向正极移动,即向b移动,移动方向与曲线②一致,故A错误;
B.因锂可与醋酸反应,则电解质溶液不能用醋酸溶液代替碳酸酯类,故B正确;
C.充电时,阴极发生还原反应生成Li,电极方程式为Li++e-═Li,故C正确;
D.充电时b电极接电源的正极,发生氧化反应生成S,故D正确.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,难度中等.1年前查看全部
- 计算机发展趋势是( )、微型化、网络化和智能化. A.大型化 B.小型化 C.精巧化 D.巨型化
 misebird1年前1
misebird1年前1 -
 lazybear2006 共回答了29个问题
lazybear2006 共回答了29个问题 |采纳率96.6%如题:计算机发展趋势是( )、微型化、网络化和智能化.x0dA.大型化 B.小型化 C.精巧化 D.巨型化1年前查看全部
- 未来的计算机将向( )方向发展.A.智能化 B.微型化 C.网络化 D.巨型化
 烛的泪1年前8
烛的泪1年前8 -
 shiftlr 共回答了15个问题
shiftlr 共回答了15个问题 |采纳率100%A,肯定是智能化了!1年前查看全部
- 微型化录音录像的高性能磁带中,磁粉的主要材料之一是化学组成相当于CoFe 2 O 4 的化合物;又知铁元素在上述化合物中
微型化录音录像的高性能磁带中,磁粉的主要材料之一是化学组成相当于CoFe 2 O 4 的化合物;又知铁元素在上述化合物中为+3价,则钴(Co)的化合价为 [ ]
A.+4
B.+3
C.+2
D.+1 w2768663821年前1
w2768663821年前1 -
 nancy_duan 共回答了24个问题
nancy_duan 共回答了24个问题 |采纳率95.8%C1年前查看全部
- 目前计算机技术的发展趋势 A.智能化 B.自动化 C.标准化 D.网络化 E.巨型化 F.微型化
 唐槐1年前1
唐槐1年前1 -
 cb13cb13 共回答了17个问题
cb13cb13 共回答了17个问题 |采纳率94.1%1.巨型化
巨型化是指计算机的运算速度更高、存储容量更大、功能更强.目前正在研制的巨型计算机其运算速度可达每秒百亿次.
2.微型化
微型计算机已进入仪器、仪表、家用电器等小型仪器设备中,同时也作为工业控制过程的心脏,使仪器设备实现“智能化”.随着微电子技术的进一步发展,笔记本型、掌上型等微型计算机必将以更优的性能价格比受到人们的欢迎.
3.网络化
随着计算机应用的深入,特别是家用计算机越来越普及,一方面希望众多用户能共享信息资源,另一方面也希望各计算机之间能互相传递信息进行通信.
计算机网络是现代通信技术与计算机技术相结合的产物.计算机网络己在现代企业的管理中发挥着越来越重要的作用,如银行系统、商业系统、交通运输系统等.
4.智能化
计算机人工智能的研究是建立在现代科学基础之上.智能化是计算机发展的一个重要方向,新一代计算机,将可以模拟人的感觉行为和思维过程的机理,进行“看”、“听”、“说”、“想”、“做”,具有逻辑推理、学习与证明的能力1年前查看全部
- (2004•云南)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和
(2004•云南)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则钴和铁的化合价分别为( )
A.+2、+2
B.+2、+3
C.+3、+3
D.+3、+2 SELAT_NACYL1年前1
SELAT_NACYL1年前1 -
 w02ic 共回答了17个问题
w02ic 共回答了17个问题 |采纳率94.1%解题思路:根据化合物的化学式为CoFe2O4,利用已知元素的化合价及化合物中正负化合价的代数和为0以及氧元素的化合价为-2价来解答即可.磁粉的化学式为:CoFe2O4;
因为化合物中各元素的化合价代数和为0,而且氧元素的化合价为-2价;
所以该化合物中钴和铁的化合价的和为+8;
若钴和铁元素的化合价相同时,即都为+2价时,则钴和铁的化合价的和为:+2+(+2)×2=+6;都为+3价时,钴和铁的化合价的和为:+3+(+2)×3=+9;则都不符合要求;故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,钴和铁的化合价的和为:+3+(+2)×2=+7,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,钴和铁的化合价的和为:+2+(+3)×2=+8,符合要求;
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉)溶液、稀NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
[已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O]
(1)e处反应的离子方程式为______.
(2)b处的实验现象:______.d处的实验现象:______.
(3)能否通过该实验比较Cl2、FeCl3、KMnO4三种物质的氧化性强弱?______(填“能”或“不能”),若能其氧化性由强到弱的顺序是______. linny11年前1
linny11年前1 -
 dd一次 共回答了22个问题
dd一次 共回答了22个问题 |采纳率86.4%解题思路:(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,d处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)b处氯气能置换出碘,2KI+Cl2═2KCl+I2,碘遇淀粉变蓝色,d处发生的反应为:2FeCl2+Cl2═2FeCl3,Fe3+和SCN-反应使溶液变红色氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以b处看到的现象是溶液变蓝色,d处看到的现象是溶液变红色,
故答案为:溶液由无色变蓝色;溶液由浅绿色变红色;
(3)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3,
故答案为:能;KMnO4>Cl2>FeCl3.点评:
本题考点: 氯气的化学性质.
考点点评: 本题以氯气的性质为载体考查学生氧化还原反应的有关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,难度不大.1年前查看全部
- 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置
 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
(1)e处反应的离子方程式为______.该反应中发生反应的氧化剂和还原剂的物质的量之比为______.
(2)b处的实验现象:______,d处的实验现象:______.
(3)c处反应的化学方程式为______.标准状况下,当有0.224L Cl2被NaOH溶液吸收后,转移电子的物质的量为______ mol.
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱顺序是______. 双挟1年前1
双挟1年前1 -
 fancyfhx 共回答了16个问题
fancyfhx 共回答了16个问题 |采纳率93.8%解题思路:(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;高锰酸钾是氧化剂盐酸是还原剂,根据高锰酸钾和参加氧化还原反应的盐酸的计量数判断氧化剂和还原剂的物质的量之比;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,结合元素化合价的变化计算;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性.(1)e处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,反应中Mn元素化合价由+7价降至+2价,所以氧化剂为KMnO4,Cl元素化合价由-1价升高为0价,所以还原剂为HCl,氧化剂和还原剂的物质的量之比为2:10=1:5,
故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;1:5;
(2)生成的氯气在a处与碘化钾反应,置换出碘,可观察到溶液由无色变为蓝色,生成的氯气在d处与氯化亚铁反应,将亚铁离子氧化为铁离子,可观察到溶液变为红色,
故答案为:溶液由无色变为蓝色;溶液由浅绿色变为红色;
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
当有0.224L Cl2被NaOH溶液吸收后,即有0.01mol氯气被吸收,反应中Cl元素化合价由0价分别变化为-1价、+1价,则转移电子0.01mol,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;0.01;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由e处反应可知氧化性为KMnO4>Cl2,由d处反应可知氧化性为Cl2>FeCl3,则氧化性由强弱顺序为KMnO4>Cl2>FeCl3,故答案为:KMnO4>Cl2>FeCl3.点评:
本题考点: 氯气的化学性质.
考点点评: 本题以氯气的性质为载体考查学生氧化还原反应的有关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,题目难度不大.1年前查看全部
- 科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置
科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置.

(1)图乙中微型塑料滴管在实验中的作用与图甲中的仪器相同______(填字母编号).
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是______.
(3)写出实验室制取二氧化碳的化学方程式______.
(4)木炭与氧化铜在高温下可发生化学反应C+CuO═C+CO2请改正写出正确的化学方程式C+2CuO
2Cu+CO2↑高温 .C+2CuO.实验室为什么不用此方法制取二氧化碳的原因______.
2Cu+CO2↑高温 . 月满西楼YY1年前1
月满西楼YY1年前1 -
 在uu中轮回 共回答了20个问题
在uu中轮回 共回答了20个问题 |采纳率95%解题思路:从实验室制取二氧化碳的反应原理及装置和操作是否安全、简便、现象明显,药品是否易得、经济、环保节能等方面进行分析,来解答本题.(1)图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗仪器相同;故填:A;
(2)采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作;故填:药品用量少,产生的废弃物也少,方便操作;
(3)根据实验室制取二氧化碳的反应物、生成物、反应条件写出化学反应的方程式为:CaC03+2HCl=CaCl2+H20+C02↑;
(4)反应需在高温下进行,操作不便又因二氧化碳和碳在高温条件下能生成一氧化碳,反应的化学方程式为:CO2﹢C
高温
.
2CO,这样制取的二氧化碳中会混有一氧化碳,故填反应需在高温下进行,操作不便;制取的二氧化碳中会混有一氧化碳.
故答案:(1)A;(2)药品用量少,产生的废弃物也少,方便操作;(3)CaC03+2HCl=CaCl2+H20+C02↑;(4)C+2CuO
高温
.
2Cu+CO2↑;反应需在高温下进行,操作不便;制取的二氧化碳中会混有一氧化碳.点评:
本题考点: 二氧化碳的实验室制法;二氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题综合考查了二氧化碳的性质及实验室制取气体应从原理是否科学、严谨、合理,装置和操作是否安全、简便、现象明显,药品是否易得、经济、环保节能等方面进行分析的能力.1年前查看全部
- (2011•宝山区一模)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按如下图所示的装置和试剂完成了
(2011•宝山区一模)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按如下图所示的装置和试剂完成了一个实验.
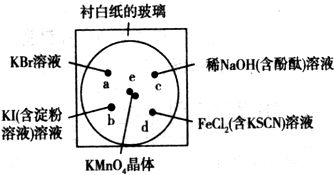
实验步骤:
①a、b、c、d四处各滴1滴如图所示的试液,浓度均为0.1mol•L-1;
②圆心e处放有2粒芝麻粒大小的KMnO4晶体,向晶体滴加1滴浓盐酸后,在试剂上盖上表面皿.
(1)e处产生黄绿色气体,写出e处发生反应的化学方程式(不用配平):
______+______→MnCl2+______+______+______
该反应中氧化剂与还原剂的物质的量之比为______.
(2)a处反应的离子方程式为______;d处的实验现象为______.
(3)通过该实验,能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?______(填“能”或“不能”),若能,三者氧化性由强到弱的顺序是______.(若认为“不能”,则此空不用填写) zxcvpyiosyfasd1年前1
zxcvpyiosyfasd1年前1 -
 WQL随心 共回答了16个问题
WQL随心 共回答了16个问题 |采纳率87.5%解题思路:(1)e处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,再根据电子转移守恒、原子守恒平衡配平方程式.
根据反应判断反应中的氧化剂为KMnO4,还原剂为HCl,根据电子转移守恒可知氧化剂和还原剂的物质的量之比为1:5.
(2)生成的氯气在a处与溴化钾反应,置换出溴;
生成的氯气在d处与氯化亚铁反应,将亚铁离子氧化为铁离子.
(3)根据反应方程式判断氧化性强弱.(1)e处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:
2 KMnO4+16 HCl(浓)═2 MnCl2+2 KCl+5 Cl2+8 H2O.反应中Mn元素化合价由+7价降至+2价,所以氧化剂为KMnO4,Cl元素化合价由-1价升高为0价,所以还原剂为HCl,氧化剂和还原剂的物质的量之比为2:10=1:5.
故答案为:2 KMnO4+16 HCl(浓)═2 MnCl2+2 KCl+5 Cl2+8 H2O;1:5.
(2)a处发生的反应为2KBr+Cl2═2KCl+Br2,离子方程式为2Br-+Cl2═2Cl-+Br2;
d处发生的反应为2FeCl2+Cl2═2FeCl3,Fe3+和SCN-反应使溶液变红色.
故答案为:2Br-+Cl2═2Cl-+Br2;溶液变红色.
(3)e处实验说明氧化性KMnO4>Cl2,d处实验说明氧化性Cl2>FeCl3,
因此,三种物质氧化性强弱顺序为KMnO4>Cl2>FeCl3.
故答案为:能;MnO4>Cl2>FeCl3.点评:
本题考点: 氧化还原反应方程式的配平;氧化性、还原性强弱的比较.
考点点评: 以实验形式考查氧化还原反应,难度中等,注意高锰酸钾与盐酸反应,盐酸起还原剂、酸性作用.1年前查看全部
- 未来的计算机将向什么方向发展A 汇编 B 微型化 C信息化 D网络化 多选题
 0011aaa00111年前4
0011aaa00111年前4 -
 慢慢长大的鱼 共回答了14个问题
慢慢长大的鱼 共回答了14个问题 |采纳率100%BD1年前查看全部
- 初三物理题手机已成为现代社会不可缺少的电子通讯设备之一,具备智能化,微型化,安全化,多功能化的优点,所以越来越普及化.已
初三物理题
手机已成为现代社会不可缺少的电子通讯设备之一,具备智能化,微型化,安全化,多功能化的优点,所以越来越普及化.已知某品牌的手机电池标签如图12所示(标称电压:3.7V,额定容量800mAh,充电限制电压4.2V),其中"标称电压"是指能使手机正常工作的额定电压值.根据电池板标签的内容完成下面的问题.
(1)该手机电池板正常充足电之后所含的电能为多少焦
(2)测得该手机在正常通话情况下的平均电流为0.16安培,试求该电池板充足电之后能维持连续多少分钟的通话时间
(3)若将充足电的电池板装入手机后让手机处于待机状态,发现手机能够维持160小时待机时间,试求该手机的待机平均电流为多少毫安
大家帮个忙啊,今天的作业,不知道额定容量什么意思,老师没教、、、步骤具体点,谢谢大家啦!~~~
 niu10191年前1
niu10191年前1 -
 无知无为无力 共回答了26个问题
无知无为无力 共回答了26个问题 |采纳率92.3%把概念搞搞清楚吧,(1)额定容量就是电池充足电后的电能,只不过单位是mAh,把它转化为焦耳就可以了,如W=0.8A*3.7V*3600S=10656J
(2)这个没什么好说,工作电压知道,电流知道,电能也知道,求时间:电能=电压×电流×时间.Q=0.16A*3.7V=0.592W, T=10656/0.592=18000S=5h
(3)第三题如第二题,只不过已知条件变化,知道电压,电能,时间,求电流.公式不变.
t=160*3600=576000s, w/(t*u)=0.005A=5mA
数字计算从上一个答案中直接考的,懒得计算,请自行检查.1年前查看全部
- (2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(C
(2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则铁和钴的化合价分别为( )
A.+3、+2
B.+2、+3
C.+2、+2
D.+3、+3 mond1年前1
mond1年前1 -
 放开nagenvhai 共回答了15个问题
放开nagenvhai 共回答了15个问题 |采纳率93.3%解题思路:根据在化合物中正负化合价代数和为零,结合CoFe2O4的化学式进行解答本题.若钴和铁元素的化合价相同时,即都为+2价时,则CoFe2O4中化合价的代数和为:(+2)+(+2)×2+(-2)×4≠0;都为+3价时,CoFe2O4中化合价的代数和为:(+3)+(+3)×2+(-2)×4≠0,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,CoFe2O4中化合价的代数和为:(+3)+(+2)×2+(-2)×4≠0,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,CoFe2O4中化合价的代数和为:(+2)+(+3)×2+(-2)×4=0,符合要求.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度较大,掌握利用化合价的原则计算指定元素的化合价的方法是正确解答的关键.1年前查看全部
- 未来计算机将朝着微型化、巨型化、智能化以及什么化方向发展
 忠义家风1年前1
忠义家风1年前1 -
 恶与善 共回答了13个问题
恶与善 共回答了13个问题 |采纳率92.3%网络化.1年前查看全部
- (2011•崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位
 (2011•崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011•崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
已知反应中有关物质的转化过程为:
KMnO4→MnCl2;
HCl→Cl2
(1)e 处的化学反应方程式为______该反应中氧化剂与还原剂的物质的量之比为_______,电子转移的数目为______.
(2)b处的实验现象为______,c处的实验现象为______.
(3)a处的反应方程式为______.
(4)通过该实验可比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是______. zhouhui1231年前1
zhouhui1231年前1 -
 小杯子 共回答了15个问题
小杯子 共回答了15个问题 |采纳率100%解题思路:(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;高锰酸钾是氧化剂盐酸是还原剂,根据高锰酸钾和参加氧化还原反应的盐酸的计量数判断氧化剂和还原剂的物质的量之比,根据化合价变化判断转移电子数目;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中氧化剂是高锰酸钾,还原剂是盐酸,根据转移电子守恒知,当2mol高锰酸钾参加反应时,参加氧化还原反应的盐酸的物质的量是10mol,所以氧化剂和还原剂的物质的量之比=2:10=1:5,转移电子数目=2(7-2)=10,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;1:5;10;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以b处看到的现象是溶液变蓝色,c处看到的现象是溶液变红色,故答案为:溶液变蓝色;溶液变红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3,
故答案为:KMnO4>Cl2>FeCl3.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题关键,知道常见的氧化剂及还原剂,会根据方程式判断物质氧化性强弱,难度不大.1年前查看全部
- 微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+
微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则钴和铁的化合价分别为( )
A. +2、+2
B. +2、+3
C. +3、+3
D. +3、+2 金川公夫1年前1
金川公夫1年前1 -
 元旦节快乐 共回答了27个问题
元旦节快乐 共回答了27个问题 |采纳率85.2%解题思路:根据化合物的化学式为CoFe2O4,利用已知元素的化合价及化合物中正负化合价的代数和为0以及氧元素的化合价为-2价来解答即可.磁粉的化学式为:CoFe2O4;
因为化合物中各元素的化合价代数和为0,而且氧元素的化合价为-2价;
所以该化合物中钴和铁的化合价的和为+8;
若钴和铁元素的化合价相同时,即都为+2价时,则钴和铁的化合价的和为:+2+(+2)×2=+6;都为+3价时,钴和铁的化合价的和为:+3+(+2)×3=+9;则都不符合要求;故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,钴和铁的化合价的和为:+3+(+2)×2=+7,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,钴和铁的化合价的和为:+2+(+3)×2=+8,符合要求;
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 指纹识别是通过比较不同指纹细节的特征来进行鉴别,反应了计算机朝着( )方向发展.A巨型化 B微型化 C网络化 D智能化
 卡基布1年前2
卡基布1年前2 -
 tangzhiyu 共回答了13个问题
tangzhiyu 共回答了13个问题 |采纳率92.3%d1年前查看全部
- 47、计算机发展的方向是巨型化、微型化、网络化、智能化.其中“巨型化”是指?
47、计算机发展的方向是巨型化、微型化、网络化、智能化.其中“巨型化”是指?
A、体积大
B、重量重
C、功能更强、运算速度更高、存储容量更大
D、外部设备更多 鱼鱼72791年前1
鱼鱼72791年前1 -
 纪小彤 共回答了22个问题
纪小彤 共回答了22个问题 |采纳率86.4%c1年前查看全部
大家在问
- 1英语翻译“Excuse me” is another short polite usage.We use it the
- 21,2,
- 3如图,四边形ABCD中,∠B=∠D=90°,AE、CF分别是∠BAD和∠BCD的内角或外角平分线,请写出AE,CF的位置
- 4把leaf和always翻译一下
- 5英语翻译要是有知道的 一定要说!救人一命盛造七级浮屠!求求各位帅哥美女,大哥大姐,大爷大妈了!
- 6如图,两个等圆圆心O和圆心O‘相交于 P,Q两点,TP和NP分别是圆心O和圆心O’过点P的切线.求∠TPN的大小
- 7下列各组有机物中,只加入溴水不能鉴别的是( )
- 8藏在心底的歌550字作文
- 9(x+a)/(y+b)的几何意义?
- 10科学实验试管 加入物质 温度 试剂1 淀粉糊+清水 37℃ 碘液2 淀粉糊+唾液 37℃ 碘液在本实验中,变重的是___
- 11接力赛 作文
- 12“我的业余爱好是喜欢打乒乓球和集邮“如何修改这个病句?
- 13第一节:完型填空(共10小题,每小题1分,共10分)阅读下面短文,掌握其大意,然后从21 - 30各题所给的四个选项中,
- 14已知A=2x²+3xy-2x=1,b=-x²+xy-1,且3A+6B的值与x无关,求y的值
- 15直接写出得数:90÷30= 270÷90= 12×40= 57+120= 630-80= 125×8= 6×35= 19
