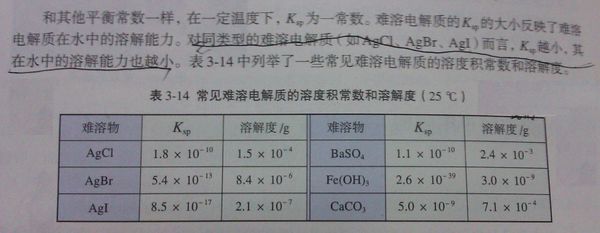
AgCl和Ag2CrO4的溶度积分别为1.8×10-10 mol2•L-2和2.0×10-12 mo
 大爱暖千秋2022-10-04 11:39:541条回答
大爱暖千秋2022-10-04 11:39:541条回答A. AgCl和Ag2CrO4的溶解度相等
B. AgCl的溶解度大于Ag2CrO4的溶解度
C. 两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D. 都是难溶盐,溶解度无意义

已提交,审核后显示!提交回复
共1条回复
 nightmoon101 共回答了15个问题
nightmoon101 共回答了15个问题 |采纳率100%- 解题思路:设AgCl溶解的浓度为xmol/L,则溶液中的银离子浓度为xmol/L,氯离子也为xmol/L,则根据溶度积为1.8×10-10 mol2•L-2可以计算出x;同理可以设Ag2CrO4溶解的浓度为ymol/L,则溶液中的银离子浓度为2ymol/L,氯离子也为ymol/L,再根据溶度积为2.0×10-12 mol3•L-3计算出y,比较x和y即可解答;
设AgCl溶解的浓度为xmol/L,则溶液中的银离子浓度为xmol/L,氯离子也为xmol/L,则根据溶度积为1.8×10-10=x×x,解得x=1.35×10-5mol/L
同理设Ag2CrO4溶解的浓度为ymol/L,则溶液中的银离子浓度为2ymol/L,氯离子也为ymol/L,再根据溶度积为2.0×10-12 计=(2y)2×y,解得y=0.8×10-4mol/L,故溶度积小的溶解度反而大,所以Ksp的大小与溶解能力没有一定的关系;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡,本题难度中等,比较溶解度大小,若用溶度积必须是同类型,否则不能比较. - 1年前
相关推荐
- 关于溶度积~假设碳酸钡的溶度积为a,那么将适量碳酸钡固体溶于水,达到沉淀溶解平衡,那么此时溶液中钡离子的浓度为根号a吗?
关于溶度积~
假设碳酸钡的溶度积为a,那么将适量碳酸钡固体溶于水,达到沉淀溶解平衡,那么此时溶液中钡离子的浓度为根号a吗?答案竟然是大于根号a,是因为碳酸根离子水解的缘故吗? hk82s6m1年前2
hk82s6m1年前2 -
 wuhuaguo 共回答了21个问题
wuhuaguo 共回答了21个问题 |采纳率85.7%是的.
如果不考虑水解的话,如下平衡:BaCO3 =可逆= Ba2+ + CO32-
达到平衡时,钡离子的浓度=根号a
但是现在要考虑水解,那么碳酸根会被消耗,所以碳酸钡的电离平衡会向右移动,则Ba2+浓度大于根号a1年前查看全部
- 溶度积与溶解度的换算题对于Ag2CrO4,S=0.00445g,求Ksp请问如何计算?麻烦给个过程,
 马三立1年前1
马三立1年前1 -
 为非nnk 共回答了28个问题
为非nnk 共回答了28个问题 |采纳率82.1%溶解度 S=0.00445 g/100 mL (题目单位不对?!)
==》 S=0.0445 g/L ==>0.0445/331.73 mol/L = 1.34 x10^-4 mol/L
因为,Ag2CrO4 ---> 2Ag+ + CrO42-
[Ag+]= 2S=2.68x10^-4,[CrO42-]=S=1.34x10^-4
Ksp=[Ag+]^2[CrO42-]=9.66x10^-121年前查看全部
- 根据MgOH2的溶度积,计算在25度时 MgOH2在水中的溶解度?
 刘思博1年前1
刘思博1年前1 -
 疑惑着 共回答了26个问题
疑惑着 共回答了26个问题 |采纳率88.5%由溶度积算出的溶解度是用物质的量浓度表示:
查得:Ksp[Mg(OH)2] = 5.61*10^-12
Mg(OH)2 = Mg2+ + 2OH-
s 2s
[Mg2+][OH-]^2 = Ksp
4s^3 = Ksp
s = (Ksp/4)^1/3
= (5.61*10^-12 / 4 )^1/3
= 1.12*10^-4 (mol/L)1年前查看全部
- 19.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
19.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl溶液中加入盐酸,Ksp值变大]
B.AgNO3溶液与NaCl溶液混合后的 溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,说明AgCl溶解度小于AgI
2、25℃时,在浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的溶液中,测得其中c(NH4+)分别为a、b、c(mol·L-1),则下列判断正确的是( )
A.a>b>c B.c>a>b
C.b>a>c D.a >c>b
3/、下列离子组能在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是( )
A、钠离子 二价铁离子 氯离子 硫酸根离子
B、钡离子 钾离子 碳酸根离子 氯离子
C、铝离子 钙离子 氯离子 硝酸根离子
D、钠离子 钡离子 硝酸根离子 碳酸氢根离子
不会的就不要乱写 阿博二世1年前1
阿博二世1年前1 -
 千娇42媚 共回答了19个问题
千娇42媚 共回答了19个问题 |采纳率89.5%1.D首先说的是Ksp仅与温度有关,无其他任何因素的事,B选项乱说得不行了我相信你懂,因为它没说量是多少,C是因为Ksp只是一个判断是否会析出晶体的值,也就是说假如我有1mol的AgCl的不饱和溶液,我现在一直往里面假如NaCl,那么当达到c(Ag+)×c(Cl-)=Ksp时候就开始有AgCl析出了,因为c(Ag+)×c(Cl-)不能大于Ksp,但是AgCl不是饱和的.
2.B勒夏特列原理你没弄好,记住平衡只能减弱不能抵消,你直接先看分子式,在高中阶段无论怎么样分子式中那个角标越大的浓度就越大,碳酸根促进铵根水解,所以剩余的比c少,因为亚铁例子水解会抑制铵根水解,但他们浓度都大于a,因为铵根角标为2,这个你一定要记好!
3.D A中五气体产生,B中钡离子与碳酸根离子不能共存,会生成沉淀,C中夜市布能产生气体,D碳酸氢根与NaOH反应生成碳酸根的时候能与钡离子结合生成沉淀,与盐酸反应则直接生成二氧化碳1年前查看全部
- 硫酸钙溶度积测定中误差偏大的原因有哪些
 雨中uu1年前1
雨中uu1年前1 -
 feixiangdeying 共回答了21个问题
feixiangdeying 共回答了21个问题 |采纳率85.7%硫酸钙 纯度不够里面有其它易溶解的物质,再一个是要用去离子水或超纯水1年前查看全部
- 关于同类的难溶化合物和难溶化合物的溶度积计算
关于同类的难溶化合物和难溶化合物的溶度积计算
我想问一下同类的难溶化合物是什么,硫酸钡和氯化银不是同类的难溶化合物吗?
我用硫酸钡的溶度积算得的溶解度怎么是2.4X10^-4呢? opopopo6281年前1
opopopo6281年前1 -
 mesosome 共回答了16个问题
mesosome 共回答了16个问题 |采纳率93.8%答:
(1)在本题中,“同类的难溶化合物”指的是:
阳离子相同,阴离子相似;或阴离子相同,阳离子相似 的两种难溶化合物.
在本题中,阳离子均为银离子,阴离子均为卤素离子.
(2)硫酸钡在20°C时溶解度确实为2.4×10^-4g,在25度时没有具体数据,但肯定不是2.4×10^-3g ,书上打错了,你算对了.
欢迎追问,1年前查看全部
- 已知PbI2在水中的溶解度为1.20×10^-3摩尔每升,求PbI2的溶度积?
 矜娉1年前1
矜娉1年前1 -
 cyx456 共回答了17个问题
cyx456 共回答了17个问题 |采纳率76.5%已知碘化铅的溶解度为1.20×10^-3摩尔每升,可得铅离子的溶解度为1.20×10^-3摩尔每升,碘离子的溶解度为铅离子的二倍,由溶度积原理可得:
kspPbI2=碘离子浓度的二倍*铅离子的浓度=1.728*10^-91年前查看全部
- 什么是化学溶度积?
 a161761年前1
a161761年前1 -
 han2yan 共回答了22个问题
han2yan 共回答了22个问题 |采纳率100%中文名称:溶度积 英文名称:solubility product 定义:在一定温度下难溶电解质饱和溶液中相应的离子之浓度的乘积,其中各离子浓度的幂次与它在该电解质电离方程式中的系数相同.
例5-5 已知Ca3(PO4)2的K sp为2.0×10-29,求: (1) Ca3(PO4)2 在纯水中的溶解度; (2)Ca3(PO4)2在0.10 mol·L-1Na3PO4溶液中的溶解度. S=6.2×10-7 即Ca3(PO4)2在纯水中的溶解度为 6.2×10-7 mol·L-1. 因为S很小,所以 2S+0.10≈0.10 =[c(Ca2+)/c ]3 [c(PO )/c ]2 =(3S)3(2S+0.10)2 ≈(3S)3(0.10)2=2.0×10-29 S=4.2×10-10 即Ca3(PO4)2在0.10 mol·L-1Na3PO4溶液中溶解度为4.2×10-10mol·L-1.1年前查看全部
- 什么是浓度积?和溶度积的区别
 chaofeng31年前2
chaofeng31年前2 -
 tomatowu 共回答了18个问题
tomatowu 共回答了18个问题 |采纳率83.3%Ksp是溶度积. Q为浓度积.当Q>Ksp,有沉淀生成;当Q1年前查看全部
- 什么浓度商啊?浓度商与溶度积有什么不同?
什么浓度商啊?浓度商与溶度积有什么不同?
.
请举例说明 bigeyes_cat1年前1
bigeyes_cat1年前1 -
 zhhb 共回答了20个问题
zhhb 共回答了20个问题 |采纳率85%浓度商溶度积的区别在于状态的不同:
1、溶度积是平衡时的浓度商
即达到平衡时,各离子浓度(活度)的“乘积”关系.如:
AgCl = Ag+ + Cl-
[Ag+][Cl-] = K = Ksp
[ ] 中表示达到沉淀溶解平衡时(即饱和溶液)的离子的浓度
2、浓度商是任意时候的离子浓度
C(Ag+)C(Cl-) = J
J(或者用Q表示)浓度商,C表示任意时候的浓度
3、比较J与Ksp大小可以判断沉淀或溶解,即溶度积规则1年前查看全部
- 判断正误:难溶电解质的溶度积越小,则它的溶解度越小.
 latao1年前1
latao1年前1 -
 梁慧芳 共回答了25个问题
梁慧芳 共回答了25个问题 |采纳率100%这个结论是错误的
溶度积是饱和时各离子的浓度之幂的乘积,而溶解度是指饱和溶液中的溶质质量(每100克水)
首先,一个是摩尔浓度,一个是质量,之间还有摩尔质量的关系,不一定容度积小,溶解度小
另外,对于结构不同的物质也不适用,如铬酸银与氯化银,设他们的饱和浓度为c,对铬酸银,4倍C的三次方为溶度积,对氯化银,c的平方为溶度积,显然,可以铬酸银的溶度积小于氯化银而溶解度大,事实上,也是这样.
综上,溶度积与溶解度无必然联系.1年前查看全部
- 一定温度下,氯化银中加入硝酸银,溶度积如何变化
一定温度下,氯化银中加入硝酸银,溶度积如何变化
那溶解度呢 yiyi801年前2
yiyi801年前2 -
 好人鹏鹏 共回答了12个问题
好人鹏鹏 共回答了12个问题 |采纳率91.7%不变.1年前查看全部
- 溶度积和溶解度的关系,同离子效应的影响
 宋晓波1年前1
宋晓波1年前1 -
 青芒果2202 共回答了14个问题
青芒果2202 共回答了14个问题 |采纳率92.9%两者之间关系是:一般来讲,当电解质的电离度相差不大时溶解度越大其溶度积与弱电解质的离解平衡一样,难溶电解质的溶解平衡也受同离子效应的影响,1年前查看全部
- 求草酸镁的溶度积如题如题
 反对萨非ll大1年前1
反对萨非ll大1年前1 -
 cheyong119 共回答了14个问题
cheyong119 共回答了14个问题 |采纳率100%8.57*10^-51年前查看全部
- 焦磷酸钙常温下的溶度积是多少?请注意是焦磷酸钙,不是磷酸钙
 接龙2571年前1
接龙2571年前1 -
 kobe_chen 共回答了19个问题
kobe_chen 共回答了19个问题 |采纳率84.2%Ca2P2O7
Calcium pyrophosphate is a sparingly soluble salt in water with a solubility product of Ksp=3×10−18.
But.for triclinic calcium pyrophosphate (beta-Ca2P2O7.2H2O crystal) Ksp=1.14x10-301年前查看全部
- 求焦磷酸锌溶度积?
 QIQI绮1年前2
QIQI绮1年前2 -
 水梦鱼 共回答了15个问题
水梦鱼 共回答了15个问题 |采纳率100%好像查不到相关数据,溶度积常数是不受PH值限制的,它受温度、溶剂的影响.溶解度才受PH值、离子强度、络合剂、沉淀剂的影响.给定溶度积常数,可以计算不同PH值的溶解度.1年前查看全部
- 说一下【化学】无机化学的溶度积计算题镍有晓得的人就说下哈,蹲
 我是安静1年前1
我是安静1年前1 -
 雨中哭泣的女子 共回答了24个问题
雨中哭泣的女子 共回答了24个问题 |采纳率87.5%她消失了!消失了!然而
你的每一半都活着,仍能完整地爬行.
说这些,对一些人
与人们的眼睛相差无几,当他们朝前看,心中没有恐惧,
落了又涨,抱怨天气,
在暮色来临的后哈哈1年前查看全部
- 溶度积和活度积有什么区别?最好举个例子
 caoanroad48001年前1
caoanroad48001年前1 -
 amandaxy 共回答了24个问题
amandaxy 共回答了24个问题 |采纳率91.7%在看到这个问题之前没有听说有活度积这个说法.
对于浓度积,一般是对溶解性比较低的离子对而言.若需要对浓度积和活度积进行举例的话,如硫酸钡在25°C水中的Ksp为1.1×10^-10,若硫酸根的活度系数为0.99,钡离子的活度系数为0.98,则硫酸钡在25°C水中的活度积为0.99*0.98*KSP.1年前查看全部
- 化学平衡常数,电离平衡常数,溶度积都只与温度有关吗?
 球神不败佛1年前3
球神不败佛1年前3 -
 mwd223 共回答了17个问题
mwd223 共回答了17个问题 |采纳率100%对1年前查看全部
- 化学离子积,溶度积,电离常数用什么符号表示?
 zhenhaoqi1年前4
zhenhaoqi1年前4 -
 zjzangel 共回答了21个问题
zjzangel 共回答了21个问题 |采纳率85.7%化学离子积Kw,溶度积Ksp,电离常数K1年前查看全部
- 有难溶物质可以随温度升高而溶度积降低吗?
 热的带鱼1年前1
热的带鱼1年前1 -
 zeroex2000 共回答了22个问题
zeroex2000 共回答了22个问题 |采纳率77.3%氢氧化钙1年前查看全部
- 同一溶液中的几种离子、生成沉淀时 溶度积越小 越先生成沉淀么?
 落叶是紫色的1年前1
落叶是紫色的1年前1 -
 gang121 共回答了14个问题
gang121 共回答了14个问题 |采纳率92.9%基本上可以说是这样、、生成同种类型沉淀的时候是这样的 不同种沉淀时 要考虑溶液中离子浓度1年前查看全部
- 哪些因素影响难溶盐氯化银溶度积的实验测定结果
 zq1680081年前2
zq1680081年前2 -
 musi250 共回答了15个问题
musi250 共回答了15个问题 |采纳率93.3%温度,还有原溶液中是否有银离子或氯离子1年前查看全部
- 已知Ca(OH)2的溶度积怎么求钙离子 的溶度积,只能算出浓度?
 百达1年前1
百达1年前1 -
 malalala 共回答了21个问题
malalala 共回答了21个问题 |采纳率100%在已知溶度积,没有其他条件下,只能计算饱和溶液中的离子浓度.
Ca(OH)2的溶度积表达式为Ksp=c(Ca2+)·c(OH-)2【此处2是指数,即c(OH-)的平方】
在Ca(OH)2饱和溶液中c(OH-)=2c(Ca2+)
所以Ksp=c(ca2+)·c(OH-)2=c(ca2+)·[2c(Ca2+)]2=4c(Ca2+)3【此处3是指数,即c(Ca2+)的3次方】,在已知Ksp的条件下,根据上面的等式就可以求出c(Ca2+)了,c(OH-)则是c(Ca2+)的2倍.
需要说明的是没有钙离子的溶度积这种说法.1年前查看全部
- 已知303K时,Ag2CrO4的溶解度为1.0×10-4 mol/L,则该温度下Ag2CrO4的溶度积Ksp为
 夜来夜无语1年前1
夜来夜无语1年前1 -
 rxh2004 共回答了11个问题
rxh2004 共回答了11个问题 |采纳率90.9%1254361年前查看全部
- 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
回答下列问题:电解质 平衡方程式 平衡常数K Ksp CH3COOH CH3COOH⇌CH3COO-+H+ 1.76×10-5 H2CO3 H2CO3⇌H++HCO3-
HCO3-⇌H++CO32-K1=4.31×10-7
K2=5.61×10-11C6H5OH C6H5OH⇌C6H5O-+H+ 1.1×10-10 H3PO4 H3PO4⇌H++H2PO4-
H2PO4-⇌H++HPO42-
HPO42-⇌H++PO43-K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13NH3•H2O NH3•H2O⇌NH4++OH- 1.76×10-5 BaSO4 BaSO4⇌Ba2++SO42- 1.07×10-10 BaCO3 BaCO3⇌Ba2++CO32- 2.58×10-9
(1)由上表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为______(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:______;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式Kh=c(HCO3−).c(OH−) c(CO32−) Kh=.c(HCO3−).c(OH−) c(CO32−) 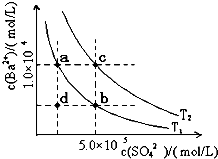
(6)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1______T2(填>、=、<),T2温度时Ksp(BaSO4)=______;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理.若使BaSO4中的SO42-全部转化到溶液中,需要反复处理______次.[提示:BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42- (aq)]. 11_241年前1
11_241年前1 -
 red_apple3 共回答了12个问题
red_apple3 共回答了12个问题 |采纳率100%解题思路:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠;
(3)25℃时,醋酸和一水合氨的电离平衡常数相等,则等浓度等体积的醋酸和一水合氨混合,溶液呈中性;
(4)相同温度下,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨或苯酚铵和苯酚;
B.如果溶液呈酸性,溶液中的溶质为苯酚和苯酚铵混;
C.含有弱根离子的盐促进水电离;
D.任何电解质溶液中都遵循物料守恒;
(5)Kh=
;c(HCO3−).c(OH−) c(CO32−)
(6)I.①升高温度促进难溶物溶解;Ksp(BaSO4)=c(Ba2+).c(SO42-);
②A.硫酸钠抑制硫酸钡电离;
B.在T1曲线上方区域(不含曲线)为过饱和溶液;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大;
II.根据化学方程式和化学平衡常数进行计算.(1)同一温度下,酸的电离常数越大其酸性越强,根据这几种酸的电离平衡常数知,它们的酸性强弱顺序是:①④③②,故答案为:①④③②;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠,离子方程式为:C6H5OH+PO43-=C6H5O-+HPO42-,故答案为:C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,醋酸和一水合氨的电离平衡常数相等,则等浓度等体积的醋酸和一水合氨混合,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得(H+)+(NH4+)=c(OH-)+c(CH3COO-),所以得(NH4+)=c(CH3COO-),故答案为:=;
(4)相同温度下,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨,苯酚和氨水的浓度相等,要使溶液呈碱性,苯酚的体积小于或等于或大于氨水体积都可能使混合溶液呈碱性,故A错误;
B.若混合液pH<7,溶液中的溶质为苯酚和苯酚铵,pH<7,则c(H+)>c(OH-),溶液中电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(C6H5O-)+c(OH-),所以c(C6H5O-)>c(NH4+),故B错误;
C.含有弱根离子的盐促进水电离,酸抑制水电离,所以苯酚铵促进水电离,苯酚抑制水电离,故C错误;
D.任何电解质溶液中都遵循物料守恒,根据物料守恒得V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH),故D正确;
故选D;
(5)Kh=
c(HCO3−).c(OH−)
c(CO32−),故答案为:Kh=
c(HCO3−).c(OH−)
c(CO32−);
(6)Ⅰ.①升高温度促进难溶物溶解,根据图象知T2的溶度积常数大于T1,所以T1<T2;Ksp(BaSO4)=c(Ba2+).c(SO42-)=1.0×10-4×5.0×10-5=5×10-9,;
故答案为:T1<T2;5.0×10-9;
②A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故选ABC;
Ⅱ.设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/2.0−x]=0.042
解得:x=0.081,处理次数=[0.2mol/0.081mol]=2.5,所以至少处理3次;
故答案为:3次.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了难溶电解质的溶解平衡及弱电解质的电离,正确理解溶度积曲线是解本题关键,结合溶度积常数来分析解答,难度中等.1年前查看全部
- 为什么不同难溶电解质的溶度积与溶解度的关系式不同,就不能反映出他们的溶液中离子浓度的大小
 广东第九浪子1年前3
广东第九浪子1年前3 -
 ILoveMiss 共回答了16个问题
ILoveMiss 共回答了16个问题 |采纳率100%溶度积(Ksp)=(C(Am+) )^n ( C(mBn-))^m 他的数值与其化学式中的系数有关的,不能直接反应其离子浓度的大小关系,但如果正负离子的电荷数比为1:1,那就简单多了,能直观的看出来.
望采纳.1年前查看全部
- 依据各沉淀溶度积由小到大的顺序依次生成各种沉淀
依据各沉淀溶度积由小到大的顺序依次生成各种沉淀
为什么.. 月临花径影交加1年前1
月临花径影交加1年前1 -
 大块头大手机 共回答了15个问题
大块头大手机 共回答了15个问题 |采纳率100%溶度积越小表示离子共存的浓度越小,越容易沉淀,所以首先沉淀的是溶度积小的物质.1年前查看全部
- 大学普通化学溶度积问题下列物质在同浓度NaS2O3溶液中溶解度(以1dm3NaS2O3)溶液中能溶解该物质的物质的量计)
大学普通化学溶度积问题
下列物质在同浓度NaS2O3溶液中溶解度(以1dm3NaS2O3)溶液中能溶解该物质的物质的量计)最大的是 A.Ag2Sr B.AgBr C.AgCl D.AgI 大体思路我知道, 小虾米041年前1
小虾米041年前1 -
 kiss123 共回答了20个问题
kiss123 共回答了20个问题 |采纳率85%溶解度最大的是AgCl.
分析:
发生的反应,例如AgCl:
AgCl + 2S2O3 2- = [Ag(S2O3 )2 ]3- + Cl-
[Ag(S2O3 )2 3- ] [Cl- ] / [S2O3 2- ]^2 = K = Ksp* K稳
即此反应程度与常数Ksp和K稳有关,即越大,反应程度越大,溶解得越多.
从溶解度来说,四种物质的溶解度顺序是:
AgCl > AgBr > AgI > Ag2S
形成了同一种配合物,所以,溶解度最大的是AgCl.1年前查看全部
- 一判断题,求溶解度与溶度积的关系
一判断题,求溶解度与溶度积的关系
AgCl和Ag2ClO4的容度积分别为1.8*10^(-10)和2.0*10^(-12) ,则AgCl的溶解度大于Ag2ClO4的溶解度.这个题正确还是错误? 森雪魔卉1年前1
森雪魔卉1年前1 -
 lodge110 共回答了22个问题
lodge110 共回答了22个问题 |采纳率90.9%错误!
s=(ksp/((n^n)*(m^m)))^(1/(n+m))
可以知道√1.8*10^(-10)<√2.0*10^(-12)/2^21年前查看全部
- 已知硫酸钡和碳酸钡的溶度积k1和k2,用1.5升,0.15mol/L的碳酸钠能将多少克硫酸钡转化为碳
 DickDouble1年前1
DickDouble1年前1 -
 天下浪迹 共回答了23个问题
天下浪迹 共回答了23个问题 |采纳率91.3%硫酸钡转化为碳酸钡:BaSO4+CO32-=BaCO3+SO42-
该反应的平衡常数:K=[SO42-]/[CO32-]=Ksp(BaSO4)/Ksp(BaCO3)=K1/K2
BaSO4+CO32-=BaCO3+SO42-
起始 0.15 0
转化 -x x
平衡 0.15-x x
x/(0.15-x)=K1/K2,由此解出x,那么转化了硫酸钡质量为xmol/L×1.5L×233g/mol1年前查看全部
- 有关溶度积的.如下:有关溶度积的.已知Mg(OH)2的容度积是5.61×10^-12,Fe (OH)3的容度积是2.64
有关溶度积的.如下:
有关溶度积的.已知Mg(OH)2的容度积是5.61×10^-12,Fe (OH)3的容度积是2.64×10^—39.
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= . 烟树临离1年前1
烟树临离1年前1 -
 天煞之星 共回答了13个问题
天煞之星 共回答了13个问题 |采纳率92.3%Ksp[Mg(OH)2]=c(Mg2+)*c(OH-)^2=5.61×10^-12
Ksp[Fe(OH)3]=c(Fe3+)*c(OH-)^3=2.64×10^—39
当PH=8时,c(H+)=10^-8,c(OH-)=10^-6当两种沉淀共存,即满足两个溶度积
c(Mg2+)*(10^-6)^2=5.61×10^-12
c(Fe3+)*(10^-6)^3=2.64×10^—39
c(Mg2+):c(Fe3+)=2.125*10^21:11年前查看全部
- 溶解平衡是指完全沉淀之前吗?计算溶度积时选取的状态是哪个?
 wengbi701年前1
wengbi701年前1 -
 zweapon 共回答了19个问题
zweapon 共回答了19个问题 |采纳率78.9%在一定温度下,当沉淀溶解和结晶的速率相等时,固体质量、离子浓度不变的状态称为溶解平衡.
沉淀溶解平衡
固体化合物AmBn难溶于水,但仍有部分An+和Bm-离开固体表面进入溶液,同时进入溶液的An+和Bm-又会在固体表面沉淀下来,当这两个过程速率相等时,离子An+和Bm-的沉淀与固体AmBn的溶解在水中达到平衡状态,固体的量就不再减小,得到AmBn的饱和溶液.这种平衡状态叫做沉淀溶解平衡.
其平衡常数叫做溶度积,通常用Ksp表示.
AmBn(S) An+(aq)+Bm-(aq)
(以PbI2为例)
PbI2(s) Pb2+(aq)+2I-(aq)
Ksp=c[ Pb2+]c2[ I-]=7.1×10-9mol3 L-3
溶解平衡的特点是动态平衡 即溶解速率等于结晶速率 且不等于零
因此达到平衡时 溶质的质量一定不变 但形状可以改变 并且一定是饱和溶液
任何物质的溶解都伴随着相应的结晶过程.
物质最终是溶解还是结晶则是由V(溶解)与V(结晶)决定的:
当V溶解>V结晶:溶质溶解 形成不饱和溶液
当V溶解=V结晶:溶质不变 形成饱和溶液 “溶解平衡”
当V溶解1年前查看全部
- AgCl 18.4度的溶度积怎么计算?
AgCl 18.4度的溶度积怎么计算?
最好有计算过程,数据来源最好是CRC handbook of chemistry and physics. 粉红的心1年前1
粉红的心1年前1 -
 花零落1 共回答了17个问题
花零落1 共回答了17个问题 |采纳率94.1%溶度积是一个检测值,不是计算出来的1年前查看全部
- 请问怎么用溶度积判断AgI和Ag2SO4的溶解度大小?
 ersanbi1年前1
ersanbi1年前1 -
 对面的镜子 共回答了17个问题
对面的镜子 共回答了17个问题 |采纳率88.2%溶度积
Ksp1=[Ag][I]=n*10^-17
Ksp2=[Ag]^2*[SO4]=n*10^5
因为Ksp1特别小,所以,只需要极少的[Ag]和[I]就可以成沉淀
所以AgI溶解度小1年前查看全部
- 已知在温室时,Mg(OH)2的溶度积K=5.6×10﹣¹²,求室温下Mg(OH)2饱和溶液中Mg²﹢和OH﹣的物质的量浓
已知在温室时,Mg(OH)2的溶度积K=5.6×10﹣¹²,求室温下Mg(OH)2饱和溶液中Mg²﹢和OH﹣的物质的量浓度
 zhuzhang1年前1
zhuzhang1年前1 -
 宴平乐 共回答了15个问题
宴平乐 共回答了15个问题 |采纳率93.3%Mg(OH)2的Ksp=c(Mg2+).c2(OH-)=5.6*10-12
假设镁离子浓度为X,则氢氧根的浓度为2X(根据氢氧化镁的电离式)
带入上式即可解得,求出应该是约数1年前查看全部
- 磷酸亚铁的溶度积是多少啊,书上查不到.
 浮生若花1年前2
浮生若花1年前2 -
 gb6au 共回答了15个问题
gb6au 共回答了15个问题 |采纳率100%1.3×10-22,pksp=21.891年前查看全部
- 根据Mg(OH)2的溶度积KspMg(OH)2=1.2*10负11 计算
根据Mg(OH)2的溶度积KspMg(OH)2=1.2*10负11 计算
1 Mg(OH)2饱和溶液中的OH- 和Mg2+ 并换算出Mg(OH)2的浓度
2 换算Mg(OH)2在0.010摩尔每升NaOH溶液中的最大浓度
3 换算Mg(OH)2在0.010摩尔每升MgCl2溶液中的最大浓度 牧马爷1年前1
牧马爷1年前1 -
 景祥1 共回答了16个问题
景祥1 共回答了16个问题 |采纳率81.3%1、Mg(OH)2 Mg2+ + 2OH-
x--------------------x--------2x
x*(2x)^2=4x^3=Ksp=1.2*10^-11
x=1.45*10^-4 mol/L,即Mg(OH)2浓度
2、OH-=0.01
Mg2+ = Ksp/(OH-)^2=1.2*10^-7 mol/L,即M(OH)2浓度
3、Mg2+ = 0.01
(OH-)^2 = Ksp/Mg2+ = 1.2*10^-9
OH- = 3.46*10^-5 mol/L,即Mg(OH)2 = 1.73*10^-5 mol/L1年前查看全部
- 急,一道溶度积的计算题已知Ksp(AgCl)=1.8*10-10 ,Ksp(AgI)=1*10-16,常温下,AgCl要
急,一道溶度积的计算题
已知Ksp(AgCl)=1.8*10-10 ,Ksp(AgI)=1*10-16,常温下,AgCl要在NaI中得到AgI,则NaI的浓度不小于(1/根号1.8)*10-11mol/L
是怎么算出来的啊, x_lee1年前1
x_lee1年前1 -
 左罗来了 共回答了19个问题
左罗来了 共回答了19个问题 |采纳率94.7%[Ag+][Cl-] = 1.8*10-10
[Ag+]=[Cl-] = 根号Ksp(AgCl) =根号(1.8*10-10) =根号1.8*10-5
AgCl要在NaI中得到AgI,[Ag+][I-] > Ksp(AgI) =1*10-16
[NaI] =[I-] > Ksp(AgI) /[Ag+] =(1*10-16)/(根号1.8*10-5) =(1/根号1.8)*10-11mol/L1年前查看全部
- 判断题:若某系统的溶液离子积等于溶度积,则该系统必然存在固相
判断题:若某系统的溶液离子积等于溶度积,则该系统必然存在固相
如题,谢谢 hkcindy1年前1
hkcindy1年前1 -
 tester2002 共回答了14个问题
tester2002 共回答了14个问题 |采纳率92.9%错,不一定1年前查看全部
- Ag2SO4的溶度积Ksp=1.4*10^-5,今有500mL 1mol/L的AgNO3溶液,如果用0.2mol/L的硫
Ag2SO4的溶度积Ksp=1.4*10^-5,今有500mL 1mol/L的AgNO3溶液,如果用0.2mol/L的硫酸与之反应,将溶液中的Ag+完全去除(使C(Ag+)小于1*10^-5mol/L),计算出硫酸至少要多少体积.能否用硫酸银沉淀法去干净Ag+
 daisy_xd1年前1
daisy_xd1年前1 -
 c5232069 共回答了20个问题
c5232069 共回答了20个问题 |采纳率95%在保持固液共存即体系中有硫酸银固体、硫酸根及银离子的情况下,当C(Ag+)小于1*10^-5mol/L时由Ksp可求得此时C(SO42-)>1.4*10^5mol/L,显然不可达到..也就是说无法保持在溶液中存在硫酸银固体的情况下是C(Ag+)小于1*10^-5mol/L.
另一种使得C(Ag+)小于1*10^-5mol/L的方法是通过加硫酸溶液来稀释银离子.此时可轻易求得V>(5*10^4-0.5)L.显然也不可行.
因此不能用硫酸银沉淀来去净银离子.1年前查看全部
- 已知25℃时,AgCl的溶度积Ksp=1.8*10^-10,则下列说法正确的是?
已知25℃时,AgCl的溶度积Ksp=1.8*10^-10,则下列说法正确的是?
19.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl溶液中加入盐酸,Ksp值变大]
B.AgNO3溶液与NaCl溶液混合后的 溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,说明AgCl溶解度小于AgI
2、25℃时,在浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的溶液中,测得其中c(NH4+)分别为a、b、c(mol·L-1),则下列判断正确的是( )
A.a>b>c B.c>a>b
C.b>a>c D.a >c>b
3/、下列离子组能在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是( )
A、钠离子 二价铁离子 氯离子 硫酸根离子
B、钡离子 钾离子 碳酸根离子 氯离子
C、铝离子 钙离子 氯离子 硝酸根离子
D、钠离子 钡离子 硝酸根离子 碳酸氢根离子 limlimckg1年前1
limlimckg1年前1 -
 fuchengwu 共回答了12个问题
fuchengwu 共回答了12个问题 |采纳率100%1 C 2B 3 D
过程不知道你需不需要 简要说一下
看第一题 A Ksp 和化学平衡常数差不多 就和温度有关 所以加入物质不变温度 Ksp是不变的
B.AgNO3溶液与NaCl溶液混合后溶液中的Cl增加 怎么可能还一定有c(Ag+)=c(Cl-) 只能是 可能相等 不知道用量啊
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp这个说明溶度积和溶解平衡常数相等了 所以溶液中就溶解平衡了 不能再溶解了 就饱和了
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,这个说明碘离子可以和AgCl反应生成AgI 这个就是例子交换 复分解反应了 复分解反应高中就是说只要能够降低离子浓度的反应都能发生 AgCl溶解度大于AgI
第二题
显然是考 水解
(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的溶液中
他们的浓度一样 铵根水解是酸性的
NH4)2CO3 中的碳酸根水解成碱性 促进了铵根的水解 所以浓度会相对减小一些
NH4)2Fe(SO4)2中的亚铁离子会水解 成酸性 所以 他会抑制铵根的水解啊
至于还有一种他就既没有促进他水解的 没有抑制他的 他的含量就居中了
第三题
很简单 那个B不能共存 只有D满足 你一看就知道了 不说了哟
好运 欢迎咨询我的百度Hi 请继续支持我们的团队1年前查看全部
- 下列说法正确的是 [ ] A.难溶电解质的溶度积Ksp越小,则它的溶解度
下列说法正确的是 [ ]A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 秀漫霜宁1年前1
秀漫霜宁1年前1 -
 飞翔小鸟1943 共回答了20个问题
飞翔小鸟1943 共回答了20个问题 |采纳率100%D1年前查看全部
- Agcl为什么溶于氨水跟溶度积有关吗
 下下集预告1年前5
下下集预告1年前5 -
 院校之家 共回答了19个问题
院校之家 共回答了19个问题 |采纳率78.9%AgCl 沉淀可以溶于氨水,原因是 Ag+ 被 NH3 络合生成 Ag(NH3)2+,使平衡 AgCl = Ag+ + Cl- 右移,AgCl 溶解.反应的 方程式为
AgCl + 2 NH3 = Ag(NH3)2+ + Cl-
AgCl还能溶解于硫代硫酸钠,氰化钾溶液1年前查看全部
- 用饱和碳酸钠溶液可将硫酸钡沉淀转变为碳酸钡沉淀,说明硫酸钡的溶度积大于碳酸钡.这句话哪错
 yww5663531年前1
yww5663531年前1 -
 melody_o 共回答了15个问题
melody_o 共回答了15个问题 |采纳率66.7%我这边有个Ksp的表(虽然不一定绝对准确):
http://desktop.nju.edu.cn/jingpin2004/courseware/dxhxsy/content/ToolBox/rdj.htm
从中得知:Ksp(BaCO3)=5.1*10^-9,Ksp(BaSO4)=1.1*10^-10
如果上面的数据是正确的,为什么BaSO4还能转化为BaCO3?
问题就在“饱和”二字上.不知道楼主是否了解难溶电解质的同离子效应,BaCO3的溶解度在Na2CO3会远远比在水中的溶解度小(饱和碳酸钠的CO32-抑制了BaCO3的电离),才会造成BaSO4的Ksp比BaCO3大的假象.1年前查看全部
- 如何分离铜离子和锡离子实验中需要将铜离子和锡离子分离,目前已知的方法是利用溶度积,通过控制pH分别沉淀出锡、铜,请问各位
如何分离铜离子和锡离子
实验中需要将铜离子和锡离子分离,目前已知的方法是利用溶度积,通过控制pH分别沉淀出锡、铜,请问各位还有没有其它方法可以分离这两种离子的,因为需要提交三种方法, 格子小熊1年前1
格子小熊1年前1 -
 你就是我的天地 共回答了19个问题
你就是我的天地 共回答了19个问题 |采纳率94.7%1、水解法:控制pH沉淀Sn(2+);
2、NaOH酸碱反应法(1年前查看全部
- 难溶物质的溶解度与溶度积怎么转换
难溶物质的溶解度与溶度积怎么转换
给出具体思路, 陈chenwei1年前2
陈chenwei1年前2 -
 光头ff 共回答了32个问题
光头ff 共回答了32个问题 |采纳率100%目前常用的溶解度有两种表示方法.
某温度,饱和溶液中
1.利用100g溶剂中溶解的溶质的质量,初中就学过这个;
2.利用溶质的物质的量浓度来表示,虽然知识在高中就学过,但是高中一般仍沿用初中的表示方法,这种表示思路大学才正式在课本提出.
溶度积是利用沉淀溶解平衡的可逆过程的K来表示的,
对于反应AxBy = x A + y B 符号KSP=[A]^x[B]^y AB我省略电荷了.
所以很容易发现,如果转化成2类溶解度很简单,因为都是用物质的量浓度来表示的,要转化为第一类就麻烦了,需要密度和摩尔质量才可以.
举例:某温度 饱和硫酸钡 溶度积 10^ -10 BaSO4 =Ba2+ + SO42-
[Ba2+][SO42-]=10^-10 所以[Ba2+]=[SO42-]=10^ -5
溶解的[BaSO4]=10 ^-5 第2类溶解度就是这个.
假设密度就是1,1L溶液溶解BaSO4 10^ -5 mol.近似看做 1000g 水 溶解 233×10^-5.1类溶解度求出.1年前查看全部
- 已知常温下硫酸钡的溶度积Ksp=10-10,求该温度下硫酸钡的溶解度,
已知常温下硫酸钡的溶度积Ksp=10-10,求该温度下硫酸钡的溶解度,
BaSO4(s)=可逆=Ba2+(aq)+SO4^2-(aq)
x x
Ksp=C(Ba2+)*C(SO4^2-)=10^-10 即x2=10^-10
x=10^-5 mol/L
即溶解的硫酸钡浓度为10^-5 mol/L
硫酸钡相对分子质量为 233g/mol
硫酸钡浓度为2.33*10^-3 g/L
1L水等于1000g水
也就是说1000g水中溶解了2.33*10^-3g硫酸钡,100g水中溶解了硫酸钡2.33*10^-4g
为什么要用到相对分子质量乘溶解的硫酸钡浓度,为什么不直接用溶解的硫酸钡浓度, 文刀大少1年前1
文刀大少1年前1 -
 俺来自高庙村 共回答了21个问题
俺来自高庙村 共回答了21个问题 |采纳率95.2%因为溶解度的单位是 g/100g水.
我们根据溶解积可以计算得出,饱和溶液中 BaSO4的物质的量浓度.
然后,根据此物质的量浓度,可以计算出,1L溶液中,所含BaSO4的质量.
接着根据这个计算出溶解度.
如果直接用 10^-5mol/L,那么只能得到饱和BaSO4溶液的物质的量浓度.
不知道这样说你明白吗?
有不理解的地方请追问!1年前查看全部
- Ag 2 CrO 4 的溶度积小于 AgCl 的溶度积,试说明 AgNO 3 滴定 Cl - 时为什么能用 K 2 Cr
Ag 2 CrO 4 的溶度积小于 AgCl 的溶度积,试说明 AgNO 3 滴定 Cl - 时为什么能用 K 2 CrO 4 作指示剂?(Ag 2 CrO 4 :; AgCl :)
 markboy1年前3
markboy1年前3 -
 派克因扎吉 共回答了18个问题
派克因扎吉 共回答了18个问题 |采纳率88.9%在含有Cl-的中性溶液中,以K2CrO4为指示剂,用AgNO3溶液滴定,由于AgCl的溶解度比Ag2CrO4小,根据分步沉淀的原理,溶液中首先析出AgCl沉淀,当AgCl定量沉淀后,过量的一滴AgNO3与CrO42-生成砖红色的Ag2CrO4沉淀 ,即为终点.
例:0.1000mol/LAgNO3标准溶液滴定0.1000mol/L的NaCl,指示剂K2CrO4浓度为5.0×10 -3 mol/l.
根据溶度积理论:Ksp(AgCl)=[Ag][Cl}=1.8×10 -10;在0.1000mol/l的Cl溶液中,析出AgCl沉淀时,溶液中[Ag]=Ksp/[Cl]=1.8×10 -10)/0.1=1.8×10 -11,此时,溶液中[Ag]2×[CrO4}=(1.8×10 -11)2×(5.0×10 -3)=1.62×10 -241年前查看全部
大家在问
- 1求翻译一下:How happy you are has little to do with how you act,bu
- 2下表是部分生物体中水分的百分比含量。表中数据说明 ①代谢旺盛的组织器官含水量较多 ②生物体中水分的含量超过了50%,是各
- 31西西=多少公斤
- 4如何证 (AUB)-C=(A-C)U(B-C)
- 5【】08除以42,要是商是一位数,方框里最大填多少.
- 6设y=cos(5x+4)求y'和dy
- 7写给知心姐姐的话 作文
- 8谁能给我一篇生物的调查报告,观察日记或实验计划
- 9六年级英语作业句型转换1、The little monkey is 40 cm tall.(在40 cm下面划横线,对划
- 10如图所示,已知矩形ABCD中,AD=8cm,AB=6cm,对角线AC的垂直平分线交AD于E,交BC于F.
- 11在南美洲的太平洋沿岸,有一个城市,夏季炎热干燥,冬季温和多雨.是开展冬季旅游的好场所.这个是哪里?
- 12关于苯和液溴制溴苯在三颈烧瓶里反应完了后,加入氢氧化钠溶液。现象是分层,上层苯中层水下层溴苯。那苯和溴苯不会溶在一起的吗
- 135/6-X=7/36
- 141.下列氧化还原反应中水做氧化剂的是( )
- 15把标有序号的句子填到两段话的横线处,最恰当的一组是( )
