298K时,1mol CO(g)与适量O2(g)中充分燃烧,
 raichol2022-10-04 11:39:541条回答
raichol2022-10-04 11:39:541条回答求
(1)在298K时反应的ΔrHθm;
(2)该反应在398K时的ΔrHθm.
(3)判断298K及P θ下反应的自发性
(4)假定 ΔrSθm与温度无关,估算该反应能自发进行的最高温度.
第一问第二问比较容易,请问,第三问和第四问,希望给一些提示(稍微详细一些,比如第三问不要只说求G),

已提交,审核后显示!提交回复
共1条回复
 黑色的小皮包 共回答了23个问题
黑色的小皮包 共回答了23个问题 |采纳率82.6%- 方程式
2CO+O2=2CO2
ΔrHθm=2ΔrHθm(co2)-2ΔrHθm(co)-ΔrHθm(02)
这些数据应该不用再给你查了吧,任何一本书上都是有的
3问
计算过程是
ΔrGθm=ΔrGθm(co2)-2ΔrGθm(co)-ΔrGθm(02)
=-393.509-2x(-137.168)-0
=-119.173
单位没写哈
这个数值小余0
所以这个反应能自发进行
4问
T=ΔrHθm(298.15K)/ΔrSθm(298.15K)=
ΔrSθm(298.15K)计算也就是查处那些热力学数据,然后算出来
代入那个公式,就得到自发进行的温度 - 1年前
相关推荐
- (2014•青浦区二模)在密闭容器中,将1mol CO和1mol O2混合,一定条件下充分反应.下列说法正确的是( )
(2014•青浦区二模)在密闭容器中,将1mol CO和1mol O2混合,一定条件下充分反应.下列说法正确的是( )
A.反应后的气体中C、O原子的物质的量之比为1:2
B.参加反应的CO和O2的物质的量之比为1:1
C.反应后气体的物质的量为原混合气体的[3/4]
D.反应后所得气体是纯净物 wx198802251年前1
wx198802251年前1 -
 终始追 共回答了12个问题
终始追 共回答了12个问题 |采纳率100%解题思路:依据2CO+O2
2CO2可知该反应进行时一氧化碳和氧气的物质的量的比是2:1,据此对反应的情况进行分析判断即可;点燃 .A、反应前C、O原子个数比为1:3,反应前后原子个数不变,因此反应后C、O原子的物质的量之比也应该为1:3,故A错误;
B、根据质量守恒配平2CO+O2=2CO2,因此参加反应的CO和O2的物质的量之比为2:1,故B错误;
C、根据2CO+O2=2CO2,1molCO消耗0.5molO2,还剩0.5molO2,生成1molCO2,因此反应后气体的物质的量=1mol+0.5mol=1.5mol,反应后气体的物质的量为原混合气体的[1.5mol/2mol]=[3/4],故C正确;
D、反应后气体包括氧气和二氧化碳,是混合物,故D错误.
故选C.点评:
本题考点: 根据化学反应方程式的计算;纯净物和混合物的判别.
考点点评: 根据质量守恒定律的元素守恒,原子的个数在反应前后不变,来处理问题,考查了学生的分析和应变能力.1年前查看全部
- 在一定条件下,将1mol CO和1mol水蒸气混合后发生如下变化:CO(g)+H2O(g)⇌CO2(g)+H2
在一定条件下,将1mol CO和1mol水蒸气混合后发生如下变化:CO(g)+H2O(g)⇌CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的( )
A. 5.75倍
B. 11.5倍
C. 30.67倍
D. 46倍 5140134481年前3
5140134481年前3 -
 虚鱼爱 共回答了27个问题
虚鱼爱 共回答了27个问题 |采纳率96.3%解题思路:由于在反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为[1×28+1×18/2]=23,利用密度之比等于相对分子质量之比可以解题;
⇌CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为[1×28+1×18/2]=23,利用密度之比等于相对分子质量之比可以解题;
由于在反应CO(g)+H2O(g)
 ⇌CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为[1×28+1×18/2]=23,利用密度之比等于相对分子质量之比可以得到混合气体的密度与相同条件下H2密度的比为23:2=11.5,故选B.
⇌CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为[1×28+1×18/2]=23,利用密度之比等于相对分子质量之比可以得到混合气体的密度与相同条件下H2密度的比为23:2=11.5,故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题主要考查相对密度的计算,在解题时要注意运用元素守恒和物质的量守恒思想,难度不大.1年前查看全部
- 这概念不咋理解甲根据1MOL CO和1MOL H2燃烧放出的热量总和比1MOL C燃烧放出的热量多,认为煤炭燃烧加少量的
这概念不咋理解
甲根据1MOL CO和1MOL H2燃烧放出的热量总和比1MOL C燃烧放出的热量多,认为煤炭燃烧加少量的水,可以使煤炭燃烧放出更多热量.
为什么说要加少量的水啊?甲这样认为的理由是什么?
将煤燃烧转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样,而将煤转化为水煤气会增加消耗,因此将煤转为水煤气得不尝失.
这说法对吗?为什么? sadjawlrkgthg1年前1
sadjawlrkgthg1年前1 -
 被撕碎的蜘蛛 共回答了15个问题
被撕碎的蜘蛛 共回答了15个问题 |采纳率93.3%加少量水可以使C变成CO和H2 但是中间过程会吸收热量 然后再释放能量
所有总和还是不会变的 而转化的时候肯定伴随能量的流失 所以得不偿失1年前查看全部
- 将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡:CO(g)+H2
将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g),此时有[2/3]的CO转化为CO2.
(1)该平衡混合物中CO2的体积分数为______.
(2)若在相同条件下,向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时与(1)相比较,平衡应向______移动(填“正反应方向”、“逆反应方向”或“不”),此时平衡混合的CO2的体积分数可能是下列各值中的______(填编号).
A.22.2%B.27.55%C.33.3%D.36.8%
(3)假如(2)中平衡向正反应方向移动时,则下列说法中正确的是______(填序号)
①生成物的产量一定增加
②生成物的体积分数一定增加
③反应物的转化率一定增加
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用了催化剂. 心速已尘封1年前1
心速已尘封1年前1 -
 dyclink 共回答了18个问题
dyclink 共回答了18个问题 |采纳率94.4%解题思路:依据化学平衡三段式列式计算,
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) [2/3] [2/3][2/3] [2/3]
平衡量(mol) [1/3] [1/3] [2/3] [2/3]
(1)体积分数=[二氧化碳物质的量/混合气体物质的量]×100%;
(2)若在相同条件下,向容器中充入1mol CO2、1mol H2和1mol H2O,极值转化相当于加入1molCO2,2molH2O,则达到平衡时与(1)相比较,等于加入1mol水平衡正向进行;依据平衡浓度计算平衡浓度,计算得到平衡常数=[生成物平衡浓度幂次方乘积/反应物平衡浓度幂次方乘积],结合化学平衡三段式列式计算;
(3)平衡向正反应方向移动,正逆反应速率增大,正反应速率增大大于逆反应速率,生成物物质的量、产率增大,反应前后气体体积不变,加入气体,气体体积分数减小,催化剂改变反应速率不改变化学平衡,结合化学平衡移动原理和反应特征选项;利用三段式法求平衡时各组分个浓度,
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) [2/3] [2/3][2/3] [2/3]
平衡量(mol) [1/3] [1/3] [2/3] [2/3]
(1)反应前后气体的体积不变,所以平衡时,混合气体的总的物质的量为1mol+1mol=2mol,
所以平衡混合物中CO2的体积分数为=
2
3mol
2mol×100%=33.3%;
故答案为:33.3%;
(2)充入1mol CO2、lmol H2和1mol H2O,反应向逆反应进行建立平衡,等效为(1)中平衡后,再加1molH2O(g),平衡向正反应移动;
化学平衡常数=生成物平衡浓度系数次方之积与反应物平衡浓度系数次方之积的比,
故该反应的平衡常数表达式k=
c(H2)c(CO2)
c(CO)c(H2O),反应在同一容器内进行,体积相同,方程式中各物质的化学计量数都是1,所以在计算中均可用物质的量数值代替浓度数值,所以k=
c(H2)c(CO2)
c(CO)c(H2O)=
2
3×
2
3
1
3×
1
3=4.
令参加反应的H2物质的量为nmol,
CO(g)+H2O(g)⇌H2(g)+CO2(g),
起始(mol):0 1 1 1
转化(mol):nnnn
平衡(mol):n1+n1-n1-n
所以
(1−n)(1−n)
n(1+n)=4,解得n=0.154
反应前后气体的体积不变,所以平衡时,混合气体的总的物质的量为1mol+1mol+1mol=3mol,
平衡混合物中CO2的体积分数为[1mol−0.154mol/3mol]×100%=28.2%;
此时平衡混合的CO2的体积分数可能是27.55%;
故答案为:正反应方向,B;
(3)平衡向向正方向移动,
①不论改变何条件,平衡向向正方向移动,生成物的物质的量一定增加,故①正确;
②对于多种气体参与反应,反应前后气体的体积不变的反应,并向其中大量加入一种反应物,而使平衡正向移动.生成物的物质的量增加,但百点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡的计算及影响因素,难度中等,平衡常数只受温度影响,温度不变,平衡常数不变.1年前查看全部
- 在一定温度下将1mol CO(g)和1mol H2O(g)通入一个容积固定的密闭容器中反应:CO(g
在一定温度下将1mol CO(g)和1mol H2O(g)通入一个容积固定的密闭容器中反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g),当再次达到平衡后,CO2的物质的量可能是( )
A.n(CO2)=0.6 mol
B.n(CO2)=1 mol
C.1 mol<n(CO2)<4 mol
D.0.6 mol<n(CO2)<1 mol yy2341年前1
yy2341年前1 -
 爱在无间 共回答了23个问题
爱在无间 共回答了23个问题 |采纳率87%解题思路:CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始 1 1 0 0
转化0.6 0.6 0.6 0.6
平衡 0.4 0.4 0.6 0.6
再通入4molH2O(g),平衡正向移动,但CO不能完全转化,以此来解答.CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始 1 1 0 0
转化0.6 0.6 0.6 0.6
平衡 0.4 0.4 0.6 0.6
再通入4molH2O(g),平衡正向移动,但CO不能完全转化,
则再次达到平衡后,CO2的物质的量大于0.6mol,小于1mol,
故选D.点评:
本题考点: 化学平衡的计算;化学反应的可逆性.
考点点评: 本题考查化学平衡的计算,注意平衡时CO的物质的量及加4molH2O(g)平衡正向移动,但CO不能完全转化为解答的关键,题目难度不大.1年前查看全部
- 在一定温度下将1mol CO和1mol H2O(g)通入一个密闭容器中反应:CO(g)+H2O(g)⇌CO2(g)+H2
在一定温度下将1mol CO和1mol H2O(g)通入一个密闭容器中反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是( )
A. 等于0.6mol
B. 等于1mol
C. 大于1mol
D. 大于0.6mol,小于1mol jiuswy1年前2
jiuswy1年前2 -
 shinning111 共回答了22个问题
shinning111 共回答了22个问题 |采纳率86.4%解题思路:反应为可逆反应,反应物不可能完全转化,达到平衡时,在加入4mol水,则平衡向正方向移动,以此解答该题.反应为可逆反应,反应物不可能完全转化,达到平衡时,在加入4mol水,则平衡向正方向移动,则达到平衡后CO2的物质的量应大于0.6mol,但小于1mol.
故选D.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学平衡的移动,题目难度不大,注意把握可逆反应的特征,此为解答该题的关键.1年前查看全部
- 现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),已知1mol CO和2mol H2O(
现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),已知1mol CO和2mol H2O(g)在一定条件下反应达平衡时生成0.7mol CO2,若其它条件不变,把2mol H2O(g)改成4mol,达平衡时生成CO2可能是( )
A. 1.2 mol
B. 0.83 mol
C. 1.5 mol
D. 2 mol 苦味糖水1年前3
苦味糖水1年前3 -
 pppaul13 共回答了18个问题
pppaul13 共回答了18个问题 |采纳率94.4%解题思路:若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,但不能完全反应,再根据极限法进行判断.若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,CO的转化率增大,故平衡时CO2的物质的量大于0.7mol,由于可逆反应不能进行完全,因此1molCO不可能完全转化,生成CO2的物质的量小于1mol,故平衡时0.7mol<n(CO2)<1mol,
故选:B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动与计算、可能反应的特点等,难度不大,注意构建平衡建立的途径利用极限法进行解答.1年前查看全部
- (2014•松江区模拟)在密闭容器中,将1mol CO和1mol O2混合,一定条件下充分反应.下列说法正确的是( )
(2014•松江区模拟)在密闭容器中,将1mol CO和1mol O2混合,一定条件下充分反应.下列说法正确的是( )
A.参加反应的CO和O2的物质的量之比为1:1
B.反应后,密闭容器气体中C、O原子的物质的量之比为1:3
C.反应后,密闭容器内气体是纯净物
D.反应后,密闭容器内气体的物质的量为2mol 懒散的拖鞋1年前1
懒散的拖鞋1年前1 -
 uu的qq1 共回答了20个问题
uu的qq1 共回答了20个问题 |采纳率95%解题思路:依据2CO+O2
2CO2可知该反应进行时一氧化碳和氧气的物质的量的比是2:1,据此对反应的情况进行分析判断即可.点燃 .依据2CO+O2
点燃
.
2CO2可知该反应进行时一氧化碳和氧气的物质的量的比是2:1;
A、由分析知一氧化碳和氧气的物质的量的比是2:1,故A错误;
B、1mol的CO含有1mol碳原子和1mol氧原子,1mol的O2含有2mol氧原子,由于化学反应前后原子的种类和个数不变,所以反应后C、O原子的物质的量之比为1:3,故B正确;
C、由于反应后所得的气体由生成的二氧化碳和剩余的氧气组成,所以反应后所得气体是混合物,故C错误;
D、根据反应的化学方程式可以知道一氧化碳和氧气恰好完全反应的物质的量比为2:1,所以将1mol的CO和1mol的O2混合反应后氧气剩余0.5mol,生成二氧化碳的物质的量为1mol,所以反应后气体的物质的量的和为:0.5mol+1mol=1.5mol,故D错误;
答案:B点评:
本题考点: 根据化学反应方程式的计算;纯净物和混合物的判别.
考点点评: 根据质量守恒定律的元素守恒,原子的个数在反应前后不变,来处理问题,考查了学生的分析和应变能力.1年前查看全部
- 如果1mol cuo可以说成是由1mol的cu离子和1mol的氧离子组成.那么1mol co可以说
如果1mol cuo可以说成是由1mol的cu离子和1mol的氧离子组成.那么1mol co可以说
如果1mol CUO可以说成是由1mol的铜离子和1mol的氧离子组成.那么1mol co可以说成是由1mol的碳原子和1mol的氧原子组成的吗?1mol的Fe2O3和1mol的CO2如何表示, zhangtao7802131年前1
zhangtao7802131年前1 -
 beifangdeyanzi 共回答了12个问题
beifangdeyanzi 共回答了12个问题 |采纳率83.3%CO分子内是共价键作用,分子间是分子间作用力
因为是共价键所以可以说
1mol的Fe2O3:2mol Fe原子和3mol氧原子
1mol的CO2:1mol C和2mol o1年前查看全部
- 在密闭容器中投入1mol CO(g)和3mol H2O(g),下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g
在密闭容器中投入1mol CO(g)和3mol H2O(g),下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡后,测得CO2(g)为0.75mol,再向其中加入5mol H2O(g),达到新平衡后,CO2(g)的物质的量可能的是( )
A. 1.1mol
B. 0.87mol
C. 0.75mol
D. 0.50mol wanxuhong1年前2
wanxuhong1年前2 -
 李明俊 共回答了18个问题
李明俊 共回答了18个问题 |采纳率88.9%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物,依据极值分析判断.根据题意:CO+H2O(g)⇌CO2 +H2,
初始物质的量:1 3 0 0
变化物质的量:0.750.750.75 0.75
平衡物质的量:0.252.250.75 0.75
此时二氧化碳和氢气的物质的量之和是1.5mol,再通入5mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.25mol,此时CO2的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.75mol-1mol之间,
只有选项B符合,
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- 向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g)⇌
向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g)⇌CO2+H2.当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( B )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mo H2
其中B选项B、采用极限分析法,1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:2mol:2mol=1:1,反应前后气体体积不变,平衡正向进行,CO的体积分数大于x,故B符合;
“平衡正向进行,CO的体积分数大于x”不懂,
还有C选项,C、采用极限分析法,0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 ,假如反应完全转化为CO和H2O物质的量为:0.9mol:l.9mol=9:19,反应前后气体体积不变,平衡相同,CO的体积分数为x,故C不符合;
平衡相同,CO的体积分数为x,看不懂, 鸲鹆1年前1
鸲鹆1年前1 -
 极品糙哥 共回答了11个问题
极品糙哥 共回答了11个问题 |采纳率100%CO+H2O(g)≒CO2+H2
A 起始 0.5 2 1 1
转化后 1.5 3 0 0
B 起始 1 1 1 1
转化后 2 2 0 0
C 起始 0.5 1.5 0.4 0.4
转化后 0.9 1.9 0 0
D 起始 0.5 1.5 0.5 0.5
转化后 1 2 0 0
从上面的分析可看出,满足原来1:2关系是A和D,故这是等效平衡,这时CO平衡组成不变,还是x;而B情况下,等效平衡后CO还余下1mol,平衡向正反应方向移动,但再移动不可能把H2O全消耗完,等效平衡后还留有多余的CO,故此时平衡中CO的体积分数就大于x;在C情况下,等效后H2O还余下0.1mol,此时平衡向正反应方向移动,使CO再消耗一些,故此时CO量比x小.1年前查看全部
- (2013•成都二模)将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C
 (2013•成都二模)将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)═CH3OH(g),△H=a kJ/mol,如图.下列分析中正确的是( )
(2013•成都二模)将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)═CH3OH(g),△H=a kJ/mol,如图.下列分析中正确的是( )
A.250℃时,0-10minH2 反应速率为 0.015 mol/(L•min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T℃时大于250℃ aomjl8881年前1
aomjl8881年前1 -
 笑看日出 共回答了17个问题
笑看日出 共回答了17个问题 |采纳率88.2%解题思路:依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式求出氢气的变化量,再求速率;
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大;
C.其他条件不变,若减小容积体积,压强增大,平衡正移;
D.△H<0,升高温度,平衡逆向移动,K减小.依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式氢气的变化量为:0.15mol×2=0.3mol,所以v(H2)=
0.3mol
1L
10min=0.03mol/(L•min),故A错误;
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大,所以CO的转化率:T℃时大于250℃时,故B错误;
C.其他条件不变,若减小容积体积,压强增大,平衡正移,CO的物质的量减少,CO物质的量分数减小,所以CO体积分数减小,故C错误;
D.由以上分析可知△H<0,即a<0,即升高温度,平衡逆向移动,K减小,所以平衡常数K:T℃时大于250℃,故D正确;
故选D.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的计算.
考点点评: 本题考查物质的量随时间的变化图象,由明确图象中量的变化来分析反应速率、转化率、影响平衡的移动因素等,题目难度不大.1年前查看全部
- 为什么1mol Na2CO3中约含有3mol Na+,1mol CO3根离子.
 知床旅情1年前2
知床旅情1年前2 -
 吃草的狼2008 共回答了20个问题
吃草的狼2008 共回答了20个问题 |采纳率80%首先你需要了解摩尔的概念.
物质的量的单位为摩尔(简称为摩,符号为mol)每1mol任何物质含有阿伏伽德罗常数(约6.02×1023)个微粒.使用摩尔时基本微粒应予指明,可以是原子、分子、离子,原子团,电子,质子,中子及其他粒子,或这些粒子的特定组合.国际上规定,1mol粒子集体所含的粒子数与0.012kg 12C(碳12)中所含的碳原子数相同即一摩尔任何物质所包含的结构粒子的数目都等于0.012kg 12C(碳12)所包含的原子个数,即6.0221367x1023 个结构粒子.
1mol Na2CO3,默认指的是1mol Na2CO3分子.1个Na2CO3分子由2个Na离子和1个CO3根离子组成,故1mol Na2CO3中约含有2mol Na+,1mol CO3根离子.1年前查看全部
- 在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H 2 O(g) CO 2
在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO 2 (g)+H 2 (g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为A.0.25 B.0.17 C.0.44 D.1.0  人生地不熟991年前1
人生地不熟991年前1 -
 千万别到无锡去 共回答了17个问题
千万别到无锡去 共回答了17个问题 |采纳率88.2%B
1年前查看全部
- 在一定温度下将1mol CO和1mol H2O(g)通入一个密闭容器中反应:CO(g)+H2O(g)⇌CO2(g)+H2
在一定温度下将1mol CO和1mol H2O(g)通入一个密闭容器中反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是( )
A. 等于0.6mol
B. 等于1mol
C. 大于1mol
D. 大于0.6mol,小于1mol shanghaif1年前3
shanghaif1年前3 -
 石凿 共回答了16个问题
石凿 共回答了16个问题 |采纳率87.5%解题思路:反应为可逆反应,反应物不可能完全转化,达到平衡时,在加入4mol水,则平衡向正方向移动,以此解答该题.反应为可逆反应,反应物不可能完全转化,达到平衡时,在加入4mol水,则平衡向正方向移动,则达到平衡后CO2的物质的量应大于0.6mol,但小于1mol.
故选D.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学平衡的移动,题目难度不大,注意把握可逆反应的特征,此为解答该题的关键.1年前查看全部
- 在一定温度下的密闭容器中,加入1mol CO、1 mol H 2 O发生反应:CO(g)+H 2 O(g) CO 2 (
在一定温度下的密闭容器中,加入1mol CO、1 mol H 2 O发生反应:CO(g)+H 2 O(g)
 CO 2 (g) +H 2 (g),达到平衡时测得 n (H 2 )为0.5 mol,下列说法不正确的是( )
CO 2 (g) +H 2 (g),达到平衡时测得 n (H 2 )为0.5 mol,下列说法不正确的是( )A.在该温度下平衡常数 K =1 B.平衡常数与反应温度无关 C.CO的转化率为50% D.其他条件不变,改变压强平衡不移动  wylcooling1年前1
wylcooling1年前1 -
 新圣诞老人 共回答了14个问题
新圣诞老人 共回答了14个问题 |采纳率100%B
平衡常数只与反应温度有关。1年前查看全部
- (2008•长春一模)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达
(2008•长春一模)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)⇌CO2+H2,此时有[1/2]的CO转化为CO2.
(1)该平衡混合物中CO2的物质的量分数为______.
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率______(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为______.
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的______(填编号)
A.16.67%B.22.2%C.33.3%D.36.8% UKSAS1年前1
UKSAS1年前1 -
 noblemondeo 共回答了29个问题
noblemondeo 共回答了29个问题 |采纳率93.1%解题思路:平衡时参加反应的CO为0.5mol,根据三段式解题法,求出平衡时各组分的物质的量,
(1)平衡时CO2的物质的量分数=[二氧化碳物质的量/混合气体总物质的量];
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,容器的容积不变,反应混合物各组分浓度不变,平衡不移动;
(3)平衡后再充入1mol CO2和1mol H2,等效为在原平衡的基础上增大压强,平衡不移动,二氧化碳的物质的量分数不变;
(4)根据原平衡计算该温度下平衡常数,充入1mol CO2、lmol H2和1mol H2O,反应向逆反应进行建立平衡,令参加反应的H2物质的量为nmol,根据三段式解题法,用n表示出平衡时各组分的物质的量,代入平衡常数k计算,据此解答.平衡时参加反应的CO为1mol×[1/2]=0.5mol,则:
CO(g)+H2O(g)⇌H2(g)+CO2(g),
起始(mol):110 0
变化(mol):0.5 0.5 0.5 0.5
平衡(mol):0.5 0.5 0.5 0.5
(1)反应前后气体的体积不变,所以平衡时,混合气体的总的物质的量为1mol+1mol=2mol,
所以平衡混合物中CO2的物质的量发生=[0.5mol/2mol]×100%=25%.
故答案为:25%;
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,容器的容积不变,反应混合物各组分浓度不变,平衡不移动,CO的转化率不变,
故答案为:不变;
(3)平衡后再充入1mol CO2和1mol H2,等效为在原平衡的基础上增大压强,平衡不移动,二氧化碳的物质的量分数不变为25%,
故答案为:25%;
(4)该温度下,平衡常数k=[0.5×0.5/0.5×0.5]=1,
充入1mol CO2、lmol H2和1mol H2O,反应向逆反应进行建立平衡,令参加反应的H2物质的量为nmol,
CO(g)+H2O(g)⇌H2(g)+CO2(g),
起始(mol):01 11
转化(mol):n nn n
平衡(mol):n1+n1-n1-n
所以
(1−n)×(1−n)
n×(1+n)=1,解得n=[1/3]
反应前后气体的体积不变,所以平衡时,混合气体的总的物质的量为1mol+1mol+1mol=3mol,
平衡混合物中CO2的体积分数为
1mol−
1
3mol
3mol×100%=22.2%
故答案为:B.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,难度中等,侧重考查等效平衡与平衡常数的运用,注意掌握三段式解题法.1年前查看全部
- 在一定温度下将1mol CO和1mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O⇌CO2(g)+
在一定温度下将1mol CO和1mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O⇌CO2(g)+H2(g)达平衡后,得到0.6mol CO2;再通入0.3mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
A. 0.9 mol
B. 0.7 mol
C. 0.8 mol
D. 0.6 mol 御寒风1年前1
御寒风1年前1 -
 lionzq 共回答了16个问题
lionzq 共回答了16个问题 |采纳率100%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物.根据题意:CO+H2O(g)⇌CO2 +H2,
初始物质的量:1 1 0 0
变化物质的量:0.6 0.6 0.6 0.6
平衡物质的量:0.4 0.4 0.6 0.6
此时二氧化碳和氢气的物质的量之和是1.2mol,再通入0.3mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.4mol,此时CO2的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间,加入的水蒸气0.3mol 不能全部转化生成的二氧化碳物质的量不能为0.9mol,
故选BC.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算分析判断,极值方法的计算应用,题目难度中等.1年前查看全部
- 在一恒温、恒容密闭容器中充入1mol CO 2 和3 mol H 2 ,一定条件下发生反应:
在一恒温、恒容密闭容器中充入1mol CO 2 和3 mol H 2 ,一定条件下发生反应:
CO 2 (g)+3H 2 (g) CH 3 OH (g)+H 2 O(g) △H=-49.0 kJ/mol
CH 3 OH (g)+H 2 O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题: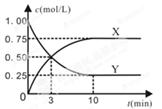
(1)Y的化学式是 。
(2)反应进行到3min时, v 正 v 逆 (填“>”或“<”、“=”)。反应前3min,H 2 的平均反应速率v(H 2 )= mol·L -1 ·min -1 。
(3)不能判断该反应达到化学平衡状态的依据是 。
(4)上述反应达到平衡后,往容器中同时加入1molCO 2 和1mol H 2 O(g),此时平衡将 (填“向左”、“向右”或“不”)移动。A.容器内各气体的体积比保持不变 B.混合气体密度不变 C.3v逆(CH 3 OH) =v正(H 2 ) D.H 2 转化率为75%
(5)上述温度下,反应CH 3 OH (g) + H 2 O(g) CO 2 (g) + 3H 2 (g)的平衡常数K= (计算结果保留2位小数)。
CO 2 (g) + 3H 2 (g)的平衡常数K= (计算结果保留2位小数)。 一滴柠檬水1年前1
一滴柠檬水1年前1 -
 raysyw 共回答了19个问题
raysyw 共回答了19个问题 |采纳率94.7%(1)CO 2 (2)> 0.5 (3)B (4)向右 (5)0.19
1年前查看全部
- (1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X是第三周期元素形成的简单阳离子半径最小的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物.
①X的简单阳离子的电子式是Al3+Al3+.
②W的最高价氧化物对应水化物的稀溶液与Z2O反应的化学方程式是3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
③已知:Fe(s)+
O2(g)═FeO(s)△H=272.0kJ/mol-11 2
2X(s)+
O2(g)═X2O3(s)△H=1675.7kJ/mol-13 2
X的单质和FeO反应的热化学方程式是3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol. 寒梅一笑1年前1
寒梅一笑1年前1 -
 宋美玲二世 共回答了22个问题
宋美玲二世 共回答了22个问题 |采纳率90.9%(1)反应物的能量比生成物高,反应放热,反应物的活化能为E1,生成物的活化能为E2,故反应的△H=E1-E2,故反应的化学方程式为:NO2(g)+CO(g)═CO2(g)+NO(g),△H=E1-E2=-234KJ/mol.
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
(2)导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是周期表前36号元素中的四种常见元素,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X是第三周期元素形成的简单阳离子半径最小的元素,所以X是铝元素;Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,且Z是前36号元素,Z的原子序数大于Y的,所以Z是铜元素.
①X的简单阳离子即Al3+的电子式即是其离子符号本身,故答案为:Al3+;
②W的最高价氧化物对应水化物的稀溶液即HNO3溶液,与Z2O即Cu2O反应的化学方程式是:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
③已知:Fe(s)+
1
2O2(g)=FeO(s)△H=-272.0kJ•mol-1①
2Al(s)+
3
2 O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1②
将方程式②-①×3得:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△HH=-859.7KJ/mol
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol.1年前查看全部
- 有关CO 2 的叙述正确的是 A.CO 2 的式量是44g B.n个CO 2 分子质量的计算表达式为 C.1mol CO
有关CO 2 的叙述正确的是
A.CO 2 的式量是44g B.n个CO 2 分子质量的计算表达式为 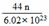
C.1mol CO 2 中含有1mol O 2 D.CO 2 的物质的量是指CO 2 的质量  寒星平1年前1
寒星平1年前1 -
 五月香草 共回答了22个问题
五月香草 共回答了22个问题 |采纳率81.8%B
1年前查看全部
- 在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)⇌CO2(g
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
A. 2.5mol
B. 1.8mol
C. 1.5mol
D. 1.2mol 学习态度1年前1
学习态度1年前1 -
 蓝絮枫 共回答了13个问题
蓝絮枫 共回答了13个问题 |采纳率100%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物.根据题意:CO+H2O(g)
 ⇌CO2 +H2,
⇌CO2 +H2,
初始物质的量:1 3 00
变化物质的量:0.750.75 0.75 0.75
平衡物质的量:0.25 2.25 0.75 0.75
此时二氧化碳和氢气的物质的量之和是1.5mol,再通入6mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各1mol,此时CO2和H2的物质的量之和是2mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2和H2的物质的量之和介于1.5mol-2mol之间.
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- 化学平衡题恒容条件下 可逆反应CO+H2O=H2+CO2 都是气态开始充入1mol CO 和 1mol H2O 达到平稳
化学平衡题
恒容条件下
可逆反应CO+H2O=H2+CO2 都是气态
开始充入1mol CO 和 1mol H2O 达到平稳时,CO2为0.6 mol
现再次充入0.3moL 气体H2O.则再次平衡时CO2为多少mol?
答案有A 0.7 B 0.8 2765762151年前2
2765762151年前2 -
 sweetheart828826 共回答了15个问题
sweetheart828826 共回答了15个问题 |采纳率86.7%解析:
方程式:CO(g) + H2O(g) = H2(g) + CO2(g)
反应前:1mol------1mol--------0---------0
平衡时:0.4mol----0.4mol------0.6mol----0.6mol
共转移:0.6mol----0.6mol------0.6mol----0.6mol
平衡常数
K =([H2]^1*[CO2]^1)/([CO]^1*[H2O]^1)
= (0.6*0.6)/(0.4*0.4)
= 2.25
再次充入0.3mol H2O(g),因为同温同压,所以平衡常数不变
再次充入0.3molH2O(g)与一次充入1.3mol,没有本质上的区别
方程式:CO(g) + H2O(g) = H2(g) + CO2(g)
反应前:1mol------1.3mol--------0-------0
平衡时:(1-x)mol-(1.3-x)mol-xmol-----xmol
共转移:xmol----xmol------xmol----xmol
平衡常数
K =([H2]^1*[CO2]^1)/([CO]^1*[H2O]^1)
= (x*x)/[(1-x)(1.3-x)]= 2.25
x^2 = 2.25*(1.3 - 2.3x + x^2)
1.25x^2 - 5.175x + 2.925 = 0
b^2-4ac = (-5.175)^2 - 4*1.25*2.925 = 12.155625
x1 =[-b+√(b^2-4ac)]/2a = [5.175 + (√12.155625)]/2*1.25 = 3.465mol
x2 =[-b-√(b^2-4ac)]/2a = [5.175 - (√12.155625)]/2*1.25 = 0.675mol
x1不合题意,舍去
所以CO2浓度 = 0.675mol1年前查看全部
- 参考下列图表和有关要求回答问题(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2
参考下列图表和有关要求回答问题
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是______,△H的变化是______(填“增大”、“减小”、“不变”).请写出NO2和CO反应的热化学方程式:______;
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知 ③H2O(g)=H2O(l)△H=-44kJ/mol
则甲醇燃烧的热化学方程式为CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-726KJ/molCH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-726KJ/mol;
(3)下表是部分化学键的键能数据:
已知白磷的燃烧热为d kJ•mol-1,白磷及其完全燃烧的产物结构如图Ⅱ所示,则上表中x=化学键 P-P P-O O=O P=O 键能/kJ•mol-1 a b c x [6a+5c+d−12b/4][6a+5c+d−12b/4]kJ•mol-1(用含有a、b、c、d的代数式表示) 秋夜孤旅1年前1
秋夜孤旅1年前1 -
 猪珠的鱼 共回答了16个问题
猪珠的鱼 共回答了16个问题 |采纳率87.5%解题思路:(1)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)依据热化学方程式,利用盖斯定律进行计算;
(3)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算.(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)利用盖斯定律进行计算,
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知 ③H2O(g)=H2O(l)△H=-44kJ/mol
依据盖斯定律计算(②×3-①×2+③×2)×[1/2]得到CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-726 KJ/mol;
故答案为:CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-726 KJ/mol;
(3)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,
x=[6a+5c+d−12b/4]KJ/mol
故答案为:[6a+5c+d−12b/4].点评:
本题考点: 化学平衡的影响因素;有关反应热的计算;热化学方程式.
考点点评: 本题考查较为综合,题目难度中等,本题注意热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握,另外注意反应热的计算,特别是注意分析白磷的氧化磷的分子结构,正确判断共价键的类型和数目.1年前查看全部
- 2CO(g)+O2(g)⇌2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为
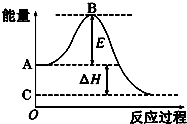 2CO(g)+O2(g)⇌2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:
2CO(g)+O2(g)⇌2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:
(1)图中A点表示:______;E的大小对该反应的反应热______(填“有”或“无”)影响.
(2)图中△H=______kJ/mol. tangshie271年前1
tangshie271年前1 -
 好心的人帮帮忙 共回答了26个问题
好心的人帮帮忙 共回答了26个问题 |采纳率92.3%解题思路:已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol,反应是放热反应,分析图象A点能量高为反应物的能量,C点为生成物的能量,E是反应的活化能,△H为反应的焓变,只与反应物和生成物能量有关,与变化过程无关.(1)已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol,反应是放热反应,分析图象A点能量高为反应物的能量,C点为生成物的能量,E是反应的活化能,决定反应进行的难易;故答案为:反应...
点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了反应能量变化,焓变、活化能意义的理解和分析,题目较简单.1年前查看全部
- 现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),已知1mol CO和2mol H2O(
现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),已知1mol CO和2mol H2O(g)在一定条件下反应达平衡时生成0.7mol CO2,若其它条件不变,把2mol H2O(g)改成4mol,达平衡时生成CO2可能是( )
A.1.2 mol
B.0.83 mol
C.1.5 mol
D.2 mol 水央央1年前1
水央央1年前1 -
 lzn0504 共回答了18个问题
lzn0504 共回答了18个问题 |采纳率88.9%解题思路:若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,但不能完全反应,再根据极限法进行判断.若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,CO的转化率增大,故平衡时CO2的物质的量大于0.7mol,由于可逆反应不能进行完全,因此1molCO不可能完全转化,生成CO2的物质的量小于1mol,故平衡时0.7mol<n(CO2)<1mol,
故选:B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动与计算、可能反应的特点等,难度不大,注意构建平衡建立的途径利用极限法进行解答.1年前查看全部
- 已知1mol CO气体完全燃烧生成二氧化碳气体放出283kJ热量,1mol氢气完全燃烧生成液态水放出286kJ热量,1m
已知1mol CO气体完全燃烧生成二氧化碳气体放出283kJ热量,1mol氢气完全燃烧生成液态水放出286kJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出氢气燃烧的热化学方程式H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/molH2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol;
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出热量为______890kJ(填“>”“<”、“=”). coletan1年前1
coletan1年前1 -
 pufalan126 共回答了12个问题
pufalan126 共回答了12个问题 |采纳率100%解题思路:(1)依据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(2)根据不同聚集状态的水的能量不同,进行判断1mol CH4气体完全燃烧生成CO2气体和水蒸气放出的热量.(1)1mol氢气完全燃烧生成液态水放出286kJ热量,则氢气燃烧的热化学方程式为:H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol;
故答案为:H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol;
(2)水由气态变为液态时要放出热量,由于1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ,
故答案为:<.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查了热化学方程式的书写、有关反应热的简单计算,题目难度不大,注意掌握热化学方程式的书写原则,能够根据物质的状态判断对反应热的影响.1年前查看全部
- 慢慢答,不用急.已知1MOL CO 气体完全燃烧生成CO2气体放出283KJ热量1MOL H2 完全燃烧成为液态水放出2
慢慢答,不用急.
已知1MOL CO 气体完全燃烧生成CO2气体放出283KJ热量
1MOL H2 完全燃烧成为液态水放出286KJ热量
1MOL CH4 完全燃烧生成C02气体和液态水放出890KJ热量
若将aMOL CH4 H2 CO 的混合气体完全燃烧生成C02气体和液态水,且二氧化碳和水的物质的量相等时,放出热量Q的取值范围是?
我在追问里提供的那个方法还有没有救,有救+分 小花旦1年前11
小花旦1年前11 -
 lwruby 共回答了14个问题
lwruby 共回答了14个问题 |采纳率85.7%写下不是很规范的方程式哈,不过从数学上看更统一
CO+(1/2)O2=CO2 283kJ
H2+(1/2)O2=H2O 286kJ
CH4+2O2=CO2+2H2O 890kJ
这里的焦点在于怎么安排能使放热最大或者最小
第三个产物1mol就可以放出890kJ的热,远超前两个
即从放热效率来说第三个最高,那么必然要使放热最大,我们希望能使第三个的含量最大
但是限制在于二氧化碳和水的物质的量相等,而能补充的只有第一个反应,所以
最大放热发生在CO:CH4=1:1
即Qmax=(a/2)*(283+890)=586.5a kJ
类似,最小的放热就是完全不用第三个
不然每用第三个一点点,放热都会变很大
所以只有一二,为了使二氧化碳和水的物质的量相等
只有CO:H2=1:1
即Qmin=(a/2)*(283+286)=284.5a kJ1年前查看全部
- 在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H 2 O(g)⇌C
在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g),若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( ) A.0.25 B.0.17 C.0.44 D.1.0  hqhope1年前1
hqhope1年前1 -
 我的天使_蕾 共回答了19个问题
我的天使_蕾 共回答了19个问题 |采纳率84.2%平衡时测得CO转化率为40%,故参加反应的CO的物质的量为1mol×40%=0.4mol,则:
CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g),
开始(mol):12 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):0.6 1.6 0.4 0.4
故该温度下平衡常数k=
c(C O 2 )•c( H 2 )
c(CO)•c( H 2 O) =
0.4×0.4
0.6×1.6 =0.17,
故选B.1年前查看全部
- 已知1MOL CO 气体完全燃烧生成CO2气体放出283KJ热量
已知1MOL CO 气体完全燃烧生成CO2气体放出283KJ热量
1MOL H2 完全燃烧成为液态水放出286KJ热量
1MOL CH4 完全燃烧生成C02气体和液态水放出890KJ热量
若将aMOL CH4 H2 CO 的混合气体完全燃烧生成C02气体和液态水,且二氧化碳和水的物质的量相等时,放出热量Q的取值范围是? yanjun_kang1年前1
yanjun_kang1年前1 -
 小小111111 共回答了22个问题
小小111111 共回答了22个问题 |采纳率100%就是分为 一氧化碳以外,全部是氢气OR全部是甲烷两种情况,
因为甲烷 氢气都是产生水更多.可以发现,甲烷 氢气与一氧化碳比例都应是1:1,所以各0.5mol.计算得到值域为284.5kJ/mol~586.5kJ/mol1年前查看全部
- 在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) 可逆反应 CO2(g)
在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) 可逆反应 CO2(g)+H2(g) 800℃时反应达平衡,若k=1.求:(1)CO的平衡浓度和转化率.
(2)若温度不变,上容器中充入 的是1mol CO和 2mol H2O(g),CO和H2O(g),的平衡浓度和转化率是多少.
(3)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g),CO和H2O(g),的平衡浓度和转化率是多少.
(4)若温度不变,要使CO的转化率达到90%,在题干的条件下还要充入 H2O(g) 物质的量为多少.
2.和4怎么写 xxoxx1239631年前1
xxoxx1239631年前1 -
 扬州牛皮糖 共回答了14个问题
扬州牛皮糖 共回答了14个问题 |采纳率78.6%CO(g)+H2O(g)﹤=﹥CO2(g)+H2(g),
开始1mol 1mol 0 0
反应 X X X X
平衡1mol-X
1mol-X X X
800度时反应平衡时各物质的物质的量浓度分别为:
C(CO)=(1mol-X)/2L
C(H2O)=(1mol-X)/2
C(CO2)=X/2L C(H2)=X/2L
K=[C(CO2)* C(H2)]/[C(CO)*(H2O)]
=[X/2*X/2L]/[(1mol-X)/2L * (1mol-X)/2L
]=1
解得X=0.5mol
CO的浓度C(CO)=0.5mol/2L=0.25mol/L
CO的转化率=0.5mol/1mol*100%=50%
3)
CO(g)+H2O(g)﹤=﹥CO2(g)+H2(g),
开始1mol 4mol 0 0
反应 X X X X
平衡1mol-X 4mol-X
X
X
K=[X*X]/[(1mol-X)*(4mol-X)]=1
解得X=0.8mol
CO的平衡浓度=(1mol-0.8mol)/2L=0.1mol/L
H2O(g)的平衡浓度=(4mol-0.8mol)/2L=1.6mol/L
CO转化率=0.8mol/1mol*100%=80%
H20的转化率=0.8mol/4mol*100%=20%
(4)
因为四个物质反应消耗量或生成量是 1:1:1:1
因为k=生成物物质的量的积X反应物物质的量的积 k=1
转化率达到90% 也就是一氧化碳消耗了0.9 mol
设a等于充入的水的物质的量
所以 0.9^2=0.1(0.1+a)
得到a=8mol
掌握平成转化率的几种计算方法和步骤
某个指定反应物的转化率= ×100%
或者= ×100%
或者= ×100%
转化率越大,反应越完全!
【梦华幻斗】团队为您答题.
请点击下面的【选为满意回答】按钮,同时可以【赞同】一下,1年前查看全部
- 已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ热量,1m
已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热
⑴ 写出H2完全燃烧热化学方程式 .
⑵ 若1mol CH4气体完全燃烧生成CO2气体和水蒸汽,放出热量 890KJ(填“ =”、“>”” yftianj1年前1
yftianj1年前1 -
 十五QQ 共回答了17个问题
十五QQ 共回答了17个问题 |采纳率100%为了使产物量相等,1mol甲烷需要搭配1molCO,1molH2则需搭配1molCO,前者放热1176KJ,后者569KJ,分别除2再乘a就得到极值1年前查看全部
- 已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ
已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热
(1)写出H2完全燃烧热化学方程式H2(g)+[1/2]O2(g)=H2O(l)△H=-286kJ•mol-1H2(g)+[1/2]O2(g)=H2O(l)△H=-286kJ•mol-1
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸汽,放出热量______890KJ(填“=”、“>””<”)
(3)若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,且CO2和H2O物质的量相等,则放出热量(Q)的取值范围是______. wenzson1年前1
wenzson1年前1 -
 偶扬雨 共回答了23个问题
偶扬雨 共回答了23个问题 |采纳率95.7%解题思路:(1)依据热化学方程式书写方法写出热化学方程式,标注物质聚集状态和对应焓变;
(2)根据不同聚集状态的水的能量不同,进行判断1mol CH4气体完全燃烧生成CO2气体和水蒸气放出的热量;
(3)根据CO2气体和液态水的物质的量相等,利用讨论法计算.(1)1molH2在O2中完全燃烧,生成1mol液态水,放出286kJ热量,表示H2燃烧热的化学方程式为:H2(g)+[1/2]O2(g)=H2O(l)△H=-286kJ•mol-1,
故答案为:H2(g)+[1/2]O2(g)=H2O(l)△H=-286kJ•mol-1;
(2)水由气态变为液态时要放出热量,由于1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ,
故答案为:<;
(3)生成的CO2和液态水的物质的量相等,还用假设分析,有以下几种可能:
①若无CO,生成的CO2和液态水的物质的量不相等,故不合题意;
②若无H2,可能是CO和CH4各为[a/2]mol,生成液态水放出的热量(Q)=[a/2×(283+890)=586.5aKJ;
③若无CH4,可能是CO和H2各为
a
2]mol,生成液态水放出的热量(Q)=[a/2]×(283+286)=284.5akJ;
④若无两种气体均不可能,
所以放出的热量(Q)的取值范围为:284.5aKJ<Q<586.5aKJ,
故答案为:284.5a KJ<Q<586.5aKJ.点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 本题考查了热化学方程式的书写、有关反应热的简单计算,题目难度中等,注意掌握热化学方程式的书写原则,能够根据物质的状态判断对反应热的影响.注意极限法和讨论法的计算运用.1年前查看全部
大家在问
- 1一瓶糖水重442克,其中糖和水的质量比是2比15,这瓶糖水中有水多少克,合多少克,糖呢,算式也要,
- 2Mrs.Smith often helps___with my Chinese on Sundays.
- 3如何验证铁、氯化铁、氯化亚铁分别具有还原性或氧化性?
- 4听对话,回答下列问题 听对话,回答下列问题.1.What's the girl's name?_____________
- 5同时投掷两个质地均匀的骰子,出现的点数之和为3的倍数的概率为( )
- 6g【x】=2的【1-x】次方是增函数还是减函数?
- 7麻烦出20道脱式计算,(简便计算)小学四年级
- 8一运动员推铅球,出手点离地面高为5/3米,当铅球水平飞行4米时达到最高点,离地面3米,问该他能把铅球推出几米
- 9有没有关于世界奇观的英语作文?不超过50词
- 10请英文高手搭救both parties and document to be identified是什么意思
- 11已知:如图,△ABC中,点D、E分别在AB、AC上,DE∥BC,过A、D、C点的圆交DE的延长线于F.求证:△FCE∽△
- 12----Give me that pan.----Which one?----_________on the desk.
- 13一的平方加二的平方加三的平方·····一直加到(n-1)的平方等于多少
- 14求other,others,another,the other的区别,从网上复制一律不采
- 15I love to wither lavender comes to men and women the lane th
