电解水实验得到的结论 2个
 jackyshi152022-10-04 11:39:542条回答
jackyshi152022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 tottisaviola 共回答了19个问题
tottisaviola 共回答了19个问题 |采纳率100%- 水通电生成氧气和氢气,水由氢元素和氧元素组成,体积比是2:1
- 1年前
 sq1097 共回答了1个问题
sq1097 共回答了1个问题 |采纳率- 错了是3个
- 1年前
相关推荐
- 下列关于电解水的叙述错误的是( ) A.电解水实验证明水是由氢、氧两种元素组成的 B.电解水时正、负极产生的气体体积比
下列关于电解水的叙述错误的是( ) A.电解水实验证明水是由氢、氧两种元素组成的 B.电解水时正、负极产生的气体体积比约为1:2 C.为增强水的导电性,常在水中加入少量的稀硫酸 D.与电源正极相连的试管内得到的气体能在空气中燃烧  独行人L1年前1
独行人L1年前1 -
 吃雪糕的小妹妹 共回答了13个问题
吃雪糕的小妹妹 共回答了13个问题 |采纳率100%A、电解水生成了氢气和氧气,证明水是由氢、氧两种元素组成的.故A叙述正确;
B、电解水时正、负极产生的气体体积比约为1:2.故B叙述正确;
C、为增强水的导电性,常在水中加入少量的稀硫酸或氢氧化钠.故C叙述正确;
D、与电源正极相连的试管内得到的气体是氧气,能支持燃烧.故D叙述错误.
故选D.1年前查看全部
- 根据所学知识,我们可以从“电解水实验”中获得更多信息和推论.下列说法错误的是( )
根据所学知识,我们可以从“电解水实验”中获得更多信息和推论.下列说法错误的是( )
A.水是由氢原子和氧原子构成的
B.正极气体能使带火星的木条复燃,说明是氧气
C.水中氢氧两种元素的质量比为1:8
D.电解水所得正负两极气体体积比为2:1 别笑俺是yy1年前1
别笑俺是yy1年前1 -
 好大根油条 共回答了13个问题
好大根油条 共回答了13个问题 |采纳率100%解题思路:A、水分子由氢原子、氧原子构成,而水分子构成水;
B、依据正极产生氧气,且氧气能使带火星木条复燃分析解决.
C、利用水中的氢氧两种元素的质量比或生成物质量比解决;
D、根据电解水的实验可以知道“正氧一负氢二”,据此分析解答即可;A、水由水分子构成而非由氢、氧原子构成,水分子是由氢氧两种原子构成;故此选项错误;
B、电解水时正极生成能使带火星的木条复燃的气体,而这时氧气的性质,所以说明是氧气;故此选项正确.
C、依据水中氢氧两种元素的质量比或者是生成的氢气与氧气的质量比均能得到该结论;故此选项正确.
D、电解水所得正负两极气体分别是氧气和氢气,其体积比为1:2,故此选项错误;
故选AD点评:
本题考点: 电解水实验.
考点点评: 本题是有关电解水的基础知识的考查,扎实地掌握化学的基础知识,对解决此问题必不可少.1年前查看全部
- 电解水实验水发生什么变化
 ener1年前3
ener1年前3 -
 52600685 共回答了19个问题
52600685 共回答了19个问题 |采纳率100%发生化学反应,反应类型为分解反应,也是氧化还原反应
阳极反应:4OH(-)-4e(-)=2H2O+O2↑
阴极反应:2H(+)+2e(-)=H2↑
总反应:2H2O=(通电)2H2↑+O2↑
水分子由氢原子和氧原子组成
通电后水分子被破坏,分解为氢原子、氧原子
两个氢原子组成一个氢分子;两个氧原子组成一个氧分子
许多氢分子聚集在一起为氢气;
许多氧分子聚集在一起为氧气1年前查看全部
- 如图所示,关于电解水实验的叙述错误的是( )
如图所示,关于电解水实验的叙述错误的是( )

A.试管a中的气体是氢气
B.试管b中的气体能使带火星的木条复燃
C.产生的氢气和氧气的质量比为2:1
D.产生的氢气和氧气的体积比为2:1 fhdqc19981年前1
fhdqc19981年前1 -
 zhangdongan 共回答了26个问题
zhangdongan 共回答了26个问题 |采纳率88.5%解题思路:电解水,发生反应的化学方程式为:2H2O
2H2↑+O2↑;可观察到:与电源负极相连的一边产生较多的气体,该气体燃烧火焰呈淡蓝色,罩在火焰上方冷而干燥的烧杯壁有水出现,可说明为氢气;与电源正极相连的一边产生气体可以使带火星的木条复燃,可说明为氧气;两边气体体积比为2:1;由实验可得出水由氢氧元素组成的结论;根据以上现象或结论,对题中叙述进行判断,选出错误的判断.通电 .A、由实验操作图,b管内气体少于a管,则a内产生的气体为氢气;故A正确.
B、根据实验操作图,b管内气体少于a管,则b管内产生的气体为氧气,氧气能使带火星的木条复燃;故B正确;
C、电解水时产生的氢气和氧气的质量比为1:8;故C错误.
D、水电解时,产生的氢气和氧气的体积比为2:1,而非质量比;故D正确;
故选C.点评:
本题考点: 电解水实验;常见气体的检验与除杂方法.
考点点评: 水电解时正极产生氧气,负极产生的为氢气,氢气、氧气体积比为2:1;练掌握水电解时的现象及结论,是解决此题的基础.1年前查看全部
- 下列关于电解水实验的叙述正确的是( )
下列关于电解水实验的叙述正确的是( )
A.实验说明水是由氢原子和氧原子组成的 B.电解水的化学方程式:H 2 O  H 2 ↑+O 2 ↑
H 2 ↑+O 2 ↑C.甲试管内产生的气体能使带火星的木条复燃 D.甲、乙两试管产生的气体质量之比为1:2  13999_ee1年前1
13999_ee1年前1 -
 张三李四116 共回答了19个问题
张三李四116 共回答了19个问题 |采纳率94.7%C
1年前查看全部
- 电解水实验时发生奇怪的现象...
电解水实验时发生奇怪的现象...
昨晚做电解水实验.用的是15V电压.今早查看电解后的气体时,发现试管周围遍布着淡蓝色絮状物,电极的金属有稍微被氧化或者腐蚀的现象.
没学过化学,高手来解答下蓝色絮状物的成分和形成原因 百灵评论二辩1年前3
百灵评论二辩1年前3 -
 uu藩茄 共回答了26个问题
uu藩茄 共回答了26个问题 |采纳率92.3%可能是铜导线作阳极,参与电解反应.
阳极:Cu-2e-=Cu2+,
阴极:2H2O+2e-=2OH-+H2↑;
Cu2+ + 2OH-=Cu(OH)2,水合铜离子和Cu(OH)2都是蓝色的.
用惰性电极(石墨/铂等)就不会有此现象了.1年前查看全部
- 电解水的疑问在电解水实验中,通电后,电极上出现(气泡),一段时间后正极和负极试管中收集到的气体体积比约为(2:1);对两
电解水的疑问
在电解水实验中,通电后,电极上出现(气泡),一段时间后正极和负极试管中收集到的气体体积比约为(2:1);对两个试管中的气体进行检验,正极产生的气体可以(支持燃烧/是带火星的木条复燃),说明是(氧气),负极产生的气体可以(燃烧),说明是(氢气).通过电解水实验说明水是由(氢元素)和(氧元素)组成的.
水的元素符号是H20,正极产生的气体是氧气,那么与氧分离的H2跑到哪里去了? 西西1231年前2
西西1231年前2 -
 lovedy1015 共回答了19个问题
lovedy1015 共回答了19个问题 |采纳率84.2%你学了电离就知道了,水电解是离子态电解的,方程式给你写出来,水种存在:H+,OH-;一个阳离子一个阴离子,阳极吸引阴离子(OH-),阴极吸引阳离子(H+),
4OH-=2H2O+O2;2H+=H2(等号上有失去电子得到电子写不上去).1年前查看全部
- 家庭电解水实验,本人家庭电解水,电极用铜,正极没有任何反应,负极有气体生成,并带有黄色物质在水中,电极用什么,只有铁,铝
家庭电解水实验,
本人家庭电解水,电极用铜,正极没有任何反应,负极有气体生成,并带有黄色物质在水中,电极用什么,只有铁,铝和不锈钢,没有什么碳棒,铂,悬赏只有20,本人只有这么多 DenisMolin1年前2
DenisMolin1年前2 -
 威罗_gg 共回答了22个问题
威罗_gg 共回答了22个问题 |采纳率100%碳棒就是你的铅笔芯啊.随便铅笔芯抽一段出来就是现成的石墨,特好用.1年前查看全部
- 电解水实验中,为了增加水的导电性,可加入少量的什么或什么拜托各位了 3Q
 梦女孩v11年前2
梦女孩v11年前2 -
 小鱼可可1 共回答了18个问题
小鱼可可1 共回答了18个问题 |采纳率100%硫酸和氢氧化钠的溶液具有良好的导电性,而纯水导电性很弱,反应较慢,所以在水中加入少量硫酸或氢氧化钠是为了增强水的导电性1年前查看全部
- 电解水实验中如果生成氧气32克,那么氢气多少克
 公子的德赛1年前2
公子的德赛1年前2 -
 鄂狼之吻 共回答了21个问题
鄂狼之吻 共回答了21个问题 |采纳率85.7%4克1年前查看全部
- 电解水实验中为什么会出现氢气和氧气 水一样,水中的稀硫酸或氢氧化钠也一样,难道是正负极使之变化
 乐藏float1年前2
乐藏float1年前2 -
 来碗菜饭 共回答了18个问题
来碗菜饭 共回答了18个问题 |采纳率88.9%在电流的作用下电能转化为化学能,使水发生了分解反应1年前查看全部
- 稀盐酸能否增强导电性 为什么在电解水实验中可以用稀硫酸来增强导电性,不可用稀盐酸?
 疯猫0021年前1
疯猫0021年前1 -
 普历矛思 共回答了15个问题
普历矛思 共回答了15个问题 |采纳率93.3%稀盐酸可以增强导电性.Hcl也是强电解质电离出H+,cl-.硫酸的阴离子为SO42-,电解水的时候就考虑到阴离子失去电子的情况.硫酸根比氢氧根难失电子,4OH-—4e-=2H2O+O2
但是cl-不同,比氢氧根易失电子2cl-—2e-=cl2,导致的结果就是先电解Hcl,生成的氯气导致氧气不纯1年前查看全部
- 电解水实验原理
 九黎之主1年前1
九黎之主1年前1 -
 newfly1363 共回答了23个问题
newfly1363 共回答了23个问题 |采纳率87%2H2O=O2↑+2H2↑
因为H+是阳离子,所以被负极吸引
O2-是阴离子,被正极吸引
生成氢气和氧气
[原理]
电解水就是通电使水分解成氢气与氧气的实验,为了增加水的导电性一般使用氢氧化钠或硫酸溶液,简单分述如下.
(一)以氢氧化钠溶液为电解液
当电流通过时溶液中的H+和Na+离子都移向阴极,但因为Na+离子获得电子的倾向小,故在阴极上析出的是氢气而不是钠.在阳极上,OH-离子放电析出氧气.
极上析出氧气.
故电解化学方程式应写成,1年前查看全部
- 电解水实验正极与负极产生的气体质量之比和体积之比
 懒懒女人1年前1
懒懒女人1年前1 -
 wyhhappy 共回答了23个问题
wyhhappy 共回答了23个问题 |采纳率100%电解
方程式:2H20==========2H2+O2
1摩尔水电解生成2摩尔氢气和1摩尔氧气
体积比正比于摩尔比,得体积之比氢气:氧气=2:1
质量之比;质量等于摩尔数X分子量,氢气质量=2X2=4:氧气质量=1X32=32
质量之比;氢气:氧气=4:32=1:81年前查看全部
- 电解水实验中原子的() 和() 都没变
 shudaicao1年前1
shudaicao1年前1 -
 楼主是鸟人 共回答了20个问题
楼主是鸟人 共回答了20个问题 |采纳率90%数目 种类1年前查看全部
- 电解水现象用水电解器进行电解水实验时,将电源正极与电解器的A级相连,电源负极与电解器的B级相连.所观察到的正确现象是()
电解水现象
用水电解器进行电解水实验时,将电源正极与电解器的A级相连,电源负极与电解器的B级相连.所观察到的正确现象是()
A、A级产生的气体比负极多
B、B级产生的气体比正极多
C、A级产生的气体可被点燃
D、B级产生的气体具有助燃性 堕降1年前1
堕降1年前1 -
 auroraying 共回答了15个问题
auroraying 共回答了15个问题 |采纳率100%B
A产生的是氧气,B极产生的是氢气.氢气和氧气的体积比约为1比2.氧气具有助燃性,氢气可燃,火焰呈淡蓝色.1年前查看全部
- 化学电解水实验中,为什么氧气产生在正极而不是负极?
 nmbbi1年前4
nmbbi1年前4 -
 下厨的狐狸 共回答了17个问题
下厨的狐狸 共回答了17个问题 |采纳率88.2%氧负离子(O2-)在正极失去电子,生成O2;氢离子(H+)在负极得电子,生成氢气.1年前查看全部
- 在电解水实验纸中加入食用盐会影响氢气的纯度吗?
在电解水实验纸中加入食用盐会影响氢气的纯度吗?
输入电压20V 2.6A反应速度太慢了,我在水槽中加入食用盐溶液,速度是提高了3倍,但是这会影响到氢气和氧气的纯度吗? scirea1年前1
scirea1年前1 -
 转转兜兜 共回答了15个问题
转转兜兜 共回答了15个问题 |采纳率66.7%只要你把两个电极产生的气体分开就可以了,加了氯化钠就是电解氯化钠了,一个电极产生氢气,一个产生氯气,氯气有毒,小心点1年前查看全部
- 哪一个选项错误 我觉得都对阿?A.用肥皂水可以区分硬水和软水 B,水既可以做反应物,也可以做生成物C.电解水实验中正极与
哪一个选项错误 我觉得都对阿?
A.用肥皂水可以区分硬水和软水 B,水既可以做反应物,也可以做生成物
C.电解水实验中正极与负极的气体体积比为2:1 C.水是能溶解多种物质的溶剂 zoutao11271年前5
zoutao11271年前5 -
 刘皓Cupid 共回答了22个问题
刘皓Cupid 共回答了22个问题 |采纳率90.9%C.电解水实验中正极与负极的气体体积比为2:1 (应该是1:2)
正氧负氢(父亲)
2H2O= 通电= 2H2↑+ O2 ↑
气体化学计量数的比即体积比1年前查看全部
- 电解水实验中气体体积比大于2:1的两个原因
电解水实验中气体体积比大于2:1的两个原因
两个原因,简短点 无汽啤酒1年前3
无汽啤酒1年前3 -
 羽砾 共回答了19个问题
羽砾 共回答了19个问题 |采纳率78.9%1、同条件下,氧气比氢气更易溶于水
2、少量氧气与电极发生反应1年前查看全部
- 求,电解水实验步骤,+注意事项
 sun_in_cloud1年前1
sun_in_cloud1年前1 -
 dyhzl 共回答了17个问题
dyhzl 共回答了17个问题 |采纳率82.4%电解水实验器的制作过程:
1.将上底半径为6厘米的圆台形的橡胶塞打上与注射器管和长颈漏斗管相匹配的三个孔.
2.将两只相同的注射器管和一个长颈漏斗管旋转插进橡胶塞的孔内,管的下沿不要超过塞子的下底面,以免装电解液时杯内留下气泡.
3.截取一小段带孔的伞骨子(镀铬不锈钢)将外附橡胶的细钢丝一端裸露部分穿入伞骨于孔内并夹紧,再将伞骨手插入已用过的一次性注射器管内的胶塞中心(此塞剪有几个孔),最后将制好的电极插入注射器管内,导线的另一端从漏斗管内穿出来,在导线上作好正负极的记号,与注射器管记号一一对应.
此步须注意以下两点:
①电极既不能露出管底,又不能插入管内太深.电极露出管底则产生的氢气和氧气混合;插入管内太深则产生气体的速度慢.
②电解器内部的细钢丝除与电极接触部分能裸露外,其余部分不能裸露.
4.将与注射器管相匹配的注射针尖截断且夹扁密封,留下针帽.
5.将制好的塞子塞到与之匹配的茶杯口内,把针帽扭到注射器管的上端.
操作步骤及现象:
1.扭下针帽,检查装置的气密性.
2.向漏斗内倒入5%至10%纯净的氢氧化钠水溶液,当电解液升到注射器管内后,加液体的速度放慢,待三个管的注段达到顶点不再改变时,将针帽扭上(不要扭得太紧).
3,通直流电源12伏至6伏,电解液浓度小则电压调大,电解液浓度大则电压调小.不到半分钟,负极(阴极)产生5毫升气体,正极(阳极)产生约2.5毫升气体.
4.切断电源,点燃木条,扭下与负极相连的针帽,迅速在管尖处点火,气体燃烧,呈淡蓝色火焰——氢气.
5.为使实验现象明显,再通电源,扭下与正极相边的针帽,迅速把带火星的木条放到管尖处,木条复燃——氧气.1年前查看全部
- 在电解水实验中,通电后,电极上出现_,一段时间后正极和负极试管中收集到的气体体积比约为_;对两个试管中的气体进行检验,正
在电解水实验中,通电后,电极上出现_,一段时间后正极和负极试管中收集到的气体体积比约为_;对两个试管中的气体进行检验,正极产生的气体可以_,说明是_,负极产生的气体可以_,说明是_.通过电解水实验说明水是由_和_组成的.
 彪弟1年前1
彪弟1年前1 -
 我爱cc 共回答了17个问题
我爱cc 共回答了17个问题 |采纳率94.1%在电解水实验中,通电后,电极上出现(气泡),一段时间后正极和负极试管中收集到的气体体积比约为(2:1);对两个试管中的气体进行检验,正极产生的气体可以(支持燃烧/是带火星的木条复燃),说明是(氧气),负极产生的气体可以(燃烧),说明是(氢气).通过电解水实验说明水是由(氢元素)和(氧元素)组成的.
该实验的现象可以这样记:
正氧负氢,氢2氧1(正极产生氧气,负极产生氢气;氢气和氧气的体积比为2:1)
除此外,经常问到的还有氢气和氧气的质量比为1:81年前查看全部
- 电解水实验中,两个电极上出现气泡,两玻璃管内液面.
 moses1年前1
moses1年前1 -
 skyeys 共回答了16个问题
skyeys 共回答了16个问题 |采纳率93.8%应该是不到2:1的关系吧,因为对水的溶解度不一样1年前查看全部
- 电解水实验时为什么要放氢氧化钠
 三纪家是1年前1
三纪家是1年前1 -
 rxh210 共回答了17个问题
rxh210 共回答了17个问题 |采纳率94.1%因为水是弱电解质,电离的离子很少.放氢氧化钠是为了增强溶液的导电性.便于水的电解1年前查看全部
- 电解水实验现象
 sdgt19691年前1
sdgt19691年前1 -
 独孤求友 共回答了20个问题
独孤求友 共回答了20个问题 |采纳率95%根据电解时生成物的情况,电解可分以下几种类型:
1.电解水型:含氧酸、强碱、活泼金属的含氧酸盐溶液的电解;
2.分解电解质型:无氧酸(如HC1)、不活泼金属的无氧酸盐(如CuCl2)溶液的电解;
3.放氢生碱型:活泼金属的无氧酸盐(如NaCl、MgBr2等)溶液的电解;
4.放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3等)溶液的电解.电解过程中的能量转化(装置特点)
阴极:一定不参与反应 不一定惰性电极 阳极:不一定参与反应 也不一定是惰性电极
发生电解反应的条件
①连接直流电源 ②阴阳电极 阴极:与电源负极相连为阴极 阳极:与电源正极相连为阳极 ③两极处于电解质溶液或熔融电解质中 ④两电极形成闭合回路
电极反应
电极反应 与电源的正极相连的电极称为阳极.物质在阳极上失去电子,发生氧化反应.如上图装置中,Cl-在阳极上失去电子转化为Cl2,阳极反应式:2Cl--2e=Cl2↑ 与电源的负极相连的电极成为阴极.物质在阴极上得到电子,发生还原反应.如上图装置中,Cu2+在阴极是得到电子转化为Cu,阴极反应式:Cu2++2e=Cu
电解结果
在两极上有新物质生成
电解池电极反应方程式的书写
阳极:活泼金属—电极极失电子(Au,Pt 除外);惰性电极—溶液中阴离子失电子 失电子能力:活泼金属(Mg~Ag)>S2->I->Br->Cl->OH->含氧酸根(NO3 ->SO4 2-)>F- 阴极:溶液中阳离子得电子 得电子能力:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(即活泼型金属顺序表的逆向) 规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件
四类电解型的电解规律
①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变.电解质溶液复原—加适量水 ②电解电解质型(无氧酸,不活泼金属的无氧酸盐,),无氧酸pH变大,不活泼金属的无氧酸盐PH不变.电解质溶液复原—加适量电解质. ③放氢生碱型(活泼金属的无氧酸盐),pH变大.电解质溶液复原—加阴离子相同的酸 ④放氧生酸型(不活泼金属的含氧酸盐),pH变小.电解质 溶液复原—加阳离子相同的碱或氧化物
意义
使在通常情况下不发生变化的物质发生氧化还原反应,得到所需的化工产品、进行电镀以及冶炼活泼的金属.在金属的保护方面也有一定的用处.
编辑本段电解原理的应用
氯碱工业(电解饱和食盐水)
制取氯气、氢气、烧碱. 饱和食盐水溶液中存在Na+和Cl-以及水电离产生的H+和OH-.其中氧化性H+>Na+,还原性Cl->OH-.所以H+和Cl-先放电(即发生还原或氧化反应). 阴极:2H+2e—=H2↑ (还原反应) 阳极:2Cl-2e-=Cl2↑ (氧化反应) 总反应的化学方程式:2NaCl+2H2O=(等号上为通电)2NaOH+H2↑+Cl2↑ 用离子方程式表示:2Cl-+2H2O=(等号上为通电)2OH-+H2↑+Cl2↑.
电镀和电解精炼铜
电镀:应用电解原理在某些金属表面镀上一薄层其他金属或者合金的过程 条件:①镀件做阴极②镀层金属做阳极③电镀液中含镀层金属离子 电镀时,把待镀的金属制品(即镀件)作阴极,镀层金属作阳极,用含有镀层金属离子的溶液作电镀液. 阳极:Mn-e-=Mn+ 阴极:Mn++e-=Mn 这样,在直流电的作用下,镀层金属就均匀地覆盖到镀件的表面. 同样的道理,用纯铜作阴极,用粗铜作阳极,用CuSO4溶液作电解液.通入直流电,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,从而达到提纯铜的目的.
电解法冶炼金属
钠、钙、镁、铝等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到.如电解熔融的氯化钠可以得到金属钠: 阴极:2Na++2e-=2Na 阳极:2Cl――2e-=Cl2↑
编辑本段电解时,物质在电极上的放电顺序
(1)阳极:与电源的正极相连. 当阳极的电极材料为金属(Pt或Au除外)时,通电后作电极的金属失去电子变成金属离子,溶解到电解质溶液中. 当阳极的电极材料是惰性物质(如Au、Pt或石墨)时,通电后溶液中的阴离子在阳极上失去电子,当溶液中同时存在多种阴离子时,还原性强的离子先失去电子发生氧化反应.常见阴离子的还原性由强到弱的顺序是:活性电极〉S2-> I- > Br-> Cl->OH->含氧酸根离子(如SO4 2-、NO3-等)>F-.Cl-和OH-在电解时的电极反应式分别是: 2Cl- ―2e-=Cl2↑ 4OH- ―4e-=2H2O+O2↑ 因为水电离能够产生OH-,所以电解含氧酸盐溶液时,在阳极上是OH-放电生成氧气,而含氧酸根离子不发生变化.(当阳极为惰性金属常用的为C 铂 金 时 自身放电) (2)阴极:与电源的负极相连. 在阴极上发生还原反应的是溶液中的阳离子.当溶液中存在多种阳离子时,按金属活动性顺序,越不活泼的金属,其阳离子的氧化性越强,越容易被还原.在水溶液中,铝之前的金属的阳离子不可能被还原.
编辑本段酸、碱、盐溶液电解规律
(1)无氧酸是其本身的电解 (2)含氧酸是水的电解 (3)可溶性碱是水的电解 (4)活泼性金属的含氧酸盐也是水的电解 (5)活泼金属的无氧盐阴极析出氢气并伴随溶液显碱性,阳极析出非金属单质 (6)不活泼金属的无氧盐是该盐的电解 (7)中等活动性金属的含氧酸盐阴极析出金属,阳极得到氧气同时酸性提高1年前查看全部
- .水分子中氢氧原子个数比电解水实验产生体积比为2∶1的氢氧气.ρ氢=0.0899g/L,ρ氧=1.429g/L,氢、氧的
.水分子中氢氧原子个数比
电解水实验产生体积比为2∶1的氢氧气.ρ氢=0.0899g/L,ρ氧=1.429g/L,氢、氧的相对原子质量分别是1、16. w_gu_8d35jl607_11年前1
w_gu_8d35jl607_11年前1 -
 3bangzhu 共回答了17个问题
3bangzhu 共回答了17个问题 |采纳率82.4%2*0.0899/1:1*1.429/16=0.1798:0.0893=2:11年前查看全部
- 电解水实验中,常加入稀硫酸或氢氧化钠溶液增强水的导电性,电解一段时间后溶液的质量 ,溶质的质量分数
 想远飞的鱼1年前1
想远飞的鱼1年前1 -
 chen0127 共回答了18个问题
chen0127 共回答了18个问题 |采纳率100%电解水实验中,常加入稀硫酸或氢氧化钠溶液增强水的导电性,电解一段时间后溶液的质量 ,溶质的质量分数增大.水被电解,溶剂减少,溶质不变,溶质的质量分数增大.1年前查看全部
- 电解水失败我在家中自己做电解水实验时,连同电源后,只有一端(某一电极)冒气泡,而且很少,气泡很小.加了食盐后也没有明显变
电解水失败
我在家中自己做电解水实验时,连同电源后,只有一端(某一电极)冒气泡,而且很少,气泡很小.加了食盐后也没有明显变化.
而且点击两端好像都被迅速氧化了(7-8秒),电极是铁的,颜色有明显变化.
而且换用铜丝做以后,水溶液有小颗粒沉淀生成,溶液变蓝(我猜是硫酸铜),可是能不明白原因,
我还异想天开的加了一些硫酸镁。 sd-zd1年前3
sd-zd1年前3 -
 嬲妮 共回答了21个问题
嬲妮 共回答了21个问题 |采纳率76.2%电解时,最好用惰性电极,如碳棒,铂电极等,因为它们不易发生反应.而楼主用铁,铜做电极都太活泼了.因为这和普通的化学反应不同,就连银放在阳极(正极)也会变为Ag+的(毕竟有电能促进反应嘛).
第一个用铁电极,铁在正极变为Fe→Fe2+,负极产生H+→H2,由于H+减少,OH-相对增多,形成Fe(OH)3→Fe2O3.
第一个用铜电极,铁在正极变为Cu→Cu2+(蓝色),负极产生H+→H2,小颗粒沉淀可能为Mg(OH)2,也可能含Cu(OH)2.
加硫酸镁可以增加导电性,不会参与电解的.1年前查看全部
- 已知同温同压下,相同体积的任何气体含有相同分子数.请解释电解水实验中氢气与氧气体积比为何是2:1.______.
 波影子1年前1
波影子1年前1 -
 我是乔奔奔 共回答了18个问题
我是乔奔奔 共回答了18个问题 |采纳率94.4%在化学变化中原子的种类和个数都不发生变化.一个水分子中含两个氢原子和一个氧原子,因此在电解水过程中,生成的氢原子和氧原子个数比为2:1,所以由原子结合成的氢分子和氧分子个数比为2:1.又已知同温同压下相同体积的任何气体含有相同分子数,因此氢气与氧气体积比为2:1.
故答案为:化学变化中原子的种类数量不变,所以生成的氢氧原子的个数比是2:1,因此氢氧分子的个数比也是2:1,同温同压下,相同体积的任何气体含有相同分子数,所以其体积比一定是2:1.1年前查看全部
- 电解水实验中,阴极产生氢气4cm3,则阳极产生的氧气体积应为( )
电解水实验中,阴极产生氢气4cm3,则阳极产生的氧气体积应为( )
A. 8cm3
B. 2cm3
C. 4cm3
D. 1cm3 唐无双1年前1
唐无双1年前1 -
 浪子龙飞 共回答了24个问题
浪子龙飞 共回答了24个问题 |采纳率83.3%解题思路:利用电解水时的现象和结论“正氧负氢,氢二氧一”解决此题.在电解水的试验中,阴极产生氢气,阳极产生的是氧气,体积比是2:1.所以:
A、阳极产生的氧气的体积比氢气少.故A错误;
B、阳极产生的氧气体积应为2cm3,故B正确;
C、阴极产生氢气与阳极产生的氧气体积不会相等.故C错误;
D、由于氢气与氧气的体积比是2:1,阳极产生的氧气体积不是1cm3,故D错误.
故选B.点评:
本题考点: 电解水实验.
考点点评: 本题主要考查了电解水实验的现象和结论,难度不大,只要了解电解水实验的现象和结论即可回答.1年前查看全部
- 稀硫酸与水混合在一起后取100克做电解水实验硫酸质量分数从4%变为5%,求已分解水的质量
 wangfeng121年前1
wangfeng121年前1 -
 aixiaofish 共回答了21个问题
aixiaofish 共回答了21个问题 |采纳率85.7%设已分解水的质量为X
100*4%/(100-X)=5%
X=20克1年前查看全部
- 电解水实验得出的2条宏观结论是什么?
 风行泉州1年前3
风行泉州1年前3 -
 come1975 共回答了20个问题
come1975 共回答了20个问题 |采纳率85%电解水产生了氢气和氧气,水是由氢元素和氧元素组成的1年前查看全部
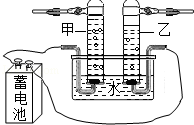
- 如图是电解水实验的示意图:(1)现象确定A端接电池______;(2)A试管里产生的是______气;B试管里产生___
如图是电解水实验的示意图:
(1)现象确定A端接电池______;
(2)A试管里产生的是______气;B试管里产生______气;B试管里的气体用______来检验;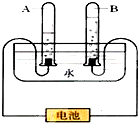
(3)该实验所发生反应的符号表达式为2H2O
2H2↑+O2↑通电 .2H2O;该实验获得两条结论:______、______.
2H2↑+O2↑通电 . 奔勇1年前1
奔勇1年前1 -
 新福成ll 共回答了21个问题
新福成ll 共回答了21个问题 |采纳率90.5%解题思路:电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2;
根据电解水的实验,可以判断水的元素组成、微观粒子的变化情况.(1)A试管产生的气体较多,是氢气,因为负极上产生的是氢气,所以A端接电池的负极.
故填:负极.
(2)A试管里产生的是氢气;B试管里产生的是氧气,氧气能使带火星的木条复燃,可以用带火星的木条检验氧气.
故填:氢;氧;带火星的木条.
(3)电解水的化学方程式为:2H2O
通电
.
2H2↑+O2↑;
化学反应前后,元素的种类不变,电解水生成氢气和氧气,说明水中含有氢元素和氧元素;
电解水的过程中,水分子分解成氢原子和氧原子,氢原子之间结合成氢分子,氧原子之间结合成氧分子,说明化学变化中,分子可分,原子不可分.
故填:2H2O
通电
.
2H2↑+O2↑;水是由氢元素和氧元素组成的;化学变化中,分子可分,原子不可分.点评:
本题考点: 电解水实验;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学反应前后,元素种类不变,原子种类、总个数不变,这是书写化学方程式的基础,要注意理解.1年前查看全部
- 下图是电解水实验装置,请回答以下问题: (1)在实验过程中,试管a产生的气体是
下图是电解水实验装置,请回答以下问题: 
(1)在实验过程中,试管a产生的气体是
(2)写出水在通电条件下反应的文字表达式
(3)在水中加入稀硫酸溶液和氢氧化钠目的是
(4)电解水得到的结论:水是由 组成。 asp9871年前1
asp9871年前1 -
 艾吾 共回答了19个问题
艾吾 共回答了19个问题 |采纳率89.5%1年前查看全部
- 电解水实验时,正极产生______负极产生______两者体积比是______自然界中的水一般是硬水,采用______转
电解水实验时,正极产生______负极产生______两者体积比是______自然界中的水一般是硬水,采用______转化成软水,硬水和软水的区别方法是______.
 mei19971年前1
mei19971年前1 -
 再见无尾鱼 共回答了18个问题
再见无尾鱼 共回答了18个问题 |采纳率77.8%解题思路:根据电解水的实验现象和软水、硬水的性质回答.电解水可简单记忆为:正氧负氢一比二,这里的比是体积比;硬水中含有较多的钙镁离子,加热时能转化为沉淀,鉴别硬水和软水常用肥皂水.电解水实验时,正极产生氧气负极产生氢气两者体积比是 1:2;自然界中的水一般是硬水,含有较多的钙镁离子,采用加热煮沸可转化成软水,硬水和软水的区别方法是 滴入肥皂水,垢状物多而泡沫少的为硬水,垢状物少而泡沫多的为软水.
故答案为:氧气、氢气、1:2;煮沸,滴入肥皂水,垢状物多而泡沫少的为硬水,垢状物少而泡沫多的为软水点评:
本题考点: 电解水实验;硬水与软水.
考点点评: 自然界中的水含有较多的钙镁离子,属于硬水,一般采用加热煮沸的方法降低其硬度.1年前查看全部
- 电解水实验!急用!若要增加水的导电性,可以用下面哪样物质?碳酸钙,肥皂水,柠檬汁,食醋,氢氧化钙…我想找的物质要在生活是
电解水实验!急用!
若要增加水的导电性,可以用下面哪样物质?碳酸钙,肥皂水,柠檬汁,食醋,氢氧化钙…我想找的物质要在生活是常见的! 宛如挥手袖底风1年前1
宛如挥手袖底风1年前1 -
 紫夜逍遥 共回答了14个问题
紫夜逍遥 共回答了14个问题 |采纳率85.7%酸盐碱均可
氯化钠(食盐)
盐酸 硫酸 硝酸 磷酸 碳酸 醋酸
烧碱(氢氧化钠)熟石灰(氢氧化钙)氢氧化钾 氢氧化钡 一水合氨(氨水)1年前查看全部
- (2011•南京)电解水实验可以确定水的组成.甲、乙、丙三位同学对电解水后液体的酸碱性进行探究.
(2011•南京)电解水实验可以确定水的组成.甲、乙、丙三位同学对电解水后液体的酸碱性进行探究.
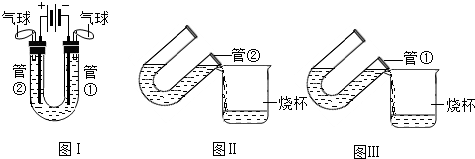
【提出问题】电解水后的液体一定呈中性吗?
【查阅资料】
图Ⅰ所示装置可用于电解水实验;硫酸钠可增强水的导电性,硫酸钠溶液呈中性.
【实验与讨论】
三位同学分别向U形管中加入含有酚酞的硫酸钠溶液,接通直流电,观察现象,电解一段时间后,断开电源.
(1)实验中发现试管①电极附近的溶液迅速变红,管②电极附近的溶液仍为无色,乙同学用pH试纸测定管②电极附近的溶液,pH小于7.说明试管①电极附近的溶液呈______性,管②附近的溶液呈______(选填“酸”、“碱”或“中”)性.
(2)甲同学将实验后U形管中的溶液按图Ⅱ所示倒入烧杯中,发现红色立刻消失.乙同学、丙同学将试验后U形管中的溶液按图Ⅲ所示分别倒入烧杯中,发现红色不完全消失.经讨论与分析,乙、丙同学的试验中溶液的红色不消失,原因可能是酸______.
(3)甲、乙、丙同学分别用蒸馏水洗涤U形管、碳棒等,再将洗涤液倒入自己实验的烧杯中,观察现象:
甲同学的溶液仍为无色.
乙同学的溶液中红色仍不消失.
丙同学的溶液中红色______.
(4)甲、乙、丙同学分析了实验现象,为确证溶液的酸碱性,又进行下列实验:
甲同学用______来测定溶液,原因是______.
乙同学向溶液中滴加______,使溶液中红色刚好褪去.因为造成(3)中溶液的红色仍不消失的原因是______.
【解释与结论】
用硫酸钠增强水的导电性时,电解后溶液混合均匀,呈中性.
【交流与反思】
甲同学取55g质量分数为2%的硫酸钠溶液进行电解,消耗了5g水后,则电解后硫酸钠溶液的质量分数为______.
甲同学的老师上课时用NaOH增强水的导电性,电解后溶液的碱性______.
乙同学的老师上课时用H2SO4增强水的导电性,电解后溶液的酸性______. jiuweitoupiao1年前1
jiuweitoupiao1年前1 -
 江北的雪松 共回答了17个问题
江北的雪松 共回答了17个问题 |采纳率88.2%解题思路:本题是溶液酸碱性的测定,利用酸碱指示剂或者pH试纸都可以测定出来,解题的关键是判断溶液里面的成分.根据实验的结果对溶液的酸碱性做出判断,进而分析即可.
【实验与探讨】(1)酚酞溶液遇碱变红,pH值小于7溶液显酸性.
故答案为:碱;酸
(2)红色不消失说明还有碱性溶液.
故答案为:不足(或酸液残留在管壁上等)
(3)丙同学的溶液中酸与碱恰好完全反应了.
故答案为:恰好褪去(或立即消失)
(4)因为酚酞溶液与酸不反应没有现象,所以无色就有2种情况,而用pH试纸就可以很简单的判断此时的溶液到底呈什么性.
故答案为:pH试纸;实验中滴加酚酞的溶液变为无色,可能呈中性,也可能因酸过量而呈酸性,故用pH试纸来确认.稀硫酸(或酸);乙同学用pH试纸测定管②电极附近溶液时消耗了少量酸.
【交流与反思】甲同学消耗了5克水,溶液还剩50克,而溶质没有变还是55×2%=1.1g.所以电解后的溶液中溶质的质量分数为[1.1g/50g]×100%=2.2%.为提高水的导电性,加入酸时,由于溶液中减少的是水,即酸的浓度在增大,所以酸性在增强,pH值在减小.而加入的是碱时,由于也是水在减少,即碱的浓度在增大,所以碱性增强,pH在增大.
故答案为:2.2%;增强;增强点评:
本题考点: 溶液的酸碱性测定;实验探究物质的性质或变化规律;酸碱指示剂及其性质.
考点点评: 本题是有一定难度的,一是题干太长,容易使人出现审题疲劳,二是如何选择判断酸碱性的方法.1年前查看全部
- 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
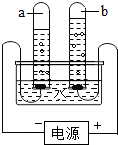 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
A.水是由氢分子和氧原子构成
B.水是由氢原子和氧原子直接构成的
C.试管a收集到的是氧气
D.试管a、b中所得气体的体积比约为2:1 阳光-眼泪1年前1
阳光-眼泪1年前1 -
 半弦之月 共回答了22个问题
半弦之月 共回答了22个问题 |采纳率86.4%A、水是由水分子构成的,故A错误;
B、水是由氢元素和氧元素组成的,故B错误;
C、试管a与电源的负极相连,所以收集到的是氢气,故C错误;
D、由图可知,试管a、b中所得气体的体积比约为2:1,故D正确.
故选:D.1年前查看全部
- (2009•顺义区一模)根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法错误的是( )
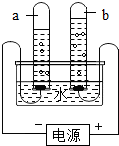 (2009•顺义区一模)根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法错误的是( )
(2009•顺义区一模)根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法错误的是( )
A.水分子是由氢原子和氧原子构成的
B.电解水所得正负两极气体的体积比为2:1
C.水中氢、氧两种元素的质量比为1:8
D.正极气体能使带火星的木条复燃,说明是氧气 ruiyan20061年前1
ruiyan20061年前1 -
 werth 共回答了16个问题
werth 共回答了16个问题 |采纳率100%解题思路:A、水分子由氢原子、氧原子构成,而水分子构成水;
B、试管a中气体体积是试管b中气体体积的两倍,试管a中为氢气,试管b中为氧气
C、利用水中的氢氧两种元素的质量比或生成物质量比解决;
D、能使带火星木条复燃的气体是氧气.A、氢、氧原子构成水分子,水分子碍聚集而构成水,因此,水由水分子构成而非由氢、氧原子构成;故此选项错误;
B、电解水所得正负两极气体的体积比为1:2,故此选项正确;
C、电解水所得到的氢气与氧气的质量比为1:8;故此选项错误.
D、正极生成氧气能使带火星的木条复燃;故此选项错误.
故选B.点评:
本题考点: 电解水实验.
考点点评: 本题是有关电解水的基础知识的考查,扎实地掌握化学的基础知识,对解决此问题必不可少.1年前查看全部
- 关于实验室电解水实验的说法不正确的是( )
关于实验室电解水实验的说法不正确的是( )
A.实验室必须使用直流电对水进行电解
B.与电源正极相连的玻璃管内产生的气体可使带火星的木条复燃
C.电源正极与负极产生的气体质量比大约是1:2
D.电解时通常在水中加入少量稀硫酸溶液增强水的导电性 linhan1年前1
linhan1年前1 -
 clouder7218 共回答了14个问题
clouder7218 共回答了14个问题 |采纳率85.7%解题思路:本题主要考查电解水实验,我们要根据电解水的实验现象,推出合理的结论,解答时要逐项分析,再判断正误.在电解水实验中,正极的气体体积少,能使带火星的木条复燃,负极的气体体积多,能燃烧,而且体积多的是少的二倍,根据以上现象可推出正极产生的气体是氧气,负极产生的气体是氢气,还能进一步推出水由氢元素和氧元素组成.A、电解水时通入的是直流电,故说法正确.
B、与正极相连的产生氧气,能使带火星的木条复燃,故说法正确.
C、电源正极与负极产生的气体体积比大约是1:2,不是质量比,故说法错误.
D、纯水导电性较差,一般要加入一些电解质以增强其导电性,说法正确.
故选C点评:
本题考点: 电解水实验.
考点点评: 题目比较简单,主要根据所学知识和实验,经过合理的分析即可判断正误.1年前查看全部
- 某同学在做电解水实验时,通电一段时间后,水的质量减少了2.7克(不考虑水的蒸发),理论上的氢气和氧气的
 qq尖峰1年前1
qq尖峰1年前1 -
 亦菲uu辅导班 共回答了22个问题
亦菲uu辅导班 共回答了22个问题 |采纳率81.8%氢气0.3g.氧气2.4g.
电解水氢气与氧气的体积比是2:1.但质量比是1:81年前查看全部
- 电解水实验产生体积为二分之一问 :原子个数比是多少?氢氧的质量比是多少?
 自游自在1年前1
自游自在1年前1 -
 JO-JO 共回答了13个问题
JO-JO 共回答了13个问题 |采纳率84.6%氢氧原子个数比2:1
氢氧的质量比1:4
(H2O,所以氢氧原子个数比2:1.
氢的原子质量1,氧的原子质量16,所以氢氧的质量比1:4)1年前查看全部
- 从“电解水实验”中可以获得许多的信息和推论.下列说法不正确的是( )
从“电解水实验”中可以获得许多的信息和推论.下列说法不正确的是( )
 A. 水是由氢元素和氧元素组成的
A. 水是由氢元素和氧元素组成的
B. 水是由氢原子和氧原子构成的
C. 分子在化学变化中可以再分
D. 试管a、b中所得气体的体积比约为2:1 新孔夫子1年前1
新孔夫子1年前1 -
 luogf 共回答了22个问题
luogf 共回答了22个问题 |采纳率95.5%解题思路:A、根据水通电分解生成氢气和氧气可知水是由氢元素和氧元素组成的进行解答;
B、根据水是由水分子构成的解答;
C、根据化学变化中分子变化情况进行解答;
D、根据试管a、b中所得气体的质体积比约为2:1进行解答;A、水通电分解生成氢气和氧气可知水是由氢元素和氧元素组成的,故A正确;
B、水是由水分子构成的,故B错误;
C、在化学变化中分子发生在分成原子,原子再重新组合,故C正确;
D、试管a、b中所得气体的质体积比约为2:1,故D正确.
故选:B.点评:
本题考点: 电解水实验.
考点点评: 本题是有关电解水的基础知识的考查,扎实地掌握化学的基础知识,对解决此问题必不可少.1年前查看全部
- 如图所示,下列关于电解水实验的叙述正确的是 ( )
如图所示,下列关于电解水实验的叙述正确的是 ()

A.氧气与氢气的体积比是2∶1 B.a试管中的电极与电源正极相连 C.b试管中产生的气体能支持燃烧 D.将b试管中的气体移近火焰可能发出爆鸣声  兔儿宝1年前1
兔儿宝1年前1 -
 Cinderella123 共回答了18个问题
Cinderella123 共回答了18个问题 |采纳率88.9%C
1年前查看全部
- 电解水实验中,为什么氢气与氧气的比例不是2:今天亲自做的实验.辅导老师让写原因.
 jiangang8231年前1
jiangang8231年前1 -
 best2007 共回答了11个问题
best2007 共回答了11个问题 |采纳率90.9%电解水的过程中,为什么氢气&氧气的体积比常常大于2:1?
原因:1.氧气的吸附性大于氢气,吸附了一部分在电极上.
2.氧气在水中的溶解性也大于氢气,溶解在水中的氧气比氢气多.
所以,实际得到的氢气和氧气的体积比大于2:1.以上都不对!众所周知纯水是不导电的,不导电的水又如何能电解呢?
我们往勿略了一个重要步骤!我们要实验的水里面加入了盐用来增加导电性能. 盐也是可以电解的,所以我们所得到的氧气中往往含有氯气等杂质.盐电解只会产生氯气,而不会像水电解一样生成两种气体.所以往往得不到1:2的气体氧气在水中的溶解性也大于氢气,溶解在水中的氧气比氢气多.第一是氧气和氢气溶解的问题
第二是刚生成的活性氧极易氧化电极 使一部分氧气没掉
导致比例失调
至于什么纯水不导电加点盐
那是小事情 不会有太大影响众所周知,纯净的水是不导电的,为了增强水水的导电性,电解水时通常会加入一些电解质,如氯化钠等.电解质在电解的同时产生少量的氢气,所以比例大于2:1 因为氧气和氢气在水中的溶解度不同,氧气不易溶,而氢气难溶,所以出现这种情况.1年前查看全部
- 某同学在做电解水实验时,采用了如图所示的简易装置.请回答下列问题:
某同学在做电解水实验时,采用了如图所示的简易装置.请回答下列问题:
(1)该化学反应的文字表达式为______,属于______反应;
(2)此装置中a端表示______极,b端表示______极;
(3)在水槽中加入少量硫酸或氢氧化钠的目的是______;
(4)图中显示表明实验______(填“未开始”“刚开始”或“已经进行了一段时间”)
(5)此改进后的电解水实验装置的优点是______.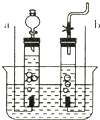
 jyth1年前1
jyth1年前1 -
 densematrix 共回答了17个问题
densematrix 共回答了17个问题 |采纳率88.2%(1)电解水能生成氢气和氧气,该化学反应的文字表达式为:水
通电
氧气+氢气,属于分解反应.
故填:水
通电
氧气+氢气;分解.
(2)此装置中,a端生成的气体体积小,是氧气,与产生氧气相连的电极是正极,那么b端表示负极.
故填:正;负.
(3)在水槽中加入少量硫酸或氢氧化钠的目的是增强水的导电性.
故填:增强水的导电性.
(4)由图中信息可知,已经生成了一定量的氢气和氧气,说明已经进行了一段时间.
故填:已经进行了一段时间.
(5)此改进后的电解水实验装置的优点是便于检验生成物.
故填:便于检验生成物.1年前查看全部
- 根据所学知识,从“电解水实验”中获得更多的信息和推论。下列说法错误的是 [
根据所学知识,从“电解水实验”中获得更多的信息和推论。下列说法错误的是 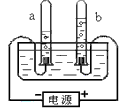 [ ]
[ ]A.水分子是由氢原子和氧原子构成的
B.电解水所得正负两极气体的体积比为2:1
C.水中氢、氧两种元素的质量比为1:8
D.正极气体能使带火星的木条复燃,说明是氧气 piaoa111年前1
piaoa111年前1 -
 shazixiebest 共回答了26个问题
shazixiebest 共回答了26个问题 |采纳率88.5%B1年前查看全部
- 电解水实验表明:氢气中的_____和氧气中的_____是从____中产生的,所以水是由_____组成
 coye_hu1年前1
coye_hu1年前1 -
 wawac 共回答了21个问题
wawac 共回答了21个问题 |采纳率90.5%氢原子,氧原子,水,氢氧1年前查看全部
- 电解水实验为何有氢气产生 无氧气产生
电解水实验为何有氢气产生 无氧气产生
氢气都差不多2ml了,氧气一点都没有 卖刀牛二51年前3
卖刀牛二51年前3 -
 vhyt55 共回答了16个问题
vhyt55 共回答了16个问题 |采纳率100%有氧气产生,无氧气产生的是电解饱和食盐水
水是弱电解质,内部存在电离平衡
①H2O=H(+)+OH(-)
②H(+)+OH(-)=H2O
v①=v②
在直流电作用下,放出氢气与氧气,氢离子与氢氧根离子不断减少,打破平衡体系,使水不停地电离,且v①>v②,所以反应不断进行
阳极反应:4OH(-)-4e(-)=2H2O+O2↑
阴极反应:2H(+)+2e(-)=H2↑ 总反应:2H2O=(通电)2H2↑+O2↑
水分子由氢原子和氧原子组成(构成)
通电后水分子被破坏,分解为氢原子、氧原子(分解)
两个氢原子组成一个氢分子;两个氧原子组成一个氧分子(重组)
许多氢分子聚集在一起为氢气;许多氧分子聚集在一起为氧气(聚集)1年前查看全部
大家在问
- 1求这个定积分∫(2x+1)/(x^2+1)dx 上限1 下限-1 虽然很简单,可我还是不会,哪位好人人教教我啊,详细点,
- 2He is behind the bar
- 3奋斗成语我想知道奋斗的真正价值是否存在?每个人都可以奋斗,但是否都又结果?
- 4实验材料要菠菜 且有叶肉的下表皮
- 5新鲜水果用保鲜袋封装起来,可延长储藏时间,主要作用是
- 6《楞伽经》中的五无间业是什么意思?
- 7哪些水果中含有人体所必需的营养成分或药物元素?
- 8春秋改进 作文
- 9— Is your father a doctor in No.2 Hospital?
- 10my favourite characters怎么写?
- 119和6的公倍数有
- 12鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味.用来洗涤的最佳物质是( )
- 13翻译:此非孟德之困于周郎者乎?况吾与子渔僬于江诸之上,侣鱼虾而友麋鹿.取自赤壁赋
- 14上海市杨浦区翔殷路790弄1号202室 英语怎么说
- 15:"当x=2,y=-1时,求3x的2次方y+[2x的2次方y-(5x的2次方y的2次方-y的2次方)】-5(x的2次方y

