三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ).制三氯化铬
 134752022-10-04 11:39:541条回答
134752022-10-04 11:39:541条回答
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因______,如何用简单方法判断其已洗涤干净______.
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是______.
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;
③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性.
正确的顺序为:⑥→③→______.
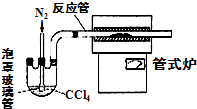
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为______.
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中.移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2═Na2S4O6+2NaI.
①该实验可选用的指示剂名称为______.w ww.k s5u.co m
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是______.
③样品中无水三氯化铬的质量分数为______.

已提交,审核后显示!提交回复
共1条回复
 yanhaihewo 共回答了21个问题
yanhaihewo 共回答了21个问题 |采纳率90.5%- 解题思路:(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质;因为(NH4)2Cr2O7显桔红色,所以可以提供颜色来判断.
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量.
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿.
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl.
(5)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,可以用淀粉作指示剂.
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差.
③由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质,用蒸馏水洗涤除去其中可溶性杂质;
因为(NH4)2Cr2O7显桔红色,最后一次洗涤的流出液呈无色,说明洗涤干净.
故答案为:除去其中可溶性杂质;最后一次洗涤的流出液呈无色.
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度.
故答案为:水浴加热(并用温度计指示温度).
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,故操作顺序为:⑥→③→②→④→⑤→①.
故答案为:②④⑤①
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl,反应方程式为COCl2+2C2H5OH→C2H5OCOC2H5+2HCl.
故答案为:COCl2+2C2H5OH→C2H5OCOC2H5+2HCl.
(5)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,可以用淀粉作指示剂,I2反应完毕蓝色褪去.
故答案为:淀粉.
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差.
故答案为:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差.
③令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.
2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+)0.0250mol/L×0.024L
故n(Cr3+)=0.0250mol/L×0.024L×[1/3]
所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.024L×[1/3]×[250mL/25mL]=0.002mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.002mol,所以样品中m(CrCl3)=0.002mol×158.5g/mol=0.317g,故样品中无水三氯化铬的质量分数为[0.317g/0.33g]×100%=96.1%.
故答案为:96.1%.点评:
本题考点: 探究物质的组成或测量物质的含量;制备实验方案的设计.
考点点评: 本题考查学生对的实验方案原理的理解与评价、物质组成含量的测定、滴定应用、化学计算等,题目难度较大,理清实验原理是关键,是对学生综合能力想考查,需要学生具备扎实的基础知识. - 1年前
相关推荐
- (2010•德阳模拟)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X和三氯化铬(CrCl3)等,这种方法制取
(2010•德阳模拟)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X和三氯化铬(CrCl3)等,这种方法制取X时便于控制反应.实验室制得纯净、干燥的X装置如图I所示.

请回答下列问题:
(1)加热时,a与b反应的化学方程式是K2Cr2O7+14HCl
2CrCl3+3Cl2↑+2KCl+7H2O△ .K2Cr2O7+14HCl.
2CrCl3+3Cl2↑+2KCl+7H2O△ .
(2)液体c的作用是______.
(3)现把制得的X持续通入图II所示的装置中进行性质实验.①A装置中可能出现的现象是______.②C装置中发生反应的离子方程式是______.
(4)向装有一定量的重铬酸钾(K2Cr2O7)的圆底烧瓶中加入一定量的浓盐酸,为了提高浓盐酸的利用率可以采取的措施是______.
(5)若设计一个简单实验,证明B装置中的Na2SO3已被氧化,则实验操作及现象是______. izotgpt1年前1
izotgpt1年前1 -
 苏_白 共回答了24个问题
苏_白 共回答了24个问题 |采纳率87.5%解题思路:(1)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X为Cl2和三氯化铬(CrCl3),依据原子守恒分析配平化学方程式;
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体;
(3)①氯气通过淀粉碘化钾溶液,氯气氧化碘离子为碘单质,遇到淀粉变蓝;
②氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,分析写出离子方程式;
(4)提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在设计实验验证.(1)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X为Cl2和三氯化铬(CrCl3),依据原子守恒写出的化学方程式为:K2Cr2O7+14HCl
△
.
2CrCl3+3Cl2↑+2KCl+7H2O;
故答案为:K2Cr2O7+14HCl
△
.
2CrCl3+3Cl2↑+2KCl+7H2O;
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体,d装置利用浓硫酸除去水蒸气;
故答案为:除去氯气中的氯化氢气体;
(3)①生成的氯气通过淀粉碘化钾溶液发生反应,Cl2+2I-=I2+2Cl-,碘单质遇淀粉变蓝色;
故答案为:变蓝色;
②C装置中发生的氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,反应的离子方程式为:Cl2+HCO3-=Cl-+HClO+CO2↑;
故答案为:Cl2+HCO3-=Cl-+HClO+CO2↑;
(4)为了提高浓盐酸的利用率可以采取的措施是提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
故答案为:小火加热,并多次少量地向烧瓶中加入浓盐酸;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在,实验步骤是,应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;
故答案为:应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;点评:
本题考点: 氯气的实验室制法.
考点点评: 本题考查了实验室制备氯气原理的分析应用,氯气性质的分析判断,实验过程特征的理解应用,离子检验的实验方法,题目难度中等.1年前查看全部
- 三氯化铬与硫化钠反应生成物是什么
 quezhicheng1年前1
quezhicheng1年前1 -
 yingjiliu0314 共回答了15个问题
yingjiliu0314 共回答了15个问题 |采纳率86.7%双水解.
2CrCl3 + 3Na2S + 3H2O = 2Cr(OH)3(沉淀) + 3H2S(气体) + 6NaCl1年前查看全部
- 二乙胺和无水三氯化铬反应时加入锌的作用是什么,急用,
 乐天梦乐巧克力1年前2
乐天梦乐巧克力1年前2 -
 气空透透来出 共回答了17个问题
气空透透来出 共回答了17个问题 |采纳率88.2%催化作用
= =1年前查看全部
- 三价铬跟三氯化铬是一个么
 梅里冰川1年前1
梅里冰川1年前1 -
 得民心 共回答了17个问题
得民心 共回答了17个问题 |采纳率88.2%三氯化铬中的铬是三价铬,硫酸铬中的铬也是三价铬.1年前查看全部
大家在问
- 1雨,晶莹的雨,沙沙的下个不停,又细又密,仿佛蚕儿在食桑叶,仿佛蚕儿在吐银丝.这句话用了修辞手法吗?如果用了,用了什么修辞
- 2下列是细胞的部分结构放大图,请根据图回答下列问题.([]中填序号, 上填
- 3滑轮组考虑动滑轮重时,绳自由端的拉力会F怎样呢
- 4已知集合A={x|x²-2x-a²-2a
- 5下列用电器中,利用电流热效应工作的是( ) A.电脑 B.电热水壶 C.洗衣机 D.电风扇
- 6X-5X-(10X+1)=1怎么解?
- 7仓颉如何造把字的
- 8已知方程组【ax-by=4,ax+by=2】的解为[x=2,y=1]则2a-3b的值为
- 9公从之中从和之分别是什么意思?最好是《古汉语常用字字典》中的意思
- 10英语翻译The evening arrived; the boys took their places.The mast
- 114.5除以1.8怎么简算
- 12求函数周期不是用公式2π/w吗,那y=3cosx和y=sin2x的周期怎么求,
- 13“I will catch up with you later.”什么意思?
- 14(2008•资阳)某实验小组的同学用质量分数为98%的浓硫酸,配制200g、质量分数为10%的稀硫酸,下列有关配制的说法
- 15修改病句:上课时,她始终专心听讲,因此成绩很好.
