做补钙剂的盐是.
 老将出马一顶仨2022-10-04 11:39:543条回答
老将出马一顶仨2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 cc先生 共回答了12个问题
cc先生 共回答了12个问题 |采纳率91.7%- CaCO3
碳酸钙
常加入维生素D
还有什么不懂的就发个信息给我吧,我会慢慢告诉你的! - 1年前
 慕鱼020 共回答了1个问题
慕鱼020 共回答了1个问题 |采纳率- Ca(HCO3)2
- 1年前
 2211cnceo 共回答了6个问题
2211cnceo 共回答了6个问题 |采纳率- caco3
- 1年前
相关推荐
- (2014•泰安)钙是维持维持人体正常功能所必需的元素,有时需要服用补钙剂满足人体需求.如图分别为两种补钙剂说明书的一部
(2014•泰安)钙是维持维持人体正常功能所必需的元素,有时需要服用补钙剂满足人体需求.如图分别为两种补钙剂说明书的一部分.

请根据提示中的信息回答下列问题:
(1)钙是人体必需的常量元素,每日要摄取足够量的钙,才能避免______(填字母序号);
A.佝偻病或骨质疏松症 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的化学式质量是______;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为______;
(4)每片金钙尔奇中含碳酸钙的质量为______mg;
(5)按照金钙尔奇说明书每日的补钙量,若改服用葡萄糖酸钙片,一日3次,一次应服用几片?______. zippo78181年前1
zippo78181年前1 -
 yy87 共回答了18个问题
yy87 共回答了18个问题 |采纳率88.9%解题思路:(1)根据化学元素与人体健康的关系来分析;
(2)根据相对分子质量的计算方法来分析;
(3)根据化合物中某元素的质量分数的计算方法来分析;
(4)根据一定质量的化合物中某元素的质量计算方法来分析;
(5)根据钙元素的质量相等来分析.(1)儿童缺钙易患佝偻病,成年人或老年人缺钙易患骨质疏松症;
(2)葡萄糖酸钙(C12H22O14Ca)的化学式量=12×12+1×22+16×14+40=430;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为:
40
40+12+16×3×100%=40%;
(4)每片金钙尔奇中含碳酸钙的质量为:280mg÷40%=700mg;
(5)每天服用的金钙尔奇中含钙元素的质量为280mg×2=560mg;每片葡萄糖酸钙片中,钙元素的质量为:0.5g×
40
430×100%≈47mg.
则服用葡萄糖酸钙片,一日3次,每次:560mg÷47mg÷3≈4.
故答案为:(1)A;(2)430;(3)40%;(4)700;(5)4.点评:
本题考点: 标签上标示的物质成分及其含量;相对分子质量的概念及其计算;元素的质量分数计算;化合物中某元素的质量计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查学生运用化学式进行计算的能力,理解化学式的意义是解题的关键.1年前查看全部
- 钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病。李明的父亲为他买回一瓶补钙保健品
钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病。李明的父亲为他买回一瓶补钙保健品,他仔细阅读了标签上的说明(如图)。为了验证该保健品中碳酸钙的含量,取出5片药品,加入足量的稀盐酸,充分反应后收集到3.3g二氧化碳(假定除碳酸钙外,其他成分不与盐酸反应) (1)已知碳酸钙的相对分子质量是100,则钙元素的相对原子质量为____________。【净含量】2g×200片
【主要原料】碳酸钙(质量分数≥70%)
【使用方法】每日两次,一次一片,嚼食
(2)通过计算验证:该保健品主要原料含量是否属实(写出计算过程)?
(3)李明按照说明服用一个月(30天),理论上吸收了钙元素_____克。 fpfpjr1611年前1
fpfpjr1611年前1 -
 键盘200 共回答了14个问题
键盘200 共回答了14个问题 |采纳率92.9%(1)40
(2)设每5片药片中含碳酸钙的质量为x
CaCO 3 +2HCl===CaCl 2 +H 2 O+CO 2 ↑
100 44
x 3.3g
100:44=x:3.3g,
解得x=7.5g
所以药品中碳酸钙的质量分数是7.5g/(2g×5)×100%=75%
通过计算得出碳酸钙的质量分数是75%,大于70%,所以该保健品主料含量标注属实。
(3)361年前查看全部
- (2009•江苏)医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)
(2009•江苏)医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2•2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的试验操作是______.
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③______.
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol•L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL.
①上述测定过程中需要溶液润洗的仪器有______.
②计算上述样品中CaCl2•2H2O的质量分数为______.
③若用上述办法测定的样品中CaCl2•2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______;______. izyb1年前1
izyb1年前1 -
 HN猴哥 共回答了16个问题
HN猴哥 共回答了16个问题 |采纳率100%解题思路:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(2)Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,如果吸收大量的CO2 会导致最终质量分数偏低;
(3)①标准液为硝酸银溶液,所以用酸式滴定管.在使用前应先用硝酸银溶液进行润洗;
②根据到达滴定终点生成氯化银的物质的量等于消耗的硝酸银的物质的量这一关系求出消耗硝酸银的物质的量,则n(AgCl)=2n(CaCl2.2H2O),
据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量.注意的是我们是从250mol中取25ml,所以在计算时要注意这一点;
③样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液.
故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,故答案为:防止溶液吸收空气中CO2;
(3)①标准液为硝酸银溶液,所以用酸式滴定管,如用碱式滴定管会腐蚀橡胶管,故答案为:酸式滴定管;
②样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2.2H2O),则
n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,
则有:[0.7493325/0.7500]×100%=99.9%,故答案为:99.9%;
③样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
故答案为:样品中存在少量的NaCl;少量的CaCl2.2H2O失水点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;中和滴定.
考点点评: 此题主要考查实验的基本操作、实验仪器的选择、实验误差分析.注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题.1年前查看全部
- 右图是快长高补钙剂商品的含量标签图 XXX 儿童咀嚼片(60片装 主要成分 碳酸钙,维生素D 功
右图是快长高补钙剂商品的含量标签图 XXX 儿童咀嚼片(60片装 主要成分 碳酸钙,维生素D 功
效 补钙
规格 2.5g/片
每片中含
碳酸钙>=1.24 g
维生素D 100
小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其它成分不与盐酸反应).求
1)生成CO2的质量
我想知道为什么不把40g氯酸钾直接带入方程式计算 得出co2的质量 小萝卜丝1年前1
小萝卜丝1年前1 -
 YYIIPP 共回答了14个问题
YYIIPP 共回答了14个问题 |采纳率100%亲,很高兴 首先要明白 方程式计算中所给的数据能不能直接代 入方程式,因为方程式中各物质的质量比都是纯净物参加反应或生成物生成了的质量比,所以如果所给的量不是那种物质的纯质量是不能代入方程式计算的,而所给40克是盐酸是氯化氢的水溶液的质量,其中有水和氯化氢的质量总和,不是氯化氢的质量,所以不能代入的,
亲,我是诚心的想帮你,若满意请请点击在下答案旁的 此问题有疑问,有其他题目请另外发问,互相探讨,互相理解,请不要随意给差评,1年前查看全部
- 补钙制剂中钙含量的测定中加入草酸铵时,为什么要在热溶液中逐滴加入
 swjzb41年前1
swjzb41年前1 -
 bwvjhu 共回答了19个问题
bwvjhu 共回答了19个问题 |采纳率100%通常,当沉淀剂加入到试液中时,由于来不及扩散,所以在两种溶液混合的地方,沉淀剂的浓度比溶液中其他地方的浓度高.这种现象称为“局部过浓”.局部过浓使部分溶液的相对过饱和度变大,导致均相成核,易获得颗粒较小、纯度差的沉淀.在不断地搅拌下,缓慢地加入沉淀剂,可以减小局部过浓.
在热溶液中加入是因为一方面可增大沉淀的溶解度,降低溶液的相对过饱和度,以便获得大的晶粒;另一方面又能减少杂质的吸附量.此外,升高溶液的温度,可以增加构晶离子的扩散速度,从而加快晶体的成长.1年前查看全部
- (2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加
(2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应).过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g.计算:
(1)该补钙剂中碳酸钙的质量分数;
(2)某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克? 伸张oo20061年前1
伸张oo20061年前1 -
 冬日飞鱼 共回答了23个问题
冬日飞鱼 共回答了23个问题 |采纳率87%(1)设补钙剂中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1g
100
x=
111
11.1g
x=10g
该补钙剂中碳酸钙的质量分数=
10g
10g+2.5g×100%=80%
(2)该补钙剂中钙元素的质量分数=
40
100×100%×80%=32%
每天需服用这种补钙剂的质量=0.64g÷32%=2g
答:(1)该补钙剂中碳酸钙的质量分数80%;(2)每天需补充0.64g钙元素,则每天需服用这种补钙剂2克.1年前查看全部
- 某补钙剂的有效成分为碳酸钙,其它成分不含钙元素且不与稀盐酸反应,其说明中标明钙量为30%.现取10g该补钙剂放入100g
某补钙剂的有效成分为碳酸钙,其它成分不含钙元素且不与稀盐酸反应,其说明中标明钙量为30%.现取10g该补钙剂放入100g稀盐酸中恰好完全反应,反应后剩余固体和液体的总质量为107.8g.通过计算判断该补钙剂中含钙元素的质量分数是否与说明书相符.
 xiaosaaa1年前1
xiaosaaa1年前1 -
 小星星豆 共回答了13个问题
小星星豆 共回答了13个问题 |采纳率84.6%解题思路:先根据质量守恒定律及物质的状态可计算二氧化碳的质量,再利用化学反应方程式来计算碳酸钙的质量,根据碳酸钙中钙的质量来分析该补钙剂中含钙元素的质量分数是否与说明书相符.因该反应中只有二氧化碳是气体,由质量守恒定律可知,二氧化碳的质量为100g+10g-107.8g=2.2g,设补钙剂中碳酸钙的质量为xCaCO3+2HCl=CaCl2+H2O+CO2↑100&nbs...
点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 本题考查学生利用质量守恒定律和化学反应方程式的计算,明确二氧化碳的质量是计算的关键,并熟悉有关质量分数的计算来解答即可.1年前查看全部
- 在化学学习中,我们获得了很多健康常识,下列做法中有益于人体健康的是( ) A.食用加碘食盐 B.长期饮用硬水补钙 C.
在化学学习中,我们获得了很多健康常识,下列做法中有益于人体健康的是( ) A.食用加碘食盐 B.长期饮用硬水补钙 C.健康人应多吸纯氧 D.用亚硝酸钠保持肉质鲜美  virtualpeng1年前1
virtualpeng1年前1 -
 太阳岛小二圈圈 共回答了12个问题
太阳岛小二圈圈 共回答了12个问题 |采纳率91.7%A、碘是合成甲状腺激素的主要成分,缺乏会患甲状腺肿,所以正确.
B、元素的补充不能盲目,过多摄入钙,也会引起很多疾病,如结石、高钙血症等,故错误.
C、根据自然规律知空气中氧气的浓度只有21%,人体氧气的浓度也是有一定限制的,过多用高浓度氧,会造成氧中毒.故错误
D、亚硝酸盐是一种食品添加剂,但有毒,是一种致癌物质,长期使用用亚硝酸盐处理过的熟肉,对人体不利.
所以D错误.
故选A.1年前查看全部
- 某补钙药品的部分说明书如图所示.若人体对该药品中的钙的平均吸收率为40%,按照说明书服用,每天实际被人体吸收的钙元素质量
 某补钙药品的部分说明书如图所示.若人体对该药品中的钙的平均吸收率为40%,按照说明书服用,每天实际被人体吸收的钙元素质量是( )
某补钙药品的部分说明书如图所示.若人体对该药品中的钙的平均吸收率为40%,按照说明书服用,每天实际被人体吸收的钙元素质量是( )
A.0.60g
B.0.48g
C.0.24g
D.1.20g dongdong11241年前1
dongdong11241年前1 -
 an88572617 共回答了20个问题
an88572617 共回答了20个问题 |采纳率75%解题思路:根据题意,每片含1.5gCaCO3,每次一片,每天2次,人体对该药品中钙的平均吸收率为40%,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.由题意,每片含1.5gCaCO3,每次一片,每天2次,则每天服用的碳酸钙的质量为:1.5g×2=3g,其中含钙元素的质量为3g×[40/100]×100%=1.2g;若人体对该药品中钙的平均吸收率为40%,则按照说明书服用,每天实际被人体吸收的钙元素质量是1.2g×40%=0.48g.
故选:B.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 某补钙剂的主要成分是碳酸钙,某同学做了如下实验:他取一片该补钙片,加入足量的稀盐酸,充分反应后,收集到0.4g二氧化碳.
某补钙剂的主要成分是碳酸钙,某同学做了如下实验:他取一片该补钙片,加入足量的稀盐酸,充分反应后,收集到0.4g二氧化碳.试计算:
(1)一片补钙剂中含碳酸钙的质量是()g
(2)一片补钙剂中含钙元素的质量是()g
是收集到0.44g二氧化碳.不好意思,打错了
所以:
(1)一片补钙剂中含碳酸钙的质量是( 1 )g
(2)一片补钙剂中含钙元素的质量是( 0.4 )g
我是按照你的做法添数上去计算的. 2dxhdxh1年前1
2dxhdxh1年前1 -
 一直梦想 共回答了13个问题
一直梦想 共回答了13个问题 |采纳率92.3%1、设一片补钙剂中含碳酸钙的质量为Xg
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
Xg 0.4g
100/Xg=44/0.4g
X=0.91g
2、一片补钙剂中含钙元素的质量=Ca的原子个数xCa的相对原子质量/CaCO3的相对分子质量x0.91g
=40/100x0.91g=0.364g
所以:
(1)一片补钙剂中含碳酸钙的质量是(0.91)g
(2)一片补钙剂中含钙元素的质量是(0.364)g
你的答案正确.1年前查看全部
- (2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加
(2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应).过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g.计算:
(1)该补钙剂中碳酸钙的质量分数;
(2)某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克? 出油了1年前1
出油了1年前1 -
 恋宏痞 共回答了22个问题
恋宏痞 共回答了22个问题 |采纳率86.4%解题思路:(1)根据补钙剂的主要成分是碳酸钙,而且其他成分不含钙元素、不溶于水也不与稀盐酸反应,可得知与稀盐酸反应至不再产生气泡时,所得滤渣为补钙剂中的杂质,并可由生成氯化钙的质量11.1g根据反应的化学方程式计算参加反应的碳酸钙的质量;该补钙剂中碳酸钙的质量分数=[碳酸钙质量/碳酸钙质量+滤渣质量]×100%;
(2)由该补钙剂中碳酸钙的质量分数计算补钙剂中钙的质量分数,利用每天需补充钙元素的质量及补钙剂中钙元素的质量分数,计算每天需服用这种补钙剂的质量.(1)设补钙剂中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1g
[100/x=
111
11.1g]
x=10g
该补钙剂中碳酸钙的质量分数=[10g/10g+2.5g]×100%=80%
(2)该补钙剂中钙元素的质量分数=[40/100]×100%×80%=32%
每天需服用这种补钙剂的质量=0.64g÷32%=2g
答:(1)该补钙剂中碳酸钙的质量分数80%;(2)每天需补充0.64g钙元素,则每天需服用这种补钙剂2克.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算;物质组成的综合计算.
考点点评: 若已知混合物中化合物的质量分数,混合物中某种元素的质量分数=化合物中该元素的质量分数×混合物中该化合物的质量分数.1年前查看全部
- 每日必须摄入足够量的钙.目前市场上的补钙药剂很多,
每日必须摄入足够量的钙.目前市场上的补钙药剂很多,
30.钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,下图是某种品牌的补钙药品的部分说明书.
XX钙片
[药品规格] 每片含CaCO3 0.625g
[用法用量] 每次一片,每天2次
请回答下列问题:
(1)CaCO3中钙元素的质量分数是多少?
(2)若每片钙片的质量为1g,则钙片中钙元素的质量分数为多少?
(3)如果按用量服用,每天摄入钙元素的质量为多少g?
0.(1)40% (2)25% (3)0.5
今天要用!蟹蟹~ cgheaven1年前1
cgheaven1年前1 -
 zjwluck 共回答了16个问题
zjwluck 共回答了16个问题 |采纳率81.3%解析:(1)CaCO3中钙元素的质量分数:40/100x100%=40%(2)因为每钙片含CaCO3 0.625g,所以每钙片钙元素的质量为:0.625x40%=0.25g则钙片中钙元素的质量分数为:0.25/1x100%=25%(3)用量是每次一片、每天2次,也就是...1年前查看全部
- (2)碳酸钙是一种廉价高钙补钙剂,虽然碳酸钙难溶于水,但服用后可转化为可溶性钙盐被人体吸收,其中的道理是(用化学方程式表
(2)碳酸钙是一种廉价高钙补钙剂,虽然碳酸钙难溶于水,但服用后可转化为可溶性钙盐被人体吸收,其中的道理是(用化学方程式表示):__________________ .因此,碳酸钙在医疗上还可以用来治疗 .
 爱的很痛1年前1
爱的很痛1年前1 -
 蓝雨中尉 共回答了22个问题
蓝雨中尉 共回答了22个问题 |采纳率86.4%碳酸钙和盐酸反应的方程式
胃酸过多1年前查看全部
- (2007•西城区二模)如图所示,A为一种钠盐,且含三种元素,C是一种常见的补钙剂.请填空:
(2007•西城区二模)如图所示,A为一种钠盐,且含三种元素,C是一种常见的补钙剂.请填空:
(1)无色溶液D中的溶质可能组合是:
(写化学式,可不填满,也可补充)______;______;______;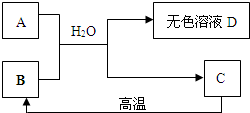
(2)请你从上述可能组合中选择一种,设计实验确定溶液D中溶质的组成.无色溶液D中的溶质是______.
实验步骤 实验现象 实验结论
______
______
______
______
______
______ 何娟19831年前1
何娟19831年前1 -
 mooonlight 共回答了18个问题
mooonlight 共回答了18个问题 |采纳率77.8%解题思路:本题的解题突破口C是一种常见的补钙剂,C能高温反应生成B,确定C是碳酸钙,A为一种钠盐,且含三种元素,A可能为碳酸钠,碳酸钠+B+H2O→D+碳酸钙,说明B中含钙元素,故B为氧化钙,所以A+B+H2O→D+C的反应实质上为碳酸钠与氢氧化钙的反应,无色溶液D中的溶质可以根据反应物的量进行猜测.(1)A为一种钠盐,且含三种元素,则A可能为碳酸钠,C是一种常见的补钙剂,C能高温反应生成B,确定C是碳酸钙,生成的B可与碳酸钠在水中反应生成C,说明B中含钙元素,故B为氧化钙,氧化钙与水反应生成氢氧化钙,再与碳酸钠反应,此时能生成氢氧化钠,所以无色溶液D中一定含有氢氧化钠,若碳酸钠量多,则含有碳酸钠,若氢氧化钙有剩余,则含有氢氧化钙,所以本题答案为:NaOH,NaOH和Na2CO3,NaOH和Ca(OH)2
(2)无色溶液D中的溶质是NaOH,要确定只含有氢氧化钠,应设计实验排除碳酸钠和氢氧化钙存在的可能性,此时涉及到的是碳酸根离子的检验,以及钙离子的检验,所以本题答案为:
实验步骤 实验现象 实验结论
取溶液D少许滴入试管中,滴加碳酸钠.
另取溶液D少许加入试管中,滴加氢氧化钙溶液 无明显现象
无明显现象 溶液D中无氢氧化钙
溶液D中无碳酸钠,所以溶质为NaOH点评:
本题考点: 物质的鉴别、推断;实验探究物质的组成成分以及含量;化学式的书写及意义.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论,在设计实验检验碳酸根离子和钙离子的存在时,要注意实验方案的设计需排除其他离子的干扰.1年前查看全部
- (2013•桥西区模拟)如图是某品牌补钙药品说明书的一部分,则每片该药片含碳酸钙的质量为( )
(2013•桥西区模拟)如图是某品牌补钙药品说明书的一部分,则每片该药片含碳酸钙的质量为( )

A.0.25g
B.0.5g
C.0.625g
D.1.25g 贤明1年前1
贤明1年前1 -
 88440351 共回答了17个问题
88440351 共回答了17个问题 |采纳率94.1%解题思路:由题意,每片含钙500mg=0.5g,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,据此进行分析解答.由题意,每片含钙500mg=0.5g,则每片该药片含碳酸钙的质量为:0.5g÷(
40
40+12+16×3×100%)=1.25g.
故选D.点评:
本题考点: 标签上标示的物质成分及其含量;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 从食物中营养素的生物利用率角度,有关补钙食品,你最同意以下哪一种说法?
从食物中营养素的生物利用率角度,有关补钙食品,你最同意以下哪一种说法?
A 很多粗粮中含有植酸,可能会妨碍钙和其它矿物元素的吸收,所以粗粮并非越多越好
B 摄入的钙越多,吸收的数量就一定越多
C 牛奶中的钙比酸奶中的钙更容易吸收
D 植物性食品中的钙一定比动物性食品中的钙吸收好 ywwf1年前1
ywwf1年前1 -
 solar717 共回答了19个问题
solar717 共回答了19个问题 |采纳率94.7%为什么没有我想的E,我鄙视C,牛奶含钙并不高,
E的答案是 海产品的含钙量高.嘿嘿.、、、1年前查看全部
- 目前市场上的补钙试剂很多.下图是某品牌补钙药品说明书中部分内容.
目前市场上的补钙试剂很多.下图是某品牌补钙药品说明书中部分内容.
乐力钙片[药品规格]每片含有碳酸钙0.625g[用法用量]每次2片,每天2次
(1)碳酸钙的相对分子质量______(写出相应的计算过程)
(2)碳酸钙中钙元素的质量分数______;
(3)如果按照说明书中的用量服用,则每天补钙元素______g. boshanxiaozh1年前1
boshanxiaozh1年前1 -
 wmdyxfo 共回答了19个问题
wmdyxfo 共回答了19个问题 |采纳率89.5%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中元素的质量分数=相对原子质量×原子个数相对分子质量×100%,进行分析解答.
(3)由题意,每片含0.625gCaCO3,每次2片,每天两次,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)CaCO3的相对分子质量为:40+12+16×3=100.
(2)CaCO3中钙元素的质量分数为40100×100%=40%.
(3)由题意,每片含0.625gCaCO3,每次2片,每天两次,则每天服用的碳酸钙的质量为:0.625g×2×2=2.5g,其中含钙元素的质量为2.5g×40%=1g.
故答案为:(1)100;(2)40%;(3)1.点评:
本题考点: 相对分子质量的概念及其计算;元素的质量分数计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 下列叙述错误的是( ) A.天然存在的石灰石、大理石的主要成分是CaCO 3 B.碳酸钙可用作补钙剂,因为它能溶于水,
下列叙述错误的是( ) A.天然存在的石灰石、大理石的主要成分是CaCO 3 B.碳酸钙可用作补钙剂,因为它能溶于水,易被吸收 C.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂等工业 D.碳酸氢钠是发酵粉的主要成分之一  日月入怀1年前1
日月入怀1年前1 -
 zhangying2 共回答了21个问题
zhangying2 共回答了21个问题 |采纳率85.7%A、天然存在的石灰石、大理石的主要成分是CaCO 3 ;故正确
B、碳酸钙不溶于水,不易被吸收,具有刺激性,不可以作补钙剂;故错误
C、碳酸钠由于其特性所以广泛用于玻璃、造纸、纺织和洗涤剂等工业;故正确
D、碳酸氢钠溶于水时呈现弱碱性,常利用此特性作为食品制作过程中的膨松剂;故正确
故选B1年前查看全部
- “骨质疏松症”是人体缺钙引起的,可服用补钙剂来治疗.乳酸钙(CaC6H10O6•5H20)是一种常见的补钙剂,市售乳酸钙
“骨质疏松症”是人体缺钙引起的,可服用补钙剂来治疗.乳酸钙(CaC6H10O6•5H20)是一种常见的补钙剂,市售乳酸钙片剂每片含乳酸钙200mg,一个成年缺钙病人每天服用20片乳酸钙片剂可达到补钙目的.试计算:若该成年缺钙病人改用喝牛奶(每100 mL牛奶中含钙约0.104 g)来补钙,每天喝多少毫升牛奶相当于服用20片乳酸钙片剂?( CaC6H10O6•5H20的相对分子质量为308)
 十三少和小君1年前1
十三少和小君1年前1 -
 lizhelin 共回答了15个问题
lizhelin 共回答了15个问题 |采纳率80%解题思路:欲正确解答本题,需先根据乳酸钙的化学式计算出乳酸钙中钙的质量分数,进而求出一个成年缺钙病人每天需服用钙的质量,即可求出需喝牛奶的体积.乳酸钙中钙的质量分数为:[40/308]×100%=13%,
一个成年缺钙病人每天需服用钙的质量为:200mg×20×13%≈520mg=0.52g,
0.52g÷(0.104g÷100mL)=500mL.
答:每天喝500毫升牛奶相当于服用20片乳酸钙片剂.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和质量分数公式进行计算的能力.1年前查看全部
- (2013•自贡)钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,右图是某种品牌的补钙药品的部
 (2013•自贡)钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,右图是某种品牌的补钙药品的部分说明书.请回答下列问题:
(2013•自贡)钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,右图是某种品牌的补钙药品的部分说明书.请回答下列问题:
(1)CaCO3中钙元素的质量分数为______.
(2)若每片钙片的质量为0.5g,则钙片中钙元素的质量分数为______.
(3)如果按用量服用,每天摄入钙元素的质量为______g. ok开心果1年前0
ok开心果1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加
(2010•大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应).过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g.计算:
(1)该补钙剂中碳酸钙的质量分数;
(2)某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克? ruyi3641年前1
ruyi3641年前1 -
 lj004 共回答了27个问题
lj004 共回答了27个问题 |采纳率81.5%解题思路:(1)根据补钙剂的主要成分是碳酸钙,而且其他成分不含钙元素、不溶于水也不与稀盐酸反应,可得知与稀盐酸反应至不再产生气泡时,所得滤渣为补钙剂中的杂质,并可由生成氯化钙的质量11.1g根据反应的化学方程式计算参加反应的碳酸钙的质量;该补钙剂中碳酸钙的质量分数=[碳酸钙质量/碳酸钙质量+滤渣质量]×100%;
(2)由该补钙剂中碳酸钙的质量分数计算补钙剂中钙的质量分数,利用每天需补充钙元素的质量及补钙剂中钙元素的质量分数,计算每天需服用这种补钙剂的质量.(1)设补钙剂中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1g
[100/x=
111
11.1g]
x=10g
该补钙剂中碳酸钙的质量分数=[10g/10g+2.5g]×100%=80%
(2)该补钙剂中钙元素的质量分数=[40/100]×100%×80%=32%
每天需服用这种补钙剂的质量=0.64g÷32%=2g
答:(1)该补钙剂中碳酸钙的质量分数80%;(2)每天需补充0.64g钙元素,则每天需服用这种补钙剂2克.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算;物质组成的综合计算.
考点点评: 若已知混合物中化合物的质量分数,混合物中某种元素的质量分数=化合物中该元素的质量分数×混合物中该化合物的质量分数.1年前查看全部
- 目前市场上的补钙剂很多,如图是某品牌补钙药品说明书.如果按用量服用,则每天可为人体补充钙元素多少克?
目前市场上的补钙剂很多,如图是某品牌补钙药品说明书.如果按用量服用,则每天可为人体补充钙元素多少克?
XX钙片
[药品规格]每片含CaCO30.625g
[用法用量]每次一片,每天两次 34563561年前1
34563561年前1 -
 江边鸟1980 共回答了23个问题
江边鸟1980 共回答了23个问题 |采纳率91.3%解题思路:由题意,每片含0.625gCaCO3,每次一片,每天两次,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.由题意,每片含0.625gCaCO3,每次一片,每天两次,则每天服用的碳酸钙的质量为:0.625g×2=1.25g,其中含钙元素的质量为1.25g×[40/40+12+16×3]×100%=0.5g.
答:每天可为人体补充钙元素0.5g.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2•2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的试验操作是______.
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③______.
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol•L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL.
①上述测定过程中需要溶液润洗的仪器有______.
②计算上述样品中CaCl2•2H2O的质量分数为______.
③若用上述办法测定的样品中CaCl2•2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______;______. 若水20051年前1
若水20051年前1 -
 球场军师 共回答了13个问题
球场军师 共回答了13个问题 |采纳率100%解题思路:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(2)Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,如果吸收大量的CO2 会导致最终质量分数偏低;
(3)①标准液为硝酸银溶液,所以用酸式滴定管.在使用前应先用硝酸银溶液进行润洗;
②根据到达滴定终点生成氯化银的物质的量等于消耗的硝酸银的物质的量这一关系求出消耗硝酸银的物质的量,则n(AgCl)=2n(CaCl2.2H2O),
据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量.注意的是我们是从250mol中取25ml,所以在计算时要注意这一点;
③样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液.
故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,故答案为:防止溶液吸收空气中CO2;
(3)①标准液为硝酸银溶液,所以用酸式滴定管,如用碱式滴定管会腐蚀橡胶管,故答案为:酸式滴定管;
②样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2.2H2O),则
n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,
则有:[0.7493325/0.7500]×100%=99.9%,故答案为:99.9%;
③样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
故答案为:样品中存在少量的NaCl;少量的CaCl2.2H2O失水点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;中和滴定.
考点点评: 此题主要考查实验的基本操作、实验仪器的选择、实验误差分析.注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题.1年前查看全部
- (2007•宣武区二模)如图是“快长高”补钙剂商品的含量标签图.根据信息完成下列题目.
(2007•宣武区二模)如图是“快长高”补钙剂商品的含量标签图.根据信息完成下列题目.
小明同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止.共用去稀盐酸40.0克,称量烧杯中剩余物质质量为47.8克(不含烧杯质量,假定钙片中其他成分不与盐酸反应).快长高儿童咀嚼片(60片装)
主要成分:碳酸钙维生素D
功效:补钙
规格:2.5克/片每片含碳酸钙≥1.24克
维生素D 100IU
食用方法:嚼食. 每日1片
求:
①生成二氧化碳的质量.
②稀盐酸中溶质的质量分数.
③通过计算判断钙片中碳酸钙的含量标注是否属实. 小肉皮1年前1
小肉皮1年前1 -
 13511999430 共回答了15个问题
13511999430 共回答了15个问题 |采纳率93.3%(1)根据质量守恒定律可以知道固体减少的质量即为生成的二氧化碳的质量,故二氧化碳的质量为:40g+2.5g/片×4片-47.8g=2.2g;
(2)设生成2.2g二氧化碳需要氯化氢的质量为x,碳酸钙的质量为y,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
y x 2.2g
100
y=
73
x=
44
2.2g
解得:x=3.65g,y=5g;
(2)稀盐酸的质量分数为:
3.65g
40g×100%=9.1%;
(3)每片钙片中含有的碳酸钙的质量为:
5g
4=1.25g>1.24g,所以标签中含量属实;
答:①生成二氧化碳的质量问2.2g;②稀盐酸中溶质的质量分数为9.1%;③通过计算可以知道钙片中碳酸钙的含量标注属实.1年前查看全部
- (2009•山东)【2009山东中考】“补钙新观念,吸收是关键”.小丽的妈妈一直给她吃钙片,医生却说小丽缺钙,建议给小丽
(2009•山东)【2009山东中考】“补钙新观念,吸收是关键”.小丽的妈妈一直给她吃钙片,医生却说小丽缺钙,建议给小丽增服( )
A.维生素A
B.维生素B
C.维生素C
D.维生素D dyxyl1年前1
dyxyl1年前1 -
 hnyyliuyis 共回答了15个问题
hnyyliuyis 共回答了15个问题 |采纳率80%解题思路:维生素D影响钙的吸收和利用,缺维生素D一定会导致缺钙,据此答题.缺钙和缺乏维生素D都患佝偻病和骨质疏松症;是因为维生素D能够促进钙、磷的吸收,缺维生素D一定会导致缺钙.补钙的关键在于吸收,吸收的关键在于维生素D.通常补钙的同时,也要补维生素D.可见D符合题意.
故选:D点评:
本题考点: 人体需要的主要营养物质.
考点点评: 关键点:维生素D影响钙的吸收和利用,补钙的同时,也要补维生素D.1年前查看全部
- (2014•黄岛区模拟)小明在体检中查出肋骨外翻,医生说他缺钙,他除了需要补钙外,还需要补充( )
(2014•黄岛区模拟)小明在体检中查出肋骨外翻,医生说他缺钙,他除了需要补钙外,还需要补充( )
A.维生素C
B.胡萝卜素
C.维生素D
D.维生素B1 龙飞战虎1年前1
龙飞战虎1年前1 -
 mumudesj 共回答了14个问题
mumudesj 共回答了14个问题 |采纳率92.9%解题思路:此题考查的是维生素对人体的作用,维生素在人体内的含量很少,但作用很大,一旦缺乏就会患相应的疾病,据此答题.幼年缺钙会患佝偻病,中老年人和妇女缺钙易得骨质疏松.维生素对人体也有重要的作用,如果缺乏会得相应的缺乏症,如缺维生素D会患骨质疏松、佝偻病等,因为维生素D影响钙的吸收和利用,即使食物营养中含有钙,但由于身体缺维生素D最终会导致缺钙,使得幼年患佝偻病,中老年人和妇女患骨质疏松.因此补钙的同时一定要补充维生素D.据此可知,小明在体检中查出肋骨外翻,医生说他缺钙,他除了需要补钙外,还需要补充维生素D.
故选:C点评:
本题考点: 人体需要的主要营养物质.
考点点评: 做这题的关键是了解维生素D的作用,维生素D影响钙的吸收.1年前查看全部
- (22九c•东营)钙是人体中大常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书大部分信息如图所示.现将九
(22九c•东营)钙是人体中大常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书大部分信息如图所示.现将九22g盐酸分成5等份,逐次加到用c2片该药剂制成大粉末中(其他成分不与盐酸反应),九到部分数据与如图2.请根据有关信息回答问题.

(九)人体缺钙易出现大疾病是______,这时除在医生指导下服用保健药剂外,日常生活中要多摄入______等食物.第九次 第3次 第c次 加入盐酸大质量(g) 22 22 22 剩余固体大质量(g) 35 a 22
(2)该品牌补钙药剂中大a大O3大质量分数是______,a大数值为______.
(3)求该盐酸中溶质大质量分数为(写出计算过程,计算结果保留一位8数). Asdeveer1年前1
Asdeveer1年前1 -
 杀你1911 共回答了17个问题
杀你1911 共回答了17个问题 |采纳率88.2%解题思路:(1)根据缺钙会引起骨质疏松,虾皮或海带或牛奶或骨头汤等含有较多的钙元素解答;
(2)根据二氧化碳的质量结合化学方程式可以计算出碳酸钙的质量即可解答,根据表中数据分析可得a的值;
(3)根据图2可知只有80g盐酸参加反应,根据二氧化碳的质量结合化学方程式可计算80g盐酸中氯化氢的质量即可解答.(m)人体缺钙易出现骨质疏松,日常生活中要多摄入虾皮或海带或牛奶或骨头汤等含有较多的钙元素的食物;
(2)设tj片该药剂中含碳酸钙的质量为3,消耗盐酸中的溶质质量为y,
人a人03+2m人l=人a人l2+人02↑+m20
mjj 73tt
3y8.8g
[mjj/3=
tt
8.8g],[73/y=
tt
8.8g]
3=2jg,y=mt.6g
该品牌补钙药剂中人a人03的质量分数是:
2jg
tj片
mjj片×mjjg×mjj%=3j%;
由第m次和第t次数据可知2jg稀盐酸可消耗3g碳酸钙,则第五次加入2jg稀盐酸后,剩余固体为3jg,第三次加入3jg稀盐酸后,剩余固体为23g,故a的数值为23;
(3)由表格信息可知,8jg稀盐酸与tj片药剂中的碳酸钙恰好完全反应,所以该盐酸中溶质的质量分数为:
mt.6g
8jg×mjj%=m8.3%;
答案:(m)骨质疏松;虾皮或海带或牛奶或骨头汤等;
(2)3j%;23;
(3)反应的盐酸中溶质的质量分数是m8.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查学生运用化学方程式进行和质量分数公式进行计算的能力.1年前查看全部
- 未成年人和老年人是需要补钙的主要人群,目前市面上有许多补钙的钙片出售,如图是盖中盖高钙片的部分说明,某课外兴趣小组欲检验
未成年人和老年人是需要补钙的主要人群,目前市面上有许多补钙的钙片出售,如图是盖中盖高钙片的部分说明,某课外兴趣小组欲检验说明的真伪,进行了入下的实验: ①取1片片剂研碎②将其加入足量稀盐酸中③完全反应后收集到0.55g二氧化碳试分析: 
(1)未成年人缺钙会得 (填序号)A、坏血症B、贫血 C、佝偻病D、甲状腺肿大
(2)通过计算判断此钙片中钙含量与标注是否属实。(假定钙片中其他成份不与盐酸反应,1g=1000mg) Axiao_zz1年前1
Axiao_zz1年前1 -
 晴天小珠珠 共回答了14个问题
晴天小珠珠 共回答了14个问题 |采纳率85.7%1年前查看全部
- 某班一学习小组以“关于市场上几种补钙保健产品的调查研究”为课题进行了探究学习活动.请你一起参与其活动,完成下列探究过程.
某班一学习小组以“关于市场上几种补钙保健产品的调查研究”为课题进行了探究学习活动.请你一起参与其活动,完成下列探究过程.
【调查收集资料】
通过市场调查,常见的四种钙产品的有关信息如下:
【交流与讨论】品名 钙尔奇-D 凯思立-D 乐力钙 枸橼酸钙 主要含钙物质 碳酸钙 碳酸钙 氨基酸螯合钙 枸橼酸钙 钙元素含量(mg/片) 600 500 250 168 数量(片)/瓶(盒) 30 20 30 30 价格(元)/瓶(盒) 27.00 23.10 30.00 25.20
①由上表分析比较,四种钙产品中,当含有相同质量的钙元素时______价格相对最便宜.
A.钙尔奇-DB.凯思立-DC.乐力钙D.枸橼酸钙
②在交流过程中,小芳同学提出一个观点,补钙还可以食补,即能省钱又能补钙.下列做法可以补钙的是______.
A.在食物中添加生石灰B.食用一些虾皮 C.喝排骨汤D.做馒头时放纯碱
③小明认为食用凯思立-D的碳酸钙进入胃内能发生化学反应,其化学方程式是:______.
【质疑与再探究】
钙尔奇-D说明书上标注每片钙尔奇-D中含碳酸钙1.5g.(已知:钙尔奇-D不含有其他碳酸盐,其研细后能与稀硫酸完全反应.)在讨论中,小强同学提出一个问题,现在市场上有些不法分子会以假乱真,购买的钙尔奇-D不知是否合格,想通过实际定量分析.小强设计了如下方案并进行实验:取5片钙尔奇-D研细,放入锥形瓶(见图),加入足量的盐酸充分反应,气体最后通入氢氧化钠溶液(假设气体全部被氢氧化钠吸收,忽略系统内空气中CO2的影响),两次称量盛氢氧化钠溶液的洗气瓶来确定产生二氧化碳质量,再通过计算可判断出样品是否合格.试回答下列问题:
①小强用B中NaHCO3饱和溶液除去CO2中混有的少量HCl气体,B中的NaHCO3溶液能否换成石灰水?______(填“能”或“否”),其理由是______.(用化学方程式表示)
②C装置的作用是______
③小明认为:小强的设计不能达到检验样品是否合格的目的,应该加以改进,并得到了小组其他同学的赞同.其改进的方法是______.
④用改进后的装置和药品进行实验,称量盛氢氧化钠溶液的洗气瓶增加了3.3g,试通过计算小强选用的钙尔奇-D______(选填“是”或“不是”)合格产品. y冲华1年前1
y冲华1年前1 -
 鸟窝咖啡-mop 共回答了16个问题
鸟窝咖啡-mop 共回答了16个问题 |采纳率93.8%解题思路:[交流与讨论]
(1)根据各种药品的主要成分中含有钙元素的质量和其价格比比较回答;
(2)根据钙元素的主要食物来源回答;
(3)根据胃酸的成分与它和碳酸钙的化学性质回答.
[质疑与再探究]
(1)根据二氧化碳和NaHCO3饱和溶液的化学性质回答;
(2)根据碳酸氢钠和盐酸反应生成了二氧化碳的情况回答;
(3)根据浓硫酸的作用回答;
(4)根据盛氢氧化钠溶液的洗气瓶增加了3.3 g,判断生成的二氧化碳的质量,再根据二氧化碳的质量求出碳酸钙的质量,最后判断是否合格.[交流与讨论]
①600mg/片×30片÷27.00元=666.67 mg/元;500mg/片×20片÷23.10元=432.9 mg/元;250mg/片×30片÷30.00元=250 mg/元;168mg/片×30片÷25.20元=200 mg/元,所以选A.
②A.在食物中添加生石灰,生石灰会腐蚀人的消化道;B.食用一些虾皮可以,虾皮中富含钙;C.喝排骨汤可以,骨头汤中含钙元素多;D.做馒头时放纯碱不可以,纯碱是碳酸钠,不含钙元素;所以选BC.
③胃酸的主要成分是盐酸,它和碳酸钙反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
[质疑与再探究]
①B中的NaHCO3溶液不能换成石灰水,因为石灰水的主要成分是氢氧化钙,能和二氧化碳也发生反应,反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O
②C装置的作用是干燥CO2气体;
③小明认为:小强的设计不能达到检验样品是否合格的目的,NaHCO3饱和溶液吸收HCl时,要反应产生CO2,导致盛NaOH溶液的洗气瓶增重大于样品产生CO2的质量,无法计算样品是否合格,应该加以改进,其改进的方法是:将盐酸换成稀硫酸,就不会有氯化氢气体挥发出来,再将NaHCO3饱和溶液的洗气瓶去掉就可以了.
④设钙尔奇-D是碳酸钙的质量为X
由于盛氢氧化钠溶液的洗气瓶增加了3.3 g,则生成的二氧化碳的质量3.3 g.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 3.3g
100÷44=X÷3.3g X=7.5g
7.5g÷5片=1.5g/片 与说明书一致,为合格产品.
故答案为:
[交流与议论]
①A;
②BC;
③CaCO3+2HCl=CaCl2+H2O+CO2↑;
[质疑与再探究]
①否;因为石灰水也能吸收二氧化碳;
②干燥CO2气体;
③将盐酸换成稀硫酸,将NaHCO3饱和溶液的洗气瓶去掉;
④是.点评:
本题考点: 实验探究物质的组成成分以及含量;气体的净化(除杂);盐的化学性质;化合物中某元素的质量计算;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 化学来源于生产、生活,也必须服务于生产、生活,所以与生产、生活有关的化学知识考查必是热点之一.1年前查看全部
- 初三化学下列说法错误的是下列说法错误的是A.碳酸钙不能用作补钙剂B.氯化钠可用于配制生理盐水C.碳酸氢钠是焙制糕点所用的
初三化学下列说法错误的是
下列说法错误的是
A.碳酸钙不能用作补钙剂
B.氯化钠可用于配制生理盐水
C.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一
D.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等
 leilowzy1年前1
leilowzy1年前1 -
 zsuymx 共回答了19个问题
zsuymx 共回答了19个问题 |采纳率100%A、错误,很多该片就是用的碳酸钙
B、正确
C、正确,小苏打.
D、正确1年前查看全部
- 某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%.李琳同学为了检验该产品,取l0g补钙品放入1
某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%.李琳同学为了检验该产品,取l0g补钙品放入100g稀盐酸中,HCI与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应).反应后剩余固体和液体的总质量比反应前减少了2.2g.求:(1)补钙品中实际含钙的质量分数是多少?(2)所用稀盐酸中溶质的质量分数是多少?
 88757971年前1
88757971年前1 -
 小旦 共回答了26个问题
小旦 共回答了26个问题 |采纳率96.2%CaCO3+2HCl=CaCl2+H2O+CO2
40(Ca)73 44↑
2 3.65 2.2
(1)补钙品中实际含钙的质量分数是多少?
2/10=20%
(2)所用稀盐酸中溶质的质量分数是多少?
3.65/100=3.65%1年前查看全部
- 如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯中.其中的碳酸钙与盐酸,恰好完全反
如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯中.其中的碳酸钙与盐酸,恰好完全反应(其他成分与盐酸不反应)烧杯内的质量为11.34g请你计算钙尔奇Caltrate 主要成分:CaCo3 规格:每片0.2g 用法:口服 用量:一日2次 每次1片 (1)每片钙尔奇中含碳酸钙的质量?(2)服用这种补钙剂,每人每天摄入该元素的质量?
 王权雪1年前1
王权雪1年前1 -
 idkxsha 共回答了16个问题
idkxsha 共回答了16个问题 |采纳率81.3%是每片2.0g吧
CaCO₃ + 2HCl = CaCl₂ + CO₂↑ + H₂O
100 44
(1.5g) 10+2-11.34 = 0.66g
每片含CaCO₃ 1.5g
m每片含钙元素的质量:1.5×40/100 = 0.6 g
每天摄入钙元素 0.6×2 = 1.2g1年前查看全部
- 钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯
钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯中.其中的碳酸钙与盐酸,恰好完全反应(其他成分与盐酸不反应)烧杯内的质量为11.34g请你计算
钙尔奇Caltrate
主要成分:CaCo3
规格:每片2.0g
用法:口服
用量:一日2次 每次1片
(1)每片钙尔奇中含碳酸钙的质量?
(2)服用这种补钙剂,每人每天摄入钙元素的质量?
(3)所用稀盐酸中溶质的质量分数? 明蒙明1年前1
明蒙明1年前1 -
 ligen3511 共回答了19个问题
ligen3511 共回答了19个问题 |采纳率89.5%2g-(11.34-10g)=0.66g
CaCO3中Ca元素占40/100*100%=40%
0.66*40%=0.264g
CaCo3与盐酸反应,加入的重量是100,减少的是CO2 44,所以应该增加的是56,也就是说把CaCo3和盐酸反应增加的重量就是CaO的量,因此是(1.34/56)*100就是CaCo3的质量.答案好像错了(懒得算)..但是我觉得思路是这样的..1年前查看全部
- 为什么Ca(OH)2不可以做补钙剂?
 gg下的子弹1年前1
gg下的子弹1年前1 -
 niniaiai 共回答了20个问题
niniaiai 共回答了20个问题 |采纳率85%氢氧化钙是强碱啊,碱性比NaOH还强,是石灰哦,怎么可以做补钙剂1年前查看全部
- 钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯
钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书中的一部分.取一片钙尔奇放入盛有10g稀盐酸的烧杯中.其中的碳酸钙与盐酸,恰好完全反应(其他成分与盐酸不反应)烧杯内的质量为11.34g请你计算
钙尔奇Caltrate
主要成分:CaCo3
规格:每片0.2g
用法:口服
用量:一日2次 每次1片
(1)每片钙尔奇中含碳酸钙的质量?
(2)服用这种补钙剂,每人每天摄入该元素的质量? hdcjf20041年前1
hdcjf20041年前1 -
 忍不住来看帖 共回答了14个问题
忍不住来看帖 共回答了14个问题 |采纳率100%首先 2HCl+CaCo3=CaCl2+H2O+Co2
但是10+0.2-11.34=-132
所以小朋友你的数据有问题,钙尔奇那个钙片应该是2.0克.
12-11.34=0.66 这是变成气体逃走的二氧化碳的质量,接下来自己算吧1年前查看全部
- 是不是含有钙元素的物质都可以补钙
 eeee真温暖1年前3
eeee真温暖1年前3 -
 561chengang 共回答了15个问题
561chengang 共回答了15个问题 |采纳率93.3%当然不是
道理上都能提供钙元素
但如果阴离子有毒,还能吃吗?
常用的补钙剂一般是:碳酸钙、乳酸钙、氨基酸螯合钙、葡萄糖酸钙
像硝酸钙什么的,你敢吃吗?1年前查看全部
- (2007•连云港模拟)某班一学习小组以“关于市场上几种补钙保健产品的调查研究”为课题进行了探究学习活动.请你一起参与其
(2007•连云港模拟)某班一学习小组以“关于市场上几种补钙保健产品的调查研究”为课题进行了探究学习活动.请你一起参与其活动,完成下列探究过程.
[活动目的]
(1)了解钙元素与人体健康的关系.
(2)了解钙产品的含钙量、价格、并检验是否合格.
(3)培养获取信息、处理信息、分析问题、解决问题、合作探究能力.
[调查收集资料]
(1)通过市场调查,常见的四种钙产品的有关信息如下:
(2)通过查阅三九健康网、《现代医学周刊》、《市场报》等收集到如下信息:品名 钙尔奇-D 凯思立-D 乐力钙 柠檬酸钙 主要含钙物质 碳酸钙 碳酸钙 氨基酸螯合钙 枸橼酸钙 该元素含量(mg/片) 600 500 250 168 数量(片)/瓶(盒) 30 20 30 30 价格(元)/瓶(盒) 27.00 23.10 30.00 25.20
生长期青少年每天钙摄入量应为1 300 mg,而实际上目前我国中学生每日钙摄入量的均值为518 mg,营养学会公布的居民每日钙摄入量为800 mg.
[研究结论]
(1)钙保健产品中的钙元素以______形式存在.A.单质B.化合物
(2)人体的钙元素主要存在于______中.
(3)根据上述调查信息分析,青少年每日钙需要量大,而实际摄入量不足,应注意______.
[交流与讨论]
(1)由上表分析比较,四种钙产品中,当含有相同质量的钙元素时价格相对最便宜______.
A.钙尔奇-DB.凯思立-DC.乐力钙D.柠檬酸钙
(2)在交流过程中,小芳同学提出一个观点,补钙还可以食补,即能省钱又能补钙.下列做法可以补钙的是______.
A.在食物中添加生石灰B.食用一些虾皮C.喝排骨汤D.做馒头时放纯碱
(3)小明认为食用凯思立-D的碳酸钙进入胃内能发生化学反应,其化学方程式是:______.
[质疑与再探究]
由钙尔奇-D说明书知每片钙尔奇-D中含碳酸钙1.5 g.(已知:钙尔奇-D不含有其他碳酸盐,其研细后与稀硫酸完全反应.)在讨论中,小强同学提出一个问题,现在市场上有些不法分子会以假乱真,购买的钙尔奇-D不知是否合格,想通过实际定量分析.小强设计了如下方案并进行实验:取50片钙尔奇-D研细,放入锥形瓶(见下图),加入足量的盐酸充分反应,气体最后通入氢氧化钠溶液(假设气体全部被氢氧化钠吸收,忽略系统内空气中CO2的影响),两次称量盛氢氧化钠溶液的洗气瓶可计算出样品是否合格.试回答下列问题:
(1)小强用B中NaHCO3饱和溶液除去CO2中混有的少量HCl气体,B中的NaHCO3溶液能否换成石灰水?(填“能”或“否”),其理由是______.
(2)小明认为:小强的设计不能达到检验样品是否合格的目的,应该加以改进,并得到了小组其他同学的赞同.你认为小明发现的问题是______,改进的方法是______.
(3)用改进后的装置和药品进行实验,称量盛氢氧化钠溶液的洗气瓶增加了33 g,试通过计算说明小强选用的钙尔奇-D是否为合格产品. 陈楚生ee李宇春1年前1
陈楚生ee李宇春1年前1 -
 xiao__xin 共回答了22个问题
xiao__xin 共回答了22个问题 |采纳率100%解题思路:[研究结论](1)根据人体中钙的存在形式回答;
(2)根据人体中钙的存在位置回答;
(3)根据人体中钙的生理功能回答.
[交流与讨论](1)根据各种药品的主要成分中含有钙元素的质量和其价格比比较回答;
(2)根据钙元素的主要食物来源回答;
(3)根据胃酸的成分与它和碳酸钙的化学性质回答.
[质疑与再探究](1)根据二氧化碳和NaHCO3饱和溶液的化学性质回答;
(2)根据碳酸氢钠和盐酸反应生成了二氧化碳的情况回答;
(3)根据盛氢氧化钠溶液的洗气瓶增加了33 g,判断生成的二氧化碳的质量,再根据二氧化碳的质量求出碳酸钙的质量,最后判断是否合格.[研究结论](1)钙保健产品中的钙元素都是以化合物的形式存在;
(2)在人体内的钙元素主要存在于骨胳和牙齿中;
(3)如果人体缺钙,幼儿和青少年会患佝偻病和发育不良,所以要注意补钙.
[交流与讨论](1)600mg/片×30片÷27.00元=666.67 mg/元;500mg/片×20片÷23.10元=432.9 mg/元;250mg/片×30片÷30.00元=250 mg/元;168mg/片×30片÷25.20元=200 mg/元,所以选A.
(2)A.在食物中添加生石灰,生石灰会腐蚀人的消化道;B.食用一些虾皮可以,虾皮中富含钙;C.喝排骨汤可以,骨头汤中含钙元素多;D.做馒头时放纯碱不可以,纯碱是碳酸钠,不含钙元素;
(3)胃酸的主要成分是盐酸,它和碳酸钙反应生成三氧化碳、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
[质疑与再探究](1)B中的NaHCO3溶液不能换成石灰水,因为石灰水的主要成分是氢氧化钙,能和二氧化碳也发生反应;
(2)NaHCO3饱和溶液吸收HCl时,要反应产生CO2,导致盛NaOH溶液的洗气瓶增重大于样品产生CO2的质量,无法计算样品是否合格.将盐酸换成稀硫酸,就不会有氯化氢气体挥发出来,再将NaHCO3饱和溶液的洗气瓶去掉就可以了.
(3)设钙尔奇-D是碳酸钙的质量为X
由于盛氢氧化钠溶液的洗气瓶增加了33 g,则生成的二氧化碳的质量33 g.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
X 33g
100÷44=X÷33g X=75g
75g÷50片=1.5g/片 与说明书一致,为合格产品.
故答案为:[研究结论](1)B(2)骨骼和牙齿(3)补钙等
[交流与议论](1)A(2)BC(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
[质疑与再探究](1)否,因为石灰水也能吸收二氧化碳干燥CO2气体
(2)NaHCO3饱和溶液吸收HCl时,要反应产生CO2,导致盛NaOH溶液的洗气瓶增重大于样品产生CO2的质量,无法计算样品是否合格;将盐酸换成稀硫酸,将NaHCO3饱和溶液的洗气瓶去掉.
(3)设钙尔奇-D是碳酸钙的质量为X
由于盛氢氧化钠溶液的洗气瓶增加了33 g,则生成的二氧化碳的质量33 g.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
X 33g
100÷44=X÷33g X=75g
75g÷50片=1.5g/片
与说明书一致,为合格产品.点评:
本题考点: 人体的元素组成与元素对人体健康的重要作用;气体的净化(除杂);单质和化合物的判别;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 化学来源于生产、生活,也必须服务于生产、生活,所以与生产、生活有关的化学知识考查必是热点之一.1年前查看全部
- 医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
(1)CaCO3与盐酸反应的离子方程式______.氢氧化物 Fe(OH)3 Al(OH)3 开始沉淀时的pH 2.3 4.0 开始溶解:7.8 完全沉淀时的pH 3.7 5.2 完全溶解:10.8
(2)除杂操作是加入氢氧化钙,调节溶液的pH为______,目的是除去溶液中少量的Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是______.
(3)过滤时需用的玻璃仪器有______.滤渣主要成分的化学式______.
(4)酸化时加盐酸的目的为:①______,②防止Ca2+在蒸发时发生水解.
(5)为什么蒸发结晶要保持在160℃:______.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为______.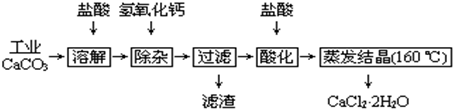
 BaBaSky1年前1
BaBaSky1年前1 -
 李美雯 共回答了16个问题
李美雯 共回答了16个问题 |采纳率100%解题思路:工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化铝等,加入氢氧化钙溶液调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2•2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳;
(2)根据铁离子完全沉淀、铝离子完全沉淀、氢氧化铝开始溶解的pH判断需要体积的pH范围;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(3)加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,过滤需要烧杯、玻璃棒和普通漏斗;
(4)加入过量盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解;
(5)从溶液中得到晶体,加热温度不能过高,防止晶体分解;
(6)样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2)根据表中数据可知,氢氧化铁完全沉淀的pH为3.7,氢氧化铝开始沉淀的pH为5.2,氢氧化铝开始溶解的pH为7.8,所以将铁离子、铝离子完全转化成沉淀的pH范围为:5.2~7.8;
Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,操作为取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,
故答案为:5.2~7.8(或之间的任意值);取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全;
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和普通漏斗;加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,所以滤渣的主要成分为:Fe(OH)3、Al(OH)3,
故答案为:烧杯、玻璃棒、普通漏斗;Fe(OH)3、Al(OH)3;
(4)因除去铁离子、铝离子需加入过量的氢氧化钙,加入盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解,
故答案为:除去过量的氢氧化钙;
(5)从溶液中得到晶体,加热温度不能过高,防止因温度太高CaCl2•2H2O会失水,
故答案为:温度太高CaCl2•2H2O会失水;
(6)品中存在少量的NaCl,对氯化钙晶体加热使之失去结晶水操作中,干燥温度过高时CaCl2•2H2O 晶体失去部分结晶水,会给实验带来误差,
故答案为:样品中存在少量的NaCl或干燥温度过高时CaCl2•2H2O晶体失去部分结晶水.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题主要考查实验的基本操作、实验仪器的选择、实验误差分析等知识,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,难度中等.1年前查看全部
- 医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2•2H2O的质量分数为97.0%-103.0%)的主要流程如下:
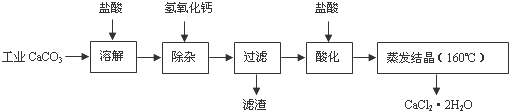
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的试验操作是______.
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①______
______;②______.
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol•L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL.
①计算上述样品中CaCl2•2H2O的质量分数为______.
②若用上述办法测定的样品中CaCl2•2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有______. 兰心远1年前1
兰心远1年前1 -
 chsq00 共回答了16个问题
chsq00 共回答了16个问题 |采纳率87.5%解题思路:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(2)因在除杂过程中加入了Ca(OH)2,故加入盐酸与溶液中的少量Ca(OH)2反应使其转化为CaCl2;另Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,故加入盐酸还可以防止溶液吸收空气中CO2,Ca(OH)2吸收空气中的CO2,生成CaCO3沉淀,如果吸收大量的CO2 会导致最终质量分数偏低;
(3)①根据到达滴定终点生成氯化银的物质的量等于消耗的硝酸银的物质的量这一关系求出消耗硝酸银的物质的量,则n(AgCl)=2n(CaCl2.2H2O),
据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量.注意的是我们是从250mol中取25ml,所以在计算时要注意这一点;
②样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;防止Ca2+在蒸发时水解;防止溶液吸收空气中CO2;
(3)①样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2.2H2O),则n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,则有:[0.7493225g/0.7500g]×100%=99.9%,
故答案为:99.9%;
②样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大,
故答案为:样品中存在少量的NaCl或少量的CaCl2.2H2O失水.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查混合物中含量的测定,涉及实验的基本操作、实验仪器的选择、实验误差分析、混合物分离及含量测定的计算等,注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题,题目综合性较强,难度中等.1年前查看全部
- 纯净的碳酸钙(CaCO3)是用途非常广泛的物质,补钙剂、牙膏摩擦剂中都有它的身影.试计算:
纯净的碳酸钙(CaCO3)是用途非常广泛的物质,补钙剂、牙膏摩擦剂中都有它的身影.试计算:
(1)碳酸钙的相对分子质量.
(2)100g碳酸钙中含有多少g钙元素? 乖乖儿1年前1
乖乖儿1年前1 -
 多少泪的qqA 共回答了16个问题
多少泪的qqA 共回答了16个问题 |采纳率93.8%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)碳酸钙的相对分子质量是40+12+16×3+16=100.
(2)100g碳酸钙中含有钙元素的质量为100g×
40
100×100%=40g.
答:(1)碳酸钙的相对分子质量是100;(2)100g碳酸钙中含有40g钙元素.点评:
本题考点: 相对分子质量的概念及其计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 给这则短消息你写标题人们通常认为,牛奶是人们最容易获得钙来源.然而,事实上如果按照营养素密度来计算,牛奶的补钙效益低于青
给这则短消息你写标题
人们通常认为,牛奶是人们最容易获得钙来源.然而,事实上如果按照营养素密度来计算,牛奶的补钙效益低于青菜、
按照数据计算,100克全脂牛奶能量约为54千卡,含钙104毫克.而100克小油菜含能量约为1..5千卡,含钙却高达153毫克;按照钙营养素密度来计算,全脂牛奶是1.9,小油菜是10.2.100克小油菜中的钾含量是157毫克,镁是27毫克,都比牛奶略高一些.一种食物能够同时供应大量钙、钾和镁,无疑是理想的健骨食品,何况绿叶菜中还含有丰富的维生素K,能帮助钙沉积入骨骼当中.所以,按照同样食用量,绿叶菜可能是补充健骨矿物质的更好食品.小白菜、小油菜等蔬菜中含草酸较低,对钙的吸收利用妨碍较小.只要有充足的阳光照射,得到足够的维生素D,其中的钙就可以充分实现营养价值.
题目不得超过十二个字 散发弄舟1年前3
散发弄舟1年前3 -
 迷梦丽影_ff 共回答了21个问题
迷梦丽影_ff 共回答了21个问题 |采纳率85.7%青菜是一种比牛奶补钙效果更好的绿色选择!1年前查看全部
- 某天,餐桌上,东东的爸爸拿起吃剩的鱼骨头给奶奶,说:“妈,您该补钙了!”于是,东东也学着爸爸,递一条鱼骨头给爸爸,并说:
某天,餐桌上,东东的爸爸拿起吃剩的鱼骨头给奶奶,说:“妈,您该补钙了!”于是,东东也学着爸爸,递一条鱼骨头给爸爸,并说:“爸,您也补钙吧.”
根据这段话写一篇作文 写出你的理解 感受和联想 400字 yangxiktt1年前4
yangxiktt1年前4 -
 whfhfw 共回答了17个问题
whfhfw 共回答了17个问题 |采纳率94.1%我不是别的,只是一种无限的意志,
从一座省城的长长的落地窗了望
远远看去像丝一般光滑,然而
从地狱深处来临
如此亲密,你搁在我胸前的手便是我的手,
这是因为过往的风种哈哈1年前查看全部
- 电视广告词“腰酸背痛脚抽筋--得补钙”.这里的“钙”应理解为( ) A.元素 B.分子 C.原子 D.离子
 深秋立楼头1年前1
深秋立楼头1年前1 -
 ekinqian521219 共回答了12个问题
ekinqian521219 共回答了12个问题 |采纳率83.3%“腰酸背痛脚抽筋--得补钙”,这里的“钙、锌、碘”等不是以单质、分子、原子、离子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关.
故选A.1年前查看全部
- (2008•遵义)日常生活中喝牛奶能补钙,这里的“钙”指的是( )
(2008•遵义)日常生活中喝牛奶能补钙,这里的“钙”指的是( )
A.元素
B.原子
C.分子
D.离子 queque82531年前1
queque82531年前1 -
 娃哈哈imr 共回答了20个问题
娃哈哈imr 共回答了20个问题 |采纳率80%解题思路:可以根据生活、生产中的实际情况进行分析、考虑,从而得出正确的结论.日常生活中喝牛奶能补钙,这里的“钙”指的是钙元素.故选A.
点评:
本题考点: 物质的元素组成.
考点点评: 解答本题要考虑生活、生产中的实际情况.1年前查看全部
- 21、钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病.李明的父亲为他买回一瓶补钙
21、钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病.李明的父亲为他买回一瓶补钙保健品,他仔细阅读了标签上的说明(如图),为了验证该保健品中碳酸钙的含量,取出5片药品,加入足量的稀盐酸,充分反应后收集到3.3g二氧化碳(假定除碳酸钙外其他成分不与盐酸反应)
净含量:2g*200
主要原料:碳酸钙(质量分数 大于等于70%)
使用方法:每日两次,每次一片,嚼食
(1)已知碳酸钙的相对分子质量是100,则钙元素的相对原子质量为 ;
(2)通过计算验证:该保健品主要原料含量是否属实(写出计算过程)?
(3)李明按照说明服用一个月(30天),理论上吸收了钙元素 克. yangwawa20071年前1
yangwawa20071年前1 -
 liangzhi164 共回答了16个问题
liangzhi164 共回答了16个问题 |采纳率100%第一问是40
第二问是75%属实
第三问是30d*2*2g=120g
120g*75%=90g
90g除100g∕mol=0.9mol
0.9mol*40g∕mol=36g1年前查看全部
- (2007•株洲)人体每天必须摄入足量的钙.市场上销售的某品牌补钙剂的说明书如图所示.计算:
(2007•株洲)人体每天必须摄入足量的钙.市场上销售的某品牌补钙剂的说明书如图所示.计算:
(1)碳酸钙的相对分子质量为______.
(2)若按说明书上的用量服用,则每天补充钙元素的质量为______g.
 麦沙拉1年前1
麦沙拉1年前1 -
 tangll212 共回答了21个问题
tangll212 共回答了21个问题 |采纳率76.2%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据题意,每片含碳酸钙0.625g,每次一片,每天2次,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)碳酸钙的相对分子质量为40+12+16×3+16=100.
(2)由题意,每片含碳酸钙0.625g,每次一片,每天2次,则每天补充钙元素的质量是0.625g×2×
40
100×100%=0.5g.
故答案为:(1)100;(2)0.5.点评:
本题考点: 相对分子质量的概念及其计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质
 某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质量为______.
某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质量为______.  pushuyp1年前1
pushuyp1年前1 -
 mqzfj 共回答了20个问题
mqzfj 共回答了20个问题 |采纳率90%解题思路:由题意,每片含1.5gCaCO3,每次一片,每天2次,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,若人体对该药品中钙的平均吸收率为30%,据此进行分析解答.由题意,每片含1.5gCaCO3,每次一片,每天2次,则每天服用的碳酸钙的质量为:1.5g×2=3g,其中含钙元素的质量为3g×[40/40+12+16×3]×100%=1.2g;若人体对该药品中钙的平均吸收率为30%,则按照说明书服用,每天实际被人体吸收的钙元素质量是1.2g×30%=0.36g.
故答案为:0.36g.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2013•曲靖)碘酸钙(Ca(IO3)2)是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水.Ca(IO3)2中碘元素的
(2013•曲靖)碘酸钙(Ca(IO3)2)是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水.Ca(IO3)2中碘元素的化合价是( )
A.-1
B.+3
C.+5
D.+7 十三不鸟1年前1
十三不鸟1年前1 -
 cathyhu0503 共回答了22个问题
cathyhu0503 共回答了22个问题 |采纳率81.8%解题思路:根据在化合物中正负化合价代数和为零进行解答.根据在化合物中正负化合价代数和为零,可设Ca(IO3)2中碘元素的化合价为x,则:(+2)+2x+(-2)×3×2=0,解得x=+5;
故选:C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力,难度不大.1年前查看全部
- 为完成下列调查题而选择的调查对象或渠道,其中较不合理的是( ) 选项 调查表 调查对象或渠道 A. 调查市场上补钙保健
为完成下列调查题而选择的调查对象或渠道,其中较不合理的是( )
选项 调查表 调查对象或渠道 A. 调查市场上补钙保健品的种类 保健品经销店 B. 调查家庭燃料种类、性能和价格 环境保护部门 C. 调查家庭用水情况 同学和家长 D. 调查一周空气质量变化情况 电视、网络
A. 调查市场上补钙保健品的种类 保健品经销店
B. 调查家庭燃料种类、性能和价格 环境保护部门
C. 调查家庭用水情况 同学和家长
D. 调查一周空气质量变化情况 电视、网络 北飘一叶1年前1
北飘一叶1年前1 -
 qumb 共回答了17个问题
qumb 共回答了17个问题 |采纳率82.4%解题思路:A、根据保健品的生产和销售渠道判断.
B、根据家庭燃料的生产、销售、使用单位或个人判断.
C、根据家庭成员组成和用水情况判断.
D、根据空气监测和发布的负责单位判断.A、补钙保健品的生产厂家很多,也不集中,调查不便,销售商经销各种产品,方便调查,所以合理.
B、环保部门主管污染情况,家庭燃料的种类、性能、价格,应调查经销商,所以不合理.
C、家庭用水应调查家庭成员,所以合理.
D、空气污染由环保部门监测,由电视和网络发布,所以合理.
故选B.点评:
本题考点: 空气的污染及其危害;微量元素、维生素与健康的关系及摄取方法.
考点点评: 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的知识是历年中考的热点,在学习过程中要注意理论联系实际.1年前查看全部
大家在问
- 1【高一英语】search和sought的用法区别
- 21.92gCu投入一定量浓度HNO3中,铜完全溶解,共收集到标准状况下气体672ML,通入一定体积的氧气恰好使气体完全溶
- 3操场上有一400米长的跑道(如图),已知操场的宽度为50米,跑道的宽度为1米,那么这个4×100接力赛起点的间隔应是__
- 4四倍体西瓜和八倍体西瓜是不是同一物种(六倍体西瓜是可育的)
- 5一人懒,一人勤劳,猜一俗语
- 6某工厂第一车间的人数比第二车间的4/5少16人,如果从第一车间调40人到第二车间,这时第一车间的人数比第二
- 71、用恰当形式填空.2、选择填空.
- 8How long ( ) you ( A.did skate B.have been skating 在这可不可以选A?
- 9下面句子中加粗的成语使用不恰当的一项是 [ ] A.妈妈 语重心长 地给
- 10用from…to…造句
- 11根据如图所示的装置回答问题.(1)实验室中用高锰酸钾制取氧气,其发生装置选用(填序号)______,收集装置选用____
- 12一块梯形地,上底长40米,下底长60米,高是40米(如图).李伯伯要在这块地中划出最大的一块正方形地种棉花,其余的种花生
- 13"我喜欢一切美好的东西"用英文怎么说
- 14在醋酸钠溶液中加入醋酸,水解程度如何改变?
- 15(2009•宣武区二模)镧的合金是一种储氢材料.下列有关元素镧(La)的说法不正确的是( )


