(2013•赤壁市模拟)如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备、夹持固定装置和连接用橡胶管
 宇韵2022-10-04 11:39:541条回答
宇韵2022-10-04 11:39:541条回答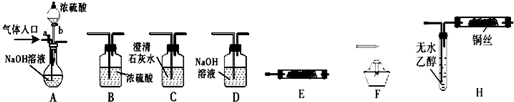
(1)甲同学在气体入口处通入CO和CO2的混合气体,E内放置CuO,并选择其他合适装置获得了纯净干燥的CO,验证了CO的还原性及氧化产物.该同学所选装置的连接顺序为A→______→______→______→______→______(填代号、下同).能验证CO氧化产物的现象是______.
(2)甲同学完成实验后,乙同学认为在甲同学实验基础上稍加改装就可制取纯净干燥的O2,并用O2氧化乙醇.
①乙同学首先将装置E内CuO换为Na2O2;
②然后按A→______→______→______→______的顺序组合装置,保持活塞a关闭,打开活塞b.开始反应一段时间后E中反应方程式为:______;
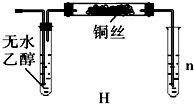
(3)乙同学实验后认为装置H在设计上有明显缺陷,并提出了如图所示的替代方案,则试管n中应装入的试剂为______(填化学式),其作用是______.

已提交,审核后显示!提交回复
共1条回复
 神秘女子 共回答了16个问题
神秘女子 共回答了16个问题 |采纳率81.3%- 解题思路:(1)用NaOH溶液除去CO2,澄清石灰水检验是否除尽,用浓硫酸干燥CO,用CuO氧化CO,用澄清石灰水检验CO的氧化产物,燃烧法除去多余的CO;
(2)②保持活塞a关闭,打开活塞b,浓硫酸与NaOH溶液反应放出热量,加快A中的水的蒸发,H2O与E中Na2O2反应可生成O2,加热无水乙醇,CH3CH2OH与O2反应生成CH3CHO;开始反应一段时间后空气进入E中,二氧化碳与过氧化钠反应;
(3)根据乙醇氧化后的产物为乙醛,为大气污染物,易溶于水,应吸收.(1)要获得纯净干燥的CO就必须用A中的NaOH溶液吸收CO2,并通过C中的澄清石灰水不变浑证明CO2已被完全吸收,再通过B浓硫酸干燥CO气体,CO通过E中加热的CuO被氧化成CO2,C中澄清石灰水吸收变浑浊,证明CO还原性及氧化产物,所选装置的连接顺序为ACBECF,
故答案为:C;B;E;C;F;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊;
(2)②要获得纯净干燥的O2,保持活塞a关闭,打开活塞b,放入浓硫酸与NaOH发生中和反应,放热有水蒸气从A装置中出来,与E中Na2O2反应就会有O2生成,杂质CO2进入D中,O2以B中浓H2SO4干燥再进入H装置将乙醇蒸气与O2在加热的铜丝网下被氧化成乙醛;开始反应一段时间后空气进入E中,二氧化碳与过氧化钠反应,方程式为:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:E;D;B;H;2Na2O2+2CO2=2Na2CO3+O2;
(3)乙醇氧化后的产物为乙醛,为大气污染物,易溶于水,应吸收;
故答案为:H2O;吸收反应过程中生成的CH3CHO,防止污染空气.点评:
本题考点: 常见气体制备原理及装置选择.
考点点评: 本题不仅考查了气体的制备、分离、干燥和性质验证,还考查了教材中的多方面核心知识内容,如Na2O2的性质,乙醇的脱氢氧化反应等,可以说考查的内容相当丰富,难度中等. - 1年前
相关推荐
- (2013•赤壁市模拟)A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子
 (2013•赤壁市模拟)A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(2013•赤壁市模拟)A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于______ 分子(填“极性”或“非极性”),AH2B分子中A原子的杂化轨道类型是______ 杂化,分子中有______个δ键、______ 个π键.
(2)当n=3时,A与B形成的晶体中含有的粒子间的作用为______.
(3)若n=3时,A、C、D三种元素的第一电离能由大到小的顺序是______(用元素符号表示).DB2分子的VSEPR模型是______;DB2分子的空间构型是______.
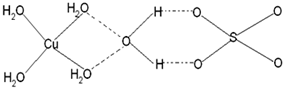
(4)已知铜能形成多种化合物,如硫酸铜的结构如图所示,请在图中标出水合铜离子中的配位键. jiang838551461年前1
jiang838551461年前1 -
 宁静夏天 共回答了14个问题
宁静夏天 共回答了14个问题 |采纳率71.4%解题思路:A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,则A属于第IVA族元素;
B元素原子的最外层子数是其电子层数的3倍,最外层电子数不超过8个,则B是O元素;
C元素原子的M能层的p能级有3个未成对电子,则C是P元素;
D元素原子核外的M能层中只有2对成对电子,则D是S元素;
(1)当n=2时,A为C元素,CO2分子结构对称,其正负电荷重心重合;CH2O分子结构简式为HCHO,C原子含有3个δ键、1个π键,据此判断C原子杂化方式;
(2)当n=3时,A为Si元素,A与B形成的晶体为SiO2,属于原子晶体,非金属元素之间易形成共价键;
(3)若n=3时,A为Si元素,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,根据价层电子对互斥理论确定DB2分子的VSEPR模型、DB2分子的空间构型;
(4)铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键.A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,则A属于第IVA族元素;
B元素原子的最外层子数是其电子层数的3倍,最外层电子数不超过8个,则B是O元素;
C元素原子的M能层的p能级有3个未成对电子,则C是P元素;
D元素原子核外的M能层中只有2对成对电子,则D是S元素;
(1)当n=2时,A为C元素,CO2分子结构对称,其正负电荷重心重合,为非极性分子;CH2O分子结构简式为HCHO,C原子含有3个δ键、1个π键,所以C原子价层电子对个数是3,则C原子采用sp2杂化,故答案为:非极性;sp2;3;1;
(2)当n=3时,A为Si元素,A与B形成的晶体为SiO2,属于原子晶体,二氧化硅晶体中Si原子和O原子之间存在共价键,故答案为:共价键;
(3)若n=3时,A为Si元素,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是P>S>Si,
SO2分子中S原子价层电子对个数=2+[1/2]×(6-2×2)=3,且含有一个孤电子对,所以二氧化硫的VSEPR模型为三角形,其空间构型为V形,故答案为:P>S>Si;三角形;V形;
(4)铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为: ,
,
故答案为: .
.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查物质结构和性质,涉及分子空间构型的判断、配位键的表示、第一电离能大小比较等知识点,这些都是考试高频点,注意VSEPR模型、分子空间构型的区别及配位键的表示方法,关键是配位键箭头方向,为易错点.1年前查看全部
- 写我的家乡赤壁市写什么标题我要写我的家乡赤壁市,求标题(不要是那种 我的家乡——赤壁市,要新颖一点 ,文化一点)
 暗淡了刀光1年前1
暗淡了刀光1年前1 -
 sam20060614 共回答了15个问题
sam20060614 共回答了15个问题 |采纳率86.7%百万雄兵征战之地——赤壁1年前查看全部
- (2013•赤壁市模拟)如图是A、B 两种物质的溶解度曲线,请根据此图回答以下相关问题:
 (2013•赤壁市模拟)如图是A、B 两种物质的溶解度曲线,请根据此图回答以下相关问题:
(2013•赤壁市模拟)如图是A、B 两种物质的溶解度曲线,请根据此图回答以下相关问题:
(1)请写出两条你从该图中获取的信息:①______,②______.
(2)在20℃时,B物质的饱和溶液中溶质的质量分数是______.(计算结果保留小数点后1位) 丁香淡淡℡1年前1
丁香淡淡℡1年前1 -
 向dd再借五百年 共回答了17个问题
向dd再借五百年 共回答了17个问题 |采纳率94.1%解题思路:根据溶解度曲线分析解答,交点表示在该温度下两种物质的溶解度相等;根据曲线的走向,确定物质的溶解度随温度的变化特点;溶质质量分数=
×100%.溶质质量 溶液质量 (1)据图可以看出,30℃时,AB两种物质的溶解度相等;当温度低于30℃时,A物质的溶解度小于B物质的溶解度;当温度高于30℃时,A物质的溶解度大于B物质的溶解度;40℃时,B物质的溶解度为50g;故填:30℃时,AB两种物质的溶解度相等;40℃时,B物质的溶解度为50g;
(2)20℃时,B的溶解度为40g,B物质的饱和溶液中溶质的质量分数是
40g
100g+40g×100%≈28.6%,故填:28.6%.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题考查了溶解度曲线的意义和应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 赤壁市是故乡怎么扩句
 kegang1年前3
kegang1年前3 -
 没有披肩 共回答了24个问题
没有披肩 共回答了24个问题 |采纳率95.8%( )赤壁市是( )故乡.
比如:(饱具历史沧桑感的)赤壁市是(我日夜思念的)家乡.1年前查看全部
- 求翻译地址:湖北省 赤壁市 赤壁大道969号 林业小区 3 栋 1楼 崔英
 Tony8207311年前4
Tony8207311年前4 -
 笨笨小肥丫 共回答了13个问题
笨笨小肥丫 共回答了13个问题 |采纳率92.3%Attn:Ms.Cui Ying
1st fl.,Bldg.3,Linye Subdistrict ,No.969 Chibi Avenue,Chibi,Hubei xxxxxx,P.R.China.
地址尽量用简写
邮编放在省名后面1年前查看全部
- (2013•赤壁市模拟)化学老师在课堂上做了一个小魔术:水能生火.只见老师向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水
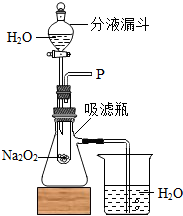 (2013•赤壁市模拟)化学老师在课堂上做了一个小魔术:水能生火.只见老师向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小军很感兴趣,于是,他和同学们进行探究.
(2013•赤壁市模拟)化学老师在课堂上做了一个小魔术:水能生火.只见老师向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小军很感兴趣,于是,他和同学们进行探究.
【提出问题】过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】①可能有一种气体和另一种物质生成
②反应过程中可能有能量变化
【设置装置】如图所示
【实验探究】实验一:探究反应生成的气体是什么?
(1)打开如图装置中分液漏斗的活塞,缓慢滴加足量的水,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是______.
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:______.
实验二:继续探究反应后生成的另一种物质是什么?
(1)小张猜想另一种物质是Na2CO3,小军认为不可能.小军的依据是:______.为了证实自己的看法,小军设计一个简单实验:向反应产物中滴加足量稀硫酸,______,则证明该物质不是碳酸盐.
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈______性.
【表达】由实验探究的结果,写出过氧化钠和水反应的化学方程式______. sgdx9301年前1
sgdx9301年前1 -
 我会等待 共回答了23个问题
我会等待 共回答了23个问题 |采纳率69.6%解题思路:实验一:(1)根据氧气有助燃性,能使带火星的木条复燃进行分析;
(2)根据Na2O2与水反应放热,使吸滤瓶中的空气受热膨胀进行分析;
实验二:(1)根据质量守恒定律,反应物中没有碳元素,碳酸钠和稀盐酸反应能生成二氧化碳气体进行分析;
(2)根据酚酞遇碱变成红色,过氧化钠与水反应后生成氧气和氢氧化钠进行分析.实验一:(1)氧气能使带火星的木条复燃,所以生成的气体是:氧气;
(2)Na2O2与水反应放热,使吸滤瓶中的空气受热膨胀,所以伸入烧杯中的导管口看到有气泡产生;
实验二:(1)根据质量守恒定律,反应物中没有碳元素,所以生成物中不可能含有碳元素,碳酸钠中含有碳元素,设计一个证明Na2CO3不存在的实验:用试管取少量的反应后溶液,然后向试管中滴加过量的稀盐酸,没有气泡冒出,说明碳酸钠不存在;
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈碱性,过氧化钠与水反应后生成氧气和氢氧化钠,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑.
故答案为:实验一:(1)氧气;
(2)过氧化钠与水反应放出热量,使吸滤瓶中的空气受热膨胀,因此伸入烧杯中的导管口看到有气泡产生;
实验二:(1)根据质量守恒定律,反应物中没有碳元素,所以生成物中不可能有Na2C03;没有气泡产生;
(2)碱,2Na2O2+2H2O═4NaOH+O2↑.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;证明碳酸盐;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.1年前查看全部
- (2013•赤壁市模拟)能正确表示下列反应的离子方程式是( )
(2013•赤壁市模拟)能正确表示下列反应的离子方程式是( )
A.FeO溶于足量稀HNO3:FeO+2H+═Fe2++H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O
C.等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O
D.将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ paopao1101年前1
paopao1101年前1 -
 云中青鸟飞 共回答了21个问题
云中青鸟飞 共回答了21个问题 |采纳率81%解题思路:A.发生氧化还原反应生成硝酸铁、NO和水;
B.NH4HCO3完全反应,生成碳酸钡、水、一水合氨;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合,反应生成碳酸钡、水、KOH;
D.等体积混合,物质的量比为1:2,反应生成硫酸钡、氢氧化铝和一水合氨.A.FeO溶于足量稀HNO3的离子反应为3FeO+NO3-+10H+═3Fe3++NO↑+5H2O,故A错误;
B.NH4HCO3溶液与足量Ba(OH)2溶液混合的离子反应为NH4++HCO3-+Ba2++2OH-═BaCO3↓+H2O+NH3.H2O,故B错误;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合的离子反应为HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D错误;
故选C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度中等.1年前查看全部
- (2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.
 (2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)═4C(g)△H>0 达到平衡时,c(A)=2mol•L-1,c(B)=4mol•L-1,c(C)=4mol•L-1.试确定B的起始浓度c(B)的取值范围是______;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是______.
A.增加C的物质的量B.加压C.升温D.使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图甲所示.则图中表示醋酸溶液中pH变化曲线的是______ (填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______ m2.(选填“<”、“=”、“>”)
(3)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是______.
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+ )c2(OH-)=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol•L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______;要使0.2mol•L-1的CuSO4 溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)______. 9o9gerer1年前1
9o9gerer1年前1 -
 goodpasswords 共回答了26个问题
goodpasswords 共回答了26个问题 |采纳率100%解题思路:(1)若A完全转化为C,B取最小值,若C完全转化为反应物,B取最大值;改变条件重新达到平衡后体系中C的体积分数增大,可使平衡正向移动或增加C;
(2)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答;
(3)在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小;
(4)根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析..(1)可逆反应A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=4mol/L,c(c)=4mol/L,若A完全转化为C,消耗B为4mol/L,则B最小值为0mol/L,若C完全转化为反应物,生成2mol/LB,则B的最大值为6mol/L,因反应为可逆反应,均不能完全转化,则B的浓度范围为0mol/L<c(B)<6mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:0mol/L<c(B)<6mol/L;C;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<;
(3)A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),还有可能c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)=2c (Na+),故D正确;
故选D;
(4)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
2×10−20
0.02mol/L=10-9mol/L,则c(H+)≤
1×10−14
10−9mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5;
Cu2+沉淀较为完全是的浓度为[0.2mol/L/1000]=2×10-4mol/L,
则c(OH-)=
2×10−20
2×10−4mol/L═10-8mol/L,
则c(H+)=
1×10−14
10−8mol/L=10-6mol/L,
所以pH=-lg(10-6)=6,
故答案为:5; 6;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
要验证该溶液遇酚酞呈红色原因,可用以下方法:
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说点评:
本题考点: 化学平衡的影响因素;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较.
考点点评: 本题考查弱电解质的电离,化学平衡影响因素分析判断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,注意把握弱电解质的电离特点和影响因素,平衡移动原理实质理解应用、溶度积常数的计算,题目难度不大,注意把握计算公式的运用.1年前查看全部
大家在问
- 1为什么这个电场做负功?
- 2已知一次函数y=(P+3)X+(2-q)当q取何值时函数图象与Y轴的交点在X轴的上方?当pq怎样取值时函数图象过原点
- 3什么是甲类装置?它和液化烃、可燃气体、可燃液体的防火距离分别是多少
- 4根据反应4HCl(浓)+MnO2 △ . MnCl2+Cl2↑+2
- 5方程x+2y+3z=14(x
- 6从0、5、6、7四个数中选出3个数字,既是2的倍数,又是3的倍数?能组出几个来.
- 7-This returned scholar has become one of the top experts in
- 8一个数增加它的0.25,又减少它的0.2.这时是16 ,这个数是多少?
- 9为什么说自己知道的越多就会发现自己知道的越少?
- 10三年级上册数学解决问题的练习题30道
- 11某同学用天平侧另一块金属的质量时,使用了3个砝码,其中有一个100g,一个50g,一个20g,游码在标尺上位置
- 12英语翻译他们通常需要六公斤的肉(变否定)
- 13某商场在一次促销活动中,第一天卖出T恤衫54件,第二天卖出总量的 1 4 ,这时已卖出的T恤与剩下的件数比是4:3,还剩
- 14我能问一下你的家庭情况吗?用英语怎么说?
- 151,2,3,4,5,6,7,8,9数字无论如何组合,是否都能被3整除.
