锌粉、铝粉、铁粉、镁粉的混合物3.8g与一定质量溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发水分得固体
 晚风佳佳2022-10-04 11:39:541条回答
晚风佳佳2022-10-04 11:39:541条回答A. 0.15g
B. 0.20g
C. 0.30g
D. 0.45g

已提交,审核后显示!提交回复
共1条回复
 胡放鸣 共回答了25个问题
胡放鸣 共回答了25个问题 |采纳率96%- 解题思路:根据质量守恒定律可知,反应物的质量之和等于生成物的质量之和,反应前后元素的种类,原子的数目均不变.
根据题目信息可知,混合物和硫酸恰好完全反应,因此混合物和纯硫酸(H2SO4)的质量之和等于剩余固体和氢气的质量之和.反应前后硫酸根的质量=(11克-3.8克)=7.2克,则纯硫酸的质量=7.2克÷[96/98]=7.35克.因此氢气的质量=硫酸中的氢元素的质量=7.35克-7.2克=0.15克,故选A.
点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题的关键是先计算出硫酸根的质量,然后算出纯硫酸的质量;注意质量守恒定律中的质量指的是参加反应的质量,因此代入的数据是纯硫酸的质量,而不是硫酸溶液的质量. - 1年前
相关推荐
- 向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后过滤,得到固体不溶物A和滤液.将A放入少量稀硫酸中,有气体产生.请
向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后过滤,得到固体不溶物A和滤液.将A放入少量稀硫酸中,有气体产生.请就下表中A的组成任选三组进行分析,判断是否合理,并说明理由.
A的组成 是否合理,并简述理由 Zn ______ Fe、Cu ______ Zn、Fe ______ Zn、Fe、Cu ______  宝沅1年前1
宝沅1年前1 -
 上王王上 共回答了21个问题
上王王上 共回答了21个问题 |采纳率95.2%解题思路:根据金属活动性由强到弱的顺序:锌>铁>H>铜,向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,铜首先被置换出来,待铜被完全置换后,铁开始被置换;将过滤得到固体不溶物A放入少量的稀硫酸中,有气体产生,说明固体中有活动性较强的铁或锌,若锌过量,固体A中含有锌;若锌量不足或恰好完全反应,则固体A中不含锌进行讨论分析.向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应,则所得固体A中一定含有被置换出来的铜;又固体A能与稀硫酸反应放出氢气,则固体A中一定含有铁;如果锌过量则固体A中含有锌;由于锌是否过量不能确定;
故答案为:
A的组成 是否合理,并简述理由
Zn 不合理,因为有Zn剩余,则一定有Fe和Cu
Fe、Cu 合理,此时Zn完全反应,置换出Fe和Cu
Zn、Fe 不合理,因为有Zn或Fe,则一定有Cu
Zn、Fe、Cu 合理,此时锌过量,将Fe和Cu完全置换出来点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金与酸、金属与盐溶液的反应,在金属与盐溶液的混合物发生置换反应时,首先和活动性最弱的金属的盐反应,待该完全反应后再和余下盐溶液中金属活动性最弱的盐继续反应,最后置换出的金属则是相对较强的金属.1年前查看全部
- 一定量的锌粉和2mol/L的过量的盐酸反应,若向其中加入少量下列物质:①石墨 ②CuO ③铜粉④铁粉
一定量的锌粉和2mol/L的过量的盐酸反应,若向其中加入少量下列物质:①石墨 ②CuO ③铜粉④铁粉⑤浓盐酸⑥CuSO4.其中能够加快反应速率,但又不影响产生H2的总量的是( )
A.①②③⑤⑥
B.①③⑤
C.③④⑤
D.①③⑥ 低调的乞讨1年前1
低调的乞讨1年前1 -
 男人糊涂 共回答了18个问题
男人糊涂 共回答了18个问题 |采纳率83.3%解题思路:盐酸过量锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,注意据此解答.①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入硫酸铜溶液,锌和硫酸铜反应生成铜,铜、锌在盐酸溶液中形成原电池反应,加快反应速率,但消耗少量锌,生成氢气量减小,故⑥错误;
故选B.点评:
本题考点: 化学平衡的影响因素;化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,难度中等,注意加入氧化铜、Fe粉对氢气总量的影响,是本题的易错点.1年前查看全部
- (8分)某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:
(8分)某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:


图Ⅰ 图Ⅱ
(1)装置图Ⅰ中放有硫酸的仪器名称是 。
(2)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 。
(3)实验结束后,得到的结论是。
(4)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是 。 OP组合1年前1
OP组合1年前1 -
 wyzxcvb 共回答了25个问题
wyzxcvb 共回答了25个问题 |采纳率96%(8分) (1)分液漏斗 (2)收集到气体的体积
(3)其他条件相同时,锌粉比锌粒反应的速率快 (4)调节滴定管的高度使得两侧液面相平
1年前查看全部
- 把6.5g 锌粉放入足量的盐酸中,锌完全反应.试计算:
把6.5g 锌粉放入足量的盐酸中,锌完全反应.试计算:
(1)6.5g锌的物质的量______;
(2)参加反应的氯化氢的物质的量______;
(3)生成氢气的体积(标准状况)______. 5yurt1年前1
5yurt1年前1 -
 诺诺_nuonuo 共回答了30个问题
诺诺_nuonuo 共回答了30个问题 |采纳率96.7%(1)6.5g锌的物质的量为
6.5g
65g/mol =0.1mol,
故答案为:0.1mol;
(2)令参加反应的HCl为xmol,则:
Zn+2HCl=ZnCl 2 +H 2 ↑
1 2
0.1mol x
故x=0.2mol,
故答案为:0.2mol;
(3)令生成的氢气物质的量为ymol,则:
Zn+2HCl=ZnCl 2 +H 2 ↑
1 1
0.1mol y
故y=0.1mol,
所以生成氢气的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L.1年前查看全部
- 锌粉和氯化铁的反应产物请各位尽快尽快,把可能的反应方程式列举出来.本人急用!十万火急!
 xtwang05121年前1
xtwang05121年前1 -
 smileDolphin 共回答了23个问题
smileDolphin 共回答了23个问题 |采纳率100%若氯化铁过量Zn+4FeCl3=3ZnCl2+3FeCl2
若锌过量3Zn+2FeCl3=2Fe+3ZnCl2
应该对的,考试我就写对的1年前查看全部
- 关于金属活动性的问题将锌粉放入稀硫酸、硫酸铜和硫酸亚铁的混合溶液中,锌粉是先与哪种物质反应?我们老师说锌粉先和稀硫酸反应
关于金属活动性的问题
将锌粉放入稀硫酸、硫酸铜和硫酸亚铁的混合溶液中,锌粉是先与哪种物质反应?
我们老师说锌粉先和稀硫酸反应,不太明白 funday20081年前1
funday20081年前1 -
 叽咕1下 共回答了23个问题
叽咕1下 共回答了23个问题 |采纳率82.6%硫酸中的H元素的活动性比铁和铜都强,所以先和稀硫酸反应1年前查看全部
- 在CuCl 2 和MgCl 2 混合溶液中,加入过量锌粉充分反应后过滤,则滤液中的溶质是( ) A.ZnCl 2 B.
在CuCl 2 和MgCl 2 混合溶液中,加入过量锌粉充分反应后过滤,则滤液中的溶质是( ) A.ZnCl 2 B.MgCl 2 C.ZnCl 2 和MgCl 2 D.CuCl 2 、ZnCl 2 和MgCl 2  TMcgrady11年前1
TMcgrady11年前1 -
 miaojc 共回答了21个问题
miaojc 共回答了21个问题 |采纳率85.7%根据金属活动性顺序可知:Mg>Zn>Cu,由“在CuCl 2 和MgCl 2 的混合液中,加入过量的锌粉能与氯化铜完全反应生成氯化锌和铜,不与氯化镁反应;反应后过滤,滤液中一定存在氯化锌和氯化镁.
故选C.1年前查看全部
- 对于100 mL 1 mol/L盐酸与锌粉的反应,采取下列措施能使反应速率加快的是 A.用等量锌粒代替锌粉 B.改用10
对于100 mL 1 mol/L盐酸与锌粉的反应,采取下列措施能使反应速率加快的是
A.用等量锌粒代替锌粉 B.改用100 mL 0.5 mol/L盐酸 C.改用300 mL 1 mol/L盐酸 D.适当升高温度  TO雨林1年前1
TO雨林1年前1 -
 我和狗狗去流浪 共回答了21个问题
我和狗狗去流浪 共回答了21个问题 |采纳率81%D
1年前查看全部
- 硫酸铁中加入锌粉离子方程式
 行人0091年前3
行人0091年前3 -
 咖啡店里的雪糕 共回答了16个问题
咖啡店里的雪糕 共回答了16个问题 |采纳率100%Zn+2Fe3+=2Fe2+ Zn2+ (Zn少量)1年前查看全部
- 铜粉和锌粉的混合物49g恰好与49g20%的稀盐酸恰好完全反应,混合物中含锌和铜各多
铜粉和锌粉的混合物49g恰好与49g20%的稀盐酸恰好完全反应,混合物中含锌和铜各多
需要详细的过程,谢了! 花yu1年前2
花yu1年前2 -
 lovexiaoyi 共回答了18个问题
lovexiaoyi 共回答了18个问题 |采纳率72.2%49g20%的稀盐酸“恰好”完全反应!这些酸能消耗多少锌(铜不反应)呢?我想你是会做的!1年前查看全部
- 把含有氯化亚铁和稀盐酸的混合溶液与一定量的锌粉混合,哪个反应优先?还是同时发生?
 fengying957331年前3
fengying957331年前3 -
 燕山ii 共回答了23个问题
燕山ii 共回答了23个问题 |采纳率95.7%对于类似于这样的置换反应,可以遵循的原则是:在金属活动顺序表中两者间隔距离较远者首先进行反应.本题一定是锌首先于盐酸反应.
金属活动顺序表是基于电极电位从底到高排序的,两者之间的电极电位差距较大时容易发生反应.1年前查看全部
- 把铁粉、锌粉放入硝酸银和硝酸铜的混合液中,充分反应后过滤,滤出的金属中一定含有( )
把铁粉、锌粉放入硝酸银和硝酸铜的混合液中,充分反应后过滤,滤出的金属中一定含有( )
A. Fe
B. Cu
C. Ag
D. Cu和Ag mt78945612301年前4
mt78945612301年前4 -
 匣中尺水 共回答了18个问题
匣中尺水 共回答了18个问题 |采纳率83.3%解题思路:根据四种金属活动性由强到弱的顺序:锌铁铜银,当把铁粉、锌粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被锌置换出来,在银完全置换后,铜才能被置换出来;当锌反应完后铁再和混合溶液反应.四种金属活动性由强到弱的顺序:锌铁铜银,当把铁粉、锌粉加入到硝酸铜和硝酸银的混合溶液中时,锌先置换硝酸银中的银,当银被完全置换之后再置换硝酸铜中的铜,当锌完全反应完,混合溶液中还有硝酸银或硝酸铜时铁再与它们反应.因此滤出的金属中一定含有银.
故选C点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 金属放入盐的混合溶液中,总是把活动性最弱的金属最先置换完,再按由弱到强的顺序一一进行置换.1年前查看全部
- 称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子.
称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子.
称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气体积.试管甲中加入PH=3的盐酸50mL,乙加入PH=3的醋酸50mL,丙加入PH=3的醋酸50mL及少量胆矾粉末.若反应终了,生成氢气一样多,且没有剩余德锌,请用〉、=、 藏蓝色无尾鱼1年前1
藏蓝色无尾鱼1年前1 -
 lurched 共回答了22个问题
lurched 共回答了22个问题 |采纳率86.4%1.丙>乙=甲,丙是原电池,反应最快;甲乙pH相同,反应速度相同.
2.甲=乙=丙.因为氢气的量相同.
3.丙1年前查看全部
- 除铜粉中铁粉用稀硫酸可以吗?除铜粉中锌粉用硫酸铜溶液可以吗?简单说说为什么
 苦不苦想想oo1年前1
苦不苦想想oo1年前1 -
 内向的猪 共回答了21个问题
内向的猪 共回答了21个问题 |采纳率95.2%都可以
因为他们:不与原物质反应,且不引进新杂质1年前查看全部
- 氯化银+稀硫酸+锌粉, 是否可以换出 金属银? 还是浓硫酸 的效果更好?
 tc78541年前4
tc78541年前4 -
 bahajetu 共回答了15个问题
bahajetu 共回答了15个问题 |采纳率93.3%从氯化银中置换出金属银,可以利用2AgCl+2NaOH=2NaCl+Ag2O+H2O.Ag2O在300℃迅速分解;在日光中逐渐分解为银和氧.1年前查看全部
- 在CuCl2和FeCl2的混合溶液中,加入一定量的锌粉,充分反应后过滤,向滤液中放入一枚铁钉,铁钉表面有红色物质生成,则
在CuCl2和FeCl2的混合溶液中,加入一定量的锌粉,充分反应后过滤,向滤液中放入一枚铁钉,铁钉表面有红色物质生成,则留在滤纸上的物质是()
A.Cu B.Zn
C.Cu、Zn D.Cu、Zn、Mg zhangqiaofen31年前12
zhangqiaofen31年前12 -
 相约好买点82 共回答了20个问题
相约好买点82 共回答了20个问题 |采纳率90%由于在金属活动性顺序中,向滤出的固体中滴加稀盐酸时,由气体生成,说明固体中一定有排在氢前的金属,而Zn+CuCl2=Cu+ZnCl2,Zn+FeCl2=Fe+ZnCl2,Fe+CuCl2=Cu+FeCl2,反应顺序是首先Zn置换出Cu,然后Zn置换出Fe,因滤渣与稀盐酸产生气体,故一定有Cu,至少还有Fe,可能还有Zn.由此分析,一定含有Cu、Fe.
所以,选A
不懂的欢迎追问,1年前查看全部
- 锌粉和铁粉与稀硫酸的反应速率为什么锌粉更快
 duinun1年前4
duinun1年前4 -
 我爱面条 共回答了13个问题
我爱面条 共回答了13个问题 |采纳率84.6%首先我们应该清楚,一般金属具有还原性,比如,铁和锌都具有还原性.金属的活泼性:锌>铁.也就是说,锌的还原性比铁的还原性强(也就是,锌比铁更容易失去电子).而稀硫酸中的氢离子具有氧化性.所以当相同浓度的稀硫酸与锌粉和铁粉反应时,由于锌的还原性比铁强,所以更容易失电子给氢离子,所以单位时间内产生的氢气更多,也就是表现为反应更剧烈,锌块在稀硫酸中运动更剧烈,这是由于产生的氢气给锌块的反冲使其运动更剧烈!
就是这样的,还有什么不懂尽管问.1年前查看全部
- 锌粉 先与硫酸亚铁反应,还是先与硫酸铜反应?
 又是天亮1年前3
又是天亮1年前3 -
 huiliang98 共回答了15个问题
huiliang98 共回答了15个问题 |采纳率93.3%其实是同时反应的,但置换出的Fe又会跟CuSO4反应,所以可以看做先跟硫酸铜反应~
加油!1年前查看全部
- 将50g铜粉和锌粉的混合物投入50ml的某浓度稀硫酸中,不再有气泡产生时,过滤,得到滤液和残渣,将残渣干燥后
将50g铜粉和锌粉的混合物投入50ml的某浓度稀硫酸中,不再有气泡产生时,过滤,得到滤液和残渣,将残渣干燥后
称得其质量为43.5克,再向残渣中加入上述稀硫酸收集到氢气0.1克
求 1 .混合物中所含铜和锌的质量
稀硫酸中H2SO4的物质的量浓度(忽略溶液体积变化) 781770641年前1
781770641年前1 -
 打点滴的 共回答了14个问题
打点滴的 共回答了14个问题 |采纳率85.7%根据化学反应方程式可以算出这0.1g氢气所参加的铝的质量,再加上前面反应的6.5g(只有铝会与稀硫酸反应生成氢气)
进而可以算出铝的质量
进而算出铜的质量
用6.5g铝反应时算出硫酸的mol质量,然后再除以体积就算出来了1年前查看全部
- 锌粉遇到水会燃烧,如果把锌粉放到氢氟酸里会不会燃烧了?
 zippo303001年前2
zippo303001年前2 -
 daisy_dai 共回答了21个问题
daisy_dai 共回答了21个问题 |采纳率85.7%错!
1、锌粉遇到水不会燃烧.
2、氢氟酸是弱酸,锌粉放到氢氟酸里也不会燃烧;即使是遇到像硫酸这样的强酸也不会燃烧.1年前查看全部
- 32.5g的锌粉与245g稀硫酸恰好完全反应
32.5g的锌粉与245g稀硫酸恰好完全反应
求:(1)生成氢气多少克?(2)所用硫酸的质量分数(3)生成物溶液的溶质质量分数
 lisa_12131年前1
lisa_12131年前1 -
 zbwj 共回答了19个问题
zbwj 共回答了19个问题 |采纳率89.5%(1)设生成氢气的质量为x
列出化学方程式 Zn + 2Hcl = Zncl₂+ H₂↑
65 2
32.5g x
解得x=1g
(2)设 所用硫酸的质量分数为x
列出化学方程式 Zn + 2Hcl = Zncl₂+ H₂↑
65 73
32.5g 245×x
计算,得x≈14.9%
(3)稀硫酸中硫酸的质量为
245g×14.9%≈36.5g
生成物溶液的溶质质量分数为
( 36.5g+32.5g)÷(32.5g+245g)≈24.9%1年前查看全部
- 将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H 2 的质量与反应时间的关系如图所示,据图回答:
将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H 2 的质量与反应时间的关系如图所示,据图回答: 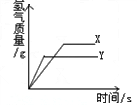
(1)金属X是 ____________ ,判断的理由为______________ 。
(2)从图中你还能获得的信息有 ___________________ (答一条即可)。 day8boy1年前1
day8boy1年前1 -
 子雯 共回答了22个问题
子雯 共回答了22个问题 |采纳率95.5%1年前查看全部
- 用锌粉在水中还原氯化银,生成的氯离子算是还原产物吗?
 xicoo1年前1
xicoo1年前1 -
 灵儿024 共回答了22个问题
灵儿024 共回答了22个问题 |采纳率95.5%不算,氯离子没有参加氧化还原反应1年前查看全部
- 100mL6mol•L-1 H2SO4跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气
100mL6mol•L-1 H2SO4跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A. 碳酸钠固体
B. 水
C. 硫酸钾固体
D. 醋酸钠固体 okrenyu1年前1
okrenyu1年前1 -
 木子蓝灵 共回答了13个问题
木子蓝灵 共回答了13个问题 |采纳率100%解题思路:减缓反应速率,应降低浓度或降低反应温度,注意不影响生成氢气总量的要求.A.加入碳酸钠固体,与硫酸反应,导致反应物浓度降低,反应速率减小,但硫酸物质的量减小,影响生成氢气的总量,故A错误;
B.加入水,相当于将硫酸稀释,会减缓反应进行的速率,但是酸中氢离子的物质的量不变,所以不影响生成氢气的总量,故B正确;
C.加入硫酸钾固体,溶液浓度不变,反应速率和氢气的总量都不受影响,故C错误;
D.加入醋酸钠固体,生成弱电解质醋酸,溶液氢离子浓度减小,反应速率减小,但不影响生成氢气的总量,故D正确.
故选BD.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查反应速率的影响因素,题目难度中等,可以根据教材知识来回答.1年前查看全部
- 又一道电离平衡填空题称等质量的三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上带导管的塞子,一定时间后
又一道电离平衡填空题
称等质量的三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上带导管的塞子,一定时间后测定生成氢气的体积.甲加入50mL PH=3的盐酸;乙加入50mL PH=3的醋酸;丙加入50mL PH=3的醋酸及少量胆矾粉末.若反应终了,生成氢气的体积一样多.将甲、乙、丙用符号“>”、“=”、“ 楚汉俊杰1年前1
楚汉俊杰1年前1 -
 ll酷酷 共回答了17个问题
ll酷酷 共回答了17个问题 |采纳率70.6%反应终了,生成氢气的体积一样多,说明消耗的锌的质量相等,由于开始时候氢离子浓度是相等的,因此
(1)开始时反应速率的大小为 甲=乙=丙
开始的时候,由于PH都是3,所以刚开始反应的时候氢离子浓度都是相等的,反应速率自然也是相等的
(2)三试管中参加反应的锌质量为 甲=乙=丙
由于生成的氢气的体积一样多,而实际的酸的量不相等的,说明酸是过量的,锌完全反应了,由于开始加入的是等质量的锌,所以三个反应消耗的锌的质量相等
(3)反应终了,所需时间为 甲>乙>丙】
随着反应的进行,盐酸是强电解质,完全电离,氢离子减少了之后就不会得到补充;而乙中醋酸是弱电解质,只能部分电离,随着反应的进行,溶液中的氢离子被消耗,同时未电离的那部分醋酸开始电离生成氢离子用于补充消耗的氢离子;丙中也是这样,唯一不同的是丙中加入了胆矾,溶解后形成的溶液中有铝离子,铝离子水解会产生氢离子,氢离子浓度越小,水解程度越大,可以补充被消耗的氢离子.所以三种溶液中甲中氢离子消耗的最快,乙次之,丙最慢.
即平均的氢离子浓度丙最大,乙次之,甲最小,所以反应时间是甲>乙>丙
(4)在反应过程中,乙、丙速率不同的理由是,胆矾中的铝离子会水解,使氢离子浓度减小的比较缓慢,而醋酸则不同,所以速率不同,具体的已经在上题中解释了^_^1年前查看全部
- 100 mL 6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加
100 mL 6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的()
A.Na2SO3(s) B.NaCl(aq) C.KHSO4(aq) D.(NH4)2SO4(s)
AD不行 BC哪个可以? zhuangwuji661年前1
zhuangwuji661年前1 -
 不复问狐狸 共回答了22个问题
不复问狐狸 共回答了22个问题 |采纳率95.5%选B.
A会反应消耗H+,不行.
D是固体,不会减小浓度.
C会电离出H+,使反应速率增大.
B可以,因为不会反应,水可以稀释溶液.1年前查看全部
- 几吨铅锌矿能浮选出多少铅,和锌粉
 outspacer1年前1
outspacer1年前1 -
 ym_1314520 共回答了19个问题
ym_1314520 共回答了19个问题 |采纳率89.5%不同的矿山产出的铅锌矿的品位是不一样的,所以给楼主介绍一下品位计算方法:
铅锌矿主要以原生矿和氧化矿两种类型产出.
原生矿表面主要呈灰、铅灰、暗绿灰色,用手指搓可以污手,铅锌两种金属主要以硫化物的形态(即PbS、ZnS)存在.在原生铅锌矿里PbS的铅质量百分含量为86.6%;ZnS的锌质量百分含量为67.1%.要知道这种矿石的品位,必须先将矿石送至有资质的分析测试单位,通过化学方式测试出PbS、ZnS的百分含量,然后再乘以各个元素的质量百分数就得到了各个元素的品位了.打个比方,现在有一块原生铅锌矿矿石,经过分析测试PbS的百分含量为20%;ZnS的百分含量为30%,那么这块铅锌矿的品位即为:Pb的品位20%×86.6%=17.32;Zn的品位30%×67.1%=20.13%.
同理,氧化矿表面呈红褐、黄褐、桔黄等色,铅锌两种金属主要以氧化化物的形态(即PbO、ZnO)存在.PbO的铅质量百分含量为92.8%;ZnO的锌质量百分含量为80.34%.测试出PbO和ZnO的百分含量再乘以铅、锌的质量百分数就得到氧化矿的品位了.
另外,原生铅锌矿的最低工业品位是Pb 0.7%~1%;Zn 1%~2%.氧化铅锌矿的最低工业品位是Pb 1.5%~2%;Zn 3%~6%.1年前查看全部
- 、(2000上海 22)取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件小充分
、(2000上海 22)取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件小充分反应,有关叙述正确的是( )
A、醋酸与锌反应放出的氢气多
B、盐酸和醋酸分别与锌反应放出的氢气一样多
C、醋酸与锌反应速率大
D、盐酸和醋酸分别与锌反应的速率一样大
BC
这个反应速率是起始的么? veeratong1年前1
veeratong1年前1 -
 寻找精神天堂 共回答了19个问题
寻找精神天堂 共回答了19个问题 |采纳率84.2%pH均等于2的盐酸和醋酸各100mL,所以两种溶液中各有0.001molH+
Zn+2H+=Zn2+ +H2
所以0.03g锌粉(0.0005mol)是少量的,所以生成的氢气一样多
因为稀释之后,醋酸电离平衡向右移动,生成更多的氢离子,而盐酸作为强电介质其电离平衡是不移动的,所以稀释之后溶液中醋酸氢离子浓度比盐酸大,所以醋酸与锌反应速率大,故选BC1年前查看全部
- 100ml 6mol/L H 2 SO 4 与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又
100ml 6mol/L H 2 SO 4 与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的 [ ]A.Na 2 SO 4 (s)
B.H 2 O
C.K 2 SO 4 溶液
D.(NH 4 ) 2 SO 4 (s) 笨笨心烦1年前1
笨笨心烦1年前1 -
 寒饮冰 共回答了14个问题
寒饮冰 共回答了14个问题 |采纳率85.7%BC1年前查看全部
- 6.5g含杂质的锌粉和足量的稀硫酸反应,生成0.21g氢气,则锌粉中含有的杂质可能是( )
6.5g含杂质的锌粉和足量的稀硫酸反应,生成0.21g氢气,则锌粉中含有的杂质可能是( )
A.Ag
B.Cu
C.Mg
D.Zn skyjaysky1年前1
skyjaysky1年前1 -
 前街女孩 共回答了11个问题
前街女孩 共回答了11个问题 |采纳率100%解题思路:铜、银在金属活动性顺序中,排在氢的后面,不能和稀硫酸反应;根据化学方程式计算,可以判断混合物的组成.采用极值法,假设全是锌计算产生的氢气的质量,和不纯的锌与稀硫酸反应生成的氢气的质量比较再结合题中的金属分析判断.金属的化学性质有:金属与氧气反应、金属与酸反应、金属与盐溶液反应;本题考查的是金属与酸反应:Zn+H2SO4=ZnSO4+H2↑;Mg+H2SO4=MgSO4+H2↑;Cu、Ag不与稀H2SO4反应.可以看到65gZn反应得到2gH2,24gMg反应得到2gH2;现在6.5g含杂质的锌粉和足量的稀硫酸反应,得到0.21gH2,那么金属混合物6.5g反应得到H2的质量大于2.1g,只有镁产生的氢气大于锌的,因此一定含有Mg.
故选:C.点评:
本题考点: 金属的化学性质;根据化学反应方程式的计算.
考点点评: 本考点中既有金属性质的应用,又有化学方程式的书写和有关的计算,考查的比较全面,只要认真分析,问题就不难解决.本考点主要出现在选择题和实验题中.1年前查看全部
- 向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充
向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体,过滤残留固体,干燥后称量,质量比加入的锌粉减轻了7.5g.试求:
(1)加入铜片的质量
(2)原硫酸的物质的量浓度. **in1年前2
**in1年前2 -
 燕子焚 共回答了15个问题
燕子焚 共回答了15个问题 |采纳率73.3%解题思路:根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.设加入Cu片的量为xmol,n(H2)=
2.24L
22.4L/mol=0.1mol,
Cu+2H2SO4(浓)
加热
.
CuSO4+SO2↑+2H2O,
xmol 2xmolxmol
CuSO4+Zn═ZnSO4+Cu
xmol xmolxmol
Zn+H2SO4═ZnSO4+H2↑
0.1mol 0.1mol 0.1mol
由Zn溶解,产生Cu质量减轻7.5g可得:65g/mol×(xmol+0.1mol)-64g/mol×xmol=7.5g
∴x=1,
∴加入铜片的质量为m(Cu)=1mol×64g/mol=64g,
原 H2SO4的物质的量浓度 c(H2SO4)=
n
V=
2×1mol+0.1mol
0.115L=18.3mol/L,
答:(1)加入铜片的质量为64g,
(2)原硫酸的物质的量浓度为18.3mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.1年前查看全部
- 在硫酸铁和硫酸铜的混合溶液中投入锌粉,出现沉淀,过滤,在沉淀中加入稀硫酸,有气泡出现,那那沉淀可能是?
在硫酸铁和硫酸铜的混合溶液中投入锌粉,出现沉淀,过滤,在沉淀中加入稀硫酸,有气泡出现,那那沉淀可能是?
铁不是比铜活泼吗?怎么还会继续反应 说时快那时迟1年前3
说时快那时迟1年前3 -
 我石头17 共回答了14个问题
我石头17 共回答了14个问题 |采纳率100%反应顺序是:锌先把三价铁离子变成二价亚铁离子,然后再把铜离子变成单质铜,最后把亚铁离子变成单质铁.
现在出现沉淀说明沉淀中有铜,沉淀可和酸反应生成气体说明还有铁甚至有过量的锌(铜不和酸反应放出气体).
所以,沉淀是铜铁混合物或铜铁锌混合物1年前查看全部
- (2012•天津模拟)一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响
(2012•天津模拟)一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2总量的是( )
①碳粉②CuO③铜粉④铁粉⑤浓盐酸⑥水.
A.①③④
B.①③⑤
C.②④⑥
D.③④⑤ 周本正1年前1
周本正1年前1 -
 zy1982423 共回答了17个问题
zy1982423 共回答了17个问题 |采纳率100%解题思路:盐酸过量锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,以此来解答.①加入碳粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入水,氢离子浓度减小,反应速率减小,故⑥错误;
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高频考点,把握常见的影响因素为解答的关键,注意加入氧化铜、Fe粉对氢气总量的影响是本题的易错点,题目难度不大.1年前查看全部
- 足量的锌粉跟500mL盐酸反应,产生的氢气在标准下的体积为1.12L,则这种盐酸的物质的量浓度为______
 cougar14121年前3
cougar14121年前3 -
 冰川天侣 共回答了17个问题
冰川天侣 共回答了17个问题 |采纳率82.4%Zn+2HCL=ZnCl2+H2
1.12/22.4=0.05mol
所以用了HCl为0.05*2=0.1mol
0.1/0.5=0.2mol/L
所以浓度为0.2mol/L1年前查看全部
- (2013•昆都仑区一模)向含有硫酸镁、硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,完全反应后过滤,滤渣为A,滤液为B.将
(2013•昆都仑区一模)向含有硫酸镁、硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,完全反应后过滤,滤渣为A,滤液为B.将A放入稀硫酸中没有气泡冒出.则下列说法不正确的是( )
A.A中一定有铜、可能有铁
B.A中只有铜
C.B中一定有硫酸镁、硫酸锌、硫酸亚铁
D.B中可能有硫酸铜 绝望的重生1年前1
绝望的重生1年前1 -
 鼠你唯一 共回答了16个问题
鼠你唯一 共回答了16个问题 |采纳率93.8%解题思路:根据金属活动性顺序.在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;据此结合题意进行分析判断.根据金属活动顺序表可知,锌比铁活泼,铁比铜活泼,锌的活动性比镁弱,所以加入一定量的锌粉,锌不能与硫酸镁溶液反应;首先锌粉和硫酸铜溶液反应,置换出单质铜,如果锌粉足量可以继续与硫酸亚铁反应置换出铁.由题意可知,向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,金属不可能是铁和锌;
A、向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,金属A不可能是铁和锌,A中一定有铜,故选项说法错误;
B、向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,A中一定有铜,金属A不可能是铁和锌,故选项说法正确;
C、滤液B中一定有硫酸镁、生成的硫酸锌、硫酸亚铁,故选项说法正确;
D、由于滤渣A中只含有金属铜,当加入的锌量极少时,硫酸铜可能有剩余,B中可能有硫酸铜,故选项说法正确.
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 本题有一定难度,主要考查了学生对金属活动顺序表的运用,在解题时要注意对定量(如一定量、过量、少量等)概念的理解和掌握.1年前查看全部
- (2013•启东市一模)向一定质量的稀硫酸中加入过量锌粉,反应的方程式是:Zn+H2SO4═ZnSO4+H2↑.下列图象
(2013•启东市一模)向一定质量的稀硫酸中加入过量锌粉,反应的方程式是:Zn+H2SO4═ZnSO4+H2↑.下列图象合理的是( )
A.
B.
C.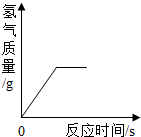
D.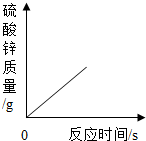
 浣夏夏1年前1
浣夏夏1年前1 -
 Frankpyyoyo 共回答了10个问题
Frankpyyoyo 共回答了10个问题 |采纳率80%解题思路:锌粒和稀硫酸反应生成硫酸锌和氢气,随着反应的进行,酸性溶液变成中性溶液,硫酸锌和氢气的质量会越来越多直至不再发生变化.A、由于是稀硫酸变成了硫酸锌溶液,溶液由酸性变成中性,故A错误;
B、由于是每向溶液中加入65份质量的锌粒只会生成2份质量的氢气扩散出来,所以,溶液的质量增加,但是反应的起点应该在纵轴上,不应该在原点;故B不正确;
C、随着反应的进行,生成的氢气会越来越多直至不再增加,故C正确;
D、随着反应的进行,生成的硫酸锌会越来越多直至不再增加,故D错误;
故选C.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用;酸的化学性质;溶液的酸碱性与pH值的关系.
考点点评: 本题难度不是很大,主要考查了金属和酸反应时引起的一系列的变化,培养学生对过程的分析能力和理解能力.1年前查看全部
- 求解一道化学题,题目如下向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列
求解一道化学题,题目如下
向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列说法正确的是( )
A.一定有锌粉剩余
B.所得溶液中一定有Zn2+和Cu2+
C.一定有银粉生成
D.所得溶液中一定有Cu2+和Ag+
答案选C
解析说可能存在一下几种情况
锌粉刚好把Ag.Cu全部置换出来了
把Ag全部置换出来,但Cu未置换出来
Ag全部置换出来,但Cu只有部分被置换出来
Ag只有部分置换出来,Cu没有置换出来.
我想问为什么锌粉会先跟AgNO3反应,而不是先跟Cu(NO3)2反应或者同时跟两种一起反应?
 bjaya1年前2
bjaya1年前2 -
 jackey512 共回答了15个问题
jackey512 共回答了15个问题 |采纳率93.3%鸡蛋壳的主要成分是(碳酸钙),某同学做了如下的家庭小实验:在一个玻璃杯中放入了大半杯白醋,将一只洗净的鸡蛋放入杯中,观察到鸡蛋慢慢沉到杯底,又慢慢浮起来,马上又下沉……这样反复运动.请通过化学和物理等知识来解释该实验现象.(鸡蛋壳的主要成分为碳酸钙,与盐酸反应产生二氧化碳气体,以气泡形式存在在蛋壳周围,使鸡蛋受到的浮力大于重力而上浮,浮出水面后气泡破裂,鸡蛋受到的浮力小于重力而下沉,如此反复).
打字不易,1年前查看全部
- 锌粉怎么与硫酸氢钠完整
 刘茂林1年前3
刘茂林1年前3 -
 124215261 共回答了18个问题
124215261 共回答了18个问题 |采纳率83.3%NaHSO4在溶液中可以电离出H+,所以具有酸的性质,可以和锌反应生成氢气.
Zn+2NaHSO4=ZnSO4+Na2SO4 + H2↑1年前查看全部
- (2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法
(2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法正确的是( )
A.滤纸上一定有Ag和Cu
B.滤纸上一定有Ag,可能有Cu、Mg
C.滤液中一定含有Zn(NO3)2、Mg(NO3)2
D.滤液中可能有Cu(NO3)2,滤纸上可能有Ag 坏鱼鱼1年前1
坏鱼鱼1年前1 -
 yuanfang6113 共回答了11个问题
yuanfang6113 共回答了11个问题 |采纳率90.9%解题思路:这类题目有个窍门,就是滤渣中一定会有最不活泼金属的单质,滤液中一定会有最活泼金属的盐溶液,也就是说滤渣中一定有银,滤液中一定有硝酸锌,但是整个过程硝酸镁并不参加反应,因为锌不如镁活泼,所以滤液中还应该有硝酸镁.
“加入一些锌粉”,根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应.A、根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应,因为锌粉的量未知,所以滤纸上一定有银,但不一定由铜,故说法错误;
B、由A的分析可知滤纸上一定有银,但不一定由铜,一定无镁,故说法错误;
C、根据金属活动性顺序镁>锌>铜>银可知:锌能置换出银所以溶液中一定含有Zn2+、但不能置换出镁所以也一定含有Mg2+,则滤液中一定含有Zn(NO3)2、Mg(NO3)2,故说法正确;
D、由C的分析可知溶液中一定含有Zn2+、Mg2+,而是否含有Ag+、Cu2+由A的分析可知:决定于放入锌粉的量,而滤纸上一定有Ag;故该项错误.
故选:C.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,利用化学反应判断物质组成的题目属于中考常考的知识点,通常在探究题中出现,考察基础知识和化学实验思想,注意仔细审题.1年前查看全部
- 弱电解质的电离平衡同体积的PH相同的盐酸 硫酸 醋酸 与足量的锌粉或碳酸钠溶液反应 问反应刚开始时和进行后的反应速率?望
弱电解质的电离平衡
同体积的PH相同的盐酸 硫酸 醋酸 与足量的锌粉或碳酸钠溶液反应 问反应刚开始时和进行后的反应速率?
望详解
刚开始 醋酸快? 大二男生1年前3
大二男生1年前3 -
 liang_wz 共回答了24个问题
liang_wz 共回答了24个问题 |采纳率83.3%刚刚开始时速度是一样的,因为各溶液的PH是一样的,所以其H+浓度是一样的.
反应一段时间以后,因为醋酸为弱酸,在H+反应后,醋酸会电离产生H+,而盐酸和硫酸为强酸,是完全电离的,所以醋酸中H+浓度会高于盐酸和硫酸.所以反应一段时间后,醋酸反应会快些.1年前查看全部
- 向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
①滤液中只有Zn2+,滤渣为Zn
②滤液中有Zn2+、Cu2+,滤渣为Cu
③滤液中有Zn2+、Cu2+,滤渣为Zn
④滤液中只有Zn2+,滤渣为Zn、Cu.
A.①②
B.②③
C.②④
D.③④ scacrise1年前1
scacrise1年前1 -
 贝壳壳 共回答了19个问题
贝壳壳 共回答了19个问题 |采纳率100%解题思路:在金属活动顺序表中锌的活动性比铜强,向CuCl2溶液加入一定量的锌粉,锌粉置换氯化铜中的铜得到铜和氯化锌,根据加入锌粉的量,分析氯化铜完全反应还是部分反应,是判断可能出现情况的根本依据.①溶液只有 Zn2+不溶物为Zn,因为加入的锌粉一定会与氯化铜反应而得到铜,固体中一定含有铜,因此该情况不可能出现;
②若加入锌粉的量不足,氯化铜部分被置换,则溶液中含有氯化铜和氯化锌,所得固体只含有铜,即溶液中有Zn2+、Cu2+,不溶物为Cu;故该情况有可能;
③溶液中有Zn2+、Cu2+,不溶物为Zn,因为锌会继续与氯化铜发生反应,故该情况不可能出现;
④若加入锌粉的过量,氯化铜全部被置换,则溶液中只含有氯化锌,所得固体含有铜及剩余的锌粉,即溶液中只有Zn2+,不溶物为Zn、Cu;故该情况有可能.
故选C点评:
本题考点: 金属的化学性质.
考点点评: 在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,这是解决此类题的关键所在.1年前查看全部
- 将锌粉和氯化银的悬浊液混合充分搅拌可以生成银和锌盐的化学方程式
将锌粉和氯化银的悬浊液混合充分搅拌可以生成银和锌盐的化学方程式
该反应属于__反应类型 fhb09911年前3
fhb09911年前3 -
 小赖-猪 共回答了12个问题
小赖-猪 共回答了12个问题 |采纳率91.7%金属活动性顺序表
K、Ca、Na、Mg、Al`Zn、Fe、Sn、Pb、H`Cu、Hg、Ag、Pt、Au
前单质置换后单质,还原性依次减弱
Zn+2AgCl==ZnCl2+2Ag
属于置换反应
置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应1年前查看全部
- (2001•黄冈)向AgNO3、NaNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后,过滤洗涤,将滤渣放
(2001•黄冈)向AgNO3、NaNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后,过滤洗涤,将滤渣放入盐酸中有气泡产生,则滤液中存在的阳离子是( )
A.Ag+、Cu2+
B.Cu2+、Zn2+
C.Zn2+、Na+
D.Zn2+、Na+ 就萌乔峰1年前1
就萌乔峰1年前1 -
 CHI9527 共回答了21个问题
CHI9527 共回答了21个问题 |采纳率95.2%解题思路:理解金属活动性顺序,及灵活的运用有关的知识活泼的金属能把不活泼的金属从盐溶液中置换出来.金属的活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)Cu、Hg、Ag、Pt、Au,由于锌在钠后,不可能把钠离子从溶液中置换出来,锌在银和铜的前面,因此锌可以和硝酸银、硝酸铜反应,由于将滤渣放入盐酸中有气泡产生,说明滤渣中有过量的锌,因此在滤液中不可能再有硝酸银和硝酸铜.
故选C.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 主要考查了金属的活动性顺序的应用,培养学生分析问题、应用所学知识解决问题的能力.1年前查看全部
- 硫酸与锌粉反应为减缓反应速率50g质量分数为32%硫酸溶液与锌粉反应,为减缓反应速率,又不影响生成氢气总质量,应加入适量
硫酸与锌粉反应为减缓反应速率
50g质量分数为32%硫酸溶液与锌粉反应,为减缓反应速率,又不影响生成氢气总质量,应加入适量的
氢氧化钾溶液 氯化钾溶液 碳酸钾溶液 水 (可多选 望大家指教) 脂猪侠5461年前1
脂猪侠5461年前1 -
 阿飞歪传 共回答了26个问题
阿飞歪传 共回答了26个问题 |采纳率96.2%水肯定可以,氯化钾也行相当于水.氢氧化钾不行会中和硫酸,碳酸钾类似会产生CO2减少氢离子.1年前查看全部
- 100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影
100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量:①Na2CO3(s)②BaCl2(aq)③KNO3(aq)④CH3COONa固体⑤NaCl(aq),其中组合正确的是( )
A.①②③
B.②④⑤
C.③④⑤
D.①③④ 小P乖1年前1
小P乖1年前1 -
 13强 共回答了18个问题
13强 共回答了18个问题 |采纳率88.9%解题思路:过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.①加入碳酸钠,与硫酸反应生成二氧化碳,减缓反应速率,硫酸不足,且影响生成氢气的总量,故①错误;
②加入氯化钡溶液对硫酸的物质的量没有影响,不影响生成氢气的总量,但H+离子浓度降低,减缓反应进行的速度,故②正确;
③加入硝酸钾,由于酸性条件下硝酸根离子具有强氧化性,不能生成氢气,故③错误;
④加入醋酸钠固体,生成弱电解质醋酸,溶液氢离子浓度减小,反应速率减小,但不影响生成氢气的总量,故④正确;
⑤加入氯化钠溶液,对硫酸的物质的量没有影响,不影响生成氢气的总量,但H+离子浓度降低,减缓反应进行的速度,故⑤正确.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,为高频考点,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.1年前查看全部
- 6.5克锌粉加入过量的20%的稀盐酸充分反应后滤除106.3克溶液 求(1)反应中生成氢气的质量是多少
6.5克锌粉加入过量的20%的稀盐酸充分反应后滤除106.3克溶液 求(1)反应中生成氢气的质量是多少
(2)加入硫酸溶液的质量为多少克.
(3)反应后溶液中剩余的硫酸溶液中硫酸的质量为多少克. 细菊灵生1年前1
细菊灵生1年前1 -
 魔力多多 共回答了17个问题
魔力多多 共回答了17个问题 |采纳率100%(1)m(H2)=2*6.5/65=0.2g
(2)m(H2SO4溶液)=106.3+0.2-6.5=100g
(3)m(H2SO4)=100*20%-98*6.5/65=10.2g1年前查看全部
- 【判断题】化学反应热效应的测定进行化学反应热效应测定时,硫酸铜溶液与锌粉加入量热计中的先后次序,对测定结果没有影响.
 wangly1372861年前1
wangly1372861年前1 -
 organdy 共回答了24个问题
organdy 共回答了24个问题 |采纳率87.5%不对.应该先加入硫酸铜溶液,再加入锌粉,这样量热计的测量才更精确.反之反应不均匀会影响测量结果.1年前查看全部
- 初三化学(关于锌粉与AgNO3和Cu(NO3)2溶液的反应?拜托各位了 3Q
初三化学(关于锌粉与AgNO3和Cu(NO3)2溶液的反应?拜托各位了 3Q
某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,将其分成A、B两份,各加入一定量的锌粉,充分反应后,过滤洗涤,分别得到滤渣和滤液; 1.将A得到的滤渣加入到稀盐酸中有气泡产生,则该滤渣中含有的物质是 ; 2.往B得到的滤液中滴加稀盐酸,有白色沉淀产生,则对应的滤渣中含有 ,滤液中含有的溶质是 . cdh9161年前2
cdh9161年前2 -
 灭螨灵 共回答了15个问题
灭螨灵 共回答了15个问题 |采纳率86.7%1、锌、铜、银 2、银; 硝酸银、硝酸铜、硝酸锌1年前查看全部
大家在问
- 1古诗之最,最难走的路
- 2x的十次方+X的五次方-2 因式分解
- 3已知数列{an}的前n项和Sn=n2+2n,若各项均为正数的等比数列{bn}满足b2=S1,b4=a2+a3,则数列{b
- 4数学题108甲乙两辆汽车分别从AB两地同时相对开出,乙车每小时行全程的10%,甲车比乙车早1/3小时到达AB两地的中点,
- 5求伤感英语日志?关于朋友的 伤感点 最好有中文翻译!谢拉
- 646号元素钯的原子结构46号元素Pd[2,8,18,18]是不是要写成[2,8,18,18,0]为什么会形成这样的结构为
- 7要做50根管口的周长为60cm的正方形钢管,钢管长5m,需要多少平方分米的钢材?
- 8Where is the panda form ?
- 9(2012•南昌)等腰三角形的顶角为80°,则它的底角是( )
- 102009年6月1日是星期一,那么,2010年6月1日是星期______.
- 11动物园售两种门票成人票,每张8元,儿童票,每张4元,现在共售出3000张票,总金额为15600元,问这两种门票各售出多少
- 12已知正比例函数y=k1x的图象与反比例函数y=k2x的图象的一个交点是(1,3).
- 13在前100个自然数中,能被2或能被三、能被5整除的数有多少个
- 14同义句:Finally the noise and shaking ended.
- 15一个边长为5CM重为10KG正方体放在一个水平桌面上,求桌面收到的压力?受力面积是多少?对桌面的压强是多少

