2℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A
 ninger992022-10-04 11:39:541条回答
ninger992022-10-04 11:39:541条回答2℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) xC(气),2min时反应达到平衡状态(温度不变),剩余了0.8mol B,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________;
X的值?

已提交,审核后显示!提交回复
共1条回复
 qqfish 共回答了19个问题
qqfish 共回答了19个问题 |采纳率94.7%- v(C)=0.4mol.L-1/2min=0.2mol/(L.min)
消耗0.2molB,生成0.8molC,所以x=4 - 1年前
相关推荐
- t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)⇌xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol•L-1.
(1)方程式中x=______
(2)用A表示该反应的反应速率为______
(3)判断该可逆反应达到平衡状态的依据是______(填序号).
a.V正(A)=V逆(B)
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.A、B、C的浓度都不再发生变化
(4)在相同实验条件下,若在同一容器中改为加入6mol A和2mol B,达到平衡后,C的物质的量为______mol.
(5)若向原平衡混合物的容器中再充入4mol C,在t℃时达到新的平衡,此时B的物质的量为______mol. angelfoot1年前1
angelfoot1年前1 -
 xiaohu1504 共回答了16个问题
xiaohu1504 共回答了16个问题 |采纳率87.5%解题思路:(1)1molB反应,剩余0.8mol,反应消耗了0.2molB,生成了0.8molC;
(2)消耗了0.2molB,同时会消耗0.2mol×3=0.6molA;
(3)a、A和B的化学计量数不同;
b、容器容积不变,气体质量不变,密度始终不变;
c、反应前后气体的化学计量数相等,气体的物质的量始终不变;
d、浓度不变化,说明生成和消耗速率相等.
(4)反应前后气体的物质的量不变,压强不变,3mol A和1mol B生成了0.8molC,则6mol A和2mol B,达到平衡生成1.6mol;
(5)根据等效平衡,加入4mol C,相当于加入了3molA、1molB.(1)根据题中信息,反应消耗了0.2molB,根据C的浓度和容器体积2L,可知生成了0.8molC,B和C的化学计量数之比为0.2:0.8=1:4,故x=4;
故答案为:4;
(2)根据化学计量数,B消耗了0.2mol,A消耗0.2mol×3=0.6mol,浓度为0.3mol/L,用A表示反应速率为:[c/t]=0.15mol•L-1min-1;
故答案为:0.15mol•L-1min-1;
(3)a、由于A和B的化学计量数不同,V正(A)=V逆(B),正逆反应速率不相等,故a错误;
b、由于容器容积不变,反应前后都是气体,故无论是否达到平衡,气体密度始终不变,故b错误;
c、反应前后化学计量数之和相等,都是气体,故物质的量始终不变,故c错误;
d、A、B、C的浓度都不再发生变化,说明生成速率和消耗速率相等,达到了平衡状态,故d正确;
故选d;
(4)由于反应前后气体的化学计量数相等,故压强对平衡没有影响,相同条件下,6mol A和2mol B,转化率不变,生成了1.6molc,故答案为:1.6;
(5)、加入4molC,相当于加入了3molA、1molB,等效平衡,故达到平衡时,B的物质的量是0.8ml+8.8mol=1.6mol,故答案为:1.6mol.点评:
本题考点: 化学平衡状态的判断;反应速率的定量表示方法;化学平衡的计算.
考点点评: 本题考查了化学平衡状态的判断及计算,注意反应前后气体的化学计量数相等的情况,压强不影响平衡,难度中等.1年前查看全部
- 在 t 摄氏度时将3mol A气体和1mol B气体通入2 L 固定体积的密闭容器中,发生反应,
在 t 摄氏度时将3mol A气体和1mol B气体通入2 L 固定体积的密闭容器中,发生反应,
3A(g)+B(g)==(可逆)4C(g),2min时反应达到平衡状态(温度不变),剩余0.8molB.若向原平衡混合物的容器中再冲入amolC,在 t 摄氏度达到新的平衡时,此时B的物质的量为____mol.
8+0.2a zpy19841年前1
zpy19841年前1 -
 玩主晶晶 共回答了13个问题
玩主晶晶 共回答了13个问题 |采纳率100%3A(g )+ B(g) == 4C(g)
开始 3 1
转化 0.6 0.2 0.8
平衡 2.4 0.8 0.8
等效于
4C(g) == 3A(g )+ B(g)
开始 4
转化 3.2 2.4 0.8
平衡 0.8 2.4 0.8
转化率为3.2/4=80%
那么再加入amolC 转化80%余下20% 就是0.2a 加上原来的0.8 就是0.8+0.2a1年前查看全部
- 在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)=2C(g),
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)=2C(g),
达到平衡时,在相同温度下次的容器内混合气体的压强是反应前的5/6,则A的转化率为?
A.67% B.50% C.25% D.5% 57zl1年前4
57zl1年前4 -
 feiping 共回答了21个问题
feiping 共回答了21个问题 |采纳率90.5%B
在相同温度下次的容器内混合气体的压强是反应前的5/6
所以n(平衡)=5/6n(起始)
所以n(平衡)=2.5mol
2A(g)+B(g)=2C(g),
2 1
2x x 2x
2-2x+x+2x=2.5
x=0.5mol
所以A的转化率为0.5*2/2=50%1年前查看全部
- 在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g) 3C(g) Δ
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)
 3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( ) 
选项 x y A 降温 A的体积分数 B 升高温度 混合气体的密度 C 再加入A B的转化率 D 再加入C A的体积分数  z5749280961年前1
z5749280961年前1 -
 我心如草 共回答了11个问题
我心如草 共回答了11个问题 |采纳率90.9%C
1年前查看全部
- 在5L的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A(g)+B(g)
在5L的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A(g)+B(g)⇌2C(g),10min后达平衡时,在相同温度下测得容器内混合气体的物质的量是反应前的[5/6],试计算:
(1)A的转化率
(2)平衡常数K
(3)10min内生成物C的反应速率. 好美好美啊1年前1
好美好美啊1年前1 -
 adpck 共回答了18个问题
adpck 共回答了18个问题 |采纳率100%解题思路:(1)设出A的转化率,然后利用化学平衡的三段式,根据在相同温度下测得容器内混合气体的物质的量是反应前的[5/6]列式计算;
(2)根据化学平衡常数表达式及达到平衡状态各组分的浓度计算出该温度下该反应的平衡常数;
(3)根据10min内C的浓度变化计算出生成物C的反应速率.(1)设A的转化率为x,根据反应列出化学平衡三段式,
2A(g)+B(g)⇌2C(g),
反应前 2mol 1mol 0
变化 2x x 2xmol
平衡时(2-2x)mol (1-x)mol 2xmol
达平衡时,在相同温度下测得容器内混合气体的物质的量是反应前的[5/6],即
(2−2x)mol +(1−x)mol+2xmol
2mol+1mol=[5/6],
解得:x=50%,
答:A的转化率为50%;
(2)反应消耗的A的物质的量为2mol×50%=1mol,达到平衡时各组分的浓度为:c(A)=[2mol−1mol/5L]=0.2mol/L,c(B)=[1mol−0.5mol/5L]=0.1mol/L,c(C)=[1mol/5L]=0.2mol/L,该温度下的化学平衡常数为:K=
c2(C)
c2(A)c(B)=
0.22
0.22×0.1=10,
答:该温度下该反应的平衡常数为10;
(3)10min内生成物C的反应速率为:v(C)=[△c/△t]=[0.2mol/L/10min]=0.02mol/(L•min),
答:10min内生成物C的反应速率0.02mol/(L•min).点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算,题目难度中等,试题涉及了转化率计算、化学平衡常数计算及化学反应速率的求算,试题培养培养离子学生的分析、理解能力和计算能力.1年前查看全部
- 向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,一定条件下发生如下反应2A(g)+B(g)⇌3C(g),经2s后达到平衡,测得C的浓度为0.6mol/L.下列说法中不正确的是( )
A.用物质A表示该反应的平均反应速率为0.2mol•L-1•s-1
B.平衡时物质A和B的转化率相等
C.平衡时物质B的浓度为0.2mol/L
D.若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 谁是谁的真命天猫1年前1
谁是谁的真命天猫1年前1 -
 mildness 共回答了14个问题
mildness 共回答了14个问题 |采纳率100%解题思路:向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L,
2A(g)+B(g)⇌3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
结合v=[△c/△t]计算.向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L,
2A(g)+B(g)⇌3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
A、v(A)=[0.4mol/L/2s]=0.2mol/(L•s),故A正确;
B、平衡时物质A的转化率为[0.4mol/L/1mol/L]×100%=40%,B的转化率为[0.2mol/L/0.5mol/L]×100%=40%,转化率相等,故B正确;
C、平衡时物质B的浓度为0.3mol/L,故C错误;
D、若将容积体积压缩为1L,反应前后气体体积不变,压强增大平衡不变,B的平衡浓度变为原来的2倍,故D正确;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算应用,主要是反应速率、转化率的计算分析,掌握基础是关键,题目较简单.1年前查看全部
- 化学等效平衡的题t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)
化学等效平衡的题
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)==x C(g),2min时反应达到平衡状态(温度不变)剩余了0.8mol B,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为0.2mol·L-1·min-1.
(2)x=______4____.
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)___C_______.
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= __________mol.
第4题是我是这样做的.
3A(g)+B(g)==x C(g)
2.4 0.8 0.8+a
3k k 4k
2.4+3k 0.8+k 0.8+a-4k
且(0.8+a-4k)/(0.8+k)=4
解得k=-0.3+1/8a
n(B)=0.5+1/8a
但答案说n(B)=0.8*(4+a)/4=(0.8+0.2a)mol
我哪里做错了? 轻薄侯1年前3
轻薄侯1年前3 -
 秋日寒流 共回答了25个问题
秋日寒流 共回答了25个问题 |采纳率96%仔细看了看又演酸了一遍,给你点提示:1、你的1、2问计算正确方程为:3A(g)+B(g)==4 C(g)这是一个反应前后气体总的 物质的量 不变的反应,所以,当温度、总体积不变时,加入amol C,相当于同倍数加入反应物,只是增大压强...1年前查看全部
- 请问标况下,1mol A气体加1mol B气体 等于2mol气体么?体积是44.8L?分子在运动 难道可以这样算?还是只
请问标况下,1mol A气体加1mol B气体 等于2mol气体么?体积是44.8L?分子在运动 难道可以这样算?还是只有双原子的 气体才能这样算!
 Dave85131年前4
Dave85131年前4 -
 干城 共回答了19个问题
干城 共回答了19个问题 |采纳率100%标况下,1mol A气体加1mol B气体 等于2mol气体.
物质的量可以直接相加的.
体积是44.8L,因为无论是纯净气体还是混合气体,Vm都是22.4L/mol
无论是什么分子都可以这样算的,只要是气体.1年前查看全部
- 在 t 摄氏度时将3mol A气体和1mol B气体通入2 L 固定体积的密闭容器中,发生反应,
在 t 摄氏度时将3mol A气体和1mol B气体通入2 L 固定体积的密闭容器中,发生反应,
3A(g)+B(g)==(可逆)4C(g),2min时反应达到平衡状态(温度不变),剩余0.8molB.若向原平衡混合物的容器中再冲入amolC,在 t 摄氏度达到新的平衡时,此时B的物质的量为____mol.
8+0.2a 逸岚8010111年前1
逸岚8010111年前1 -
 xmwldl 共回答了19个问题
xmwldl 共回答了19个问题 |采纳率89.5%冲入amolC等效于冲入3/4amolA和1/4amolB
所以冲入3mol A气体和1mol B再冲入amolc相当于冲入(3+3/4amol)A和(1+1/4amol)B
并且它是恒容恒温,所以反应平衡时反应的物质的量浓度成比例
所以答案为0.8+0.2a1年前查看全部
- 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)⇌xC(g)+D(s),t1
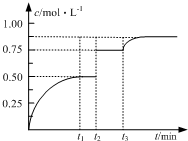 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)⇌xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)⇌xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
A.反应方程式中的x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质D
D.t1~t3间该反应的平衡常数均为4 ougeng1年前1
ougeng1年前1 -
 ninja-Z 共回答了13个问题
ninja-Z 共回答了13个问题 |采纳率76.9%解题思路:A、t2时刻C的浓度增大,浓度不变说明平衡不移动,应是增大压强造成的,压强不影响该平衡;
B、使用催化剂不影响平衡移动;
C、D为固体,减少D的量,不影响平衡移动;
D、t1~t3间温度相同,平衡常数相同,利用三段式计算t1时反应混合物的浓度,代入平衡常数计算.A、t2时刻C的浓度增大,浓度不变说明平衡不移动,应是增大压强造成的,压强不影响该平衡,所以有x=1+1=2,故A正确;
B、加入催化剂C的浓度不发生变化,故B错误;
C、D为固体,减少D的量,不影响平衡移动,C的浓度不发生变化,故C错误;
D、t1~t3间温度相同,平衡常数相同,由图可知平衡时C的浓度为0.5mol/L,则:
A(g)+B(g)⇌2C(g)+D(s),
开始(mol/L):0.5 0.5 0
变化(mol/L):0.25 0.25 0.5
平衡(mol/L):0.25 0.25 0.5
所以平衡常数k=
c2(C)
c(A)•c(B)=
0.52
0.25×0.25=4,故D正确;
故选AD.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 考查化学平衡图象、外界条件对化学平衡的影响、平衡常数等,难度中等,注意t2~t3浓度未变化是解题的关键.1年前查看全部
- 向容积为2L的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生如下反应:2A(g)
向容积为2L的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生如下反应:2A(g)+B(g)⇌3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol•L-1.下列说法中正确的是( )
①用物质A表示该反应的平均反应速率为0.2mol•L-1•s-1
②用物质B表示该反应的平均反应速率为0.2mol•L-1•s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2mol•L-1.
A.①②③
B.①③
C.②④
D.①③④ 黑原檀香1年前1
黑原檀香1年前1 -
 ratafia 共回答了12个问题
ratafia 共回答了12个问题 |采纳率91.7%解题思路:向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L, 2A(g)+B(g)⇌3C(g)起始(mol/):1 0.5 0转化(mol/):0.4 0.2 0.6 平衡(mol/):0.6 0.3 0.6结合v=△c△t计算.向容积为2L的密闭容器中充入2mol A气体和1mol B气体,则起始时A的浓度为1mol/L,B的浓度为0.5mol/L,
2A(g)+B(g)⇌3C(g)
起始(mol/):1 0.5 0
转化(mol/):0.4 0.2 0.6
平衡(mol/):0.6 0.3 0.6
①v(A)=[0.4mol/L/2s]=0.2mol/(L•s);
②v(B)=[0.2mol/L/2s]=0.1mol/(L•s);
③平衡时物质A的转化率为
0.4
1×100%=40%,B的转化率为
0.2
0.5×100%=40%,转化率相等;
④平衡时物质B的浓度为0.3mol/L.则正确的只有①③,
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,注意利用三段式法解答该类题目.1年前查看全部
- 高中化学】10.在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B
高中化学】10.在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B
10.在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g) 3C(g)ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是()
c为正确选项,d为什么不对?
 rogers598151年前1
rogers598151年前1 -
 擎天浪涛 共回答了17个问题
擎天浪涛 共回答了17个问题 |采纳率100%这是个化学平衡问题,D选项,这是个等效平衡问题,注意观察这个反应是个体积前后没有变化的反应,所以加入C的时候,建立平衡后相当于增大了压强,由于化学计量数2+1=3,所以加压平衡不动,所以A的体积分数不会变化1年前查看全部
- 向容积为2L 的密闭容器中充入2mol A 气体和1mol B气体,在一定条件下
向容积为2L 的密闭容器中充入2mol A 气体和1mol B气体,在一定条件下发生如下反应:2A(g)+B(g)⇌3C(g);经2s 后反应达平衡,测得C气体的浓度为0.6mol/L.下列说法中不正确的是( )
A.用A的浓度变化表示的该反应平均速率为0.2 mol/(L•s)
B.平衡时A与B的转化率相等
C.平衡时B的浓度为0.2 mol/L
D.其它条件不变,向容器中再加入1 mol C,达到新平衡时,C的体积分数不变 hsystc1年前1
hsystc1年前1 -
 uu司机 共回答了19个问题
uu司机 共回答了19个问题 |采纳率94.7%解题思路:依据化学平衡三段式列式计算,经2s 后反应达平衡,测得C气体的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌3C(g);
起始量(mol) 2 1 0
变化量(mol) 0.8 0.4 1.2
平衡量(mol) 1.2 0.6 1.2
A、依据反应速率概念计算得到;
B、计算AB的转化率比较;
C、依据浓度概念计算得到;
D、反应前后是气体体积不变的反应,加入C最后达到相同的平衡状态;依据化学平衡三段式列式计算,经2s 后反应达平衡,测得C气体的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌3C(g);
起始量(mol) 2 1 0
变化量(mol) 0.8 0.4 1.2
平衡量(mol) 1.2 0.6 1.2
A、用A的浓度变化表示的该反应平均速率=
0.8mol
2L
2s=0.2 mol/(L•s),故A正确;
B、计算AB的转化率比较,αA=[0.8mol/2mol]×100%=40%,αB=[0.4mol/1mol]×100%=40%,所以转化率相同,故B正确;
C、依据浓度概念计算得到平衡时B的浓度[0.6mol/2L]=0.3 mol/L,故C错误;
D、反应前后是气体体积不变的反应,加入C相当于增大容器中压强,平衡后达到相同的平衡状态,C的体积分数不变,故D正确;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡三段式计算应用,主要是我在浓度,转化率,反应速率概念的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- t℃时,将3mol A 和1mol B气体,通入体积为2L的密闭容器(容积不变),发生反应
t℃时,将3mol A 和1mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g)+B(g)⇌4C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为______.
(2)达到平衡状态时,B 物质的转化率α(B)=______,平衡常数K=______(填计算结果).
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡______(填字母)
A、向正反应方向移动B、向逆反应方向移动C、平衡不移动.
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n (B)=______ mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:______. jjs19877141年前1
jjs19877141年前1 -
 linaxiaolong 共回答了15个问题
linaxiaolong 共回答了15个问题 |采纳率80%(1)2min时反应达到平衡状态时,C 的浓度为0.4mol/L,所以v(C)=
0.4mol/L
2min =0.2mol/(L•min),
故答案为:0.2mol/(L•min);
(2)平衡时C 的浓度为0.4mol/L,由方程式可知B的浓度变化量为0.4mol/L×
1
4 =0.1mol/L,故B的转化率为
0.1mol/L
1mol
2L ×100%=20%,
3A(g)+B(g)⇌4C(g)
开始(mol/L):1.5 0.5 0
变化(mol/L):0.3 0.1 0.4
平衡(mol/L):1.2 0.4 0.4
故平衡常数k=
0. 4 4
0.4×1. 2 3 =
1
27
故答案为:20%,
1
27 ;
(3)容器的容积不变,通入氦气,反应混合物的浓度不变,平衡不移动,故答案为:C;
(4)根据(2)中三段式可知,平衡时B的物质的量分数为
0.4
1.2+0.4+0.4 =
1
5 ,向原平衡中再充入a mol C,等效为开始通入(a+4)molC,恒温恒容下,该反应前后气体的体积不变,压强增大,平衡不移动,平衡时各组分的含量不变,故n(B)=(a+4)mol×
1
5 =(0.8+0.2a)mol,故答案为:0.8+0.2a;
(5)恒温恒容下,该反应前后气体的体积不变,按化学计量数转化到左边,满足n(A):n(B)=3:1即可,故n(A)+
3
4 n(C)=
3[n(B)+
1
4 n(C)],整理的n(A)=3n(B),故满足n(A)=3n(B),n(C)>0即可,故答案为:n(A)=3n(B),n(C)>0.1年前查看全部
- 在5L体积恒定的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A(g)+
在5L体积恒定的密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A(g)+B(g)⇌2C(g)+xD (g),反应进行到4s时用D的浓度变化表示的平均反应速率为0.075mol/(L•s),B的浓度减少了1/2,试计算:
(1)以C的浓度变化表示的平均反应速率是多少?
(2)达到平衡时A的转化率是多少?
(3)x的值是多少? 明灯亮1年前1
明灯亮1年前1 -
 绿子1980 共回答了16个问题
绿子1980 共回答了16个问题 |采纳率81.3%解题思路:(1)根据反应速率=[△c/△t]计算出B的速率,再利用速率之比等于计量数之比求得C的速率;
(2)根据物质的量之比等于化学计量数之比,利用平衡时B的物质的量,求出参加反应的A的物质的量,再利用转化率的定义计算;
(3)根据D的反应速率与B的速率之比等于化学计量数之比计算x.(1)B起始的浓度为[1mol/5L]=0.2mol/L,所以B的反应速率为[0.2mol/L/4s]=0.05mol/L•s,结合化学方程式可知以C的浓度变化表示的平均反应速率等于B的反应速率的2倍,所以C的反应速率为0.1mol/L•s,
答:以C的浓度变化表示的平均反应速率是0.1mol/L•s;
(2)参加反应的A的物质的量n(A)=2n(B)=2×0.5mol=1mol,
所以A的转化率为[1mol/2mol]×100%=50%;
答:达到平衡时A的转化率是50%;
(3)因为D的浓度变化表示的平均反应速率为0.075mol/(L•s),由(1)知C的浓度变化表示的平均反应速率是0.1mol/L•s,
根据速率之比等于化学计量数之比,得2:x=0.1:0.075,解得x=1.5,
答:x的值是1.5点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,注意对基础知识的理解、积累.1年前查看全部
- 在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)⇌2C(g),达到平衡时B的浓度为0.1mol/L,则A的转化率为( ) A.67% B.50% C.25% D.缺少条件无法计算  pizizhu13151年前1
pizizhu13151年前1 -
 旗正飘飘 共回答了31个问题
旗正飘飘 共回答了31个问题 |采纳率83.9%平衡时B的物质的量为0.1mol/L×5L=0.5mol,则
2A(g)+B(g)⇌2C(g)
起始量(mol) 2 1 0
变化量(mol) 10.5 1
平衡量(mol)10.5 1
则A的转化率=
1mol
2mol ×100%=50%,
故选B.1年前查看全部
大家在问
- 1The teacher was so angry that she could_____(hard)say a word
- 2江西省2009英语听力竞赛在哪查(南昌赛区)
- 3猴子将一堆桃子放沙滩,每天日出吃,一天吃掉一半,二天又吃掉剩下的一半,直到沙滩上只剩下了一个桃子
- 4西湖电视机厂针对不同收入的家庭设计了A、B两种型号的电视机投放市场,2005年1~4月份销售情况如下表.
- 5(2012•贵州)1元硬币的外观有银白色的金属光泽,一些同学认为它可能是铁制成的.在讨论时,有同学提出:“我们可以先拿磁
- 6小明和小亮练习跑步,小明每秒钟跑6米,小亮每秒钟跑4米,小亮站在小明前面10米处,两人同时同向起跑
- 7先把鲁迅先生的名言警句补充完整,再理解意思。
- 8将乙酸逐渐滴加入到NaOH溶液中,使溶液为中性,此时
- 9运用乘法公式计算:(a+b+c)(a+b-c)
- 10求 澳网女单决赛 的英文+创造(打破)历史记录 的英文.
- 111+2+3+4+.+2015=?
- 12在如图所示的四种情境中,人对物体做功的是( )
- 13负三的2N次方乘负三分之一的2N加一次方减二乘负一的2N加一次方
- 14设平面内有△ABC,且P表示这个平面内的动点,则属于集合{P|PA=PB}∩{P|PA=PC}的点是______.
- 15英语翻译上课迟到:15分钟后:长大后:她尽量让别人听到她的声音:
