在稀硫酸中加入少量下列固体,溶液PH值变化不大的是?
 dsfdgdfsg2022-10-04 11:39:547条回答
dsfdgdfsg2022-10-04 11:39:547条回答
在稀硫酸中加入少量下列固体,溶液PH值变化不大的是?
A.氧化镁
B.碳酸钾
C.氢氧化钡
D.氧化钡
A.氧化镁
B.碳酸钾
C.氢氧化钡
D.氧化钡

已提交,审核后显示!提交回复
共7条回复
 aipeng418 共回答了18个问题
aipeng418 共回答了18个问题 |采纳率94.4%- D
本质上四种物质都可以与氢离子反映生成相应的盐,消耗溶液中的氢离子,提高溶液PH.但在本题中选用的是硫酸和固体反应,D生成的硫酸钡会将氧化钡包裹起来阻止反应进一步进行,所以PH变化不大.
氢氧化钡的溶解度比氧化钡大的多可以近似认为是液相反应,可以进行到底.
本题主要考查的是反应能否进行到底而不是生成物的水解问题.在有强酸碱存在的时候基本不用考虑由于水解引起的PH变化. - 1年前
 赌东道009 共回答了5个问题
赌东道009 共回答了5个问题 |采纳率- A。生成的硫酸镁是强酸弱碱盐显算性,其余的都显中性。
- 1年前
 波动和振动 共回答了10个问题
波动和振动 共回答了10个问题 |采纳率- 应该是D
B,C都显碱性显然不行
而D与H2SO4生成BaSO4沉淀。A与H2SO4生成MgSO4而不能去除。
所以我认为选D - 1年前
 pengpengzhu 共回答了3个问题
pengpengzhu 共回答了3个问题 |采纳率- 答案:A
A:氧化镁与稀硫酸反应生成硫酸镁(强酸弱碱盐)和水,反应后溶液显酸性
B:碳酸钾与稀硫酸反应生成硫酸钾(强酸强碱盐)和水,反应后溶液显中性
C:氢氧化钡与稀硫酸反应生成硫酸钡(难溶物)和水,反应后溶液显中性
D:氧化钡与稀硫酸反应生成硫酸钡(难溶物)和水,反应后溶液显中性
综上所述,只有A反应后溶液继续呈酸性,PH变化最小,所以答案选A... - 1年前
 tcz680 共回答了88个问题
tcz680 共回答了88个问题 |采纳率- d氧化钡与稀硫酸反应生成BaSO4覆盖在固体表面,阻止反应进行,实际基本不反应,所以溶液PH值变化不大
- 1年前
 将无同 共回答了1个问题
将无同 共回答了1个问题 |采纳率- No enough information to answer:
1, 少量 mean how much? the same weight or the same 当量 of each chemcial?
2, 稀硫酸 means 多稀 and how much 稀硫酸?
3, stiring when adding in?
4, How much you wait... - 1年前
 cctve2007 共回答了2个问题
cctve2007 共回答了2个问题 |采纳率- A、MgO+H2SO4=MgSO4+H2O 碱性氧化物与强酸反应
B、K2CO3+H2SO4=K2SO4+H2O+CO2↑
C、Ba(OH)2+H2SO4=BaSO4↓+2H2O
D、BaO+H2SO4=BaSO4↓+H2O
综上,B、强酸强碱盐和气体 C、D沉淀和水。 PH 中性
A强酸弱碱盐,(谁强显谁性,这是偶的老师当年记忆口诀)
... - 1年前
相关推荐
- 将13g锌放入100g稀硫酸溶液中恰好完全反应,可生成氢气多少mol?
 挖挖的耐耐1年前1
挖挖的耐耐1年前1 -
 胖胖月球球 共回答了19个问题
胖胖月球球 共回答了19个问题 |采纳率100%设生成氢气的质量为X
Zn + H2SO4 = ZnSO4 + H2↑
65 2
13g X
65/2=13g/X
X=0.4g1年前查看全部
- 稀硫酸敞口放置,其中水会挥发?为什么?
 sz102391年前3
sz102391年前3 -
 mjkn976 共回答了25个问题
mjkn976 共回答了25个问题 |采纳率84%只有浓硫酸有较强的吸水性,希硫酸就没浓的吸水性强,要比强的弱的多,相当于没有吸水性(酸是比较稀的情况下),由于稀硫酸里面水较多,所以水会挥发,挥发大于吸收,因此稀硫酸会挥发1年前查看全部
- 某化学探究小组称取6g镁铜合金样品于烧杯中,然后将80g稀硫酸分四次加入,充分反映后过滤,洗涤,干燥,称重,得到的实验过
某化学探究小组称取6g镁铜合金样品于烧杯中,然后将80g稀硫酸分四次加入,充分反映后过滤,洗涤,干燥,称重,得到的实验过程中有关物质的用量及质量测定记录如下.
第一次加入稀硫酸的质量 20g
剩余固体的质量4.8g
第二次加入稀硫酸的质量 20g
剩余固体的质量mg
第三次加入稀硫酸的质量 20g
剩余固体的质量2.4g
第四次加入稀硫酸的质量 20g
剩余固体的质量1.8g
问题:
1.上述表格中m的值
2.该合金中Mg的质量分数
3.实验操作结束后的溶液中溶质的化学式
4.所用稀硫酸中溶质的质量分数
5.反映后所得溶液的总质量
希望能有人给出解答过程,不要只给答案,谢谢.
 发骚男人1年前1
发骚男人1年前1 -
 zihuoyanyan 共回答了13个问题
zihuoyanyan 共回答了13个问题 |采纳率100%第四次加入稀硫酸,剩余固体的质量还减小,所以第三次加入稀硫酸,镁还过量,
前后次加入稀硫酸,每次减小0.12克,所以
1.上述表格中m=3.6克
2.该合金中Mg的质量分数=(6-1.8)/6=70%
3.实验操作结束后的溶液中溶质的化学式:MgSO4
Mg + H2SO4 = MgSO4 + H2
24 98
6-4.8=1.2 X
X=4.9g
4.所用稀硫酸中溶质的质量分数=1.2/20=6%
Mg + H2SO4 = MgSO4 + H2
24 120 2
6-1.8=4.2 Y Z
Y=21g
Z=0.35g
5.反映后所得溶液的总质量=4.8+80-0.35=84.45g1年前查看全部
- 能鉴别甲烷和乙烯的试剂是溴的四氯化碳溶液还是稀硫酸?
 lanlianhua_1231年前1
lanlianhua_1231年前1 -
 伽萘僧伽 共回答了11个问题
伽萘僧伽 共回答了11个问题 |采纳率100%溴的四氯化碳溶液.甲烷与溴的四氯化碳溶液不反应.溴的四氯化碳溶液加入乙烯颜色褪去.1年前查看全部
- 区分稀盐酸、氯化钠溶液、氢氧化钠溶液的方法 区分石灰水、氢氧化钠溶液可以滴入什么溶液 区别石灰水、氢氧化钠、稀硫酸的方法
区分稀盐酸、氯化钠溶液、氢氧化钠溶液的方法 区分石灰水、氢氧化钠溶液可以滴入什么溶液 区别石灰水、氢氧化钠、稀硫酸的方法是滴入什么溶液,相关化学方程式
 谁dd谁1年前1
谁dd谁1年前1 -
 水里窒息的鱼 共回答了22个问题
水里窒息的鱼 共回答了22个问题 |采纳率81.8%1、区分稀盐酸、氯化钠溶液、氢氧化钠溶液的方法
取三种样品,各加入少量的碳酸钠,气泡产生的,是稀盐酸.无现象的另外两种溶液.
2HCl+Na2CO3=2NaCl+H2O+CO2↑
再另个两种溶液样品,加入少量的硫酸钠,有蓝色沉淀生成是氢氧化钠,无现象是氯化钠.
2NaOH +CuSO4=Cu(OH)2↓+Na2SO4
2、区分石灰水、氢氧化钠溶液可以滴入什么溶液
通入二氧化碳气体,有沉淀生成的是石灰水,无沉淀生成的是氢氧化钠.
CO2+Ca(OH)2=CaCO3↓+H2O
3、区别石灰水、氢氧化钠、稀硫酸的方法是滴入什么溶液,相关化学方程式
通入二氧化碳气体,有沉淀生成的是石灰水.CO2+Ca(OH)2=CaCO3↓+H2O
无沉淀是另个两种溶液.在另个两种溶液中加入铁块,有气体生成是稀硫酸.无气体生成是氢氧化钠.Fe+H2SO4=FeSO4+H2↑1年前查看全部
- 把98%,密度为1.84克每立方厘米的浓硫酸稀释成3mol/l的稀硫酸100mi求浓硫酸多少毫升
 蓝子lan1年前3
蓝子lan1年前3 -
 暗夜流星天边过 共回答了20个问题
暗夜流星天边过 共回答了20个问题 |采纳率85%这是一道典型的关于溶液稀释的计算题.涉及两种浓度,综合性较强.解答这类题目的原理很简单,不管是稀释,还是不同浓度间的换算,溶质是不变的.比如:硫酸的物质的量不变——(V*1.84*98%/98 = 3*0.1或者硫酸的质量不变—...1年前查看全部
- 室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
A.改用热的稀硫酸
B.改用98%的浓硫酸
C.改用铁粉
D.改用2 mol•L-1硫酸 yoat1年前1
yoat1年前1 -
 荔枝后援1号 共回答了21个问题
荔枝后援1号 共回答了21个问题 |采纳率90.5%解题思路:增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.A.改用热的稀硫酸,温度升高,活化分子的百分数增大,反应速率增大,故A不选;
B.改用98%的浓硫酸,铁在室温下与浓硫酸发生钝化反应,不能加快生成氢气的反应速率,故B选;
C.改用铁粉,固体表面积增大,反应速率增大,故C不选;
D.改用2 mol•L-1硫酸,浓度增大,且不影响硫酸的性质,反应速率增大,故D不选.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.1年前查看全部
- 铜和氧气 稀硫酸制取硫酸铜的化学方程式拜托了各位
铜和氧气 稀硫酸制取硫酸铜的化学方程式拜托了各位
还有离子方程式 谢桥女1年前1
谢桥女1年前1 -
 就是来黑你的 共回答了17个问题
就是来黑你的 共回答了17个问题 |采纳率94.1%楼上错了.不能合起来写 应该是2Cu+O2=2CuO(条件是△) CuO+H2SO4=CuSO4+H2O1年前查看全部
- 将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H
将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全.
(1)该原电池的负极反应式为______
(2)原稀硫酸的物质的量浓度是______mol•L-1
(3)列式计算锌片减少的质量. ttQWERss1年前1
ttQWERss1年前1 -
 轩辕行素311 共回答了12个问题
轩辕行素311 共回答了12个问题 |采纳率100%解题思路:(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,写出相应的电极反应式.
(2)锌和稀硫酸反应生成氢气,根据氢气体积和硫酸的关系式计算硫酸的物质的量浓度.
(3)根据锌和氢气之间的关系式计算锌减少的质量.(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以负极上的电极反应式为:Zn-2e-=Zn2+,电池反应式为:Zn+2H+=Zn2++H2↑.
故答案为:Zn-2e-=Zn2+.
(2)设硫酸的物质的量浓度是C.
Zn+H2SO4=ZnSO4+H2↑
1mol22.4L
0.25Cmol 6.72L
C=1.2mol/L.
故答案为:1.2.
(3)设锌减少的质量为m.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m6.72L
m=19.5g
故答案为:19.5g.点评:
本题考点: 原电池和电解池的工作原理;氧化还原反应的计算.
考点点评: 本题考查了电极反应式的书写及物质的量的有关计算,难度不大,根据物质的物质的量之间的关系式来解答即可.1年前查看全部
- 向下列分散系中滴加稀硫酸,先生成沉淀继而沉淀又溶解的是:A、Fe(OH)3胶体 B、H2SiO3胶体 C、Na2SiO3
向下列分散系中滴加稀硫酸,先生成沉淀继而沉淀又溶解的是:A、Fe(OH)3胶体 B、H2SiO3胶体 C、Na2SiO3溶液D、Ba(HCO3)2溶液.
 mh1683691年前1
mh1683691年前1 -
 李小军202 共回答了18个问题
李小军202 共回答了18个问题 |采纳率88.9%答案是A
A中先是氢氧化铁聚沉,后硫酸过量,氢氧化铁溶解
B中硅酸聚沉
C中变成硅酸沉淀
D中变成硫酸钡,1年前查看全部
- 已知1 molZn与1 mol H2SO4的能量大于1 mol ZnSO4与1 mol H2的能量,但是Zn与稀硫酸的反
已知1 molZn与1 mol H2SO4的能量大于1 mol ZnSO4与1 mol H2的能量,但是Zn与稀硫酸的反应不一定放出热量
 jotony1年前2
jotony1年前2 -
 小小孩的无奈 共回答了18个问题
小小孩的无奈 共回答了18个问题 |采纳率88.9%Zn与H2SO4能发生反应是因为该反应吉布斯自由能△G0
△H=△G+△S,不能确定.Zn与稀硫酸的反应不一定放出热量(△H为焓变,决定放热与否)1年前查看全部
- 甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧
甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
 桃花梦梦1年前1
桃花梦梦1年前1 -
 ho6ho630 共回答了22个问题
ho6ho630 共回答了22个问题 |采纳率95.5%因为锌的相对原子质量为64,铁为56,故剩余的为铁,因为H2SO4的物质的量浓度为xmol·L-1,所以H2SO4为0.5xmol,反应的铁为28xg,锌为32xg,所以28x<m,32x≥m,联立解得m/28>x≥m/321年前查看全部
- 化学初三关于溶液这类的问题生铁加入足量的稀硫酸,恰好完全反应,剩余黑色固体是什么?溶液中溶质?溶液中存分析一下
 jijimela1年前7
jijimela1年前7 -
 毕恭毕敬的人 共回答了12个问题
毕恭毕敬的人 共回答了12个问题 |采纳率83.3%生铁主要是由Fe和C两种物质组成.
加入稀硫酸,恰好反应,方程式为:Fe + H2SO4===FeSO4 + H2(气体)
所以,溶液中的溶质是FeSO4.
剩余的黑色固体是不和酸反应的碳颗粒.1年前查看全部
- 把100毫升98%的浓硫酸稀释成10%的稀硫酸,需要加水多少毫升?
把100毫升98%的浓硫酸稀释成10%的稀硫酸,需要加水多少毫升?
98%的浓硫酸的密度为1.84克每立方厘米
10%的稀硫酸的密度为1.07克每立方厘米 farmerdavid1年前1
farmerdavid1年前1 -
 liyouting1 共回答了19个问题
liyouting1 共回答了19个问题 |采纳率73.7%100*1.84*98%=w*10%
m=w-100*1.841年前查看全部
- 暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸
暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸至酸性后转化为橙色溶液D.向酸化的D溶液中滴加Na2SO4溶液得绿色溶液E.向E中加入氨水得灰蓝色沉淀F,再加入氯化铵并微热则F溶解得紫红色溶液G.请给出字母所代表的物质并写出相关的反应方程式.
 yuhuat1年前2
yuhuat1年前2 -
 guiwawa0428 共回答了15个问题
guiwawa0428 共回答了15个问题 |采纳率93.3%A:Cr2O3
B:NaCrO2
C:Na2CrO4
D:Na2Cr2O7
E:Cr2(SO4)3
F:Cr(OH)3
G:[Cr(NH3)2(H2O)4]3+1年前查看全部
- 向两只烧杯中各加入含有4.9g硫酸的稀硫酸,并将烧杯分置于天平的两个托盘上调节天平使之达到平衡.若向一只烧杯中加入ag金
向两只烧杯中各加入含有4.9g硫酸的稀硫酸,并将烧杯分置于天平的两个托盘上调节天平使之达到平衡.若向一只烧杯中加入ag金属锌,试讨论a的取值范围不同时,需向另一只烧杯中加入多少克金属镁,反应完毕时,天平仍能保持平衡?
十分钟以内答复加20分,二十分钟以内答复10分, 小绵杨1年前6
小绵杨1年前6 -
 暴打美眉 共回答了13个问题
暴打美眉 共回答了13个问题 |采纳率92.3%天平仍保持平衡,说明两边加入金属的质量与放出气体的质量差值相等.
先看两个极限情况,锌刚好反应消耗3.25g,镁刚好反应消耗1.2g.
(1)a>=3.25,硫酸完全反应,放出气体质量相等,所以加入金属质量也相等.
镁的质量为a
(2)a1年前查看全部
- (水解基础问题)稀氨水逐滴加入稀硫酸中 解释得好的追加
(水解基础问题)稀氨水逐滴加入稀硫酸中 解释得好的追加
生成硫酸铵 按根离子会水解成一水合氨 那么请问这水解生成的一水合氨能和硫酸共存么? 战锋1年前2
战锋1年前2 -
 -分花拂柳- 共回答了19个问题
-分花拂柳- 共回答了19个问题 |采纳率89.5%(NH4)2SO4+2H2O==2NH3·H2O+H2SO4
首先你要知道水解是微弱进行的,硫酸铵的水解很微弱,以至生成的氨水和硫酸的浓度很小,发生化学反应需要达到一定的浓度,这里的氨水,硫酸浓度太小了,以至于不能发生反应,所以可以共存.
求采纳1年前查看全部
- 我要准确的(越快越好!)1.稀盐酸与铁锈 2.氢氧化钠与稀硫酸 3.纯碱溶液与石灰水 4.硫酸铜溶液与氢氧化钠溶液 6.
我要准确的(越快越好!)
1.稀盐酸与铁锈 2.氢氧化钠与稀硫酸 3.纯碱溶液与石灰水 4.硫酸铜溶液与氢氧化钠溶液 6.氯化铁溶液和氢氧化钠溶液反应(以上操作的试验现象反应前后) 梓辰1年前1
梓辰1年前1 -
 yipengfei 共回答了13个问题
yipengfei 共回答了13个问题 |采纳率92.3%1.铁锈渐渐消失,溶液变黄色2.没有现象3.一开始没现象,然后出现沉淀4.出现蓝色沉淀,溶液澄清5.先生成灰白色沉淀,然后沉淀变红色,溶液变无色1年前查看全部
- 除杂质 求答鉴别物质的方法如:氢氧化钠固体和氢氧化钙固体 ;氢氧化钠溶液和石灰水 ;稀盐酸和稀硫酸 ;氢氧化钠和碳酸钠
除杂质 求答
鉴别物质的方法如:氢氧化钠固体和氢氧化钙固体 ;氢氧化钠溶液和石灰水 ;稀盐酸和稀硫酸 ;氢氧化钠和碳酸钠 ;
9、除杂质的方法如:氧化铜(铁) ;食盐(泥沙) ;稀盐酸(稀硫酸) ;
氢氧化钠(碳酸钠) .氢气(氯化氢) . 七分之一1年前1
七分之一1年前1 -
 kgdapscc 共回答了10个问题
kgdapscc 共回答了10个问题 |采纳率90%氢氧化钠固体和氢氧化钙固体加入Na2CO3 (有沉淀的是氢氧化钙) 氢氧化钠溶液和石灰水(亲,石灰水就是氢氧化钙啊!)稀盐酸和稀硫酸 加入AgCl(有沉淀的是盐酸) 氢氧化钠和碳酸钠 加盐酸(有气体生成的是碳酸钠)
氧化铜(铁)用磁铁, 食盐(泥沙)蒸发结晶, 稀盐酸(稀硫酸) 加入BaCl2然后过滤,氢氧化钠(碳酸钠)加入氢氧化钙然后过滤, 氢气(氯化氢) 这个我也不知道 .1年前查看全部
- 区分稀盐酸和稀硫酸,应选用的药品是什么
 chenlei5191年前1
chenlei5191年前1 -
 janeli 共回答了26个问题
janeli 共回答了26个问题 |采纳率88.5%BaCl21年前查看全部
- 实验室制取二氧化碳不能使用稀硫酸的原因是
 小胖雪爱大头飞1年前1
小胖雪爱大头飞1年前1 -
 rilson 共回答了19个问题
rilson 共回答了19个问题 |采纳率78.9%硫酸钙是微溶于水的,多了之后会阻碍反应进行1年前查看全部
- 某校进行化学实验需要1000g质量分数为19.6%的稀硫酸,但是实验室中只有质量分数为98%的浓硫酸,则需要进行的操作如
某校进行化学实验需要1000g质量分数为19.6%的稀硫酸,但是实验室中只有质量分数为98%的浓硫酸,则需要进行的操作如下
需要浓硫酸的质量为 需要加入水的质量为 藏珍斋1年前1
藏珍斋1年前1 -
 dingshaoning 共回答了21个问题
dingshaoning 共回答了21个问题 |采纳率95.2%浓硫酸稀释一定要将浓硫酸慢慢倒入水中,并且不停的搅拌.
需要浓硫酸的量=1000*19.6%/98%=
1000克减去浓硫酸的量,就是需要加水的量.1年前查看全部
- 把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
反应的化学方程式是什么? lihao05161年前3
lihao05161年前3 -
 lapers 共回答了14个问题
lapers 共回答了14个问题 |采纳率85.7%当然是氯化铜溶液了
CuCl2+Zn=ZnCl2+Cu 置换反应
锌片溶解,铜析出1年前查看全部
- 用于造纸、纺织等行业的酸碱盐是( ) 1)熟石灰 2)食盐 3)稀硫酸 4)稀盐酸 5)纯碱
 hao87fei1年前2
hao87fei1年前2 -
 myqaq123 共回答了16个问题
myqaq123 共回答了16个问题 |采纳率93.8%5)纯碱1年前查看全部
- 稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
A2.5 B4.5 C4.9 D9.0 E10 F13
急得很 无限感激 钟吾手心1年前1
钟吾手心1年前1 -
 传说断 共回答了16个问题
传说断 共回答了16个问题 |采纳率100%10A的电流流动电解时间为64分20秒,则电量为38600C,即0.4mol电子.
2H+ +2e-=H2
所以生成0.2molH2,阴极生成气体在27度 1atm时是4.9升1年前查看全部
- 工人师傅用98%的浓硫酸,稀释成500g19.6%的稀硫酸除铁锈问需要98%的浓硫酸多少毫升,加水多少毫升
 hank00720071年前1
hank00720071年前1 -
 fei8531953 共回答了14个问题
fei8531953 共回答了14个问题 |采纳率78.6%500*19.6%=98g
98/98%=100g 98%的硫酸98%硫酸的密度是1.84
100g/1.84=54.3ml 98%的硫酸
需要加水500-54.3=445.7ML水1年前查看全部
- 铜的电解精炼为什么电解质一定得用含铜离子的盐溶液,像用稀硫酸不可以吗?
 ntlsfw1年前3
ntlsfw1年前3 -
 垂垂老去 共回答了27个问题
垂垂老去 共回答了27个问题 |采纳率81.5%一定.粗铜Cu变Cu2+,而溶液中的Cu2+变精铜
如果溶液中没有Cu2+,电解可能无法进行.因为阳极上存在的杂质也发生了电极反应,而阴极上只有铜析出.1年前查看全部
- 以锌.稀硫酸.氧化铜制取铜的方案最简单的是
 捻花郎1年前1
捻花郎1年前1 -
 kemior 共回答了16个问题
kemior 共回答了16个问题 |采纳率87.5%CuO+H2SO4=CuSO4+H2O
Zn+CuSO4=ZnSO4+Cu1年前查看全部
- 1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为
1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为C和D的混合溶液,则A、B、C、D的化学式分别是:
2. 将一定质量的镁铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaoH溶液的体
积关系如图:
求A点为多少?具体的方程式和式子)
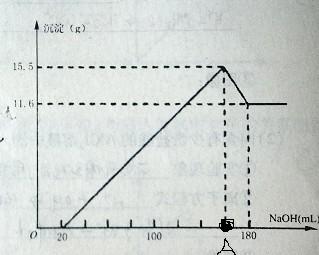
图上有个地方错了。A点的地方,沉淀是19.4... 5513600011年前1
5513600011年前1 -
 alexissui 共回答了19个问题
alexissui 共回答了19个问题 |采纳率94.7%赤铁矿被还原生成铁单质,A是Fe.Fe在纯氧中燃烧生成四氧化三铁B为Fe3O4.Fe3O4可视为FeO·Fe2O3所以C和D分别为FeSO4和Fe2(SO4)3.就是这个分析,真的没有计算方法.
2.当加入体积为20ml的时候把盐酸完全的中和了,在A点的时候生成Mg(OH)2和Al(OH)3,在180的时候Al(OH)3反应生成AlO2^-
Al(OH)3 + OH- = AlO2^- + 2H2O.得到Al(OH)3的质量为15.5 - 11.6 = 3.9g 氢氧化铝的物质的量为3.9/78 = 0.05mol,消耗氢氧根为0.05mol
11.6为氢氧化镁的质量Mg(OH)2,物质的量为11.6/58 = 0.2mol,则消耗氢氧根的量为0.4mol
共消耗氢氧化钠0.45mol.体积为0.45/5 x 1000 = 90ml
加上一开始中和盐酸的20ml,则在A点的体积为90+20 = 110ml
不够详细,很多都是文字,请见谅.
有问题欢迎追问.
希望我的回答能够对你有所帮助1年前查看全部
- 将质量分数为百分之a,物质的量浓度为c1 mol/L 的稀硫酸蒸发掉一定量的水,使其质量分数为百分之2a 此时若物质的量
将质量分数为百分之a,物质的量浓度为c1 mol/L 的稀硫酸蒸发掉一定量的水,使其质量分数为百分之2a 此时若物质的量浓度为c2 mol/L,则 C1 和 C2 关系为:A C2=2C1 B C1>2C2 C C2>2C1 D C1=2C2 .
还有一道:标准状况下 ,1体积水可溶解500体积HCl 气体,现用一只充满干燥 HCl 气体的烧瓶倒置在足量的水中,请回答下列问题:
若烧瓶中溶液没有扩散,其物质的量浓度为 :.
要有过程阿,我都想半天了,就是不会做.
还有就是顺便问一下 ,用量筒量取液体时 仰视和俯视 读数 会使测量结果 偏大或偏小的问题? 洞天杯蓝丝带1年前1
洞天杯蓝丝带1年前1 -
 fan樊 共回答了18个问题
fan樊 共回答了18个问题 |采纳率83.3%1、c
2、设烧瓶体积为V,物质的量浓度为:V/22.4/V=1/22.41年前查看全部
- 把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
A.滤出的不溶物中只有铜,不可能含铁
B.滤出的不溶物中只有铁,不可能含铜
C.滤出的不溶物中一定含有铜,也可能含有铁
D.滤液中一定含有FeSO4,不可能有CuSO4和H2SO4
为什么答案上说C也是对的呢?哪有Cu? zhangyying1年前1
zhangyying1年前1 -
 若渝 共回答了22个问题
若渝 共回答了22个问题 |采纳率90.9%稀硫酸先和氧化铜反应生成CuSO4,因为稀硫酸是一定量的所以还有铁粉剩下,剩下的铁粉再和CuSO4发生反应,所以有Cu.1年前查看全部
- 称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00m
称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00mL0.02000mol/L的KMnO4溶液滴定至终点,求软锰矿的氧化能力(以已知)(8分)
 c1dt1ybg1年前1
c1dt1ybg1年前1 -
 youbear 共回答了24个问题
youbear 共回答了24个问题 |采纳率91.7%哦,擅长领域还是化学的呢?!
5H2C2O4.2H2O :2KMnO4
5*126.07 2
X 30/1000*0.02 X = 5*126.07*0.02/2/1000 = 0.1891g
MnO2 :H2C2O4.2H2O
86.94 126.07
Y 0.1891 Y = 86.94*0.1891/126.07 = 0.1304g
……1年前查看全部
- 依次向滤纸喷洒AB两种无色试剂.当喷洒A时,纸上出现一朵红色玫瑰.喷洒B时玫瑰消失.若B稀硫酸,则A为
 冬天戴草帽1年前1
冬天戴草帽1年前1 -
 程吟 共回答了26个问题
程吟 共回答了26个问题 |采纳率92.3%A是氢氧化钠,滤纸上有无色酚酞,酚酞遇到酸不变色,遇到碱变红色,所以一开始为红色,但后来喷了稀硫酸,将氢氧化钠反应了生成正盐NaCl,所以又变无色了.1年前查看全部
- 金属活动性的比较比较Fe、Cu、Ag的金属活动性,将三种金属片用导线两两连接,插入稀硫酸中为什么不行呢?
 余向秋1年前2
余向秋1年前2 -
 ee机遇安徽 共回答了15个问题
ee机遇安徽 共回答了15个问题 |采纳率93.3%铁的金属性可以利用原电池原理分别和铜、银连接鉴别活泼性,实际上氧化还原反应中是铁和硫酸制取氢的反应;而铜、银的活泼性比氢弱,故铜银两种金属的导线相连时,两种金属都排在氢后面两个电极都相当于不活泼电极.1年前查看全部
- 化学提问网站7克含杂质的锌可以跟100克9.8%稀硫酸溶液恰好反应,计算 1,该稀硫酸的溶质的质量是多少?2,可制的多少
化学提问网站
7克含杂质的锌可以跟100克9.8%稀硫酸溶液恰好反应,计算 1,该稀硫酸的溶质的质量是多少?2,可制的多少克氧气?3,反应后所得的溶液中溶质的质量分数是多少? 734530f9af070c471年前1
734530f9af070c471年前1 -
 风流不在人知 共回答了13个问题
风流不在人知 共回答了13个问题 |采纳率76.9%1.100X9.8%=9.8 g
2.m/M=9.8/98=0.1mol
由氢守恒 0.1mol H2SO4~0.1mol H2
0.1×2=.0.2 g
3.0.1mol H2SO4~0.1molZnSO4
溶质质量0.1×65=6.5 g
总的溶液质量 100+7-0.2=106.8 g
质量分数=6.5÷106.8=6.09%1年前查看全部
- 取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
生成沉淀质量与加入氢氧化钠溶液体积关系如图,则原合金中镁的质量为?(沉淀最大值19.4克,沉淀最大值对应氢氧化钠的量为160毫升,最后沉淀为11.6克,对应氢氧化钠的量为180毫升.) 爱情三分球1年前1
爱情三分球1年前1 -
 习他们的 共回答了13个问题
习他们的 共回答了13个问题 |采纳率92.3%最后的沉淀为氢氧化镁,可以算出氢氧化镁物质的量为 11.6/58=0.2mol 所以Mg为0.2mol,为4.8g 沉淀最大时,应该是氢氧化铝和氢氧化镁共存,所以氢氧化铝质量为19.4-11.6=7.8g 其物质的量为 7.8/78=0.1mol 所以铝为2.7g1年前查看全部
- 了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
完全反应后,称得烧杯中剩余的物质质量为59.9g.
①10g+50g-59.9g=0.1g表示( )的质量
②样品中铜的质量分数为( )
③通过计算反应后的溶液溶质中有无硫酸
麻烦哪位高手给我细细讲解下,我的化学真的不好~ 2727843451年前1
2727843451年前1 -
 clmmiky 共回答了17个问题
clmmiky 共回答了17个问题 |采纳率76.5%①10g+50g-59.9g=0.1g表示( 生成氢气 )的质量
铜与稀硫酸不反应
Zn+H2SO4=ZnSO4+H2
65 98 2
x y 0.1g
65/x=98/y=2/0.1g
x=3.25g
y=4.9g
②样品中铜的质量分数为(10g-3.25g)/10g*100%=67.5%
50g*19.5%=9.75g>4.9g
③反应后的溶液溶质中有硫酸1年前查看全部
- 取配置200g24.5%的稀硫酸,需_____g98%浓硫酸和_____g水,实际操作时,取98%浓硫酸____mL(精
取配置200g24.5%的稀硫酸,需_____g98%浓硫酸和_____g水,实际操作时,取98%浓硫酸____mL(精确到1mL)
 zrpbt20051年前1
zrpbt20051年前1 -
 好久没吃串串香 共回答了13个问题
好久没吃串串香 共回答了13个问题 |采纳率92.3%浓硫酸:200×0.245=49g
49÷0.98=50g
水:200-49=151g
v=50÷1.84=27.1ml
ok、1年前查看全部
- 将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为10
将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为108克,(不考虑过滤过程中溶液质量的损失).请分析并计算
(1)反应后溶液增加的质量为参加反应▁▁▁的质量.
(2)稀硫酸中含H2SO4的质量分数. 逍遥灵子1年前1
逍遥灵子1年前1 -
 aiya3602 共回答了19个问题
aiya3602 共回答了19个问题 |采纳率89.5%(1)cuo
(2)9.8%
因为反应后的物质没有气体等会溢出的东西,故增加的即为cuo质量
因为刚好完全反应,故列出反应式即可求得h2so4有9.8g1年前查看全部
- 〔急〕市售 黄金粉 是由Zn和Cu组成的合金粉,将此粉20g与93.7g稀硫酸充分反应,可得氢气0.2g.将反应后的混合
〔急〕
市售 黄金粉 是由Zn和Cu组成的合金粉,将此粉20g与93.7g稀硫酸充分反应,可得氢气0.2g.将反应后的混合物过虑,所虑出固体中只含Cu
1.求黄金粉中Zn的质量分数 amyloveamyhoho1年前1
amyloveamyhoho1年前1 -
 48480501 共回答了20个问题
48480501 共回答了20个问题 |采纳率100%Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2
65/x=2/0.2,解得x=6.5
故黄金粉中含有6.5gZn,且质量分数为6.5/20*100%=32.5%1年前查看全部
- 小塑料块放在稀硫酸中,投入锌片塑料块上浮还是下沉
 天山牧羊1231年前3
天山牧羊1231年前3 -
 z0111 共回答了23个问题
z0111 共回答了23个问题 |采纳率95.7%上浮.
原来塑料的重力等于浮力.
投入锌片后,发生反应H2SO4 +Zn=ZnSO4 +H2
溶质是ZnSO4,密度变大,所以浮力变大.
那么塑料上浮.1年前查看全部
- 在天平的两个托盘上,分别放上质量相等的两只烧杯,在烧杯中分别加入同组成、同体积的稀硫酸(过量),此时天平呈平衡状态,然后
在天平的两个托盘上,分别放上质量相等的两只烧杯,在烧杯中分别加入同组成、同体积的稀硫酸(过量),此时天平呈平衡状态,然后分别向两只烧杯中加入等质量的碳酸钠和碳酸氢钠,反应终止后,天平两端的情况是?
A、 放Na2CO3的一端重
B、同样重
C、放NaHCO3的一端重
D、无法判断 乖乖的呆呆1年前4
乖乖的呆呆1年前4 -
 玻璃心馨 共回答了13个问题
玻璃心馨 共回答了13个问题 |采纳率92.3%因为酸过量,则产生气体的多少决定天平的高低.因为碳酸钠与碳酸氢钠质量相同,而摩尔质量碳酸钠是106g/mol,碳酸氢钠是84g/mol,所碳酸氢钠产生的CO2多.则放碳酸钠的一端重.1年前查看全部
- 关于铜片和稀硫酸的反应铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?氯化钠
关于铜片和稀硫酸的反应
铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?
氯化钠 硝酸钾 硫酸钠 碳酸钠? 长青131年前2
长青131年前2 -
 korla31g 共回答了21个问题
korla31g 共回答了21个问题 |采纳率81%硝酸钾
NO3-在酸性环境下具有硝酸性质,具有强氧化性
故加入硝酸钾后,会发生氧化还原反应
3Cu+8H+ +3NO3-=2Cu2+ +2NO+4H2O1年前查看全部
- 为了测定奶粉中蛋白质的含量,我们把蛋白质中的氧元素完全转化成氨气(化学式:NH3),再有稀硫酸吸收氨气,反应的化学方程式
为了测定奶粉中蛋白质的含量,我们把蛋白质中的氧元素完全转化成氨气(化学式:nh3),再有稀硫酸吸收氨气,反应的化学方程式为:
2nh3+h2so4=====(nh4)2so4,再根据蛋白质中氮元素的质量分数(约为16%)进行计算.
某监测站对某品牌奶粉检测时,取一定量该奶粉样品分解其中的蛋白质,产生的氨气用10g溶质质量分数为4.9%的稀硫酸恰好完全吸收.计算并回答下列问题.
(1)经过这种方法测的该奶粉样品中约含有蛋白质的质量是多少?(计算结果精确到0.01g,下同)
(2)如果该奶粉样品,有不法商贩向其中添加1g三聚***胺(c3n6h6),相当于增加蛋白质的质量为多少?
要过程啊! 逍遥情愿1年前1
逍遥情愿1年前1 -
 wangyang32 共回答了17个问题
wangyang32 共回答了17个问题 |采纳率88.2%根据 那个方程式 2NH3 +H2SO4 == (NH4)2SO4 10克 百分之4.9 的稀硫酸 10*百分之4.9 得到 稀硫酸的质量0.49克 稀硫酸的物质的量是98克每MOL 0.49 就是 0.05 MOL 根据方程式 计算 氨气 再算蛋白质
2 NH3 + H2SO4 =(NH4)2SO4
34 98 132
X 0.49
可求出 X=0.17g
(1)0.86
(2)0.831年前查看全部
- 33.如图是一个用来测定液密度的装置,A管插人的甲烧杯中,B管插人盛放加有紫色石蕊试液的稀硫酸的乙烧杯中
 nnlx1年前1
nnlx1年前1 -
 然犯 共回答了24个问题
然犯 共回答了24个问题 |采纳率91.7%A为两端开口的试管,B为一轻塑料片,烧杯中装有盐水,B在盐水中的深度是你的问题说清楚了吗?如果开始时将B堵在试管的一段,放在盐水中,由于盐水1年前查看全部
- 如何检验一种溶液是稀硫酸请带上化学方程式
 猴塞因1年前3
猴塞因1年前3 -
 gxwst 共回答了17个问题
gxwst 共回答了17个问题 |采纳率100%先加Ba(OH)2,如果得到不溶于酸的固体,说明有SO4(2-)根
再加Na2CO3,如果生成能使澄清石灰水变浑浊的气体,就说明有H+
所以就是H2SO4
Ba(OH)2+H2SO4=2H20+BaSO4↓
Na2CO3+H2SO4=H20+CO2↑+Na2SO4
CO2+Ca(OH)2=CaCO3↓+H201年前查看全部
- 现用质量分数为98%的浓硫酸配制280g质量分数为14%的稀硫酸时,需要在浓硫酸中加____毫升水.
 清茶微风1年前1
清茶微风1年前1 -
 xunuonn 共回答了10个问题
xunuonn 共回答了10个问题 |采纳率80%设需要98%的浓硫酸的质量为X
则:X*98%=280g*14% X=40克
水的质量为:280-40=240克
水的体积为240/1=240毫升1年前查看全部
- 氧化铜加稀硫酸 加热硫酸铜晶体 搅拌食盐 三个实验的实验报告单,
 wzhao888881年前1
wzhao888881年前1 -
 edwardzs 共回答了17个问题
edwardzs 共回答了17个问题 |采纳率82.4%CuO+H2SO4=CuSO4+H2O 固体氧化铜被溶解掉了生成蓝色溶液CuSO4
CuSO4.5H2O=△=CuSO4+5H2O 熔融产生水,持续加热水分完全蒸发,只剩下CuSO4
水中加入食盐的话搅拌可以使溶解更快1年前查看全部
- 除去二氧化氮中的少量氨气,用浓硫酸还是稀硫酸,为什么?
 zier1年前4
zier1年前4 -
 yc_nicson 共回答了5个问题
yc_nicson 共回答了5个问题 |采纳率100%用浓硫酸; 稀硫酸含水多会和二氧化氮反应H2O+3NO2=2HNO3+NO .浓硫酸含水极少不和二氧化氮反应、但和氨反应2NH3+H2SO4=(NH4)2SO41年前查看全部
大家在问
- 1如图所示,用电流表测灯L 1 中的电流的四幅电路图中,正确的是
- 2l am Mike.l have a new schoolbag是什么意思?
- 3尊重别人就是 尊重自己是谁说的要写作文
- 4已知ab∈0派,且tana.tanb是方程x∧2-5x+6的两根,求a+b
- 5英语翻译1.菠菜营养丰富2橄榄可以做成油,也可以直接食用3那个东西看起来像个动物
- 6若2分之与五分之二互为倒数,求x的值.
- 7若三角形ABC的三边a,b,c满足(a-b):(c-b):(a+b)=7:1:18 判断这个三角形的形状.
- 8从圆x^2+y^2=9外一点P(3,2)向该圆引切线,求切线的方程.
- 9巾帼不让须眉
- 10根据短文内容和首字母提示完成空白内所缺单词。 Kate Smith (
- 11关于温度、热量、内能,下列说法正确的是( )
- 12在实验室里制取氧气常用以下三种方法:
- 13五年级作文我这个人第一节具体形容我五官中的一个,然后再写关于我这个器官的一件事,
- 14蚕阅读答案她在自己的生活中织下了一个厚厚的茧. 那是用一种细细的、柔韧的、若有若无的丝织成的.是痛苦的丝织成的. 她埋怨
- 15因式分解 6(x-3)²-24
