氮化硅的化学式为?
 l_t_l2022-10-04 11:39:541条回答
l_t_l2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 reinhardczh24 共回答了12个问题
reinhardczh24 共回答了12个问题 |采纳率66.7%- Si3N4
- 1年前
相关推荐
- (2012•梧州模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可通过以下反应制得:3SiO2+6C+2N2
(2012•梧州模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可通过以下反应制得:3SiO2+6C+2N2
Si3N4+6CO,有关说法不正确的是( )高温 .
A.该反应的平衡常数表达式为K=c6(CO) c2(N2)
B.若增大压强,则上述平衡向逆反应方向移动
C.该反应中只有N2是氧化剂
D.该反应在高温下反应,△H一定大于零 湖光月夜1年前1
湖光月夜1年前1 -
 xiaowu1532 共回答了21个问题
xiaowu1532 共回答了21个问题 |采纳率90.5%解题思路:A、化学平衡常数K=[生成物平衡浓度系数次幂之积/反应物平衡浓度系数次幂之积];
B、增大压强,平衡向着气体系数和减小的方向进行;
C、化合价降低元素所在的反应物是氧化剂;
D、根据反应能否自发进行的判据△H-T△S<0来判断.A、3SiO2+6C+2N2
高温
.
Si3N4+6CO的平衡常数表达式K=
c6(CO)
c2(N2),故A正确;
B、增大压强,平衡向着气体系数和减小的方向即逆方向进行,故B正确;
C、化合价降低的元素是N,所在的反应物氮气是氧化剂,故C正确;
D、在高温下进行的反应,不一定是吸热反应,故D错误.
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查学生影响化学平衡移动的因素知识,注意知识的迁移和应用是关键,难度不大.1年前查看全部
- 下列关于环境、能源和材料的叙述中不正确的是( ) A.氮化硅、光导纤维均属于新型无机非金属材料 B.日本福岛核电站泄漏
下列关于环境、能源和材料的叙述中不正确的是( ) A.氮化硅、光导纤维均属于新型无机非金属材料 B.日本福岛核电站泄漏的放射性核素 131 I与 127 I属于同素异形体 C.在西部和沿海地区兴建风力发电站,可缓解能源短缺问题 D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀  红色羊毛衫是母狗1年前1
红色羊毛衫是母狗1年前1 -
 closed1 共回答了18个问题
closed1 共回答了18个问题 |采纳率77.8%A、玻璃、沙子、水泥等属于传统的无机非金属材料,氮化硅、光导纤维均属于新型无机非金属材料,故A正确;
B、 五3五 I与 五27 I的质子数相同而中子数不同,均为碘元素的不同核素,互为同位素,故B错误;
C、西部和沿海地区有丰厚的风能资源,可以用来发电,在此地兴建风力发电站,可缓解能源短缺问题,故C正确;
D、铁质器具表面刷漆或将其置于干燥处保存,均能使铁与氧气和水隔绝有利于防止铁生锈,故D正确.
故选B.1年前查看全部
- (2008•溧水县二模)化学科学中最具有创造性的工作就是设计和制备新物质,为人类造福.化学科技工作者合成的氮化硅(Si3
(2008•溧水县二模)化学科学中最具有创造性的工作就是设计和制备新物质,为人类造福.化学科技工作者合成的氮化硅(Si3N4)是一种新型陶瓷材料的主要成分.氮化硅属于( )
A.单质
B.化合物
C.有机物
D.混合物 愚人ss了ss1年前1
愚人ss了ss1年前1 -
 明月是前身 共回答了23个问题
明月是前身 共回答了23个问题 |采纳率100%解题思路:A、根据单质的定义和氮化硅的组成判断.
B、根据化合物的定义和氮化硅的组成判断.
C、根据有机物的定义和氮化硅的组成判断.
D、根据混合物的定义和氮化硅的组成判断.A、单质是由同种元素组成的纯净物,而氮化硅是由氮、硅两种元素组成的,所以错误.
B、化合物是由不同种元素组成的纯净物,氮化硅有固定的化学式(或组成),是一种纯净物,是由氮、硅两种元素组成的,所以正确.
C、有机物是指含碳的化合物(碳的氧化物、碳酸、碳酸盐除外),而氮化硅中不含碳元素,所以错误.
D、混合物是由不同物质组成的,而氮化硅有一个化学式,结构和组成固定,是纯净物,所以错误.
故选B.点评:
本题考点: 单质和化合物的判别;物质的简单分类;有机物与无机物的区别.
考点点评: 物质的分类知识是初中化学的教学难点,也是考查的热点之一,透彻理解有关概念,明确概念间的相互关系是解题的关键.1年前查看全部
- 氮化硅与氢氟酸反应的方程式
 131452771年前1
131452771年前1 -
 yukuangzhang 共回答了18个问题
yukuangzhang 共回答了18个问题 |采纳率77.8%Si3N4+4HF+9H2O=====3H2SiO3(沉淀)+4NH4F1年前查看全部
- (2011•闵行区模拟)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
(2011•闵行区模拟)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
A.氮化硅的摩尔质量为140g
B.氮化硅中Si、N两种元素的质量比为3:4
C.140g氮化硅中含氮元素的质量为14g
D.氮化硅中氮元素的质量分数为40% iexyc0__7_ww3fe71年前1
iexyc0__7_ww3fe71年前1 -
 albert2681 共回答了15个问题
albert2681 共回答了15个问题 |采纳率86.7%解题思路:根据氮化硅的化学式为Si3N4,利用元素原子的相对原子质量和原子个数来进行计算.A、因氮化硅的相对分子质量=28×3+14×4=140,所以氮化硅的摩尔质量是140g/mol;故不正确;
B、氮化硅中Si、N两种元素的质量比为28×3:14×4=3:2,故不正确;
C、140g氮化硅中含氮元素的质量=140g×[14×4/140]×100%=56g,故不正确;
D、氮化硅中氮元素的质量分数为 [14×4/28×3+14×4]×100%=40%,故正确.
故选D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;元素质量比的计算;元素的质量分数计算;物质组成的综合计算.
考点点评: 本题是有关化学式的简单计算.根据化学式逐项进行计算,即可正确选择.1年前查看全部
- 已知氮、硅原子结构示意图如图. 氮化硅是一种新型陶瓷材料的
已知氮、硅原子结构示意图如图. 

氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等.
试写出氮化硅的化学式_ _________ .
医学研究表明:偏硅酸有软化血管的作用,对心脏病、高血压有一定疗效.偏硅酸是二元酸,又是含氧酸.则偏硅酸的化学式为 _________ . 也曾因梦送钱财1年前1
也曾因梦送钱财1年前1 -
 红糖棒棒 共回答了22个问题
红糖棒棒 共回答了22个问题 |采纳率81.8%Si 3 N 4 ;H 2 SiO 3 .1年前查看全部
- 怎样根据氮、硅的原子结构示意图推测氮化硅的化学式?
 myecjtu1年前2
myecjtu1年前2 -
 民办老师 共回答了20个问题
民办老师 共回答了20个问题 |采纳率100%首先你要明白地是,高中提到的原子结构示意图只是粗略地表示原子核外电子分布,(比如,实际上L层的8个电子的能量并不相同).而且高中的化学认为共价化合物(如HCl)的形成是由于氯原子外层达到8电子稳定结构,但是实际的情况并不是这样的.而且氮化硅是原子晶体,他的化学式是根据其结构中的最小晶胞所含的氮原子数和硅原子数来确定的
氮化硅结构是正八面体,它的的两个顶是Si,然后连着Si的是四个N,也就是八面体的中间,然后以这四个N产生的平面的中心,就是最后那个Si了.至于为什么是正八面体,这要考虑到轨道杂化的知识,感兴趣的话可以去找大学的普通化学或有机化学的教材,或者奥赛书来看看1年前查看全部
- (2014•海港区一模)下列关于耐高温新型陶瓷材料氮化硅(Si3N4)的叙述正确的是( )
(2014•海港区一模)下列关于耐高温新型陶瓷材料氮化硅(Si3N4)的叙述正确的是( )
A.氮化硅中氮元素的化合价为+4
B.氮化硅是有机高分子合成材料
C.氮化硅中硅与氮的质量比为3:4
D.氮化硅中氮元素的质量分数为40% daphne2261年前1
daphne2261年前1 -
 8291101 共回答了12个问题
8291101 共回答了12个问题 |采纳率100%解题思路:A、根据化合价原则进行分析.
B、有机高分子合成材料是指人工合成的有机高分子(相对分子质量很大的有机物)材料,据此进行分析判断.
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
D、根据化合物中元素的质量分数公式进行分析解答.A、硅元素显+4价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:3×(+4)+4x=0,则x=-3价,故选项说法错误.
B、氮化硅不含碳元素,不属于有机物,不是有机高分子合成材料,故选项说法错误.
C、氮化硅中硅与氮的质量比为(28×3):(14×4)≠3:4,故选项说法错误.
D、氮化硅中氮元素的质量分数为[14×4/28×3+14×4]×100%=40%,故选项说法正确.
故选:D.点评:
本题考点: 有关元素化合价的计算;元素质量比的计算;元素的质量分数计算;有机高分子材料的分类及鉴别.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用有机高分子合成材料、化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 氮化硅是一种新型的耐高温耐磨材料
氮化硅是一种新型的耐高温耐磨材料
Si3N4 氮化硅为什么是原子晶体? 一枚子1年前1
一枚子1年前1 -
 粗粗大禹 共回答了11个问题
粗粗大禹 共回答了11个问题 |采纳率90.9%鄙人认为:首先构成Si3N4晶体的最小粒子是原子,晶体内不含任何分子和离子,这决定了它是原子晶体.看到这你可能会问为什么构成它的是原子或者我怎么知道构成它的就是原子呢?1:将该晶体熔融,发现此时的晶体不能导电,则排除它是由离子构成的,若为离子构成的熔融状态下可导电,因为离子发生了定向移动形成了电流,这是离子晶体所特有的性质;2:由于熔融可发现其熔点较高,则排除它是分子晶体,即不是有分子构成的,因为分之晶体熔点相对较低,例如干冰融化所需要的温度,你可以它为标杆比较并确定Si3N4熔融所需的温度是高是低;3:Si和N都是非金属元素,根本提不到属于金属晶体;(构成物质的粒子只有三中,分子、原子、离子,由此以断定由原子构成)最后,它与SiO2相似,N和O同周期且相临,无外乎把O 原子换成了N原子,所以仍是原子晶体.一般于Si有关的化合物所形成的晶体一般都是原子晶体.例如SiC等.1年前查看全部
- (2013•房山区一模)碳化硅(SiC)、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在
(2013•房山区一模)碳化硅(SiC)、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
(1)Al的原子结构示意图为______;Al与NaOH溶液反应的离子方程式为______.
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为______.
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g)△H<0高温
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g.
①H2的平均反应速率是______ mol/(L•min).
②平衡时容器内N2的浓度是______mol•L-1.
③SiCl4(g)的转化率是______.
④若按n(SiCl4):n(N2):n(H2)=3:2:6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减”或“不变”).
⑤在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现.下列四种投料方式,其中可行的是______.
选项 投料方式 A n(SiCl4):n(N2):n(H2)=1:1:2 B n(SiCl4):n(N2):n(H2)=1:2:2 C n(SiCl4):n(N2):n(H2)=3:2:2 D n(SiCl4):n(N2):n(H2)=2:1:3  chen138181629651年前0
chen138181629651年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•赤峰模拟)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
(2013•赤峰模拟)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g)△H<0上述反应达到平衡后,下列说法正确的是( )高温 .
A.其他条件不变时,增大Si3N4物质的量,平衡向左移动
B.其他条件不变,增大压强,平衡常数K减小
C.其他条件不变,增大H2物质的量,H2的转化率增大
D.其他条件不变,移走部分HCl,逆反应速率先减小后增大 海豚井宝宝1年前1
海豚井宝宝1年前1 -
 啊呀呦 共回答了14个问题
啊呀呦 共回答了14个问题 |采纳率92.9%解题思路:该反应为放热反应,气体体积增大的反应,则加压平衡逆向移动,升高温度平衡逆向移动,增大生成物的浓度平衡逆向移动,但氮化硅为纯固体,改变用量平衡不移动.A、其他条件不变时,增大Si3N4物质的量,氮化硅为纯固体,改变用量平衡不移动,故A错误;
B、其他条件不变,压强增大,平衡逆向移动,但温度不变,平衡常数K不变,故B错误;
C、其他条件不变,增大H2物质的量,本身的转化率减小,故C错误;
D、其他条件不变,移走部分HCl,生成物的浓度减小,逆反应速率减小后来平衡正向移动,生成物的浓度增加,逆反应速率增大,故D正确;故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查外界条件对化学反应速率的影响和平衡的影响,综合性强,但比较容易.1年前查看全部
- 四氯化硅中硅的化合价氮化硅Si3N4中氮的化合价
 欢子Ю1年前7
欢子Ю1年前7 -
 dadog76 共回答了18个问题
dadog76 共回答了18个问题 |采纳率100%因为硅要和4个氯形成离子键所以四氧化硅中的硅是正4价,以此类推氮化硅中的氮是+3价1年前查看全部
- 判断对错.并说明理由.1.乙醇分子是由三种元素组成的有机物.2.氮化硅中氮元素的质量分数为60%.(我怎么算都不是这个答
判断对错.并说明理由.
1.乙醇分子是由三种元素组成的有机物.
2.氮化硅中氮元素的质量分数为60%.(我怎么算都不是这个答案,可为什么标准答案上这个就对呢?) QQ中毒1年前1
QQ中毒1年前1 -
 我怎么爱你 共回答了15个问题
我怎么爱你 共回答了15个问题 |采纳率86.7%1.错,应是三种原子组成的分子或改成乙醇是由三种元素组成 这句话也是病句,分子不是有机物 2.答案错了.si3n4硅质量分数才是60%1年前查看全部
- (2011•江苏二模)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C
(2011•江苏二模)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2
Si3N4+6CO.下列说法正确的是( )高温 .
A.氮化硅晶体属于分子晶体
B.氮化硅中氮元素的化合价为-3
C.上述反应中,N2是还原剂,SiO2是氧化剂
D.上述反应中,每生成1mol Si3N4,N2得到6mol电子 popow1年前1
popow1年前1 -
 lcx5613568 共回答了11个问题
lcx5613568 共回答了11个问题 |采纳率81.8%解题思路:A.根据晶体含有的微粒确定其晶体类型;
B.根据化合物中各元素化合价的代数和为0计算氮元素化合价;
C.在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
D.根据氮化硅和转移电子之间的关系式计算.A.氮化硅晶体中的构成微粒是原子,原子间以共价键相结合构成原子晶体,故A错误;
B.氮化硅中氮元素的电负性大于硅元素,所以氮元素显负价,硅元素显正价,硅元素的化合价是+4价,化合物中各元素的化合价代数和为0,所以氮元素的化合价是-3价,故B正确;
C.该反应中,氮气得电子,碳失电子,二氧化硅中各元素的化合价不变,所以氮气是氧化剂,碳是还原剂,故C错误;
D.上述反应中,每生成1mol Si3N4,N2得到2×2×[0-(-3)]=12mol电子,故D错误;
故选B.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题关键,注意氮化硅中氮元素的化合价,为易错点.1年前查看全部
- (2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3S
 (2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
(2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)高温 .
(1)该反应的平衡常数表达式为K=K=
,[c(CO)]6 [c(N2)]2 K=;
,[c(CO)]6 [c(N2)]2
(2)若知上述反应为放热反应,则升高温度,其平衡常数值______(选填“增大”、“减小”
或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
(3)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:
若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是______;图中t6时引起变化的条件是______;图中表示平衡混合物中CO的含量最高的一段时间是______. zcqmig1年前1
zcqmig1年前1 -
 yanmingth 共回答了24个问题
yanmingth 共回答了24个问题 |采纳率95.8%解题思路:(1)根据平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积计算;
(2)反应放热,△H<0,根据升高温度平衡移动的方向判断平衡常数的变化;根据速率之比等于化学计量数之比计算反应速率;
(3)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在反应向逆反应之前衡混合物中CO的含量最高;(1)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=
[c(CO)]6
[c(N2)]2,故答案为:K=
[c(CO)]6
[c(N2)]2;
(2)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=[1/3]×v(CO)=[1/3]×18mol•L-1.min‑1=6 mol•L-1.min‑1,
故答案为:减小;6 mol•L-1•min-1;
(3)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,
故答案为:升高温度或缩小体积;加入了催化剂;t3~t4.点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义;用化学平衡常数进行计算.
考点点评: 本题考查化学平衡的移动,难度不大,做题时注意外界条件对化学平衡的影响.1年前查看全部
- (17分)氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO 2 + 6C
(17分)氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO 2 + 6C + 2N 2
 Si 3 N 4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si 3 N 4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应是 (填“吸热”或“放热”)反应。
(3)在一定温度下,上述反应在4L密闭容器内进行,用M、N两种物质描述其物质的量随时间变化的曲线如图⑶所示:
①M、N表示的物质分别为 、 。
②比较t 2 时刻,正逆反应速率大小 (正)
(正)  (逆) 。
(逆) 。
(填“>”、“=”、“<”)。.
③若t 2 =2min,计算反应开始至t 2 时刻,M的平均化学反应速率为 。
④t 3 时刻化学反应达到平衡时反应物的转化率为 。
(4)①某种氢燃料电池是用固体金属氧化物陶瓷作电解质,某电极上发生的电极反应为:A极H 2 -2e - +O 2 - ===H 2 O;则A极是电池的 极 (填“正”或“负”)。
②上述合成氮化硅的反应产生的尾气不能排放,经过处理以后可以用下图所示的仪器测量尾气中CO的含量。多孔电极中间的固体氧化锆—氧化钇为电解质,这种固体电解质允许O 2- 在其间通过,其工作原理如图⑷所示,其中多孔Pt电极a、b分别是气体CO、O 2 的载体。
Ⅰ.该电池的正极为 (填a或b);O 2 流向 (填 “正极”或“负极”)
Ⅱ.该电池的正极反应式为 ,负极反应式为 。 pure2181年前1
pure2181年前1 -
 汤潜 共回答了22个问题
汤潜 共回答了22个问题 |采纳率95.5%(1)C;Si 3 N 4 ;(2)放热 ;(3)① CO 、N 2 ; ② (正) > (逆) ③ 1mol/(L·min);④ 75% ;(4)① 负 。②Ⅰ. b ;负极; Ⅱ.正极反应为O 2 +4e - ===2O 2 - ;负极反应为CO-2...1年前查看全部
- 新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,工业上制氮化硅的方法是:用单质硅(
新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,工业上制氮化硅的方法是:用单质硅(Si)和氮气在高温条件下反应生成氮化硅,写出该反应的化学方程式3Si+2N2
Si3N4高温 .3Si+2N2,该反应的基本类型是______反应.
Si3N4高温 . wheel92001年前1
wheel92001年前1 -
 3566666 共回答了23个问题
3566666 共回答了23个问题 |采纳率73.9%解题思路:根据书写化学方程式的方法及反应类型来分析解答.由题意,反应物为硅和氮气,生成物为氮化硅,反应条件为高温,故反应的化学方程式为:3Si+2N2
高温
.
Si3N4;该反应符合多变一的特点,故属于化合反应;
故答案为:3Si+2N2
高温
.
Si3N4;化合点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;反应类型的判定.
考点点评: 明确化学方程式的书写及反应类型的判断是解答本题的关健.1年前查看全部
- 工业制取氮化硅的化学方程式3Si+2N2==Si3N4,该反应属于何种类型?
 溯和流1年前1
溯和流1年前1 -
 一种生话方式不行 共回答了16个问题
一种生话方式不行 共回答了16个问题 |采纳率81.3%化合反应1年前查看全部
- 有谁知道四氯化硅SiCl4和氮气N2在氢气H2的保护下反应制取氮化硅的方程式
 水花语1年前1
水花语1年前1 -
 PLMsir 共回答了21个问题
PLMsir 共回答了21个问题 |采纳率95.2%也可用化学气相沉积法,使SiCl4和N2在H2气氛保护下反应,产物Si3N4积在石墨基体上,形成一层致密的Si3N4层.此法得到的氮化硅纯度较高,其反应如下:
SiCl4+2N2+6H2→Si3N4+12HCl1年前查看全部
- 化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶
化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.已知:6Ag(s)+O3(g)═3Ag2O(s);反应生成3mol Ag2O(s)时放出的热量235.8kJ•mol-1,已知2Ag2O(s)═4Ag(s)+O2(g);反应生成4mol Ag(s)时吸收的热量为62.2kJ,试根据题给数据判断O3转化为O2是______(填“放热”或“吸热”)反应.
(2)氮化硅可由石英与焦炭在高温的氯气流中通过如下反应制得:3SiO2+6C+2N2
Si3N4+6CO,在VL的密闭容器中进行反应,实验数据如下表:高温
①实验l和实验2表明,______对反应速率有影响,对同一规律研究的实验还有一组是______(填实验序号).本实验还研究了______对反应速率的影响.序号 碳粉的质量/g 氮气的物质的量/mol 二氧化硅的质量/g 二氧化硅的形状
反应温度/℃达到平衡所用的时间/s 平衡时氮化硅的质量/g 1 7.2 3.0 12.0 大颗粒 1500 300 m1 2 7.2 3.0 12.0 大颗粒 1550 200 m2 3 7.2 3.0 12.0 小颗粒 1550 120 m3 4 7.2 3.0 12.0 小颗粒 1600 80 6.3 5 7.2 3.0 12.0 粉末 1550 t1 7.0
②实验5中,t1______(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为______. nn心1年前1
nn心1年前1 -
 十渡 共回答了17个问题
十渡 共回答了17个问题 |采纳率88.2%解题思路:(1)利用盖斯定律解答;
(2)①根据表中数据分析;
②反应物接触面积越大,反应速率越快,据化学方程式计算转化率.(1)据题意知:①6Ag(s)+O3(g)═3Ag2O(s)△H=-235.8KJ/mol,②2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2KJ/mol,
据盖斯定律,①×2+②×3得:2O3(g)═3O2(g)△H=-285KJ/mol,
故答案为:放热;
(2)①实验l和实验2只有温度不同,实验3和实验4也是,除温度外还有二氧化硅的形状不同,研究反应物的接触面积对反应速率的影响,
故答案为:温度;实验3与实验4;反应物的接触面积;
②实验5比实验3反应物的接触面积大,反应速率快;
生成7.0g氮化硅需要反应的二氧化硅为:[180×7.0g/140]=9.0g,
二氧化硅的转化率为
9.0g
12.0g×100%=75%,
故答案为:<;75%.点评:
本题考点: 反应热和焓变;化学平衡的计算;探究影响化学反应速率的因素.
考点点评: 本题考查了盖斯定律的应用、影响化学反应速率的因素、转化率等,题目难度不大.1年前查看全部
- 二氧化硅、氮化硅、单晶硅薄膜对近红外光的反射率
二氧化硅、氮化硅、单晶硅薄膜对近红外光的反射率
我最近在做薄膜对近红外光的反射实验,但是具体的数值我不确定,所以请问大家:
0.5μm厚度的氮化硅薄膜对808nm近红外光的反射率?
1μm厚度的二氧化硅薄膜对808nm近红外光的反射率?
380μm厚度的单晶硅薄膜对808nm近红外光的反射率? 爱恨交加时1年前1
爱恨交加时1年前1 -
 霍启刚 共回答了22个问题
霍启刚 共回答了22个问题 |采纳率95.5%这个有难度,薄膜的反射率取决于很多因素,而不仅仅是材料本身.建议查相关资料的基础上,根据表面形状(包括薄膜形成方式)估计反射率,并以实测数据相互印证.1年前查看全部
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2
Si3N4+6CO.下列叙述正确的是( )高温 .
A.Si3N4的摩尔质量是154g
B.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
C.Si3N4既是氧化产物,又是还原产物
D.1mol SiO2发生反应,N2得到4mol电子 toofmw1年前1
toofmw1年前1 -
 xpai 共回答了20个问题
xpai 共回答了20个问题 |采纳率85%解题思路:该反应中N元素化合价由0价变为-3价、C元素化合价由0价变为+2价,所以氮气是氧化剂、碳是还原剂、氮化硅是还原产物、一氧化碳是氧化产物,再结合二氧化硅和转移电子之间的关系式计算.A.Si3N4的摩尔质量是154g/mol,故A错误;
B.该反应中N元素化合价由0价变为-3价、C元素化合价由0价变为+2价,所以氮气是氧化剂,二氧化硅中各元素化合价不变,所以二氧化硅既不是氧化剂也不是还原剂,故B错误;
C.氮化硅是还原产物,故C错误;
D.当1mol SiO2发生反应,有[2/3]mol氮气参加反应,则N2得到电子的物质的量=
2
3mol×6=4mol,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确反应中元素化合价变化即可解答,根据基本概念、元素化合价变化、物质之间的关系式解答,题目难度不大.1年前查看全部
- 新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定.
新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定.工业上制得氮化硅的化学反应方程式为aSi+bN2
Si3N4;则a、b的数值分别为a=______、b=______.1300 . 渡梦人1年前1
渡梦人1年前1 -
 爱情三步倒 共回答了18个问题
爱情三步倒 共回答了18个问题 |采纳率94.4%解题思路:根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可;配平时要注意化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数.工业上制得氮化硅的化学反应方程式为aSi+bN2
1300
.
Si3N4,本题可利用“定一法”进行配平,把Si3N4的化学计量数定为1,则Si、N2前面的化学计量数分别为:3、2.
故答案为:3;2.点评:
本题考点: 化学方程式的配平.
考点点评: 本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数1年前查看全部
- (2005•白山一模)新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物
(2005•白山一模)新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意( )
A.通入足量的氧气
B.有无氧气无影响
C.可在氮气气氛中合成
D.通入少量氧气 liang21661年前1
liang21661年前1 -
 最新提交 共回答了18个问题
最新提交 共回答了18个问题 |采纳率83.3%解题思路:根据反应条件和碳、硅的性质分析判断,碳、硅都易和氧气反应.由题给信息“在高温下进行”,C、Si等在高温下可与氧气反应生成氧化物而导致不能生成碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)这些物质,因而合成这些物质时应避免接触氧气,应在保护气中进行反应.
故选B.点评:
本题考点: 无机非金属材料.
考点点评: 本题考查了元素化合物的性质,难度不大,注意基础知识的积累.1年前查看全部
- 下列关于耐高温新型陶瓷--氮化硅(Si3N4)的叙述,正确的是( )
下列关于耐高温新型陶瓷--氮化硅(Si3N4)的叙述,正确的是( )
A. 氮化硅中Si、N两种元素的质量比为4:3
B. 氮化硅中氮元素的质量分数为60%
C. 14g氮化硅中含硅8.4g
D. 氮化硅的相对分子质量为l44 tangsi1年前1
tangsi1年前1 -
 han800 共回答了13个问题
han800 共回答了13个问题 |采纳率76.9%解题思路:A、氮化硅中Si、N两种元素的质量比为:(Si的相对原子质量×Si原子个数):(N的相对原子质量×N原子个数);
B、氮化硅中氮元素的质量分数为:[N的相对原子质量×N原子个数/氮化硅的相对分子质量]×100%;
C、根据“14g×氮化硅中硅元素的质量分数”计算;
D、根据氮化硅的化学式,氮化硅的相对分子质量=(硅的相对原子质量×硅原子个数)+(氮的相对原子质量×氮原子个数);A、根据氮化硅的化学式,氮化硅中Si、N两种元素的质量比为:(28×3):(14×4)=5:4;故A不适合;B、氮化硅中氮元素的质量分数为:14×4140×100%=40%.故B不适合;C、14g氮化硅中含硅的质量为:14g×28×3140=8....
点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算;元素的质量分数计算;化合物中某元素的质量计算.
考点点评: 本题是有关化学式的简单计算.根据化学式逐项进行计算,即可正确选择.1年前查看全部
- (2011•闵行区模拟)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
(2011•闵行区模拟)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
A.氮化硅的摩尔质量为140g
B.氮化硅中Si、N两种元素的质量比为3:4
C.140g氮化硅中含氮元素的质量为14g
D.氮化硅中氮元素的质量分数为40% coolmeme1年前1
coolmeme1年前1 -
 我是赤脚 共回答了17个问题
我是赤脚 共回答了17个问题 |采纳率88.2%A、因氮化硅的相对分子质量=28×3+14×4=140,所以氮化硅的摩尔质量是140g/mol;故不正确;
B、氮化硅中Si、N两种元素的质量比为28×3:14×4=3:2,故不正确;
C、140g氮化硅中含氮元素的质量=140g×
14×4
140×100%=56g,故不正确;
D、氮化硅中氮元素的质量分数为
14×4
28×3+14×4×100%=40%,故正确.
故选D.1年前查看全部
- 氮化硅(Si 3 N 4 )是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得 (1)配平上述反应的化
氮化硅(Si 3 N 4 )是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得 
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是________,其还原产物是________;
(3)该反应的平衡常数表达式为K=________;
(4)若知上述反应为放热反应,则其反应热ΔH________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18 mol/(L·min),则N 2 消耗速率为v(N 2 )=________mol/(L·min). 永远期待中1年前1
永远期待中1年前1 -
 jie_511 共回答了20个问题
jie_511 共回答了20个问题 |采纳率80%1年前查看全部
- (2011•德州一模)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C
(2011•德州一模)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2 ⇌Si3N4+6CO.下列说法正确的是( )
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol的电子
C.若已知上述反应为放热反应,升高温度,其平衡常数增大
D.若增大压强,上述平衡向逆反应方向移动,v逆增大,v正减小 小熊猫的外公1年前1
小熊猫的外公1年前1 -
 程晓军 共回答了15个问题
程晓军 共回答了15个问题 |采纳率86.7%A.C元素的化合价由0升高为+2价,N元素的化合价由0降低为-3价,则C为还原剂,N2是氧化剂,故A错误;
B.上述反应中每生成1molSi3N4,N2得到2mol×2×(3-0)=12mol的电子,故B正确;
C.若已知上述反应为放热反应,升高温度,平衡逆向移动,其平衡常数减小,故C错误;
D.若增大压强,上述平衡向逆反应方向移动,v逆增大,v正增大,故D错误;
故选B.1年前查看全部
- (三选一)【化学与技术】氮化硅(Si 3 N 4 )是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(三选一)【化学与技术】
氮化硅(Si 3 N 4 )是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
I.工业上有多种方法来制备氮化硅,常见的方法有:
①方法一直接氮化法:在1300~1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为__________________________。
②方法二化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是__________________
③方法三Si(NH 2 ) 4 热分解法:先用四氯化硅与氨气反应生成Si(NH 2 ) 4 和一种气体__________(填分子式);然后使Si(NH 2 ) 4 受热分解,分解后的另一种产物的分子式为_________。
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是_____________(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:_____________________。
(3)上述生产流程中电解A的水溶液时,____(填“能”或 “不能”)用Cu作为阳极材料;写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极方程式:
阳极:__________________;阴极:___________________。 疼疼小染1年前1
疼疼小染1年前1 -
 appledorothy 共回答了21个问题
appledorothy 共回答了21个问题 |采纳率95.2%1年前查看全部
- 氮化硅与氢氟酸反应生成两种物质分别是氨和什么?
 laosil1年前4
laosil1年前4 -
 xiayongfei86 共回答了14个问题
xiayongfei86 共回答了14个问题 |采纳率92.9%Si3N4 + 12HF = 3SiF4 + 4NH3
满意请采纳(手机版点“满意”即可)1年前查看全部
- (2009•营口模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(2009•营口模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的氧化剂是______,其还原产物是______;
(2)该反应的平衡常数表达式为 K=c6(CO) c2(N2) ;c6(CO) c2(N2)
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.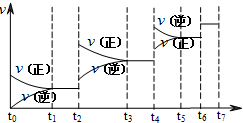
图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中CO的含量最高的一段时间是______.
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是多少?(写出计算过程)提示:272=729. nduo1年前1
nduo1年前1 -
 dhysfu 共回答了17个问题
dhysfu 共回答了17个问题 |采纳率88.2%解题思路:(1)根据化合价的变化判断氧化剂和还原产物;
(2)根据平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积计算;
(3)反应放热,△H<0,根据升高温度平衡移动的方向判断平衡常数的变化,根据速率之比等于化学计量数之比计算反应速率;
(4)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在反应向逆反应之前衡混合物中CO的含量最高;
(5)根据平衡常数计算.(1)反应中N元素的化合价降低,有0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,应为氮化硅,
故答案为:氮气;氮化硅;
(2)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=
c6(CO)
c2(N2),故答案为:K=
c6(CO)
c2(N2);
(3)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,
则v(N2)=[1/3]×v(CO)=[1/3×18mol•L-1.min‑1=6 mol•L-1.min‑1,
故答案为:<;减小;6 mol•L-1.min‑1;
(4)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,
故答案为:升高温度或增大压强,t3~t4;
(5)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
起始:2mol 0
转化:x 3x
平衡:2-x 3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:
(3x)6
(2−x)2]=729,解之得x=1,
则N2的转化率是
1
2×100%=50%,
故答案为:50%.点评:
本题考点: 化学平衡的计算;氧化还原反应;吸热反应和放热反应;反应速率的定量表示方法;化学平衡常数的含义;化学平衡的影响因素;化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查化学平衡的有关计算,本题难度较大,做题时注意平衡常数的计算和应用.1年前查看全部
- (2010•天津)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
(2010•天津)下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
A.氮化硅中Si、N两种元素的质量比为3:4
B.氮化硅中氮元素的质量分数为40%
C.140g氮化硅中含硅元素的质量为84g
D.氮化硅的相对分子质量为140g 雨夕听雨1年前1
雨夕听雨1年前1 -
 lulisong 共回答了24个问题
lulisong 共回答了24个问题 |采纳率100%解题思路:根据氮化硅的化学式为Si3N4,利用元素原子的相对原子质量和原子个数来进行计算.A、氮化硅中Si、N两种元素的质量比为28×3:14×4=3:2,故A错误;
B、氮化硅中氮元素的质量分数为[14×4/28×3+14×4]×100%=40%,故B正确;
C、140g氮化硅中含硅元素的质量=140g×[28×3/28×3+14×4]×100%=84g,故C正确;
D、氮化硅的相对分子质量=28×3+14×4=140≠140g,故D不正确;
故选BC.点评:
本题考点: 有关化学式的计算和推断;化合物中某元素的质量计算.
考点点评: 根据物质的化学式可以表示物质的组成和构成,利用化学式中各元素原子的相对原子质量和原子个数可完成与化学式相关的计算.1年前查看全部
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2=高温=Si3N4+6CO.下列叙述正确的是
A该反应的氧化剂是SiO2和N2
B该反应的还原产物是Si3N4
C该反应中氧化剂和还原剂的质量比为9:7
D1mol Si3N4生成时共转移6mol电子
还有B中还原产物应该是氧化剂被还原的产物吧,就应该是CO? 长生剑玉京1年前3
长生剑玉京1年前3 -
 魔域桃源88 共回答了17个问题
魔域桃源88 共回答了17个问题 |采纳率94.1%A 反应中N的化合价降低,所以N2是氧化剂,Si化合价没变化,所以不是氧化剂
B 氧化剂对应的是还原产物,所以B正确
C 氧化剂 N2 还原剂C 质量比 2*28:6*12=7:18
D 该反应转移电子数:N从0价到-3,降低3,一共4个,所以转移为12mol电子
综上 B1年前查看全部
- (2005•杭州)氮化硅(Si3N4)是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天工业等.氮化硅属于(
(2005•杭州)氮化硅(Si3N4)是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天工业等.氮化硅属于( )
A.金属单质
B.非金属单质
C.化合物
D.混合物 思念落叶1年前1
思念落叶1年前1 -
 daili147 共回答了18个问题
daili147 共回答了18个问题 |采纳率94.4%解题思路:本题考查利用化合物的概念来判断物质是否为化合物,抓住化合物中至少两种元素,且只有一种物质组成.氮化硅中只有一种物质组成的,并且氮化硅是由硅元素、氮元素两种元素组成的,所以氮化硅是化合物,故选C.
点评:
本题考点: 单质和化合物的判别.
考点点评: 应抓住概念的要点来判断物质的类别,了解常见物质的组成.1年前查看全部
- 氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定.工业上用硅与氮气在1300℃时反应制得氮化硅,
氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定.工业上用硅与氮气在1300℃时反应制得氮化硅,请写出该反应的化学方程式:
 luohouchun1年前1
luohouchun1年前1 -
 181099 共回答了19个问题
181099 共回答了19个问题 |采纳率94.7%1300°C
3Si+2N2 ====Si3N41年前查看全部
- 氧化铝,碳化硅,氮化硅中,哪些由分子构成,哪些由离子构成.
 九九里1年前2
九九里1年前2 -
 o0鲂綮 共回答了14个问题
o0鲂綮 共回答了14个问题 |采纳率78.6%这个我要说的是
Al2O3是离子化合物,由Al3+和O2-构成
SiC是原子晶体,不是由分子和离子构成的,只是由C和Si原子构成的
Si3N4一样,也是由Si和N原子构成的1年前查看全部
- 氮化硅属于什么晶体,氮化硼融化克服什么作用力
 2782366451年前1
2782366451年前1 -
 李奕瞳 共回答了18个问题
李奕瞳 共回答了18个问题 |采纳率83.3%原子晶体
克服的是 共价键1年前查看全部
- 氮化硅与氧气反应的方程式
 cocoollee1年前1
cocoollee1年前1 -
 xx傻冒 共回答了22个问题
xx傻冒 共回答了22个问题 |采纳率86.4%高温下生成二氧化硅和氮气1年前查看全部
- 氮化硅和水反应的方程式
 youpenghuoye1年前1
youpenghuoye1年前1 -
 dohkp 共回答了9个问题
dohkp 共回答了9个问题 |采纳率88.9%Si3N4 + 6H2O = 3SiO2 + 4NH3,
另外氮化硅生产必须添加一定比例的烧结助剂,否则烧结不成.所以考虑实际氮化硅材料的水解的时候,还有一个非常重要的因素是烧结助剂的水解和氧化.1年前查看全部
- 氮化硅和碳化硅中硅的化合价
 qkly1年前4
qkly1年前4 -
 一片回忆 共回答了14个问题
一片回忆 共回答了14个问题 |采纳率92.9%两种材料中硅都是正四价
除氢氟酸外,它不与其他无机酸反应(反应方程式:Si3N4+12HF═3SiF4↑+4NH3,抗腐蚀能力强.1年前查看全部
- 如何分类以下物质纯净物分为有机物,酸,碱,盐,氧化物.分类以下物质:四氯化碳(CCl4)五硼烷(B5H9)氮化硅二硫化碳
如何分类以下物质
纯净物分为有机物,酸,碱,盐,氧化物.
分类以下物质:
四氯化碳(CCl4)
五硼烷(B5H9)
氮化硅
二硫化碳(CS2) 绿瘦红肥1年前3
绿瘦红肥1年前3 -
 lianrenye 共回答了25个问题
lianrenye 共回答了25个问题 |采纳率92%我认为====四氯化碳是有机物
金属阳离子和酸根阴离子组成的化合物1年前查看全部
- 氮化硅的化学式什?氮化硅是一种硬度大,熔点高的物质
 aomama1年前3
aomama1年前3 -
 笨笨的药 共回答了16个问题
笨笨的药 共回答了16个问题 |采纳率75%Si3N41年前查看全部
- 氮化硅属于什么A.混合物 B.化合物 C.金属单质 D.非金属单质
 飞翔的蛤蟆1年前3
飞翔的蛤蟆1年前3 -
 斯婕 共回答了22个问题
斯婕 共回答了22个问题 |采纳率90.9%B.化合物1年前查看全部
- 工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl 4 (g)+2N 2 (g)+6H 2 (g) Si 3 N
工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl 4 (g)+2N 2 (g)+6H 2 (g)
 Si 3 N 4 (s)+12HCl(g) ΔH<0
Si 3 N 4 (s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl 4 (g)、0.2 mol N 2 (g)、0.6 mol H 2 (g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si 3 N 4 (s)的质量是5.60 g。
(1)H 2 的平均反应速率是 mol·L -1 ·min -1 。
(2)平衡时容器内N 2 的浓度是 mol·L -1 。
(3)SiCl 4 (g)的转化率是 。
(4)若按n(SiCl 4 )∶n(N 2 )∶n(H 2 )=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl 4 (g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl 4 (g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。选项 投料方式 A n(SiCl 4 )∶n(N 2 )∶n(H 2 )=1∶1∶2 B n(SiCl 4 )∶n(N 2 )∶n(H 2 )=" " 1∶2∶2 C n(SiCl 4 )∶n(N 2 )∶n(H 2 )=" " 3∶2∶2 D n(SiCl 4 )∶n(N 2 )∶n(H 2 )=" " 2∶1∶3
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si 3 N 4 的物质的量减小
D.重新平衡时c(H 2 )/c(HCl)增大 方凉1年前1
方凉1年前1 -
 leonjojo 共回答了21个问题
leonjojo 共回答了21个问题 |采纳率76.2%(1)0.048 (2)0.06 (3)40% (4)减小 (5)A、B (6)A、C、D
依据“三部曲”计算
3SiCl 4 (g)+2N 2 (g)+6H 2 (g) Si 3 N 4 (s)+12HCl(g)
Si 3 N 4 (s)+12HCl(g) : 0.15 0.1 0.3 0
: 0.15 0.1 0.3 0 : 0.06 0.04 0.12 0.24
: 0.06 0.04 0.12 0.24 : 0.09 0.06 0.18 0.24
: 0.09 0.06 0.18 0.24
(4)相当于加压,平衡左移;(5)A、B、C、D的投料比分别为3∶3∶6、3∶6∶6、3∶2∶2、3∶1.5∶4.5,A、B、C、D分别相当于在3∶2∶6的投料配比基础上增加N 2 、增加N 2 、减少H 2 、减少N 2 和H 2 ;(6)升高温度不论平衡向哪个方向移动,正逆反应速率均增大,B错误;升高温度,平衡左移,c(H 2 )增大,c(HCl)减小,A、C、D正确1年前查看全部
- 氮化硅与氮化碳熔沸点高低?
 guangnide1年前2
guangnide1年前2 -
 susanhelen 共回答了22个问题
susanhelen 共回答了22个问题 |采纳率100%解析:.氮化碳熔沸点高于氮化硅
因为氮化硅和氮化碳都是原子晶体,原子晶体的熔沸点高低取决于共价键的键能大小,键能大小取决于原子半径大小,原子半径越小,键能越大,溶沸点越高.
C原子半径小于Si原子半径,即C-N键能>Si-N键能 ,所以氮化碳熔沸点高于氮化硅.1年前查看全部
- (2009•莆田)新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,其中硅元素属于_
(2009•莆田)新型材料的研制与应用推动了现代高新技术的发展.氮化硅(Si3N4)是一种高温陶瓷材料,其中硅元素属于______元素(填“金属”或“非金属”).工业上制氮化硅的方法是:用单质硅(Si)和氮气在高温条件下反应生成氮化硅,写出该反应的化学方程式3Si+2N2
Si3N4高温 .3Si+2N2,该反应的基本类型是______反应.
Si3N4高温 . never3201年前1
never3201年前1 -
 tony219 共回答了15个问题
tony219 共回答了15个问题 |采纳率86.7%元素根据性质分成金属元素、非金属元素和稀有气体元素,可根据汉字偏旁决定元素种类,带金字旁的是金属元素,带石字旁和气字头的是非金属元素,所以硅属于非金属元素;
根据信息:用单质硅(Si)和氮气在高温条件下反应生成氮化硅可写出方程式为:3Si+2N2
高温
.
Si3N4该反应中反应物是两种,生成物是一种,故是化合反应;
故答案为:非金属;3Si+2N2
高温
.
Si3N4;化合反应.1年前查看全部
- (2014•松江区一模)氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损.一定条件下,氮气、
(2014•松江区一模)氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损.一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2→Si3N4+12HCl,氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂.
(1)氮原子的最外层电子排布式是______;氮元素有多种化合价,写出含2种价态氮的化合物的化学式______(举一例).
(2)硅原子核外电子排布在______种不同能量的电子亚层上,氮化硅属______晶体.
(3)上述反应中,属于同一周期的元素符号有______,用______事实可以比较它们的非金属性强弱.
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物.NH3分子的空间构型是______;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是______(举一例).
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有______mol,其中转移电子数目______.
(6)肼能与硫酸反应生成N2H6SO4,该物质晶体类型与硫酸铵相同,则其溶液PH______7(填>、<或=),原因是______(用离子方程式表示). zhangzhen1年前1
zhangzhen1年前1 -
 yuhaiclo1 共回答了12个问题
yuhaiclo1 共回答了12个问题 |采纳率83.3%解题思路:(1)N元素为7号元素,原子核外有2个电子层;NH4+中N元素为-3价,N元素的含氧酸根中N为正价;
(2)根据硅原子核外电子排布式分析;根据氮化硅的物理性质分析;
(3)Si与Cl都是第三周期元素;元素的氢化物越稳定,对应非金属性越强,或最高价氧化物对应水化物酸性酸性越强,则元素的非金属性越强;
(4)根据氨气中N原子的杂化分析;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6;
(5)根据氮氢键和生成气体、转移电子之间的关系式计算;
(6)N2H6SO4晶体类型与硫酸铵相同,根据硫酸铵的性质分析.(1)N元素为7号元素,原子核外有2个电子层,其最外层电子排布式是2s22p3;NH4+中N元素为-3价,N元素的含氧酸根中N为正价,所以含2种价态氮的化合物的化学式为NH4NO3或NH4NO2,
故答案为:2s22p3;NH4NO3或NH4NO2;
(2)Si为14号元素,其核外电子排布式为1s22s22p63s23p2,所以其核外电子排布在5种不同能量的电子亚层上;氮化硅有超硬和耐磨性,所以属于原子晶体,
故答案为:5;原子;
(3)一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2→Si3N4+12HCl,反应中Si、Cl都是第三周期元素;元素的氢化物越稳定,对应非金属性越强,或最高价氧化物对应水化物酸性酸性越强,则元素的非金属性越强,
故答案为:Si、Cl;氢化物稳定性或最高价氧化物对应水化物酸性;
(4)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6,
故答案为:三角锥型;C2H6;
(5)若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成气体的物质的量=[7/2]mol=3.5mol,转移电子数=[8/2]=4NA,
故答案为:3.5;4NA;
(6)肼能与硫酸反应生成N2H6SO4,该物质晶体类型与硫酸铵相同,已知硫酸铵水解显酸性,所以N2H6SO4的溶液也显酸性,即PH<7;其水解方程式为:N2H62++2H2O⇌N2H4•2H2O+2H+,故答案为:<;N2H62++2H2O⇌N2H4•2H2O+2H+.点评:
本题考点: 原子核外电子排布;化学方程式的有关计算;盐类水解的应用.
考点点评: 本题考查较综合,涉及核外电子排布、空间构型的判断、有关物质的量的计算、盐的水解等知识点,分子空间构型是考试热点,要注重基础知识的积累,题目难度较大.1年前查看全部
- 怎么判断该示意图粒子是原子 怎么写氮化硅的化学式 计算 :某铜矿石,主要成分为CuFeS2中含硫元素29.75%
怎么判断该示意图粒子是原子 怎么写氮化硅的化学式 计算 :某铜矿石,主要成分为CuFeS2中含硫元素29.75%
求该矿石中铜元素的质量分数.
某硝酸铵样品中NH4NO3的纯度为90%,求此氮元素的质量分数 madanone1年前1
madanone1年前1 -
 chivaschen 共回答了19个问题
chivaschen 共回答了19个问题 |采纳率94.7%1:示意图中 核内质子数=核外电子总数 则为原子
2;Si5N4
3;在CuFeS2中 Cu和S的质量比=64|32=2:1
即 2:1=铜元素的质量分数:硫元素29.75%
所以:铜元素的质量分数=59%
4:NH4NO3中 氮元素的质量分数=28:80=35 %
此氮元素的质量分数=90 %*35 %=31.5 %1年前查看全部
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

(1)该反应的平衡常数表达式为K=c6(CO) c2(N2) ;c6(CO) c2(N2)
(2)若知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)若使压强增大,则上述平衡向______反应方向移动(填“正”或“逆”);
(4)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)=______ mol/(L.min). xgz5011年前1
xgz5011年前1 -
 037ahhf 共回答了18个问题
037ahhf 共回答了18个问题 |采纳率94.4%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(2)对于放热反应,反应热△H<0;
该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
(3)增大压强平衡向气体体积减小的方向移动;
(4)根据速率之比等于化学计量数之比计算.(1)可逆反应3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)的平衡常数K=
c6(CO)
c2(N2),故答案为:
c6(CO)
c2(N2);
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小,故答案为:小于;减小;
(3)该反应正反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即向逆反应移动,故答案为:逆;
(4)已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为:v(N2)=[1/3]v(CO)=[1/3]×18mol/(L•min)=6mol/(L•min),故答案为:6.点评:
本题考点: 化学平衡常数的含义;反应速率的定量表示方法;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数与影响因素、影响平衡移动的因素、化学反应速率计算等,比较基础,注意方程式中物质的状态,注意基础知识的掌握.1年前查看全部
大家在问
- 1某混合烃和过量氧再一密闭容器中完全反应,测知反应前后的压强不变则该混合烃可能是
- 21800s是十九世纪还是十八世纪?
- 3一个人究竟该如何面对困难,榜样就是小明(修改病句)
- 4测量学的问题实地有2个已知控制点A、B,A坐标为(50,150)B坐标为(100,100)单位米,图纸上有一个待建屋角点
- 5《龟虽寿》中盈缩之期,不但在天表明作者怎样的人生观
- 6(2013•湖州模拟)如图,在平面直角坐标系xOy中,抛物线y=−16x2+bx+c过点A(0,4)和C(8,0),P(
- 7甲、乙两个同学在台上表演:(1)听到老师口令,他俩并排自南向北离开窗子行走,在两个同学行走的过程中,回答以下问题:①以窗
- 8某工件形状如图所示,BC的度数为60°,AB=6cm,点B到点C的距离等于AB,∠BAC=30°,则工件的面积等于(
- 9The lndian girl has to do housework at home.单项选择
- 10我曾有这样的一位老师 作文
- 11什么不能从空气中直接分离?氢气?稀有气体?(中考化学)
- 12铜在这种条件下生锈吗我把一块铜放在水池里(搪瓷的 就是正常使用 没有积着水 只是潮湿环境)温度:25·c过了两三个月有一
- 13英语中的连字符用法?已成功为取向是success-oriented oriented在这里是形容词还是动词的被动?连字符
- 14地球在转,人为什么不会掉下来?
- 15翠绿和水平如镜和柔弱的反义词?神秘和清幽和陶醉的近义词?



