向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示.下列有关溶液中粒子浓度关系的描
 要去qq玩2022-10-04 11:39:542条回答
要去qq玩2022-10-04 11:39:542条回答
向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示.下列有关溶液中粒子浓度关系的描述中,正确的是( )
A.在A、B间任一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
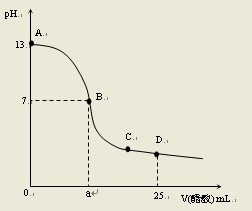
A.在A、B间任一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)


已提交,审核后显示!提交回复
共2条回复
 MickeyLin 共回答了28个问题
MickeyLin 共回答了28个问题 |采纳率92.9%- 我是化学老师,答复如下:
A.不对.开始的时候,OH―很多,CH3COO―浓度是小于OH―的
D.对.物料守恒.Na的物料是25×0.1=2.5,醋酸的物料是25×0.2=5.所以是2倍的关系. - 1年前
 ygp12 共回答了9540个问题
ygp12 共回答了9540个问题 |采纳率0.2%- A:错。在靠近A处,[OH-]>[CHCOO-]
D:对。由物料守恒得到,醋酸是烧碱的两倍。 - 1年前
相关推荐
- 60mL0.1mol/LHAc溶液与25mL0.1mol/LNaOH溶液相混合,溶液是否具有缓冲作用,PH多少?
60mL0.1mol/LHAc溶液与25mL0.1mol/LNaOH溶液相混合,溶液是否具有缓冲作用,PH多少?
60mL0.1mol/LHAc溶液与25mL0.1mol/LNaOH溶液相混合,溶液是否具有缓冲作用,该混合溶液PH多少? 郎心久废1年前1
郎心久废1年前1 -
 鸿登 共回答了13个问题
鸿登 共回答了13个问题 |采纳率100%混合后,形成醋酸-醋酸钠缓冲溶液.
c(HAc)=(60 - 25)*0.1/(60+25)=0.04mol/L
c(NaAc)=25*0.1/(60+25)=0.03mol/L
pH=pKa - lgc(HAc)/c(NaAc)=4.74-lg0.04/0.03=4.621年前查看全部
- 一道化学弱电解质电离题.室温时,向25mL0.1mol/L的HCL溶液中逐渐滴加0.25mol/LNH3.H2O 溶液.
一道化学弱电解质电离题.
室温时,向25mL0.1mol/L的HCL溶液中逐渐滴加0.25mol/LNH3.H2O 溶液.当溶液恰好中和时 所用的氨水体积为什么小于10ml?恰好中和时什么意思啊傻傻分不清 sh00801年前4
sh00801年前4 -
 long73473 共回答了10个问题
long73473 共回答了10个问题 |采纳率100%恰好中和的意思是酸碱恰好反应,谁也不过量,从你说的意思来看,所用氨水应为10mL.
还有一种是:恰好中和到中性,像你说的这题如果这样的话,因为生成的氯化铵溶液是酸性的,所以要呈中性,必须要多加些氨水,体积会大于10mL.1年前查看全部
- 将2.44gBaCl2.xH2O晶体溶于水,配成100mL溶液,取此溶液25与25mL0.1mol/L的Na2SO4溶液
将2.44gBaCl2.xH2O晶体溶于水,配成100mL溶液,取此溶液25与25mL0.1mol/L的Na2SO4溶液作用,钡离子恰好沉淀完全
1求2.44gBaCl2.xH20中的物质的量.
2求Bacl2.xH20的相对分子持量.
3求Bacl2.xH20中的X值. 疯号1年前1
疯号1年前1 -
 溪北 共回答了20个问题
溪北 共回答了20个问题 |采纳率85%其实,这一题就是
BaCl2 +Na2SO ==BaSO4(沉淀)+2NaCl
25mL0.1mol/L的Na2SO4为0.0025mol
根据反应,BaCl2也为0.0025mol
配成100mL溶液,取此溶液25
所以本来的物质的量是0.0025mol×4==0.01mol
相对分子质量是 m/n==2.44/0.01==244
Ba原子量是137,Cl是35.5
所以xH20一共的分子量是:244-137-35.5×2==36
所以x==36/(16+2)==2
所以:
1求2.44gBaCl2.xH20中的物质的量:0.01mol
相对分子质量:244
X的值是:21年前查看全部
- 室温下,向25mL0.1mol/L的NaOH溶液中逐滴滴加同浓度的HCI溶液,若每20滴溶液的体积恰好为1ml,试计算:
室温下,向25mL0.1mol/L的NaOH溶液中逐滴滴加同浓度的HCI溶液,若每20滴溶液的体积恰好为1ml,试计算:
若滴定到终点时甲基橙恰好由黄变橙,则过量的盐酸体积为多少毫升? 碧草情天1年前1
碧草情天1年前1 -
 lycdlk 共回答了22个问题
lycdlk 共回答了22个问题 |采纳率90.9%甲基橙由黄变橙PH=4.4,即氢离子浓度10^-4.4[10的负4.4次方]mol/L,过量的氢离子为[(10^-4.4)-(10^-7)]mol/L,全由0.1mol/L的盐酸提供.
假设过量的盐酸体积为V,恰好完全反应时溶液体积为50mL,则
[(10^-4.4)-(10^-7)]/1000*(50+V)=0.1*V
V=0.01986mL1年前查看全部
大家在问
- 1翻译:He flies in a spaceship 快! 十万火急啊!我在线等
- 2在冬天太阳升起晚,落得早,翻译成英文
- 3人教版英语的答案
- 4求一些低碳生活故事!谢谢啦!
- 5一个五位数和一个六位数,省略万位后面的尾数后近似数相同.这个五位数最小是______,这个六位数最大是______.
- 6荷塘月色 作文
- 7At the airport 作文
- 8婉转是什么意思?
- 9原子是由______和电子组成;一般情况下人体的安全电压不高于______V.
- 10琳达的父母一周工作几天?翻译_____ _____ days will Linda's parents work a w
- 11阅读下面短文并根据短文内容回答文后5个问题。 Seasons in Canada
- 12若点P在曲线y=x3-3x2+(3-3)x+[3/4]上移动,经过点P的切线的倾斜角为α,则角α的取值范围是( )
- 13阅读理解寻 春①迎着早春的轻寒,或野游,或山行,多么好啊.也许,早春的景色过于素淡了;可也正因为还没有万紫千红的撩拨,才
- 14一根均匀的直尺AB在水平桌面上,直尺伸出桌面的部分OB是全尺长的1/3,当B端挂3N的重物时,直尺的A端刚刚开
- 15已知α,β∈(0,π/2)向量a=(sinα,1-cosα),向量b=(cosβ,sinβ)且向量a乘向量b=3/2-c
