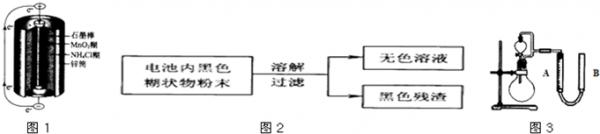
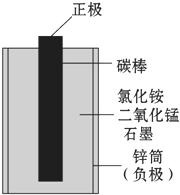
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
 我的宝宝喜欢猫猫2022-10-04 11:39:541条回答
我的宝宝喜欢猫猫2022-10-04 11:39:541条回答(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mol e-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀,______ | 无色溶液中 存在Zn2+离子 |
| ②______ | ______ | 无色溶液中 存在NH4+离子 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.

已提交,审核后显示!提交回复
共1条回复
 xwh_924 共回答了14个问题
xwh_924 共回答了14个问题 |采纳率92.9%- 解题思路:(1)锌锰干电池的负极上Zn失去电子,负极消耗1mol时转移2mol电子,NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气;
(2)Zn(OH)2是两性氢氧化物,能溶解在NaOH溶液中,无色溶液中含Zn2+、NH4+,加碱均发生反应;
(3)黑色粉末部分溶解,则二氧化锰反应生成锰离子,
①等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一、二中参加反应的H2O2的物质的量相同;
②实验二中反应生成锰离子、水、氧气;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意A、B中液面相平.(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,负极消耗1mol时转移2mol电子,每通过0.4mole-,负极质量减少0.2mol×65g/mol=13.0g,由NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,正极反应为2NH4++2e-═2NH3↑+H2↑,
故答案为:Zn-2e-═Zn2+;13.0;2NH4++2e-═2NH3↑+H2↑;
(2)①无色溶液中含Zn2+、NH4+,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
故答案为:白色沉淀逐渐溶解,产生刺激性气味的气体;
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝;
(3)黑色粉末部分溶解,则二氧化锰反应生成锰离子,Mn元素的化合价降低,则MnO2做氧化剂,生成Mn2+离子,故答案为:MnO2做氧化剂;生成Mn2+离子;
①等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一中过氧化氢既是氧化剂又是还原剂,实验二中H2O2是还原剂,由氧气的体积1:2可知,等物质的量的过氧化氢均完全反应,则参加反应的H2O2的物质的量之比为1:1,故答案为:1:1;
②实验二中反应生成锰离子、水、氧气,离子反应为H2O2+2H++MnO2═Mn2++2H2O+O2↑,故答案为:H2O2+2H++MnO2═Mn2++2H2O+O2↑;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平,故答案为:上下移动B管,使A、B两管中液面相平.点评:
本题考点: 性质实验方案的设计;原电池和电解池的工作原理;探究物质的组成或测量物质的含量.
考点点评: 本题考查较为综合,涉及原电池、离子反应、氧化还原反应及实验设计,明确习题中的信息及物质的性质即可解答,题目难度中等. - 1年前
相关推荐
- (8分)化学电池在通讯、交通及日常生活中有着广泛的应用。 (1)右图是锌锰干电池的基本构造图,关于该
(8分)化学电池在通讯、交通及日常生活中有着广泛的应用。 (1)右图是锌锰干电池的基本构造图,关于该(8分)化学电池在通讯、交通及日常生活中有着广泛的应用。

(1)右图是锌锰干电池的基本构造图,关于该电池的使用和性能,说法 正确的是
正确的是
A.该 电池可充电后反复使用
电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
已知Ni(OH) 2 和Cd(OH) 2 均难于溶于但酸,以下说法正确的是 A.以上反应是可逆反应 B.反应环境为碱性
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd做负极 D.是一种二次电池
(3)美国阿波罗的氢氧燃料电池是一种新型电源,其构造如图所示,a、b两个电极均由多孔的碳块组成,通入氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。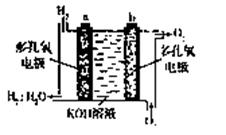
①其电极为a是 极(填正或负)
②若为飞行员提供了360kg的水,则电路中通过了 mol电子。
 hai929131年前1
hai929131年前1 -
 dongsmqs 共回答了21个问题
dongsmqs 共回答了21个问题 |采纳率81%(每空2分)
(1)B(2)B、C、D(3)负 40000
略1年前查看全部
- 碱性锌锰干电池的反应式该如何理解 不懂呢←_←
 SIX141年前1
SIX141年前1 -
 神奇熊猫宝宝 共回答了23个问题
神奇熊猫宝宝 共回答了23个问题 |采纳率87%如何正极反应是2MnO2+2e+2H2O=2MnOOH+2OH-的话,那么这个应该是锌锰碱性电池
负极:Zn-2e+2OH- =Zn(OH)2
然后两式想加,总的反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH
如何是锌锰干电池的话,溶液中才会有铵根
负极:Zn-2e=Zn2+
正极:(2NH4+)+2e=2NH3↑+H2↑
两式相加,总反应为:Zn+:(2NH4+)=(Zn2+)+2NH3↑+H2↑1年前查看全部
- 碱性锌锰干电池的 负极反应式 Zn失去电子 为什么还要与氢氧根反应?
 乱乱乱乱乱乱1年前1
乱乱乱乱乱乱1年前1 -
 02011053 共回答了17个问题
02011053 共回答了17个问题 |采纳率76.5%因为电池内部环境是碱性的,含有大量OH-,而Zn失去电子之后变成 Zn2+ 不能存在于碱性环境,会合OH-反应生成Zn(OH)2.
附反应方程式:
负极:Zn - 2e- + 2OH- == Zn(OH)2正极:2MnO2 + 2H2O + 2e- == 2MnO(OH) + 2OH-总:2MnO2 + Zn + 2H2O == 2MnO(OH) + Zn(OH)2
(注:生成物 “ MnO(OH) ” 叫做 “氢氧化氧锰” )
祝学业进步!1年前查看全部
- 锌锰干电池用到后来为什么会变瘪
 yangfuyu11年前2
yangfuyu11年前2 -
 hero0630 共回答了27个问题
hero0630 共回答了27个问题 |采纳率88.9%锌锰干电池是最常见的化学电源.干电池的外壳(锌)是负极,中间的碳棒是正极,在碳棒的周围是细密的石墨和去极化剂MnO2的混合物,在混合物周围再装入以NH4Cl溶液浸润的ZnCl2,NH4Cl和淀粉或其他填充物(制成糊状物).为了避免水的蒸发,干电池用蜡封好.干电池在使用时的电极反应为
碳极:
2NH4+ + 2e- = 2NH3 + H2
H2 + 2MnO2 = 2MnO(OH)
锌极:Zn - 2e- = Zn2+
总反应:Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+
从反应式看出:加MnO2是因为碳极上2NH4+离子获得电子产生H2,妨碍碳棒与2NH4+ 的接触,使电池的内阻增大,即产生“极化作用”.添加MnO2就能与H2反应生成MnO(OH).这样就能消除电极上氢气的集积现象,使电池畅通.所以MnO2起到消除极化的作用,叫做去极剂.
从反应原理中可以找到锌锰干电池用到后来为什么会变瘪的原因:干电池使用时产生氨气,或连续长时间使用产生的氢气,不能及时消除电极上氢气的集积现象,使电池发涨,气体释放后变瘪.1年前查看全部
- 锌锰干电池是普遍使用的化学能源,铅锰干电池的基本构造如右图所示,其中含有MnO2,NH4Cl,ZnCl2等的糊状物,以锌
锌锰干电池是普遍使用的化学能源,铅锰干电池的基本构造如右图所示,其中含有MnO2,NH4Cl,ZnCl2等的糊状物,以锌筒为负极材料,石墨为正极材料,干电池的工作原理是
Zn+2MnO2+2NH4+=====ZN2++2NH3+H2O
求
1.正负极的反应式 21高跟鞋1年前1
21高跟鞋1年前1 -
 sirchang 共回答了18个问题
sirchang 共回答了18个问题 |采纳率94.4%正极为阴极,锰由四价还原为三价
2MnO2+2H2O+2e→2MnO(OH)+2OH-
负极为阳极,锌氧化为二价锌离子:
Zn+2NH4Cl→Zn(NH3)2Cl2+2H++2e1年前查看全部
- 锌锰干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO 2 +2N Zn 2+ +Mn 2 O 3 (s)+2N
锌锰干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO 2 +2N
 Zn 2+ +Mn 2 O 3 (s)+2NH 3 ↑+H 2 O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn 2+ +Mn 2 O 3 (s)+2NH 3 ↑+H 2 O,在此电池放电时正极(碳棒)上发生反应的物质是( )A.Zn B.碳 C.MnO 2 和N D.Zn 2+ 和NH 3  aini1924lian1年前1
aini1924lian1年前1 -
 1ww0519 共回答了17个问题
1ww0519 共回答了17个问题 |采纳率94.1%C
根据方程式可知:Zn为原电池的负极,碳棒为原电池的正极,负极失电子变成Zn 2+ ,失去的电子被MnO 2 和N得到,生成了低价态的Mn 2 O 3 和不带电的NH 3 。所以在正极上N和MnO 2 为反应物。1年前查看全部
- 下列说法中正确的是( ) A.镍镉电池、锂离子电池和碱性锌锰干电池都是二次电池 B.燃料电池是一
下列说法中正确的是( )
A.镍镉电池、锂离子电池和碱性锌锰干电池都是二次电池 B.燃料电池是一种高效但是会污染环境的新型电池 C.化学电池的反应本质是氧化还原反应 D.铅蓄电池放电的时候正极是Pb,负极是PbO 2  小陈姑娘1年前1
小陈姑娘1年前1 -
 无rr9 共回答了21个问题
无rr9 共回答了21个问题 |采纳率85.7%C
1年前查看全部
- 下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是()

A.电池内部含有电解质 B.锌是负极,碳棒是正极 C.电池用完后可埋入土壤 D.锌锰干电池属一次电池  冰清曦红1年前1
冰清曦红1年前1 -
 阳光种业 共回答了20个问题
阳光种业 共回答了20个问题 |采纳率95%C
1年前查看全部
- 原电池反应书写比如说 碱性 锌锰干电池 负极:Zn+2OHˉ→Zn(OH)2+2eˉ正极:2MnO2+H2O+2eˉ→M
原电池反应书写
比如说 碱性 锌锰干电池
负极:Zn+2OHˉ→Zn(OH)2+2eˉ
正极:2MnO2+H2O+2eˉ→Mn2O3+2OHˉ
为什么不能写Zn→Zn2+ +2eˉ
Mn4+ + eˉ→Mn3+
解释最好口语化一点``
不是叠加的问题 .我知道叠加不能得.我是举个例子 ,为什么 不能写离子反应本身 .还要加上其他的条件 .而且什么时候要加 WW0051年前2
WW0051年前2 -
 小格111 共回答了22个问题
小格111 共回答了22个问题 |采纳率86.4%对于原电池的初学者,电极反应式的书写是一大难点,如何较轻松的解决这一难点,关键是掌握书写电极反应式的书写技巧.
根据原电池原理可得:
负极:失电子 发生氧化反应(一般通式:M Mn+ + ne-)
正极:得电子 发生还原反应(一般通式:N + me- Nm-)
要把电极反应式准确写出,最关键的是把握准总反应,我们可以通过总反应进一步写出电极反应式,即通总反应判断出发生氧化和还原的物质(原电池的条件之一就是自发的发生氧化还原反应),将氧化与还原反应分开,结合反应环境,便可得到两极反应.
一、原电池电极反应式书写技巧
1、凡有金属参与的原电池反应一般较活泼金属做负极:
如:⑴Mg、Al在酸性(非氧化性酸)环境中构成原电池活泼金属做负极
解析:在酸性环境中Mg 比 Al活泼,其反应实质为Mg的析氢蚀:
∴负极:Mg- → Mg2++2e-
正极:2H++2e- → H2↑
总反应式:Mg+2H+=Mg2+H2↑
铜锌原电池就是这样的原理.
(2)较活泼金属不一定做负极,要看哪种金属自发发生反应:
如:Mg、Al在碱性环境中构成的原电池,相对不活泼的Al做负极
解析:在碱性环境中Al 比 Mg活泼,其反实质为Al与碱溶液的反应:
2Al+2OH-+6H2O=2AlO2-+3H2↑+4H2O
∴负极:2Al + 8OH- → 2[Al(OH)4]- +6e-
正极:6H2O+6e-→ 3H2↑+6OH-
注意:Al-3e-=Al3+,此时Al3+在碱性环境不能稳定存在,会与OH-(过量)结合转化为[Al(OH)4]-.
再如:Fe、Cu常温下在浓H2SO4、HNO3溶液中构成的原电池也是如此.
2、燃料电池:
(1)关键是负极的电极反应式书写,因为我们知道,一般的燃料电池大多是可燃性物质与氧气及电解质溶液共同组成的原电池,虽然可燃性物质与氧气在不同的电极反应,但其总反应方程式应该是可燃物在氧气中燃烧.当然由于涉及电解质溶液,所以燃烧产物可能还要与电解质溶液反应,再写出燃烧产物与电解质溶液反应的方程式,从而得到总反应方程式.这一步对大多数学生而言没什么难度.由于在反应中氧气由0价变为-2价,得电子,即O2作氧化剂是正极,接下来我们即可写出正极的电极反应式: ①若此时电解质溶液为酸性,则反应过程可以理解为:正极上首先发生: O2+4e- → 2O2+ 由于在酸性环境中大量存在H+ 故O2-会与H+结合成H20,故正极反应式应为: O2+4e+4H+ → 2H2O ;②当然若电解质为中性或碱性时,则正极反应式就应只是O2+4e+2H2O → 4OH_.此时负极的反应式就可以由总电极方程式减去正极的电极方程式得到(注意此时唯一值得注意的是要将方程式中的氧气抵消掉).又称为加减法书写电极反应式:如,熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极染气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池.
看后自然明白1年前查看全部
- 小刚为了解生活中常见的锌锰干电池,做了以下探究.
 小刚为了解生活中常见的锌锰干电池,做了以下探究.
小刚为了解生活中常见的锌锰干电池,做了以下探究.
他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损.
小刚查阅了资料:锌锰干电池的结构如图所示,它以中心的碳棒(石墨)作正极,外围的锌筒作负极,锌筒与碳棒之间填满用氯化铵溶液(作电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用.在电池的使用中,锌逐渐变成了氯化锌.请你根据初中学习的知识和小刚的探究活动,完成下面各题:
(1)用碳棒作电极主要利用了石墨的______性.
(2)干电池在使用过程中的能量转化是______.
(3)用简单的方法证明黑色粉末中含有石墨,写出操作步骤和实验现象:______
______.
(4)通过回收废旧锌锰干电池可得到的物质有______、______(至少2种). 为侬1年前1
为侬1年前1 -
 doiphin 共回答了18个问题
doiphin 共回答了18个问题 |采纳率83.3%解题思路:根据电池是一种将化学能转化为电能的装置,用碳棒作电极是由于石墨能导电,同时电池中还含有多种其他物质,如Zn、MnO2及生成的ZnCl2等,因此废旧电池不能随意丢弃,而应回收再利用进行解答.(1)石墨容易导电,可以做电极.故填:导电.
(2)干电池在使用过程中的能量转化是化学能转化成电能.故填:化学能转化成电能.
(3)证明方法:把黑色粉末充分燃烧,如果能生成使澄清的石灰水变浑浊的气体,则证明含有石墨.故填:将黑色粉末放在金属片上加热,黑色粉末能燃烧,在其上方放一块附有澄清石灰水的玻璃片,玻璃片上出现白色物质,则说明黑色粉末中含有石墨.
(4)回收废旧锌锰电池可得到的物质有石墨、氯化锌等.故填:石墨、氯化锌.点评:
本题考点: 碳单质的物理性质及用途;碳的化学性质;物质发生化学变化时的能量变化.
考点点评: 物质的性质决定物质的用途,合理设计实验探究物质的组成情况.1年前查看全部
- 如何简单快捷地延长高功率锌锰干电池的寿命?
如何简单快捷地延长高功率锌锰干电池的寿命?
我的mp3经常5够电使,听一晚就无电啦~(另:我用的大多是高功率锌锰干电) fhfhdhgtjn1年前2
fhfhdhgtjn1年前2 -
 custom1001 共回答了16个问题
custom1001 共回答了16个问题 |采纳率68.8%没有办法,锌锰干电池的机理为原电池,是在电池内部发生的电化学反应,以锌为负极,碳棒为正极,以铵根离子二氧化锰为电解液的原电池,总反应式为:Zn + 2MnO2 + 2NH4+ = Zn2+ Mn2O3 + 2NH3 + H2O
当锌或者电解液成分消耗尽的时候,电池就没电了,因此没有办法延长使用寿命.
可以尝试换用充电的Mp3听哦1年前查看全部
- 关于锌锰干电池对人体的危害记得五年前我在给电灯换电池时,谁只那电池漏液了,一不小心漏液溅到了眼睛里了,我马上用自来水冲洗
关于锌锰干电池对人体的危害
记得五年前我在给电灯换电池时,谁只那电池漏液了,一不小心漏液溅到了眼睛里了,我马上用自来水冲洗,然后又用减轻眼睛疲劳的眼药水冲洗,可能有些液体顺着鼻泪管流到了鼻子里,一段时间后我发现两鼻孔间右鼻孔的内壁肿了,硬硬的,现在还大了点,这是什么?肿瘤? 875671年前1
875671年前1 -
 zb790528 共回答了17个问题
zb790528 共回答了17个问题 |采纳率100%锌锰干电池电解液一般为氯化铵、氯化锌或者碱性电池的氢氧化钾.接触后一般用大量水去清洗即可,并不会有很大的伤害,暂时没有见因为这些干电池电液造成肿瘤的病例报告.你应该可以放心.1年前查看全部
- 锌锰干电池是最早使用的化学电池,其基本构造如图1所示.(1)锌锰干电池的负极电极反应式是______,电路
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.(1)锌锰干电池的负极电极反应式是______,电路
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole - ,负极质量减少______g;工作时NH 4 + 离子在正极放电产生2种气体,其中一种气体分子是含10e - 的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验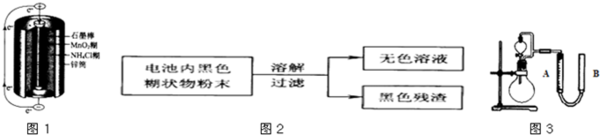
已知:Zn(OH) 2 是两性氢氧化物.完成下列实验报告:
(3)利用残渣中分离出的MnO 2 ,研究其在H 2 O 2 制O 2 过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H 2 O 2 溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).实验步骤 实验现象 实验结论 ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. 生成白色沉淀,______ 无色溶液中
存在Zn 2+ 离子②______ ______ 无色溶液中
存在NH 4 + 离子
①实验一、二中参加反应的H 2 O 2 的物质的量之比为______;序号 烧瓶中的物质 实验记录 实验结论与解释 实验一 足量MnO 2 收集到56mL气体 MnO 2 做催化剂 实验二 足量MnO 2
和稀硫酸黑色粉末部分溶解,
收集到112mL气体______
______
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
 solojean0071年前1
solojean0071年前1 -
 uuren2007 共回答了20个问题
uuren2007 共回答了20个问题 |采纳率95%(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e - ═Zn 2+ ,负极消耗1mol时转移2mol电子,每通过0.4mole - ,负极质量减少0.2mol×65g/mol=13.0g,由NH 4 + 离子在正极放电产生2种气体,其中一种气体分子是含10e - 的微粒为氨气,另一种为氢气,正极反应为2NH 4 + +2e - ═2NH 3 ↑+H 2 ↑,
故答案为:Zn-2e - ═Zn 2+ ;13.0;2NH 4 + +2e - ═2NH 3 ↑+H 2 ↑;
(2)①无色溶液中含Zn 2+ 、NH 4 + ,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
故答案为:白色沉淀逐渐溶解,产生刺激性气味的气体;
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝;
(3)黑色粉末部分溶解,则二氧化锰反应生成锰离子,Mn元素的化合价降低,则MnO 2 做氧化剂,生成Mn 2+ 离子,故答案为:MnO 2 做氧化剂;生成Mn 2+ 离子;
①等物质的量浓度、等体积H 2 O 2 溶液加入分液漏斗中,实验一中过氧化氢既是氧化剂又是还原剂,实验二中H 2 O 2 是还原剂,由氧气的体积1:2可知,等物质的量的过氧化氢均完全反应,则参加反应的H 2 O 2 的物质的量之比为1:1,故答案为:1:1;
②实验二中反应生成锰离子、水、氧气,离子反应为H 2 O 2 +2H + +MnO 2 ═Mn 2+ +2H 2 O+O 2 ↑,故答案为:H 2 O 2 +2H + +MnO 2 ═Mn 2+ +2H 2 O+O 2 ↑;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平,故答案为:上下移动B管,使A、B两管中液面相平.1年前查看全部
- 碱性锌锰干电池 zn和谁反应
 雨中路客1年前2
雨中路客1年前2 -
 玛姬同学 共回答了13个问题
玛姬同学 共回答了13个问题 |采纳率84.6%正极:MnO2
负极:Zn
电解质:KOH
负极:Zn+2OH-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)21年前查看全部
- 下列有关电池的说法正确的是 [ ] A.锌锰干电池中,锌电极是负极
下列有关电池的说法正确的是 [ ]A.锌锰干电池中,锌电极是负极
B.手机上用的锂离子电池属于二次电池
C.甲醇燃料电池可把化学能转化为电能
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 chd6151年前1
chd6151年前1 -
 yellowbill 共回答了9个问题
yellowbill 共回答了9个问题 |采纳率100%ABC1年前查看全部
- 下列有关锌锰干电池的说法中正确的是( )
下列有关锌锰干电池的说法中正确的是( )
A.锌外壳是负极,石墨碳棒是正极材料
B.在外电路中电子从碳棒流向锌外壳
C.电流从锌流到碳棒上
D.在电池内部阳离子从碳棒向锌片移动 gvkgchhgct67851年前1
gvkgchhgct67851年前1 -
 我微笑 共回答了19个问题
我微笑 共回答了19个问题 |采纳率100%解题思路:A、阳极原电池原理分析,失电子的做负极,在正极上得到电子发生还原反应;
B、原电池中电子流向从负极沿导线流向正极;
C、原电池中电子流向从负极沿导线流向正极;电流方向从正极流向负极;
D、原电池中电解质溶液中阳离子移向正极.A、阳极原电池原理分析,失电子的做负极,在正极上得到电子发生还原反应;锌外壳失电子是负极,石墨碳棒是正极材料,故A正确;
B、原电池中电子流向从负极沿导线流向正极;在外电路中电子从锌外壳流向碳棒,故B错误;
C、原电池中电子流向从负极沿导线流向正极;电流方向从正极流向负极;电流从碳棒流到锌上,故C错误;
D、原电池中电解质溶液中阳离子移向正极,从锌移向碳棒,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池盒电解池工作原理的应用,电极名称,电极判断,电流和电子流向分析,题目较简单.1年前查看全部
- 废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnS
废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4•7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:

(1)操作②中所用的加热仪器应选______(填“蒸发皿”或“坩埚”).
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:______.
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为______(填字母).NH3•H2O的Kb Zn 2+完全沉淀的pH Zn(OH)2溶于碱的pH 1.8×10-5 8.9 >11
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol•L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为______.
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是______.
步骤3:向滤液中滴加0.5mol•L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为2MnCO3+O2
2MnO2+2CO2△ .2MnCO3+O2.
2MnO2+2CO2△ .
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol•L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在______℃左右.
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择______mol•L-1左右.
 kafeiduo1年前1
kafeiduo1年前1 -
 133521wy 共回答了18个问题
133521wy 共回答了18个问题 |采纳率88.9%解题思路:(1)根据物质的熔融需要较高的温度来回答;
(2)三价铁离子和氨水反应的实质是和氨水电离出的氢氧根离子之间的反应;
(3)根据表中的数据结合实际来回答;
(4)二氧化锰具有氧化性,能将双氧水氧化;活性碳的作用:吸附性,碳酸锰在氧气存在下,受热反应生成二氧化锰;
(5)根据碳酸锰的最高产率来确定浸泡的温度;酸锰的最高产率时的浓度即为最佳浓度.(1)物质的熔融需要较高的温度,操作②中所用的加热仪器应选坩埚,故答案为:坩埚;
(2)三价铁离子和氨水反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)由上表数据知道Zn2+完全沉淀的pH为8.9,所以应调节溶液pH最好为9,除去溶液中的Zn2+,故答案为:9;
(4)将MnO2溶解,加热除去过量H2O2,得MnSO4溶液的离子方程式为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑,pH为6,使Fe3+沉淀完全,再加活性炭搅拌,加活性炭的作用是吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒,碳酸锰在氧气存在下,受热反应生成二氧化锰,即2MnCO3+O2
△
.
2MnO2+2CO2,
故答案为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑;吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒;2MnCO3+O2
△
.
2MnO2+2CO2;
(5)①根据图示内容,碳酸锰的最高产率为65%左右,可以确定浸泡的温度的温度是60℃左右,故答案为:60;
②碳酸锰的产率最高时,盐酸和硝酸的最佳浓度是6mol/L左右,故答案为:6.点评:
本题考点: 物质分离、提纯的实验方案设计.
考点点评: 本题是一道关于物质的分离提纯的实验方案设计题目,考查学生分析和解决问题的能力,难度大.1年前查看全部
- (2010•常州)如图是某锌锰干电池的剖面图:
 (2010•常州)如图是某锌锰干电池的剖面图:
(2010•常州)如图是某锌锰干电池的剖面图:
(1)锌锰干电池工作时可以将化学能转化为______能;
(2)碳棒具有______性,可作为干电池的电极;
(3)MnO2可作为实验室用双氧水制O2的______;
(4)废旧电池中的锌可回收利用,用于实验室与稀硫酸反应制取氢气.写出该反应的化学方程式:______. 陨石sq1年前1
陨石sq1年前1 -
 anzichun 共回答了12个问题
anzichun 共回答了12个问题 |采纳率100%解题思路:主要涉及到与锌锰干电池相关的一些化学知识点,解题时依据要求对各方面的知识进行分析探讨即可.(1)干电池的工作原理是电池内部发生化学变化并把化学能转化为电能,故答案为:电.(2)作电极的材料一定导电,碳棒也不例外,故答案为:导电.(3)在利用双氧水制取氧气的过程中二氧化锰可作催化剂,故答案为:...
点评:
本题考点: 物质发生化学变化时的能量变化;催化剂的特点与催化作用;金属的化学性质;碳单质的物理性质及用途;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对干电池所包含的化学知识进行的探讨,主要是常规性识记的题目.1年前查看全部
- 电池是日常必备用品之一,但它也是环境污染的一个重要来源.下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程
电池是日常必备用品之一,但它也是环境污染的一个重要来源.下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程,请参与其中

知识储备:
(1)锌锰电池的构造和组成(如图1所示)
(2)结晶水合物:当一些溶质从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水.含有结晶水的化合物称为结晶水合物.硫酸盐常以结晶水合物的形式存在,如胆矾-CuSO4•5H2O,明矾-KAl(SO4)2•12H2O等.
(3)结晶水合物的特殊性质:在逐步升温的条件下,结晶水合物能部分或全部失去结晶水,如蓝色的胆矾晶体(CuSO4•5H2O)在受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4).
(Ⅰ)制备皓矾晶体(ZnSO4•xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图2所示:
(1)已知“锰粉”中除含极少量ZnCl2、Zn(OH)2外,主要成分应NH4Cl、C、______,则加入30%盐酸与Zn(OH)2发生的反为:______.
(2)操作1、操作2均为______,玻璃棒的作用是______.
(3)将滤液2蒸发浓缩、冷却结晶可得皓矾(ZnSO4•xH2O)晶体,蒸发时要用玻璃棒不断搅拌,目的是防止______引起液滴飞溅.
(Ⅱ)皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4•xH2O)带回实验室,用如图3所示装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管):称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为16.1g.
(1)B中的试剂可从下列物质中选取,你的选择是______.
A.浓硫酸B.硝酸银溶液C.饱和碳酸氢钠溶液D.澄清石灰水
(2)实验中有以下步骤,正确的实验操作顺序是______(填选项序号):
①打开K1 ②关闭K1 ③点燃酒精灯④熄灭酒精灯使C中玻璃管冷却至常温
(3)实验过程中若不通入CO2,测得结果将______(填“偏大”、“偏小”或“无影响”).
(4)根据实验结果,计算皓矾晶体中结晶水的x值为______.(写出计算过程)
(Ⅲ)兴趣拓展--回收二氧化锰
小组同学改进实验(Ⅰ)中锰粉的操作步骤后,即可回收二氧化锰固体.
(1)小王同学认为试剂a为水,你认为能不能实现实验目的?答:______.
(2)灼烧一般要在______(填仪器名称)中进行,同时需要的仪器还有泥三角、三脚架等.此处在空气最充分灼烧的目的是除去滤渣中的______.
(Ⅳ)你还想研究的问题是什么?______. wanglin19821年前1
wanglin19821年前1 -
 乖乖_乖 共回答了24个问题
乖乖_乖 共回答了24个问题 |采纳率79.2%解题思路:(Ⅰ)(1)根据图中干电池的构造可知“锰粉”中所含的物质和酸碱中和反应;
(2)根据操作1分离混合物的状态及过滤可用于难溶性固体和可溶性固体的分离进行分析;
(3)根据蒸发时玻璃棒搅拌的作用解答;
(Ⅱ)(1)根据实验的目的是测定皓矾中结晶水的含量所以不使水蒸气随二氧化碳进入碱石灰中分析解答;
(2)根据加热C之前要先通二氧化碳排净装置中的空气后再加热,停止加热待装置冷却后才能停止通二氧化碳解答;
(3)根据空气中含有水蒸气,会影响皓矾中结晶水的测定结果解答;
(4)根据C装置中固体质量的减轻就是失去的结晶水的质量解答;
(Ⅲ)(1)根据锰粉的主要成分及其溶解性分析解答;
(2)根据灼烧所需的仪器和灼烧的目的解答;
(Ⅳ)根据实验中的基本操作和锰粉的成分解答.(Ⅰ)(1)从图1可知锰粉中含有碳、二氧化锰和氯化锌;氢氧化锌和盐酸反应生成氯化锌和水;
(2)根据流程图操作1和2都是不溶性固体和液体的分离,因此是过滤操作,过滤时玻璃棒起到引流的作用;
(3)蒸发时用玻璃棒不断搅拌,防止局部受热造成液滴飞溅;
(Ⅱ)(1)实验的目的是测定皓矾中结晶水的含量所以不使水蒸气随二氧化碳进入碱石灰中,所以B中的试剂具有吸水性,题中四中物质中只有A浓硫酸具有吸水性;
(2)加热C之前要先通二氧化碳排净装置中的空气后再加热,停止加热待装置冷却后才能停止通二氧化碳;
(3)空气中含有水蒸气,碱石灰吸收的既有皓矾分解得到的水蒸气也有空气中的水蒸气,使测定的结果偏大;
(4)28.7g皓矾晶体中结晶水的质量为28.7g-16.1g=12.6g,ZnSO4•xH2O中结晶水的质量分数为[18 x/161+18 x]=[12.6g/28.7g]
x=7
(Ⅲ)(1)“锰粉”中主要成分应NH4Cl、C、二氧化锰,其中氯化铵溶于水,碳和二氧化锰不溶,所以加水氯化铵溶解其余的成分不溶;
(2)坩埚可用于灼烧,灼烧过程锰粉中的碳和空气中的氧气反应生成二氧化碳从而除去锰粉中的碳;
(Ⅳ)从图中实验可知回收了锰粉中的二氧化锰,氯化铵是一种常见的氮肥也可回收;
故答案:(Ⅰ)MnO2;Zn(OH)2+2HCl=ZnCl2+2H2O(2)过滤;引流;(3)局部受热.
(Ⅱ)(1)A;(2)①③④②;(3)偏大;(4)7(过程:略)
(Ⅲ)(1)能;(2)坩埚; 碳(C)
(Ⅳ)能否提取氯化铵?(合理答案即可).点评:
本题考点: 混合物的分离方法;实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;金属的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以信息题的方式考查了物质的分离和提纯,侧重能力的考查.1年前查看全部
- 高中化学普通锌锰干电池有何缺点?相比之下碱性锌锰电池有何不同,做了什么改变?有何优点?
 aiyaya211年前1
aiyaya211年前1 -
 dany11 共回答了15个问题
dany11 共回答了15个问题 |采纳率100%普通锌锰干电池以氯化氨(酸性)为电解质,会腐蚀电池的锌筒且反应有氢气生成,所以容易造成电池膨胀及漏液现象.
碱性锌锰电池的电解质溶液是碱性的,不会腐蚀电池的锌筒且不产生气体,因此不会有漏液现象,而且提供的电流更加稳定和持久.1年前查看全部
- 二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料 利用硫酸亚铁制备高
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料 利用硫酸亚铁制备高
纯二氧化锰.流程图:
其中加热至沸的目的是什么? 冯长华1年前1
冯长华1年前1 -
 伴君ss 共回答了13个问题
伴君ss 共回答了13个问题 |采纳率92.3%加热至沸腾的目的是硫化锰反应彻底1年前查看全部
- 在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:
在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:
Zn+2MnO 2 +2H 2 O=2MnOOH+Zn(OH) 2
下列该电池的电极反应正确的是A.负极反应为Zn-2e - =Zn 2+ B.负极反应为Zn+2H 2 O-2e - = Zn(OH) 2 +H + C.正极反应为2MnO 2 +2H + + 2e - =2MnOOH D.正极反应为2MnO 2 +2H 2 O + 2e - =2MnOOH+2OH -  cyb197420041年前0
cyb197420041年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1,在碱性锌锰干电池和锌银电池中锌作负极,电极反应为ZN-2e+2oh-=zn(oh)2,为什么不能写Zn-2e=Zn2
1,在碱性锌锰干电池和锌银电池中锌作负极,电极反应为ZN-2e+2oh-=zn(oh)2,为什么不能写Zn-2e=Zn2+
2.在氢氧燃料电池中为什么O2在正极得电子就变成了OH-?而且为什么反应式是O2+4e+2h2o=4oh- 为什么有h2o? 888888zh1年前6
888888zh1年前6 -
 林间过客 共回答了14个问题
林间过客 共回答了14个问题 |采纳率85.7%书写电极反应式,需考虑环境(介质)对生成物的影响.Zn2+不能稳定存在于碱性介质中,会生成Zn(OH)2.
O2在正极得电子,按说会变为O2- ,但氧离子只存在高温下.常温下,O2-+H2O=2OH-
所以反应式是O2+4e- +2H2O=4OH-
两题都是介质的问题.1年前查看全部
- 在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,
在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,下列该电池的电极反应正确的是( )
A. 负极反应为Zn-2e-═Zn2+
B. 负极反应为Zn+2H2O-2e-═Zn(OH)2+2H+
C. 正极反应为2MnO2+2H++2e-═2MnOOH
D. 正极反应为2MnO2+2H2O+2e-═2MnOOH+2OH- 影子哦1年前2
影子哦1年前2 -
 6cm9 共回答了17个问题
6cm9 共回答了17个问题 |采纳率88.2%解题思路:该电池中,Zn失电子发生氧化反应作负极,二氧化锰得电子发生还原反应作正极,负极反应式为Zn-2e-+2OH-=Zn(OH)2,正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-,据此分析解答.该电池中,Zn元素化合价由0价变为+2价,所以Zn作负极,Mn元素化合价由+4价变为+3价,所以二氧化锰作正极,根据电池反应式知,负极反应式为Zn-2e-+2OH-=Zn(OH)2,正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-,故选D.
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电极反应式的书写,根据电池反应式知生成物及电解质溶液酸碱性书写电极反应式,为学习难点,注意:碱性介质中不能生成氢离子,酸性介质中不能生成氢氧根离子,为易错点.1年前查看全部
- 干电池是普通锌锰干电池的简称,一般手电筒中使用锌锰干电池.其中正极材料是——,负极材料是——.
 violet20101年前1
violet20101年前1 -
 ff的话记心头2 共回答了16个问题
ff的话记心头2 共回答了16个问题 |采纳率87.5%正极材料是碳棒,负极是锌皮1年前查看全部
- 下列有关原电池的说法不正确的是 A.锌锰干电池中锌电极是负极,工作时锌被还原 B.锌与稀硫酸反应时,加入少量硫酸铜溶液可
下列有关原电池的说法不正确的是
A.锌锰干电池中锌电极是负极,工作时锌被还原 B.锌与稀硫酸反应时,加入少量硫酸铜溶液可使反应加快 C.燃料电池的电极本身不包含活性物质,其燃料和氧化剂由外部供给 D.判断一种电池的优劣主要看其比能量、比功率以及可储存时间的长短  风萧萧CX1年前1
风萧萧CX1年前1 -
 zh1209 共回答了19个问题
zh1209 共回答了19个问题 |采纳率84.2%A
原电池中较活泼的金属作负极,失去电子,被氧化发生氧化反应,选项A是错误的。B中锌可以把铜离子置换出来,生成铜单质,和锌构成原电池,加快反应速率。所以答案选A。1年前查看全部
- 有关锌锰干电池该电池的正极不是生成氢氧化氧锰吗?为什么会生成三氧化二锰?详述化学原理,拒绝任何形式的复制.
 ruby_mw1年前1
ruby_mw1年前1 -
 哆啦些多 共回答了15个问题
哆啦些多 共回答了15个问题 |采纳率80%氢氧化氧锰脱水就是三氧化二锰,2MnO(OH)=Mn2O3+H2O 不同的书写法不同而已.1年前查看全部
- 锌锰干电池中碳极上NH4+获电子生H2 妨碍碳棒与NH4+接触 增大电池内阻 产生极化作用
锌锰干电池中碳极上NH4+获电子生H2 妨碍碳棒与NH4+接触 增大电池内阻 产生极化作用
这句话中, 就这样了阿1年前2
就这样了阿1年前2 -
 林锐 共回答了21个问题
林锐 共回答了21个问题 |采纳率100%电极上有(净)电流流过时,电极电势偏离其平衡值(可逆值)的现象称作极化.当电极上有气体产生时,这种差异会变得很大.电极的极化有浓差极化和电化学极化.气体引起的极化属于电化学极化的一种.
“极化作用”指的就是产生了极化这种现象.它使得电极电势不再等于可逆情况下的电极电势了.
一般来说,电解的时候只需要略大于原电池的电势差就可以,但是有极化作用存在下时,需要比前面的数值大很多的电势差反应才可以发生.因此往往需要“去极化”.1年前查看全部
- 用完电的锌锰干电池为什么还有电压,而且还1点几伏?(我是用万用表测的,测了几颗都一样)
 鹌鹑变大鹏1年前1
鹌鹑变大鹏1年前1 -
 直线电机 共回答了21个问题
直线电机 共回答了21个问题 |采纳率95.2%因为电池内部是氧化反应,新电池的反应很剧烈,因此能提供较大的电流,用到一定程度后,反应就不那么剧烈了,因此带不动负载(如录音机.收音机等),但是不等于电池内部的反应停止了,所以你测量时有点压,但带不动用电器了,1年前查看全部
- 下列说法中正确的是( )A. 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池B. 燃料电池是一种高效但是会污染环境的
下列说法中正确的是( )
A. 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B. 燃料电池是一种高效但是会污染环境的新型电池
C. 化学电池的反应基础是氧化还原反应
D. 铅蓄电池放电的时候:正极是Pb,负极是PbO2 紫袭1年前2
紫袭1年前2 -
 干人尔女马 共回答了18个问题
干人尔女马 共回答了18个问题 |采纳率94.4%解题思路:A.碱性锌锰干电池为一次电池;
B.燃料电池的产物多为CO2、H2O等,不污染环境;
C.化学电池是将化学能转变为电能的装置,有电子的转移,实质为氧化还原反应;
D.铅蓄电池放电的时候,Pb被氧化,为原电池的负极.A.镍氢电池、锂离子电池为二次电池,碱性锌锰干电池为一次电池,故A错误;B.燃料电池有氢氧燃料电池、甲烷燃料电池、乙醇燃料电池等,产物多为CO2、H2O等,不污染环境,故B错误;C.化学电池是将化学能转变为电能...
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查常见原电池的组成以及工作原理,题目难度不大,学习中注意常见原电池的组成以及工作原理,注意相关基础知识的积累.1年前查看全部
- 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 某软锰矿的主要成分为M
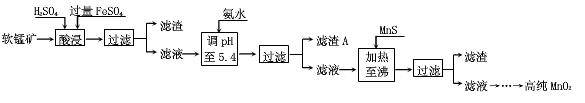
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 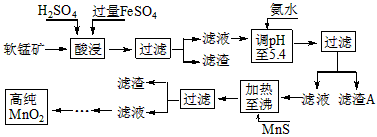
某软锰矿的主要成分为MnO 2 ,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题 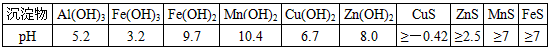
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为
_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO 2 参与的电极反应方程式为___________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。 goodleon1年前1
goodleon1年前1 -
 lbmfff 共回答了18个问题
lbmfff 共回答了18个问题 |采纳率88.9%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 =MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3
(3)Cu 2+ 、Zn 2+
(4)MnO 2 +H 2 O+e - =MnO(OH)+OH - (或2MnO 2 +H 2 O+2e - =Mn 2 O 3 +2OH - )
(5)锌、二氧化锰1年前查看全部
- (7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO 2 ,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
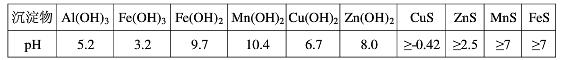
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为______________________________.沉淀物 pH Al(OH) 3 5.2 Fe(OH) 3 3.2 Fe(OH) 2 9.7 Mn(OH) 2 10.4 Cu(OH) 2 6.7 Zn(OH) 2 8.0 CuS ≥-0.42 ZnS ≥2.5 MnS ≥7 FeS ≥7
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO 2 参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种). maxinyan1年前1
maxinyan1年前1 -
 kky0 共回答了17个问题
kky0 共回答了17个问题 |采纳率94.1%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3 (3)Cu 2 + 、Zn 2 +
(4)MnO 2 +H 2 O+e - ===MnOOH+OH - (5)Zn、MnO 2
(1)根据FeSO 4 在反应条件下将MnO 2 还原为MnSO 4 ,Fe 2 + 被氧化为Fe 3 + ,可以写其反应方程式2FeSO 4 +MnO 2 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O。
(2)根据反应后滤液(Mn 2 + 、Fe 3 + 、Al 3 + 、Cu 2 + 、Zn 2 + 、Fe 2 + )加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH) 3 和Al(OH) 3 。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu 2 + 、Zn 2 + .
(4)碱性锌锰干电池中Zn作负极,则MnO 2 作正极得电子.其电极反应式应为 MnO 2 +H 2 O+e - ===MnOOH+OH - 。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO 2 。1年前查看全部
- 南浮电池是什么种类 例如:“555”牌5号电池 锌锰干电池 再说不同种类的电池
 5115211年前1
5115211年前1 -
 蟋蟀的 共回答了22个问题
蟋蟀的 共回答了22个问题 |采纳率86.4%南浮电池绝大多数都是碱性干电池,有5号的,也就是AA电池;也有7号的,也就是AAA电池.
至少我还没有见过南浮的锌锰干电池.1年前查看全部
- ”锌锰干电池自放电时,MnO2发生还原反应,体现还原性“ 为什么不是降价得电子被还原体现氧化性?
 用什么名字1年前1
用什么名字1年前1 -
 成吉思涵 共回答了26个问题
成吉思涵 共回答了26个问题 |采纳率88.5%你说的是对的,这里锌体现出还原性.氧化剂具有氧化性,化合价降低,得电子,被还原,发生还原反应,生成还原产物.1年前查看全部
- 回收废旧锌锰干电池壳得到的物质至少两种
 sdff332431年前1
sdff332431年前1 -
 波千万里 共回答了14个问题
波千万里 共回答了14个问题 |采纳率92.9%锌,锰,钢,铁,碳1年前查看全部
- 锌锰干电池中正极是什么?C棒?OR MnO2?
锌锰干电池中正极是什么?C棒?OR MnO2?
注意!正极! 傻干gg1年前1
傻干gg1年前1 -
 ff简单 共回答了15个问题
ff简单 共回答了15个问题 |采纳率100%锌锰干电池是最常见的化学电源.干电池的外壳(锌)是负极,中间的碳棒是正极,在碳棒的周围是细密的石墨和去极化剂MnO2的混合物.1年前查看全部
- 锌锰干电池的正负电极反应方程式是怎么确定的?
锌锰干电池的正负电极反应方程式是怎么确定的?
注意是怎么确定的不是是什么。 八段圣堂武士1年前1
八段圣堂武士1年前1 -
 西门石桥 共回答了14个问题
西门石桥 共回答了14个问题 |采纳率100%无论什么电池,负极一定发生氧化反应,半反应式中方程左侧会出现失电子的项(或右侧出现得电子的项);正极一定发生氧化反应,半反应式中方程左侧会出现得电子的项(或右侧出现失电子的项).通常而言,参与负极反应的一定有还原性较强的物质,参与正极反应的一定有氧化性较强的物质.1年前查看全部
- 锌锰干电池的电极反应方程式是?
 一笑远红尘1年前1
一笑远红尘1年前1 -
 妖精168 共回答了16个问题
妖精168 共回答了16个问题 |采纳率93.8%这个原理有点超纲,记一下就好了
正2H2O + 2MnO2 +2e- ==== 2MnO(OH)+2OH-
负Zn + 2OH- -Ee-====Zn(OH)21年前查看全部
- 锌锰干电池两极的反应式?
 爱着镜子的老鼠1年前1
爱着镜子的老鼠1年前1 -
 雅之雀 共回答了19个问题
雅之雀 共回答了19个问题 |采纳率94.7%负极(Zn):Zn-2e-==Zn2+
正极(C):2NH4Cl+2MnO2+2e-==(NH3)2Cl2-+2MnO(OH)1年前查看全部
- 锌锰干电池mno2在其中不是电解质溶液不是正极不是负极那么他是干什么的
 tianxiao20081年前1
tianxiao20081年前1 -
 43740221 共回答了14个问题
43740221 共回答了14个问题 |采纳率100%参与化学反应 构成原电池1年前查看全部
- 锌锰干电池储存期间锌壳受腐蚀的原因
锌锰干电池储存期间锌壳受腐蚀的原因
在浆液与封口的交界处出现有腐蚀的现象到底是怎么回事.... luckzsy1年前4
luckzsy1年前4 -
 cylt 共回答了11个问题
cylt 共回答了11个问题 |采纳率90.9%电解质溶液是NH4Cl,水解呈弱酸性,腐蚀了Zn1年前查看全部
- 锌锰干电池自放电腐蚀的反应方程式是什么?
 twincle21年前1
twincle21年前1 -
 灵魂的翅膀 共回答了16个问题
灵魂的翅膀 共回答了16个问题 |采纳率100%锌失电子变成在锌离子溶解1年前查看全部
- 为什么锌锰干电池若没有Mn2O2参与,干电池将难以持续稳定工作
为什么锌锰干电池若没有Mn2O2参与,干电池将难以持续稳定工作
正极反应中,前后经历下列反应:
2NH4- + 2e-=2NH3+ H2 2MnO2 + H2=Mn2O3+H2O khger1年前1
khger1年前1 -
 三答不溜点 共回答了17个问题
三答不溜点 共回答了17个问题 |采纳率88.2%负极反应是Zn与H2O的反应,若正极没有Mn2O2参与,就没有H2O的生成,负极也就失去反应原料,一旦溶液本身的H2O反应完了,电池就不能再工作了1年前查看全部
- 碱性锌锰干电池为什么生成氧化锌要具体点。还要能懂。
 fans55661年前1
fans55661年前1 -
 啊撇 共回答了14个问题
啊撇 共回答了14个问题 |采纳率100%氢氧化性不稳定.
正极的反应是谁得到电子生成氢气,而后氢气被吸收.
负极的反应时锌失去电子生成锌离子,而后结合氢氧根(水得到电子后)形成氢氧化锌.再就是氢氧化锌分解.1年前查看全部
- 知道 > 已解决 锌锰干电池中炭黑什么作用?锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,...
知道 > 已解决 锌锰干电池中炭黑什么作用?锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,...
知道 >
已解决
锌锰干电池中炭黑什么作用?
锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,还填有MnO2糊和炭黑,NH4Cl是正极,淀粉糊提供离子通道,MnO2糊吸收NH3,那炭黑什么作用?
MnO2糊吸收H2
湘茫幽梦2011-4-10
相当于原电池的正极
干电池是以碳棒为正极,锌为负极
干电池内有点解液,
负极中金属失去电子,流到碳棒,由于碳棒有负电子,因此会吸引电解液中的正电子,故会聚集正电子.负极中金属失电子,形成金属阳离子,与电解液中的负离子结合.
与电解液中的负离子结合还是与电解液中的阴离子结合. xcfdfdfdfdf1年前1
xcfdfdfdfdf1年前1 -
 pfr1988 共回答了17个问题
pfr1988 共回答了17个问题 |采纳率64.7%我靠!干电池里有正电子?
炭黑,有很大的表面积和催化活性,在干电池里,用于把电子塞到铵根离子里面,维持外界的电流通路.1年前查看全部
- 废旧锌锰干电池可回收的物质为什么是Zn、MnO2而不是反应的生成物?都用完了怎么还会有Zn、MnO2?
废旧锌锰干电池可回收的物质为什么是Zn、MnO2而不是反应的生成物?都用完了怎么还会有Zn、MnO2?
"可回收的物质""循环利用的物质"这类的题目经常做错, 花心逃兵1年前1
花心逃兵1年前1 -
 小猪比大福 共回答了15个问题
小猪比大福 共回答了15个问题 |采纳率86.7%电池中的Zn、MnO2是不可能都用完的,只用了其中以少部分而已,可回收的物质是剩余的Zn、MnO2.
这个反应的产物是水和氯化锌,氯化锌在溶液中不易收回.1年前查看全部
- 碱性锌锰干电池的电极反应
 gg不猛1年前1
gg不猛1年前1 -
 zll520wr 共回答了20个问题
zll520wr 共回答了20个问题 |采纳率80%正极:MnO2
负极:Zn
电解质:KOH
负极:Zn+2OH-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)21年前查看全部
- 下列有关电池叙述不正确的是( ) A.锌锰干电池是一种常用的二次电池 B.氢氧燃料电池比火力发电的能量转变率要高 C.
下列有关电池叙述不正确的是()
A.锌锰干电池是一种常用的二次电池 B.氢氧燃料电池比火力发电的能量转变率要高 C.锌锰干电池工作一段时间后锌外壳逐渐变薄 D.碱性燃料电池正极反应是O 2 + 2H 2 O + 4e - =4OH -  叶静思1年前1
叶静思1年前1 -
 我只说cc话的 共回答了19个问题
我只说cc话的 共回答了19个问题 |采纳率84.2%A
1年前查看全部
- 下列关于化学电源的叙述错误的是 [ ] A.普通锌锰干电池中碳棒为正极
下列关于化学电源的叙述错误的是 [ ]A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO 2 的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池单位质量输出的电能比普通锌锰干电池多 oo的季节SP1年前1
oo的季节SP1年前1 -
 SB客星 共回答了17个问题
SB客星 共回答了17个问题 |采纳率94.1%B1年前查看全部
大家在问
- 1下表是玉米种子和黄豆种子的食用部分营养表 分析可得出
- 2带有数字的成语???
- 3下列数列中哪个属于动态数列
- 4一艘十万吨远洋货轮价值多少
- 5估测质量一灌可乐,一袋大米,一包食盐,一台彩电
- 6如图,将边长为8cm的正方形纸片ABCD折叠,使点D落在BC边中 点E处,点A落在点F处,折痕为M
- 7英语完形急、急、、、、、、、A UN ------said that the world'spopulation had
- 8一个长方体,长5米,宽3米,高2米,棱长和是______,表面积是______,体积是______.
- 9《新黑马阅读》笑到最后才最美的答案
- 10观察计算 当a=5,b=3时,a+b2与 ab的大小关系是
- 11一道数学题,是流水(行船)问题一艘轮船从甲码头顺水到乙码头顺水需要12小时,从乙码头返回甲码头需要18小时,水流每小时2
- 12六年级寒假新时空78怎么做
- 13娇娇有神 孜孜不倦 迫不及待 学而不倦 见( )思齐 川流不 ( )( )者如斯
- 14I (never see) that man before用所给词填空
- 15已知牛郎星和织女星之间的距离有17光年,他们相距多少千米?
