母液浓度10ppm,100毫升,要配制0.2ppm,50毫升,需要母液多少?求详细解答方法!
 kk为我倾倒2022-10-04 11:39:541条回答
kk为我倾倒2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 小杰xiaojie 共回答了22个问题
小杰xiaojie 共回答了22个问题 |采纳率95.5%- 先计算需要溶质的量,再除以母液浓度就可得出需要母液的量
即,50*0.2/10=1ml - 1年前
相关推荐
- 为什么母液氯化铵中加入氯化钠会析出氯化铵?
为什么母液氯化铵中加入氯化钠会析出氯化铵?
联合制碱法中的疑问 晚饭只吃一根山药1年前1
晚饭只吃一根山药1年前1 -
 ljh2004 共回答了19个问题
ljh2004 共回答了19个问题 |采纳率73.7%(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与卤化钠反应生成一分子的卤化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度很小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.1年前查看全部
- 有机化合物A,分子式为C6H12O,A和NaOH的碘溶液生成黄色沉淀,将母液酸化得到B,B在红磷存在下加入溴单质,得到单
有机化合物A,分子式为C6H12O,A和NaOH的碘溶液生成黄色沉淀,将母液酸化得到B,B在红磷存在下加入溴单质,得到单溴化合物C.C在NaOH醇溶液作用下失去HBr生成D(可使溴水褪色),D和过量的铬酸在硫酸化下蒸馏得到一元酸E(E分子量为60),求ABCDE各为什么物质
 summer831年前1
summer831年前1 -
 aidanzlz1983 共回答了19个问题
aidanzlz1983 共回答了19个问题 |采纳率68.4%A 3-甲基-2-戊酮
B 2-甲基丁酸
C 2-甲基-2-溴丁酸
D 2-甲基-2-丁烯酸
E 乙酸1年前查看全部
- 有关侯氏制碱法的一些问题为什么向母液中通氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
 nn19811221年前3
nn19811221年前3 -
 xhd_home 共回答了17个问题
xhd_home 共回答了17个问题 |采纳率94.1%氨气能提高溶液的碱性和铵根离子的浓度
氢氧根使碳酸氢根变成碳酸根
而按根离子的浓度增大能使氯化铵更纯1年前查看全部
- (10分)制取碘盐的流程如下: 试回答下列问题(1)检验母液中是否含有SO 4 2 - 离子的方法是
(10分)制取碘盐的流程如下:

试回答下列问题
(1)检验母液中是否含有SO 4 2 - 离子的方法是 ▲ 。
(2)过滤时,用到的玻璃仪器有: ▲ 、 ▲ 、 ▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO 3 溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲ mg/Kg(保留一位小数),是否是合格产品 ▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO 3 - +5CNS - +H + +2H 2 O=3I 2 +5HCN+5SO 4 2 - ,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲ 或 ▲ 。 sxwjf0071年前1
sxwjf0071年前1 -
 pn0533 共回答了19个问题
pn0533 共回答了19个问题 |采纳率84.2%(1)取少量母液先加入稀盐酸酸化,再加入BaCl 2 溶液,若有白色沉淀,则说明有SO 4 2 - 离子。
(2)漏斗 玻璃棒烧杯
(3)25.4 不合格
(4)淀粉溶液
(5)2KIO 3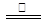 2KI+3O 2 ↑12KIO 3 +6H 2 O
2KI+3O 2 ↑12KIO 3 +6H 2 O 6I 2 +12KOH+15O 2 ↑
6I 2 +12KOH+15O 2 ↑
(第3小题第一小问2分,其它每空1分,共10分)
(1)检验母液中是否含有SO 4 2 - 离子的方法是:取少量母液先加入稀盐酸酸化,再加入BaCl 2 溶液,若有白色沉淀,则说明有SO 4 2 - 离子。
(2)过滤时,用到的玻璃仪器有:漏斗 玻璃棒烧杯
(3)计算出1mL0.001mol/L KIO 3 中碘元素的质量,用碘元素质量除以精盐和KIO 3 的质量和,即可得到该碘盐的含碘量,约为25.4 mg/Kg,销售品≥30mg/Kg,所以此盐不合格。
(4)因为有碘单质生成,所以,还需要的一种试剂,最好是淀粉,因为碘遇淀粉变蓝色。
(5)碘酸钾两种情况下分解的化学方程式:2KIO 3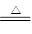 2KI+3O 2 ↑12KIO 3 +6H 2 O
2KI+3O 2 ↑12KIO 3 +6H 2 O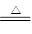 6I 2 +12KOH+15O 2 ↑
1年前查看全部
6I 2 +12KOH+15O 2 ↑
1年前查看全部
- (6分)海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料——纳米氧
(6分)海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料——纳米氧化镁,其简要流程如下:

(1)海水晒盐是_____________(填“物理”或“化学”)变化,包含蒸发、_________等过程。(2)写出食盐的一种用途:____________。(3)A步骤反应的化学方程式是_____________。(4)实验室进行a操作时,需要的玻璃仪器有烧杯、漏斗、_______________。 荫下跃跃1年前1
荫下跃跃1年前1 -
 恋芝风雪 共回答了23个问题
恋芝风雪 共回答了23个问题 |采纳率78.3%(1)物理,结晶(2)做调味品(3)CaCO 3 CaO+CO 2 ↑(4)玻璃棒 根据流程结合已有的知识进行分析,海水晒盐没有生成新的物质,属于物理变化,该过程包含水的蒸发和食盐的结晶;食盐具有咸味,能用...1年前查看全部
- 怎样过滤稀土母液中的杂质?
 xwbll1年前1
xwbll1年前1 -
 我真的跟不上ww 共回答了15个问题
我真的跟不上ww 共回答了15个问题 |采纳率100%这个要看你是什么杂质了,一般不容的就让它沉底抽上清液就行了.过滤就不必了.其它杂质你说我给你对策1年前查看全部
- 提取Nacl后剩余的海水(母液)中的Mg和Br2,先提取哪一个
 lijileisea1年前2
lijileisea1年前2 -
 mjm7912 共回答了21个问题
mjm7912 共回答了21个问题 |采纳率76.2%先澄清一下:海水中没有镁,只有镁离子;没有溴,只有溴离子.提溴的常规做法是通入Cl2,再用空气吹出Br2,碱液吸收,浓缩再酸化.提取镁无外乎就是浓缩结晶得盐了.这样看来,与其先通Cl2,不如先提取镁盐.先去除Mg离子,即生成Mg(OH)2沉淀,后再提取Br2;节约成本.1年前查看全部
- 一道化学题(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参
一道化学题
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参照右图各物质的溶解度曲线。从卤水中提取氯化钾晶体采用下列方法:
①将卤水加热到60℃以上蒸发水分就会逐渐析出_________(填名称)晶体,理由是_________。
②将①中的晶体过滤后,得到滤液,把滤液降温到30℃以下,又析出氯化钾晶体和氯化镁晶体,然后用少量的______(填热水,冷水)洗涤两晶体的混合物,就可以得到较纯的氯化钾晶体。
告诉我答案 并说明为啥 谢谢啦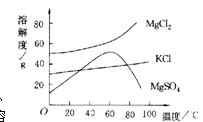
 kcwjq1年前4
kcwjq1年前4 -
 jamesyy 共回答了23个问题
jamesyy 共回答了23个问题 |采纳率87%①硫酸镁
理由:温度高于60℃时,硫酸镁溶解度较小
②冷水
理由:低于30℃时,氯化镁的溶解度大于氯化钾的溶解度1年前查看全部
- 浓度换算问题现有母液1mg/mL的激素NAA,要在1000mL的溶液中加多少 其浓度变为1mg/L,我加了1mL的激素N
浓度换算问题
现有母液1mg/mL的激素NAA,要在1000mL的溶液中加多少 其浓度变为1mg/L,我加了1mL的激素NAA, 大江征战1年前1
大江征战1年前1 -
 765432108 共回答了16个问题
765432108 共回答了16个问题 |采纳率87.5%假设加xml,则
x/(1000+x)=1/1000
1000x=1000+x
解得x=1000/9991年前查看全部
- 如何控制亚氨基二乙酸在母液的溶解点?
 冰雪娃娃1年前3
冰雪娃娃1年前3 -
 szlg2008 共回答了13个问题
szlg2008 共回答了13个问题 |采纳率84.6%利用亚氨基二乙酸-氯化钠-水三元体系溶解度模型
采用电解质型三元体系NRTL活度系数关联方程,建立计算IDA-NaCl-H2O三元体系溶解度数学模型.采用该模型对体系0—60℃范围内的溶解度随温度变化关系进行关联计算,并与实测结果进行对比分析,结果令人满意.按照基团静电作用机制,理论解释了NaCl浓度对IDA溶解度的影响规律.1年前查看全部
- 我想问下几个化学药剂是如何反应的!母液是:把铁屑加入硫酸和硝酸的混合溶液里,煮沸,滴几滴过氧化氢,然后冷却过滤.A:测硅
我想问下几个化学药剂是如何反应的!母液是:把铁屑加入硫酸和硝酸的混合溶液里,煮沸,滴几滴过氧化氢,然后冷却过滤.A:测硅:先加钼酸铵溶液,再加草酸,继续加入硫酸亚铁铵.B:测锰:在母液里先加硝酸银5滴,再加过硫酸铵.C:测P:先加硫代硫酸钠2滴,再加磷显色液(抗坏血酸,无水乙醇,硝酸铋—钼酸铵溶液.
又能力的帮忙写化学反应式, 88快龙1年前1
88快龙1年前1 -
 kuangancheng 共回答了27个问题
kuangancheng 共回答了27个问题 |采纳率88.9%第一步HNO3与H2SO4溶解合金,反应式参看硝酸溶解Fe的,但是H2SO4可以额外提供H+,反应其实不充分,会有Fe2+残留,H2O2可以氧化Fe2+为Fe3+
A生成钨硅酸,之后被还原为钨蓝,组成复杂且不固定,没法写
BAg+催化下过二硫酸铵氧化Mn2+为MnO4-
2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4
C生成磷钼酸,还原为钼蓝,参考A
这么说吧,有几步反应写出化学式才是骗你呢1年前查看全部
- KNO3晶体中混有少量的NACL,经溶解 降温结晶,过滤后得到母液,这母液一定是...的饱和溶液,可能是...的不
 求不得与放不下1年前1
求不得与放不下1年前1 -
 风在海上 共回答了17个问题
风在海上 共回答了17个问题 |采纳率100%一定是KNO3的饱和溶液,因为冷却热饱和溶液会有KNO3析出,既然有晶体析出,那么一定饱和.可能是NaCl的不饱和溶液.1年前查看全部
- 请问:什么是试剂的工作液 浓缩液 母液 稀释液
请问:什么是试剂的工作液 浓缩液 母液 稀释液
试剂配置时经常有这种说法:工作液 浓缩液 母液 稀释液~具体是什么? 专干春kk1年前1
专干春kk1年前1 -
 热带鱼80 共回答了12个问题
热带鱼80 共回答了12个问题 |采纳率91.7%一搜就有.很详细!1年前查看全部
- 有m1gKCL饱和溶液,其溶质的质量分数为c1%,改变温度或蒸发水后析出m3gKCL 饱和溶液,母液质量为m2g,其溶质
有m1gKCL饱和溶液,其溶质的质量分数为c1%,改变温度或蒸发水后析出m3gKCL 饱和溶液,母液质量为m2g,其溶质
的质量分数为c2%则下列关系一定正确的是
A c1一定大于c2 B m1-m3=m2
C m1c1-m2c2=100m3 D 原条件下KCL的溶解度小于c1g
请把每一个选项都分析出来被, 假货地摊ss1年前1
假货地摊ss1年前1 -
 vskkbeyond 共回答了17个问题
vskkbeyond 共回答了17个问题 |采纳率82.4%选C,因为由于溶质减少了m3g,所以m1c1%-m2c2%=m3
此过程要分改变温度或蒸发水两种情况分析:
改变温度时,由于只减少溶质的量没有减少水的量,所以c1大于c2,m1-m3=m2;但蒸发水时,由于同时减少了溶质和水的量,原溶液还是原温度下饱和溶液,所以c1等于c2,m1-m3≠m2;所以A、B错.
因为S/(100+S)=c1%,可得S=100c1/(100-c1)>c1,所以D错1年前查看全部
- ms培养基大量元素母液中,七水硫酸镁和二水氯化钙分别用无水硫酸镁和无水氯化钙代替,会不会使配制时更易
 红塔山19651年前2
红塔山19651年前2 -
 矜持妖妇 共回答了17个问题
矜持妖妇 共回答了17个问题 |采纳率94.1%如果硫酸镁和氯化钙都是无水的话,溶解的时候比较困难,这样反而会使得配置更困难.1年前查看全部
- 我最近想学配ms培养基母液、请问你会吗?可以教教我吗?
 jelly_13141年前1
jelly_13141年前1 -
 andy851899 共回答了20个问题
andy851899 共回答了20个问题 |采纳率90%MS培养基的配制包括以下步骤.培养基母液的配制和保存 MS培养基含有近30种营养成分,为了避免每次配制培养基都要对这几十种成分进行称量,可将培养基中的各种成分,按原量的20倍或200倍分别称量,配成浓缩液,这种浓缩液叫做培养基母液.1年前查看全部
- MS培养基大量元素母液按照什么顺序才不会那么容易产生沉淀?
 daidai5201年前2
daidai5201年前2 -
 llihhui 共回答了20个问题
llihhui 共回答了20个问题 |采纳率95%先加蒸馏水 多加点 然后加母液,容易产生沉淀的两种母液要分开加,顺序上分隔越大越好.1年前查看全部
- 卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下
 卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关物质的溶解度曲线(如图所示)回答下列问题:
卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关物质的溶解度曲线(如图所示)回答下列问题:
(1)将卤水加热升温到160℃以上,随着水分的蒸发,会逐渐析出晶体.这时得到的晶体的主要成分是______.
(2)过滤出上述晶体后,将滤液降温到30℃以下,还会逐渐析出晶体.这时得到的晶体的主要成分是______.
(3)将第(2)步操作得到的晶体用一定量的冷水洗涤,最后可以得到比较纯净的______晶体. longmiao1年前1
longmiao1年前1 -
 小黑SAM 共回答了17个问题
小黑SAM 共回答了17个问题 |采纳率94.1%解题思路:(1)加热时析出晶体,说明该晶体溶解度随温度的生高而降低.
(2)降温时析出晶体,说明该晶体溶解度随温度的降低而降低.
(3)比较温度较低时两种物质的溶解度大小,溶解度小的物质就会析出.(1)观察溶解度图象,当温度大于60℃,随着温度的升高,MgSO4的溶解度反而下降,NaCl的溶解度一直比较低.所以这两种物质就会结晶析出,故答案为:NaCl和MgSO4;
(2)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,MgCl2和KCl随着温度的降低而下降,故答案为:MgCl2和KCl;
(3)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,在温度较低时,MgCl2的溶解度大于KCl的溶解度;所以冷水洗涤时较纯的KCl固体就会析出.低于30℃时,MgCl2的溶解度大于KCl的溶解度,所以,用少量冷水淋洗析出的晶体,就得到较纯的KCl晶体.故答案为:KCl.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;晶体和结晶的概念与现象.
考点点评: 学会分析溶解度图象的方法,并且理解升温或者降温时结晶析出的条件.1年前查看全部
- 卤水(提取食盐后的母液)含有MgCl2、NaCl、MgSO4、KCl.从卤水中提取KCl固体,采用下列方法:
 卤水(提取食盐后的母液)含有MgCl2、NaCl、MgSO4、KCl.从卤水中提取KCl固体,采用下列方法:
卤水(提取食盐后的母液)含有MgCl2、NaCl、MgSO4、KCl.从卤水中提取KCl固体,采用下列方法:
(1)将卤水加热到60℃以上蒸发水分就逐渐析出晶体A,滤出晶体得到母液R,根据下图所示溶解度曲线,晶体A中主要含有______和______,理由是______.
(2)将母液R降温(降到30℃以下)析出晶体B,则晶体B主要含有______和______,理由是______.
(3)将析出的晶体B,用一定量的冷水洗涤,就可以得到较纯的KCl固体,理由是______. 牧川牧川1年前1
牧川牧川1年前1 -
 表现不俗的 共回答了20个问题
表现不俗的 共回答了20个问题 |采纳率90%解题思路:(1)加热时析出晶体,说明该晶体溶解度随温度的生高而降低.
(2)降温时析出晶体,说明该晶体溶解度随温度的降低而降低.
(3)比较温度较低时两种物质的溶解度大小,溶解度小的物质就会析出.(1)观察溶解度图象,当温度大于60℃,随着温度的升高,MgSO4的溶解度反而下降,NaCl的溶解度一直比较低.所以这两种物质就会结晶析出,故答案为:NaCl,MgSO4;温度高于60℃时这两种物质的溶解度较小.
(2)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,MgCl2和KCl随着温度的降低而下降,故答案为:MgCl2,KCl;由于温度下降,这两种物质溶解度也随之下降.
(3)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,在温度较低时,MgCl2的溶解度大于KCl的溶解度;所以冷水洗涤时较纯的KCl固体就会析出.故答案为:低于30℃时,MgCl2的溶解度大于KCl的溶解度,所以,用少量冷水淋洗析出的晶体,就得到较纯的KCl晶体.点评:
本题考点: 固体溶解度曲线及其作用;混合物的分离方法.
考点点评: 学会分析溶解度图象的方法,并且理解升温或者降温时结晶析出的条件.1年前查看全部
- 过滤中,若母液是CuSO4,怎样获得CuSO4·5H2O晶体?加热蒸发,冷却结晶,过滤洗涤.感激不尽!
 争论的误区1年前2
争论的误区1年前2 -
 勇敢_de心 共回答了18个问题
勇敢_de心 共回答了18个问题 |采纳率88.9%加热蒸发的目的是使溶液变成饱和溶液,然后冷却,硫酸铜晶体(即CuSO4·5H2O)的溶解度随着温度降低而减小,所以就会从溶液中结晶析出.过滤后,晶体留在滤纸上,用蒸馏水洗涤.1年前查看全部
- 看说明里面(1)写出下列的化学反应(离子反应的写出离子方程式)贝壳煅烧 石灰乳与母液反应 六水合氯化镁晶体脱水成为氯化镁
看说明里面
(1)写出下列的化学反应(离子反应的写出离子方程式)
贝壳煅烧 石灰乳与母液反应 六水合氯化镁晶体脱水成为氯化镁
氯化镁电解
(2)若在空气中加热六水合氯化镁,生成的是Mg(OH)cl或MgO,写出相应的化学方程式
(3)有X,Y,Z三种元素,它们在常温下均为单质气体,X可以在Z中燃烧,生成物为XZ,火焰为苍白色,XZ极易溶于水,在水中电离出X+与Z-,其水溶液使兰色石蕊试纸变红.每2个X2分子能与一个Y2分子化合成2个X2Y分子,X2Y常温下为液体.Z单质溶于X2Y中,所得溶液具有漂白性.写出X,Y,Z元素符号
(4)(要过程)高锰酸钾与浓盐酸反应制取氯气,
2KMnO4+16HCL==2KCL+2MnCl+5Cl2+8H2O
问:反应中氧化剂为 电子转移的数目为
消耗高锰酸钾15.8克,生成氯气多少升
如果用二氧化锰与浓盐酸制取上面的氯气,消耗二氧化锰多少克 nr089820031年前1
nr089820031年前1 -
 ll外企白领 共回答了18个问题
ll外企白领 共回答了18个问题 |采纳率88.9%(1)贝壳煅烧 CaCO3=CO2+CaO(条件是△)
石灰乳与母液 母液是什么?
六水合氯化镁晶体脱水 MgCl2·6H2O=MgCl2+6H2O(条件是△)
氯化镁电解 MgCl2=Mg+Cl2(条件是通电)
(2)不会啊
(3)X:H Y:O Z:Cl
(4)氧化剂为KMnO4 1molKMnO4电子转移的数目为5mol
生成氯气为(过程)
消耗高锰酸钾的摩尔质量为15.8÷158=0.1mol
2KMnO4+16HCL==2KCL+2MnCl2+5Cl2+8H2O
2————————————————5
0.1mol ————————————x=0.25mol
氯气体积为0.25×22.4=5.6L(标准状况下)
MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
1 ————————————1
y=0.25mol ————————0.25mol
消耗二氧化锰为0.25×87=21.75克
上面方程式中的横线无用处1年前查看全部
- 用重结晶法分离有机物x,y,已知x的溶解度大于y,二者均溶于所用溶剂,则最终结晶,过滤后的母液中 ________ (既
用重结晶法分离有机物x,y,已知x的溶解度大于y,二者均溶于所用溶剂,则最终结晶,过滤后的母液中 ________ (既含有x,又含有y)
为什么? adiner1年前2
adiner1年前2 -
 其染 共回答了20个问题
其染 共回答了20个问题 |采纳率85%重结晶法:
重结晶的一般过程是使重结晶物质在较高的温度下溶于合适的溶剂里;趁热过滤以除去不溶物质和有色杂质;将滤液冷却,使晶体从饱和溶液里析出,而可溶性杂质仍留在溶液里;然后进行减压过滤,把晶体从母液中分离出来;洗涤晶体以除去吸附在晶体表面上的母液.
不管在什么温度下,物质总是有一定的溶解度的,所以母液里总是会含有x,y
分离操作只是将大部分的x与y分开而已.
:)1年前查看全部
- 海水晒盐.母液是nacl的饱和溶液,也是所含杂质cacl2的饱和溶液和mgcl2的饱和溶液,
 a5ohh1年前1
a5ohh1年前1 -
 mark1982 共回答了33个问题
mark1982 共回答了33个问题 |采纳率90.9%不对,因为这三个物质在同等质量的溶剂水中的溶解度不同所以说是饱和的就不对,因为他们的含量不同!1年前查看全部
- 这个该怎么算啊?现在有(20%,M/V)SDS的母液,实验需要1%(M/V)的SDS,要怎么计算呢?感激不尽!
 royalist891年前2
royalist891年前2 -
 yeahly 共回答了17个问题
yeahly 共回答了17个问题 |采纳率94.1%设20%的母液有100ml,
则含SDS的质量为100×20%=20克
需加水x毫升(是水溶液吗?):
20/(100+x)*100%=1%
x=1900ml
即在100ml母液中加入1900ml水即可.1年前查看全部
- 侯氏制碱法中在过滤后的母液中加入氯化钠粉末,通入氨气,来使副产品氯化铵晶体析出
侯氏制碱法中在过滤后的母液中加入氯化钠粉末,通入氨气,来使副产品氯化铵晶体析出
加入细小食盐颗粒并冷却,就是利用氯化铵在低温下溶解度比NaCL小的原理,来析出氯化铵,一直不理解为什么氯化铵在低温下溶解度比NaCL小就能使氯化铵析出,这跟氯化铵和氯化钠的溶解度有关吗 还有,如果不加入氯化钠不可以吗 ss市民1年前4
ss市民1年前4 -
 xu568306675 共回答了14个问题
xu568306675 共回答了14个问题 |采纳率100%不可以的,加入氯化钠是因为氯化钠可以在溶液中加入氯离子,而且溶解度很高,其实如果不再加氯化钠,也可以析出氯化铵,因为氯化铵低温溶解度较小,低温下易饱和.而加入氯化钠之后可让氯化铵析出更多.NH4(+)+Cl-==NH4Cl(中间为可逆号)加入氯化钠,氯离子增多,促进方程式右移,析出增多.1年前查看全部
- (2002•海南)饱和溶液析出晶体后,若温度不变,则剩余的母液一定是( )
(2002•海南)饱和溶液析出晶体后,若温度不变,则剩余的母液一定是( )
A.稀溶液
B.纯溶剂
C.不饱和溶液
D.饱和溶液 候补男友1年前1
候补男友1年前1 -
 夜半灵心 共回答了20个问题
夜半灵心 共回答了20个问题 |采纳率90%解题思路:可以根据结晶的概念与原理方面进行分析、判断,当晶体从饱和溶液中析出后,说明该温度该溶液中不能继续溶解该溶质,从而得出正确的结论.当晶体从饱和溶液中析出后,说明该温度该溶液中不能继续溶解该溶质,此时剩余的液体被称为母液,它通常是饱和溶液.
故选D点评:
本题考点: 饱和溶液和不饱和溶液;晶体和结晶的概念与现象.
考点点评: 解答本题的关键是要掌握饱和溶液的定义,只有这样才能对问题做出正确的判断.1年前查看全部
- 氨氮母液3.819g氯化铵是如何计算出来的
 上书房跑步1年前1
上书房跑步1年前1 -
 百合花盛开0 共回答了22个问题
百合花盛开0 共回答了22个问题 |采纳率90.9%这个是初中化学的知识就可以计算了.可能你对一些概念不是很懂,我给你解说一下.
氨氮,是以铵的形势存在,以氮来计算.
因为手头没计算器,我用二氧化硫举例,它的分子量是64,硫元素32,氧元素16×2=32,也就是说,每64g二氧化硫,含有氧就是32g.
同样的道理,设你需要100g氨氮,则需要铵的量计算出来,为a,又因为a是包含于氯化铵中的,所以氯化铵的量就是b.
明白了吧1年前查看全部
- 乙酰苯胺重结晶过程中若发现母液中有少量活性炭,是什么原因?该怎么处理?
 zzxjdxls1年前2
zzxjdxls1年前2 -
 liuhan888 共回答了23个问题
liuhan888 共回答了23个问题 |采纳率95.7%活性炭使用过量,因其对被提纯物即乙酰苯胺本身的吸附而进入母液.1年前查看全部
- (2012•安徽)海洋中有丰富的水生生物和化学资源.海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料
(2012•安徽)海洋中有丰富的水生生物和化学资源.海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料--纳米氧化镁,其简要流程如图:

(1)海水晒盐是______(填“物理”或“化学”)变化,包含蒸发、______等过程.
(2)写出食盐的一种用途:______.
(3)A步骤反应的化学方程式是CaCO3
CaO+CO2↑高温 .CaCO3.
CaO+CO2↑高温 .
(4)实验室进行a操作时,需要的玻璃仪器有烧杯、漏斗、______. single3141年前1
single3141年前1 -
 nonozht 共回答了14个问题
nonozht 共回答了14个问题 |采纳率92.9%解题思路:根据流程结合已有的知识进行分析,海水晒盐没有生成新的物质,属于物理变化,该过程包含水的蒸发和食盐的结晶;食盐具有咸味,能用作调味品;碳酸钙高温能分解生成氧化钙和二氧化碳;过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒等.(1)海水晒盐没有生成新的物质,属于物理变化,该过程包含水的蒸发和食盐的结晶,故填:物理,结晶;
(2)食盐具有咸味,能用作调味品,故填:做调味品;
(3)碳酸钙高温能够分解生成氧化钙和二氧化碳,故填:CaCO3
高温
.
CaO+CO2↑;
(4)过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒等,故填:玻璃棒.点评:
本题考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;碳酸钙、生石灰、熟石灰之间的转化;氯化钠与粗盐提纯;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了海洋资源的利用,完成此题,可以依据已有的知识进行,要求同学们加强对基础知识的储备,以便灵活应用.1年前查看全部
- 硫酸铵母液结晶颗粒过小离心过程损失过多 成平收获过少 洁净不增长
 alexgujie1年前2
alexgujie1年前2 -
 lel220 共回答了19个问题
lel220 共回答了19个问题 |采纳率68.4%从新溶解得到接近饱和溶液,然后缓慢地降温,不要去干扰(拿,搅拌)溶液,就会得到很好的晶体.1年前查看全部
- 请教你一下草酸沉淀硫酸铵稀土的详细固体草酸用量,如:100立方母液如何确定草酸用量?
 南山愚公1年前2
南山愚公1年前2 -
 wjf0098 共回答了16个问题
wjf0098 共回答了16个问题 |采纳率75%我的客户每次要30吨硫酸铵的时候加6吨左右草酸1年前查看全部
- 请教用硫酸铵浸出稀土母液后,用草酸沉淀稀土时草酸用量讲究吗?那么怎样来计算草酸的用量?
 jiangshuiliu1年前1
jiangshuiliu1年前1 -
 嚣张づ帅帅 共回答了26个问题
嚣张づ帅帅 共回答了26个问题 |采纳率88.5%一点五倍的样子 至于含量可以先取样用草酸沉淀测试下1年前查看全部
- 在Kcl重结晶过程中析出的kcl(s)化学势为什么小于母液中kcl化学势?
 小汤圆candy1年前1
小汤圆candy1年前1 -
 marimo1987 共回答了21个问题
marimo1987 共回答了21个问题 |采纳率90.5%因为析出的是固体啊,母液中的是离子态,同一物质固态的化学势必然低于离子态的化学势.
化学势越低,其能量越低,状态越稳定.1年前查看全部
- 如何计算重结晶时留在母液中的乙酰苯胺的量?
 灌水两个月1年前1
灌水两个月1年前1 -
 jalwo 共回答了21个问题
jalwo 共回答了21个问题 |采纳率85.7%粗产品测下纯度,重结晶后产品再测下纯度
粗产品质量*纯度-重结晶后产品质量*纯度即可得到结果1年前查看全部
- 重结晶中:让杂质全部或大部分仍留在母液中
重结晶中:让杂质全部或大部分仍留在母液中
杂质在溶剂中的溶解度较大,热溶解的时候大部分杂质都融在溶剂里了,之后是直接把过滤下来的晶体干燥就行了?还是怎么着?为什么老师说要提取的有机物要在热的溶剂里溶解度大,冷的溶剂里溶解度小?重结晶 一定要按照 热溶解 热过滤 冷却结晶的顺序么? faretheewell1年前1
faretheewell1年前1 -
 爱神DANDAN 共回答了17个问题
爱神DANDAN 共回答了17个问题 |采纳率88.2%“杂质的溶解度大”这种理解是错误的:杂质是因为含量少,重结晶时形成的是不饱和溶液,因此不会结晶析出.
不管在冷的溶剂中还是在热的溶剂中,杂质都形成不饱和溶液,因此不会结晶析出.
热溶解的目的是为了提高目的产物的溶解度,减少溶剂的使用量,在冷却结晶后才会有更多的目的产物晶体析出,提高回收率.1年前查看全部
- 母液都有什么成分呢?rt 我很好奇 想知道 有知道的吗?求告知
 狂爱飞轮海1年前2
狂爱飞轮海1年前2 -
 wzy_eagle 共回答了21个问题
wzy_eagle 共回答了21个问题 |采纳率85.7%母液的意思就是循环使用的溶液.因为经常对其成分作出调整,但是溶液是循环使用的(回收其中的有价物质),不是用过就倒掉.
丙酮的生产方法不同,因此母液并不相同.主要有异丙醇法、异丙苯法、发酵法、乙炔水合法和丙烯直接氧化法.目前世界上丙酮的工业生产以异丙苯法为主.世界上三分之二的丙酮是制备苯酚的副产品,是异丙苯氧化后的产物之一.
异丙苯法制丙酮,联产苯酚以丙烯和苯为原料,经烃化制得异丙苯,再以空气氧化得到氢过氧化异丙苯,然后以硫酸或树脂分解,同时得到丙酮和苯酚;其母液可能还有原料异丙苯和产物苯酚.
回答了这么多你是不是应该把分给我呢?1年前查看全部
- 培养基母液配制的方法如何
 zzool1年前1
zzool1年前1 -
 hh通用 共回答了18个问题
hh通用 共回答了18个问题 |采纳率94.4%一般配制成百倍浓度的.
譬如CoCl2溶液的培养基浓度是0.006%,那你就配制成0.6%的溶液,配制一升培养基的话取10ml即可.
通常我们的实际情况是同一个培养基需要配制多个母液,我们可以将多个微量元素配制在一起,然后在溶液里加几滴浓硫酸,保证母液的稳定性.
然后母液应该放在冰箱里4℃冷藏.最好是避光,譬如用棕色瓶分装或外裹一层牛皮纸.
使用时则尽量用干净无菌的吸管来移液,或者直接用移液器,枪头一般一次性使用.1年前查看全部
- 配置培养基母液时为什么要按顺序加入各种药品
 yuermi1年前2
yuermi1年前2 -
 36504080 共回答了18个问题
36504080 共回答了18个问题 |采纳率94.4%如果先后顺序弄错,有可能会导致母液出现沉淀等各种反应,导致培养基失效或效果降低.1年前查看全部
- 我有母液浓度2000ppm的,想要配个浓度为50ppm的,该怎么配?用纯水.有公式的请列出公式.
我有母液浓度2000ppm的,想要配个浓度为50ppm的,该怎么配?用纯水.有公式的请列出公式.
2000ppm的cod标准液. yinzhuke1年前1
yinzhuke1年前1 -
 都市牡牛 共回答了24个问题
都市牡牛 共回答了24个问题 |采纳率79.2%50ppm = 2000ppm / 40 = 1/40 ( 2000)
所以 1 - 1/40 = 39/40就是 水的占比
公式就是 纯水量 = 39*母液量1年前查看全部
- [初三化学]1】析出晶体后的母液是不饱和溶液吗?
[初三化学]1】析出晶体后的母液是不饱和溶液吗?
2】40℃时物质甲在水中的溶解度为60g.当40℃时把80g甲固体放进100g水中,充分搅拌,所得溶液的质量是多少?
3】50℃时某溶液所溶解的甲和乙物质都已饱和,把该溶液冷却到室温,有晶体析出,晶体主要是甲,原因是____(填编号)
①50℃时甲溶解度最大
②50℃时乙溶解度最大
③甲的溶解度受温度变化比乙大
4】溶质、溶剂、溶液之间,有怎样的量的关系?
唉,我们还没学这些,寒假作业就要做这种题TAT 莫然如春1年前3
莫然如春1年前3 -
 nteemr 共回答了12个问题
nteemr 共回答了12个问题 |采纳率75%1】析出晶体后的母液是不饱和溶液吗?
不是.因为溶液饱和了,所以才有晶体析出.所以母液是饱和溶液.
2】40℃时物质甲在水中的溶解度为60g.当40℃时把80g甲固体放进100g水中,充分搅拌,所得溶液的质量是多少?120g对不对?
溶解度:100g水中所能溶解的溶质的最大量.所以当40℃时把80g甲固体放进100g水中,只有60g溶解.溶液质量 = 100+60=160g
3】50℃时某溶液所溶解的甲和乙物质都已饱和,把该溶液冷却到室温,有晶体析出,晶体主要是甲,原因是__3__(填编号)
①50℃时甲溶解度最大
②50℃时乙溶解度最大
③甲的溶解度受温度变化比乙大
溶解度受温度变化越大,则当温度改变时,晶体越容易析出.
4】溶质、溶剂、溶液之间,有怎样的量的关系?
溶质质量 + 溶剂质量 = 溶液质量1年前查看全部
- 配置MS培养基母液时为什么要按顺序加入各药品?
配置MS培养基母液时为什么要按顺序加入各药品?
且溶解CaCl2.2H2O时,为什么要将蒸馏水加热?
且溶解CaCl2.2H2O时,为什么要将蒸馏水加热?
防沉淀、失效、减効。加热:除去二氧化碳。 zhangqicai1年前1
zhangqicai1年前1 -
 嫣如 共回答了18个问题
嫣如 共回答了18个问题 |采纳率88.9%大量元素原则上是可以混在一起溶解,硫酸镁和氯化钙一定要单独溶解,因为高浓度的钙离子和镁离子在磷酸盐中混合,会产生不溶解性沉淀,所以要分开溶解到最后定容.
而氯化钙虽然可溶于水,但是在热水中可以可以更好溶解.一般用个的一次蒸馏水是含有二氧化碳的但是这个对一般组培影响不大,可以不考虑除去.1年前查看全部
- 30%过氧化氢配成5mmol/L的溶液取多少母液
30%过氧化氢配成5mmol/L的溶液取多少母液
同题,要计算公式.呵呵, 炽血天使1年前1
炽血天使1年前1 -
 dyaxjl1314 共回答了22个问题
dyaxjl1314 共回答了22个问题 |采纳率95.5%瓶装过氧化氢的密度1.10g/ml,假设配制5mmol/Lg过氧化氢的体积为1L,需取30%的过氧化氢Xml,则:
X(ml)*30%*1.10(g/ml)/34(g/mol)*1000=5mmol/L*1L
X=0.5ml
其中:34是过氧化氢的摩尔质量,乘以1000是把mol转化成mmol1年前查看全部
- 侯式制碱法的原理不能在氯化钠溶液中通入二氧化碳,然后再通如氨气制得碳酸氢钠得原因是_____在析出小苏打得母液中加入生石
侯式制碱法的原理
不能在氯化钠溶液中通入二氧化碳,然后再通如氨气制得碳酸氢钠得原因是_____
在析出小苏打得母液中加入生石灰发生反应的化学方程式是________ 陈学1年前2
陈学1年前2 -
 guyue2317 共回答了12个问题
guyue2317 共回答了12个问题 |采纳率91.7%联合制碱法(侯氏制碱法)
根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥.
此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,革除了CaCO3制CO2这一工序.1年前查看全部
- 几题科学题~1.下列正确的是( ) 1、饱和溶液降温析出晶体,过滤后的溶液叫母液,仍也饱和溶液 2、降低饱和溶液的温度,
几题科学题~
1.下列正确的是( ) 1、饱和溶液降温析出晶体,过滤后的溶液叫母液,仍也饱和溶液 2、降低饱和溶液的温度,不一定都有晶体析出 3、粗盐的提纯可用冷却热饱和溶液结晶法 A、1.2.3 B、2.3 C、2 D、1.2 2.要使食盐大量地从饱和溶液中结晶出来,应选择的方法是( ) A.升高温度 B.降低温度 C.蒸发溶剂 D.增大压强 3.50℃时,A物质溶液100克,在温度不变的条件下先蒸发掉10克水,又有5克晶体析出,则A物质在50℃时的溶解度为( ) A、4克 B、5克 C、40克 D、50克 4.在硫酸铜饱和溶液中加入一块硫酸铜晶体,保持温度不变,若忽略液体的蒸发,则加入的晶体质量( ) (填“不变”或“改变”,下同),形状( ) 别了康桥1年前1
别了康桥1年前1 -
 bknde 共回答了19个问题
bknde 共回答了19个问题 |采纳率84.2%1.D 2.C 第三题题目错了 . 4.不变 不变 (这题你也搞错了吧. 哪有人没事干往饱和硫酸铜溶液里加硫酸铜晶体啊.加胆矾还差不多 再看看题目吧 是不是抄错了)1年前查看全部
- 侯氏制碱法中,为什么向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出,不加食盐细粉可不可以?
 心事在飞1年前3
心事在飞1年前3 -
 用户017 共回答了12个问题
用户017 共回答了12个问题 |采纳率100%这是同离子效应,它们共同有Cl离子,而且NaCl相对于NH4Cl是强电解质.氯离子的加入,使NH4Cl电离平衡向分子方向移动,就析出来了.
在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的解离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应.1年前查看全部
- 为什么母液氯化铵溶液中加入氯化钠晶体后会析出氯化铵?
 liarone1年前1
liarone1年前1 -
 weinierlail 共回答了14个问题
weinierlail 共回答了14个问题 |采纳率92.9%(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与卤化钠反应生成一分子的卤化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度很小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
回答者:some_thing - 首席执行官 十四级 12-19 09:251年前查看全部
- 聚羧酸减水剂母液一般是什么颜色?
 ljh20041年前2
ljh20041年前2 -
 晴天小芸 共回答了25个问题
晴天小芸 共回答了25个问题 |采纳率96%有黄色的,红色的,透明的等多种颜色,原材料及工艺不同,做出的颜色也不同,常见的就是上边三种1年前查看全部
- 植物组织培养为什么要配置母液
 hzyyl1年前3
hzyyl1年前3 -
 wujie1007 共回答了23个问题
wujie1007 共回答了23个问题 |采纳率95.7%母液的配置在植物组织培养是的作用一是提供所培养外植体的基本营养成份;二是方便培养基的配制.1年前查看全部
- 利用海水淡化后母液中含有的氯化镁和海边盛产的贝壳(主要成分CaCO3),制取金属镁,生产大致流程如图所示:
利用海水淡化后母液中含有的氯化镁和海边盛产的贝壳(主要成分CaCO3),制取金属镁,生产大致流程如图所示:
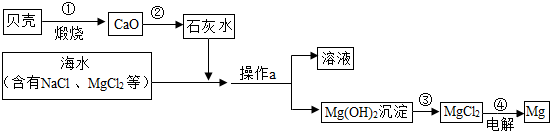
(1)请写出母液中氯化镁转化为氢氧化镁的化学方程式:______.
(2)操作a的名称是______.
(3)工业上常以氯化镁为原料,电解就可以生产金属镁.反应的化学方程式为MgCl2
Mg+X.X的化学式是______.通电 . 五叶虫1年前1
五叶虫1年前1 -
 zo6ht 共回答了13个问题
zo6ht 共回答了13个问题 |采纳率76.9%解题思路:(1)根据氯化镁转化为氢氧化镁的反应,写出反应的化学方程式;
(2)根据实验的操作分析操作的名称;
(3)根据质量守恒定律反应前后原子的种类及数目不变分析X的化学式.(1)由反应的流程可知,氯化镁转化为氢氧化镁的反应是氯化镁与氢氧化钙反应生成了氢氧化镁沉淀和氯化钙,反应的化学方程式是:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;
(2)由反应的流程可知,操作a是将固液分开,操作的名称是过滤;
(3)在化学方程式为MgCl2
通电
.
Mg+X中,左边有镁原子1个,氯原子两个,右边有镁原子1个,由质量守恒定律反应前后原子的种类及数目不变可知,X的化学式是:Cl2.
故答为:Ⅰ.(1)MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;(2)过滤;(3)Cl2.点评:
本题考点: 物质的相互转化和制备;碳酸钙、生石灰、熟石灰之间的转化;盐的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题涉及到镁的生产过程,所考查知识点较多,但都较简单,所以题目本身不难.1年前查看全部
大家在问
- 1氢氧化钠与少量氯化铝反应方程式
- 20是关于X的方程,(M-2)X的平方+3X+M的平方+2M_8=0求实数M
- 3现有氯酸钾和二氧化锰的混合物16.5克,将其加热到不再分解为止,冷却后称得残余固体物质质量为11.7克,求
- 4所有细胞的组成成分都含有纤维素.______(判断对错).
- 5my future job英语作文
- 6a1²+a2²+a3²+……+an²≥1/n(a1+a2+a3+……+an)
- 7(2007•永州)张巧同学,在省里举行的体操比赛中取得了第一名的好成绩.你认为这一成绩的取得,除了她刻苦训练外,还与下列
- 8设G是n介有限循环群 且m整除n 求证:G一定有m元子群
- 9一个两位数,加上36以后还是两位数,且十位上的数字与个位上的数字正好互换位置.这样的两位数有______个,最大的一个是
- 10检查视力的时候,医生将视力表放在被测者头部后面0.4m的地方,距离平面镜2.5m,如图所示.被测者识别视力表在对面墙上镜
- 11急1.can you see the ( )on the mountain?they are fat and stron
- 12已知集合A={x|(x-5)/(x+1)
- 1334倍根二乘以四分之根6加根2,除以二分之一等于多少,急用
- 14the weather is very hotthe children are ___(swim/swimming)in
- 15动物在生物圈中的作用不包括下列哪一项( ) A.能帮助植物传播花粉、果实、种子 B.能促进生态系统的物质循环 C.能促
