下表是某厂生产的加钙食盐包装标签上的部分内容,请仔细阅读后问答以下问题:
 优雅着yy2022-10-04 11:39:541条回答
优雅着yy2022-10-04 11:39:541条回答| 下表是某厂生产的加钙食盐包装标签上的部分内容,请仔细阅读后问答以下问题: (1)KIO 3 的相对分子质量是______; (2)KIO 3 中碘(I)元素的质量分数为______; (3)商标上的钙含量是指______(选填“单质钙”、“碳酸钙”、“钙元素”).  |

已提交,审核后显示!提交回复
共1条回复
 jiangxu 共回答了13个问题
jiangxu 共回答了13个问题 |采纳率76.9%- (1)KIO 3 的相对分子质量=39+127+16×3=214;
(2)碘酸钾KIO 3 中碘元素的质量分数=
127
214 ×100%=59.3%.
(3)因为某种加钙食盐中的钙是以化合物的形式存在,化合物是由元素组成的,故包装标签上钙含量是指钙元素; - 1年前
相关推荐
- 如图是某厂生产的加钙碘盐包装袋商标的部分内容.
如图是某厂生产的加钙碘盐包装袋商标的部分内容.

请阅读后回答以下问题:
(1)求一袋该食盐中KIO3的质量最多为多少?
(2)为了测定此盐中钙元素的含量,取10g这种盐溶于水,加入足量盐酸,生成O.132g二氧化碳.请计算此加钙食盐中钙元素的质量分数. harbuziaway1年前1
harbuziaway1年前1 -
 bdlee_99 共回答了20个问题
bdlee_99 共回答了20个问题 |采纳率95%解题思路:(1)根据标签的信息可以知道碘的含量最多为50mg/Kg,可以据此来求算出碘酸钾的最大含量.
(2)根据生成的二氧化碳的质量计算出碘盐中碳酸钙的质量,然后计算才钙元素的质量,最后计算出钙元素的质量分数即可.(1)碘酸钾中碘元素的质量=[127/39+127+16×3]×100%=59.3%
根据标签可得出碘的含量最多为50mg/Kg,所以所以一袋碘盐中碘元素的质量=50mg/Kg×0.5Kg=25mg,
所以一袋该食盐中KIO3的最大含量=25mg÷59.3%=42.2mg.
(2)设10g食盐中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.132g
[100/x=
44
0.132g]
解得:x=0.3g
所以钙元素的质量为:0.3g[40/100]×100%=0.12g
所以钙元素的质量分数为:[0.12g/10g]×100%=1.2%
答:(1)一袋该食盐中KIO3的质量最多为42.2mg;
(2)此加钙食盐中钙元素的质量分数为1.2%.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 读懂标签,理解化学式的意义,能够根据化学式熟练的求出物质的相对分子质量及各元素的质量分数等基本计算.1年前查看全部
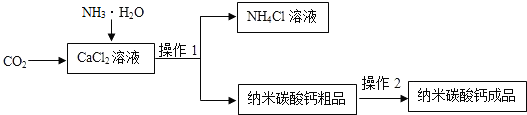
- (8分)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请答下列问题:
(8分)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请答下列问题:

(1)试剂A的化学式为 ,操作1和操作2的名称是 ,若在实验室中进行该操作,实验中玻璃棒的作用是 。
(2)操作3为 和 。
(3)写出向氯化钡溶液加入氢氧化钾并通入二氧化碳时发生反应的化学方程式
, 。
(4)该流程中的副产物可用作 。(写一种用途) 幽香蓝月1年前1
幽香蓝月1年前1 -
 快打小子 共回答了17个问题
快打小子 共回答了17个问题 |采纳率82.4%(1)HCl 过滤 引流 (2)洗涤 干燥(或烘干)
(3)2KOH+CO 2 =K 2 CO 3 +H 2 O K 2 CO 3 +BaCl 2 =BaCO 3 ↓+2KCl
(4)钾肥或化肥
1年前查看全部
- 下表是某厂生产的加钙食盐包装标签上的内容,请仔细阅读后问答以下问题:
下表是某厂生产的加钙食盐包装标签上的内容,请仔细阅读后问答以下问题:
(1)CaCO 3 的相对分子质量是______;
(2)KIO 3 中碘元素的质量分数为______;
(3)一袋该食盐中碘元素的质量为______g.
 sinadoor1年前1
sinadoor1年前1 -
 wang123155 共回答了13个问题
wang123155 共回答了13个问题 |采纳率76.9%(1)CaCO 3 的相对分子质量是40+12+16×3+16=100.
(2)KIO 3 中碘元素的质量分数为
127
39+127+16×3 × 100%≈59.3%.
(3)500g=0.5kg;由标签信息可知,碘的含量最多为50mg/kg,则一袋碘盐中碘元素的质量=50mg/kg×0.5kg=25mg=0.025g.
故答案为:(1)100;(2)59.3%;(3)0.025.1年前查看全部
- 纳米碳酸钙是一种重要的无机化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
纳米碳酸钙是一种重要的无机化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
请回答下列问题: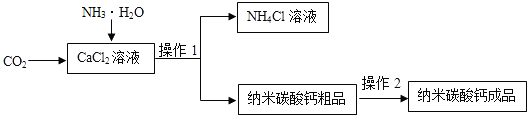
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:CaCl2+______+CO2=CaCO3↓+______+H2O
(2)若在实验室中进行该实验,操作1的名称是______,使用到的非玻璃实验用品有______、______.
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有______(写一种化学式即可).操作2为:______、检验和干燥,检验操作中选用的试剂为______(选择序号).
①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液 ④Ba(NO3)溶液
(4)上述流程中的副产品可用作______.(写一种用途) 看的真累1年前1
看的真累1年前1 -
 bidndx 共回答了22个问题
bidndx 共回答了22个问题 |采纳率86.4%解题思路:(1)根据方程式的写法考虑;
(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;
(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;
(4)根据副产品的组成和用途考虑.(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号,所以化学方程式是CaCl2+2NH3•H2O+CO2=CaCO3↓+2NH4Cl+H2O;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(4)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料.
故答案为:
(1)2NH3•H2O; 2NH4Cl;(2)过滤、滤纸、漏斗架(或铁架台、铁圈);(3)NH4Cl 或CaCl2、洗涤、②;(4)氮肥(化学肥料、化肥等均可)点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- (2013•滨湖区一模)纳米碳酸钙是一种重要的无机化工产品.下图是某厂生产纳米碳酸钙的工艺流程.
(2013•滨湖区一模)纳米碳酸钙是一种重要的无机化工产品.下图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+______═CaCO3↓+(NH4)2SO4
(2)操作Ⅰ的名称是______.在实验室里进行操作Ⅰ需要用到的玻璃仪器有玻璃棒、烧杯和______.
(3)纳米碳酸钙粗品洗涤后的溶液中含有的物质可用______(填所需试剂)进行检验.
(4)生产中的(NH4)2SO4晶体可用作______(写一种用途). yjrd1年前1
yjrd1年前1 -
 2007_shu 共回答了17个问题
2007_shu 共回答了17个问题 |采纳率82.4%解题思路:(1)根据反应前后各种原子的种类和数目不变考虑本题;(2)根据不溶于液体的固体和液体分离的一种方法和操作过程中用到的仪器考虑;(3)根据硫酸根离子的检验方法考虑;(4)根据肥料的分类考虑.(1)生成物中含有1个钙原子、1个碳原子、7个氧原子、2个氮原子、8个氢原子、1个硫原子;反应物中已经含有1个钙原子、1个碳原子、6个氧原子、2个氮原子、6个氢原子、1个硫原子,还缺少2个氢原子和1个氧原子,所以空格中填H2O;
(2)不溶于液体的固体和液体分离的一种方法是过滤,过滤时用到的玻璃仪器有:烧杯、漏斗、玻璃棒;
(3)纳米碳酸钙粗品洗涤后的溶液中含有的物质是硫酸铵,所以检验出是否含有硫酸根离子就行,所以可以用硝酸钡,如果有沉淀生成,说明含有硫酸铵;
(4)化学式中含有氮元素,所以硫酸铵可用作氮肥.
故答案为:(1)H2O;(2)过滤;漏斗;(3)硝酸钡;(4)氮肥.点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题关键是要知道反应前后原子种类和数目不变,知道过滤除去的杂质类别,用到的仪器,知道硫酸根离子的检验方法,硫酸铵属于氮肥.1年前查看全部
- (2007•石景山区一模)(1)如图是某厂生产的葡萄糖酸锌口服液的标签,从标签中可知:葡萄糖酸锌是由______种元素组
 (2007•石景山区一模)(1)如图是某厂生产的葡萄糖酸锌口服液的标签,从标签中可知:葡萄糖酸锌是由______种元素组成的;每支口服液含葡萄糖酸锌45.5mg,标签中“----”上的数据是______.
(2007•石景山区一模)(1)如图是某厂生产的葡萄糖酸锌口服液的标签,从标签中可知:葡萄糖酸锌是由______种元素组成的;每支口服液含葡萄糖酸锌45.5mg,标签中“----”上的数据是______.
(2)欲配制600g 溶质质量分数为5%的双氧水用于制取O2,需30%的双氧水的质量是______g. honghong55441年前1
honghong55441年前1 -
 xuelimm 共回答了20个问题
xuelimm 共回答了20个问题 |采纳率100%解题思路:(1)根据葡萄糖酸锌化学式的含义、化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.(1)葡萄糖酸锌是由碳、氢、氧、锌四种元素组成的;每支口服液含葡萄糖酸锌45.5mg,其中锌元素的质量为:45.5g×[65/12×12+1×22+16×14+65]×100%=6.5mg.
(2)根据溶液稀释前后,溶质的质量不变,
设需30%的双氧水的质量为x,
则600g×5%=30%x,x=100g.
故答案为:(1)4;6.5;(2)100.点评:
本题考点: 标签上标示的物质成分及其含量;有关溶质质量分数的简单计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合葡萄糖酸锌口服液的标签新信息,灵活运用化学式的含义与有关计算、溶液稀释前后溶质的质量不变进行分析问题、解决问题的能力.1年前查看全部
- (2014•南海区二模)纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程.
(2014•南海区二模)纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)若在实验室中进行该实验,操作l的名称是______.
(2)上述流程中的副产品可用作的其中一种用途是______.
(3)写出该工艺中生成CaCO3的反应方程式:______.
(4)在上述过程中,操作2为:洗涤、检验和干燥.
洗涤的目的是为了除去所制得的碳酸钙粗品表面可能含有的可溶性固体杂质,该杂质是______(写出其中一种的化学式即可).在检验操作中,若要证明碳酸钙粗品表面的可溶性固体杂质已被除尽,实验的相关步骤与结论是:______. linlinsky1981年前1
linlinsky1981年前1 -
 huoyee 共回答了22个问题
huoyee 共回答了22个问题 |采纳率81.8%解题思路:(1)根据液体与固体分离的方法考虑;
(2)根据副产品的组成和用途考虑;
(3)根据二氧化碳、氨水和氯化钙生成碳酸钙、氯化铵和水书写;
(4)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑.(1)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,故答案:过滤;
(2)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料,故答案:做氮肥(或做肥料);
(3)二氧化碳、氨水和氯化钙生成碳酸钙、氯化铵和水,故答案:CO2+2NH3•H2O+CaCl2═CaCO3↓+2NH4Cl+H2O;
(4)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
故答案:NH4Cl(或CaCl2);取少量洗涤后的滤液,向其中加入几滴AgNO3溶液,若没有白色沉淀产生,证明杂质已被除尽.点评:
本题考点: 物质的相互转化和制备;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- (2014•高邮市一模)纳米碳酸钡是一种重要的无机化工产品,如图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:
(2014•高邮市一模)纳米碳酸钡是一种重要的无机化工产品,如图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:

(1)试剂A的化学式为______,操作1和操作2的名称是______,若在实验室中进行该操作,实验中玻璃棒的作用是______.
(2)操作3为______和______.
(3)写出向氯化钡溶液加入氢氧化钾并通入二氧化碳时发生反应的化学方程式______,______.
(4)该流程中的副产物可用作______.(写一种用途) asgril1年前1
asgril1年前1 -
 何必这样子 共回答了13个问题
何必这样子 共回答了13个问题 |采纳率84.6%解题思路:(1)根据碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂是盐酸,
根据操作后得到溶液和固体,利用过滤操作的特点,可以判断操作1、2均为过滤,并说明过滤操作中玻璃棒的作用;
(2)根据操作3后得到了纳米碳酸钡,所以需要将固体表面的其他物质洗去,然后再进行干燥就可以得到纯净的固体进行分析;
(3)根据题中的叙述找出反应物、生成物,然后依据质量守恒定律书写化学方程式;
(4)根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡进行反应,判断副产物为氯化钾,结合该物质的组成及性质,说明该物质的用途.(1)加入试剂A后得到了氯化钡,依据质量守恒定律可知,碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,所以试剂A的化学式为:HCl,过滤操作可以将固体和液体分离,经过操作1、2后,得到了液体和固体,所以操作1和操作2的名称是:过滤,玻璃棒在过滤操作中的作用是引流;
(2)碳酸钡固体经过操作3后得到了纳米碳酸钡,需要将固体表面残留的其他药液洗去,然后在进行干燥就可以得到纳米碳酸钡,所以操作3的名称是洗涤、干燥;
(3)向氯化钡溶液加入氢氧化钾并通入二氧化碳时,氢氧化钾和二氧化碳反应生成碳酸钾和水,碳酸钾和氯化钡反应生成白色的碳酸钡沉淀和氯化钾,
化学方程式为:2KOH+CO2=K2CO3+H2O,K2CO3+BaCl2=BaCO3↓+2KCl;
(4)在向碳酸钡中加入稀盐酸时产生的二氧化碳可通入氯化钡溶液中,与氢氧化钾、氯化钡混合溶液反应后得到碳酸钡,即二氧化碳在反应过程中可以循环利用,生成的副产物氯化钾中含有钾元素,可以为植物生长提供所需的钾元素,可用作钾肥.
故答案为:(1)HCl,过滤,引流;
(2)洗涤,干燥;
(3)2KOH+CO2=K2CO3+H2O,K2CO3+BaCl2=BaCO3↓+2KCl;
(4)钾肥.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析反应流程中的各个反应,然后结合学过的知识和题中的条件进行分析解答.1年前查看全部
- (2006•太原)如图是某厂生产的葡萄糖酸锌口服液的标签,每支口服液含葡萄糖酸锌45.5mg,标签“_____”上的数据
 (2006•太原)如图是某厂生产的葡萄糖酸锌口服液的标签,每支口服液含葡萄糖酸锌45.5mg,标签“_____”上的数据是( )
(2006•太原)如图是某厂生产的葡萄糖酸锌口服液的标签,每支口服液含葡萄糖酸锌45.5mg,标签“_____”上的数据是( )
A.3.25
B.6.5
C.13
D.14.3 剁你小jj1年前1
剁你小jj1年前1 -
 y0579 共回答了21个问题
y0579 共回答了21个问题 |采纳率95.2%解题思路:根据相对分子的质量为组成分子的各原子的相对原子质量之和,计算葡萄糖酸锌的相对分子质量;
根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质的相对分子质量]×100%,求葡萄糖酸锌中锌的质量分数;
即可求每支口服液含葡萄糖酸锌45.5mg中含锌的质量.根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得葡萄糖酸锌的相对分子质量
为:12×12+22+16×14+65=455;
根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质的相对分子质量]×100%,可得葡萄糖酸锌中锌的
质量分数=[65/455]×100%;
每支口服液含葡萄糖酸锌45.5mg中含锌的质量为:45.5mg×[65/455]×100%=6.5mg;
故选:B.点评:
本题考点: 有关化学式的计算和推断;元素的质量分数计算;物质组成的综合计算.
考点点评: 将质量分数的计算与生活实际相联系;计算时要理清各个量之间的关系,再结合题意进行分析解答.1年前查看全部
- (2005•赤峰)下表是某厂生产的铝质电壶说明书上的有关参数.
(2005•赤峰)下表是某厂生产的铝质电壶说明书上的有关参数.
求:(1)电壶正常工作是的电阻是多少?型号×× 生产日期×× 额定电压220V 额定功率1kW 容量3L 质量0.5kg
(2)通常用它将一壶20℃水加热到100℃,电壶正常工作时大约需要多长时间?[C铝=0.9×103J/(kg•℃);C水=4.2×103J/(kg•℃)]. 南门西拐24号1年前1
南门西拐24号1年前1 -
 幻我梵 共回答了23个问题
幻我梵 共回答了23个问题 |采纳率95.7%解题思路:(1)知道电热水壶的额定电压和额定功率,根据P=
求出其电阻;U2 R
(2)先根据水的密度和体积求出水的质量,再根据公式Q吸=cm(t-t0)求出水和铝质电壶吸收的热量,再根据Q=W=Pt求出加热时间.(1)根据P=
U2
R可得,电壶正常工作时的电阻:
R=
U2
P=
(220V)2
1000W=48.4Ω;
(2)根据ρ=[m/V]可得,壶内水的质量:
m=ρV=1.0×103kg/m3×3×103m3=3kg,
水吸收的热量:
Q吸=cm(t-t0)=4.2×103J/(kg•℃)×3kg×(100℃-20℃)=1.008×106J,
铝质电壶吸收的热量:
Q吸′=cm(t-t0)=0.9×103J/(kg•℃)×0.5kg×(100℃-20℃)=0.036×106J,
则消耗的电能:
W=Q=Q吸+Q吸′=1.008×106J+0.036×106J=1.044×106J,
根据W=Pt可得,加热时间:
t=[W/P]=
1.044×106J
1000W=1044s.
答:(1)电壶正常工作是的电阻是48.4Ω;
(2)通常用它将一壶20℃水加热到100℃,电壶正常工作时大约需要1044s.点评:
本题考点: 电功与热量的综合计算.
考点点评: 本题考查了电功与热量的综合计算,涉及到电功率公式、电功公式和吸热公式的应用,计算过程要注意消耗的电能等于水和铝质电壶吸收热量之和.1年前查看全部
- 下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:

为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2 ml二氧化碳气体。请计算此加钙食盐中钙元素的质量分数。 天使之网1年前1
天使之网1年前1 -
 52044778 共回答了16个问题
52044778 共回答了16个问题 |采纳率93.8%1.2%
1年前查看全部
- 初中数学题某厂生产一批某种型号学生装,已知每3厘米长的某种布可做上衣两件和裤子三条,一件上衣和一条裤子为一套,计划用六百
初中数学题
某厂生产一批某种型号学生装,已知每3厘米长的某种布可做上衣两件和裤子三条,一件上衣和一条裤子为一套,计划用六百米长的这种布生产学生装,应分别用多少布料生产上衣和裤子才能配套?可生产多少套?(用一元一次方程解答)
很急!谢谢大家!
 axa3331年前1
axa3331年前1 -
 梦小朵 共回答了13个问题
梦小朵 共回答了13个问题 |采纳率100%设用X米做上衣,则用(600-X)米做裤子,
根据题意得:
2X/3=3(600-X)/3,
2X=1800-3X
5X=1800
X=360,600-360=240,∴360米作上衣,240米作裤子
可生产:360÷3×2=240套.1年前查看全部
- 图是某厂生产的加钙碘盐包装袋商标的部分内容.请仔细阅读后回答以下问题:
 图是某厂生产的加钙碘盐包装袋商标的部分内容.请仔细阅读后回答以下问题:
图是某厂生产的加钙碘盐包装袋商标的部分内容.请仔细阅读后回答以下问题:
(1)人体缺乏钙元素易引发的疾病是______(填代码)
A.夜盲症B.甲状腺肿大C.佝偻病D.坏血病
(2)碘酸钾(化学式为KIO3)中碘元素的质量分数是多少?
(3)一袋该食盐中KIO3的质量最多是多少? wu51781年前1
wu51781年前1 -
 rouck 共回答了19个问题
rouck 共回答了19个问题 |采纳率89.5%解题思路:(1)根据微量元素对人体的影响来解答该题;
(2)根据化学式的基本计算可以求出碘酸钾中碘元素的质量分数;
(3)根据标签的信息可以知道碘的含量最多为50mg/Kg,可以据此来求算出碘酸钾的最大含量.(1)钙元素是人体必须的元素,对于骨骼的生长发育具有非常重要的作用,如果缺少了钙元素则会引起发育不良,如佝偻病,身材矮小等病症;
(2)碘酸钾中碘元素的质量=[127/39+127+16×3]×100%=59.3%;
(3)根据标签可得出碘的含量最多为50mg/Kg,所以所以一袋碘盐中碘元素的质量=50mg/Kg×0.5Kg=25mg,
所以一袋该食盐中KIO3的最大含量=25mg÷59.3%=42.2mg.
故答案为:(1)C;
(2)59.3%;
(3)42.2mg.点评:
本题考点: 人体的元素组成与元素对人体健康的重要作用;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 读懂标签,理解化学式的意义,能够根据化学式熟练的求出物质的相对分子质量及各元素的质量分数等基本计算.1年前查看全部
- 纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:
纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题: 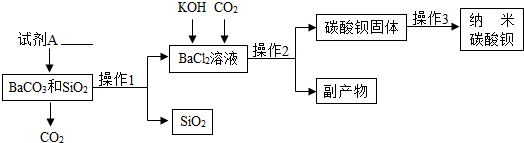
(1)试剂A的化学式______,若在实验室中进行该实验,操作1和操作2的名称是______,该实验中玻璃棒的作用______.
(2)该工艺中生成碳酸钡固体的反应方程式为:BaCl 2 +______+2KOH=BaCO 3 +2______+______,请完成并配平该方程式.
(3)操作3为洗涤、检验和______,洗涤的作用是______,检验洗涤是否干净可选用试剂______(写化学式).
(4)上述流程中可循环利用的物质是______,该流程中的副产物可用作______.(写一种用途)
(5)分析该流程可得出SiO 2 部分性质,下列属于其物理性质______,化学性质______.(填序号)
A.不溶于水B.可溶于水C.不与盐酸反应D.能与盐酸反应
(6)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na 2 SiO 3 ),该反应的化学方程式______.根据此原理该同学设计出如下方案制备:
取碳酸钡和二氧化硅混合物,滴加______(填“少量”或“过量”)的氢氧化钠溶液,过滤,洗涤,烘干得碳酸钡固体. 刘莼1年前1
刘莼1年前1 -
 attree 共回答了14个问题
attree 共回答了14个问题 |采纳率100%(1)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,溶质的化学式为HCl;为从反应后的氯化钡溶液中除去二氧化硅固体,应进行过滤,过滤时需要使用玻璃棒进行引流,防止直接倾倒而冲破滤纸;
(2)由流程图可知向氯化钡溶液中加入氢氧化钾与二氧化碳,反应后得到碳酸钡沉淀,可知反应的化学方程为BaCl 2 +CO 2 +2KOH═BaCO 3 ↓+2KCl+H 2 O;
(3)为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;为检验洗涤干净,利用氯化钾能与硝酸银产生白色沉淀,可向洗涤后的溶液中滴加硝酸银检验洗涤后的溶液中不再含有氯化钾,以证明洗涤干净;
(4)在向碳酸钡中加入稀盐酸时产生的二氧化碳气体可通入氯化钡溶液中,与氢氧化钾、氯化钡的混合溶液发生反应得到碳酸钡,即二氧化碳在过程中可进行循环利用,在此过程中生成的副产物碳酸钾可提供作物生成所需的钾元素,可用作钾肥;
(5)在向碳酸钡与二氧化硅的混合物中加入稀盐酸时,二氧化硅既不溶于水又不能与稀盐酸发生反应,可得知二氧化硅的物理性质有不溶于水,化学性质有不能与稀盐酸反应;
(6)二氧化硅为非金属氧化物,根据这两类物质的反应特点,可知反应生成硅酸钠和水,反应的化学方程式为SiO 2 +2NaOH═Na 2 SiO 3 +H 2 O;为除去碳酸钡与二氧化硅中的二氧化硅,利用二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠,可向混合物中加入过量氢氧化钠溶液以完全除去二氧化硅,经过过滤,洗涤,烘干得碳酸钡固体.
故答案为:
(1)HCl,过滤,引流;
(2)CO 2 ,KCl,H 2 O;
(3)烘干,除去沉淀表面可溶性杂质或残留滤渣表面滤液,AgNO 3 ;
(4)CO 2 ,钾肥或钾盐;
(5)A,C;
(6)SiO 2 +2NaOH═Na 2 SiO 3 +H 2 O,过量.1年前查看全部
- 已知每个木模的质量=5.6kg,木头的密度为07乘以10^3kg/m^3,先某厂用这个木模浇铸铁铸件100个,需要熔化多
已知每个木模的质量=5.6kg,木头的密度为07乘以10^3kg/m^3,先某厂用这个木模浇铸铁铸件100个,需要熔化多少吨的铁?(铁的密度是7.9乘以10^3kg/m^3)
 知我何求1年前1
知我何求1年前1 -
 abo1116 共回答了15个问题
abo1116 共回答了15个问题 |采纳率80%木模的体积:V=m木/ρ木=5.6*10^3/0.7=8*10^3cm^3
所以需要铸铁的体积为:V铁=100V=8*10^5cm^3
需要熔化的质量:m铁=ρ铁V铁=7.9*8*10^5=6.32*10^6g=6.32t
祝您策马奔腾哦~1年前查看全部
- 如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
 如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
(1)碳酸钙中碳、氧元素的质量比为______.
(2)计算高钙片中碳酸钙的质量分数. skin121年前1
skin121年前1 -
 akit_1874 共回答了19个问题
akit_1874 共回答了19个问题 |采纳率94.7%解题思路:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)由题意,每片中含钙元素500mg=0.5g,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)碳酸钙中碳、氧元素的质量比为12:(16×3)=1:4.
(2)由题意,每片中含钙元素500mg=0.5g,则每片中含碳酸钙的质量为0.5g÷(
40
100×100%)=1.25g,每片高钙片的质量为2.5g,
则高钙片中碳酸钙的质量分数为
1.25g
2.5g×100%=50%.
故答案为:(1)1:4;(2)50%.点评:
本题考点: 标签上标示的物质成分及其含量;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2013•崇安区一模)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.
(2013•崇安区一模)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.

请回答下列问题:
(1)BaCO3中碳元素的化合价为______价.
(2)试剂A的化学式是______,若在实验室中进行该实验,操作1和操作2的名称是______.
(3)操作3为洗涤、检验和烘干,其中洗涤的作用是______,检验洗涤是否干净的方法是(要求有步骤、现象和结论)______.
(4)上述流程中可循环利用的物质是______. zlkj2lkjlkfasjdl1年前1
zlkj2lkjlkfasjdl1年前1 -
 0311576 共回答了16个问题
0311576 共回答了16个问题 |采纳率87.5%解题思路:(1)根据化合物的各元素的化合价的代数和为0进行解答;
(2)根据碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;根据操作后得到溶液与固体,利用过滤操作的特点,可判断操作1、2均为过滤操作;
(3)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,其中洗涤的作用是除去沉淀表面可溶性杂质或残留滤渣表面滤液;
(4)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;(1)根据化合物的各元素的化合价的代数和为0以及钡元素的化合价为+2价、氧元素的化合价为-2价,可知BaCO3中碳元素的化合价为+4价,
(2)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,溶质的化学式为HCl;为从反应后的氯化钡溶液中除去二氧化硅固体,应进行过滤;
(3)为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;检验是否洗涤干净可用硝酸银溶液,若没有洗涤干净,滤液中含有氯离子,氯离子与银离子结合成白色沉淀.
(4)在向碳酸钡中加入稀盐酸时产生的二氧化碳气体可通入氯化钡溶液中,与氢氧化钾、氯化钡的混合溶液发生反应得到碳酸钡,即二氧化碳在过程中可进行循环利用.
故答案为:
(1)+4;(2)HCl;过滤;(3)除去沉淀(固体)表面的可溶性杂质; 取样,往洗涤液中滴加硝酸银溶液,观察是否有白色沉淀生成,若有,则未洗涤干净;若无,则洗涤干净;
(4)CO2.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;有关元素化合价的计算.
考点点评: 通过流程图的分析,明确生产过程中所涉及的物质性质及变化规律,体现运用知识分析问题、解决问题的能力.1年前查看全部
- 纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程.
纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程. 
请回答下列问题:
(1)请完成该工艺中生成CaCO 3 固体的反应方程式:CaCl 2 +______+CO 2 =CaCO 3 ↓+______+H 2 O.
(2)上述过程制得的碳酸钙粗品表面一定含有的可溶性杂质有______.操作b有:______、干燥.
(3)上述流程中的副产品可用作______.(写一种用途) weiliang7891年前1
weiliang7891年前1 -
 何处寻ii 共回答了16个问题
何处寻ii 共回答了16个问题 |采纳率93.8%(1)从该流程图可以看出,反应物是二氧化碳,氨水和氯化钙,生成物为碳酸钙和氯化铵,而方程式书写中提示有水.所以该反应的反应物为二氧化碳、氨水和氯化钙,生成物为碳酸钙和氯化铵和水.所以反应方程式为CaCl 2 +2NH 3 ?H 2 O+CO 2 =CaCO 3 ↓+2NH 4 Cl+H 2 O.
(2)由于碳酸钙粉末是从氯化铵溶液中分离出来的不溶性物质,所以表面会附有可溶性的氯化铵,而氯化钙则是可能含有的,这个取决于先前反应的程度.利用碳酸钙的不溶性和氯化铵的可溶性,洗涤干燥即可.
(3)氯化铵是含氮化合物,所以可以作化肥(氮肥),同时由于氯化铵溶液显酸性,可以用于金属表面除锈.
故填:(1)2NH 3 ?H 2 O; 2NH 4 Cl;(2)NH 4 Cl; 洗涤;(3)化肥或者氮肥.1年前查看全部
- 下图是某厂生产的加钙碘盐包装袋商标的部分内容.请仔细阅读后回答以下问题:
下图是某厂生产的加钙碘盐包装袋商标的部分内容.请仔细阅读后回答以下问题:
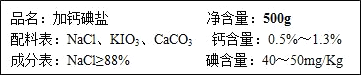
(1)配料表中KIO3的碘元素的质量分数为______.(计算结果保留整数)
(2)若人每天摄入5g该食盐,则从中获取的钙元素质量最多是______mg.
(3)求一袋该食盐中最少应添加的KIO3的质量为______mg.(计算结果保留整数) al12tbd1g1年前1
al12tbd1g1年前1 -
 守望家园1970 共回答了21个问题
守望家园1970 共回答了21个问题 |采纳率95.2%解题思路:(1)根据碘酸钾化学式为KIO3,利用组成元素的质量分数=[元素的相对原子质量×原子个数/相对分子质量]×100%,计算碘酸钾中碘元素的质量分数.
(2)根据商标可知:食盐中钙的含量最多为1.3%,再根据钙元素的质量=食盐的质量×钙的含量.
(3)根据商标可知:1Kg食盐中最少含有碘元素为40mg,再根据一袋碘盐的质量求得所含碘元素的质量;最后根据碘酸钾的质量=[碘元素的质量/碘元素在碘酸钾中的质量分数]
即可计算出一袋食盐中碘酸钾的质量.(1)碘酸钾KIO3中碘元素的质量分数=[127/214]×100%=59%.
(2)食盐中钙的含量最多为1.3%,
则钙元素的质量=食盐的质量×钙的含量=5g×1.3%=0.065g=65mg.
(3)因为1Kg食盐中最少含有碘元素为40mg,
所以一袋碘盐中碘元素的质量=40mg/kg×0.5kg=20mg;
则一袋食盐中碘酸钾的质量=[碘元素的质量/碘元素在碘酸钾中的质量分数]=[20mg/59%]=34mg.
故答案为:(1)59%;(2)65mg(3)34mg.点评:
本题考点: 有关化学式的计算和推断;化合物中某元素的质量计算.
考点点评: 根据物质的化学式可以表示物质的组成及分子构成,利用物质的化学式可以计算组成元素的质量比、组成元素的质量分数等.1年前查看全部
- (5分)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.
(5分)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.

请回答下列问题:
(1)试剂A的化学式 ,若在实验室中进行该实验,操作1和操作2的名称是
(2)操作3为洗涤、检验和烘干,其中洗涤的作用是 ,检验洗涤是否干净可选用试剂
(3)上述流程中可循环利用的物质是 4400002905301年前1
4400002905301年前1 -
 pxh123 共回答了27个问题
pxh123 共回答了27个问题 |采纳率88.9%⑴ HCl 过滤
⑵ 除去沉淀表面的可溶性杂质 硝酸银溶液
⑶ CO 2
(1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;根据操作后得到溶液与固体,利用过滤操作的特点,可判断操作1、2均为过滤操作,
(2)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡间所发生的反应,判断副产物为碳酸钾,结合该物质的组成及性质,举例说明其用途;1年前查看全部
- 纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程.请回答下列问题:
纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程.请回答下列问题:

(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:
CaCl2+______+CO2═CaCO3↓+______+H2O
(2)若在实验室中进行该实验,操作l的名称是______,使用到的玻璃仪器有玻璃棒、______、______,其中玻璃棒的作用是______.
(3)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是______,检验是否洗涤干净的方法是向最后一次洗涤液中加入______溶液(①Ca(OH)2、②AgNO3、③CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净.
(4)上述流程中的副产品(NH4Cl)可用作______.(写一种用途) 管铭辰1年前1
管铭辰1年前1 -
 zhihan168 共回答了16个问题
zhihan168 共回答了16个问题 |采纳率87.5%解题思路:(1)根据方程式的写法考虑;(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;(4)根据副产品的组成和用途考虑.(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;玻璃棒的作用是引流;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(4)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料.
故答案为:(1)2NH3•H2O;2NH4Cl;(2)过滤; 烧杯;漏斗;引流;(3)NH4Cl(或CaCl2);②;(4)氮肥(化肥、肥料).点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;常见化肥的种类和作用;化学方程式的配平.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- 以下是某厂生产的某种加钙食盐标签上的部分文字.请仔细阅读后回答问题:
以下是某厂生产的某种加钙食盐标签上的部分文字.请仔细阅读后回答问题:
(1)此食盐属于______(填“纯净物”或“混合物”);配料表:氯化钠、食用碳酸钙、碘酸钾
净含量:500g
成份表:氯化钠≥80%
钙(以Ca计):0.5%-1.3%
碘(以I计):(20-50)mg/kg
(2)氯化钠(NaCl)、食用碳酸钙(CaCO3)、碘酸钾(KIO3)三种物质______(填“是”或“不是”)氧化物. 用户基本信息1年前1
用户基本信息1年前1 -
 魔天使 共回答了23个问题
魔天使 共回答了23个问题 |采纳率87%解题思路:本题考查利用纯净物、氧化物的概念来判断物质是否为纯净物,宏观上看只有一种物质,微观上只有一种分子.氧化物由两种元素组成,一种是氧元素的化合物.(1)由配料表::氯化钠、食用碳酸钙、碘酸钾可知此食盐是混合物;
(2)氯化钠(NaCl)中没有氧元素不属于氧化物、食用碳酸钙(CaCO3)、碘酸钾(KIO3)中都含有三种元素,氧化物必须是两种元素,故不属于氧化物.
故答案为:(1)混合物;(2)不是.点评:
本题考点: 纯净物和混合物的判别;从组成上识别氧化物.
考点点评: 熟悉概念的基础上能从宏观和微观两个方面来判断纯净物和混合物,还要从社会实践中了解生活中常见物质的组成,了解氧化物的特点.1年前查看全部
- (2005•郴州)某校综合实践活动小组进行“诚信食品”研究,分析标签所列成分含量与实际是否相符,右图是某厂生产的味精包装
 (2005•郴州)某校综合实践活动小组进行“诚信食品”研究,分析标签所列成分含量与实际是否相符,右图是某厂生产的味精包装上的部分说明,某同学取5g味精,溶于水后加入足量AgNO3溶液,再滴加适量稀HN3(防止某些杂质的干扰),经过滤、洗涤、干燥得白色沉淀2.87g,(化学方程式为
(2005•郴州)某校综合实践活动小组进行“诚信食品”研究,分析标签所列成分含量与实际是否相符,右图是某厂生产的味精包装上的部分说明,某同学取5g味精,溶于水后加入足量AgNO3溶液,再滴加适量稀HN3(防止某些杂质的干扰),经过滤、洗涤、干燥得白色沉淀2.87g,(化学方程式为
NaCl+AgNO3=AgCl↓+NaNO3)试通过计算确定:该味精是否可列入“诚信食品”名单? lioushahp1年前1
lioushahp1年前1 -
 矿石 共回答了25个问题
矿石 共回答了25个问题 |采纳率84%解题思路:已知沉淀的质量是2.87克,然后写出化学方程式并计算出氯化钠的质量,最后计算出味精中氯化钠的质量分数.设生成2.87 g沉淀需NaCl的质量为X.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
X 2.87克
[58.5/143.5]═[X/2.87克]
得:X=1.17克
∴味精中氯化钠的质量分数=[1.17克/5克]×100%=23.4%.
∵23.4%>20%.∴该味精不能列入“诚信食品”名单.
答:该味精不能列入“诚信食品”名单.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 掌握化学方程式的计算格式和规范性,注意:最后要有“答”.1年前查看全部
- 纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程。请回答下列问题: (1)
纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程。请回答下列问题: 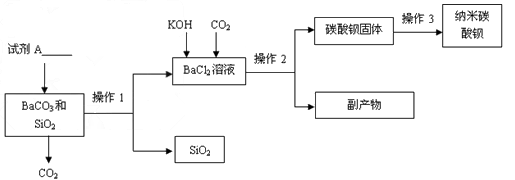
(1)试剂A的化学式___________,若在实验室中进行该实验, 操作1和操作2的名称是___________,该实验中玻璃棒的作用____________。
(2)操作3为洗涤、检验和 _________,洗涤的作用是_____________,检验洗涤是否干净可选用试剂 ____________(写化学式)。
(3)上述流程中可 循环利用的物质是___________,该流程中的副产物可用作_______________。(写一种用途)
(4)分析该流程可得出SiO 2 部分性质,下列属于其物理性质 ___________,化学性质_____________。
A.不溶于水B.可溶于水C.不与盐酸反应D.能与盐酸反应
(5)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na 2 SiO 3 ),该反应的化学方程式 _____________。根据此原理该同学设计出如下方案制备:取碳酸钡和二氧化硅混合物,滴加__________(填“少量” 或“过量”)的氢氧化钠溶液,过滤,洗涤,烘干得碳酸钡固体。 砖头啊砖头71年前1
砖头啊砖头71年前1 -
 马其顿长枪手 共回答了18个问题
马其顿长枪手 共回答了18个问题 |采纳率88.9%1年前查看全部
- 统计学的一道题某厂2008年的产量比2007年增长了14% 产品成本总额增长了8% 问该厂2008年产品成本的变动情况如
统计学的一道题
某厂2008年的产量比2007年增长了14% 产品成本总额增长了8% 问该厂2008年产品成本的变动情况如何 小妖妖精1年前1
小妖妖精1年前1 -
 MiraiNoYume 共回答了23个问题
MiraiNoYume 共回答了23个问题 |采纳率95.7%(1+x)*1.14=1.08
解方程就行了1年前查看全部
- 初一数学题某厂每天能生产甲种零件a个或乙种零件b个,且a:b=2:3.甲乙两种零件各一个配成一套产品,30天内能生产的产
初一数学题
某厂每天能生产甲种零件a个或乙种零件b个,且a:b=2:3.甲乙两种零件各一个配成一套产品,30天内能生产的产品最多是多少套 过程详细!悬赏可增!
 ht323101年前1
ht323101年前1 -
 00小宝00 共回答了24个问题
00小宝00 共回答了24个问题 |采纳率91.7%a:b=2:3=>3a=2b,
所以生产3天甲再生产2天乙共五天,此时生产的零件可以全部配套.
以五天一循环,30/5=6,共6循环
五天中三天生产的甲的数量为3a,乙的数量为2b
所以30天中生产甲的天数为3×6=18天,数量为18a,
30天中生产乙的天数为2×6=12天,数量为12b,
所以最多生产18a套或12b套.1年前查看全部
- 如图所示是某厂生产的一块模板,已知模板的边AB平行CF,CD平行AE.按规定AB,CD的延长线相交成70°角,因角
如图所示是某厂生产的一块模板,已知模板的边AB平行CF,CD平行AE.按规定AB,CD的延长线相交成70°角,因角
如图所示是某厂生产的一块模板,已知模板的边AB平行CF,CD平行AE.按规定AB,CD的延长线相交成70°角,因交点不在模版上,不便测.这时师傅告诉徒弟只要测一个角,就知道AB,CD的延长线的夹角是否合乎规定?请问是哪一个角?说明理由.

 gzy_468181年前1
gzy_468181年前1 -
 zhangabc88 共回答了21个问题
zhangabc88 共回答了21个问题 |采纳率95.2%已知模板的边AB平行CF,CD平行AE.把AB、CF、CD、AE,延长相交,就是平行四边形.平行四边形的性质就有,对角相等,四边形内角之和是360°.也就是说,知道∠BAE,就知道∠DCF,∠BAE=∠DCF,AB,CD的延长线的夹角=(360°-2∠BAE...1年前查看全部
- 如图是某厂生产的加钙碘盐包装袋商标的部分内容.
如图是某厂生产的加钙碘盐包装袋商标的部分内容. 
请阅读后回答以下问题:
(1)求一袋该食盐中KIO 3 的质量最多为多少?
(2)为了测定此盐中钙元素的含量,取10g这种盐溶于水,加入足量盐酸,生成O.132g二氧化碳.请计算此加钙食盐中钙元素的质量分数. buaa_ckz1年前1
buaa_ckz1年前1 -
 lianer0 共回答了16个问题
lianer0 共回答了16个问题 |采纳率93.8%(1)碘酸钾中碘元素的质量=
127
39+127+16×3 ×100%=59.3%
根据标签可得出碘的含量最多为50mg/Kg,所以所以一袋碘盐中碘元素的质量=50mg/Kg×0.5Kg=25mg,
所以一袋该食盐中KIO 3 的最大含量=25mg÷59.3%=42.2mg.
(2)设10g食盐中碳酸钙的质量为x
CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑
100 44
x 0.132g
100
x =
44
0.132g
解得:x=0.3g
所以钙元素的质量为:0.3g
40
100 ×100%=0.12g
所以钙元素的质量分数为:
0.12g
10g ×100%=1.2%
答:(1)一袋该食盐中KIO 3 的质量最多为42.2mg;
(2)此加钙食盐中钙元素的质量分数为1.2%.1年前查看全部
- 该图是某厂生产的加钙食盐包装标签上的部分文字说明,请仔细阅读并计算:为了测定此食盐中的钙元素含量,取10g这种食盐
 该图是某厂生产的加钙食盐包装标签上的部分文字说明,请仔细阅读并计算:为了测定此食盐中的钙元素含量,取10g这种食盐溶于水,加入足量的稀盐酸,生成0.132g二氧化碳,请计算此加钙食盐中碳酸钙的质量分数.(注:成分中只有碳酸钙与盐酸反应)
该图是某厂生产的加钙食盐包装标签上的部分文字说明,请仔细阅读并计算:为了测定此食盐中的钙元素含量,取10g这种食盐溶于水,加入足量的稀盐酸,生成0.132g二氧化碳,请计算此加钙食盐中碳酸钙的质量分数.(注:成分中只有碳酸钙与盐酸反应)  萧萧费1年前1
萧萧费1年前1 -
 不能名落孙山 共回答了21个问题
不能名落孙山 共回答了21个问题 |采纳率85.7%解题思路:根据碳酸钙与盐酸反应的化学方程式和生成的二氧化碳的质量,即可计算出参与反应的碳酸钙的质量(即10g这种盐中碳酸钙的质量);然后再计算出此加钙食盐中碳酸钙的质量分数.设参与反应的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 0.132g
[100/x=
44
0.132g]
解之得:x=0.3g,
此加钙食盐中碳酸钙的质量分数=[0.3g/10g]×100%=3%.
答:此加钙食盐中碳酸钙的质量分数为3%;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了根据化学方程式进行的有关计算,完成此题,可以依据化学方程式的有关基础计算进行.1年前查看全部
- (2013•河西区二模)纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程.
(2013•河西区二模)纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)请完成该工艺中生成CaCO3固体的反应方程式:CaCl2+______+CO2=CaCO3↓+______+H2O.
(2)上述过程制得的碳酸钙粗品表面一定含有的可溶性杂质有______.操作b有:______、干燥.
(3)上述流程中的副产品可用作______.(写一种用途) ivywing651年前1
ivywing651年前1 -
 空飘荡 共回答了24个问题
空飘荡 共回答了24个问题 |采纳率83.3%解题思路:(1)从该流程图可以看出,反应物是二氧化碳,氨水和氯化钙,生成物为碳酸钙和氯化铵,而方程式书写中提示有水.所以该反应的反应物为二氧化碳、氨水和氯化钙,生成物为碳酸钙和氯化铵和水.
(2)由于碳酸钙粉末是从氯化铵溶液中分离出来的不溶性物质,所以表面会附有可溶性的氯化铵,而氯化钙则是可能含有的,这个取决于先前反应的程度.利用碳酸钙的不溶性和氯化铵的可溶性,洗涤干燥即可.
(3)氯化铵是含氮化合物,所以可以作化肥(氮肥),同时由于氯化铵溶液显酸性,可以用于金属表面除锈.(1)从该流程图可以看出,反应物是二氧化碳,氨水和氯化钙,生成物为碳酸钙和氯化铵,而方程式书写中提示有水.所以该反应的反应物为二氧化碳、氨水和氯化钙,生成物为碳酸钙和氯化铵和水.所以反应方程式为CaCl2+2...
点评:
本题考点: 物质的相互转化和制备;混合物的分离方法;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 从流程图分析对应的反应物和生成物,这是信息处理能力.对于产品可能含有的杂质,要注意结合反应进行的程度和物质的性质进行分析.1年前查看全部
- 如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
(1)碳酸钙中碳、氧元素的质量比为______.
(2)计算高钙片中碳酸钙的质量分数.
 587374211年前1
587374211年前1 -
 nbma 共回答了25个问题
nbma 共回答了25个问题 |采纳率92%(1)碳酸钙中碳、氧元素的质量比为12:(16×3)=1:4.
(2)由题意,每片中含钙元素500mg=0.5g,则每片中含碳酸钙的质量为0.5g÷(
40
100 × 100%)=1.25g,每片高钙片的质量为2.5g,
则高钙片中碳酸钙的质量分数为
1.25g
2.5g ×100% =50%.
故答案为:(1)1:4;(2)50%.1年前查看全部
- 纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:
纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:

(1)试剂A的化学式______,若在实验室中进行该实验,操作1和操作2的名称是______,该实验中玻璃棒的作用______.
(2)该工艺中生成碳酸钡固体的反应方程式为:BaCl2+______+2KOH=BaCO3+2______+______,请完成并配平该方程式.
(3)操作3为洗涤、检验和______,洗涤的作用是______,检验洗涤是否干净可选用试剂______(写化学式).
(4)上述流程中可循环利用的物质是______,该流程中的副产物可用作______.(写一种用途)
(5)分析该流程可得出SiO2部分性质,下列属于其物理性质______,化学性质______.(填序号)
A.不溶于水B.可溶于水C.不与盐酸反应D.能与盐酸反应
(6)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na2SiO3),该反应的化学方程式______.根据此原理该同学设计出如下方案制备:
取碳酸钡和二氧化硅混合物,滴加______(填“少量”或“过量”)的氢氧化钠溶液,过滤,洗涤,烘干得碳酸钡固体. May131年前1
May131年前1 -
 小小哈哈猪 共回答了16个问题
小小哈哈猪 共回答了16个问题 |采纳率100%解题思路:(1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;根据操作后得到溶液与固体,利用过滤操作的特点,可判断操作1、2均为过滤操作,并说明过滤操作中玻璃棒的作用;
(2)利用二氧化碳与氢氧化钾反应生成碳酸钾和水、碳酸钾与氯化钡反应生成碳酸钡沉淀和氯化钾,推断向氯化钡溶液中加入氢氧化钾、通入二氧化碳后所发生的反应,写出反应的化学方程式;
(3)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(4)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡间所发生的反应,判断副产物为碳酸钾,结合该物质的组成及性质,举例说明其用途;
(5)根据二氧化硅放入稀盐酸中的变化情况,推断二氧化硅的性质,并对物质性质进行物理性质与化学性质的区分;
(6)利用非金属氧化物与碱溶液的反应规律,判断二氧化硅与氢氧化钠的反应,写出反应的化学方程式;并结合除杂的操作方法,判断过程中加入氢氧化钠的量.(1)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,溶质的化学式为HCl;为从反应后的氯化钡溶液中除去二氧化硅固体,应进行过滤,过滤时需要使用玻璃棒进行引流,防止直接倾倒而冲破滤纸;
(2)由流程图可知向氯化钡溶液中加入氢氧化钾与二氧化碳,反应后得到碳酸钡沉淀,可知反应的化学方程为BaCl2+CO2+2KOH═BaCO3↓+2KCl+H2O;
(3)为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;为检验洗涤干净,利用氯化钾能与硝酸银产生白色沉淀,可向洗涤后的溶液中滴加硝酸银检验洗涤后的溶液中不再含有氯化钾,以证明洗涤干净;
(4)在向碳酸钡中加入稀盐酸时产生的二氧化碳气体可通入氯化钡溶液中,与氢氧化钾、氯化钡的混合溶液发生反应得到碳酸钡,即二氧化碳在过程中可进行循环利用,在此过程中生成的副产物碳酸钾可提供作物生成所需的钾元素,可用作钾肥;
(5)在向碳酸钡与二氧化硅的混合物中加入稀盐酸时,二氧化硅既不溶于水又不能与稀盐酸发生反应,可得知二氧化硅的物理性质有不溶于水,化学性质有不能与稀盐酸反应;
(6)二氧化硅为非金属氧化物,根据这两类物质的反应特点,可知反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O;为除去碳酸钡与二氧化硅中的二氧化硅,利用二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠,可向混合物中加入过量氢氧化钠溶液以完全除去二氧化硅,经过过滤,洗涤,烘干得碳酸钡固体.
故答案为:
(1)HCl,过滤,引流;
(2)CO2,KCl,H2O;
(3)烘干,除去沉淀表面可溶性杂质或残留滤渣表面滤液,AgNO3;
(4)CO2,钾肥或钾盐;
(5)A,C;
(6)SiO2+2NaOH═Na2SiO3+H2O,过量.点评:
本题考点: 物质的相互转化和制备;碳酸钠、碳酸氢钠与碳酸钙;化学方程式的配平.
考点点评: 通过流程图的分析,明确生产过程中所涉及的物质性质及变化规律,体现运用知识分析问题、解决问题的能力.1年前查看全部
- 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸做试剂进行检测.加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO 3 +5KI+6HCl=6KCl+3I 2 +3H 2 O,生成的I 2 遇淀粉变蓝.在上述反应中氧化产物与还原产物的物质的量之比为______.
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体.请计算此加钙食盐中钙元素的质量分数.
 永不悔1年前1
永不悔1年前1 -
 dell2k 共回答了16个问题
dell2k 共回答了16个问题 |采纳率93.8%(1)在反应KIO 3 +5KI+6HCl=6KCl+3I 2 +3H 2 O中,KIO 3 中I元素的化合价由+5价降低到0价,化合价变化的数目为5,KI中I元素的化合价由-1价升高到0价,化合价的变化的数目为1,氧化产物和还原产物都是I 2 ,根据氧化还原反应得失电子数目相等可知,5:1;当有1molKIO 3 反应时,有5mol5KI被氧化,所以反应中氧化产物与还原产物的物质的量之比为5:1,
故答案为:5:1;
(2)10克此盐中含有mg碳酸钙,
根据反应方程式计算:
CaCO 3 +2HCl═CaCl 2 +CO 2 ↑+H 2 O
100g 22.4L
m 67.2×10 -3 L
m=
100g×67.2× 10 -3 L
22.4L =0.3g,
0.3g中含钙元素的质量为 0.3g×
40
100 =0.12g,
此加钙食盐中钙元素的质量分数为
0.12g
10g ×100% =1.2%,
答:此加钙食盐中钙元素的质量分数1.2%.1年前查看全部
- 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体.请计算此加钙食盐中钙元素的质量分数. 刁钻古怪1年前1
刁钻古怪1年前1 -
 洋c侍 共回答了22个问题
洋c侍 共回答了22个问题 |采纳率95.5%解题思路:发生反应:CaCO3+2HCl═CaCl2+H2O+CO2↑,根据n=
计算CO2的物质的量,根据方程式计算CaCO3的物质的量,根据m=nM计算Ca2+的质量,进而计算Ca2+的质量分数.V Vm 标况下,67.2mLCO2的物质的量=[0.0672/22.4L/mol]=0.003mol,
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 1
n(CaCO3) 0.003mol
n(CaCO3)=0.003mol
故m(Ca2+)=0.003mol×40g/mol=0.12g
Ca2+的质量分数=[0.12g/10g]×100%=1.2%,
答:此加钙食盐中钙元素的质量分数为1.2%.点评:
本题考点: 元素质量分数的计算;化学方程式的有关计算.
考点点评: 本题以食盐中钙元素含量测定为载体,考查质量分数的计算,比较基础,侧重考查学生运用知识解决实际问题的能力.1年前查看全部
- 纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程.
纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:______.
(2)若在实验室中进行该实验,操作l的名称是______,使用到的玻璃仪器有______、______、______(填写完整).
(3)上述过程制得的碳酸钙粗品表面含有的可溶性杂质有______(化学式).
(4)操作2为:洗涤、检验、干燥,检验操作中选用的试剂为______(选择序号).
①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液. 春风秋宇1年前1
春风秋宇1年前1 -
 顶级鸟 共回答了21个问题
顶级鸟 共回答了21个问题 |采纳率90.5%解题思路:(1)根据流程图分析反应物、生成物并依据方程式的写法解答;
(2)根据过滤的原理分析解答,并根据过滤操作用到的仪器考虑玻璃仪器;
(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质;
(4)根据氯离子常用硝酸银溶液检验分析回答.(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,并在碳酸钙后面标上沉淀符号;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤;过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;
(4)把碳酸钙粗品表面含有的可溶性杂质氯化铵或氯化钙除掉的方法是用水清洗;检验是否还含有氯化铵或氯化钙,可以利用检验氯离子的方法,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
故答案为:
(1)CO2+2NH3•H2O+CaCl2═CaCO3↓+2NH4Cl+H2O;(2)过滤;烧杯、漏斗、玻璃棒;(3)NH4Cl或CaCl2;(4)②.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题的关键是要熟悉方程式的写法,过滤操作的原理及应用,熟悉过滤操作中使用的仪器,并知道氯离子的检验方法.1年前查看全部
- 下表是某厂生产的加钙食盐包装标签上的部分内容,请仔细阅读后回答以下问题:
下表是某厂生产的加钙食盐包装标签上的部分内容,请仔细阅读后回答以下问题:
(1)KIO3的相对分子质量是______;KIO3中碘元素的质量分数为______;配料表:NaCl、KIO3、CaCO3
净含量:500g
成分表:NaCl≧88%
钙(以Ca计):(0.5~1.3)%
碘(以I计):(0.04~0.05)mg/g
(2)一袋该食盐中KIO3的质量最多为______mg;
(3)商标上的钙含量是指______(选填“单质钙”、“碳酸钙”、“钙元素”). kamdy1年前1
kamdy1年前1 -
 明镜台之我见 共回答了19个问题
明镜台之我见 共回答了19个问题 |采纳率94.7%解题思路:(1)根据相对分子质量为组成分子的各原子的相对原子质量之和,化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答.
(2)根据标签的信息可知:碘的含量最多为0.05mg/g,可以据此来求算出碘酸钾的最大含量.
(3)商标上的钙含量不是以单质、化合物、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.(1)KIO3的相对分子质量=39+127+16×3=214;KIO3中碘元素的质量分数=[127/214]×100%=59.3%.
(2)根据标签可得出碘的含量最多为0.05mg/g,所以一袋碘盐中碘元素的质量=0.05mg/g×500g=25mg,
所以一袋该食盐中KIO3的最大含量=25mg÷59.3%=42.2mg.
(3)商标上的钙含量不是以单质、化合物、分子、原子等形式存在,这里的“钙”不是以单质、化合物、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关.
故答案为:(1)214;59.3%;(2)42.2;(3)钙元素.点评:
本题考点: 相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算、元素的概念等进行分析问题、解决问题的能力.1年前查看全部
- (2011•青岛二模)右图是某厂生产的“糯米白醋”的标签说明.
 (2011•青岛二模)右图是某厂生产的“糯米白醋”的标签说明.
(2011•青岛二模)右图是某厂生产的“糯米白醋”的标签说明.
①已知醋酸的化学式为CH3COOH,则一个醋酸分子中含有______个原子.其相对分子质量为______;
②一瓶这样的糯米白醋中含有醋酸______g. ianwell1年前1
ianwell1年前1 -
 逍菩 共回答了25个问题
逍菩 共回答了25个问题 |采纳率88%解题思路:①根据醋酸的化学式可计算出一个分子中所含原子的个数和相对分子质量;
②溶质的质量等于溶液的质量乘以溶质质量分数.①已知醋酸的化学式为CH3COOH,则一个醋酸分子中所含原子个数为1+3+1+1+1+1=8,其相对分子质量为=12×2+1×4+16×2=60;
②根据标签,一瓶这样的糯米白醋中含有醋酸的质量=3.5g/100ml×500ml=17.5g;
故答案为:
①8,60;
②17.5点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;有关溶质质量分数的简单计算;相对分子质量的概念及其计算;标签上标示的物质成分及其含量.
考点点评: 本题主要考查学生运用化学式和元素质量分数进行计算的能力.1年前查看全部
- 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸做试剂进行检测.加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO3+5KI+6HCl=6KCl+3I2+3H2O,生成的I2遇淀粉变蓝.在上述反应中氧化产物与还原产物的物质的量之比为______.
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体.请计算此加钙食盐中钙元素的质量分数. rbapa1年前1
rbapa1年前1 -
 flyer99 共回答了14个问题
flyer99 共回答了14个问题 |采纳率92.9%解题思路:(1)根据化合价的变化结合化学计量数判断氧化产物与还原产物的物质的量之比;
(2)根据碳酸钙与盐酸反应的化学方程式计算碳酸钙的计算,进而计算此加钙食盐中钙元素的质量分数.(1)在反应KIO3+5KI+6HCl=6KCl+3I2+3H2O中,KIO3中I元素的化合价由+5价降低到0价,化合价变化的数目为5,KI中I元素的化合价由-1价升高到0价,化合价的变化的数目为1,氧化产物和还原产物都是I2,根据氧化还原反应得失电子数目相等可知,5:1;当有1molKIO3反应时,有5mol5KI被氧化,所以反应中氧化产物与还原产物的物质的量之比为5:1,
故答案为:5:1;
(2)10克此盐中含有mg碳酸钙,
根据反应方程式计算:
CaCO3+2HCl═CaCl2+CO2↑+H2O
100g 22.4L
m 67.2×10-3L
m=
100g×67.2×10−3L
22.4L=0.3g,
0.3g中含钙元素的质量为0.3g×
40
100=0.12g,
此加钙食盐中钙元素的质量分数为
0.12g
10g×100%=1.2%,
答:此加钙食盐中钙元素的质量分数1.2%.点评:
本题考点: 化学方程式的有关计算;氧化还原反应.
考点点评: 本题考查化学方程式的相关计算,题目难度不大,注意化学计量应用于化学方程式的计算的利用,本题易错点为氧化还原反应中氧化剂和还原剂的比较,但难度不大.1年前查看全部
- 如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
如图所示是某厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题:
(1)碳酸钙中碳、氧元素的质量比为______.
(2)计算高钙片中碳酸钙的质量分数.
 vivinaxiang1年前1
vivinaxiang1年前1 -
 济南的春天 共回答了26个问题
济南的春天 共回答了26个问题 |采纳率96.2%(1)碳酸钙中碳、氧元素的质量比为12:(16×3)=1:4.(2)由题意,每片中含钙元素500mg=0.5g,则每片中含碳酸钙的质量为0.5g÷( 40 100 × 100%)=1.25g,每片高钙片的质量为2.5g,则高钙片中碳...1年前查看全部
- 纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程
纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程
请回答下列问题:
(1)若实验室中进行该实验,操作1的名称是______.使用到的玻璃仪器有玻璃棒、烧杯、______,其中玻璃棒的作用是______.
(2)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是______,检验是否洗涤干净的方法是向最后一次洗涤液中加入______溶液(①Ca(OH)2、②AgNO3、③CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净.
(3)流程中用氨水而不是用水吸收CO2的原因是______
(4)上述流程中的副产品(NH4Cl)可用作______.(写一种用途) wjl06161年前1
wjl06161年前1 -
 天宇00006 共回答了14个问题
天宇00006 共回答了14个问题 |采纳率85.7%解题思路:(1)根据液体与固体分离的方法进行分析,根据过滤操作用用到的仪器进行分析,根据玻璃棒在过滤操作中的作用进行分析;
(2)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;
(3)根据二氧化碳是酸性气体,碱性溶液能吸收更多的二氧化碳进行分析;
(4)根据副产品的组成和用途进行分析.(1)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、玻璃棒,其中玻璃棒的作用是引流;
(2)由于碳酸钙粗品是从氯化氨溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙,检验是否含有氯化铵或氯化钙,可以利用检验氯离子的方法,使用硝酸银,银离子能与氯离子生成氯化银沉淀,有沉淀说明没有除尽,没有沉淀说明除尽了,故选②;
(3)二氧化碳是酸性气体,碱性溶液能吸收更多的二氧化碳,所以流程中用氨水而不是用水吸收CO2的原因是:氨水呈碱性,能吸收更多的二氧化碳;
(4)氯化铵是氮肥,可以作肥料.
故答案为:(1)过滤,漏斗,引流;
(2)NH4Cl或CaCl2,②;
(3)氨水呈碱性,能吸收更多的二氧化碳;
(4)肥料.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;常见化肥的种类和作用.
考点点评: 在解此类题时,首先分析反应流程中各个步骤的作用,然后结合学过的知识和题中的条件进行分析解答.1年前查看全部
- (2012•亭湖区一模)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:
(2012•亭湖区一模)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题:

(1)试剂A的化学式______,若在实验室中进行该实验,操作1和操作2的名称是______,该实验中玻璃棒的作用______.
(2)操作3为洗涤、检验和______,洗涤的作用是______,检验洗涤是否干净可选用试剂______(写化学式).
(3)上述流程中可循环利用的物质是______,该流程中的副产物可用作______.(写一种用途)
(4)分析该流程可得出SiO2部分性质,下列属于其物理性质______,化学性质______.
A.不溶于水B.可溶于水C.不与盐酸反应D.能与盐酸反应
(5)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na2SiO3),该反应的化学方程式______.根据此原理该同学设计出如下方案制备:取碳酸钡和二氧化硅混合物,滴加______(填“少量”或“过量”)的氢氧化钠溶液,过滤,洗涤,烘干得碳酸钡固体. 冰如兰1年前1
冰如兰1年前1 -
 NeilHorse 共回答了13个问题
NeilHorse 共回答了13个问题 |采纳率100%解题思路:(1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;根据操作后得到溶液与固体,利用过滤操作的特点,可判断操作1、2均为过滤操作,并说明过滤操作中玻璃棒的作用;
(2)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡间所发生的反应,判断副产物为碳酸钾,结合该物质的组成及性质,举例说明其用途;
(4)根据二氧化硅放入稀盐酸中的变化情况,推断二氧化硅的性质,并对物质性质进行物理性质与化学性质的区分;
(5)利用非金属氧化物与碱溶液的反应规律,判断二氧化硅与氢氧化钠的反应,写出反应的化学方程式;并结合除杂的操作方法,判断过程中加入氢氧化钠的量.(1)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,溶质的化学式为HCl;为从反应后的氯化钡溶液中除去二氧化硅固体,应进行过滤,过滤时需要使用玻璃棒进行引流,防止直接倾倒而冲破滤纸;
(2)为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;为检验洗涤干净,利用氯化钾能与硝酸银产生白色沉淀,可向洗涤后的溶液中滴加硝酸银检验洗涤后的溶液中不再含有氯化钾,以证明洗涤干净;
(3)在向碳酸钡中加入稀盐酸时产生的二氧化碳气体可通入氯化钡溶液中,与氢氧化钾、氯化钡的混合溶液发生反应得到碳酸钡,即二氧化碳在过程中可进行循环利用,在此过程中生成的副产物碳酸钾可提供作物生成所需的钾元素,可用作钾肥;
(4)在向碳酸钡与二氧化硅的混合物中加入稀盐酸时,二氧化硅既不溶于水又不能与稀盐酸发生反应,可得知二氧化硅的物理性质有不溶于水,化学性质有不能与稀盐酸反应;
(5)二氧化硅为非金属氧化物,根据这两类物质的反应特点,可知反应生成硅酸钠和水,反应的化学方程式为2NaOH+SiO2══Na2SiO3+H2O;为除去碳酸钡与二氧化硅中的二氧化硅,利用二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠,可向混合物中加入过量氢氧化钠溶液以完全除去二氧化硅,经过过滤,洗涤,烘干得碳酸钡固体.
故答案为:
(1)HCl;过滤;引流;
(2)烘干; 除去沉淀表面可溶性杂质或残留滤渣表面滤液;AgNO3;
(3)CO2; 钾肥或钾盐;
(4)A;C;
(5)2NaOH+SiO2═Na2 SiO3+H2O;过量.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;碱的化学性质;盐的化学性质;化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过流程图的分析,明确生产过程中所涉及的物质性质及变化规律,体现运用知识分析问题、解决问题的能力.1年前查看全部
- (2014•如皋市二模)纳米碳酸钙是一种重要的化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
(2014•如皋市二模)纳米碳酸钙是一种重要的化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
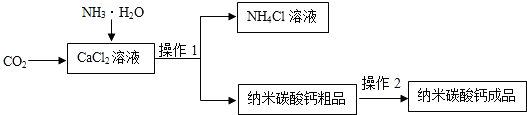
请回答下列问题:
(1)完成并配平该工艺中生成CaCO3的反应方程式(在“-”填写适当的数字和化学式):
CO2+CaCl2+______NH3•H2O═2NH4Cl+CaCO3↓+______.
(2)若在实验室中进行该实验,操作l的名称是______,使用到的玻璃仪器有烧杯、漏斗和______.
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有______(写一种化学式即可).操作2为:洗涤、检验和干燥,检验操作中选用的试剂为______(选择序号).
①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液
(4)上述流程中的副产品可用作______.(写一种用途) wendou59211年前1
wendou59211年前1 -
 chakwai 共回答了27个问题
chakwai 共回答了27个问题 |采纳率96.3%解题思路:(1)根据方程式的写法考虑;(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;(4)根据副产品的组成和用途考虑.(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号,方程式是:CaCl2+2NH3•H2O+CO2=CaCO3↓+2NH4Cl+H2O;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(4)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料.
故答案为:(1)2;H2O;(2)过滤;玻璃棒;(3)NH4Cl;②;(4)化肥.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;质量守恒定律及其应用.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- 关于显著性检验的一道题某厂生产净重340克的罐头,随机抽样100罐,查得实际平均净重338克,标准差为10g,依据一定显
关于显著性检验的一道题
某厂生产净重340克的罐头,随机抽样100罐,查得实际平均净重338克,标准差为10g,依据一定显著系数,将可判断生产线资料设施的运行情况.
Q:若决策人将发生第一类错误的概率为5%,即显著性水平Z0.025=1.96,根据抽样结果检验生产线设施运行是否正常? liuwenwumail1年前1
liuwenwumail1年前1 -
 cn77 共回答了13个问题
cn77 共回答了13个问题 |采纳率84.6%取0.05就是置信度为95%,取0.01置信度就是99%.具体选哪个就看得到的结果了,如有大部分都得P值都非常小,那就取0.01了,要是P值都很大,那就取0.05好了.一般情况下,0.05就可以,当然0.01就更精确了.1年前查看全部
- (6分)(下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
(6分)(下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:

(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸做试剂进行检测。加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO 3 + 5KI + 6HCl = 6KCl+3I 2 +3H 2 O,生成的I 2 遇淀粉变蓝。在上述反应中氧化剂与还原剂物质的量之比为 。(3分)
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体。请计算此加钙食盐 中钙元素的质量分数(取2位有效数字)。(3分)
中钙元素的质量分数(取2位有效数字)。(3分) reuenhild1年前1
reuenhild1年前1 -
 dhbfbdfh 共回答了17个问题
dhbfbdfh 共回答了17个问题 |采纳率82.4%1年前查看全部
- 纳米碳酸钙是一种重要的无机化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
纳米碳酸钙是一种重要的无机化工产品,如图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:CaCl2+______+CO2=CaCO3+______+H2O
(2)若在实验室中进行该实验,操作l的名称是______,使用到的玻璃仪器有______、______、______.
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有______(写一种化学式即可).操作2为:______、检验和干燥,检验操作中选用的试剂为______(选择序号).
①NH4Cl溶液②AgNO3溶液③CaCl2溶液. yangyuancn1年前1
yangyuancn1年前1 -
 钢厂ss 共回答了11个问题
钢厂ss 共回答了11个问题 |采纳率100%解题思路:(1)根据纳米碳酸钙的工艺流程和质量守恒定律完成方程式的写法;
(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;
(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑.(1)由纳米碳酸钙的工艺流程和质量守恒定律可知,生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号,所以化学方程式是CaCl2+2NH3•H2O+CO2=CaCO3↓+2NH4Cl+H2O;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)由于碳酸钙粗品是从氯化铵溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了.
故答案为:
(1)2NH3•H2O; 2NH4Cl;(2)过滤、滤纸、漏斗架(或铁架台、铁圈);(3)NH4Cl 或CaCl2、洗涤,②.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- (4分)海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。下图是某厂生产纯碱的工艺流程图:
(4分)海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。下图是某厂生产纯碱的工艺流程图:

请完成下列问题:
(1)该厂最终产品有 (填物质名称);
(2)流程Ⅰ中为了除去杂质,加入过量BaCl 2 溶液、NaOH溶液和Na 2 CO 3 溶液,下列说法正确的是
(填字母序号)
A.加入三种物质的顺序不能调整
B.加入三种溶液将粗盐水中的SO 4 2- 、Mg 2+ 、Ca 2+ 转化为沉淀
C.按流程Ⅰ所加溶液的顺序除杂,过滤后得4种沉淀
(3)在流程Ⅱ中,如果加入氨气不是为了生产氯化铵,氨气在制碱过程中的作用
是 ;
(4)写出Ⅲ中发生反应的化学方程式 。 一懒散人儿1年前1
一懒散人儿1年前1 -
 2356 共回答了20个问题
2356 共回答了20个问题 |采纳率100%(1)碳酸钠和氯化铵。(2)BC
(3)可增加二氧化碳吸收量
(4)2NaHCO 3 △ Na 2 CO 3 +H 2 O+CO 2 ↑
1年前查看全部
大家在问
- 1定语从句中先行词是the onIy one 指人,关系词用什么
- 2一个语法小问题.does make you feel better.为什么加does.(全句见补充)
- 3集体备课和教研活动记录可以一样吗
- 4在四边形中,AD‖BC,∠1=∠2,∠3=∠4,直线DC过E点,交AD于D,交BC于点C,求证 AD+BC=AB
- 5在长方体中检验两个面是否垂直中,找出图中的合页型折纸
- 6下列有关于水的认识正确的是( )
- 7一方石头有多重.
- 8关於英文文法I can finish studying English grammar in a day句中的study
- 9阅读理解Mrs Simpson' s Soup(汤)Mrs Simpson wanted to invite (邀请)
- 10英语翻译再翻译:我穿8号的
- 11李明的妈妈为家里的圆形餐桌买了一块长方形的桌布,长为1.6米,宽为1.2米.李明经过测量知道餐桌的直径为
- 12(2014•嘉定区一模)下列化学用语与所表述的意义不相符的是( )
- 13文言文学奕用的是什么写作手法
- 14如何检验一个图形是否是一个函数的图象?检验法则是什么
- 15现有一瓶蒸馏水和一瓶稀氯化钾溶液,可用什么简单的方法把它们鉴别开:______.





