溶解度大小和溶解性的关系是什么
 小孬再来2022-10-04 11:39:541条回答
小孬再来2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 生如夏花529 共回答了18个问题
生如夏花529 共回答了18个问题 |采纳率100%- 一种物质在一定温度下的100克水中,最多能溶解的质量叫该物质在该温度下的溶解度.
当20℃时,一种物质在100克水中的溶解度小于0.01克时,该物质叫难溶(或叫不溶),如碳酸钙、硫酸钡等;溶解度在0.01克到1克之间时,该物质叫微溶,如碳酸镁、氢氧化钙等;溶解度在1克到10克之间时,该物质叫可溶,如高锰酸钾等;当该物质的溶解度大于10克时,该物质叫易溶,如氯化钠等.
还有一个你不用了解,但该物质在水中的溶解度大于50克时,叫极易溶,如氯化氢气体、氨气等. - 1年前
相关推荐
- KNO3和KCl在不同温度时的溶解度如表所示
KNO3和KCl在不同温度时的溶解度如表所示
根据此表获取下列信息中正确的是( )温度 0 10 20 30 40 50 60 70 KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
A.从KNO3和KCl的混合物中分离出KCl,用降温结晶法
B.KNO3和KCl在温度为10℃-20℃时具有相同的溶解度
C.将 50℃时KNO3的不饱和溶液降温至10℃,一定能得到KNO3的饱和溶液
D.若将KNO3和KCl的热混合溶液(两者均已饱和)冷却至室温析出晶体后的溶液是饱和溶液 zwwlyzq1年前1
zwwlyzq1年前1 -
 mmssnn530 共回答了13个问题
mmssnn530 共回答了13个问题 |采纳率84.6%解题思路:根据已有的知识进行分析,根据表格提供的数据可以看出,硝酸钾的溶解度随温度升高变化很大,氯化钾的溶解度随温度变化增大不如硝酸钾明显,在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,据此解答即可.A、从KNO3和KCl的混合物中分离出KCl,可以先将溶液蒸发水分形成硝酸钾的饱和溶液,然后再冷却硝酸钾的饱和溶液使硝酸钾结晶析出,故错误正确.
B、根据图表中提供的数据知,在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,故B错误.
C、不知道50℃时KNO3的不饱和溶液中溶质的质量,则该不饱和溶液降温至10℃,不一定能得到KNO3的饱和溶液,故C错误.
D、硝酸钾的溶解度受温度影响大,降低温度就会有大量的晶体析出,氯化钾的溶解度受温度影响小,降温后不会大量析出;室温约是20℃,这时溶液中含有硝酸钾和氯化钠并且都达到饱和.故D正确.
故选:D.点评:
本题考点: 固体溶解度的影响因素;结晶的原理、方法及其应用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 本题考查了溶解度的有关应用,完成此题,可以依据溶解度的概念进行.1年前查看全部
- 关于糊精溶解性羟丙基环糊精在水中的溶解性很好,但是我想找一种溶剂,使羟丙基糊精在这种溶剂中的溶解度减小,先谢过了!
 屿梵1年前2
屿梵1年前2 -
 j90ij 共回答了22个问题
j90ij 共回答了22个问题 |采纳率90.9%加氯化钠吧,有机物在盐溶液中的溶解度降低1年前查看全部
- 初中溶解度难题917、某MgCl2、BaCl2的固体混合物36.3g,溶于100g税后,与87gMgSO4溶液恰好完全反
初中溶解度难题9
17、某MgCl2、BaCl2的固体混合物36.3g,溶于100g税后,与87gMgSO4溶液恰好完全反应,生成沉淀过滤烘干的固体23.3g,弱视眼中没有任何物质损失.试计算:
(1)原混合物中MgCl2的质量
(2)滤液中溶质的质量分数
 网上风云1年前1
网上风云1年前1 -
 不完美的缺陷 共回答了13个问题
不完美的缺陷 共回答了13个问题 |采纳率76.9%1)溶液中发生反应:BaCl2+MgSO4=BaSO4↓+MgCl2
所以沉淀过滤烘干的固体为BaSO4质量是23.3g,
所以根据元素质量守恒,Ba元素质量为:23.2×(137/137+96)
所以原混合物中BaCl2的质量为:23.2×(137/137+96)÷(137/137+35.5×2)=20.7克
所以原混合物中MgCl2的质量为:36.3-20.7=15.6克
2)反应后溶液总质量为:36.3+100+87-23.3=200克
BaCl2+MgSO4=BaSO4↓+MgCl2
.233..95
.23.3
因为反应生成BaSO4质量是23.3g,所以生成的MgCl2质量为:95×23.3÷233=9.5克
所以溶质总质量为:9.5+15.6=25.1克
所以滤液中溶质的质量分数:25.1/200=12.55%1年前查看全部
- 碳酸氢钠与碳酸钠那个溶解度更小?碳酸氢钾和碳酸氢钠呢?如何判断?与范德华力有关?还是别的什么?
 kip1231年前1
kip1231年前1 -
 了他几眼他 共回答了23个问题
了他几眼他 共回答了23个问题 |采纳率87%分子晶体溶解度与是否极性有关 相似相容
对于结构相似(很重要这一点)的分子晶体范德华力的大小与其溶沸点有关
当然是范德华力越大溶沸点越高啦1年前查看全部
- 如何计算溶解度.已知:Ksp AgCl:1.8x10^-10计算1.纯水2.1mol/L的盐酸中AgCl的溶解度.
 cc16211年前1
cc16211年前1 -
 zxy128866 共回答了20个问题
zxy128866 共回答了20个问题 |采纳率90%1.纯水
s=(Ksp)^0.5=1.34x10^-5mol/l
2.1mol/L盐酸
AgCl = Ag+ + Cl-
x x+1
Ksp=x(x+1)
近似处理Ksp=x*1
s=x=Ksp=1.8x10^-10mol/L1年前查看全部
- Mg(OH)2在同浓度的氨水和氯化氨溶液中的溶解度哪个大?为什么?
 Redchuanbo1年前4
Redchuanbo1年前4 -
 phxswpu 共回答了23个问题
phxswpu 共回答了23个问题 |采纳率87%NH4Cl中比较大···氯化铵是酸性滴···有助于氢氧化镁溶解平衡正方向移动滴···氨水碱性滴···对它的溶解起副作用滴···1年前查看全部
- 影响固体物质溶解度大小的主要因素是( )
影响固体物质溶解度大小的主要因素是( )
A 温度 B 溶剂的量 C 搅拌 D 以上三项都是
我感觉是A和B 我不知道B错在哪 知道的请回答下 理应1年前2
理应1年前2 -
 尘土道人 共回答了24个问题
尘土道人 共回答了24个问题 |采纳率95.8%根据溶解度的定义:一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种溶质在这种溶剂里的溶解度.则溶剂的量是确定不变的:是100克.所以只能是温度.
而搅拌只能加快溶解的速度,不能改变溶解度的大小.所以只能选A.1年前查看全部
- (2014•清远一模)如表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
 (2014•清远一模)如表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
(2014•清远一模)如表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
(1)依据如表数据,绘制Ca(OH)2和NaOH的溶解度曲线,如图中能表示NaOH溶解度曲线的是______(填A或B).温度/℃ 0 20 40 60 80 100 溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08 NaOH 31 91 111 129 313 336
(2)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙______ 甲(填“>”、“<”或“=”).
(3)现有Ca(OH)2和NaOH两种溶质的混合溶液,若要得到较纯净的NaOH溶液,应加入适量______试剂.
(4)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH______(填“偏大”、“偏小”或“不受影响”). happydavy1年前1
happydavy1年前1 -
 insx 共回答了13个问题
insx 共回答了13个问题 |采纳率92.3%解题思路:(1)据表格可知氢氧化钠的溶解度随温度升高而增大;
(2)氢氧化钙的溶解度随 温度升高而减小,氧化钙溶于水放热,据此分析解答;
(3)要得到纯净的氢氧化钠溶液,可向溶液中加入能与氢氧化钙反应的物质,但不能引入新杂质,结合氢氧化钙的性质解答;
(4)欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则溶液被稀释,溶液的碱性减小,据此解答.(1)依据如表数据,绘制Ca(OH)2和NaOH的溶解度曲线,如图中能表示NaOH溶解度曲线的是A,因为据表格可知氢氧化钠的溶解度随温度升高而增大;
(2)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),氧化钙溶于水放热,而氢氧化钙的溶解度随 温度升高而减小,则溶液中要析出溶质,溶质的质量分数减小,所以此时溶液中溶质的质量分数 乙 小于 甲;
(3)现有Ca(OH)2和NaOH两种溶质的混合溶液,可向溶液中加入碳酸钠溶液,将氢氧化钙反应掉,同时生成氢氧化钠和碳酸钙沉淀,过滤即可得较纯净的NaOH溶液;
(4)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则溶液被稀释,溶液的碱性减小,pH减小;
故答案为:(1)A;(2)<; (3)碳酸钠溶液;(4)偏小.点评:
本题考点: 固体溶解度曲线及其作用;溶液的酸碱度测定;溶质的质量分数、溶解性和溶解度的关系;碱的化学性质.
考点点评: 本题考查知识较为全面,在除杂时注意所加物质与杂质反应,且不引入新的杂质,能较好培养学生分析、解决问题的能力.1年前查看全部
- 下列关于溶液和溶解度的说法正确的是 [ ] A、物质可以无限制地溶解在一
下列关于溶液和溶解度的说法正确的是 [ ]A、物质可以无限制地溶解在一定量的水中而形成溶液
B、从10g5%的蔗糖溶液取出5mL,该蔗糖溶液浓度为0.5%
C、100g水溶解36g食盐达到饱和状态,即食盐的溶解度是36g
D、蒸发溶剂能析出溶质后的溶液一定是饱和溶液 kaki10031年前1
kaki10031年前1 -
 eltonz2003 共回答了22个问题
eltonz2003 共回答了22个问题 |采纳率90.9%D1年前查看全部
- 以水,CCl4为溶剂,在哪种溶剂中溴分子的溶解度更大
以水,CCl4为溶剂,在哪种溶剂中溴分子的溶解度更大
在溴水中加入CCl4,充分振荡后会发生什么变化,现象是什么?原因是什么 hma90001年前1
hma90001年前1 -
 攀爬的男人 共回答了21个问题
攀爬的男人 共回答了21个问题 |采纳率71.4%在四氯化碳中溴的溶解度更大
会出现分层,下层是溴的四氯化碳溶液,为橙红色,上层是水,几乎是无色的.四氯化碳能从溴水中萃取溴分子1年前查看全部
- 关于碱的碱性强弱如何比较NaoH.Mg(oH)2,Ca(OH)2的碱性强弱可Mg(oH)2不是不溶吗?问碱性强弱与溶解度
关于碱的碱性强弱
如何比较NaoH.Mg(oH)2,Ca(OH)2的碱性强弱
可Mg(oH)2不是不溶吗?问碱性强弱与溶解度有关系吗? 139921年前3
139921年前3 -
 小孩58号 共回答了18个问题
小孩58号 共回答了18个问题 |采纳率94.4%1.从化学式分析,看金属阳离子电离程度的强弱,Na+>Mg2+>Ca2+,故碱性由强到弱为:NaOH>Mg(OH)2>Ca(OH)2
2.a.直接用普通PH值试纸测定,PH值越大的,碱性越强
b.用专门检测碱性强弱程度的试纸检测,值越大的,碱性越强.1年前查看全部
- 【初中化学】溶解度为什么是(溶质质量/溶剂质量)×100g?
【初中化学】溶解度为什么是(溶质质量/溶剂质量)×100g?
不是说在100g溶剂中达到饱和溶质的质量吗
怎么转换成(溶质质量/溶剂质量)×100g的? 74521dick1年前1
74521dick1年前1 -
 oymiumiu 共回答了12个问题
oymiumiu 共回答了12个问题 |采纳率91.7%溶质质量/溶剂质量是没有单位的,但是在数值上等于一克溶剂中的溶质质量,乘以100g之后自然就是100g溶剂中的溶质质量1年前查看全部
- 在40°C时,73克NH4CL的饱和溶液中含有NH4CL23克,求此温度下NH4CL的溶解度?
在40°C时,73克NH4CL的饱和溶液中含有NH4CL23克,求此温度下NH4CL的溶解度?
而且是初二的那种运算过程 光辉メ岁月1年前1
光辉メ岁月1年前1 -
 宋benben 共回答了19个问题
宋benben 共回答了19个问题 |采纳率78.9%溶解度的定义:100g溶剂中最多能溶解多少克溶质.
73克NH4CL的饱和溶液中含有NH4CL23克
溶剂是50g,溶质是23g
所以,溶解度是46g.1年前查看全部
- 将220克60摄氏度的硝酸钾溶液降温至20摄氏度,析出78.4克硝酸钾晶体,判断原溶液是否饱和(硝酸钾的溶解度60摄氏度
将220克60摄氏度的硝酸钾溶液降温至20摄氏度,析出78.4克硝酸钾晶体,判断原溶液是否饱和(硝酸钾的溶解度60摄氏度时是110克,20摄氏度时是31.6克)
80摄氏度时氯化钾的溶解度为51克,在此温度下氯化钾溶液240克,若要制成饱和溶液,还需加入51克氯化钾,问原溶液中含氯化钾多少克? nature_fine1年前1
nature_fine1年前1 -
 xz4444 共回答了17个问题
xz4444 共回答了17个问题 |采纳率88.2%假设饱和,应该析出的晶体为
220*(110-31.6)/(100+110)=82.1g>78.4g
所以没有饱和
设原有 x g
(x+51)/(240-x)=51/100
x=47.3g1年前查看全部
- (2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
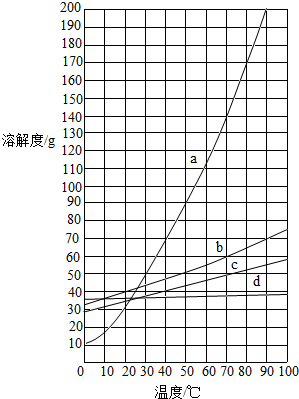 (2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
(2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
根据图表信息判断下列说法正确的是( )NaCl KCl NH4Cl KNO3 10℃ 35.8g 31.0g 33.3g 20.9g 60℃ 37.3g 45.5g 55.2g 110.0g
A.图中a曲线是KNO3的溶解度曲线
B.b的溶解度小于a的溶解度
C.要从a与d的混合物中得到a,通常采用蒸发溶剂使其结晶的方法
D.60℃时,将120gKNO3放入100g水中充分溶解,所形成溶液的溶质质量分数为54.5% bbl3121年前1
bbl3121年前1 -
 crzhidaonsss 共回答了16个问题
crzhidaonsss 共回答了16个问题 |采纳率75%解题思路:要比较溶解度的大小,必须指明一定温度下.60℃时,KNO3的溶解度为110g,则120gKNO3在100g水中不能完全溶解,所形成的溶液中溶质为110g,溶剂为100g,根据溶质质量分数=[溶质质量/溶液质量]×100%即可求出KNO3溶液的质量分数.A、根据表中数据,KNO3的溶解度随温度变化最大,故a曲线是KNO3的溶解度曲线,对;
B、a、b 的溶解度曲线有交点,小于交点温度时,溶解度a<b,大于交点温度时,溶解度a>b,错;
C、d 溶解度受温度影响很小,故要从a与d的混合物中得到a,应使用降温的方法,错;
D、60℃时,100g水中最多能溶解110gKNO3,则所形成溶液的溶质质量分数=[110g/110g+100g]×100%=52.4%,D错.
故选A.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题易错选A,在求溶质质量分数时一定要先判断溶液是否饱和,确定溶质质量和溶剂质量,再根据溶质质量分数计算公式即可求解.1年前查看全部
- 气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积.为比较温度对气体溶解度的影响,查得10
气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积.为比较温度对气体溶解度的影响,查得101kPa时,M、N两气体在不同温度下的溶解度数值:SM.20℃=0.023L/LH2O,SN,40℃=0.023L/LH2O.则在101kPa、30℃时,M、N两种气体的溶解度大小关系正确的是( )
A. SM<SN
B. SM=SN
C. SM>SN
D. 无法比较 ee头等大事1年前1
ee头等大事1年前1 -
 谁都不为 共回答了18个问题
谁都不为 共回答了18个问题 |采纳率94.4%解题思路:弄清气体溶解度的影响因素:随温度的升高而减小,随压强的增大而增大.气体的溶解度随温度的升高而减小,因此,30℃时,M的溶解度比原来减小,N的溶解度比原来增大.故选A
点评:
本题考点: 气体溶解度的影响因素.
考点点评: 主要考查了气体的溶解度和温度之间的关系,培养学生分析问题、解决问题的能力.1年前查看全部
- 钙的什么化合物其溶解度高?大概是多少
 i7771年前1
i7771年前1 -
 雪飘_随风 共回答了29个问题
雪飘_随风 共回答了29个问题 |采纳率86.2%硝酸钙!
硝酸钙常温下溶解度是129g/100g水!
氯化钙常温下溶解度是74.5g/100g水1年前查看全部
- 难溶物质的溶解度与溶度积怎么转换
难溶物质的溶解度与溶度积怎么转换
给出具体思路, 陈chenwei1年前2
陈chenwei1年前2 -
 光头ff 共回答了32个问题
光头ff 共回答了32个问题 |采纳率100%目前常用的溶解度有两种表示方法.
某温度,饱和溶液中
1.利用100g溶剂中溶解的溶质的质量,初中就学过这个;
2.利用溶质的物质的量浓度来表示,虽然知识在高中就学过,但是高中一般仍沿用初中的表示方法,这种表示思路大学才正式在课本提出.
溶度积是利用沉淀溶解平衡的可逆过程的K来表示的,
对于反应AxBy = x A + y B 符号KSP=[A]^x[B]^y AB我省略电荷了.
所以很容易发现,如果转化成2类溶解度很简单,因为都是用物质的量浓度来表示的,要转化为第一类就麻烦了,需要密度和摩尔质量才可以.
举例:某温度 饱和硫酸钡 溶度积 10^ -10 BaSO4 =Ba2+ + SO42-
[Ba2+][SO42-]=10^-10 所以[Ba2+]=[SO42-]=10^ -5
溶解的[BaSO4]=10 ^-5 第2类溶解度就是这个.
假设密度就是1,1L溶液溶解BaSO4 10^ -5 mol.近似看做 1000g 水 溶解 233×10^-5.1类溶解度求出.1年前查看全部
- 已知常温下硫酸钡的溶度积Ksp=10-10,求该温度下硫酸钡的溶解度,
已知常温下硫酸钡的溶度积Ksp=10-10,求该温度下硫酸钡的溶解度,
BaSO4(s)=可逆=Ba2+(aq)+SO4^2-(aq)
x x
Ksp=C(Ba2+)*C(SO4^2-)=10^-10 即x2=10^-10
x=10^-5 mol/L
即溶解的硫酸钡浓度为10^-5 mol/L
硫酸钡相对分子质量为 233g/mol
硫酸钡浓度为2.33*10^-3 g/L
1L水等于1000g水
也就是说1000g水中溶解了2.33*10^-3g硫酸钡,100g水中溶解了硫酸钡2.33*10^-4g
为什么要用到相对分子质量乘溶解的硫酸钡浓度,为什么不直接用溶解的硫酸钡浓度, 文刀大少1年前1
文刀大少1年前1 -
 俺来自高庙村 共回答了21个问题
俺来自高庙村 共回答了21个问题 |采纳率95.2%因为溶解度的单位是 g/100g水.
我们根据溶解积可以计算得出,饱和溶液中 BaSO4的物质的量浓度.
然后,根据此物质的量浓度,可以计算出,1L溶液中,所含BaSO4的质量.
接着根据这个计算出溶解度.
如果直接用 10^-5mol/L,那么只能得到饱和BaSO4溶液的物质的量浓度.
不知道这样说你明白吗?
有不理解的地方请追问!1年前查看全部
- 60摄氏度时硝酸钾饱和溶液中,溶质82.5克,溶剂75克,求60摄氏度时硝酸钾的溶解度
 jinxupeng1年前1
jinxupeng1年前1 -
 mikeleeni 共回答了17个问题
mikeleeni 共回答了17个问题 |采纳率94.1%82.5*(100/75)=110克1年前查看全部
- 溶解度的问题与多种溶质的溶液为什么在一定温度下物质在水中溶解的质量达到溶解度时无法继续溶解,而再加入其他的溶质为什么能继
溶解度的问题与多种溶质的溶液
为什么在一定温度下物质在水中溶解的质量达到溶解度时无法继续溶解,而再加入其他的溶质为什么能继续溶解新溶质? 我成都人1年前1
我成都人1年前1 -
 昨夜无人入睡 共回答了24个问题
昨夜无人入睡 共回答了24个问题 |采纳率87.5%溶液是否饱和只是对某一溶质而言.例如:一定温度下、一定量溶剂的食盐饱和溶液,食盐不能继续溶解,但对于其他物质还可以溶解.1年前查看全部
- 下表为KNO3在不同温度时的溶解度;
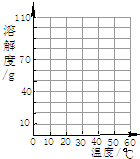 下表为KNO3在不同温度时的溶解度;
下表为KNO3在不同温度时的溶解度;
(1)请根据上表数据在图中画出 KNO3的溶解度曲线;温度/°C 0 20 40 60 溶解度/g 13.3 31.6 63.9 110
(2)从溶解度曲可以看出,KNO3溶液的溶解度随温度的升高而______;若某固体物质的溶解度受温度的影响不大,这物质可能是______. L5551年前1
L5551年前1 -
 jaystec 共回答了13个问题
jaystec 共回答了13个问题 |采纳率92.3%解题思路:(1)根据溶解度曲线做法结合KNO3在不同温度时的溶解度做出KNO3的溶解度曲线;
(2)根据溶解度曲线的意义,分析KNO3的溶解度随温度变化的情况,根据氯化钠的溶解度受温度的影响不大进行分析.(1)由KNO3在不同温度时的溶解度,找出对应的点,将这些点连成线,即可得出KNO3的溶解度曲线,如下图;
(2)由从溶解度曲可以看出,KNO3溶液的溶解度随温度的升高而升高;由于氯化钠的溶解度受温度的影响不大,所以若某固体物质的溶解度受温度的影响不大,这物质可能是NaCl.
故答为:(1)见下图;(2)升高,NaCl.
点评:
本题考点: 固体溶解度的影响因素;固体溶解度的概念.
考点点评: 通过本题的练习,会根据有关温度及溶解度会进行绘制溶解度曲线,并能理解溶解度曲线的意义,1年前查看全部
- 问个关于溶解度的初三化学题在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和合溶液中含X、Y两种物质的质量
问个关于溶解度的初三化学题
在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和合溶液中含X、Y两种物质的质量相等 这句话对吗?如果不对为什么?请举个例子~ aifza1年前2
aifza1年前2 -
 我想好了 共回答了22个问题
我想好了 共回答了22个问题 |采纳率86.4%不对.例如现有X饱和溶液100g,Y饱和溶液500g,两者含有的X、Y两种物质的质量显然不相等.
正确的描述:在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和合溶液中含X、Y两种物质的质量分数相等1年前查看全部
- 在20°C时,硝酸钾饱和溶液的质量分数为24%,计算硝酸钾的溶解度
 狐狸朱1年前1
狐狸朱1年前1 -
 布衣羊 共回答了12个问题
布衣羊 共回答了12个问题 |采纳率91.7%(100-24):24=100:S
S=31.58
在20°C时,硝酸钾饱和溶液的质量分数为24%,意思是:100克饱和溶液中含有24克硝酸钾,所以计算得到该温度下,硝酸钾的溶解度是31.58克.1年前查看全部
- 溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
A,升高温度
B,降低温度
C,恒温加溶质
D,恒温蒸发溶剂. 随风飘dh1年前1
随风飘dh1年前1 -
 杰才杰色 共回答了16个问题
杰才杰色 共回答了16个问题 |采纳率81.3%答案选A,B,由于已经是饱和溶液,因此升高或降低温度可以改变溶解度(溶解度与温度有关,具体我不记得硝酸钾的溶解度是随温度上升而增大还是降低了,总之可以改变溶解度),至于C,恒温的情况再加溶质已经加不进去了,恒温蒸发溶剂的话,溶液也一直是饱和的,质量分数不变,蒸发掉了溶剂相应就有溶质析出1年前查看全部
- 20度时,蔗糖饱和溶液15g,其中有10克溶质,求此温度时的溶解度?
 cdwls123151年前1
cdwls123151年前1 -
 lysuna 共回答了15个问题
lysuna 共回答了15个问题 |采纳率86.7%溶质除以溶液乘以百分之百1年前查看全部
- 固体混合物特点:各组分溶解度随温度变化差异不大方法:物理蒸发结晶 化学使用化学剂将其转变气体或沉淀
 xiao尧1年前1
xiao尧1年前1 -
 sadgkhagkjeg 共回答了24个问题
sadgkhagkjeg 共回答了24个问题 |采纳率83.3%各组分溶解度随温度变化差异不大,所以不能用蒸发结晶的方法,这样不能分离.
所以要用化学方法.1年前查看全部
- 固体的溶解度表示在____下,某固态物质在____ 里达到_____状态时所溶解的质量.
固体的溶解度表示在____下,某固态物质在____ 里达到_____状态时所溶解的质量.
气体的溶解度是指这种气体在压强为___和___时溶解在____里达到饱和状态时的气体体积
汽油去油污是______原理
如果两种固体混合物都是可溶的,一般用_____的方法分离
溶液的浓度
意义:表示一定量溶液中含有溶质的多少,用___表示 干戈10871年前1
干戈10871年前1 -
 Shitanni 共回答了23个问题
Shitanni 共回答了23个问题 |采纳率82.6%1.一定温度,100g溶剂,饱和
(一般滴,溶剂是水.)
2.1标准大气压,一定温度,1体积溶剂
相似相容原理,
沉淀或重结晶
质量百分比浓度1年前查看全部
- 我想知道对苯二甲腈在二甲苯中的溶解度以及在二甲苯中温度低了0-5度之间对苯二甲腈会不会析出
 存在之轻声1年前1
存在之轻声1年前1 -
 爱VS奉献 共回答了24个问题
爱VS奉献 共回答了24个问题 |采纳率91.7%这个数据一般很难查到,况且你也没有给温度/
你最好还是试一下,在一定的温度条件下,取一定质量的对苯二甲腈,加入一定量的二甲苯,搅拌1小时,看是不是全部溶解,如果没有全部溶解,就过滤,称重,就可以算出来了,如果全部溶解,就继续加对苯二甲腈,再搅拌1小时,直到有不溶解的出现,再过滤称重.
至于你说的降低温度,也要看具体是什么温度,从60降低到55,还是从30降低到25,不同的范围,溶解度变化是不一样的.1年前查看全部
- 在20摄氏度蒸干食盐溶液60克得到食盐15克,则此温度下溶解度是( )答案是无法计算,
 tyz1954071年前2
tyz1954071年前2 -
 夜色倾城 共回答了15个问题
夜色倾城 共回答了15个问题 |采纳率86.7%食盐溶液60克如果不是饱和溶液,则无法计算
溶解度是指某温度时,100个水中最多能溶解的溶质的质量,所以一定要是饱和溶液1年前查看全部
- 在20℃时,将100克蔗糖溶于水中.配成150克饱和溶液,求溶液的质量百分比浓度和溶解度
 cyzzdz1年前1
cyzzdz1年前1 -
 zw1998kj2 共回答了24个问题
zw1998kj2 共回答了24个问题 |采纳率87.5%w(蔗糖)=100/150*100%=66.7%
S(蔗糖)=100/(150-100)*100=200(g/100g H2O)1年前查看全部
- 书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
如果在100g水中溶20g硝酸铵 达到饱和 硝酸铵溶水吸热 溶液降温 ;则降温后溶解度也随之降低 会有硝酸铵固体析出 ——这种猜想对吗 我有点饿1年前2
我有点饿1年前2 -
 grace00 共回答了31个问题
grace00 共回答了31个问题 |采纳率90.3%降温速度要快于溶解速度.假如温度t时,100g水溶解20g硝铵达到饱和,那么将20g硝铵投入100g水中,它会边降温边溶解.由于降温速度快于溶解速度,所以,达到某一平衡点后,总有部分硝铵无法溶解,直至外界温度使溶液温度又逐渐升高,它才会继续溶解剩余部分.当回升至t时,全部溶解.
所以,溶解过程中,会发现是逐渐溶解掉的,而不是溶解后又析出.1年前查看全部
- 溶解度是对物质溶解性的定量表示,在理解固体物质和气体物质溶解度的定义时,你认为应分别抓住哪些关键因素?
 牛人杰1年前1
牛人杰1年前1 -
 瓦拉杜利德 共回答了19个问题
瓦拉杜利德 共回答了19个问题 |采纳率100%固体 温度 单位是g
气体 温度和压强 单位是体积
都有溶质和溶剂的性质 饱和状态1年前查看全部
- 除去硫酸铁中的硫酸锌,不能用锌,不能用溶解度.
 fire0011年前3
fire0011年前3 -
 新好男人 共回答了21个问题
新好男人 共回答了21个问题 |采纳率81%如果是干净的溶液
加入过量的浓碱,铁全部变成氢氧化铁沉淀,锌在过量碱作用下变成可溶的锌酸盐,然后过滤出固体氢氧化铁,再用硫酸溶解即可1年前查看全部
- 为什么甲基苯酚比苯酚溶解度小、
 dongdong11241年前1
dongdong11241年前1 -
 RexLv 共回答了23个问题
RexLv 共回答了23个问题 |采纳率91.3%甲基不亲水1年前查看全部
- 一道关于硫酸铜的竞赛题t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于水中,恰好形成饱和溶液;再取3X克
一道关于硫酸铜的竞赛题
t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于水中,恰好形成饱和溶液;再取3X克无水硫酸铜,加入该饱和溶液,析出Z克硫酸铜晶体(CuSO4·5H2O),最后将该Z克硫酸铜晶体溶于M克水中,又恰好得到N克饱和溶液(温度维持不变).下列说法正确的是:(多选)
A.Y=M=300
B.Y=300,N小于300
C.(3X·25/16)=Z
D.(3X·25/16)小于Z jasonwu20061年前1
jasonwu20061年前1 -
 hyuber 共回答了10个问题
hyuber 共回答了10个问题 |采纳率90%t℃时,无水硫酸铜在水中的溶解度是X克,现取3X克无水硫酸铜溶于Y克水中,恰好形成饱和溶液;Y=300
CuSO4+5H2O=CuSO4.5H2O
160 250
3X 3X*25/16
水参与反应,饱和溶液要析出CuSO4.5H2O晶体,所以.(3X*25/16)小于Z
Z克硫酸铜晶体溶于M克水中,又恰好得到N克饱和溶液(温度维持不变).M=300
所以选 AD1年前查看全部
- 乙酸乙酯在饱和碳酸钠溶液中的溶解度
 秋水亭1年前1
秋水亭1年前1 -
 delphi506 共回答了17个问题
delphi506 共回答了17个问题 |采纳率82.4%乙酸乙酯在水中电离出乙酸和乙醇.乙酸自身存在电离平衡,产生一定量的氢离子和乙酸根离子.那么也就相当于乙酸乙酯和水最终产生了氢离子.
在饱和碳酸钠溶液中,由于碳酸钠的水解,产生大量OH-.其量的大小远大于乙酸乙酯和水产生的H+的量.因为酸碱中和,所以对于醋酸的电离,其H+不停被消耗,平衡右移,醋酸不断生成再消耗,导致乙酸乙酯的电离也不断进行.最终,溶解在水中的乙酸乙酯经过上述过程,剩余量已经很少了,即低.
因为溶解度低,那么溶液中乙酸乙酯的量很少.又因为乙酸乙酯的密度比水小,所以会浮在水面上形成"油层".于是水溶液与油层(乙酸乙酯)便有很明显的界限,几乎不会互溶,便于分层.因为以上平衡进行得很缓慢,所以是可以看到明显分层的.但时间一长,油层,即乙酸乙酯逐渐消耗,便看不到5层,只看到水层了.
乙酸乙酯在水中溶解度不大,且溶解很缓慢,其速率取决于水溶液的酸碱性.PH越大,溶解越快.在纯水中,速率还是很慢的.
另外,值得注意的是,这里的溶解不同于像食盐等物质.乙酸乙酯溶解后,就很难重新收集,一方面是挥发性等,另一方面,乙酸乙酯在溶解中由于存在水解与电离平衡,使得想恢复液态的乙酸乙酯很难做到.1年前查看全部
- 比较AgBr在AgNo3溶液与KNO3溶液中的溶解度
 enjoyen141年前1
enjoyen141年前1 -
 骑羊羊的老头子 共回答了19个问题
骑羊羊的老头子 共回答了19个问题 |采纳率78.9%AgBr==Ag++Br- AgNo3会电离出Ag+ 抑制AgBr的溶解 所以AgBr 在KNO3中溶解度大1年前查看全部
- 已知AgCl溶解度大于AgBr,现将AgCl,AgBr的饱和溶液等体积混合,再加入浓AgNO3溶液,发生的反应为:
已知AgCl溶解度大于AgBr,现将AgCl,AgBr的饱和溶液等体积混合,再加入浓AgNO3溶液,发生的反应为:
A.只有AgBr沉淀生成.
B,AgBr沉淀多于AgCl
C.AgBr沉淀少于AgCl
选什么,并请解释以下
请用化学平衡原理解释,教科书上说溶解度小的沉淀转化成溶解度大的沉淀容易实现 又见边城1年前4
又见边城1年前4 -
 红白菜 共回答了22个问题
红白菜 共回答了22个问题 |采纳率77.3%这里氯化银和溴化银的溶解度都变小.
根据勒夏特列原理,向反应物中加入同种离子(AgNO3),迫使沉淀溶解平衡向左移动,所以两种沉淀的溶解度都小了.
根据沉淀溶解平衡常数(Ksp)
即Ksp(AgCl)=(氯离子浓度*银离子浓度)/氯化银浓度
AgCl=Cl-+Ag+
Ksp(AgBr)=(银离子浓度*溴离子浓度)/溴化银浓度
AgBr=Br-+Ag+
因为Ksp(AgCl)大于Ksp(AgBr)
所以沉淀向(AgBr)移动 选B1年前查看全部
- 关于计算溶解度的公式M前乘质量分数(前)=M后乘质量分数(后)质量一样,质量分数不同,怎么可能会相等?质量分数是不是说在
关于计算溶解度的公式
M前乘质量分数(前)=M后乘质量分数(后)
质量一样,质量分数不同,怎么可能会相等?质量分数是不是说在100g溶液中,含有这种物质多少g? yx497849091年前1
yx497849091年前1 -
 chenxyvaio 共回答了16个问题
chenxyvaio 共回答了16个问题 |采纳率81.3%M前乘质量分数(前)=M后乘质量分数(后)
这个公式是溶液稀释或浓缩的计算公式
稀释 M后=M前+加水的质量 质量分数(前)>质量分数(后)
浓缩 M后=M前-蒸发水的质量 质量分数(前)1年前查看全部
- 碳酸氢钙在水中的溶解度是多少?如何提高?
 sameo1年前1
sameo1年前1 -
 Baby小天使 共回答了15个问题
Baby小天使 共回答了15个问题 |采纳率93.3%碳酸氢钙在水中的溶解度
16.16 g/100 mL (0 °C)
16.6 g/100 mL (20°C)
17.05 g/100 mL (40°C)
17.5 g/100 mL (60°C)
17.95 g/100 mL (80°C)
18.4 g/100 mL (100 °C)
适当升温可提高溶解度1年前查看全部
- 纸层析法分离铁铜离子时,哪一种离子溶解度大,向上移动得快?
纸层析法分离铁铜离子时,哪一种离子溶解度大,向上移动得快?
还有,在***中,是亲脂性强的离子溶解度大,移动得快么? hu_0081年前1
hu_0081年前1 -
 vincent1982 共回答了18个问题
vincent1982 共回答了18个问题 |采纳率88.9%Fe3+移动的快在上面,Cu2+在下面.用氨熏后可以看到下面是蓝色上面是红棕色.
层析时,水是固定相,有机溶剂是移动相,一般来说,亲脂性强的物质在移动相中分配得多,就是移动得快;亲水性的在固定相分配得多,移动得慢1年前查看全部
- 请问哪位知道氟橡胶(F2314)在丙酮中的溶解度?
 希范爱庚宝1年前1
希范爱庚宝1年前1 -
 金色创艺 共回答了21个问题
金色创艺 共回答了21个问题 |采纳率85.7%你提供的应该是3F的氟橡胶.
据我了解,氟橡胶耐酮类和酯类的能力都不怎么样.1年前查看全部
- 计算AgCl的溶解度 在25℃时在6.O mol•L一1氨水溶液中[Kθ稳(Ag(NH3)2+)=1.12×107].
计算AgCl的溶解度 在25℃时在6.O mol•L一1氨水溶液中[Kθ稳(Ag(NH3)2+)=1.12×107].
 luck_mw1年前1
luck_mw1年前1 -
 山野之间 共回答了17个问题
山野之间 共回答了17个问题 |采纳率88.2%缺少AgCl溶度积条件,设为Ks,再设溶解度为x mol/L
AgCl(s) + 2NH3 == [Ag(NH3)2]+ + Cl- 该反应平衡常数K=Ks*K稳
平衡时 6-2x x x
根据K=x*x/(6-2x)^2
求解即可得出x1年前查看全部
- 某温度下.A克溶质溶解在A克水中恰好饱和.此溶质在该温度下溶解度是多少
 ok4l1年前5
ok4l1年前5 -
 gzhzh987 共回答了18个问题
gzhzh987 共回答了18个问题 |采纳率88.9%溶解度是100克水中溶解的溶质的质量,既然A克溶质溶解在A克水中恰好饱和,那么100克水中最多能溶解100克溶质,即溶解度为100克1年前查看全部
- 氢氧化钙的溶解度为什么会随温度升高而降低?
 右脚枪1年前1
右脚枪1年前1 -
 cs008 共回答了12个问题
cs008 共回答了12个问题 |采纳率91.7%温度升高时 H2O的K值增大,由H2O电离出的H+也增大 由电离平衡可知,当H+的浓度增大时,由同离子效应,OH-的浓度要降低 即由氢氧化钙电离出来的OH-浓度要降低,所以更难溶解1年前查看全部
- 关于溶解度的小问题(化学)`已知NaCl在60度时的溶解度是37.1g,现电解60度的精致饱和食盐水1371g,答案中有
关于溶解度的小问题(化学)`
已知NaCl在60度时的溶解度是37.1g,现电解60度的精致饱和食盐水1371g,
答案中有写到 60度饱和食盐水1371g,含有371克NaCl
请问为什么? yuhan37771年前1
yuhan37771年前1 -
 烟雾在消散 共回答了22个问题
烟雾在消散 共回答了22个问题 |采纳率68.2%溶解度的定义:100g溶剂能溶解的溶质的质量.在这里,溶剂是水,溶质是NaCl,故而每100g水能溶解37.1gNaCl,从而1000g水能溶解371gNaCl.1年前查看全部
- 为什么碘单质中加碘化钾可以增加碘单质的溶解度?
 雪域王子1年前2
雪域王子1年前2 -
 panda_q 共回答了19个问题
panda_q 共回答了19个问题 |采纳率94.7%因为I2单质难溶于水,为了增大它溶解的量,加入KI,I-在溶液中和I2结合成I3-,增大溶解度1年前查看全部
大家在问
- 1where____you____?I look for you everyday.1.have...been 2.did
- 2复数z=[1−3i/1+i]的虚部是______.
- 3蒸发的速度比沸腾快吗?吹雪_西门2 :那为什么有些人说蒸发速度比沸腾慢呢?你是不是弄错了.
- 4同学们都知道,将额定电压相同、额定功率不同的两只灯泡并联接入家庭电路中,额定功率大的灯泡亮.如果将这两只灯泡串联接入家庭
- 5若全集U=R,集合A={x|x>1},B={x|x>2},则集合A∩(∁ U B)=______.
- 6甲数是80,比乙数少20%,乙数是(),乙比甲多()%
- 7(2004•镇江)下列现象中,可以用光的直线传播来解释的是( )
- 8小明看一本书,第一天看了全书的[1/3],第二天看了第一天的[1/3],还剩全书的几分之几没有看?
- 9某班学生参加科技活动,其中参加的女生是全班人数的百分之二十,参加的男生的人数比全班人数的七分之二多2人,不参加的人数比全
- 10英语翻译At five he was collecting old newspapers to make money .
- 11Lisa didn't go to the party yeaterday.She _________ready for
- 12已知函数f(x)=1/x+1的算术平方根,求f(a的平方-1)的值.求详解.
- 13半圆周长25.7厘米求半圆的直径.
- 14不让青春虚度,在每一天的生活里载入一点点收获,让自信的微笑浮在你我的脸上,坚信付出就有回报,激情迸发精彩,求翻译
- 15铁碳固溶体中滞弹性产生的原因是什么?
