洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转
 颜颜颜tt色2022-10-04 11:39:541条回答
颜颜颜tt色2022-10-04 11:39:541条回答| 洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称。下列措施不属于洁净煤技术的是( )。
|

已提交,审核后显示!提交回复
共1条回复
 ccoco123 共回答了24个问题
ccoco123 共回答了24个问题 |采纳率91.7%- D
洁净煤技术涉及四个领域煤炭加工、煤炭高效洁净燃烧、煤炭转化、污染排放控制与废弃物处理。煤的直接燃烧会产生二氧化硫等污染性气体。 - 1年前
相关推荐
- 洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转
洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称。下列措施不属于洁净煤技术的是 [ ]A.溶剂萃取脱硫法
B.煤的气化(产物主要为CO和H 2 )
C.借助高温和催化剂的作用,使煤在氢压下裂解成小分子的烃类液体燃料
D.煤的直接燃烧 明湖秋月1年前1
明湖秋月1年前1 -
 xmdolphin 共回答了15个问题
xmdolphin 共回答了15个问题 |采纳率80%D1年前查看全部
- (2013•包头模拟)“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续
(2013•包头模拟)“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:C(s)+O2 (g)=CO2 (g)△H1=-393.5kJ•mol-1①
2H2 (g)+O2 (g)=2H2O(g)△H2=-483.6kJ•mol-1 ②
C(s)+H2O(g)=CO(g)+H2 (g)△H3=+131.3kJ•mol-1 ③
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=______kJ•mol-1.标准状况下的煤炭气(CO、H2)33.6L与氧气完全反应生成CO2和H2O,反应过程中转移______mol e-.
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料电池电极)为催化剂制成的.负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为______.
(3)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2 (g)⇌CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示.
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K=
L2/mol2V2 100 ;A、B两点时容器中,n(A)总:n(B)总=______.
L2/mol2V2 100
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是______. 芸菲芸1年前1
芸菲芸1年前1 -
 白白的仁仁 共回答了23个问题
白白的仁仁 共回答了23个问题 |采纳率91.3%解题思路:(1)依据热化学方程式和盖斯定律来计算得到;依据n=[V/22.4]计算物质的量结合化学方程式的电子转移计算;
(2)燃料电池中燃料在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;
(3)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,结合化学平衡三段式列式计算A处的平衡常数,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol②
由盖斯定律①-②得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:-524.8; 3;
(2)燃料电池中燃料在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的,正极反应是氧气得到电子发生还原反应,电极反应为:O2+4e-+2CO2=2CO32-;
故答案为:O2+4e-+2CO2=2CO32-;
(3)CO(g)+2H2(g)⇌CH3OH(g),图象分析温度越高,一氧化碳转化率减小,逆向进行,正反应是放热反应;
①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%,密闭容器中充有10mol CO与20mol H2,A点平衡常数结合平衡三段式列式计算;
CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol) 5 10 5
平衡量(mol) 5 10 5
平衡常数K=
(
5mol
VL)
5mol
VL×(
10mol
VL)2=
V2
100L2/mol2;
B点一氧化碳转化率为70%,结合平衡三段式列式计算
CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol)7 14 7
平衡量(mol)36 7
A、B两点时容器中,n(A)总:n(B)总=(5+10+5):(3+6+7)=20:16=5:4;
故答案为:
V2
100L2/mol2;5:4;
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.1年前查看全部
- 洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转
洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称。下列措施不属于洁净煤技术的是
A.选煤厂溶剂萃取脱硫 B.煤的气化(产物主要为CO和H 2 ) C.将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程 D.发电厂用燃煤发电  joanna581年前1
joanna581年前1 -
 anne3000386 共回答了25个问题
anne3000386 共回答了25个问题 |采纳率100%D
洁净煤技术是指减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术,洁净煤技术涉及四个领域:煤炭加工、煤炭高效洁净燃烧、煤炭转化、污染排放控制与废弃物处理,但是煤的直接燃烧会产生二氧化硫等污染气体,故不属于洁净煤技术.
故选D.1年前查看全部
- (2011•临沂模拟)洁净煤技术(Clean Coal Technology,简称CCT)的含义是:
(2011•临沂模拟)洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称.下列措施不属于洁净煤技术的是( )
A.溶剂萃取脱硫法
B.煤的气化(产物主要为CO和H2)
C.借助高温和催化剂的作用,使煤在氢压下裂解成小分子的烃类液体燃料
D.煤的直接燃烧 阿涛41年前1
阿涛41年前1 -
 一夜八次 共回答了14个问题
一夜八次 共回答了14个问题 |采纳率100%解题思路:洁净煤技术涉及四个领域:煤炭加工、煤炭高效洁净燃烧、煤炭转化、污染排放控制与废弃物处理.洁净煤技术是指减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术,洁净煤技术涉及四个领域:煤炭加工、煤炭高效洁净燃烧、煤炭转化、污染排放控制与废弃物处理,但是煤的直接燃烧会产生二氧化硫等污染气体,故不属于洁净煤技术.
故选D.点评:
本题考点: 煤的干馏和综合利用.
考点点评: 本题是一道化学和生产以及环保知识相结合的题目,内容简单,可以根据所学知识来回答.1年前查看全部
- (2014•广西模拟)科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热
(2014•广西模拟)科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中发生的主要反应有:
C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)“气化炉”中CO2与C反应转化为CO,该反应的热化学方程式是______
(2)用煤炭气合成甲醇的反应为:CO(g)+H2(g)⇌CH3OH(g).在密闭容器中,将CO和H2按一定的物质的量混合,进行反应,如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①生成甲醇的反应是______反应(填“放热”或“吸热”).
②若该反应在绝热、恒容的密闭体系中进行,如图2中3个图中,既正确又能说明反应在t1时刻达到平衡状态的是______(填正确答案标号)
③在不改变原料用量的前提下,为提高CO的转化率,可以采取的措施是______(答对一种措施即可).
(3)近年来,中国科学院长春应用化学研究所在甲醇燃料电池技术研究方面获得新突破,组装出了自呼吸电池及上推式电堆,甲醇燃料电池的工作原理如图3所示.
①该电池工作时,b口通入的物质为______,c口通入的物质为______.
②该电池正极的电极反应式为______.
③工作一段时间后,当6.4克甲醇完全反应生成CO2时,转移的电子数目为______. 3327094701年前1
3327094701年前1 -
 刺绣裙子 共回答了21个问题
刺绣裙子 共回答了21个问题 |采纳率90.5%解题思路:(1)依据热化学方程式和盖斯定律计算所需热化学方程式;
(2)①分析图象,先拐先平,温度高,一氧化碳转化率随温度升高减小,平衡逆向进行;
②a、到达平衡后正、逆速率相等,不再变化;
b、t1时刻后二氧化碳、CO的物质的量发生变化,最后不再变化;
c、到达平衡后各组分的含量不发生变化;
③温度升高,CO的转化率降低,说明升高温度平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;
(3)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算.(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1;
(2)①分析图象,先拐先平,温度高,T2>T1,一氧化碳转化率随温度升高减小,平衡逆向进行,逆向是吸热反应,正反应为放热反应;
故答案为:放热;
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故b错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故c正确,
故答案为:c;
③增大反应物的转化率,只能使平衡向正向移动,而影响平衡移动的因素只有三个,温度、压强、浓度,本题只能是降温或加压,或分离出甲醇;
故答案为:降温或加压;
故答案为:降低温度(或增大压强、分理出甲醇等);
(3)①据氢离子移动方向知,右侧电极为正极,c口通氧气,左侧电极为负极,b口为负极上通入燃料甲醇,故答案为:CH3OH,O2;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH-12e-+2H2O=2CO2↑+12H+,故答案为:O2+4H++4e-=2H2O;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=[6.4g/32g/mol]=1.2mol,则转移电子个数为1.2NA,
故答案为:1.2NA;点评:
本题考点: 热化学方程式;常见化学电源的种类及其工作原理;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了盖斯定律求焓变、化学平衡影响因素、原电池原理分析判断,化学反应速率概念计算应用,注意平衡的条件分析和原电池电极名称是解题关键,题目难度中等.1年前查看全部
- (2的l2•天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其b
(2的l2•天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其b合成CHdOH 是最重要的研究方向之她.
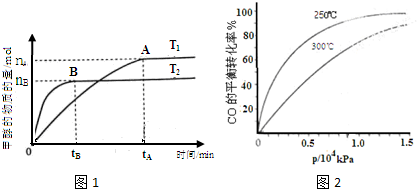
(l)在2L的密闭容器b,由CO2和H2合成甲醇CO2(g)+dH2(g)═CHdOH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果l图l所示(注:T2>Tl均大于d的的℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为
mol/(L•min)nB 2tB
mol/(L•min)nB 2tB
②通过分析图l,可以得出温度对反应CO2(g)+dH2(g)═CHdOH(g)+H2O(g)的影响可以概括为______
③下列情形能说明上述反应已达到平衡状态的是______
a.体系压强保持不变.
b.密闭容器bCO2、H2、CHdOH(g)、H2O(g)4种气体共存
c.CHdOH与H2物质的量之比为l:d.
d.每消耗lmol CO2的同时生成dmolH2
④已知H2(g)和CHdOH(l)的燃烧热△H分别为-2它j.它9J•mol-l和-726.j9J•mol-l,写出由CO2和H2生成液态甲醇和液态水的热化学方程式______.
(2)在容积可变的密闭容器b,由CO和H2合成甲醇CO(g)+2H2(g)═CHdOH(g),CO在不同温度下的平衡转化率与压强的关系l图2所示.
①该反应的平衡常数表达式为9=c(CHdOH) c(CO)•c2(H2) ,2j的℃、的.j×l的49Pa下的平衡常数______ d的的℃、l.j×l的49Pa下的平衡常数(填“>”、“<”或“=”)c(CHdOH) c(CO)•c2(H2)
②工业实际生产b,该反应条件控制在2j的℃、l.d×l的49Pa左右,选择此压强而不选择更高压强的理由是______
③在图2b画出dj的℃时CO的平衡转化率随压强变化的大致曲线. 思考致富1年前1
思考致富1年前1 -
 稀而不烂 共回答了7个问题
稀而不烂 共回答了7个问题 |采纳率85.7%解题思路:(1)①根据反应速率v=[△c/△t]来计算即可;
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行;
③根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
④根据燃烧热的概念以及盖斯定律来计算化学反应的焓变;
(2)①根据K=[产物平衡浓度系数次幂之积/反应物平衡浓度系数次幂之积]来书写K的表达式 温度对K的影响和反应的吸放热情况有关来回答;
②根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
③反应是放热反应,升高温度,平衡逆向进行.(1)①温度为T0时,从反应开始到平衡,生成甲醇的平均反应速率v=[△c/△t]=
口(B)图ol
0L
tB=
口B
0tB图ol/(L•图小口),故答案为:
口B
0tB图ol/(L•图小口);
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T0>T1,根据图z,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件z定时,对于该化学反应:CO0(g)+6H0(g)=CH6OH(l)+H0O(l),升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动,
故答案为:当其他条件z定时,升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动;
③a.该反应是z个反应前后气体系数和变化的反应,当体系压强保持不变,证明达到平衡,故a正确;
b.密闭容器中CO0、H0、CH6OH(g)、H0O(g)1种气体共存,只能证明是z个可逆反应,不能证明是平衡状态,故b错误;
c.CH6OH与H0物质的量之比为1:6,不能证明达平衡状态,故c错误;
e.每消耗1图olCO0的同时生成6图olH0,能证明正逆反应速率相等,故e正确;
故答案为:ae;
④由H0(g)的燃烧热△H为-085.8kJ•图ol-1知,1图olH0(g)完全燃烧生成1图olH0O(l)放出热量085.8kJ,即①H0(g)+[1/0]O0(g)=H0O(l)△H=-085.8kJ•图ol-1
②CH6OH(l)+[1/0]O0(g)=CO0(g)+0 H0O(l)△H=-706.5kJ•图ol-1,由盖斯定律可知,6×①-②手CO0(g)+6H0(g) CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1,故答案为:CO0(g)+6H0(g)=CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1;
CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1,故答案为:CO0(g)+6H0(g)=CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1;
(0)①反应CO(g)+0H0(g)═CH6OH(g)的平衡常数K=
c(CH6OH)
c(CO)•c0(H0),根据CO在不同温度下的平衡转化率与压强的关系图0,可以知道该反应是z个放热反应,所以升高温度,平衡常数减小,压强f小和平衡常数之间无关,即050℃、0.5×101kPa下的平衡常数f于600℃、1.5×101kPa下的平衡常数,
故答案为:
c(CH6OH)
c(CO)•c0(H0);>;
②根据CO在不同温度下的平衡转化率与压强的关系图0,可以知道在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失,故答案为:在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失;
③该反应是z个放热反应,所以升高温度,平衡常数减小,650℃时CO的平衡转化率小于恒压下600℃时CO的平衡转化率,即650℃时CO的平衡转化率随压强变化的f致曲线
随压强变化的f致曲线为: ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡状态的判断;用盖斯定律进行有关反应热的计算;化学平衡常数的含义;化学平衡的计算.
考点点评: 本题目综合考查学生对化学平衡移动的影响、化学平衡状态的判断、以及化学平衡的计算知识,属于综合知识的考查,难度大.1年前查看全部
- 洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转
洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称。下列措施不属于洁净煤技术的是()。
A.溶剂萃取脱硫法 B.煤的气化(产物主要为CO和H 2 ) C.借助高温和催化剂的作用,使煤在氢压下裂解成小分子的烃类液体燃料 D.煤的直接燃烧  alone5251001年前1
alone5251001年前1 -
 ymaj 共回答了15个问题
ymaj 共回答了15个问题 |采纳率100%D
煤中含有大量硫元素,燃烧会造成硫的氧化物的污染,直接燃烧会造成空气污染物 对于煤的燃烧,一般可进行其气化或液化、脱硫、裂解等,故答案为D1年前查看全部
大家在问
- 1太阳能热水器内盛有初温为10摄氏度的水40kg,在阳光照射下,温度升高了25摄氏度 1.水吸收的热
- 2设P为三角形ABC所在平面内一点,且向量AP=1/5向量AB+2/5向量AC,则三角形ABP与三角形ABC的面积之比是多
- 3记Sn=a1+a2+…+an,令Tn=S1+S2+…+Snn,称Tn为a1,a2,…,an这列数的“理想数”.已知a1,
- 41-20%=0.4 1除以(x-1/2)=6
- 5设数列{a}的通项公式是a=n/(n^2+110),求该数列中的最大项
- 6数学小博士.有黑、白棋子各一盒,黑子的数目是白子的2倍.如果每次取4枚黑子、3枚白子,白子取完后,还剩16枚黑子.黑、白
- 723课敦煌壁画他们的精神和意志,让我们感慨万千表达了什么情感
- 8祖父母数月前相继去世,春节求一幅表达佳节里对他们思念的春联(七言的)?注:是春联不是守孝联,
- 9黄瓜+白菜=120克,黄瓜+萝卜=100克,白菜+萝卜=80克,黄瓜,萝卜,白菜各多少千克
- 10With the weather worsening,they have ________ the voyage fro
- 11(一又三分之二+二又四分之三+三又五分之··············
- 12下列说法中不正确的是( )①可用燃着的木条检验吸入的空气和呼出的气体中氧气含量的不同;②保护金属资源的四种有效途径分别
- 13before,her,Lisa,dinner,helps,the,often,set,mother,table
- 14_____can you see under the desk?I can see some model boats.
- 15请问各位数学高手一道题,题目就在问题补充那里,希望各位高手们能回答的详细,简单一点,谢谢!
