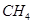联氨分子中包含_______个σ键,_______个π键
 我爱雅典娜2022-10-04 11:39:544条回答
我爱雅典娜2022-10-04 11:39:544条回答我认为是5、0.
有人说NN之间重叠的那部分有个π键,联氨里不是只有5个键吗?1个N—N键、4个N—H键,应该是5个σ键吧?
大π键是分子里3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键,比如苯环里的封闭共轭π键。这里只有2个N原子有p轨道,

已提交,审核后显示!提交回复
共4条回复
 海水的衍射 共回答了17个问题
海水的衍射 共回答了17个问题 |采纳率94.1%- 支持楼主,没有π键,氮是第二周期元素,要想形成大π键参加形成的原子必须共平面,而在联氨分子中的氮是sp3杂化的,氢原子与氮原子不共平面,这是其一.再说氢原子由于没有相应轨道跟什么原子都不可能形成大π键的,只可能形成超共轭效应,这在烷烃里很常见.
- 1年前
 liuyh208 共回答了43个问题
liuyh208 共回答了43个问题 |采纳率- 我认为也是1个N—N键、4个N—H键,应该是5个σ键,没有π键。
- 1年前
 hhlwuc 共回答了2637个问题
hhlwuc 共回答了2637个问题 |采纳率- 是5个σ键,没有π键。
- 1年前
 huangchenglx 共回答了4个问题
huangchenglx 共回答了4个问题 |采纳率- 这都涉及到大学的有关键的知识!我听老师讲过!是有一个什么大π键!不过好像很复杂!!
那我不晓得了!我还没读大学呢!不过正要读了!看看有没哪位教授或大师来解决了哟!! - 1年前
相关推荐
- 发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染.
发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染.
富马酸亚铁颗粒
C4H2FeO4 每包含富马酸亚铁0.2g 适应症:缺铁性贫血
服用量:每次1~2包(成人)
(1)反应的化学方程式为2N2H4+N2O4=3 +4H2O,请在横线上填写化学式以完成该化学方程式.
(2)请计算9.6gN2H4完全燃烧需要助燃物N2O4的质量. roverking1年前1
roverking1年前1 -
 一直在等你0504 共回答了15个问题
一直在等你0504 共回答了15个问题 |采纳率93.3%(1)N2
设需要助燃物N2O4的质量为x 2N2H4+N2O4===3N2+4H2O
64 92 9.6kg x
64/92=9.6g/x X=13.8kg 答:需要助燃物N2O4 的质量为13.8kg1年前查看全部
- N2H4.H2O 是“联氨”还是“联胺”,到底是哪个字?
 maten5201年前6
maten5201年前6 -
 向辛苦 共回答了26个问题
向辛苦 共回答了26个问题 |采纳率96.2%应该是“联胺”
氨——氮和氢的一种化合物,分子式为NH3,分子结构呈三角锥形,电子式为,其中氮原子有一对孤对电子.氨是一种无色、有臭味的气体,易溶于水.氨能够单独存在.也就是说,“氨”只用来指氨气或者液氨.
铵——指NH4^+,存在于铵盐中.如硝酸铵NH4NO3
胺——氨分子里的氢被烃基或其他非酸性有机基取代后衍生出的一类有机化合物 [amine].对胺的使用常常出现与化学命名不符的情况.常常把胺基酸说成是氨基酸.只不过由于说的人多了,就只好将就了.
我也是学化学的,我认为联胺其实就是两个氨分子里的氢被对方(非酸性有机基)互相取代.1年前查看全部
- 联氨(N 2 H 4 )及其衍生物是一类重要的火箭燃料,N 2 H 4 与N 2 O 4 反应能放出大量的热。
联氨(N 2 H 4 )及其衍生物是一类重要的火箭燃料,N 2 H 4 与N 2 O 4 反应能放出大量的热。
(1)已知:2NO 2 (g)=N 2 O 4 (g) △H=-57. 20 kJ/mol。一定温度下,在密闭容器中反应 达到平衡。
达到平衡。
其他条件不变时,下列措施能提高NO 2 转化率的是_____________ (填字母)。
A.减小NO 2 的浓度 B.降低温度 C.增加NO 2 的浓度 D.升高温度
(2)25℃时,1 00 g N 2 H 4 (1)与足量N 2 O 4 (l)完全反应生成N 2 (g)和H 2 O(l),放出19.14 kJ的热量。则反应2N 2 H 4 (1)+N 2 O 4 (1)=3N 2 (g) +4H 2 O(1)的△H=____kJ/mol
(3)17℃、1.01×l0 5 Pa,密闭容器中N 2 O 4 和NO 2 的混合气体达到平衡时,c(NO 2 ) =0. 030 0 mol/L、c(N 2 O 4 )=0.0120 mol/L。计算反应 的平衡常数K。_______________________
的平衡常数K。_______________________
(4)现用一定量的Cu与足量的浓HNO 3 反应,制得1.00 L已达到平衡的N 2 O 4 和NO 2 的混合气体(17℃、1.01×10 5 Pa),理论上至少需消耗Cu多少克?________________________________________ 菡萏池边抚瑶琴1年前1
菡萏池边抚瑶琴1年前1 -
 rabbitzhao 共回答了22个问题
rabbitzhao 共回答了22个问题 |采纳率95.5%(1)BC
(2) -1224.96
(3)根据题意知平衡时:c(N 2 O 4 )=0.012 0 mol/L c( NO 2 )=0.030 0 moI/L
答:平衡常数为13.3。
(4)由(3)可知,在17℃、1. 01×10 5 Pa达到平衡时,l.00 L 混合气体中:
n(N 2 O 4 )=c(N 2 O 4 )×V=0.0120 mol/L ×l.00L=0.0120 mol
n( NO 2 )=c( NO 2 )×v=0.0300 mol/L×l.00 L =0.0300 moI
则n总( NO 2 )=n(NO 2 ) +2×n(N 2 O 4 )=0.0540 mol
由Cu+4HNO 3 =Cu(NO 3 ) 2 +2NO 2 ↑ +2H 2 O可得
答:理论上至少需消耗Cu l.73 g。1年前查看全部
- 发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染.反应的化学方程式为2
发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染.反应的化学方程式为2N2H4+N2O4
3N2+4X;点燃 .
(1)X的化学式为______.
(2)请计算10g96%的联氨样品完全燃烧需要助燃物N2O4的质量. rong_hui1年前1
rong_hui1年前1 -
 医者使命战胜爱滋 共回答了17个问题
医者使命战胜爱滋 共回答了17个问题 |采纳率94.1%解题思路:(1)根据质量守恒定律的涵义:反应前后元素的种类不变,原子的个数相等,可推测X的化学式.
(2)根据联氨的质量结合反应的化学方程式可以计算出四氧化二氮的质量.(1)根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N2H4+N2O4=3N2+4X看,反应前反应物中氮、氢、氧元素的原子个数依次为:6、8、4;反应后生成物中除4X外,氮元素的原子个数为6.比较反应前后原子种类及个数可得知,4X中应含有8个氢原子、4个氧原子,所以X的化学式为H2O.
(2)10g96%的联氨样品中联氨的质量为y
设需要助燃物N2O4的质量为x
2N2H4+N2O4
点燃
.
3N2+4H2O
64 92
9.6g x
[64/9.6g]=[92/x]
解得:x=13.8g
答:10g96%的联氨样品完全燃烧需要助燃物N2O4的质量为13.8g.点评:
本题考点: 根据化学反应方程式的计算;质量守恒定律及其应用.
考点点评: 本题为根据化学方程式的基础计算,与高科技的结合,体现化合与高科技的密切关系.1年前查看全部
- 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol
则32g肼完全燃烧得到气态产物时放出热量______kJ.
(2)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,正极的电极反应式是______,电池工作一段时间后,电解质溶液的pH将______(填“增大”、“减小”、“不变”).
(3)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4.该装置的实际意义是______.
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,电解的离子方程式为4AgNO3+2H2O
4Ag+4HNO3+O2↑通电 .4AgNO3+2H2O,若______ 极(填A或B)增重10.8g,该燃料电池理论上消耗______molN2H4.
4Ag+4HNO3+O2↑通电 . guwei1231年前1
guwei1231年前1 -
 wertqwer 共回答了19个问题
wertqwer 共回答了19个问题 |采纳率89.5%解题思路:(1)由盖斯定律可得肼完全燃烧得到气态产物的热化学方程式,结合肼的物质的量计算反应热;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,根据原电池总反应式可判断溶液pH的变化;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,应为铜的精炼装置;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,阳极上OH-被氧化生成O2,根据电极反应式计算.(1)已知①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol,
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol,
利用盖斯定律将[①+②/2]可得:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,
n(N2H4)=[32g/32g/mol]=1mol,
则32g肼完全燃烧得到气态产物时放出热量为1mol×534kJ/mol=534kJ,
故答案为:534;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,负极反应式为N2H4-4e-+4OH-=N2+4H2O,电池总反应式为N2H4+O2=N2+2H2O,由总反应式可知,反应生成水,OH-浓度减小,则pH减小,
故答案为:O2+2H2O+4e-=4OH-;减小;
(3)①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4,则电解池工作时,阴极生成铜,阳极消耗粗铜,应为铜的精炼装置,
故答案为:精炼粗铜;
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,在阴极上析出Ag,电极反应式为Ag++e-=Ag,
阳极上OH-被氧化生成O2,电极反应式为4OH-=O2+2H2O+4e-,总反应式为4AgNO3+2H2O
通电
.
4Ag+4HNO3+O2↑,
n(Ag)=[10.8g/108g/mol]=0.1mol,得到0.1mol电子,由N2H4-4e-+4OH-=N2+4H2O可知,需要n(N2H4)=[0.1mol/4]=0.025mol,
故答案为:4AgNO3+2H2O
通电
.
4Ag+4HNO3+O2↑;B;0.025mol.点评:
本题考点: 化学电源新型电池;有关反应热的计算;电解原理.
考点点评: 本题考查电化学知识,题目难度中等,本题注意电极反应式的书写,为解答本题的关键,也是易错点.1年前查看全部
- 发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,反应的化学方程式如下:2N 2
发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,反应的化学方程式如下:2N 2 H 4 +N 2 O 4  3N 2 +4H 2 O,生成物不会对大气造成污染。请计算:3.2KgN 2 H 4 发生燃烧,需要助燃物N 2 O 4 的质量。
3N 2 +4H 2 O,生成物不会对大气造成污染。请计算:3.2KgN 2 H 4 发生燃烧,需要助燃物N 2 O 4 的质量。 loveSuede1年前1
loveSuede1年前1 -
 ganyongwen1980 共回答了21个问题
ganyongwen1980 共回答了21个问题 |采纳率95.2%1年前查看全部
- 发射通讯卫星的火箭用联氨N2H4作燃料用四氧化二氮气体作助燃剂燃烧后的生成物之一是氮气写出反应化学方程
发射通讯卫星的火箭用联氨N2H4作燃料用四氧化二氮气体作助燃剂燃烧后的生成物之一是氮气写出反应化学方程
发射通讯卫星的火箭用联氨(N2H4)作燃料用四氧化二氮(N2O4)气体作助燃剂,燃烧后的生成物之一是氮气.写出反应的化学方程式: 六妖飞1年前3
六妖飞1年前3 -
 gogaga 共回答了9个问题
gogaga 共回答了9个问题 |采纳率88.9%2N2H4+N2O4=3N2+4H2O1年前查看全部
- 联氨和双氧水反应从环保的角度看这一反应有个突出有点是什么?
 刘oo19851年前1
刘oo19851年前1 -
 兰沭 共回答了16个问题
兰沭 共回答了16个问题 |采纳率100%产物氮气和水不污染环境.1年前查看全部
- (1)肼(N 2 H 4 )又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN 2 H 4
(1)肼(N 2 H 4 )又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN 2 H 4 在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N 2 H 4 完全燃烧反应的热化学方程式是______________________ 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。 肼-空气燃料电池放电时:正极的电极反应式是__________________;负极的电极反应式是___________________。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是_______________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气________L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH 3 ,制得肼的稀溶液。该反应的离子方程式是___________________。 2bh1c1年前1
2bh1c1年前1 -
 tfen 共回答了22个问题
tfen 共回答了22个问题 |采纳率81.8%(1)N 2 H 4 (1) +O 2 (g) =N 2 (g)+2H 2 O(1);△H=-624kJ/mol
(2)O 2 +2H 2 O+4e - =4OH - ;N 2 H 4 +4OH - -4e - =4H 2 O+N 2 ↑
(3)Cu 2+ +2e - =Cu;112L
(4)ClO - +2NH 3 =N 2 H 4 +Cl - +H 2 O1年前查看全部
- 联氨即N2H4与盐酸反应生成什么?
 li46331年前1
li46331年前1 -
 nova_ma 共回答了14个问题
nova_ma 共回答了14个问题 |采纳率100%若N2H4过量,则
N2H4+HCl==N2H5Cl
若HCl过量,则
N2H4+2HCl==N2H6Cl21年前查看全部
- 联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O.下列说法错误的是( )
联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O.下列说法错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. N2H4的摩尔质量为32g/mol
D. 此反应中N2H4作氧化剂 323232w1年前1
323232w1年前1 -
 zhczy1984 共回答了14个问题
zhczy1984 共回答了14个问题 |采纳率100%解题思路:A、根据化合价是否变化判断;
B、根据化学反应与能量变化的关系判断;
C、根据分子量判断摩尔质量;
D、根据得失电子判断.A、此反应中N元素有化合价的变化,所以是氧化还原反应,故A正确;
B、该反应是一个放热反应,反应瞬间产生大量高温气体,推动火箭进行,故B正确;
C、N2H4的分子量是32,所以其摩尔质量为32g/mol,故C正确;
D、该反应2N2H4+2NO2=3N2+4H2O中,N2H4→N2,N元素由-2价→0价,失电子,所以N2H4作还原剂,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据化合价是否变化判断是否是氧化还原反应,要注意的是:无论氧化剂还是还原剂都是反应物不是产物.1年前查看全部
- 发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 0 4 )助燃,反应的化学方程式如下:2N 2
发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 0 4 )助燃,反应的化学方程式如下:2N 2 H 4 +N 2 0 4
3N 2 +4H 2 0,生成物不会对大气造成污染.请计算:3.2kgN 2 H 4 发生燃烧,需要助燃物N 2 0 4 的质量.点燃 .  风铃暗哑1年前1
风铃暗哑1年前1 -
 ii足球人201 共回答了17个问题
ii足球人201 共回答了17个问题 |采纳率94.1%设需要助燃物N 2 0 4 的质量为x
2N 2 H 4 +N 2 0 4
点燃
.
3N 2 +4H 2 0
64 92
3.2kg x
64
3.2kg =
92
x
x═4.6kg
答:需要助燃物N 2 0 4 的质量为4.6kg.1年前查看全部
- (10长沙48)2010年6月2日23时53分,第四颗北斗导航卫星在我国西昌卫星发射中心成功发射。发射卫星的火箭用联氨(
(10长沙48)2010年6月2日23时53分,第四颗北斗导航卫星在我国西昌卫星发射中心成功发射。发射卫星的火箭用联氨(N 2 H 4 )作燃料,用四氧化二氮(N 2 O 4 )作助燃剂,反应的化学方程式为:2N 2 H 4 +N 2 O 4 =3N 2 +4H 2 O,生成物不污染空气,低碳环保。请计算3.2KgN 2 H 4 完全燃烧后生成N 2 的质量。
 lonely82481年前1
lonely82481年前1 -
 69号烂番茄 共回答了21个问题
69号烂番茄 共回答了21个问题 |采纳率95.2%设生成N2的质量为x
2N 2 H 4 +N 2 O 4 =3N 2 +4H 2 O,
64 84
3.2Kg x
64:84=3.2Kg:x
解得x=4.2Kg
答:生成N2的质量为4.2Kg。
略1年前查看全部
- 发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,生成物不会对大气造成污染.反应的化学方程式为2
发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,生成物不会对大气造成污染.反应的化学方程式为2N2H4+N2O4═3X+4H2O.则X的化学式为( )
A.NO
B.NO2
C.NH3
D.N2 喳头zz1年前1
喳头zz1年前1 -
 linda_ll 共回答了19个问题
linda_ll 共回答了19个问题 |采纳率89.5%解题思路:根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减,结合化学方程式2N2H4+N2O4═3X+4H2O从而推断X的化学式.根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N2H4+N2O4═3X+4H2O看,反应前反应物中N、H、O元素的原子个数依次为:6、8、4;反应后生成物中除3X外,H、O元素的原子个数为8、4.比较反应前后原子种类及个数可得知,3X中应含有6个N原子,所以X的化学式为N2.
故选D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,利用化学方程式进行计算,从而推断出物质的化学式.1年前查看全部
- 发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 0 4 )助燃,生成物不会对大气造成污染.反应
发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 0 4 )助燃,生成物不会对大气造成污染.反应的化学方程式为2N 2 H 4 +N 2 O 4 ═3X+4H 2 O.则X的化学式为( ) A.NO B.NO 2 C.NH 3 D.N 2  小红马1年前1
小红马1年前1 -
 门口的大树 共回答了21个问题
门口的大树 共回答了21个问题 |采纳率81%根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N 2 H 4 +N 2 O 4 ═3X+4H 2 O看,反应前反应物中N、H、O元素的原子个数依次为:6、8、4;反应后生成物中除3X外,H、O元素的原子个数为8、4.比较反应前后原子种类及个数可得知,3X中应含有6个N原子,所以X的化学式为N 2.
故选D.1年前查看全部
- 发射卫星的火箭用联氨(N 2 H 4 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为_
发射卫星的火箭用联氨(N 2 H 4 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为______.  x05141年前1
x05141年前1 -
 majin_110 共回答了11个问题
majin_110 共回答了11个问题 |采纳率81.8%联氨(N 2 H 4 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为:2N 2 H 4 +N 2 O 4
点燃
.
3N 2 +4H 2 O.
故答案为:2N 2 H 4 +N 2 O 4
点燃
.
3N 2 +4H 2 O.1年前查看全部
- 发射通讯卫星的火箭用联氨(化学式为N2H4)作燃料,用N2O4作氧化剂,燃烧后生成氮气和水.写出联氨和N2O4反应的化学
发射通讯卫星的火箭用联氨(化学式为N2H4)作燃料,用N2O4作氧化剂,燃烧后生成氮气和水.写出联氨和N2O4反应的化学方程式:2N2H4+N2O4
3N2+4H2O点燃 .2N2H4+N2O4.
3N2+4H2O点燃 . jolyoon1年前1
jolyoon1年前1 -
 黄群丽 共回答了12个问题
黄群丽 共回答了12个问题 |采纳率100%解题思路:根据题意,联氨(化学式为N2H4)作燃料,用N2O4作氧化剂,燃烧后生成氮气和水,写出反应的化学方程式即可.联氨(化学式为N2H4)作燃料,用N2O4作氧化剂,燃烧后生成氮气和水,反应的化学方程式为:2N2H4+N2O4
点燃
.
3N2+4H2O.
故答案为:2N2H4+N2O4
点燃
.
3N2+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
根据题意完成下列计算:
⑴联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式.该氢化物受撞击则完全分解为氮气和氢气.4.30g该氢化物受撞击后产生的气体在标准状况下的体积为几L. 萱奕1年前1
萱奕1年前1 -
 郭晓琴 共回答了21个问题
郭晓琴 共回答了21个问题 |采纳率90.5%你好:
设该氢化物的分子式为NxHy
由题意得,
【相对分子质量为43.0】=>14x+1y=43.0
【氮原子的质量分数为0.977】=>14x/43.0=0.977
解得x≈3,y≈1
所以该氢化物的分子式为N3H
【该氢化物受撞击则完全分解为氮气和氢气】可转化为如下化学方程式:
2N3H=撞击= 3N2 + H2
由此可得,反应后生成的气体的物质的量为反应物的物质的量的两倍,即
n(N2+H2)=2n(N3H)
因为4.30g该氢化物的物质的量为0.1mol
所以产生的气体的体积V(总)=0.1×2mol×22.4L/mol=4.48L
回答完毕,懂啦?
望采纳O(∩_∩)O1年前查看全部
- (8分)(1)肼(N 2 H 4 )又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN 2
(8分)(1)肼(N 2 H 4 )又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN 2 H 4 在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N 2 H 4 的燃烧热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是 。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO 2 +4H + +2SO 4 2- 2PbSO 4 +2H 2 O,充电时:阳极反应式 : 用此装置电解水和重水(D 2 O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO 4 +2H 2 O,充电时:阳极反应式 : 用此装置电解水和重水(D 2 O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:  呆要1年前1
呆要1年前1 -
 徐瑞芬 共回答了14个问题
徐瑞芬 共回答了14个问题 |采纳率85.7%(1)N 2 H 4 (1)+O 2 (g)=N 2 (g)+2H 2 O(1);△H=-624kJ/mol;(2)N 2 H 4 +4OH - -4e - =4H 2 O+N 2 ↑
(3)PbSO 4 -2e - +2H 2 O==PbO 2 +SO 4 2- +4H + 3∶1
1年前查看全部
- 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生反应的电极反应式为______
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
①N2(g)+2O2(g)═2NO2(g)△H=-67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
③2NO2(g⇌N2O4(g)△H=-52.7kJ/mol
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,用尿素[CO(NH2)2]和次氯酸钠一氢氧化钠溶液反应获得,尿素法反应的离子方程式为______. Little-rain1年前1
Little-rain1年前1 -
 gutanqiuyi07 共回答了19个问题
gutanqiuyi07 共回答了19个问题 |采纳率89.5%解题思路:(1)左端为负极,在碱性电解质中失去电子生成氮气和水;
(2)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式.(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)⇌N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ•mol-1)×2-(-67.7kJ•mol-1)-(-52.7kJ•mol-1)=-947.6 kJ•mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1;
(3)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O.点评:
本题考点: 化学电源新型电池;离子方程式的书写;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查离子方程式、热化学反应方程式及电极反应式的书写,根据盖斯定律、原电池原理来分析解答即可,注意电极反应式的书写要结合溶液的酸碱性,为易错点.1年前查看全部
- 肼(N2H4)又称联氨,广泛用于火箭推进剂,有机合成及燃料电池.
肼(N2H4)又称联氨,广泛用于火箭推进剂,有机合成及燃料电池.
1.
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池.工业上在高锰酸钾 的催化下,用尿素[CO(NH2)2]与次氯酸钠—氢氧化钠溶液反应制肼.尿素法制肼的反应 如下:CO(NH2)2 + ClO- + 2OH- N2H4 + Cl- + CO32- + H2O,下列说法正确的是
A.CO(NH2)2中N的化合价是-2 B.CO32-是氧化产物
C.CO(NH2)2分子中既含σ键又含π键 D.生成2.24L N2H4转移0.2mol电子
(为什么选C?D 为什么不对?)
2.
.恒温、恒容:N2 (g) + 3H2 (g) ⇌ 2NH3(g);△H = -QkJ·mol-1.向甲、乙两个容积相同
的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
容 器
甲
乙
平衡时NH3的体积分数
ω1
ω2
平衡时N2的浓度(mol·L-1)
c1
c2
反应的能量变化(kJ)
Q1
Q2
反应物的转化率
α1
α2
下列说法不正确的是
A.ω1 = ω2 B.c1 = c2 C.Q1+Q2 = Q D.α1+α2 = 1
(为什么选A?D为什么是正确的?) 无帆的小帆船1年前1
无帆的小帆船1年前1 -
 阿瞒BABY 共回答了23个问题
阿瞒BABY 共回答了23个问题 |采纳率100%CO(NH2)2分子中 有C=O共价双键,共价单键是σ键,共价双键有一个σ键,π键,共价三键由一个σ键,两个π键组成.生成2.24L 是2个 N2H是0.1mol cl从+1到-1 那样说也是0.1mol 电子1年前查看全部
- (2011•朝阳区一模)发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污
(2011•朝阳区一模)发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染,其反应的化学方程式为:2N2H4+N2O4
3N2+4H2O,请计算12.8g N2H4完全燃烧需要N2O4的质量.______.点燃 . 苍浪蒲客1年前1
苍浪蒲客1年前1 -
 zhongyunbin8899 共回答了17个问题
zhongyunbin8899 共回答了17个问题 |采纳率88.2%解题思路:利用该反应的化学方程式,根据N2H4的质量求出N2O4的质量.设需要N2O4的质量为x.
2N2H4+N2O4
点燃
.
3N2+4H2O
6492
12.8gx
[64/12.8g=
92
x]
x=18.4g
答:需要N2O4的质量为18.4g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题是一道最基本的根据化学方程式的计算题,虽然用到的化学方程式学生不熟悉,但只要掌握了根据化学方程式计算的方法,就能轻易的解答本题.1年前查看全部
- 联氨与四氧化二氮反应燃烧尾气有氮气和水蒸气的反应化学方程式是?急
 应亦心1年前1
应亦心1年前1 -
 九月翌日 共回答了16个问题
九月翌日 共回答了16个问题 |采纳率75%2NH2-NH2+N2O4=3N2+4H2O1年前查看全部
- 发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染。
发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为2N 2 H 4 +N 2 O 4 =3__________+4H 2 O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6gN 2 H 4 完全燃烧需要助燃物N 2 O 4 的质量。 Amy雪儿1年前1
Amy雪儿1年前1 -
 匪徒不要命 共回答了20个问题
匪徒不要命 共回答了20个问题 |采纳率90%(1)N 2 (2)13.8g
1年前查看全部
- 联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O.下列说法错误的是( )
联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O.下列说法错误的是( )
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭飞行
C.N2H4的摩尔质量为32g/mol
D.此反应中N2H4作氧化剂 lypatrickl1年前1
lypatrickl1年前1 -
 酱缸 共回答了17个问题
酱缸 共回答了17个问题 |采纳率88.2%解题思路:A、根据化合价是否变化判断;
B、根据化学反应与能量变化的关系判断;
C、根据分子量判断摩尔质量;
D、根据得失电子判断.A、此反应中N元素有化合价的变化,所以是氧化还原反应,故A正确;
B、该反应是一个放热反应,反应瞬间产生大量高温气体,推动火箭进行,故B正确;
C、N2H4的分子量是32,所以其摩尔质量为32g/mol,故C正确;
D、该反应2N2H4+2NO2=3N2+4H2O中,N2H4→N2,N元素由-2价→0价,失电子,所以N2H4作还原剂,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据化合价是否变化判断是否是氧化还原反应,要注意的是:无论氧化剂还是还原剂都是反应物不是产物.1年前查看全部
- 发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,反应的化学方程式如下:2N2H4+N204
发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,反应的化学方程式如下:2N2H4+N204
3N2+4H20,生成物不污染空气,低碳环保.点燃 .
(1)N2O4中N的化合价为______;
(2)请计算9.6kg N2H4燃完全燃烧需要助燃剂N204的质量. haipinglj1年前1
haipinglj1年前1 -
 kkkk-llll 共回答了15个问题
kkkk-llll 共回答了15个问题 |采纳率86.7%解题思路:(1)根据化合物中各元素的化合价的代数和为0进行解答;
(2)根据反应的化学方程式,利用反应消耗反应物联氨(N2H4)的质量可计算同时需要消耗反应物四氧化二氮(N204)的质量.(1)根根据在化合物中正负化合价代数和为零,氧元素显-2,设氮元素的化合价是x,可知N2O4中氮元素的化合价:2x+(-2)×4=0,则x=+4;故填:+4;(2)设需要助燃物N204的质量为x2N2H4+N204 点燃 . 3...
点评:
本题考点: 根据化学反应方程式的计算;有关元素化合价的计算.
考点点评: 利用反应的化学方程能表示反应中各物质的质量关系的含义,根据反应中任一物质的质量都可以计算出反应中其它物质的质量.1年前查看全部
- 联氨的化学式
 kevinchang_20001年前5
kevinchang_20001年前5 -
 hinge888 共回答了16个问题
hinge888 共回答了16个问题 |采纳率93.8%联氨的化学式是N2H4
联氨不溶于乙醚、氯仿和苯,能与水、甲醇、乙醇等混溶.与水能形成恒沸物.
联氨有吸湿性,在空气中发烟,燃烧时呈紫色火焰.液体中分子以二聚体存在.有强还原性和腐蚀性.1年前查看全部
- 发射卫星的火箭用联氨(N2H2)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成.写出反应方程式.是
发射卫星的火箭用联氨(N2H2)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成.写出反应方程式.是不是这个

不好意思联氨(N2H4) yan25751年前3
yan25751年前3 -
 wufei0247 共回答了16个问题
wufei0247 共回答了16个问题 |采纳率93.8%应该是:4N2H2+N2O4=点燃=5N2+4H2O1年前查看全部
- (2010•长沙)2010年6月2日23时53分,第四颗北斗导航卫星在我国西昌卫星发射中心成功发射.发射卫星的火箭用联氨
(2010•长沙)2010年6月2日23时53分,第四颗北斗导航卫星在我国西昌卫星发射中心成功发射.发射卫星的火箭用联氨(N2H4)作燃料,用四氧化二氮(N2O4)作助燃剂,反应的化学方程式为:2N2H4+N2O4=3N2+4H2O,生成物不污染空气,低碳环保.请计算3.2KgN2H4完全燃烧后生成N2的质量.
 黄亚俊1年前1
黄亚俊1年前1 -
 ac453c46660b0574 共回答了21个问题
ac453c46660b0574 共回答了21个问题 |采纳率85.7%解题思路:根据反应的化学方程式2N2H4+N2O4=3N2+4H2O,可利用参加反应的联氨的质量计算完全反应后生成的氮气的质量.设生成氮气的质量为x 2N2H4+N2O4 点燃 . 3N2+4H2O 64 843.2kg&n...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 利用反应的化学方程式可以表示反应中各物质的质量关系,由一种物质的质量可计算反应中其它物质的质量.1年前查看全部
- (2011•江苏模拟)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
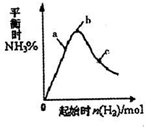 (2011•江苏模拟)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
(2011•江苏模拟)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
(1)火箭常用N2H4作燃料,N2O4作氧化剂.已知:
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
NO2(g)⇌[1/2]N2O4(g)△H=--26.35kJmol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______.
(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氨化钾溶液.该电池放电时,正极的电极反应式为______.
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g)+2H2(g)⇌2NH3(g)△H<0的影响如图所示.
①请在图中画出400℃时对应的图象.
②在a、b、c三点中,H2的转化率最高的是______(填字母). ftsxfxf1年前1
ftsxfxf1年前1 -
 aha_ahaa 共回答了15个问题
aha_ahaa 共回答了15个问题 |采纳率86.7%解题思路:(1)根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
(2)燃料电池的正极是燃料空气中的氧气得电子发生还原反应,即O2 +4e-+2H2O=4OH-;
(3)①温度对化学平衡移动的影响,升高温度化学平衡向逆反应移动氨气的平衡百分含量减少;
②化学平衡转化率的考查,对多种物质参加反应,改变其中一种物质,对另一物质转化率的影响.(1)已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③NO2(g)⇌[1/2]N2O4(g)△H=-26.35kJ•mol-1
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
故△H=2×(-534.0kJ•mol-1)-67.7kJ•mol-1-2×(-26.35kJ•mol-1)=-1083kJ•mol-1,
故热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083kJ•mol-1;
(2)燃料电池的正极是燃料空气中的氧气得电子发生还原反应,1mol氧气得到4mol电子,结合2mol电子生成4molOH-,故答案为:O2 +4e-+2H2O=4OH-;
(3)①正反应是放热反应,则升高温度,平衡向逆反应方向移动,所以当温度升高时氨气的含量降低,故图象为 ,故答案为:
,故答案为: .
.
②在可逆反应A+B⇌C中增加一种反应物A的量,等于提高另一种反应物B的转化率,而A本身的转化率反而降低,所以氢气的量越小,H2的转化率最高,故答案为:a.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡建立的过程.
考点点评: 本题考查利用盖斯定律进行反应热计算、燃料电池电极反应方程式的书写,以及化学平衡原理的考查,也体现了利用所学课本知识能够学以致用,该题基础性强,难度中等,注意电极反应式的书写,为易错点、难点.1年前查看全部
- 求“联氨”分子式及其性质
 zixugong1年前5
zixugong1年前5 -
 rocshen327927 共回答了16个问题
rocshen327927 共回答了16个问题 |采纳率93.8%联氨是一种无色的高度吸湿性的可燃液体,在联氨中氮原子的孤电子对可以同H结合而显碱性,但其碱性不如氨强,联氨是一个二元弱碱.联氨和氨一样也能生成配位化合物,例如[Pt(NH3)2(N2H4)2]Cl2 ,[(NO2)2Pt(N2H4)2Pt(NO2)2]...1年前查看全部
- (16分)肼(N 2 H 4 )又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液
(16分)肼(N 2 H 4 )又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。
Ⅰ氢气的制取与储存是氢能源利用领域的研究热点。
已知: (g)+
(g)+  (g)=
(g)= (g)+
(g)+ (g)
(g) = +
= +

 (g)+
(g)+  (g)=
(g)= (g)+
(g)+ (g)
(g) = +
= +

(1)氢气作为新能源的优点 。(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为 。
(g)的热化学方程式为 。
(3)H O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是 、 。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是 、 。
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(5)下图是一个电化学装置示意图。用肼一空气燃料电池做此装置的电源。
①如果A是铂电极,B是石墨电极,C是硫酸—硫酸铵,阴极的电极反应式是 。
②利用该装置可制得少量过氧化氢:在阳极上SO 4 2— 被氧化成S 2 O 8 2— (过二硫酸根离子),S 2 O 8 2— 与H 2 O反应生成H 2 O 2 ,S 2 O 8 2— +2H 2 O=2SO 4 2— +H 2 O 2 +2H + 。若要制取2molH 2 O 2 ,该燃料电池理论上需消耗 molN 2 H 4 。
(6)由A、B、C、D四种金属按下表中装置进行实验。
①装置丙中溶液的P H 。(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是 。 美丽有qq1年前1
美丽有qq1年前1 -
 ycz8065591 共回答了14个问题
ycz8065591 共回答了14个问题 |采纳率100%1年前查看全部
- 氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨反应,
氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨反应,
该反应中还原剂与氧化剂的物质的量之比为2:1,写出给反应化学方程式
用亚硝酸氧化联氨可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L, yandan031年前1
yandan031年前1 -
 callme209 共回答了22个问题
callme209 共回答了22个问题 |采纳率90.9%2NH3 +NaClO===N2H4+NaCl+H2O
43*97.7%=42.011,显然是3个N,所以分子式为HN3.
HN3==0.5H2 +1.5N2
2.15g(即0.05mol),产生0.1mol的气体,显然为2.24L.1年前查看全部
- 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.根据题意完成下列计算:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式______.该氢化物受撞击则完全分解为氮气和氢气.4.30g该氢化物受撞击后产生的气体在标准状况下的体积为______L.
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量.
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3=5N2+6H2O
6NO2+8NH3=7N2+12H2O
NO与NO2混合气体180mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气.吸收后氨水密度为0.980g/cm3.
计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数).
(4)氨和二氧化碳反应可生成尿素CO(NH2)2.尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物.测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比. weareallman1年前1
weareallman1年前1 -
 cj1982330 共回答了16个问题
cj1982330 共回答了16个问题 |采纳率93.8%解题思路:(1)利用氢化物的相对分子质量直接求出组成该氢化物两种元素的原子数,而后求得分子式.N原子数=43.0×0.977÷14=3,H原子数=43.0×0.023÷1=1,故分子式为HN3.因为该氢化物分解生成两种气体都是双原子分子,根据N原子、H原子守恒可求得混合气体体积.
(2)依题意知N2H4被氧化生成H2O,根据氢元素守恒可求得N2H4质量
(3)①根据N原子守恒可求得参加反应的氨的物质的量,根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量;
②根据质量守恒可求得反应后溶液质量,进而求得溶液的体积和溶液的浓度;
(4)三聚物有两种情况,一种为链状缩合时每生成一个三聚物同时生成2个氨气,一种为环状缩合时每生成一个三聚物同时生成3个氨气,根据质量守恒计算.(1)氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氢原子的质量分数为0.023,则n(N):n(H)=[0.977/14]:[0.023/1]=3:1,所以最简式为HN3,
设化学式为(HN3)n,有(1+14×3)n=43,n=1,所以分子式为HN3,
4.30g该氢化物的物质的量为n=[4.30g/43g/mol]=0.1mol,根据反应2HN3═H2+3N2,共产生气体的物质的量为0.1mol×2=0.2mol,体积为0.2mol×22.4L/mol=4.48L,
故答案为:HN3;4.48;
(2)反应的方程式为:2N2H4+N2O4═3N2+4H2O,生成72.0kg水时,n(H2O)=[72000g/18g/mol]=4000mol,则消耗的n(N2H4)=2000mol,联氨的质量为2000mol×32g/mol=64000g,即64Kg,
答:推进剂中联氨的质量为64kg;
(3)①根据N原子守恒可求得参加反应的氨的物质的量.
n(NH3)+180mol=156mol×2,n(NH3)=132mol.
根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量.
设为NO的物质的量X,NO2的物质的量为(180mol-X),
132mol×3=Xmol×2+(180-X)mol×4,X=162mol,(180mol-X)=18mol,
NO与NO2体积比为162:18=9:1.
答:该混合气体中NO与NO2的体积比为9:1;
②根据质量守恒可求得反应后溶液质量.
8.90×103g+162mol×30g•mol-1+18mol×46gmol-1-156mol×28g•mol-1=10220g,
其溶液体积为10220g÷0.980g•cm-3=10428cm3=10428mL=10.428L,
反应后溶液中剩余溶质氨的物质的量是8.90×103g×0.300÷17g•mol-1-132mol=25.058mol,
吸收后氨水的物质的量浓度为25.058mol÷10.428L=2.4 mol•L-1.
答:吸收后氨水的物质的量浓度为2.4mol/L;
(4)三聚物有两种情况,一种为链状缩合时每生成一个三聚物同时生成2个氨气,一种为环状缩合时每生成一个三聚物同时生成3个氨气,根据二聚物物质的量分数为0.6,则三聚物的物质的量分数为0.4,设二聚物的物质的量为x,链状三聚物的物质的量为y,环状三聚物的物质的量为z,则有2x+3y+3z=120,x+2y+3z=80,x:(y+z)=3:2,
解之得x=30mol,y=10mol,z=10mol,
答:缩合产物中各缩合物的物质的量之比为3:1:1.点评:
本题考点: 有关混合物反应的计算;化学方程式的有关计算;复杂化学式的确定.
考点点评: 本题考查较为综合,涉及混合物的计算、分子式的确定以及化学方程式的有关计算,题目难度较大,注意从质量守恒的角度分析.1年前查看全部
- 发射通讯卫星用联氨(H2N4)作燃料用四氧化二氮(N2O4)助燃,反应的化学方程式如下
发射通讯卫星用联氨(H2N4)作燃料用四氧化二氮(N2O4)助燃,反应的化学方程式如下
2N2H4+N2O4点燃3N2+4H2O,生成物不会对大气造成污染.试计算:3.2kgN2H4完全燃烧需要助燃物N2O4的质量.详细 tigerrfh1年前3
tigerrfh1年前3 -
 lsr520134 共回答了16个问题
lsr520134 共回答了16个问题 |采纳率93.8%3.2kgN2H4恰好是0.1kmol,需要N2O4为0.05kmol,质量为4.6kg1年前查看全部
- 发射卫星的火箭用联氨(N 2 H 4 )作燃料,用四氧化二氮(N 2 O 4 )作助燃剂,反应的化学方程式为:2N 2
发射卫星的火箭用联氨(N 2 H 4 )作燃料,用四氧化二氮(N 2 O 4 )作助燃剂,反应的化学方程式为:2N 2 H 4 +N 2 O 4 =3N 2 +4X,生成物不污染空气.则X的化学式为( ) A.NO B.NO 2 C.H 2 O D.N 2 O  时间81751年前1
时间81751年前1 -
 zxm751024 共回答了22个问题
zxm751024 共回答了22个问题 |采纳率81.8%根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N 2 H 4 +N 2 O 4 =3N 2 +4X看,反应前反应物中氮、氢、氧元素的原子个数依次为:6、8、4;反应后生成物中除4X外,氮元素的原子个数为6.比较反应前后原子种类及个数可得知,4X中应含有8个氢原子、4个氧原子,所以X的化学式为H 2 O.
故选C.1年前查看全部
- (3分)发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污
(3分)发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染,其反应的化学方程式为:2N 2 H 4 + N 2 O 4 点燃 3N 2 + 4H 2 O,请计算12.8 g N 2 H 4 完全燃烧需要N 2 O 4 的质量。
 xiezeyu1年前1
xiezeyu1年前1 -
 宽容就会快乐 共回答了12个问题
宽容就会快乐 共回答了12个问题 |采纳率100%18.4g。
1年前查看全部
- 古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3•H2O→N2H4+NaCl+H2O
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3•H2O→N2H4+NaCl+H2O
(1)请配平上述化学方程式.并用单线桥法标出电子转移的方向和数目.
(2)NH3•H2O在上述反应中显示出来的性质是______.
A.氧化性B.还原性C.酸性D.碱性
(3)该反应的氧化产物是______,NaClO发生______反应.
(4)若生成 0.2mol N2H4,则转移的电子为______ mol. 100321年前1
100321年前1 -
 丝路骆驼 共回答了13个问题
丝路骆驼 共回答了13个问题 |采纳率92.3%解题思路:(1)根据氧化还原反应中得失电子守恒的思想来配平方程式;
(2)化合价升高元素在反应中作还原剂,具有还原性;
(3)还原剂对应的产物叫氧化产物,氧化剂在反应中被还原,发生还原反应;
(4)根据氧化还原反应中得失电子的数目和各种物质的量的关系来回答.(1)一水合氨中的氮元素化合价由-3价升高到了-2价,失1mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,氧化还原反应中得失电子守恒,则配平情况电子转移的方向和数目为:
 ,故答案为:
,故答案为: ;
;
(2)一水合氨中氮元素的化合价升高了,表现了还原性,故答案为:B;
(3)还原剂是一水合氨,对应的原产物是N2H4,次氯酸钠中氯元素化合价由+1价降低到了-1价,为氧化剂,发生了还原反应,故答案为:N2H4;还原;
(4)2mol一水合氨中的氮元素化合价由-3价升高到了-2价,失2mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,反应共转移2mol电子,生成1mol N2H4,若生成 0.2mol N2H4,转移0.4mol,电子,故答案为:0.4.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的电子转移数目计算.
考点点评: 本题考查学生氧化还原反应中的有关概念以及转移电子的知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 联氨与双氧水反应方程式急
 天黑_2159851年前1
天黑_2159851年前1 -
 真想爱 共回答了24个问题
真想爱 共回答了24个问题 |采纳率87.5%N2H4+2H2O2=N2+4H2O(g)1年前查看全部
- 联氨与双氧水反应生成氨气和水蒸气,化学式产物一边有没有气体箭头?
 yy2334804611年前1
yy2334804611年前1 -
 公子的dd 共回答了16个问题
公子的dd 共回答了16个问题 |采纳率100%要写气体符号1年前查看全部
- 根据酸碱质子理论,以水为溶剂,联氨是酸还是碱?为什么?
 karena791年前2
karena791年前2 -
 yxi_001 共回答了22个问题
yxi_001 共回答了22个问题 |采纳率90.9%碱1年前查看全部
- 联氨与N2O4反应该反应是否属于基本反应类型
 bjxlhd1年前1
bjxlhd1年前1 -
 雾里看她 共回答了19个问题
雾里看她 共回答了19个问题 |采纳率89.5%属于,符合反应条件,第一、有气体的生成;第二、化合价的升高和降低.方程式:N2H4+N2O4=3N2+4H2O1年前查看全部
- 联氨(N2H4)和双氧水(H2O2)混合时产生水蒸气和一种单质,并放出大量的热优点是什么
 liuhaiyang_11年前1
liuhaiyang_11年前1 -
 datura88 共回答了16个问题
datura88 共回答了16个问题 |采纳率81.3%单质只能是N2,这个反应的最大优点就是环保和高效,不产生任何有害废料,而且都是液体,便于携带,这是和氢气相比的优势
这个反应是火箭推动的反应之一;
此外最常见的是N2H4和N2O4进行反应,1年前查看全部
- 如何用次氯酸钠氧化氨制联氨?五校联考化学题,我倒要看看全上海选化学的有几个会做
 想跳舞的大笨象1年前1
想跳舞的大笨象1年前1 -
 voicesea 共回答了18个问题
voicesea 共回答了18个问题 |采纳率77.8%NH3 +NACLO==NH2CL +NAOH
NH3+NH2CL +NAOH==N2H4+NACL+H2O
总方程式:2NH3+NACLO=N2H4 +NACL +H2O1年前查看全部
- 联氨与碘的化学放大反应方程式...
 pfbag6661年前2
pfbag6661年前2 -
 七昼夜 共回答了16个问题
七昼夜 共回答了16个问题 |采纳率87.5%产物是氮气和碘化氢.
(NH2)2+2 I2=4HI+N2
又(NH2)2是二元碱呈碱性,HI酸性,但是根据反应液的酸碱度不同,联氨和碘化氢的反应进行程度不同,产物可能有 (2HNNH3+) I- [(NH3)2]2+ I-
而这两种盐在不太酸的条件下是共存的,所以不知道反应到底进行到哪里.
所以这条方程式总反应方程式不好写,氧化还原反应原理方程式就是上面那条.1年前查看全部
- 联氨和强氧化剂双氧水,反应生成氮气和水蒸气 化学方程式怎么写
 anglelucifa1年前1
anglelucifa1年前1 -
 hrdjpe 共回答了18个问题
hrdjpe 共回答了18个问题 |采纳率88.9%N2H4+2H2O2=N2+4H2O1年前查看全部
- (2012•顺义区二模)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知:N2(g)+2O2(g)=2N
(2012•顺义区二模)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH-
C.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 寒竹木青1年前1
寒竹木青1年前1 -
 三秋夜冷 共回答了17个问题
三秋夜冷 共回答了17个问题 |采纳率82.4%解题思路:A、根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数,进行相应的加减.
B、肼是与氨类似的弱碱,N2H4不是电解质,N2H4•H2O是弱电解质,N2H4•H2O存在电离平衡电离出N2H5+、OH-.
C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式.
D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,溶液PH值减小.A、已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
由盖斯定律,①+②得2N2H4(g)+2O2(g)=2N2(g)+4H2O(g)△H=67.7kJ/mol-1135.7kJ/mol=-1068 kJ/mol.
即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol.故A错误;
B、N2H4不是电解质,N2H4•H2O是弱电解质,N2H4•H2O存在电离平衡,电离方程式为N2H4•H2O⇌N2H5++OH-,故B错误;
C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式为N2H4-4e-+4OH-=N2+4H2O,故C正确;
D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,碱性减弱,溶液PH值减小,故D错误.
故选:C.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池.
考点点评: 考查盖斯定律、热化学方程式书写、弱电解质的电离、原电池工作原理与电极反应式书写,难度中等,注意利用正、负电极反应式之和等于总反应式书写电极反应式.1年前查看全部
- 发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4
发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4+N2O4
3N2+4H2O点燃 .2N2H4+N2O4.
3N2+4H2O点燃 . shangxinzhidi1年前1
shangxinzhidi1年前1 -
 品尝qq 共回答了11个问题
品尝qq 共回答了11个问题 |采纳率90.9%解题思路:根据题意,发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,写出反应的化学方程式即可.联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为:2N2H4+N2O4
点燃
.
3N2+4H2O.
故答案为:2N2H4+N2O4
点燃
.
3N2+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 比较氨气,联氨,羟氨的碱性,并说明原因
 云彩飘飘0001年前1
云彩飘飘0001年前1 -
 6224001 共回答了11个问题
6224001 共回答了11个问题 |采纳率81.8%NH3>N2H4>NH2OH,因为电负性H1年前查看全部
大家在问
- 1求趣味相同的近义词或反义词,形容好朋友因不良嗜好而在一起趣味相同的四字成语,想不起来了
- 2读某同学画的等温线作业图,回答16-17题
- 3孙权劝学 (14分) 初,权谓吕蒙曰:“卿今当涂掌事,不可不学!”蒙辞以军中多务。权曰:“孤岂欲卿治经为博士邪!但当涉猎
- 4求求好心的 人 推导下球的体积和表面积的公式吧
- 5五(2)班有42人,这学期有20人订阅了《少年文艺》,订阅《小学生数学报》的人数比订阅《少年文艺》的人数多
- 6如图所示,两块水平放置的平行正对的金属板a、b与电源相连,在距离两板等距离的M点有一个带电液滴处于静止状态.若将b板向上
- 7如果1g水中含有a个氢原子,则阿伏加德罗常数应该表示为什么?
- 8硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O 和过量ba(oh)2反应的离子方程式?
- 91.这学期有了很大的进步
- 10如图,在Rt△ABC中,∠C=90°,点O在AB上,以O为圆心,OA长为半径的圆与AC、AB分别交于D、E,且⊙O与直线
- 11一个十位数为0的3位数,等于各个数和的m倍,交换其百位与个位数的位置,得到的3位数是其各位数和的n倍,n
- 12平行四边形ABCD中,E为BC中点,DE与AC相交于点F,设向量AB=a,向量AD=b 证明 向量AF=2向量FC
- 136.能证实20℃时原KNO3的溶液是饱和溶液的事实是( )
- 14This summer,I will have ------holiday with my family.I reall
- 15看下作文,有错的改错Believe it or not,in today’s fast-developing era,t