提纯含有少量硝酸钡的硝酸钾,可以使用什么方法
 似云亦云_aa2022-10-04 11:39:541条回答
似云亦云_aa2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 浪子05 共回答了18个问题
浪子05 共回答了18个问题 |采纳率100%- K2SO4来洗,逐滴加.因为BaSO4沉淀,很好分.理论上是这样
- 1年前
相关推荐
- 常见物质的分离、提纯和鉴别方法如常见物质的分离、提纯和鉴别具体的除杂或分离1.甲烷气体中有乙烯或乙炔(除杂)(溴水)2.
常见物质的分离、提纯和鉴别方法
如
常见物质的分离、提纯和鉴别
具体的除杂或分离
1.甲烷气体中有乙烯或乙炔(除杂)(溴水)
2.己烷中有己烯(除杂) (酸性KMnO4)
3.醋酸钠固体中有萘(除杂和分离)(升华)
越多越好
我要特别具体特别全的 heyeum1年前1
heyeum1年前1 -
 风在吼浪在啸 共回答了17个问题
风在吼浪在啸 共回答了17个问题 |采纳率100%1.结晶和重结晶:利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3.
2.蒸馏冷却法:在沸点上差值大.乙醇中(水):加入新制的CaO吸收大部分水再蒸馏.
3.过滤法:溶与不溶,如NaCl,CaCO3.
4.升华法:SiO2(I2).
5.萃取:如用CCl4来萃取I2水中的I2.
6.溶解法 :Fe粉(A1粉):溶解在过量的NaOH溶液里过滤分离.
7.增加法:把杂质转化成所需要的物质,如CO2(CO):通过热的CuO;CO2(SO2):通过饱和的NaHCO3溶液.
8.吸收法:用做除去混合气体中的气体杂质,气体杂质必须被药品吸收:N2(O2):将混合气体通过铜网吸收O2.
9.转化法:
两种物质难以直接分离,加药品变得容易分离,然后再还原回去:Al(OH)3,Fe(OH)3:先加NaOH溶液把Al(OH)3溶解,过滤,除去Fe(OH)3,再加酸让NaAlO2转化成A1(OH)3.1年前查看全部
- 从含有少量氯化钠的硝酸钾中提纯硝酸钾 从含有少量硝酸钾的氯化钠中提纯氯化钠
从含有少量氯化钠的硝酸钾中提纯硝酸钾 从含有少量硝酸钾的氯化钠中提纯氯化钠
这两者分别用什么方法
稍微详细一点,最好是有过程和原理 zhmtcl1年前1
zhmtcl1年前1 -
 鸟瞰天下 共回答了19个问题
鸟瞰天下 共回答了19个问题 |采纳率78.9%根据两者在水中溶解度随温度的变化可知:硝酸钾变化大,所以要提纯硝酸钾可以用降温(冷却)结晶,先1.加热浓缩(制热的饱和溶液)2.降温结晶 3.过滤 4.洗涤干燥;氯化钠变化小,所以用蒸发结晶,注意当蒸发皿中出现大量固体时停止加热,然后用余热蒸干.1年前查看全部
- 高温石墨化提纯方法
 rcl1231231年前1
rcl1231231年前1 -
 爱得连线 共回答了12个问题
爱得连线 共回答了12个问题 |采纳率91.7%石墨化提纯一般是在石墨化炉中进行,石墨化炉一般为2种:艾奇逊炉与内串石墨化炉.将石墨制品置于石墨化炉中,炉温升高至3000℃左右时,即可达到物理提纯的目的.若想进一步提高石墨纯度,可向炉内通入纯化气体,已达到更好的提纯效果.1年前查看全部
- (2013•长春二模)工业制取的粗盐(NaCl)中常混有MgCl2、CaCl2,欲分离提纯加以利用,实验过程如图:
(2013•长春二模)工业制取的粗盐(NaCl)中常混有MgCl2、CaCl2,欲分离提纯加以利用,实验过程如图:

(1)将粗盐溶于水,加入过量氢氧化钠将氯化镁转化为沉淀后过滤,再向滤出的沉淀中加入适量的______,得到氯化镁,使氯化镁得以分离再利用;
(2)在滤液b中加入适量盐酸的目的是______,如果滴加的稀盐酸过量,对最后得到的精盐的成分______影响(选填“有”或“没有”) 妙不可言61年前1
妙不可言61年前1 -
 控制面板2 共回答了11个问题
控制面板2 共回答了11个问题 |采纳率90.9%解题思路:(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,盐酸溶质氯化氢沸点低,稀盐酸过量,对最后得到的精盐的成分没有影响;(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,故在滤液b中加入适量盐酸的目的是把氢氧化钠转化为氯化钠;盐酸溶质氯化氢沸点低,在蒸发过程中早已跑掉,故稀盐酸过量,对最后得到的精盐的成分没有影响;
答案:(1)稀盐酸;
(2)把氢氧化钠转化为氯化钠,没有;点评:
本题考点: 氯化钠与粗盐提纯;酸的化学性质;盐的化学性质.
考点点评: 本题涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握.1年前查看全部
- 提纯氯化钠时,为什么要先除去SO4离子,然后再除去Ca离子和Mg离子?顺序能否颠倒过来?
 微笑71年前3
微笑71年前3 -
 狂欢的小鸟 共回答了12个问题
狂欢的小鸟 共回答了12个问题 |采纳率75%按照你颠倒顺序的思路做:
先除钙和镁离子:加入过量的碳酸钠,
现在溶液中还有:硫酸根离子、氯离子、钠离子、碳酸根离子.
接下来除去硫酸根离子:加入适量的氯化钡(产生硫酸钡和碳酸钡沉淀).
按不颠倒的顺序做:
先除硫酸根离子:加入过量氯化钡
除去钙和镁离子:加入过量碳酸钠(产生碳酸钡、碳酸钙还有碳酸镁沉淀).
除去碳酸根离子:加入过量稀盐酸
第一种方案是纯理想化的方案.因为加入的氯化钡再适量也做不到好精确的,总会有多加一滴或者少加一滴的情况.而第二种方案相对来说就要好的多了.因为他都是加入过量的物质,溶液的的残留杂质离子相对第一种方案就少的多.
所以最佳方案还是先除去硫酸根离子.1年前查看全部
- 氯化亚硝酰其状态及提纯
 longspy1年前2
longspy1年前2 -
 晓雨芊芊 共回答了10个问题
晓雨芊芊 共回答了10个问题 |采纳率80%中文名:氧氯化硒(氯化亚硒酰;二氯氧化硒)
英文名:Selenium Oxychloride
分子式:SeOCl
强氧化性.不稳定易分解,存在于王水中不易提纯1年前查看全部
- 重结晶提纯硫酸铜,蒸发滤液时,问什么加热不可过猛
 火元素师1年前1
火元素师1年前1 -
 爱原来是孤独 共回答了23个问题
爱原来是孤独 共回答了23个问题 |采纳率87%防止液体溅出,防止滤液蒸干1年前查看全部
- 某位同学提纯后计算出的精盐产厉比同期适应的其他同学的都低的多,请你帮他分析,产生原因可能是
 senddh1年前2
senddh1年前2 -
 sunjie235 共回答了25个问题
sunjie235 共回答了25个问题 |采纳率88%1.溶解过滤时,尚未完全溶解就过滤
2.蒸发结晶时,析出大量固体时未停止加热,导致食盐飞溅1年前查看全部
- 化学分离和提纯有什么区别?
 叶公好龙1年前3
叶公好龙1年前3 -
 成都吉奥汽车 共回答了24个问题
成都吉奥汽车 共回答了24个问题 |采纳率91.7%举个例子,某混合物中有A、B两种物质,其中B是杂质.
分离:要使A、B分开,分别得到纯净的A、B
提纯:只要除去杂质B即可,只得到纯净的A
分离要比提纯要求更高
转载自MB小熊
关于化学中物质的分离与提纯的关系,提纯是分离的目的,分离是提纯的手段和工艺过程,提纯必须通过分离才能实现,比如化学沉淀分离,就是利用某些物质在某种条件下生成沉淀的原理,进行分步沉淀,过滤,经几次沉淀与过滤,将主成分与其他有用成分分开,除去其中大部分杂质,达到提纯的目的.分离的方法还有溶剂萃取分离、离子交换法分离、电解法分离、隔膜法分离、活性碳吸附分离等,都是将溶液中的有用成分分开,使有用成分与杂质成分分离的方法.1年前查看全部
- 研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的基团
我选得ABC...AB为什么对了
A看错了=
B 能确定成分吗?有氧也能鉴别?有羟基也能鉴别? ptp0201年前1
ptp0201年前1 -
 梦琪子夜 共回答了17个问题
梦琪子夜 共回答了17个问题 |采纳率94.1%a肯定对啊?这是一种常用方法,但不是所有情况都能用.
b是用来确定实验式的,即C,H,O的原子个数比
C,核磁共振氢谱是确定氢原子的化学环境的,比如甲烷只有一个峰,应为它的四个H处于完全相同的化学环境
D,不解释了
总之要会揣摩出题人的意图,懂了不?1年前查看全部
- 粗盐提纯的六个方程式我写的之后还有的是什么?
粗盐提纯的六个方程式我写的之后还有的是什么?
BaCl2 + Na2SO4 === BaSO4↓+ 2H2O
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
MgCl2 + 2NaOH == Mg(OH)2↓+2NaCl
Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O ralfz1年前1
ralfz1年前1 -
 梦之翼 共回答了20个问题
梦之翼 共回答了20个问题 |采纳率100%少量这个:Na2CO3 + CaCl2 === CaCO3↓+ 2NaCl1年前查看全部
- 在碳酸钠,二氧化锰和水的混合物中如果提纯碳酸钠和二氧化锰?
 xugang20021年前1
xugang20021年前1 -
 xfcqu 共回答了22个问题
xfcqu 共回答了22个问题 |采纳率95.5%加水溶解,过滤得到 二氧化锰,在蒸发结晶得到碳酸钠1年前查看全部
- 氯化钠提纯实验中,钙离子和镁离子生成沉淀完全的pH是多少?
 iqhv1年前1
iqhv1年前1 -
 希尔顿1112 共回答了16个问题
希尔顿1112 共回答了16个问题 |采纳率100%盐酸是强酸,而氢氧化钠是强碱,生成的盐属于强酸强碱盐,所以一般情况下氯化钠溶液都在中性的,即7.0(实际应该是7.3-7.4,我自己做过测试),至于氯化钠提纯实验,不知道你指的是什么实验的?是不是从海盐中提取氯化钠的实验?那么该反应中,应该是用到碳酸钠来沉淀钙离子和镁离子,那么反应,如果条件中有提到是适量的碳酸钠那么,应该是中性7.0,如果碳酸钠是过量的,那应该就是碱性,即大于7.0!1年前查看全部
- 离子反应在物质提纯和鉴定的实例
 孙娜1年前1
孙娜1年前1 -
 bbbb99 共回答了17个问题
bbbb99 共回答了17个问题 |采纳率94.1%粗盐提纯
鉴定红砖中铁元素的价态1年前查看全部
- 求高中常见的物质的提纯和分离,知识点,越权越好.
 guolianglj1年前1
guolianglj1年前1 -
 镜观六路 共回答了18个问题
镜观六路 共回答了18个问题 |采纳率94.4%常见物质的分离、提纯和鉴别
1、 化学方法分离和提纯物质
对物质的分离可一般先用化学方法对物质进行处理,然后再根据混合物的特点用恰当的分离方法(见化学基本操作)进行分离.
用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂.用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去.
对于无机物溶液常用下列方法进行分离和提纯:
(1)生成沉淀法 例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性.
(2)生成气体法 例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去.
(3)氧化还原法 例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3.若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去.
(4)正盐和与酸式盐相互转化法 例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质.若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3.
(5)利用物质的两性除去杂质 例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3.
(6)离子交换法 例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2+、Mg2+进行交换,而使硬水软化.
2、物质的鉴别
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理.
鉴定通常是指对于某一种物质的定性检验,根据物质的化学特性,分别检出阳离子、阴离子,鉴别通常是指对分别存放的两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另一种,也可根据几种物质的颜色、气味、溶解性、溶解时的热效应等一般性质的不同加以区别.推断是通过已知实验事实,根据性质分析推求出被检验物质的组成和名称.我们要综合运用化学知识对常见物质进行鉴别和推断.
1.常见气体的检验
常见气体 检验方法
氢气 纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水.不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气
氧气 可使带火星的木条复燃
氯气 黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝)
氯化氢 无色有刺激性气味的气体.在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成.
二氧化硫 无色有刺激性气味的气体.能使品红溶液褪色,加热后又显红色.能使酸性高锰酸钾溶液褪色.
硫化氢 无色有具鸡蛋气味的气体.能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑.
氨气 无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟.
二氧化氮 红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性.
一氧化氮 无色气体,在空气中立即变成红棕色
二氧化碳 能使澄清石灰水变浑浊;能使燃着的木条熄灭.SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭.
一氧化碳 可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;能使灼热的CuO由黑色变成红色.
甲烷 无色气体,可燃,淡蓝色火焰,生成水和CO2;不能使高锰酸钾溶液、溴水褪色.
乙烯 无色气体、可燃,燃烧时有明亮的火焰和黑烟,生成水和CO2.能使高锰酸钾溶液、溴水褪色.
乙炔 无色无臭气体,可燃,燃烧时有明亮的火焰和浓烟,生成水和 CO2,能使高锰酸钾溶液、溴水褪色.
2.几种重要阳离子的检验
(l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变为红色.
(2)Na+、K+ 用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片).
(3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸.
(4)Mg2+ 能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液.
(5)Al3+ 能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液.
(6)Ag+ 能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成〔Ag(NH3)2〕+.
(7)NH4+ 铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体.
(8)Fe2+ 能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀.或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色.2Fe2++Cl2=2Fe3++2Cl-
(9)Fe3+ 能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液,能与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀.
(10)Cu2+ 蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的 CuO沉淀.含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成.
3.几种重要的阴离子的检验
(1)OH- 能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色.
(2)Cl- 能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+.
(3)Br- 能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸.
(4)I- 能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝.
(5)SO42- 能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸.
(6)SO32- 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色.能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体.
(7)S2- 能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀.
(8)CO32- 能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体.
(9)HCO3- 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊.或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体.
(10)PO43- 含磷酸根的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸.
(11)NO3- 浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体.
4.几种重要有机物的检验
(1)苯 能与纯溴、铁屑反应,产生HBr白雾.能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯.
(2)乙醇 能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生有刺激性气味的乙醛.乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上.
(3)苯酚 能与浓溴水反应生成白色的三溴苯酚沉淀.能与FeCl3溶液反应,生成紫色溶液.
(4)乙醛 能发生银镜反应,或能与新制的蓝色Cu(OH)2加热反应,生成红色的 Cu2O沉淀.
5.用一种试剂或不用试剂鉴别物质
用一种试剂来鉴别多种物质时,所选用的试剂必须能和被鉴别的物质大多数能发生反应,而且能产生不同的实验现象.常用的鉴别试剂有FeCl3溶液、NaOH溶液、Na2CO3溶液、稀H2SO4、Cu(OH)2悬浊液等.
不用其他试剂来鉴别一组物质,一般情况从两个方面考虑:
①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先鉴别出来,然后再用该试剂去鉴别其他物质.
②采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别.1年前查看全部
- 粗盐提纯的方程式
 排骨牛1年前1
排骨牛1年前1 -
 提那 共回答了18个问题
提那 共回答了18个问题 |采纳率94.4%混合物溶解如水中,则可过滤碳酸钙和泥沙.
然后加入足量的稀盐酸,除去碳酸钠.
最后加热,除去水和多余的盐酸.
得到氯化钠.
具体的是这样
一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
[编辑本段]二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
[编辑本段]三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
[编辑本段]四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液(防止溶液迸溅).
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
5.粗盐中含有Mg2+、Ca2+、SO42-
去除可溶性杂质:
溶解
加入过量BaCl2(去除硫酸根离子)SO42-+Ba2+=BASO4
加入过量NaOH(去除镁离子)Mg2++2OH-=Mg(OH)2
加入过量Na2CO3(去除钙离子及BaCl2中的钡离子) Ca2+CO32-=CaCO3
Ba2+CO32-=BaCO3
过滤
往滤液中加入适量HCl(除去过量NAOH,可用pH试纸控制加入的量)
蒸发,结晶1年前查看全部
- 下列提纯物质的实验方法不正确的是
下列提纯物质的实验方法不正确的是
1 用碳酸钠溶液除去混在氯化钠溶液中的氯化镁杂质
2 用蒸馏法除去混在水中的氧气
3 用酒精萃取溶解在水中的溴
4 将高锰酸钾溶液减压低温蒸发,以获得晶体高锰酸钾 WUXAN941年前1
WUXAN941年前1 -
 日落的下午 共回答了18个问题
日落的下午 共回答了18个问题 |采纳率100%1.引入了新的杂质
故不对1年前查看全部
- 粗盐提纯顺序问题我不懂为何要这样的顺序?这几步除了(溶解和过滤)感觉全可以颠倒啊
 你大哥1年前2
你大哥1年前2 -
 as852 共回答了12个问题
as852 共回答了12个问题 |采纳率83.3%请问“这样的顺序”是怎样的顺序?
总之,全部操作是
1,加水溶解
2、过滤,得滤液
3、蒸发结晶
具体是这三部,至于有什么别的操作都是多余的.上面散步的顺序不可换.1年前查看全部
- 下列物质提纯的方法正确的是 A.除去混在NO 2 中的NO:将气体与足量O 2 混合 B.除去混在CO 2 中的SO 2
下列物质提纯的方法正确的是
A.除去混在NO 2 中的NO:将气体与足量O 2 混合 B.除去混在CO 2 中的SO 2 :将气体依次通过足量酸性KMnO 4 溶液和浓硫酸 C.除去KCl溶液中的K 2 CO 3 :加入过量BaCl 2 溶液后过滤 D.除去乙酸中混有的乙醇:加入生石灰后蒸馏  秀女玉莹1年前1
秀女玉莹1年前1 -
 蝶舞采风 共回答了18个问题
蝶舞采风 共回答了18个问题 |采纳率94.4%B
A中容易引入杂质氧气,A不正确;SO 2 具有还原性,能被酸性高锰酸钾溶液氧化,B增强;C不正确,这样引入了杂质Ba 2 + ,应该加入盐酸;D不正确,乙酸和生石灰反应,所以答案选B。1年前查看全部
- 如何提纯含有少量Cacl2 ,MgSo4的固体食盐?简述食盐步骤,并写出除杂反应的化学方程式.
如何提纯含有少量Cacl2 ,MgSo4的固体食盐?简述食盐步骤,并写出除杂反应的化学方程式.
请问能不能用Na2Co3 和 BaOH 两个来做呢?
大概有个公式,不用配平也好~ mryty_19871年前5
mryty_19871年前5 -
 粉紫雪 共回答了16个问题
粉紫雪 共回答了16个问题 |采纳率93.8%首先我们要先加Na2Co3与Cacl2 反应生成碳酸钙沉淀和氯化钠Na2CO3+CaCl2=2NaCl+CaCO3↓(通常是加入过量的Na2Co3),然后加入Ba(OH)2与MgSo4,
Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓生成硫酸钡沉淀和氢氧化镁沉淀(Ba(OH)2也要过量),过滤后就加入稀盐酸,与剩余的Ba(OH)2先反应2HCl+Ba(OH)2=BaCl2+2H2O 再与Na2Co3反应
2HCl+Na2Co3=2NaCl+H2O+CO2↑
如果是盐酸剩余可以通过加热,盐酸会挥发1年前查看全部
- 粗盐提纯实验过程中,有哪些操作可能使食盐受热损失?
 开心吉它手1年前1
开心吉它手1年前1 -
 cnwuhao 共回答了10个问题
cnwuhao 共回答了10个问题 |采纳率100%最主要的是:加热时间太长,食盐晶体形成后继续加热,晶体会受热飞溅出蒸发皿.应该加热至有较多固体析出是即停止加热,利用余热使剩余水分蒸发掉.另外,加热时应用玻璃棒不断搅拌,防止局部过热使固体飞溅,造成损失.1年前查看全部
- 2003年1月5日,我国科学家首次在太空进行了用于“生物大分子和细胞的空间分离提纯”的电泳技术实验.则下列有关叙述中正确
2003年1月5日,我国科学家首次在太空进行了用于“生物大分子和细胞的空间分离提纯”的电泳技术实验.则下列有关叙述中正确的是( ) A.电泳就是指电子在水中游泳 B.悬浊液粒子也具有电泳现象 C.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下可能产生电泳现象 D.氢氧化铁胶体电泳时,其胶体微粒向阳极移动  pansz1年前1
pansz1年前1 -
 5485444 共回答了14个问题
5485444 共回答了14个问题 |采纳率85.7%A、因电泳是胶体粒子在外电压的作用下的定向移动,不是电子在水中游,故A错误;
B、因悬浊液粒子不带电,则不具有电泳现象,故B错误;
C、胶体微粒具有较大的表面积,具有吸附性,吸附离子而带电,故在电场作用下可能产生电泳现象,故C正确;
D、氢氧化铁胶体粒子带正电,电泳时其胶体微粒向阴极移动,故D错误;
故选C.1年前查看全部
- 根据粗盐提纯的实验回答下列问题.
根据粗盐提纯的实验回答下列问题.
(1)请写出实验的主要步骤:①______②______③______④______.
(2)前三个步骤中都用到了______,其作用分别是①______②______③______. srfrefres1年前1
srfrefres1年前1 -
 hz0904 共回答了21个问题
hz0904 共回答了21个问题 |采纳率81%解题思路:粗盐的初步提纯步骤:目的是除去泥沙,所以可通过①溶解:用玻璃棒搅拌;②过滤:注意“一贴二低三靠”,用玻璃棒引流;③蒸发:用玻璃棒搅拌,避免液体局部过热造成液滴飞溅;④重结晶.(1)粗盐的初步提纯,目的是除去泥沙,所以可通过①溶解,②过滤:注意“一贴二低三靠”,③蒸发,④重结晶等主要步骤;
(2)前三个步骤都用到玻璃棒,玻璃棒的作用是:溶解时,用玻璃棒搅拌加快溶解速度;过滤时用玻璃棒引流,将液体引入过滤器内;蒸发时用玻璃棒搅拌,避免液体局部过热造成液滴飞溅.
故答案为:
(1)①溶解 ②过滤 ③蒸发 ④重结晶;
(2)玻璃棒 ①搅拌,加快食盐溶解 ②引流,将液体引入过滤器内 ③搅拌,避免液体局部过热造成液滴飞溅.点评:
本题考点: 氯化钠与粗盐提纯;过滤的原理、方法及其应用;常用仪器的名称和选用.
考点点评: 在解此类题时,首先要分析各种操作步骤的作用,然后结合选项中的顺序进行分析解答.1年前查看全部
- 化学(混合物的分离和提纯)谢绝搀杂使假.(1)I2的CCl4溶液,如何得到固态I2?(2)两液态互溶物,沸点相差20度,
化学(混合物的分离和提纯)
谢绝搀杂使假.
(1)I2的CCl4溶液,如何得到固态I2?
(2)两液态互溶物,沸点相差20度,能否用蒸馏法分离?
(3)KNO3溶液中有少量NaCl如何得到KNO3晶体?
(4)NaCl溶液中混有少量KNO3如何得到NaCl晶体? ku891年前1
ku891年前1 -
 yuyang0804 共回答了26个问题
yuyang0804 共回答了26个问题 |采纳率80.8%1.萃取
2.能
3.降温结晶.(或降温热饱和溶液)
4.降温结晶后过滤,滤液蒸发结晶1年前查看全部
- 浓硫酸和乙醇 加热170摄氏度 反应后 怎样把生成物提纯 ? 求详细过程和步骤 !
 crazyman5211年前1
crazyman5211年前1 -
 yangcun 共回答了22个问题
yangcun 共回答了22个问题 |采纳率86.4%该反应生成水和不溶于水的乙烯 已经分离开了1年前查看全部
- (2010•乐山)实验小组的同学欲对一粗盐样品进行初步提纯.所用实验仪器或用品如下:
(2010•乐山)实验小组的同学欲对一粗盐样品进行初步提纯.所用实验仪器或用品如下:
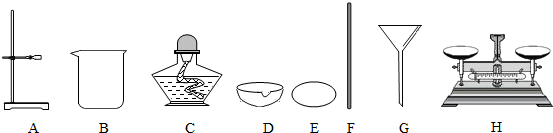
(1)A的名称是______;
(2)提纯的步骤是:溶解、过滤、______、计算产率;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是______;
(4)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:______. 泪娃子1年前1
泪娃子1年前1 -
 噩梦鬼魅 共回答了25个问题
噩梦鬼魅 共回答了25个问题 |采纳率84%解题思路:(1)根据题中所给的装置及常见的化学仪器进行分析,
(2)根据粗盐提纯的步骤进行解答,
(3)根据过滤时的操作要点进行分析解答,
(4)可以从导致精盐减少的原因进行分析解答,(1)A是用来支撑装置过滤、支撑蒸发皿进行加热的,故答案为:铁架台,
(2)在粗盐提纯的实验中需要将滤液蒸发水分后得到精盐,然后计算产率,故答案为:蒸发,
(3)两低主要是为了防止滤液漫过漏斗、漫过滤纸而起不到过滤的目的,故答案为:滤纸边缘低于漏斗边缘,滤液液面低于滤纸边缘,
(4)精盐的质量偏少,在过滤、蒸发操作时损失了液体的质量,故答案为:蒸发时,液滴飞溅;称量时操作或读数错误点评:
本题考点: 氯化钠与粗盐提纯;实验数据处理或者误差分析的探究;过滤的原理、方法及其应用;常用仪器的名称和选用.
考点点评: 本题主要对粗盐的提纯实验进行了全面的考查,以及对实验数据所产生的误差能够正确的分析.1年前查看全部
- 带双键的有机物如何分离提纯
 小萌791年前2
小萌791年前2 -
 不会呼吸 共回答了17个问题
不会呼吸 共回答了17个问题 |采纳率88.2%能不能举个具体的例子,带双键的有机物很多1年前查看全部
- 为什么限制酶是从原核生物中分离提纯出来的?这类酶在原核生物中的作用是什么?
 niuff190881年前1
niuff190881年前1 -
 wangxh1982 共回答了18个问题
wangxh1982 共回答了18个问题 |采纳率94.4%因为此酶在原核生物体内是为了切除外源DNA,以免对原核生物遗传表达造成影响1年前查看全部
- 粗盐提纯方程式及步骤就是出去其中可溶性的盐的步骤,分别要加什么,为什么加还有加的顺序及原因
 sunny_star881年前1
sunny_star881年前1 -
 我来下电影 共回答了13个问题
我来下电影 共回答了13个问题 |采纳率100%⑴、粗盐中含有较多的可溶性杂质(CaCl2、MgCl2等)和不溶性杂质(泥沙等).可通过什么方法来制取精盐?
除去可溶性杂质,一般是选择一种或几种化学试剂将这些可溶性杂质反应掉,同时不能生成新的杂质.除去不溶性杂质一般通过溶解、过滤、蒸发三个步骤来实现.
⑵、实验前所称量的粗盐不宜过多,否则会出现过剩的现象,影响提纯的质量.溶解时要注意及时搅拌,以使粗盐能够完全溶解到水中.
⑶、过滤时要注意“一贴、两低、三靠”.建议在过滤前先静置一会儿,过滤时先让上层滤液滤过,再将混有泥沙的溶液倒入漏斗中.如果一起倒入会造成滤纸的堵塞,减缓过滤的速度.
步骤:
加入BaCl2,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀BaSO4,除去杂质SO42-;
加入Na2CO3,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀CaCO3,除去杂质Ca2+;
加入NaOH,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀Mg(OH)2,Ba(OH)2;
最后加入HCl至溶液呈中性.1年前查看全部
- 5克粗硫酸铜提纯的产率是多少
 矿石会咬你1年前2
矿石会咬你1年前2 -
 deepblue1972 共回答了17个问题
deepblue1972 共回答了17个问题 |采纳率94.1%产率=提纯获得纯净物质量/样品质量
你的问题中条件不足,没有提纯后纯净硫酸铜的质量,所以没法直接计算的
希望对你有所帮助,亲!1年前查看全部
- 用分馏发提纯液体时,为什么分馏柱必须保持一定的回流比?
 原原野苹果1年前1
原原野苹果1年前1 -
 刘晓凤 共回答了11个问题
刘晓凤 共回答了11个问题 |采纳率81.8%简单的说,回流比就是分馏柱回流液滴下的速度与冷凝管下端产物滴下的速度之比.如果回流比过大,表明柱子保温能力差,分馏速度慢;过小,则说明柱高不够,产物和杂质没有彻底分开.所以必须保持一定的回流比.1年前查看全部
- (2014•苏州)有关粗盐提纯的实验操作合理的是( )
(2014•苏州)有关粗盐提纯的实验操作合理的是( )
A.溶解前用玻璃棒研磨大颗粒粗盐
B.过滤时液体的液面要低于滤纸边缘
C.加热蒸发时要不断搅拌直至水分全部蒸干
D.实验结束随即用手将蒸发皿从三脚架上取下 yuxuwen2011年前1
yuxuwen2011年前1 -
 0mfz 共回答了11个问题
0mfz 共回答了11个问题 |采纳率100%解题思路:A、根据玻璃棒不能研磨固体进行分析;
B、根据过滤时,漏斗中液体的液面应低于滤纸边缘进行分析;
C、根据蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体进行分析;
D、根据实验结束时,蒸发皿的温度较高进行分析.A、玻璃棒不能研磨大颗粒粗盐,容易使玻璃棒折断,应该用研杵,故A错误;
B、过滤时,漏斗中液体的液面应低于滤纸边缘,故B正确;
C、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体,故C错误;
D、实验结束时,蒸发皿的温度较高,会将手烫伤,故D错误.
故选:B.点评:
本题考点: 氯化钠与粗盐提纯;过滤的原理、方法及其应用;常用气体的发生装置和收集装置与选取方法.
考点点评: 本题主要考查了过滤操作中的注意事项,难度不大,依据课本知识即可完成.1年前查看全部
- 在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的钙离子镁离子硫酸根离子及泥沙.要不同的方法!
 羊咩咩05261年前1
羊咩咩05261年前1 -
 guan12 共回答了19个问题
guan12 共回答了19个问题 |采纳率94.7%先过滤除去泥沙,然后滴入氯化钡除去硫酸根离子,再加入氢氧化钠除去镁离子,最后通过碳酸钠出去钙离子.
既然要除去粗盐中的杂质,就不能引进其他的杂质,例如:氢氧化钾也可以除去镁离子,但除去后又要考虑除去钾离子.所以一般除去杂质不能引入其他杂质的.1年前查看全部
- 除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组( ) 选项 待提纯的物质 选用的试剂 操作的
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组( )
选项 待提纯的物质 选用的试剂 操作的方法 A CaO(CaCO3) 水 溶解、过滤、结晶 B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥 C CuSO4(H2SO4) 氢氧化钠溶液 过滤 D CO2(CO) 氧气 点燃
A.A
B.B
C.C
D.D 米罔学1年前1
米罔学1年前1 -
 风雪悠扬 共回答了16个问题
风雪悠扬 共回答了16个问题 |采纳率87.5%解题思路:除杂题目,一方面要考虑试剂的选择,另外一方面需要考虑该过程该如何实施,如同样一种试剂,加入的量是怎么样的,加入采取怎样的操作,都在一定程度上影响着实验的结果.A、CaO中混有碳酸钙,用水时,考虑的是溶解性或者与水的反应,由于碳酸钙不溶于水,但是CaO却能够与水反应,导致主要成分减少,而杂质却没有减少.错误.
B、Cu中混有CuO,使用盐酸,由于加入的盐酸和CuO能够反应,而和Cu不反应,且生成物中没有固体,所以可以采用这样的方法.在充分反应后过滤、洗涤、干燥后就能够得到纯净的Cu.CuO+2HCl=CuCl2+H2O.正确.
C、CuSO4中混有H2SO4,由于主要区别在于阳离子,所以需要将氢离子转化为铜离子,而加入氢氧化钠时,加入物质中的阳离子为钠离子,所以该试剂选用不合理.错误.
D、CO2中混有CO,采用氧气,由于使用燃烧法对氧气的浓度有要求,所以即使低浓度的CO能够被点燃甚至被消耗掉,也会导致氧气成为新的杂质.错误.
故选:B点评:
本题考点: 物质除杂或净化的探究;混合物的分离方法;二氧化碳的化学性质;一氧化碳的化学性质;酸的化学性质;碱的化学性质;酸碱盐的溶解性.
考点点评: 给定试剂和方法的除杂题,可以从给定试剂与主要成分和杂质之间的溶解和反应关系入手,如果是和主要成分反应或者溶解等,则该方法一般就是不合适的.1年前查看全部
- 粗盐提纯 为什么要在碳酸钠之前加入氯化钡
粗盐提纯 为什么要在碳酸钠之前加入氯化钡
如果先加入碳酸钠,CaCl2+Na2CO3=2NaCl+CaCO3 再加氯化钡,Na2SO4+BaCl2=BaSO4+2NaCl 这样碳酸钙和硫酸钡除去,过量的氯化钡和碳酸钠也可以互相反应除去啊,BaCl2+Na2CO3=BaCO3+2NaCl,生成碳酸钡沉淀
为什么说先加碳酸钠多余的钡离子就不能除去呢? niuchuyan1年前2
niuchuyan1年前2 -
 chuangchee 共回答了15个问题
chuangchee 共回答了15个问题 |采纳率86.7%先加碳酸钠,CaCl2+Na2CO3=2NaCl+CaCO3 保证除尽,应加过量
再加氯化钡,Na2SO4+BaCl2=BaSO4+2NaCl BaCl2+Na2CO3=2NaCl+BaCO3 (沉淀) 两个都是生成沉淀,不知道硫酸钠什么时候反应完.为保证除尽,也应加过量 .这就出现了多余的钡离子了.1年前查看全部
- 下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
A、分液B、过滤C、萃取D、蒸馏E、结晶F、加热分解
(1)除去Ca(OH)2 溶液中悬浮的 CaCO3______;
(2)从碘水中提取碘______;
(3)用自来水制取蒸馏水______;
(4)分离植物油和水______;
(5)除去 KNO3中所含的少量NaCl______;
(6)除去 KCl固体中少量 KClO3______. 人间极品1年前1
人间极品1年前1 -
 义和团的 共回答了14个问题
义和团的 共回答了14个问题 |采纳率78.6%解题思路:分离和提纯物质的方法很多,但是依据的原理各不相同,在完成此类题目时,要根据具体情况具体分析.
A.分液是分离互不相溶的两种液体的方法;
B.过滤是把不溶于液体的固体物质跟液体分离开来的一种方法;
C.萃取利用溶质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来;
D.蒸馏把互相溶解但沸点不同的两种液体的分离出来;
E.结晶是分离可溶性固体和水(或者两种可溶性且溶解度随温度变化差别大的固体)的一种方法;
F.加热分解除去混合物中加热可分解成气体的物质.(1)CaCO3难溶于水,Ca(OH)2和CaCO3属于固液混合物,应用过滤的方法分离,故答案为:B;
(2)碘易溶于有机溶剂,可加入苯或四氯化碳用萃取的方法分离,故答案为:C;
(3)自来水中含有一些难以挥发的无机盐类物质,可通过蒸馏的方法制取蒸馏水,故答案为:D;
(4)植物油和水互不相溶,可用分液的方法分离,故答案为:A;
(5)KNO3、NaCl的溶解度受温度影响不同,可用结晶的方法除杂,故答案为:E;
(6)在加热条件下,KClO3分解生成KCl,所以可用加热方法除去杂质,故答案为:F.点评:
本题考点: 物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查物质的分离、提纯的基本方法选择与应用,题目难度中等,注意根据混合物组分性质的差异性选择分离的方法,注意加入试剂的顺序和除杂原理.1年前查看全部
- 已知由海水制得的粗盐中含有的主要成分为氯化钠,还有不溶性泥沙,可溶性氯化钙,氯化镁以及硫酸盐,设计实验提纯氯化纳
 yqbtb8131年前1
yqbtb8131年前1 -
 苗玉 共回答了20个问题
苗玉 共回答了20个问题 |采纳率95%这到题目我读书的的时候化学书上有,建议你仔细看看一下书1年前查看全部
- 在粗硅提纯的第二步、需要还原四氯化硅、是否可以使用二氧化碳?为什么?
 westor_wang1年前1
westor_wang1年前1 -
 神奇猪猪 共回答了16个问题
神奇猪猪 共回答了16个问题 |采纳率87.5%高温、去氧环境下进行.利用氢气的还原性.高温无氧,粗硅与氯气反应,生成氯化硅,然后氯化硅高温下与氢气反应,得到纯硅和氯化氢 硅电池高能耗1年前查看全部
- 为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止...
为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止...
为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止加热?还有:醋酸和甲醇的化学式怎么写? 雨baby1年前1
雨baby1年前1 -
 千禧成狼d 共回答了20个问题
千禧成狼d 共回答了20个问题 |采纳率95%当彻底加热至滤液蒸干时,蒸发皿还是热的这样会容易破碎,如果加热至晶体出现时,再用蒸发皿的余热就可以是其中的水分蒸干.1年前查看全部
- 一直没弄懂:分离和提纯是同时进行的吗?像过滤,蒸发,蒸馏,萃取,分液这些方法到地属于分离还是提纯?(如果分离和提纯是同时
一直没弄懂:分离和提纯是同时进行的吗?像过滤,蒸发,蒸馏,萃取,分液这些方法到地属于分离还是提纯?(如果分离和提纯是同时进行的,那就既属于分离又属于提纯了?)
————————(我是弱弱的分割线)——————
我的问题有些弱,望大神们见谅,谢 小-黑1年前1
小-黑1年前1 -
 冰颖雪花 共回答了17个问题
冰颖雪花 共回答了17个问题 |采纳率82.4%这取决于你需要的是什么,只要其中一种 就叫提纯.两种物质都要 就叫分离了1年前查看全部
- 化学实验中分离和提纯的常用方法
 hejuan91年前1
hejuan91年前1 -
 sayadada 共回答了13个问题
sayadada 共回答了13个问题 |采纳率92.3%倾析:从液体中分离密度较大且不溶的固体 分离沙和水
过滤:从液体中分离不溶的固体 净化食用水
溶解和过滤:分离两种固体,一种能溶于某溶剂,另一种则不溶 分离盐和沙
离心分离法:从液体中分离不溶的固体 分离泥和水
结晶法:从溶液中分离已溶解的溶质 从海水中提取食盐
分液:分离两种不互溶的液体 分离油和水
萃取:加入适当溶剂把混合物中某成分溶解及分离 用庚烷
提取水溶液中的碘
蒸馏:从溶液中分离溶剂和非挥发性溶质 从海水中取得纯水
分馏:分离两种互溶而沸点差别较大的液体 从液态空气中分离氧和氮; 石油的精炼
升华:分离两种固体,其中只有一种可以升华 分离碘和沙
吸附:除去混合物中的气态或固态杂质 用活性炭除去黄糖中的有色杂质
色层分析法:分离溶液中的溶质 分离黑色墨水中不同颜色的物质1年前查看全部
- 请加粗盐提纯出去杂质(Mg,Ca,SO4)的方程式写一下.告诉我为什么要先加BaCL2 以下是自己的理解 请指错
请加粗盐提纯出去杂质(Mg,Ca,SO4)的方程式写一下.告诉我为什么要先加BaCL2 以下是自己的理解 请指错
带有so4的溶液+BaCL2生成BaSO4沉淀,剩有过量的BaCL2
带有Mg的溶液+NaOH生成Mg(OH)2沉淀,盛有过量的NaOH
带有Ca的溶液+NaCO3生成沉淀CaCO3,剩有过量的NaCO3
然后用HCL出去杂质我就不会了
请高手帮我下以下除杂的方程式 wangba21年前2
wangba21年前2 -
 凌乱不堪278 共回答了15个问题
凌乱不堪278 共回答了15个问题 |采纳率93.3%先加BaCl2是相对的,正确说法是BaCl2要加在Na2CO3前面,因为过量的Ba2+要用Na2CO3除去.
用HCl是为了出除去过量的NaOH和Na2CO3
除杂离子方程式:
SO4^2- + Ba2+ == BaSO4↓
Mg2+ + 2OH- == Mg(OH)2↓
Ca2+ + CO3^2- == CaCO3↓
Ba2+ + CO3^2- == BaCO3↓
过滤,加盐酸
H+ + OH- == H2O
2H+ + CO3^2- == H2O + CO2↑1年前查看全部
- 盐析怎么提纯蛋白质
 我将不再潜水1年前1
我将不再潜水1年前1 -
 神的gg1 共回答了18个问题
神的gg1 共回答了18个问题 |采纳率88.9%蛋白质在轻金属盐中的溶解度小于水中的溶解度,析出的蛋白质可以重新溶解,(不可以在浓酸、浓碱或重金属盐中进行),这样就像重结晶一样把一些没有这种性质的物质分离开了,这就是盐析的基本原理.1年前查看全部
- 下列物质的分离提纯主要是利用化学性质的是( )
下列物质的分离提纯主要是利用化学性质的是( )
A.沙里淘金
B.利用磁铁分离铁屑和沙混合物
C.利用自来水制备蒸馏水
D.粗盐提纯中除去粗盐含有的可溶性杂质 弯弯小豆1年前1
弯弯小豆1年前1 -
 我的梦理 共回答了15个问题
我的梦理 共回答了15个问题 |采纳率100%解题思路:通过化学变化表现出来的性质属于物质的化学性质,不需要通过化学变化表现出来的性质属于物质的物理性质.A.沙里淘金没有新物质生成,是物理性质,故A错误;
B.利用磁铁分离铁屑和沙混合物没有新物质生成,是物理性质,故B错误;
C.利用自来水制备蒸馏水没有新物质生成,是物理性质,故C错误;
D.粗盐提纯中除去粗盐含有的可溶性杂质需要加入试剂生成沉淀,属于化学性质,故D正确.
故选D.点评:
本题考点: 物质的分离、提纯和除杂.
考点点评: 本题考查化学变化,注意化学变化的实质是有新物质生成,解答本题时须从概念入手,分析各选项是否有生成新物质,即可解题,本题难度不大.1年前查看全部
- 下列有关电化学知识的叙述正确的是( ) A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极
下列有关电化学知识的叙述正确的是( )
A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极 C.电解池中,阳极本身一定不参加反应 D.电解池工作时,阳极上不一定析出物质  幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 wang_god 共回答了22个问题
wang_god 共回答了22个问题 |采纳率72.7%BD
原电池中,阴离子移向负极,阳离子移向正极;电解池中,如果阳极是活泼金属,那么阳极就参加反应;电解池工作时,阳极上可能有物质析出,如Cl - 放电生成Cl 2 ,也可能没有物质析出。1年前查看全部
- 油脂凭什么是混合物啊?经过高度精炼、提纯过的单甘油酯也必须是混合物吗?那世界上岂不没有纯净物了
油脂凭什么是混合物啊?经过高度精炼、提纯过的单甘油酯也必须是混合物吗?那世界上岂不没有纯净物了
是因为油脂是酯会水解吗?
我是问,高级脂肪酸的甘油酯能不能是纯净物?
Piece_by_piece这名咋那么眼熟?不是大伟吗? 任逍遥12411年前2
任逍遥12411年前2 -
 dlwwcaishy 共回答了11个问题
dlwwcaishy 共回答了11个问题 |采纳率90.9%高级脂肪酸的甘油酯可以是纯净物.如果用纯的大大过量的高级脂肪酸与甘油酯化,控制条件保证甘油的三个醇羟基全部酯化,再将酯提纯出来的话,所得基本就应该是纯净物了(某些副产物在高中忽略不计).一般使用的油脂没有分离提纯,所以才是混合物
悬赏分都没有,太不大方啦.1年前查看全部
- 硫酸提纯能不能用电解的方法?还有,我用220VAC直接通入全波整流桥(1N4007×4),导出,我用这个装置电解水,气泡
硫酸提纯能不能用电解的方法?
还有,我用220VAC直接通入全波整流桥(1N4007×4),导出,
我用这个装置电解水,气泡冒得很厉害(没加任何电解液) 萍儿WP1年前1
萍儿WP1年前1 -
 ikfo 共回答了30个问题
ikfo 共回答了30个问题 |采纳率86.7%硫酸提纯不能用电解的方法1年前查看全部
- 混合物的分离与提纯 过滤适用于什么和什么的分离
 goodzw1年前3
goodzw1年前3 -
 JYSY_123 共回答了18个问题
JYSY_123 共回答了18个问题 |采纳率94.4%过滤的适用范围:适于分离固体和液体混合物的分离1年前查看全部
- ★粗盐提纯★实验报告★名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯
★粗盐提纯★实验报告★
名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯净的NaCl吗 还有什么成分 如何除杂质”)
关键是 目的 现象 结论 jason99581年前2
jason99581年前2 -
 早z在wi 共回答了22个问题
早z在wi 共回答了22个问题 |采纳率95.5%一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如: 等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
五、实验总结
过滤操作中的问题探析
过滤是最常用的分离液体和固体的实验操作.现行的初中化学教材中仅粗浅地介绍了过滤的操作要点,而实际操作过程中,往往会遇到许多细节性的问题.笔者结合教学实际,就过滤操作中经常遇到的问题谈一下自已的解决办法,仅供参考.
(一)、怎样选择漏斗和滤纸?
漏斗的大小主要取决于要过滤的沉淀的量或析出固体的量,而不是看液体的体积.沉淀量或固体量较多,则所选用的漏斗就大,反之亦然.漏斗的圆锥角应为60°.管径粗细适宜,太粗难以保持水柱,太细则水流速度慢,过滤需要的时间过长.管径末端应稍微倾斜.滤纸的选择依据所做的实验来定.滤纸分定性滤纸和定量滤纸.定性滤纸在过滤操作中主要用于研究物质的物理性质和化学性质;定量滤纸主要用于物质的定量分析.在中学实验中,过滤操作常用于定性实验,所以大多用定性滤纸.选好的滤纸放入漏斗后,纸的边缘要比漏斗边缘低5毫米左右为宜.
(二)、怎样组装过滤器?
首先,将选好的滤纸对折两次,第二次对折要与第一次对折的折缝不完全重合.当这样的滤纸放入漏斗(顶角60°)中,其尖角与漏斗壁间有一定的间隙,但其上部却能完好贴在漏斗壁上.这样装成的过滤器比所有表面都贴在漏斗上的过滤器的过滤速度更快.对折时,不要把滤纸顶角的折缝压得过扁,以免削弱尖端的强度.然后剪去三层纸那边的两层的小角,以便在湿润后,滤纸的上部能紧密地贴在漏斗壁上.
其次,将叠好的滤纸放入合适的漏斗中,用洗瓶的水湿润滤纸,用手指把滤纸上部1/3处轻轻压紧在漏斗壁上.把水注入漏斗时,漏斗颈应充满水,或用手指堵住漏斗颈末端,使其充水至漏斗顶角稍上部为止.漏斗颈保持有连续的水柱,会产生向下的引力,加速了过滤过程.
(三)、怎样正确地进行过滤?
在过滤时,玻璃棒与盛有过滤液的烧杯嘴部相对着;玻璃棒末端和漏斗中滤纸的三层部分相接近,但不能触及滤纸;要保持垂直(笔者认为玻璃棒斜立易导致过滤液外溢);漏斗的颈部尖端紧靠接收滤液烧杯嘴部的内壁.每次转移的液体不可超过滤纸高度的三分之二,防止滤液不通过滤纸而由壁间流出.对于残留在烧杯里的液体和固体物质应该用溶剂或蒸馏水按少量多次的原则进行润冲,将洗液全部转移到漏斗中进行过滤.
(四)、怎样正确洗涤沉淀物?
如果需要洗涤沉淀物,则应立即进行洗涤,否则沉淀物在滤纸上放置过久会开裂或结块,不易润洗.可用原溶剂、蒸馏水或其它适当的洗涤剂进行润洗.换一个洁净的空烧杯以代替原来接受滤液的烧杯,这样可以避免因沉淀穿透滤纸而要重新过滤大体积的液体.每次洗液用量以能浸没所收集的沉淀物为宜.洗涤时,用少量洗液小心沿四周从上而下冲洗,将沉淀冲到漏斗底部,不可使液体流速过猛,否则会使沉淀冲出过滤器.也不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸,前功尽弃.一般洗2到3次左右,可基本洗净
(五)、怎样检验沉淀物是否洗净?
可根据沉淀物上可能检出的杂质类别,在最后一次洗出液中加入适宜的试剂,来检验洗涤程度.如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀物是否洗净,应选择AgNO3溶液.若在最后一次洗出液中加入AgNO3溶液无沉淀(AgCl)生成,则说明沉淀已洗净.
(六)、过滤时,滤液过多而超出滤纸边缘或滤纸被划破怎么办?
可用少量原溶剂冲洗漏斗和滤纸2到3次,原滤液连同洗液重新进行过滤.
(七)、分离沉淀和液体是否必需用过滤操作?
否.当分离的沉淀量很少时,可盛物于离心试管内,用离心机进行常温下沉淀分离.用吸管吸取沉淀上清液.根据需要可进行洗涤后再离心分离.只有当沉淀量较多时,才适宜用过滤法分离
(八)、过滤操作是否还有其他方式?
有.要使过滤速度快,且方便洗涤,可用布氏漏斗进行减压抽滤,这使得过滤和洗涤费时少,而且便于洗涤;当过滤需要在一定温度下进行时应选用保温漏斗进行过滤.1年前查看全部
大家在问
- 1在某种程度上英语怎么翻译
- 2用意大利语说他们是美国人可以直接用Sono吗?还是用Loro sono?
- 3The shop __________ near my house. [
- 4起点 内容:积极向上作文500字
- 5中国共产党在思想、政治、组织等领域的全面拨乱反正,是从这次会议开始的;伟大的社会主义改革开放,是由这次会议揭开序幕的;建
- 6在一个周长600米的池塘周围种树,每隔10米种一棵树,那么一共要种树多少棵
- 7求英语话剧剧本主题是:跨国婚姻,人物5或6个,内容简短些
- 8请你用n表示3个连续偶数为 (n为自然数),它们的和为,用m表示两个连续奇数为 (m为自然数),它们的和为
- 9下面是用二分法求方程x5-3x+1=0在(0,1)上的近似解(精确度为0.001)的部分程序框图.
- 10你认为最好的爸爸或妈妈应该是什么样的,根据你的想象设计全新的爸爸妈妈。你认为最好的爸爸妈妈应该具备哪此条件,想好后一条一
- 11首先,要保持良好的个人卫生(英语翻译)
- 12求解运动物体的速度(动量定理问题)
- 13有人对你说 I miss you so much 你该怎么回答用英文?
- 14修改下面的病句(1)列车奔驰在祖国大西南的崇山峻岭中走着.(2)济南的冬天是旅游最好的地方.
- 15(2010•沁水县模拟)在下面( )箱中摸球,摸到红球的可能性是[1/3].
