(12分) “物质结构与性质”(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其
 成熟是一种罪2022-10-04 11:39:541条回答
成熟是一种罪2022-10-04 11:39:541条回答| (12分) “物质结构与性质” (1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。 (2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 的原子或离子  (3)CuCl 2 溶液与乙二胺(H 2 N-CH 2 -CH 2 -NH 2 )可形成配离子:请回答下列问题: ① H、N、O三种元素的电负性由大到小的顺序是 。 ②SO 2 分子的空间构型为 。与SnCl 4 互为等电子体的一种离子的化学式为 。 ③乙二胺分子中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH 3 ) 3 ]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。  ④⑶中所形成的配离子中含有的化学键类型有 。 a.配位键 b.极性键 c.离子键 d.非极性键 ⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为 。 |

已提交,审核后显示!提交回复
共1条回复
 雨幕沉思 共回答了18个问题
雨幕沉思 共回答了18个问题 |采纳率100%- (12分)
⑴1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 (或[Ar]3d 10 4s 2 4p 1 )(1分)
正四面体(1分)原子晶体(1分)
⑵能够接受孤电子对的空轨道(1分)
⑶① O >N >H(1分)
②V形 (1分) SO 4 2- 、SiO 4 4- 等(1分)
③sp 3 杂化 (1分) 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(1分)
④abd (2分)
⑤4(1分)
略 - 1年前
相关推荐
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键B.极性键C.金属键D.配位键E.氢键F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.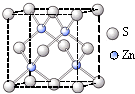
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol•L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______. 兜兜装伤心1年前1
兜兜装伤心1年前1 -
 美mmmm 共回答了14个问题
美mmmm 共回答了14个问题 |采纳率85.7%解题思路:A(1)①根据K3[Fe(CN)6的组成元素判断成键特点来判断含有的化学键类型;
②K3[Fe(CN)6中心离子为Fe3+离子,根据能量最低原理可写出电子排布式;
③根据CN-为双原子离子,含有14个电子,以此判断CN-的等电子体;
④用价电子对互斥理论可知二氧化硒分子中含有的价层电子对数和孤电子对数,以此判断分子的立体构型;
(2)①As与Se位于元素周期表中第四周期相邻主族,根据核外电子排布特点比较二者的第一电离能;
②硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键;
B(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管;IBr易发生水解反应;
(2)根据溴化氢易挥发以及使物质充分混合反应的做法来分析;
(3)根据淀粉的特性来选择试剂.A.(1)①K3[Fe(CN)6为离子化合物,应含有离子键,Fe和CN之间为配位键,C与N之间为极性键,
故答案为:CEF;
②Fe的电子排布式为[Ar]3d64S2,则Fe3+离子的电子排布式为:[Ar]3d5,故答案为:[Ar]3d5;
③CN-为双原子离子,含有14个电子,其等电子体有CO、N2,故答案为:CO、N2;
④二氧化硒分子中含有2δ键个,孤电子对数为
6−2×2
2=1,分子为V形,故答案为:V形;
(2)As的价电子排布为4s24p3,而Se的价电子排布为4s24p4,二者相比较,前者p轨道半充满,处于稳定状态,第一电离能较大,硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键,故配位数为4,故答案为:>;4;
B.(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管,不能用碱式滴定管盛装,IBr易发生水解反应,反应方程式为:IBr+H2O=HIO+HBr,故答案为:酸式滴定管(或移液管 );IBr+H2O=HIO+HBr;
(2)溴化氢易挥发,置于暗处可减少溴化氢挥发,为使反应充分进行,应不断搅动使物质充分接触而反应,
故答案为:碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应;
(3)碘遇淀粉变蓝色,可用淀粉为反应的指示剂,滴定时终点的判断为 溶液由蓝色恰好变为无色且30秒内不变化,
故答案为:淀粉溶液;溶液由蓝色恰好变为无色且30秒内不变化.点评:
本题考点: 配合物的成键情况;原子核外电子排布;元素电离能、电负性的含义及应用;化学键;“等电子原理”的应用;晶胞的计算;极性键和非极性键;中和滴定;探究物质的组成或测量物质的含量.
考点点评: 本题考查配合物知识和实验化学两部分知识,题目较为综合,具有一定难度,做题时注意等电子体以及配位数的判断.1年前查看全部
- (2013•南京二模)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题
 (2013•南京二模)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
(2013•南京二模)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.[物质结构]
[Cu(NH3)4]SO4•H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为______.
(2)元素N、O、S的第一电离能由大到小排列的顺序为______.
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______.
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为______.
(5)与S
互为等电子体的一种分子的化学式为______.O 2−4
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为______.
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下: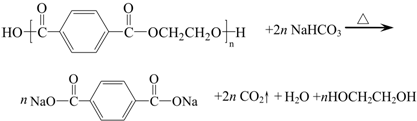
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是______.
(2)步骤2是为了分离出______.
(3)步骤3抽滤需要用到的主要仪器有______.
(4)步骤4加沸石的目的是______.
(5)步骤5用盐酸酸化的目的是______.
(6)步骤6用丙酮洗涤的目的是______. vhhimu1年前1
vhhimu1年前1 -
 zxg979713 共回答了17个问题
zxg979713 共回答了17个问题 |采纳率94.1%解题思路:A.(1)铜是29号元素,其原子核外有29个电子,根据构造原理写出其基态原子的电子排布式; (2)同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小;(3)相互形成氢键的物质能互溶;(4)根据含有的价层电子对判断其杂化类型;(5)原子个数、价电子数相等的微粒是等电子体;(6)利用均摊法确定其化学式;B(1)根据反应方程式中生成物确定实验现象;(2)减压蒸馏能分离出沸点较低的物质;(3)抽滤需要用到的主要仪器有布氏漏斗和吸滤瓶;(4)沸石有防止暴沸的作用;(5)对苯二甲酸钠和盐酸能反应;(6)利用丙酮作洗涤剂易于干燥.A.(1)铜是29号元素,其原子核外有29个电子,其基态原子的电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;(2)N、O元素处于第二周期,且N元素处于第VA族,O元素处于第VIA族,S元素处于第三周期第VIA族,所以这...
点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断;制备实验方案的设计.
考点点评: 本题考查物质结构和性质及制备实验方案的设计,注意物质结构和性质中第一电离能变化趋势及异常现象,为易错点.1年前查看全部
- (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的
(12分)本题包括a、b两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按a题评分。
a.黄血盐(亚铁***化钾,k 4 [fe(cn) 6 ] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg - 1 。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的***化钾。
回答下列问题:
(1)写出基态fe 2+ 的核外电子排布式 。k 4 [fe(cn) 6 ] 中fe 2+ 与cn - 两种离子之间的作用力是 。
(2)cn - 中碳原子的杂化方式为 ;1molcn - 中含有π键的数目为 。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为 。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与cn - 是等电子体的气态化合物,反应化学方程式为 。 dongnao4511年前1
dongnao4511年前1 -
 精伶兔 共回答了20个问题
精伶兔 共回答了20个问题 |采纳率95%(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 或[Ar]3d 6 (2分) 配位键(2分)
(2)sp杂化(2分) 2N A 个(2分)
(3)2:3(2分)
(4) K 4 Fe(CN) 6 + 6H 2 SO 4 + 6H 2 O 2K 2 SO 4 + FeSO 4 +3(NH 4 ) 2 SO 4
2K 2 SO 4 + FeSO 4 +3(NH 4 ) 2 SO 4
+6CO↑(2分)
(1)根据构造原理可写出其核外电子排布式。氮原子中含有孤电子对,铁中含有空轨道,所以通过配位键。
(2)CN - 是直线型结构,采取sp杂化。因为三键是由1个δ键和2个π键构成的。
(3)铜属于面心立方最密堆积结构,对应B图,则钾对应A图,属于体心立方堆积,其配位数分布为12和8,钾、铜两种晶体晶胞中金属原子的配位数之比为2:3。
(4)与CN - 是等电子体的气态化合物应该是氮气或CO,因为是非氧化还原反应,所以只能是CO。1年前查看全部
- 本题对应于“物质结构与性质”选修模块的内容。
本题对应于“物质结构与性质”选修模块的内容。
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。Z M L Q R D A T X Y E J
(1)Y分别与D、E形成的化合物中熔点较高是_________(用具体物质的化学式表示)。
(2)LX 2 分子的电子式是_________,MY 3 分子是_________(填“极性分子”或“非极性分子”)。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR) 4 ,其中J的化合价是0价。则基态J原子的核外电子排布式是__________________; J(LR) 4 固态时属于_________晶体(填晶体类型)
(4)A与M组成的一种化合物AM 2 ,刷新了金属化合物超导温度的最
高记录。右图中所示的是该化合物的晶体结构单元。图中上,下
底面中心“Δ”处的原子是_______(填元素符号)。
 半山鸟1年前1
半山鸟1年前1 -
 山水吉 共回答了13个问题
山水吉 共回答了13个问题 |采纳率92.3%(1) NaCl
(2) ____ 略 _ _ 非极性分子
(3) [Ar]3d 8 4s 2 __ 分子
(4) Mg
略1年前查看全部
- (2011•徐州模拟)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题
 (2011•徐州模拟)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
(2011•徐州模拟)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.氧元素与多种元素具有亲和力,所形成化合物的种类很多.
(1)氮、氧、氟元素的第一电离能从大到小的顺序为______.氧元素与氟元素能形成OF2分子,该分子的空间构型为______.
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是______;1mol O22+中含有的π键数目为______.
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等.Cr3+基态核外电子排布式为______.
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为______.
B.硫酸锌是一种重要的工业原料.在实验室从粗锌(含有少量的铅)与稀硫酸反应后的废液中提取硫酸锌的主要操作步骤如下:
步骤1:将废液过滤,调节滤液的pH约为2,过滤,将滤液加热浓缩,制得较高温度下的饱和溶液,冷却结晶得到粗制晶体.
步骤2:①在烧杯中用蒸馏水溶解步骤1得到的晶体,滴加少量稀硫酸,水浴加热至晶体全部溶解.②停止加热,让其自然冷却、结晶.③抽滤,用少量无水乙醇洗涤晶体l~2次,得精制晶体.
(1)废液中含有的不溶性杂质是______.
(2)步骤1中调节滤液pH约为2,可加入的物质是______.(填字母)
a.NH3•H2Ob.ZnOc.ZnCO3d.NaOH
(3)步骤1中对滤液加热浓缩时,当______时,停止加热.
(4)步骤2中滴加少量稀硫酸的目的是______.
(5)抽滤装置如图2所示,仪器B的名称是______.仪器C的作用是______.
(6)用少量无水乙醇洗涤晶体的目的是______. 动就有可能1年前1
动就有可能1年前1 -
 苍蝇小时候 共回答了20个问题
苍蝇小时候 共回答了20个问题 |采纳率85%解题思路:A.(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;根据价层电子对互斥理论确定该分子的空间构型;
(2)根据价层电子对互斥理论确定N原子轨道杂化类型;原子个数相等、价电子数相等的微粒为等电子体,等电子体结构相似,O22+和N2分子为等电子体,其结构和N2结构相似,根据氮气分子结构计算1mol O22+中含有的π键数目;
(3)Cr元素的原子序数是24号元素,其原子核外有24个电子,Cr3+核外电子数是21,根据构造原理书写其基态核外电子排布式;
(4)利用均摊法确定该物质的化学式;
B.(1)PbSO4是不溶性固体;
(2)除杂时要除去杂质且不引进新的杂质;
(3)溶液表面出现晶膜要停止加热;
(4)硫酸锌属于强酸弱碱盐,锌离子易水解;
(5)根据仪器名称书写仪器;缓冲装置能防止倒吸;
(6)乙醇和水互溶,且易挥发.A.(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以这三种元素第一电离能大小顺序是:F>N>O;
OF2分子中O原子价层电子对个数=2+[1/2(6−2×1)=4,且含有2个孤电子对,所以其空间构型为V形,
故答案为:F>N>O;V形;
(2)NO2+离子中氮原子价层电子对个数=2+
1
2](5-1-2×2)=2,所以为sp杂化;
O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有两个π键,则1mol O22+中含有的π键数目为2NA;
故答案为:sp;2NA;
(3)Cr元素的原子序数是24号元素,其原子核外有24个电子,Cr3+核外电子数是21,根据构造原理其核外电子排布式为1s22s22p63s23p63d3,故答案为:1s22s22p63s23p63d3;
(4)该晶胞中,钙离子个数=8×[1/8+6×
1
2]=4,过氧根离子个数=12×[1/4]+1=4,所以其化学式为:CaO2,故答案为:CaO2;
B.(1)锌和稀硫酸反应生成可溶性的硫酸锌,铅和硫酸反应生成难溶性的硫酸铅,所以废液中不溶性杂质为PbSO4,故答案为:PbSO4;
(2)氧化锌和碳酸锌与稀硫酸反应生成硫酸锌且不引进新的杂质,氨水和氢氧化钠溶液都能改变溶液pH,但引进杂质,故选bc;
(3)当溶液表面出现晶膜时停止加热,利用余热将水分蒸干即可,故答案为:溶液表面出现晶膜;
(4)硫酸锌为强酸弱碱盐,锌离子水解而使其溶液呈酸性,为防止硫酸锌水解,应该向溶液中加入少量稀硫酸,故答案为:防止硫酸锌水解;
(5)该仪器为吸滤瓶;C装置有缓冲作用,能防止倒吸,故答案为:吸滤瓶;防止倒吸;
(6)乙醇和水能互溶,且乙醇易挥发,挥发时带走水分,故答案为:利用乙醇挥发性除去晶体表面的水分.点评:
本题考点: 晶胞的计算;判断简单分子或离子的构型;原子轨道杂化方式及杂化类型判断;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质结构、性质和物质的分离和提纯,涉及电子式的书写、杂化轨道理论、空间构型的判断、晶胞的计算、化学与实验等知识点,根据价层电子对互斥理论、均摊法等知识点来分析物质结构和性质;化学与实验中,明确实验原理是解本题关键,根据物质的性质分析实验操作步骤,难度中等.1年前查看全部
- (12分)[选做题]本题包括A、B两小题,分别对应于 “物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题
(12分)[选做题]本题包括A、B两小题,分别对应于 “物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料。化学上常用KSCN溶液等来检验溶液中是否存在Fe 3+ 。
(1)Fe 3+ 离子基态的电子排布式可表示为 。
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是 。
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为 。
(填化学式)
(4)C、N、O三种元素的第一电离能由大到小的顺序为 。(填元素符号)
(5)离子化合物Fe 2 O 3 的熔点高于KC1的熔点的原因是 。
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示。晶体中距每个X原子周围距离最近的Q的原子的个数是 。
 aoshiqingyi1年前1
aoshiqingyi1年前1 -
 临心听声 共回答了18个问题
临心听声 共回答了18个问题 |采纳率100%A.(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 (2)2
(3)NH 3 >CH 4 (4)N>O>C
(5)Fe 2 O 3 的晶格能大于KCl的晶格能(6)2
(1)根据构造原理可知,Fe 3+ 离子基态的电子排布式可表示为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 。
(2)在体心立方堆积中,含有的铁原子个数是8×1/8+1=2。
(3)非金属性越强,相应氢化物的稳定性越强,N的非金属性强于C的,所以稳定性是NH 3 >CH 4 。
(4)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,所以第一电离能大于氧元素的,即N>O>C。
(5)由于Fe 2 O 3 的晶格能大于KCl的晶格能,所以离子化合物Fe 2 O 3 的熔点高于KC1的熔点。
(6)Q位于体心处,X位于面心处,所以晶体中距每个X原子周围距离最近的Q的原子的个数是2个。1年前查看全部
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
A.海底热液研究(图1)处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Ni2+的核外电子排布式是______.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是______.
(3)下列说法正确的是______.电离能/kJ•mol-1 I1 I2 铜 746 1958 锌 906 1733
A.电负性:N>O>S>C B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化D.CO、H2S、HCN都是极性分子
(4)“酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为______.
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是______.在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为______.
B.制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离.下面是某化学兴趣小组的活动记录:
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:NaNO3 KNO3 NaCl KCl 10℃ 80.5 20.9 35.7 31.0 100℃ 175 246 39.1 56.6
实验方案:
Ⅰ.溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
Ⅱ.蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图3所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ.冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤.得KNO3粗产品m2g.
Ⅳ.重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤.得KNO3纯品.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:
(1)操作Ⅱ中趁热过滤的目的是.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g.为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g.
(3)操作Ⅲ中采用减压过滤,其优点是______.该小组同学所用的装置如图4所示,试写出该装置中主要用到的玻璃仪器的名称:______.若实验过程中发现倒吸现象,应采取的措施是______. 相框1年前1
相框1年前1 -
 来无影方方 共回答了18个问题
来无影方方 共回答了18个问题 |采纳率88.9%解题思路:A(1)镍属于28号元素,二价镍离子是镍原子失去2个电子得到的,根据构造原理可以写出该离子的核外电子排布式,注意原子失去电子是从外向内失;
(2)根据其结构是否稳定判断;
(3)A、根据元素周期律判断元素的电负性,同一周期,原子序数越大,电负性越大;同一主族,原子序数越大,电负性越小.
B、等电子体含有相同的原子和价电子数.
C、根据分子的结构判断杂化方式.
D、根据共价化合物结构判断分子的类型.
(4)根据图片结合题意写出其化学式.
(5)离子晶体中晶格能越大其熔点越高,晶格能与电荷有关,电荷越大晶格能越大.;根据氯化钠的晶胞判断.
B(1)根据不同温度硝酸钾的溶解度不同分析,温度较低时,硝酸钾因溶解度变小而析出.
(2)先根据氯化钾和硝酸钠的质量计算其物质的量,把氯化钾和硝酸钠的混合溶液看成氯化钠和硝酸钾的混合溶液;根据100℃时,氯化钠和硝酸钾的溶解度判断是否析出氯化钠和硝酸钾及析出的固体质量;再根据10℃时氯化钠和硝酸钾的溶解度判断是否有固体析出及析出的固体质量.
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;根据图片判断所用仪器;若实验过程中发现倒吸现象,应采取的措施是打开旋塞K.(1)镍属于28号元素,镍原子核外有28个电子,二价镍离子是镍原子失去2个电子得到的,根据构造原理可以写出该离子的核外电子排布式,Ni2+的核外电子排布式是1s22s22p63s23p63d 8.
故答案为:1s22s22p63s23p63d8或[Ar]3d8.
(2)Cu失去一个电子成为Cu+,核外电子排布从[Ar]3d104s1变为[Ar]3d10能量较低的稳定结构,而Zn核外电子排布为[Ar]3d104s2较稳定,所以Cu第一电离能较Zn小,第二电离能相对较大.
故答案为:Cu失去一个电子成为Cu+,核外电子排布从[Ar]3d104s1变为[Ar]3d10能量较低的稳定结构,而Zn核外电子排布为[Ar]3d104s2较稳定,所以Cu第一电离能较Zn小,第二电离能相对较大.
(3)A、同一周期,原子序数越大,电负性越大;同一主族,原子序数越大,电负性越小,所以电负性大小为
O>N>S>C,故A错误.
B、CO2与COS(硫化羰)中原子个数相等,氧和硫的价电子数相等都是6,所以互为等电子体,故B正确.
C、NH3分子中氮原子采用sp3杂化,构型是三角锥形,故C正确.
D、CO、H2S、HCN都不是对称型结构,所以都是极性分子,故D正确.
故选:BCD.
(4)根据图片知,该离子中含有11个氢原子,5个氧原子,且是带一个单位正电荷的离子,所以该离子为H11O5+.
故答案为:H11O5+.
(5)FeS所带的电荷比氯化钠的多,所以FeS晶体的晶格能比NaCl晶体晶格能大,所以FeS晶体的熔点比NaCl晶体的大;根据氯化钠的判断知其为正八面体.
故答案为:FeS晶体的晶格能比NaCl晶体晶格能大;正八面体.
B、(1)温度较低时,硝酸钾因溶解度变小而析出,为防止降温时析出硝酸钾而降低产率,所以要趁热过滤.
故答案为:防止降温时析出硝酸钾而降低产率.
(2)①29.8g KCl的物质的量=[29.8g/74.5g/mol=0.4mol;34.0g NaNO3的物质的量=
34.0g
85g/mol=0.4mol
氯化钾和硝酸钠不反应,所以氯化钾和硝酸钠的混合溶液可看作是氯化钠和硝酸钾的混合溶液,硝酸钾和氯化钠的物质的量还是0.4mol,硝酸钾的质量为40.4g,氯化钠的质量为23.4g.
100℃时,20g水中溶有氯化钠的质量为39.1g×
1
5]=7.82g<23.4g,所以析出氯化钠的质量=23.4g-7.82g=15.58g;
20g水中溶有硝酸钾的质量为246g×[1/5]=49.2g>40.4g,所以硝酸钾形成的是不饱和溶液,溶液析出的固体全部是氯化钠,即m1g=15.58g.
②10℃时,20g水中溶有氯化钠的质量为35.7g×[1/5]=7.14g,所以析出氯化钠的质量为7.82g-7.14g=0.68g;
20g水中溶有硝酸钾的质量为20.9g×[1/5]=4.18g<40.4g,所以析出硝酸钾的质量为40.4g-4.18g=36.22g;
所以析出固体的总质量为0.68g+36.22g=36.9g.
10℃时,设0.68g氯化钠溶于水得到饱和溶液所需要水的质量为x.
[0.68/x=
35.7
100]
x=1.9g.
故答案为:36.9,0.68,1.90.
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;
根据图片知,所用玻璃仪器为吸滤瓶、安全瓶、抽气泵;若实验过程中发现倒吸现象,应采取的措施是打开旋塞K.
故答案为:加快过滤速度,并能得到较干燥的沉淀;吸滤瓶、安全瓶、抽气泵;打开旋塞K.点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;晶胞的计算;蒸发和结晶、重结晶;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了原子核外电子排布、电负性、晶格能、物质的分离和提纯等知识点,综合性较强,难度较大,做题时注意电子排布式的书写方法,注意由原子失去电子生成离子时核外电子的失去先后顺序为:由外向内失去电子,不是根据能量失去电子.1年前查看全部
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.(1)K 3 [Fe(CN) 6 ]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键B.极性键C.金属键D.配位键E.氢键F.非极性键
②中心离子的基态电子排布式______.
③配位体CN - 的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.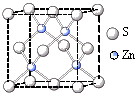
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol•L -1 硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
②IBr+KI=I 2 +KBr
③I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______. wgq1161年前1
wgq1161年前1 -
 asa314 共回答了15个问题
asa314 共回答了15个问题 |采纳率93.3%A.(1)①K 3 [Fe(CN) 6 为离子化合物,应含有离子键,Fe和CN之间为配位键,C与N之间为极性键,
故答案为:CEF;
②Fe的电子排布式为[Ar]3d 6 4S 2 ,则Fe 3+ 离子的电子排布式为:[Ar]3d 5 ,故答案为:[Ar]3d 5 ;
③CN - 为双原子离子,含有14个电子,其等电子体有CO、N 2 ,故答案为:CO、N 2 ;
④二氧化硒分子中含有2δ键个,孤电子对数为
6-2×2
2 =1 ,分子为V形,故答案为:V形;
(2)As的价电子排布为4s 2 4p 3 ,而Se的价电子排布为4s 2 4p 4 ,二者相比较,前者p轨道半充满,处于稳定状态,第一电离能较大,硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键,故配位数为4,故答案为:>;4;
B.(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管,不能用碱式滴定管盛装,IBr易发生水解反应,反应方程式为:IBr+H 2 O=HIO+HBr,故答案为:酸式滴定管(或移液管 );IBr+H 2 O=HIO+HBr;
(2)溴化氢易挥发,置于暗处可减少溴化氢挥发,为使反应充分进行,应不断搅动使物质充分接触而反应,
故答案为:碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应;
(3)碘遇淀粉变蓝色,可用淀粉为反应的指示剂,滴定时终点的判断为 溶液由蓝色恰好变为无色且30秒内不变化,
故答案为:淀粉溶液;溶液由蓝色恰好变为无色且30秒内不变化.1年前查看全部
- 下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。

A.(12分)【物质结构与性质】
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
⑴科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体晶格能数据如下表:
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ▲ 。晶体 NaCl KCl CaO 晶格能/(kJ·mol -1 ) 786 715 3 401
⑵科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
①写出基态Cu原子的核外电子排布式 ▲ ;金属铜采用下列 ▲ (填字母代号)堆积方式。
A B C D
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) ▲ 。
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 ▲ 。
④SO 4 2 - 的空间构型是 ▲ 。
B.(12分)【实验化学】
硫酸亚铁铵的化学式为(NH 4 ) 2 SO 4 ·FeSO 4 ·6H 2 O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na 2 CO 3 溶液,加热,过滤、洗涤、干燥、称量,质量记为 m 1 。
步骤二:FeSO 4 的制备。将上述铁屑加入到一定量的稀H 2 SO 4 中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为 m 2 。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH 4 ) 2 SO 4 加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
⑴步骤三中称取的(NH 4 ) 2 SO 4 质量为 ▲ 。
⑵①铁屑用Na 2 CO 3 溶液处理的目的是 ▲ 。制备FeSO 4 溶液时,用右图装置趁热过滤,原因是 ▲ 。
②将(NH 4 ) 2 SO 4 与FeSO 4 混合后加热、浓缩,停止加热的时机是 ▲ 。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe 3 + 标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀HCl溶液外,还应注意的问题是 ▲ 。
④该实验最终通过 ▲ 确定硫酸亚铁铵产品等级。 a124501年前1
a124501年前1 -
 152493496 共回答了15个问题
152493496 共回答了15个问题 |采纳率100%A.⑴MgO>CaO>NaCl>KCl
⑵①1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 或[Ar] 3d 10 4s 1 C
②
③水的熔、沸点较高,结冰时密度减小
④正四面体
 A.本题涉及新增知识点“晶格能、核外电子排布、配位键、空间构型”。(1)中晶格能大小决定于微粒半径与电荷,而晶格能大小又直接影响熔点,Mg 2+ 半径小于Ca 2+ ,MgO晶格能大,故熔点高。
A.本题涉及新增知识点“晶格能、核外电子排布、配位键、空间构型”。(1)中晶格能大小决定于微粒半径与电荷,而晶格能大小又直接影响熔点,Mg 2+ 半径小于Ca 2+ ,MgO晶格能大,故熔点高。
(2)金属铜的堆积方式为C,需要记忆;Cu 2+ 配位数为4,所以为 ;氢键影响分子晶体的物理
性质比如熔沸点、密度等;SO 4 2 - 中心原子S的杂化方式为SP 3 ,有两个配位键,故为正四面体,类似可以思考PO 4 3 — 、CO 3 2 — 的结构,也可以从价电子对互斥考虑。1年前查看全部
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.《物质结构与性质》:原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36.已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
(1)X、Y、Z的电负性从大到小的顺序为______(用元素符号表示),元素Y的第一电离能大于Z的原因是______.电离能/kJ•mol-1 I1 I2 I3 I4 X 496 4562 6912 9543 Y 738 1451 7733 10540 Z 578 1817 2745 11578
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示.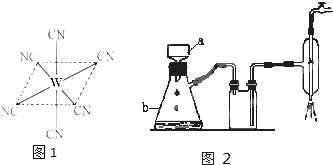
①W元素基态原子价电子排布式为______.
②已知CN-与______分子互为等电子体,1molCN-中π键数目为______.
③上述沉淀溶解过程的化学方程式为______.
B.《化学实验》:无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂,工业上作防腐剂、制造白色颜料(锌钡白)等.某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50mL制氢废液,过滤.除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体.
①加入少量氧化锌调节滤液使pH≈2目的是______;
②加热蒸发、浓缩溶液时,应加热到______时,停止加热.
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解.停止加热,让其自然冷却、结晶.抽滤(装置如图2所示).将所得晶体用少量无水乙醇洗涤1-2次,得到较纯的硫酸锌晶体.
①写出下列仪器的名称.a______;b______.
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是______.
③用少量无水乙醇洗涤晶体的目的是______.
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量______(填“有”、“无”)影响,原因是______. sadgsdwqe1年前1
sadgsdwqe1年前1 -
 虹膜识别 共回答了18个问题
虹膜识别 共回答了18个问题 |采纳率94.4%解题思路:A、原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36,X、Y和Z为第三周期元素,由表中元素的电离能可知,X元素的第二电离能剧增,故X表现为+1价,故X为钠元素;Y的第三电离能剧增,Y为+2价,故Y为镁元素;Z的第四电离能剧增,表现+3价,故Y为铝元素.
(1)同周期自左而右,电负性增大,元素的第一电离能呈增大趋势,但能级处于半满、全满时,能量较低,元素的第一电离能高于同周期相邻元素.
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输,可知W为Fe元素.
①Fe是26号元素,根据核外电子排布规律书写基态原子价电子排布式.
②原子总数相同,价层电子数相同的为等电子体.CN-中存在C≡N三键,三键中有1个σ键,2个π键,.
③由结构图可知Fe(CN)2与KCN反应生成K4[Fe(CN)6].
B、(1)①制氢气的废液中含有硫酸,应除去.
②加热至溶液表面出现晶膜时,停止加热,利用余热蒸干.
(2)①a是布氏漏斗,b是吸滤瓶.
②抽滤跟普通过滤相比,得到沉淀较干燥,过滤速度快.
③晶体表面附着水分.
(3)铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁,过滤除去.A、原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36,X、Y和Z为第三周期元素,由表中元素的电离能可知,X元素的第二电离能剧增,故X表现为+1价,故X为钠元素;Y的第三电离能剧增,Y为+2价,故Y为镁元素;Z的第四电离能剧增,表现+3价,故Y为铝元素.
(1)同周期自左而右,电负性增大,所以电负性从大到小的顺序为Al>Mg>Na;同周期自左而右,元素的第一电离能呈增大趋势,但Y的最外层电子排布处于全满稳定状态,能量降低,Y元素的第一电离能高于Z元素.
故答案为:Al>Mg>Na;Y的最外层电子排布处于全满稳定状态,能量降低.
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输,可知W为Fe元素.
①Fe是26号元素,基态原子价电子排布式为3d64s2.
故答案为:3d64s2.
②将C原子及1个电子用“N”代换可得CN-等电子体分子N2;CN-中存在C≡N三键,三键中有1个σ键,2个π键,所以1molCN-中π键数目为2NA.
故答案为:N2;2NA.
③由结构图可知Fe(CN)2与KCN反应生成K4[Fe(CN)6],反应方程式为Fe(CN)2+4KCN=K4[Fe(CN)6].
故答案为:Fe(CN)2+4KCN=K4[Fe(CN)6].
B、(1)①制氢气的废液中含有硫酸,加入少量氧化锌,将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质.
故答案为:将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质.
②加热至溶液表面出现晶膜时,停止加热,利用余热蒸干.
故答案为:溶液表面出现晶膜.
(2)①a是布氏漏斗,b是吸滤瓶.
故答案为:布氏漏斗;吸滤瓶.
②抽滤跟普通过滤相比,不仅得到沉淀较干燥,而且过滤速度快.
故答案为:过滤速度快.
③晶体表面附着水分,硫酸锌不溶于酒精,利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失.
故答案为:利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失.
(3)铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁,过滤除去,锌粒中混有少量的铁、铜杂质,对硫酸锌的质量无影响.
故答案为:无;铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁过滤除去.点评:
本题考点: 原子结构与元素周期律的关系;制备实验方案的设计.
考点点评: 题目综合性较大,包含物质结构与化学实验,涉及电离能、电负性、核外电子排布规律、化学键与配合物、对实验利用的理解、实验条件控制、物质分离提纯等,难度较大,需要学生具备良好的心理素质、扎实的基础知识和运用知识理解问题的能力.1年前查看全部
- “物质结构与性质”模块(10分)
“物质结构与性质”模块(10分)
请回答下列问题:
(1)N、AI、Si、Zn四种元素中,有一种元素的电离能数据如下:
(2)则该元素是__ ① ___(填写元素符号)。Zn原子的电子排布式是__ ② __。Ce的最高价氯化物分子式是_ __ ③ ___。该元素可能的性质或应用有__ ④ ___。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个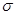 键和1个
键和1个 键
键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 ⑥ 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦  swane1年前1
swane1年前1 -
 wkx1204 共回答了12个问题
wkx1204 共回答了12个问题 |采纳率91.7%①AI
②
③
④C、D
⑤B、D
⑥>
⑦两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
(1)该元素在第四电离能发生突变,该元素为正三价,为铝元素;根据能量最低原理和核外电子排布规律不难写出电子排布式;Ge和C为同族元素,Ge最高价为+4价,氯化物分子式为GeCl 4 。Ge位于金属和非金属分界线附近,既具有金属性,也具有一定的非金属性,可作为半导体材料;Ge不是一种活泼的金属;Ge为金属,电负性要小于硫;Ge的氯化物和溴化物均为分子晶体,相对分子质量越大,分子间作用力越大,Ge的溴化物沸点更高。
分子中含有碳碳非极性共价键,也含有碳氢极性共价键,B项正确;分子中含有4个 C-H 和3个
C-H 和3个 C-C 和2个
C-C 和2个 C-O ,3个π键,1个π C=C 和2个π C=O ;该分子中含有两个醛基,溶解度要大于2-丁烯。
C-O ,3个π键,1个π C=C 和2个π C=O ;该分子中含有两个醛基,溶解度要大于2-丁烯。
(4)两者均为离子化合物,晶格能越大,熔点越高;两者阴阳离子电荷数均为1,但后者的离子半径较大,晶格能小,因此其熔点较低。
【考点定位】本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、化学键类型等知识,具有一定的难度。1年前查看全部
- 化学选修3难还是选修5难选修三 《物质结构与性质)选修五 (有机化学基础》
 西园蝴蝶黄1年前5
西园蝴蝶黄1年前5 -
 进来打哈望也 共回答了24个问题
进来打哈望也 共回答了24个问题 |采纳率95.8%客观来讲,选修五好理解,也挺有趣!
因为它从结构解释化学,有本质的“突破”~不过选三有数据的解析,更为直接、浅显,只是算起来偶尔麻烦~1年前查看全部
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.叠氮化钠(NaN3)是一种无色结晶,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O=NaN3+NaOH+NH33NaNH2+NaNO3=NaN3+3NaOH+NH3↑
(1)下列说法正确的是______.
A.N
与N2O互为等电子体−3
B.NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
D.第一电离能 N比O大
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因:______.
(3)依据价层电子对互斥理论,NO3-空间构型呈______形.
(4)一种叠氮桥基化合物,合成方法如下:
醋酸铜中,Cu2+在基态时核外电子排布式为:______.配合物C中,氮原子杂化方式有:______.
(5)汽车安全气囊是基于反应6NaN3+Fe2O3
3Na2O+2Fe+9N2↑,铁的晶体有三种堆积方式,其中两种的堆积方式如下:撞击 .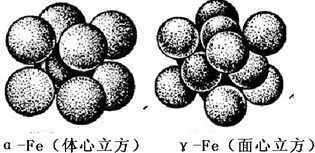
下列说法正确的是______.
A.空间利用率α-Fe大于γ-Fe
B.α-Fe、γ-Fe的堆积方式分别与铜和镁相同
C.金属铁的导电性是由于通电时自由电子作定向移动
D.α-Fe延展时,可以转变为γ-Fe
B.以苯酚为原料合成对羟基苯乙酮的原理如下:
(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:______.
②乙酸酐过量的目的是:______.
③有机相先用试剂X洗涤,X可能是______.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是______.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如下表
适宜的温度是______;反应时间是______.反应温度/℃ 反应时间(min) 收率 30~35 180 10.0 20~25 60 18.0 20~25 120 26.0 20~25 180 58.5  chriscyf1年前1
chriscyf1年前1 -
 shentijiankang 共回答了17个问题
shentijiankang 共回答了17个问题 |采纳率88.2%解题思路:A(1)A.原子数相同,电子数目相同的微粒为等电子体;
B.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,共价化合物中只含共价键;
C.离子晶体中阴阳离子电荷越多,半径越小,熔点越高;
D.根据同周期元素的第一电离能结构2p轨道的稳定状态判断.
(2)氢键使物质的熔沸点升高;
(3)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
(4)铜的原子序数是29;
(5)A.面心立方空间利用率大于体心立方;
B.镁型为体心立方;
C.金属靠自由电子导电;
D.面心比体心排列紧密.
B(1)①该反应是放热反应;
②提高一种反应物的量能提高提高另一种的转化率;
③Na2CO3能除掉苯酚和乙酸酐;
(2)①硝基苯是极性溶剂;
②根据表格确定时间和温度.A(1)A.N
−3与N2O原子数相同,电子数目相同,互为等电子体,故A正确;
B.NaN3、NaNH2、NaOH、NaNO3含有离子键,均为离子化合物,故B正确;
C.阴阳离子电荷越多,半径越小,熔点越高,与相对分子质量无关,故C错误;
D.同周期元素从左到右元素的第一电离能逐渐增大,由于N2p轨道为半饱和状态,较为定,难以失去电子,则N、O三种元素第一电离能从大到小的顺序是N>O,故D正确.
故答案为:ABD;
(2)氨气中存在氢键,氢键使物质的熔沸点升高,故答案为:前者分子间以较强氢键结合,后者以微弱的分子间作用力结合;
(3)NO3-中价层电子对个数=σ键个数+孤电子对个数=3+[1/2](6-3×2)=3,所以其空间构型为平面正三角形,故答案为:平面正三角;
(4)铜的原子序数是29,Cu2+在基态时核外电子排布式为1s22s22p63s23p63d9,N原子形成2个、3个、4个δ键且无孤对电子,为sp、sp2、sp3杂化,杂化方式有:sp、sp2、sp3,故答案为:1s22s22p63s23p63d9或[Ar]3d9;sp、sp2、sp3;
(5)A.面心立方空间利用率大于体心立方,α-Fe小于γ-Fe,故A错误;
B.镁型为体心立方,铜型为面心立方,故B错误;
C.金属靠自由电子定向移动导电,故C正确;
D.面心比体心排列紧密,α-Fe压缩可以转变为γ-Fe,故D错误.
故答案为:C;
B.(1)①碎冰温度低有利于酯的生成,故答案为:该反应是放热反应,碎冰温度低有利于酯的生成;
②提高乙酸酐的量能提高苯酚的转化率,故答案为:提高苯酚的转化率;
③Na2CO3能除掉苯酚和乙酸酐,降低酯的溶解度,故答案为:Na2CO3或NaHCO3溶液;
(2)①硝基苯是极性溶剂,可溶解乙酰苯酚,故答案为:作(极性)溶剂;
②根据表格确定时间和温度,20~25;180min时收率最高,故答案为:20~25;180min.点评:
本题考点: 判断简单分子或离子的构型;元素电离能、电负性的含义及应用;“等电子原理”的应用;金属晶体的基本堆积模型;有机物的合成.
考点点评: 本题考查内容较多,是一道综合题,涉及晶体类型、结构、杂化轨道、电子排布式除杂等,题目难度中等,注意面心立方空间利用率大于体心立方.1年前查看全部
- [化学选修—物质结构与性质](15分)
[化学选修—物质结构与性质](15分)
已知A、B、C、D和E 5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是___________________________;
(2)B和C的分子式分别是__________和__________;C分子的立体结构呈_______形,该分子属于__________分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式是______________________________________________。
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO 2 和2 mol H 2 O,则E的分子式是_____________。 mr_gary1年前0
mr_gary1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1客货车从甲乙两地中间背向行驶3小时后客车到达甲货车离乙还有50千米已知客货车速度比是5:7,甲乙有几千米
- 2一道超简单的初二物理题在“伏安法”测小灯泡电阻的实验中,若缺少电流表,其他器材齐全,且多了一个定值电阻(已知阻值)和一个
- 3小马虎在做两位数乘两位数的计算时,把第二个因数22的个位上的2看作5,结果比正确的积多69,正确的结果应该
- 4简单的描写人物长相的英文形容词有哪些
- 5甲乙两人分别从相距40千米的AB两地同时相向而行
- 6根据下图回答问题;生物圈的范围包括:海平面以上______千米和海平面以下______千米的这样的一个区域.分为三个部分
- 7细胞膜上的糖蛋白的功能体现了细胞膜的什么功能?
- 8I’ve work with children before, so I know what ___ in my job
- 9各位学霸 问一下用猪八戒的语气说取经路上的一件事 咋写捏???
- 10I don’t think fifteen-year-old should be allowed to drive 改为
- 11英语翻译致我即将逝去的青春,青春中又属于我的各种风景.那些风景中都会有个身影,我的青春有个你的存在,
- 12修改错别字 纤陌纵横
- 135、一辆儿童自行车,前轮直径是0.4米,后轮直径是0.5米.如果后轮转动20圈,前轮要转动多少圈?
- 14在如图所示的电路中,电源电压和小灯泡的阻值均保持不变,灯泡R1标有“12V 9W”.将S1、S2和S3都闭合时
- 15There are twelve months a year.(变成疑问句) —— ——twelve months in
