摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充
 全海涛2022-10-04 11:39:541条回答
全海涛2022-10-04 11:39:541条回答| 摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH 3 OH+3O 2 +4OH -  2CO 3 2 - +6H 2 O,则下列说法不正确的是 ( ) 2CO 3 2 - +6H 2 O,则下列说法不正确的是 ( )
|

已提交,审核后显示!提交回复
共1条回复
 lvdefahong 共回答了17个问题
lvdefahong 共回答了17个问题 |采纳率88.2%- C
- 1年前
相关推荐
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH 3 OH+3O 2 +4OH -
 2CO 3 2- +6H 2 O,则下列有关说法不正确的是
2CO 3 2- +6H 2 O,则下列有关说法不正确的是A.放电时化学能转变为电能 B.放电时CH 3 OH参与正极反应 C.充电时阴极产生CH 3 OH D.充电时每生成1mol CH 3 OH,则转移6mol电子  EllieLandau1年前1
EllieLandau1年前1 -
 shark233 共回答了17个问题
shark233 共回答了17个问题 |采纳率94.1%B
1年前查看全部
- 摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:
摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O 其中X的化学式为( )
A. O2
B. CO
C. CO2
D. H2 路见不平20041年前1
路见不平20041年前1 -
 lkdsjflkjsadlfjl 共回答了16个问题
lkdsjflkjsadlfjl 共回答了16个问题 |采纳率81.3%解题思路:根据化学变化前后原子的种类、数目不变,由反应的化学方程式2CH3OH+3X+4NaOH═2Na2CO3+6H2O,推断反应中反应物X的化学式.由电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O,据此可知,
反应前的原子个数:碳原子2个,氢原子12个,氧原子6个,钠原子4个;
反应后的原子个数:碳原子2个,氢原子12个,氧原子12个,钠原子4个;
根据质量守恒定律可知,3X中含有6个氧原子,故X的化学式为O2.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想处理问题;掌握有关化学式的计算和推断的方法;同时也考查了学生的分析和应变能力.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH+3O 2 +4OH -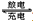 2CO 3 2- +6H 2 O,则下列说法错误的是 [ ]
2CO 3 2- +6H 2 O,则下列说法错误的是 [ ]A.放电时CH 3 OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O
D.充电时每生成1molCH 3 OH转移6mol电子 sdong0361年前1
sdong0361年前1 -
 lingbingnvhai126 共回答了17个问题
lingbingnvhai126 共回答了17个问题 |采纳率100%A1年前查看全部
- 报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH + 3O 2 + 4OH — 2CO 3 2— + 6H 2 O,则下列说法错误的是 ( )
2CO 3 2— + 6H 2 O,则下列说法错误的是 ( )A.放电时CH 3 OH参与反应的电极为正极 B.充电时电解质溶液的pH逐渐增大 C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - = CO 3 2— + 6H 2 O D.充电时每生成1 mol CH 3 OH转移6 mol电子  w1984p1年前1
w1984p1年前1 -
 yyll2222 共回答了16个问题
yyll2222 共回答了16个问题 |采纳率100%A
1年前查看全部
- 高一化学题(有关电池)13.据报道,最近摩托罗拉公司研制了一种有由甲醇和氧气以及强碱作电解质的新型手机电池,电量可达到现
高一化学题(有关电池)
13.据报道,最近摩托罗拉公司研制了一种有由甲醇和氧气以及强碱作电解质的新型手机电池,电量可达到现用镍氢电池的10倍,有关此电池的叙述错误的是( )
A.溶液中的阳离子移向正极
B.负极反应式:CH3OH + 8OH- - 6e-= CO32-- + 6H2O
C.电池在使用过程中,电解质溶液的c(OH-)不变
D.当外电路通过6 mol电子时,理论上消耗1.5 mol O2 bozima1年前3
bozima1年前3 -
 loner_math 共回答了21个问题
loner_math 共回答了21个问题 |采纳率85.7%C
负极:CH3OH + 8OH- - 6e-= CO32-- + 6H2O
正极:O2+4e+2H2O==4OH-
总反应 2CH3OH + 4OH- +3O2 = 2CO32-- + 6H2O
易知 A正确(原电池中 阴离子靠近负极,阳离子向正极)
B 正确
C 错误 由总反应式,c(OH-)减小
D 由正极反应 正确1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,其电池反应为:
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,其电池反应为:
2CH3OH+3O2+4OH- 2CO32-+6H2O,下列说法错误的是( )
2CO32-+6H2O,下列说法错误的是( )
A.放电时CH3OH参与反应的电极为负极
B.充电时每生成1molCH3OH转移12mol电子
C.放电时负极的电极反应为:CH3OH+8OH--CO32-+6H2O+6e--
D.充电时电解质溶液的pH逐渐增大 Yao日月1年前1
Yao日月1年前1 -
 jiangsan 共回答了18个问题
jiangsan 共回答了18个问题 |采纳率88.9%解题思路:电池放电时,相当于原电池的工作原理,正极发生得电子的还原反应,负极发生失电子的氧化反应;充电时,相当于电解池的工作原理,根据反应方程式来确定溶液的酸碱性并判断电子转移的量.A、放电时,负极是甲醇发生失电子的氧化反应,故A正确;
B、充电时,根据电池反应可知每生成2molCH3OH转移电子12mol,所以充电时每生成1molCH3OH转移6mol电子,故B错误;
C、放电时,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,故C正确;
D、充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,故D正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查学生有关二次电池的有关知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- (2011•西城区二模)摩托罗拉公司研发了一种由甲醇(CH3OH)为原料的新型手机电池.电池反应的原理为:2CH3OH+
(2011•西城区二模)摩托罗拉公司研发了一种由甲醇(CH3OH)为原料的新型手机电池.电池反应的原理为:2CH3OH+3O2+4NaOH═2Na2CO3+6H2O.若消耗了3.2g甲醇,可生成多少克水?
 sdafwegu1年前1
sdafwegu1年前1 -
 猪鬃 共回答了19个问题
猪鬃 共回答了19个问题 |采纳率94.7%解题思路:根据化学方程式,得出各物质之间的质量比,列出比例式,就可计算出生成水的质量.设生成H2O的质量为x.
2CH3OH+3O2+4NaOH═2Na2CO3+6H2O
64 108
3.2g x
[64/108=
3.2g
x] x=5.4g
答:能生成5.4g的H2O.点评:
本题考点: 常见能源的种类、能源的分类;根据化学反应方程式的计算.
考点点评: 本题难度不大,主要考查学生根据化学方程式进行计算的能力.1年前查看全部
- 摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:
摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH 3 OH+3O 2 +4NaOH═2X+6H 2 O,其中X的化学式为( ) A.Na 2 CO 3 B.Na 2 O C.NaHCO 3 D.CH 4  突然有这种想法1年前1
突然有这种想法1年前1 -
 apple199919 共回答了17个问题
apple199919 共回答了17个问题 |采纳率100%由电池反应原理为:2CH 3 OH+3O 2 +4NaOH═2X+6H 2 O,根据质量守恒定律的元素守恒的思想,可知反应前后元素种类不变,原子的个数相等,即:反应前的原子个数:碳原子2个,氢原子12个,氧原子12个,钠原子4个;反应后的原子个数:碳原子0个,氢原子12个,氧原子6个,钠原子0个;故可知2X中含有6个氧原子、4个钠原子、2个碳原子.故X的化学式为Na 2 CO 3 .
故选A.1年前查看全部
- 解一道关于原电池的化学问题,急据报道最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱 作电解质溶液的新型手机电池,电量可达
解一道关于原电池的化学问题,急
据报道最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱
作电解质溶液的新型手机电池,电量可达现用镍氢或锂电池
的十倍,可连续使用一个月才充一次电.据此回答:
(1)甲醇是___极,电极反应是______________________
(2)电池反应的离子方程式___________________________
(3)这种电池若用在宇宙飞船上还可以为宇航员提供生活用水.
设在这种电池的总反应中每消耗1mol甲醇将生成amol水和放
出QkJ的热量,在实际使用中这种电池每发1度电时生成mg
水.则电池的能量利用率为_______________ (用含a、Q、
m的代数式表示.
第三问最好有详细过程 woohyukyang1年前0
woohyukyang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2C放电 充电
+6H2O,则O 2−3
(1)放电时电极反应方程式:正极______;负极______.
(2)充电时电解质溶液的pH逐渐______(填增大、减小),充电时每生成1molCH3OH转移______ mol电子. 爱情回来过1年前1
爱情回来过1年前1 -
 goohh12 共回答了18个问题
goohh12 共回答了18个问题 |采纳率94.4%解题思路:(1)放电时,相当于原电池的工作原理,正极发生得电子的还原反应,负极发生失电子的氧化反应;
(2)充电时,相当于电解池的工作原理,根据反应方程式来确定溶液的酸碱性并判断电子转移的量.(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,即O2+2H2O=4OH-+4e-,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,故答案为:O2+2H2O=4OH-+4e-;CH3OH+8OH-=6H2O+CO32-+6e-;
(2)充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,每生成2molCH3OH转移电子12mol,所以充电时每生成1molCH3OH转移6mol电子,故答案为:增大;6.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查学生有关二次电池的有关知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月。其电池反应为:2CH 3 OH+3O 2 +4OH -
 2CO 3 2 — +6H 2 O,则下列说法正确的是( )
2CO 3 2 — +6H 2 O,则下列说法正确的是( )A.放电时CH 3 OH参与反应的电极为正极 B.放电时负极的电极反应为CH 3 OH+8OH - -6e - =CO 3 2 — +6H 2 O C.标准状况下,通入5.6 L O 2 并完全反应后,有0.5 mol电子转移 D.放电一段时间后,通入氧气的电极附近溶液的pH降低  nanycmmly1年前1
nanycmmly1年前1 -
 山本五十九 共回答了19个问题
山本五十九 共回答了19个问题 |采纳率89.5%B
A项,放电时为原电池装置,失去电子一极为负极,得到电子一极为正极,CH 3 OH中碳元素化合价升高,失电子,参与反应的电极为负极;C项,标准状况下,通入5.6 L O 2 即0.25 mol完全反应后,转移电子数为4×0.25 mol=1 mol;D项,放电时通入氧气一端方程式为:O 2 +2H 2 O+4e - =4OH - ,电极附近c(OH - )增加,pH增大。1年前查看全部
- 16,据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池
16,据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池
,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH-2CO32-+6H2O,则下列说法错误的是
A 充电时每生成1mol CH3OH转移6 mol电子
B 充电时电解质溶液的pH逐渐增大
C 放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D 放电时CH3OH参与反应的电极为正极
我的疑问:解析中,A “根据电池反应可知每生成2molCH3OH转移电子12mol,”为什么?B正确,可是不是消耗了H20吗?C,“放电时,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,”为什么?方程式怎么配的,
解析附下:
A ,充电时,根据电池反应可知每生成2molCH3OH转移电子12mol,所以充电时每生成1molCH3OH转移6mol电子,故A正确
B,充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,故B正确
C放电时,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,故C正确
D,放电时,负极是甲醇发生失电子的氧化反应,所以放电时CH3OH参与反应的电极为负极.故D错 wananzhu1年前1
wananzhu1年前1 -
 小ff传奇 共回答了25个问题
小ff传奇 共回答了25个问题 |采纳率76%A 选项,电解时CO32-生成CH3OH,前者碳为+4价,后者碳为-2加,化合价降低6,那么每生成1mol甲醇,得电子数为6mol所以,每生成2mol甲醇,转移电子数为12mol.正确
B消耗水,但是还生成了氢氧根,所以PH增大
C方程式配平根据化合价变化,前者碳为-2价,后者碳为+4价,升高6,所以失6个电子,然后根据电子守恒,左边失6个电子,右边有2个负电荷,那么相当于右边多出了8个负电荷,这是碱性溶液,所以负电荷用OH-.所以OH- 的系数为8,再根据原子守恒,水的系数为61年前查看全部
- 据报道,世界著名企业摩托罗拉公司研发了一种由甲醇和氧气以及NaOH溶液做电解质的新型手机电池,可连续使用一个月才充一次电
据报道,世界著名企业摩托罗拉公司研发了一种由甲醇和氧气以及NaOH溶液做电解质的新型手机电池,可连续使用一个月才充一次电.其工作时的反应为2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )
A.此时CH3OH在正极上参与反应
B.工作中电解质溶液的pH逐渐增大
C.工作中正极的电极反应为:2H2O+O2+4e-═4OH-
D.工作中电解质溶液的OH-移向O2参加反应的电极 c33451年前1
c33451年前1 -
 小龙出世 共回答了23个问题
小龙出世 共回答了23个问题 |采纳率100%解题思路:放电时,该装置是原电池,负极上燃料失电子发生氧化反应,电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-.A.C元素的化合价升高,甲醇为原电池的负极,故A错误;
B.该反应中氢氧根离子参加反应,且生成水,所以氢氧根离子浓度逐渐减小,故B错误;
C.正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-═4OH-,故C正确;
D.工作中电解质溶液中氢氧根离子向负极移动,即移向甲醇参加反应的电极,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,注意放电为原电池,充电为电解池来解答1年前查看全部
- 甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,
甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上有一种生产甲醇的反应为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H=-49.0kJ▪mol-1
在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为______.容器 A B 反应物投入量 1mol CO2(g)和3mol H2(g) 1mol CH3OH(g)和3mol H2O(g) CH3OH(g)浓度(mol•L-1) c1 c2 反应能量变化 放出29.4kJ 吸收akJ
②A中达到平衡时CO2的转化率为______.③a=______.
某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图:
①写出甲中通入甲醇这一极的电极反应式______
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式______;在t2时所得溶液的pH为______.(假设溶液体积不变) 冰伊人1年前1
冰伊人1年前1 -
 海豚听风 共回答了21个问题
海豚听风 共回答了21个问题 |采纳率85.7%解题思路:(1)①根据甲醇的浓度计算二氧化碳的浓度变化量,再根据v=[△c/△t]计算用CO2来表示的平均反应速率;
②根据反应放出的热量计算参加反应的二氧化碳的物质的量,再利用转化率定义计算;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;
(2)①甲醇发生氧化反应,在碱性条件下生成碳酸根与水;
②原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.(1)①该反应中甲醇的v=[△c/△t]=
c1
10mol/(L.s)=0.1c1 mol/(L.s)或v=[△c/△t]=
c2
10smol/(L.s)=0.1mol/(L.s),二氧化碳和甲醇的计量数相同,所以其反应速率相同,即甲醇的反应速率为0.1c1mol/(L•S) 或0.1c2mol/(L•S),
故答案为:0.1c1mol/(L•S) 或0.1c2mol/(L•S);
②1mol二氧化碳完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的n(CO2)=[29.4kJ×1mol/49.0kJ]=0.6mol,所以二氧化碳的转化率=[0.6mol/1mol×100%=60%,
故答案为:60%;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热-放出的热量=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
(2)①甲醇燃料电池中,在碱性条件下,甲醇失电子生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;
t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=
0.112L×4mol
22.4L]=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=[0.02mol/0.2L]=0.1mol/L,所以溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O;1.点评:
本题考点: 化学平衡的计算;电极反应和电池反应方程式.
考点点评: 本题考查了化学平衡的有关计算、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法正确的是( )放电 充电
A.充电时有CH3OH生成的电极为阳极
B.放电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D.充电时每生成1 mol CH3OH转移12mol电子 猪如我也1年前1
猪如我也1年前1 -
 copyleftgirl 共回答了22个问题
copyleftgirl 共回答了22个问题 |采纳率86.4%解题思路:A.充电时,阴、阳极正好是原电池的负极、正极上反应的逆反应;
B.放电时,溶液中氢氧根离子浓度减小;
C.放电时,负极上燃料失电子和氢氧根离子反应生成碳酸根离子和水;
D.根据甲醇和转移电子之间的关系式进行计算.A.充电时,碳酸根离子得电子生成甲醇,则有CH3OH生成的电极为阴极,故A错误;
B.放电时,氢氧根离子参加反应导致溶液中氢氧根离子浓度减小,则溶液的pH减小,故B错误;
C.放电时,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D.充电时每生成1molCH3OH转移1mol×(4+2)=6mol电子,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了化学电源新型电池,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,知道阴、阳极正好是原电池的负极、正极上反应的逆反应,为易错点.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次.假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO 3 2 - .
(1)该电池反应的离子方程式为
(2)甲醇在 极发生反应(填“正”或“负”),电池中放电过程中溶液pH将 (填“下降”、“上升”或“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液假设能量利用率为80%。则将产生标准状况下氧气 L。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y 2 O 3 的ZrO 2 固体,它在高温下能传导O 2 - 离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式为 ;
(4)放电时固体电解质里的O 2 - 离子的移动方向是向 极移动(填“正”或“负”)。 夏天降宇1年前1
夏天降宇1年前1 -
 重生芙蓉 共回答了18个问题
重生芙蓉 共回答了18个问题 |采纳率72.2%(1)2CH 3 OH+3O 2 +4OH - →2CO 3 2 - +6H 2 O (2)负、13.44L;(3)O 2 +4e - =2O 2 - ;(4)负号、
(1)该电池的总反应式可由下列二式合并得到:2CH 3 OH+3O 2 →2CO 2 +4H 2 O,CO 2 +2OH - =CO 3 2 - +H 2 O。(2)燃料电池中可燃物被氧化作负极,根据得失电子数守恒建立关系式:
2CH 3 OH~3O 2
64g 67.2L
16g×80% X=(67.2×16×0.8)/64=13.44L1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,其电池反应为:
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,其电池反应为:
2CH 3 OH+3O 2 +4OH -
2CO 3 2- +6H 2 O,下列说法错误的是( )A.放电时CH 3 OH参与反应的电极为负极 B.充电时每生成1molCH 3 OH转移12mol电子 C.放电时负极的电极反应为:CH 3 OH+8OH- - CO 3 2- +6H 2 O+6e -- D.充电时电解质溶液的pH逐渐增大  太阳雨2281年前1
太阳雨2281年前1 -
 宋焱楚风 共回答了11个问题
宋焱楚风 共回答了11个问题 |采纳率100%A、放电时,负极是甲醇发生失电子的氧化反应,故A正确;
B、充电时,根据电池反应可知每生成2molCH 3 OH转移电子12mol,所以充电时每生成1molCH 3 OH转移6mol电子,故B错误;
C、放电时,负极是甲醇发生失电子的氧化反应,即CH 3 OH+8OH - =6H 2 O+CO 3 2- +6e - ,故C正确;
D、充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,故D正确.
故选B.1年前查看全部
- (2011•济南二模)摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次
(2011•济南二模)摩托罗拉公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3O2+4NaOH═2X+6H2O,其中X的化学式为( )
A.Na2CO3
B.Na2O
C.NaHCO3
D.CH4 shanzi05131年前1
shanzi05131年前1 -
 铁公子 共回答了18个问题
铁公子 共回答了18个问题 |采纳率88.9%解题思路:由电池反应原理为:2CH3OH+3O2+4NaOH═2X+6H2O,根据质量守恒定律的元素守恒的思想,可知反应前后元素种类不变,原子的个数相等,则可推测X的化学式.由电池反应原理为:2CH3OH+3O2+4NaOH═2X+6H2O,根据质量守恒定律的元素守恒的思想,可知反应前后元素种类不变,原子的个数相等,即:反应前的原子个数:碳原子2个,氢原子12个,氧原子12个,钠原子4个;反应后的原子个数:碳原子0个,氢原子12个,氧原子6个,钠原子0个;故可知2X中含有6个氧原子、4个钠原子、2个碳原子.故X的化学式为Na2CO3.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想处理问题;掌握有关化学式的计算和推断的方法;同时也考查了学生的分析和应变能力.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH+3O 2 +4OH -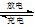 2CO 3 2- +6H 2 O,则下列说法错误的是[ ]
2CO 3 2- +6H 2 O,则下列说法错误的是[ ]A.放电时CH 3 OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O
D.充电时每生成1mol CH 3 OH转移6mol电子 coangel1年前1
coangel1年前1 -
 poppy05 共回答了10个问题
poppy05 共回答了10个问题 |采纳率90%A1年前查看全部
- 请问摩托罗拉公司的销售部门的AE和RE的中文意思是什么?英文全写是怎么样的?
 kentyyao1年前1
kentyyao1年前1 -
 九月冰飒 共回答了17个问题
九月冰飒 共回答了17个问题 |采纳率94.1%AE:客户主管 Account Executive
RE:零售市场销售主任 Retail Executive1年前查看全部
大家在问
- 1班主任用英语怎么说?
- 2提问,to be successful还是be a success .还是其他
- 3question stuff matter issue用法有什么区别?
- 4下列有关糖类、油脂、蛋白质的说法中,正确的是( )
- 5看图选择对应的单词,并将单词写在横线上。 ( ) 1. A. rain
- 6见到一头白象很难的英文翻译是什么
- 7鼓励( 填一个词
- 8如何判断遗传病是否由基因控制酶的合成而引起
- 9用一根长20cm的铁丝做成一些半径是0.5cm的小圆,最多可以做多少个
- 10时钟每整点敲的次数是该钟点数,每半小时敲一次,一昼夜敲了多少次?
- 11The teacher asks him —(finish) his homework on time 这个空怎么填?
- 12I seldom(几乎不) eat sweet food.(同义)
- 13翻译练习。1 .我们决不能忽视污染严重的这个事实.(lose sight of) _______
- 14读“世界人种分布图”,完成下列问题.
- 15英语单词我们 他们 她们它们的写法
