用H2C2O4•2H2O滴加浓H2SO4制备CO,通入灼热的铁氧化粉末中,做炼铁实验.但此法制备的CO中含有其他气体,必
 养在深闺2022-10-04 11:39:541条回答
养在深闺2022-10-04 11:39:541条回答
根据题目要求,回答下列问题:
(1)写出H2C2O4•2H2O在浓硫酸催化作用下制备CO的化学方程式.
| ||
| △ |
| ||
| △ |
(2)用a~h表示连接顺序,正确顺序为a______i.
(3)用A~F正确表示下面实验操作的先后顺序:______.
A.点燃甲装置的酒精灯,打开分液漏斗,调节浓硫酸的滴速.
B.点燃乙装置中的酒精灯,加热氧化铁.
C.检查整套装置的气密性.
D.将导管口i处的尾气验纯后,点燃加以处理.
E.待乙装置玻璃管内的Fe2O3完全变黑时,熄灭乙装置中的酒精灯.
F.关好甲装置中分液漏斗的开关后,再熄灭该装置中的酒精灯.
(4)空洗气瓶的作用是______,浓硫酸洗气瓶的作用是______.
(5)假设H2C2O4•2H2O的分解产物以气体形式从a处导出,则该混合气体的平均摩尔质量为______.
(6)假设乙中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取a克混合物充分反应后,质量减轻了[8a/29]克,通过计算确定该混合物中三种氧化物的物质的量的关系是:______.

已提交,审核后显示!提交回复
共1条回复
 new2008year 共回答了18个问题
new2008year 共回答了18个问题 |采纳率94.4%- 解题思路:(1)草酸晶体在浓硫酸作催化剂、加热的条件下,发生分解反应,根据碳元素的化合价变化可知,除生成一氧化碳外还有二氧化碳生成;
(2)根据原理和各装置的作用连接,得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO;
(4)除去二氧化碳要防止溶液倒吸;进入乙装置的气体应干燥;
(5)根据质量守恒,混合气体的质量等于草酸晶体的质量,结合方程式可知,混合气体的物质的量为草酸晶体的5倍,由摩尔质量定义可得,混合气体的平均摩尔质量为草酸晶体的1/5;
(6)质量减轻[8a/29]克,为a克铁氧化物的混合物所含氧原子的质量,由此计算混合物中铁原子的质量,再求出混合物中铁原子与氧原子的个数比,据此确定混合物组成及混合物中各组分的物质的量关系.(1))草酸晶体在浓硫酸作催化剂、加热的条件下,发生分解反应,根据碳元素的化合价变化可知,除生成一氧化碳外还有二氧化碳生成,反应方程式为
H2C2O4•2H2O
浓硫酸
△CO↑+CO2↑+3H2O,
故答案为:H2C2O4•2H2O
浓硫酸
△CO↑+CO2↑+3H2O;
(2)得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸,所以装置的连接顺序为a接d;e 接g;f接c; b 接h,
故答案为:d e g f c b h;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO.所以操作步骤顺序为CADBEF,故答案为:CADBEF;
(4)除去二氧化碳要防止溶液倒吸,进入乙装置的气体应干燥,所以空洗气瓶的作用是防倒吸,浓硫酸洗气瓶的作用是干燥CO,
故答案为:防倒吸;干燥CO;
(5)混合气体的质量等于草酸晶体的质量,混合气体的物质的量为草酸晶体的5倍,由摩尔质量定义可得,混合气体的平均摩尔质量为草酸晶体的1/5,混合气体的摩尔质量为126g/mol×[1/5]=25.2g/mol,故答案为:25.2g/mol;
(6)a克铁氧化物的混合物所含铁原子的质量为(a-[8a/29])g=[21a/29]g,
所以混合物中n(Fe):n(O)=
21a
29g
56g/mol:
8a
29g
16g/mol=3:4
由于Fe3O4中铁原子与氧原子的个数比为3:4,只要FeO与Fe2O3保证混合铁原子与氧原子的个数比为3:4,即可,与Fe3O4任意含量无关,
令n(FeO)为x,n(Fe2O3)为y,所以有(x+2y):(x+3y)=3:4,即x:y=1:1,
且满足三者质量之和为ag,即72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a
故答案为:n(FeO):n(Fe2O3)=1:1,n(Fe3O4)≥0;72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a点评:
本题考点: 常见气体制备原理及装置选择.
考点点评: 以实验为载体,综合考查学生化学计算、推断能力和对氧化还原反应、实验原理及装置的理解. - 1年前
相关推荐
- (2012•黄石)草酸晶体(H2C2O4•2H2O)熔点较低,受热时会迅速熔化并发生分解,其分解反应的化学方程式为:H2
(2012•黄石)草酸晶体(H2C2O4•2H2O)熔点较低,受热时会迅速熔化并发生分解,其分解反应的化学方程式为:H2C2O4•2H2O
CO↑+CO2↑+3H2O.某实验小组为检验草酸分解产物中是否有CO,设计了如图所示的实验装置.回答下列有关问题:△ .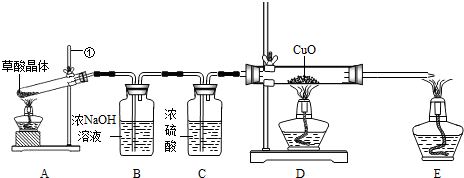
(1)写出A装置中仪器①的名称______.
(2)点燃A处酒精灯后,先收集一试管气体,用拇指______,若不发出尖锐的爆鸣声,才点燃E和D处的酒精灯.
(3)C装置的作用是______.
(4)D装置中发生反应的化学方程式是CuO+CO
Cu+CO2△ .CuO+CO.
Cu+CO2△ .
(5)实验时D装置中可观察到的现象是______.
(6)实验结束时,应先熄灭______处(填“A”、“D”或“E”)的酒精灯. menxyz1年前1
menxyz1年前1 -
 lsnjrjrj 共回答了21个问题
lsnjrjrj 共回答了21个问题 |采纳率90.5%解题思路:(1)根据实验室常见仪器的名称填空;
(2)根据一氧化碳不纯遇火或加热会发生爆炸、一氧化碳的验纯方法解答;
(3)浓硫酸具有吸水性;
(4)根据反应物、生成物以及反应条件书写化学反应方程式;
(5)根据一氧化碳还原氧化铜的原理知,黑色的氧化铜被还原为红色的铜单质了;
(6)根据一氧化碳还原氧化铜实验需要注意事项填空.(1)图中A装置中仪器①的名称是铁架台(或带铁夹的铁架台);
故答案是:铁架台(或带铁夹的铁架台);
(2)CO不纯遇火或加热会发生爆炸,检验CO的纯度要先收集一试管气体,用拇指堵住试管口迅速移近试管口,若不发出尖锐的爆鸣声证明较为纯净可以使用;
故答案是:堵住试管口,靠近火焰点火;
(3)浓硫酸有吸水性,可以干燥气体,以利于后续实验.
故答案是:除去CO气体中混有的水蒸气(或干燥CO气体);
(4)一氧化碳的还原性能和金属氧化物反应,生成金属和二氧化碳,其反应方程式为:CuO+CO
△
.
Cu+CO2
故答案是:CuO+CO
△
.
Cu+CO2;
(5)在一氧化碳还原氧化铜的实验中,因氧化铜为黑色,铜为红色,所以实验中可观察到D处黑色粉末变红;
故答案是:黑色固体逐渐变成红色;
(6)当氧化铜完全反应时,还要继续通一氧化碳,直到试管冷却为止,所以熄灭酒精灯时要先熄灭D处酒精灯最后熄灭E处酒精灯.E处酒精灯的作用就是点燃未反应的一氧化碳使它转化为二氧化碳,防止污染空气;
故答案是:D.点评:
本题考点: 常见气体的检验与除杂方法;实验操作注意事项的探究.
考点点评: 本题主要考查物质的化学性质及化学方程式的书写,要求学生具有良好的实验分析能力和解题能力.1年前查看全部
- 5、已知在空气中加热H2C2O4•2H2O(二水合乙二酸),生成的气体通入澄清石灰水后出现浑浊,则其热分解方
5、已知在空气中加热H2C2O4•2H2O(二水合乙二酸),生成的气体通入澄清石灰水后出现浑浊,则其热分解方程式为_____.由此可知Na2C2O4(草酸钠)的热分解方程式为________.
 xujungood1年前2
xujungood1年前2 -
 生ss会 共回答了19个问题
生ss会 共回答了19个问题 |采纳率94.7%H2C2O4*2H2O----->3H2O+CO2+CO;
Na2C2O4----->Na2O+CO2+CO1年前查看全部
- 某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解,其化学方程式为:H2C2O4•2H2O
某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解,其化学方程式为:H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学在实验室分别进行了如下实验,回答下列问题:△ .
(1)甲同学利用如图装置制取并收集CO.
①试管口略向下倾斜的原因是______;
②B装置的作用______.
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
其中正确的方案是______.
(3)丙同学按下列装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
①丁同学认为去掉A装置,对测定结果无影响,他的观点______(填“正确”或“不正确”),判断理由是______.而戊同学认为从环保的角度考虑应在D装置后再增加______装置,若无此装置,对测定结果是否有影响?______(填“是”或“否”).
②当C装置中铁的氧化物全部被还原后,称量剩余的质量为11.2g,同时测得D装置的质量增加13.2g,则该铁的氧化物中铁元素和氧元素的质量比为______. 木木0070071年前1
木木0070071年前1 -
 女棋手 共回答了19个问题
女棋手 共回答了19个问题 |采纳率94.7%解题思路:(1)根据草酸分解的产物及所设计装置的目的,判断各装置的作用及操作注意事项;
(2)根据所设计方案中试剂在验证混合气体中的作用,设计正确的顺序对混合气体的每一成分进行验证;
(3)①分析为测定铁的氧化物的组成所设计的实验装置中各装置的作用,对各装置进行评价,并判断对测定结果所产生的影响;
②根据对所测得装置质量的分析,计算铁的氧化物中所含铁元素与氧元素的质量,求得该铁的氧化物中铁元素和氧元素的质量比.(1)①为防止在试管冷凝的水回流至试管底部而引起试管爆裂,在对固体物质加热时,试管口要略向下倾斜;
②利用氢氧化钠溶液吸收分解产物中的二氧化碳气体,从而收集到较为纯净的一氧化碳;
(2)由于检验二氧化碳气体需要把混合气体通入澄清石灰水,影响混合气体中水的检验,因此在检验二氧化碳、一氧化碳气体应首先使用无水硫酸铜检验混合气体中的水;然后利用澄清石灰水检验二氧化碳,而不能使用与二氧化碳反应无明显现象的氢氧化钠溶液,在检验一氧化碳前需要使用足量澄清石灰水既检验二氧化碳又完全吸收二氧化碳,接下来把气体通过灼热氧化铜和澄清石灰水,检验一氧化碳;故正确方案应选D方案;
(3)①装置A除去混合气体中的二氧化碳,若除去则会使所测得二氧化碳质量偏大;由于未完全反应一氧化碳会随尾气排入空气造成污染,因此需要对尾气进行收集或直接点燃的处理,该处理只是为防止造成空气污染,不影响测定结果;
②完全反应后,装置C中剩余固体质量11.2g即铁的氧化物中铁的质量,而装置D增加的质量为反应生成二氧化碳的质量,二氧化碳是由一氧化碳与氧化物中氧结合而得,因此二氧化碳中氧元素质量的一半为铁的氧化物中氧的质量,则铁的氧化物为氧的质量=13.2g×[32/44]×100%×[1/2]=4.8g;
则该铁的氧化物中铁元素和氧元素的质量比=11.2g:4.8g=7:3;
故答案为:
(1)①防止水倒流,试管炸裂;②除去二氧化碳(CO2);
(2)D;
(3)①不正确;生成物中的CO2会影响测定结果;尾气处理装置(点燃、收集等);否;②7:3.点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 根据实验目的及所设计的实验装置,明确每个装置在实验中所起的作用,是解答好此问题的基础与关键.1年前查看全部
- 某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H
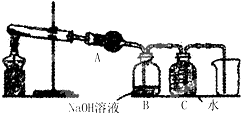 某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H2O
某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学设计了如图所示的装置并进行了实验,收集一瓶CO,请回答:△ .
(1)为证明分解产物中有水,装置A中的物质应该是______;
(2)装置B的作用是______;
(3)实验中采用“压水法”收集CO(装置C);从CO的物理性质考虑,是因为______;
(4)若要验证二氧化碳有无生成,则应在______之间加一个装置,该装置中盛放的物质是______. 天堂的红叶1年前1
天堂的红叶1年前1 -
 yxiang546 共回答了23个问题
yxiang546 共回答了23个问题 |采纳率100%解题思路:(1)根据无水硫酸铜常用来检验水的存在,遇水变蓝色进行分析;
(2)根据氢氧化钠和二氧化碳会生成碳酸钠和水进行分析;
(3)根据一氧化碳的物理性质进行分析;
(4)根据检验二氧化碳常用澄清石灰水检验进行分析.(1)无水硫酸铜遇水变蓝,常用来检验水的存在,所以装置A中的物质应该是:无水硫酸铜;
(2)氢氧化钠溶液常用来除去二氧化碳气体,氢氧化钠和二氧化碳会生成碳酸钠和水,所以装置B的作用是:吸收二氧化碳;
(3)采用“压水法”收集CO实质上是排水法,可以采用此法收集的气体需具备不易或难溶于水的性质,所以从CO的物理性质考虑,是因为:一氧化碳难溶于水;
(4)实验室检验二氧化碳常用澄清石灰水检验,所以要验证二氧化碳有无生成,需要在除去二氧化碳之前检验,则应在AB之间加一个装置,该装置中盛放的物质是:氢氧化钙溶液.
故答案为:(1)无水硫酸铜;
(2)吸收二氧化碳;
(3)一氧化碳难溶于水;
(4)AB,氢氧化钙溶液.点评:
本题考点: 物质的相互转化和制备;常见气体的检验与除杂方法;二氧化碳的检验和验满;一氧化碳的物理性质.
考点点评: 进行物质检验或除杂时,要根据物质的性质进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.1年前查看全部
- 某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为 H2C2O4•2H
某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为 H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学在实验室分别进行了如下实验,请回答下列问题:△ .
(1)甲同学利用图1装置制取并收集CO:
①B装置的作用______.
②CO集满后,将集气瓶由水槽中加盖取出,为防止产生倒吸,应先______(选填“a.先把导管从水槽中移出”或“b.断开A、B之间的连接”)
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、氢氧化钠溶液、灼热的氧化铜、石灰水
你认为其中正确的方案是______.
(3)丙同学按图2装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
①样品的质量是23.2g,当C装置中铁的氧化物全部被还原后,称量剩余的质量为16.8g,则该铁的氧化物的化学式为______.
②丁同学认为去掉A装置,对测定铁的氧化物的化学式结果______影响(填“有”或“无”) 空谷明月1年前1
空谷明月1年前1 -
 雪色纱衣 共回答了19个问题
雪色纱衣 共回答了19个问题 |采纳率100%解题思路:(1)根据草酸分解的产物及实验目的,判断各装置的作用及操作注意事项;二氧化碳与氢氧化钠溶液可反应;
(2)根据所设计方案中试剂在验证混合气体中的作用,设计正确的顺序对混合气体的每一成分进行验证;
(3)①根据对所测装置质量的分析(C装置减少的质量就是氧化物中氧元素的质量),计算铁的氧化物中所含铁元素与氧元素的质量,根据铁的氧化物中铁元素和氧元素的质量比求出氧化物的化学式;
②分析为测定铁的氧化物的组成各装置的作用,对各装置进行评价,并判断对测定结果所产生的影响.(1)①利用氢氧化钠溶液吸收分解产物中的二氧化碳气体,从而收集到较为纯净的一氧化碳;
②收集完毕,为防止产生倒吸,应先把导管从水槽中移出,再断开A、B之间的连接,然后熄灭酒精灯;
(2)检验二氧化碳气体要把混合气体通入澄清石灰水,气体再出来时带来水蒸气,影响混合气体中水的检验,因此在检验二氧化碳、一氧化碳气体应首先使用无水硫酸铜检验混合气体中的水;然后利用澄清石灰水检验二氧化碳,而不能使用与二氧化碳反应无明显现象的氢氧化钠溶液;检验二氧化碳完毕要通过氢氧化钠溶液除掉二氧化碳,防止对一氧化碳反应产物的干扰,即在检验一氧化碳前要既检验二氧化碳又完全吸收二氧化碳;接下来把气体通过灼热氧化铜和澄清石灰水,检验一氧化碳;故正确方案应选D方案;
(3)①完全反应后,装置C中剩余固体质量16.8g,即铁的氧化物中铁的质量;而装置C减少的质量为氧化物中氧元素的质量,23.2g-16.8g=6.4g;
设则该铁的氧化物化学式为FexOy,氧化物中铁元素和氧元素的质量比为:[56x/16y]=[16.8g/6.4g],整理得[x/y]=[3/4],所以该铁的氧化物的化学式是Fe3O4;
②装置A是除去混合气体中的二氧化碳,对C装置的质量变化并无影响,所以对测定铁的氧化物的化学式结果无影响;
故答案为:
(1)①除去二氧化碳(CO2);
②a;
(2)D;
(3)①Fe3O4;
②无.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;根据化学反应方程式的计算.
考点点评: 根据实验目明确所设计的实验装置的作用,是解答好此类题的基础与关键,检验混合气体中含有水蒸气,通常放在第一步.1年前查看全部
- 草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和C
草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.
草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)不明白为什么选D不选A呢?

 oxfam1年前1
oxfam1年前1 -
 老牯牛 共回答了25个问题
老牯牛 共回答了25个问题 |采纳率92%若选C,生成的H2O倒流回试管底,导致试管破裂,所以应该选D,试管口朝下,用加热草酸晶体的方法获取某些气体,可能和气体的密度有关系,空气的密度29,CO为28,为了获取CO,所以才试管口口向下,排出了CO2,因为CO2大于空气密度,有两方面的考虑.1年前查看全部
- (2005•连云港)某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为H2C2O
(2005•连云港)某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解其化学方程式为H2C2O4•2H2O≜CO↑+CO2↑+3H2O,
该课题小组的同学在实验室分别进行了如下实验
请回答下列问题:
(1)甲同学利用右图装置制取并收集CO:
①B装置的作用______.
②CO集满后,将集气瓶由水槽中加盖取出,然后先______,再______.
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
你认为其中正确的方案是______.
(3)丙同学按下图装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
①当C装置中铁的氧化物全部被还原后,称量剩余的质量为a g,同时测的D装置的质量增加b g,则该铁的氧化物中铁元素和氧元素的质量比为______.
②丁同学认为去掉A装置,对测定结果无影响,他的观点______(填“正确”或“不正确”)你的判断理由是______.而戊同学认为在D装置后还应再增加某装置,该装置是______;若无此装置,对测定结果是否有影响?______(填“是”或“否”) 小人物情怀1年前1
小人物情怀1年前1 -
 百家姓第十 共回答了17个问题
百家姓第十 共回答了17个问题 |采纳率88.2%解题思路:根据实验室制氧气来考虑本题具体情况,根据一氧化碳、二氧化碳、水蒸气的具体性质来回答本题,根据实验装置质量变化的原因分析好本题,再具体去分析.解;(1)①氢氧化钠溶液属于碱能吸收酸性气体,所以除去二氧化碳;②实验完毕要先撤导管后熄灭酒精灯,防止水倒吸使试管炸裂;
(2)先通过无水硫酸铜是验证有没有水蒸气、石灰水是验证有没有二氧化碳、灼热的氧化铜看有没有还原性气体、石灰水看有没有二氧化碳生成即判断有没有一氧化碳;
(3)①剩余的质量为a g即铁元素的质量为a g,D装置的质量增加b g即生成二氧化碳质量是b g,由于二氧化碳是一氧化碳还原的结果,所以其中氧元素的一半来自于铁的氧化物,则来自氧化铁的氧元素的质量为[16b/44],所以氧化铁中铁元素和氧元素的质量比为[a
16b/44]=[44a/16b]=[11a/4b].
②去掉A装置,对测定结果有影响因为二氧化碳会进入右边的装置内使测量结果不准确.
故答案为:(1)①除去CO2②将导管从水槽中移出,熄灭酒精灯
(2)D(3)①11a:4b,②不正确;混合气体中的CO2会进入装置,使测定结果不准确;盛有氢氧化钠溶液的洗气瓶(或装有碱石灰的干燥管);是.点评:
本题考点: 常见气体的检验与除杂方法;化学实验方案设计与评价;二氧化碳的化学性质;一氧化碳的化学性质;一氧化碳还原氧化铁;元素质量比的计算.
考点点评: 检验二氧化碳用澄清石灰水,检验一氧化碳时先通过灼热的氧化铜,再通过澄清石灰水,检验氢气时先通过灼热的氧化铜,再通过无水硫酸铜.1年前查看全部
- (2008•义乌市)某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写
(2008•义乌市)某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4•2H2O)可以制取CO,方程式可写成H2C2O4•2H2O
CO↑+CO2↑+3H2O,该课题小组的同学设计了如图所示的装置并进行了实验.请回答:△ .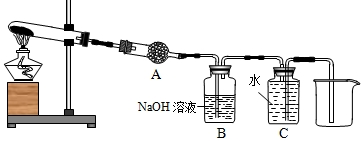
(1)为证明分解产物中有水,装置A中的物质应该是______;
(2)装置B的作用是______;
(3)实验中采用“压水法”收集CO(装置C);从CO的物理性质考虑,是因为______;
(4)通常情况下CO2能用来灭火,与此相关的化学性质是______. benfly1年前1
benfly1年前1 -
 yedoudou 共回答了24个问题
yedoudou 共回答了24个问题 |采纳率91.7%解题思路:检验气体的存在或除去气体,可以从物质的性质加以考虑,采用物理或化学方法.无水硫酸铜与水反应生成五水硫酸铜,由白色变为蓝色,常用来检验水的存在,氢氧化钠溶液常用来吸收二氧化碳,浓硫酸常用来吸水.(1)无水硫酸铜遇水变蓝,常用来检验水的存在,所以本题答案为:无水硫酸铜;
(2)氢氧化钠溶液常用来除去二氧化碳气体,所以本题答案为:除去二氧化碳(或吸收二氧化碳);
(3)采用“压水法”收集CO实质上是排水法,可以采用此法收集的气体需具备不易或难溶于水的性质,所以本题答案为:难溶于水(或不溶于水);
(4)二氧化碳既不燃烧也不支持燃烧,常用作灭火剂,所以本题答案为:不能燃烧也不能支持燃烧.点评:
本题考点: 气体的净化(除杂);二氧化碳的化学性质;一氧化碳的物理性质.
考点点评: 进行物质检验或除杂时,要根据物质的性质进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.1年前查看全部
- 草酸(H2C2O4•2H2O)是一种无色晶体,实验室常用加热的方法使其分解制取CO气体,反应的化学方程式为:H2C2O4
草酸(H2C2O4•2H2O)是一种无色晶体,实验室常用加热的方法使其分解制取CO气体,反应的化学方程式为:H2C2O4•2H2O
CO↑+CO2↑+3H2O,某学生设法将上述反应产物中的CO2和水蒸气除掉,验证CO的还原性.△ .
(1)该学生所设计的实验装置如下图,回答有关问题:
①上述实验装置中三个洗气瓶分别盛有澄清石灰水、氢氧化钠溶液、浓硫酸,则甲应盛______;
乙的作用是______;
②丙装置中能说明CO具有还原性的实验现象是______,证明CO具有还原性的化学方程式是CO+CuO
Cu+CO2△ .CO+CuO;
Cu+CO2△ .
③丁装置的实验现象是______.
(2)在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性.请回答下列问题.
①为确证通往玻璃管的CO气体已除去CO2,可在甲和乙之间连接______.(填装置序号)
②在装置丙和丁之间连接b装置,其作用是______;
③为了防止余气对实验室或环境造成污染,可在装置丁后连接______.(填装置序号) 风石度1年前1
风石度1年前1 -
 zhenghx2008 共回答了20个问题
zhenghx2008 共回答了20个问题 |采纳率95%解题思路:(1)①根据实验的目的:将上述反应产物中的CO2和水蒸气除掉分析装置内的药品及作用,氢氧化钠与二氧化碳反应可以除去二氧化碳,浓硫酸具有很好的吸水性分析;
②根据一氧化碳还原氧化铜生成铜和二氧化碳描述实验现象,写出反应的方程式;
③根据澄清石灰水能检验二氧化碳的存在分析;
(2)①根据检验二氧化碳的除去程度的目的需要澄清的石灰水;
②根据装置的特点分析;
③根据一氧化碳的毒性要对尾气的处理分析.(1)①要将上述反应产物中的CO2和水蒸气除掉,需要先通过氢氧化钠溶液除去二氧化碳,再通过浓硫酸的吸水性进行干燥;
②一氧化碳还原氧化铜生成铜和二氧化碳,故会看到黑色固体变成红色,反应的方程式为;CO+CuO
△
.
Cu+CO2;
③因为有二氧化碳的生成,故会看到澄清石灰水变浑浊;
(2)①要检验二氧化碳是否除去,可以通过澄清的石灰水是否变浑浊进行检验,故连接c装置;
②若装置骤冷可能会使石灰水倒流,引起玻璃管的炸裂,故加以b装置;
③因为一氧化碳有毒,会污染空气,可以通过点燃法或收集法等,本装置是通过排水收集多余的一氧化碳;
故答案为:(1)①氢氧化钠溶液;浓硫酸;②黑色固体变成红色;CO+CuO
△
.
Cu+CO2;③澄清石灰水变浑浊;
(2)①c;②防止石灰水倒流,引起玻璃管炸裂;③a.点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法.
考点点评: 本题考查一氧化碳还原氧化铁的实验装置及相关问题,属于课本基本实验的延伸,难度不大,要明确实验的目的及试剂的作用.1年前查看全部
- 要测定草酸晶体(H2C2O4•2H2O)的纯度
 情场浪子vv1年前2
情场浪子vv1年前2 -
 赫拉拉 共回答了20个问题
赫拉拉 共回答了20个问题 |采纳率75%250ml:7.200/(2+24+64+36)=0.057mol
25ml:0.057/10=0.0057mol
Kmno4:0.0057*2/5=0.00228mol
0.00228/0.1=0.0228L=22.8ml
理论消耗Kmno4=22.8ml
产率=20/22.8=87.7%
这只是大致计算,精细计算需要把相对分子质量好好算算.1年前查看全部
- (1)取一定质量H2C2O4•2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第
 (1)取一定质量H2C2O4•2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol•L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol•L-1H2SO4溶液酸化后,用0.10mol•L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4•2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol•L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol•L-1H2SO4溶液酸化后,用0.10mol•L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
①第二份溶液中滴定终点的判断现象是:______.
②第二份溶液中生成的H2C2O4在酸性条件下与KMnO4溶液反应的离子方程式:______.
③混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为______.
(2)某实验小组用如图所示的装置探究FeC2O4•2H2O在隔绝空气条件下受热分解的产物.当36.0g FeC2O4•2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g.求残留固体的成分和物质的量.(已知FeC2O4•2H2O的相对分子质量为180;设反应产生的气体被充分吸收) HENCES1年前1
HENCES1年前1 -
 颓废nn 共回答了18个问题
颓废nn 共回答了18个问题 |采纳率77.8%解题思路:(1)①第二份溶液中滴定终点,溶液由无色变为浅红色;
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水;
③依据原子守恒和化学方程式计算得到;
(2)最后被点燃的为一氧化碳气体,浓硫酸增重7.2g为水,碱石灰增重11.0g为二氧化碳气体,依据反应生成的物质在过程中的质量分别计算得到.(1)①第二份溶液中滴定终点,溶液由无色变为浅红色,且30s内不褪色,故答案为:溶液由无色变为浅紫红色.且30s内不褪色;
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水,反应的离子方程式为5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O,
故答案为:5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O;
③25mL中,设xmol H2C2O4•2H2O ymol KHC2O4根据滴定的,可以得出:2x+y=0.25×0.02,
根据氧化还原的,可以得出:x+y=0.1×0.016×2.5,x=0.001,y=0.003mol,所以原混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为1:3,
故答案为:1:3;
(2)被点燃的气体为CO,质量为m(CO)=36.0 g-13.6 g-7.2 g-11.0 g=4.2 g;
又FeC2O4•2H2O为0.2 mol,n(H2O)=7.2 g÷18 g/mol=0.4 mol,
n(CO2)=11.0 g÷44 g/mol=0.25 mol,n(CO)=4.2 g÷28 g/mol=0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe)=0.2 mol,n(O)=0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol;
答:Fe为0.05 mol,FeO为0.15 mol.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查物质的含量测定,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质,结合反应的方程式计算该题,难度中等.1年前查看全部
- 草酸晶体(H2C2O4•2H2O)熔点较低,受热时会迅速熔化并发生分解,某实验小组为检验草酸分解产物中是否有CO,设计了
草酸晶体(H2C2O4•2H2O)熔点较低,受热时会迅速熔化并发生分解,某实验小组为检验草酸分解产物中是否有CO,设计了如图所示的实验装置.回答下列有关问题:

(1)写出A装置中仪器①的名称______.
(2)证明存在CO的现象______,D中反应的化学方程式是CuO+CO
Cu+CO2△ .CuO+CO.
Cu+CO2△ .
(3)B装置的作用是______.
(4)E处酒精灯的作用是______,实验结束时,应先熄灭______处(填“A”、“D”或“E”)的酒精灯.
(5)为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50g,向其中加入过量锌粒,完成反应后收集到0.3g氢气,请完成下列计算与分析:Ⅰ.计算该盐酸中溶质的质量分数.Ⅱ.小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是______. feisepugongying1年前1
feisepugongying1年前1 -
 宝贝狼 共回答了13个问题
宝贝狼 共回答了13个问题 |采纳率100%解题思路:(1)根据实验室常见仪器的名称填空;
(2)根据一氧化碳具有还原性,能使金属氧化物生成金属单质解答;
(3)根据氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水进行解答;
(4)根据一氧化碳有毒以及一氧化碳还原氧化铜注意事项进行解答;
(5)根据氢气的质量可求出该盐酸中溶质的质量分数以及浓盐酸具有挥发性进行解答.(1)图中A装置中仪器①的名称是铁架台(或带铁夹的铁架台);
故答案是:铁架台(或带铁夹的铁架台);
(2)一氧化碳的还原性能和金属氧化物反应,生成金属和二氧化碳,所以在一氧化碳还原氧化铜的实验中,因氧化铜为黑色,铜为红色,所以实验中可观察到D处黑色粉末变红,D中反应的化学方程式是CuO+CO
△
.
Cu+CO2;
故答案为:黑色固体逐渐变成红色;CuO+CO
△
.
Cu+CO2;
(3)氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,所以B装置的作用是除去一氧化碳气体中的二氧化碳.
故答案是:除去一氧化碳气体中的二氧化碳;
(4)当氧化铜完全反应时,还要继续通一氧化碳,直到试管冷却为止,所以熄灭酒精灯时要先熄灭D处酒精灯最后熄灭E处酒精灯.E处酒精灯的作用就是点燃未反应的一氧化碳使它转化为二氧化碳,防止污染空气;
故答案是:点燃未反应的一氧化碳使它转化为二氧化碳,防止污染空气;D;
(5)Ⅰ设50g盐酸中氯化氢的质量为x,
Zn+2HCl═ZnCl2+H2↑
73 2
x 0.3g
[73/x=
2
0.3g]
x=10.95g
该盐酸中溶质的质量分数为:[10.95g/50g]×100%=21.9%
答:该盐酸中溶质的质量分数为21.9%.
Ⅱ因为浓盐酸具有挥发性,溶质氯化氢挥发后会导致溶质质量分数变小.
故填:浓盐酸具有挥发性,溶质挥发后导致溶质质量分数变小.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;一氧化碳的化学性质;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题主要考查物质的化学性质及化学方程式的书写,要求学生具有良好的实验分析能力和解题能力.1年前查看全部
- 一道分析化学题.下列物质必须用间接法配制成标准溶液的是 .①HCl,②NaOH,③H2C2O4•2H2O,④
一道分析化学题.
下列物质必须用间接法配制成标准溶液的是 .
①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤K2Cr2O7,⑥NaCl,⑦EDTA,⑧AgNO3 猪头吴小球1年前4
猪头吴小球1年前4 -
 真加使徒 共回答了16个问题
真加使徒 共回答了16个问题 |采纳率100%1,HCL易挥发,没有基准物质,要标定.
2,NaOH要潮解,和CO2反应,没有基准物质,要标定.
3,草酸,易分解,没有基准物质,要标定.
4,高锰酸钾固体易分解,而且配成溶液后缓慢分解成MnO2,没有基准物质,要标定.
5,重铬酸钾,很稳定,有基准物质,可直接配.
6,NaCl,很稳定,有基准物质,可直接配.
7,EDTA,很稳定,有基准物质,可直接配.
8,AgNO3,较稳定,避光保存即可,买得到基准物质,可直接配制.
所以要间接配制的是1,2,3,4
还有什么不明白的可以追问我.1年前查看全部
- 草酸晶体是重要的有机试剂,其化学式为H2C2O4•2H2O.某研究性学习小组进行以下的猜想:
草酸晶体是重要的有机试剂,其化学式为H2C2O4•2H2O.某研究性学习小组进行以下的猜想:
若加热完全分解:A、只生成CO2、H2O;B、只生成CO、H2O;C、可生成CO、CO2、H2O.请应用所学的化学原理分析以上三种猜想的正确性:
(1)______(填“A”或“B”或“C”)是合理猜想,根据是______.
(2)写出草酸晶体加热完全分解的合理化学方程式(要配平)H2C2O4•2H2O
CO2↑+CO↑+3H2O△ .H2C2O4•2H2O.
CO2↑+CO↑+3H2O△ . 我动故我在1年前1
我动故我在1年前1 -
 大雨离魂 共回答了20个问题
大雨离魂 共回答了20个问题 |采纳率90%解题思路:(1)根据质量守恒定律进行分析.在化学反应前后原子的种类及数目不变;
(2)根据反应写出反应的方程式;(1)若加热草酸晶体完全分解,由草酸晶体中各元素原子的个数比和质量守恒定律可知,可生成CO、CO2、H2O,若只生成CO2、H2O或CO、H2O,则生成物中的原子个数比与草酸晶体中元素原子的个数比不符.
(2)加热草酸晶体完全分解生成了二氧化碳、一氧化碳和水,反应的方程式是:H2C2O4•2H2O
△
.
CO2↑+CO↑+3H2O.
故答为:(1)C,依据草酸晶体中元素原子的个数比和质量守恒定律;(2)H2C2O4•2H2O
△
.
CO2↑+CO↑+3H2O.
故答为:C,依据草酸晶体中各元素原子的个数比和质量守恒定律;H2C2O4•2H2O
△
.
CO2↑+CO↑+3H2O.点评:
本题考点: 质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 准确理解质量守恒定律,会用质量守恒定律分析反应物或生成物的组成等.1年前查看全部
- (2010•大兴区一模)用固体草酸(化学式为H2C2O4•2H2O)可以制取CO(CO难溶于水),其反应方程式为:H2C
(2010•大兴区一模)用固体草酸(化学式为H2C2O4•2H2O)可以制取CO(CO难溶于水),其反应方程式为:H2C2O4•2H2O
CO↑+CO2↑+3H2O.△ .
(1)若要制得纯净干燥的CO,可将产生的气体通过图1中的两个装置,其导管口的连接顺序是______;所盛药品依次是______、______.
(2)如图2所示装置用于获得均匀稳定气流.下列对其原理分析正确的是______(填数字序号).
①该装置也可用作暂时储存少量气体的储气装置;
②纯净的一氧化碳气体通过该装置纯度不会受影响;
③实验中的HCl气体需要稳流,可直接将该装置连入实验中;
④当两活塞的开启大小一致时,从Y 端流出气流的大小受装置中两液面差的影响;
⑤打开活塞时,由X端进入的不稳定气流靠漏斗内液面的升降调整压强大小而被缓冲. usster1年前1
usster1年前1 -
 lil29 共回答了16个问题
lil29 共回答了16个问题 |采纳率75%解题思路:(1)洗气时导管需要长进短出,浓硫酸有吸水性,氢氧化钠能够吸收二氧化碳,
(2)通过水会携带水蒸气,氯化氢极易溶于水.(1)在运用洗气装置进行除杂质时,导管的顺序要长进短出,实验室常用浓硫酸来吸收水分,用氢氧化钠来吸收二氧化碳,故答案为:baef,氢氧化钠溶液、浓硫酸.
(2)一氧化碳通过该装置是会携带水蒸气,会使纯度受到影响,所以②错了,氯化氢极易溶于水,经过该装置时,氯化氢会溶于水,而不会有气体排出,所以③错了,故选:①④⑤点评:
本题考点: 气体的净化(除杂);仪器的装配或连接;气体的干燥(除水).
考点点评: 选择科学的方法除去混合物中的杂质,也称为物质净化或提纯,是物质研究的基础.1年前查看全部
- (2011•上海)草酸晶体(H2C2O4•2H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO
(2011•上海)草酸晶体(H2C2O4•2H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )
A.
B.
C.
D.
 a4605160581年前1
a4605160581年前1 -
 bluesmith 共回答了25个问题
bluesmith 共回答了25个问题 |采纳率92%解题思路:根据草酸晶体先失水,试管口应向下倾斜;加热固体来制取气体,应选择试管,不能选择锥形瓶;熔化的草酸会流到试管口,而酒精加热部位在试管底部,会使样品无法继续受热分解;
解决了受热过程中产生水以及样品融化流动的这两个问题即可解答.A、试管口向上倾斜,水倒流进试管,会使试管底炸裂,故A错误;
B、加热固体来制取气体,应选择试管,不能选择锥形瓶,故B错误;
C、草酸熔点低,在分解之前就熔化,C装置熔化的草酸会流到试管口,而酒精加热部位在试管底部,会使样品无法继续受热分解,故C错误;
D、该装置圆满的解决了受热过程中产生水以及样品融化流动的这两个问题,由草酸晶体100℃开始失水,试管口应向下倾斜,故D正确.
故选D.点评:
本题考点: 加热反应气体性质实验装置.
考点点评: 此题考核学生对于简易气体发生装置的应用.一般对于涉及到实验装置图的选项甄别,需要仔细观察装置之间的细微差别,同时结合题干文字部分进行选择.1年前查看全部
- 一道分析化学题下列物质必须用间接法配制成标准溶液的是 .①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤
一道分析化学题
下列物质必须用间接法配制成标准溶液的是 .
①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤K2Cr2O7,⑥NaCl,⑦EDTA,⑧AgNO3 梦逸飞天1年前2
梦逸飞天1年前2 -
 dd大平 共回答了18个问题
dd大平 共回答了18个问题 |采纳率77.8%⑥NaCl1年前查看全部
- (2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它
(2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它与氢氧化钙的反应为:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O.
甲、乙两同学对草酸受热分解的产物作如下探究:
(1)猜想与假设:第一种:草酸分解生成CO2和H2;第二种:草酸分解生成CO2、CO和H2O;
第三种:草酸分解:H2C2O4→CO2↑+H2O(未配平);
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是______.
(2)设计与实验:
甲、乙两同学分别设计了下图所示的A、B两套实验装置(图中铁架台略去).
①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断______(填“严密”或“不严密”).
②乙同学的B装置图方框内的仪器未画完整,请你帮他画完整(直接画在图上或答题卡上).
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个______烧杯,有白色固体生成,证明产物中有______;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
(3)结论与思考:
①草酸受热分解的化学方程式为:H2C2O4
CO2↑+CO↑+H2O(2分);加热 ..H2C2O4.
CO2↑+CO↑+H2O(2分);加热 ..
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:______. ujdf21年前1
ujdf21年前1 -
 zpp402423 共回答了12个问题
zpp402423 共回答了12个问题 |采纳率100%解题思路:猜想生成物首先考虑元素化合价反应前后肯定有升高的也又降低的,再根据图中设计的实验和二氧化碳的性质解决其它题目.(共8分)
(1)酸受热分解若只生成二氧化碳和水,氢氧元素化合价不变,而碳元素化合价升高,所以反应后应有化合价降低的元素,所以(1)答案:(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低(1分).
(2)烧杯敞口放置在空气中空气中也有二氧化碳,时间长了烧杯内的澄清石灰水也会变浑浊,故答案:①不严密(1分)注意洗气瓶要长进短出,进气的导管要浸没液体中,出气导管只要刚刚露出橡皮塞.故答案②如右下图(长管不伸入液面下不给分,不作美观要求)(1分)
因为无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,所以草酸受热分解肯定生成二氧化碳和水,但都被吸收.到最后点燃的是一氧化碳,燃烧生成二氧化碳.故答案:内壁附有澄清石灰水(其它合理答案均给分)(1分)CO(1分)
(3)根据实验现象和前面的分析知草酸受热分解生成二氧化碳、一氧化碳、水.故答案:①H2C2O4
△
.
CO2↑+CO↑+H2O(2分);
二氧化碳能和碱石灰中的氢氧化钠反应,虽没现象但干燥管因吸收它质量增加.故答案:②称量实验前后盛有碱石灰的干燥管的质量(意思相近的表述均给分)(1分)点评:
本题考点: 实验探究物质的性质或变化规律;化学实验方案设计与评价;化学方程式的配平;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是实验探究题,综合考查到了质量守恒定律、物质的性质、化学用语相关知识.1年前查看全部
大家在问
- 1寻求“身边的数学知识”或“生活中的数学知识”
- 2圆形惯性矩公式的推导过程已经知道圆形惯性矩为:∫2*y^2(r^2-y^2)^(1/2)dy 求积分过程,不要结果!
- 3高中英语短文改错,10个,大小写不算,
- 4∫2x^2e^(-2x)dx 微积分
- 5已知点p(2,0),圆c:x² y²-6x 4y 4=0
- 6惠子之言也善譬“譬”是什么意思,王曰:“未谕也.
- 7几道数学题(求求大家了,我们老师要检查,没写的要被抄几十遍)
- 8一个长方形的公园,七是400米,宽是200米,这个公园地面积是多少平方米?合多少公顷?
- 9---同位角、内错角、同旁内角1、如(1)图,∠1和∠2是直线_____和__呗直线__所栽得的___角,∠A和∠1是直
- 10下列变化中,属于化学变化的是( )
- 11解方程x-10分之7x+15=2分之1x
- 12This is the house that Lao She lived in .可改用为什么
- 13shake one's head的缩写
- 14酵母菌、乳酸菌属于生态系统的什么成分?
- 15You look very tired___ _____ have a rest now 你看上去很累,你现在最好休息一
