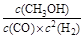汽车动力是看功率还是扭矩?像比如:“动力上,新傲虎有两种动力配备,排量分别是2.5L和3.6L的水平对置发动机.其中2.
 穿201件衣服2022-10-04 11:39:541条回答
穿201件衣服2022-10-04 11:39:541条回答像比如:“动力上,新傲虎有两种动力配备,排量分别是2.5L和3.6L的水平对置发动机.其中2.5L发动机最大功率167马力(123千瓦),最高扭矩229牛米;3.6L发动机最大功率260马力(191千瓦),最大扭矩350牛米.”
扭矩229是不是又点少了?我记得锐志的都已经280多将近300了.

已提交,审核后显示!提交回复
共1条回复
 爱到绝路 共回答了17个问题
爱到绝路 共回答了17个问题 |采纳率88.2%- 简单的说:功率是衡量汽车能开到的最高速度.功率越大,汽车的最高时速越快.
扭矩是衡量汽车的加速能力,扭矩越大,汽车加速能力越强,给人的感觉是推背感很强,百米加速用时少.
单独说功率和扭矩都不太合适.因为他们都与发动机转速有关.所以说要详细了解的话还得看发动机的工况图.
所以说,看发动机性能得综合看它的扭矩及功率,尤其是发动机低转速时的扭矩比较重要,因为日常驾驶发动机转速一般不会超过3500rpm,而最高功率一般都要到6000rpm是才达到.我个人觉得,乘用车功率较重要,而suv则扭矩较重要.
上面所说的两款发动机都还算可以,2.5的发动机扭矩在4000转就可达到229牛米.作为城市型suv足够了.不知这样的回答能否解决你的疑问. - 1年前
相关推荐
- 甲醇作为汽车动力安全吗
 星星鱼543211年前1
星星鱼543211年前1 -
 pattyjin 共回答了21个问题
pattyjin 共回答了21个问题 |采纳率90.5%“多燃料发动机智能控制系统”,加装简单方便,油路清洁的话,十分钟左右可加装完毕.加装后,甲、乙醇、汽油既可单独使用,也可任何比例的混合使用.任何电喷发动机的汽车,都可以进行这种甲醇汽车改装,而且在改装过程中,不需要对发动机做任何改造,改装后的汽车在外地如果不方便加注甲醇的话,可以加入任何比例的汽油,动力性好,对发动机无损害,比使用天然气还省钱,比使用汽油节省60%左右燃油费,市场前景广阔1年前查看全部
- (16分)甲醇是新型的汽车动力燃料。工业上可通过H 2 和CO化合制备甲醇,该反应的热化学方程式为:2H 2 (g)+C
(16分)甲醇是新型的汽车动力燃料。工业上可通过H 2 和CO化合制备甲醇,该反应的热化学方程式为:2H 2 (g)+CO(g)
 CH 3 OH(g)
CH 3 OH(g)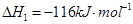
(1)已知:
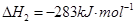


1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H 2 (g)+CO(g) CH 3 OH(g)反应速率的是 (双选)。
CH 3 OH(g)反应速率的是 (双选)。
(3)(3)用H 2 和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H 2 和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):A.分离出CH 3 OH B.升高温度 C.减小压强 D.加入合适的催化剂 
①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH 2 和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H 2 (g)+CO(g) CH 3 OH(g)的平衡常数。(写出计算过程)
CH 3 OH(g)的平衡常数。(写出计算过程) peiti331年前1
peiti331年前1 -
 37361298 共回答了15个问题
37361298 共回答了15个问题 |采纳率86.7%(1) (3分)
(3分)
(2)BD (4分)(3)①230℃(3分)
②其他条件不变,CO的平衡转化率随着H 2 与CO的起始组成比增大而增大(或:其他条件不变,CO的平衡转化率随温度升高而降低。) (2分)
(4)a点H 2 与CO的起始组成比为1.5,CO的平衡转化率为50%。(1分)
2H 2 (g)+CO(g) CH 3 OH(g)
CH 3 OH(g)
起始物质的量(mol) 1.5 1 0
转化物质的量(mol) 1 0.5 0.5
平衡物质的量(mol) 0.5 0.5 0.5
平衡浓度(mol/L) 0.5 0.5 0.5(1分) (2分)
(2分)
(1)考查盖斯定律的应用。根据已知反应可知,②+③×2-①即得到 ,所以反应热是-283kJ/mol-242 kJ/mol×2+116 kJ/mol=-651 kJ/mol.
,所以反应热是-283kJ/mol-242 kJ/mol×2+116 kJ/mol=-651 kJ/mol.
(2)考查外界条件对反应速率对影响。增大反应物的浓度或升高温度或使用催化剂等都可以加快反应速率,BD正确,AC都是降低反应速率的,答案选BD。
(3)①应用反应是放热反应,所以温度越高,转化率越低。X曲线表示的转化率最大,所以温度最低,即X表示的是230℃。
②根据图像可知,其他条件不变,CO的平衡转化率随着H 2 与CO的起始组成比增大而增大。
(4)考查平衡常数的有关计算。
a点H 2 与CO的起始组成比为1.5,CO的平衡转化率为50%
2H 2 (g)+CO(g) CH 3 OH(g)
CH 3 OH(g)
起始物质的量(mol) 1.5 1 0
转化物质的量(mol) 1 0.5 0.5
平衡物质的量(mol) 0.5 0.5 0.5
平衡浓度(mol/L) 0.5 0.5 0.5
所以 1年前查看全部
1年前查看全部
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO (g)+2H2(g)⇌CH3OH (g)△H1=-116kJ•mol-1某些化学键的键能数据如下表:
则CO中碳氧键的键能是( )化学键 C-H H-H C-O H-O 键能/kJ•mol-1 413 436 358 463
A.431kJ•mol-1
B.946kJ•mol-1
C.1072kJ•mol-1
D.1130kJ•mol-1 大大的信心1年前1
大大的信心1年前1 -
 As-time-gs-by 共回答了17个问题
As-time-gs-by 共回答了17个问题 |采纳率88.2%解题思路:依据化学反应焓变=反应物键能总和-生成物键能总和来分析.CO(g)+2H2(g)⇌CH3OH (g)的焓变=反应物总键能之和-生成物总键能之和,设CO中碳氧键的键能为X,结合图表提供的化学键的键能,则△H═X+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,解得:X=1072KJ/mol,故选C.
点评:
本题考点: 有关反应热的计算.
考点点评: 本题主要考查了反应热的计算,掌握化学反应的焓变和化学键键能之间的关系是解题的关键,难度不大.1年前查看全部
- 煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应
 煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)⇌CH3OH(g)
煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)⇌CH3OH(g)
(1)下列描述中能说明上述反应已达平衡的是______;
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(2)在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4min时候达到其限度,此时容器中压强与反应前之比为3:5,容器内物质的各种物质的量浓度如下表:
则b=______时间/浓度 c(CO)(mol/L) c(H2)(mol/L) c(CH3OH)(mol/L) 起始 0.200 0.300 0.000 第4min a b c
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图所示,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l),则负极的电极反应式为______,如果该电池工作时电路中通过1.2mol电子,则消耗CH3OH有______mol. 雪上飞20091年前1
雪上飞20091年前1 -
 zhuimengren11 共回答了18个问题
zhuimengren11 共回答了18个问题 |采纳率88.9%解题思路:(1)A、气体的总质量不变,气体的物质的量变化,根据M=[m/n]可知气体的平均摩尔质量是一个变量;
B、化学反应速率之比不等于化学计量数之比,证明正、逆速率不等;
C、对于气体而言,该反应不是一个等体积、等物质的量的反应,容器中气体的压强随着气体的物质的量的变化而变化;
D、生成n molCO的同时生成2n mol H2均代表逆反应速率;
(2)恒温恒压条件下,气体的压强与物质的量浓度成正比,利用差量法分析计算;
(3)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,据此书写电极反应式,然后根据电极反应式判断则消耗CH3OH的物质的量.(1)A、气体的总质量不变,气体的物质的量变化,根据M=[m/n]可知气体的平均摩尔质量是一个变量,当气体的平均摩尔质量保持不变,说明达到化学平衡状态,故A正确;
B、2v(H2)正=v(CH3OH)逆,化学反应速率之比不等于化学计量数之比,证明正、逆速率不等,故B错误;
C、对于气体而言,该反应不是一个等体积、等物质的量的反应,容器中气体的压强随着气体的物质的量的变化而变化,当压强不变说明处于化学平衡状态,故C正确;
D、生成n molCO的同时生成2n mol H2均代表逆反应速率,不能说明正、逆速率相等,故D错误;
故答案为:A、C;
(2)恒温恒压条件下,气体的压强与物质的量浓度成正比,平衡时气体的浓度和为:(0.200+0.300)mol/L×[3/5]=0.300mol/L,△c=0.500mol/L-0.300mol/L=0.200mol/L,
CO (g)+2H2(g)⇌CH3OH(g)△n
1 2 1 2
x 0.200mol/L
x=0.200mol/L,因此b=0.300mol/L-0.200mol/L=0.100mol/L,
故答案为:0.100;
(3)可燃物甲醇在负极失去电子生成二氧化碳,负极电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
由CH3OH~~~~6e-,
1mol6mol
0.2mol 1.2mol
故答案为:CH3OH-6e-+H2O=CO2+6H+;0.2.点评:
本题考点: 化学平衡状态的判断;化学电源新型电池.
考点点评: 本题考查知识点全面,综合性较强,涉及化学平衡状态的判定、燃料电池等知识,明确燃料电池中正负极上得失电子是解答(3)的关键,题目难度较大.1年前查看全部
- 作为汽车动力燃料的汽油,其主要成份是异辛烷.下列各式可以肯定与上述异辛烷互称为同系物的是 A.C8H18 B
作为汽车动力燃料的汽油,其主要成份是异辛烷.下列各式可以肯定与上述异辛烷互称为同系物的是 A.C8H18 B
作为汽车动力燃料的汽油,其主要成份是异辛烷。下列各式可以肯定与上述异辛烷互称为同系物的是
A.C8H18 B.C7H16 C.C6H12 D.C2H4 peeer1年前1
peeer1年前1 -
 MYGF6006 共回答了11个问题
MYGF6006 共回答了11个问题 |采纳率81.8%异辛烷是2,2,4-三甲基戊烷,通式是C8H18,因此A(同系物要差nCH2的)、C、D就可排除.1年前查看全部
- (Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H 2 化合制备甲醇,该反应的热化学方程式为:CO(g)+2H 2
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H 2 化合制备甲醇,该反应的热化学方程式为:CO(g)+2H 2 (g)
 CH 3 OH(g) △H
CH 3 OH(g) △H
已知某些化学键的键能数据如下表:化学键 C—C C—H H—H C—O C≡O H—O 键能/kJ·mol -1 348 413 436 358 1072 463
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的△H= ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH 2 ,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:反应时间/min 0 5 10 15 20 25 压强/MPa 12.6 10.8 9.5 8.7 8.4 8.4
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2v(H 2 ) 正 =v(CH 3 OH) 逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH 2
(Ⅱ)回答下列问题:
(1)体积均为100ml pH=2的CH 3 COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH 3 COOH)(填>、<或=)
(2)25℃时,CH 3 COOH与CH 3 COONa的混合溶液,若测得pH=6,则溶液中C(CH 3 COO − )-c(Na + )=____________mol·L -1 (填精确值)。 落魄的阿牛1年前1
落魄的阿牛1年前1 -
 ai逍遥 共回答了23个问题
ai逍遥 共回答了23个问题 |采纳率91.3%Ⅰ(1)-116 KJ/mol (2)0.0125mol/(L·min); 4; 减小。 (3)B C
Ⅱ(1)> (2)9.9×10 -7 ;
1年前查看全部
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,已知CO中的C与O之间为三键连接,甲醇分子中的化学键全
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,已知CO中的C与O之间为三键连接,甲醇分子中的化学键全部为单键,某些化学键的键能数据如下表:
请回答下列问题:化学键 C-C C-H H-H C-O C≡O H-O 键能/KJ•mol-1 348 413 436 358 1072 463
(1)工业制备甲醇的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H=______;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积为2L的密闭容器内充入1mol CO和2mol H2,加入合适的催化剂(体积变化忽略不计)后在250℃开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到20min时,以CO表示的平均反应速率=______,该温度下的化学平衡常数K=______,反应时间/min 0 5 10 15 20 25 压强/MPa 12.6 10.8 9.5 8.7 8.4 8.4
若升高温度则K值______(填“增大”、“减小”、或“不变”);在______(填“较高”、或“较低”)温度下有利于该反应的自发进行.
(3)下列描述中能说明上述反应已达平衡的是______(填字母代号)
A.容器内气体的平均相对分子量保持不变 B.2ν(H2)正=ν(CH3OH)逆
C.容器内气体的压强保持不变 D.容器内气体的密度保持不变. 时间的记忆1年前0
时间的记忆1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 车在水平路面上沿直线匀速行驶,汽车动力为400N,则阻力为多少?刹车过程(动力消失),则车受到的阻力为多少
 luce02161年前2
luce02161年前2 -
 只爱32 共回答了18个问题
只爱32 共回答了18个问题 |采纳率100%.这题目也太.
如果你说完了,那么根据车是匀速直线运动状态,所以汽车受到的合力为0.而汽车动力和汽车受到阻力在水平方向应该合力也为0,故汽车受到的阻力也为400N.动力消失后,汽车受到的阻力不变,直到汽车速度为0后,阻力为01年前查看全部
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)⇌CH3OH (g)△H1(反应1)该反应的原料CO和H2本身都可作为燃料提供动力,已知下列物质燃烧的热化学方程式为:
CO(g)+[1/2] O2(g)═CO2(g)△H2=-283.0kJ/mol(反应2)
2H2(g)+O2(g)=2H2O(g)△H3=-484kJ•mol-1(反应3)
2H2(g)+O2(g)=2H2O(l)△H4=-571.6KJ•mol-1(反应4)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H5=-890KJ•mol-1(反应5)
某些化学键的键能数据如下表:
请回答下列问题:化学键 C-C C-H H-H C-O C≡O(CO) H-O 键能/kJ•mol-1 348 413 436 358 1072 463
(1)反应1的焓变△H1=______.
(2)写出表示CH3OH (g)燃烧热的热化学方程式______.
(3)工业上制备甲醇反应体系中加入催化剂对反应热是否有影响?______(填“是”或“否”),原因是______.
(4)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式______. 飞车路霸1年前1
飞车路霸1年前1 -
 小九黑1 共回答了21个问题
小九黑1 共回答了21个问题 |采纳率85.7%解题思路:(1)焓变△H=反应物的总键能-生成物的总键能;
(2)甲醇的燃烧热的热化学方程式指1mol甲醇完全燃烧生成液态水放出的热量,根据反应1、2、4利用盖斯定律构成目标热化学方程式;
(3)反应热只与始态、终态有关,与反应途径无关,催化剂改变反应途径,不能改变化学反应始态和终态.
(4)根据反应4、5利用盖斯定律构成目标热化学方程式.(1)反应CO(g)+2H2(g)⇌CH3OH(g)的焓变△H1=1072kJ/mol+2×436kJ/mol-[3×413kJ/mol+358kJ/mol+463kJ/mol]=-116kJ/mol;
故答案为:-116kJ/mol;
(2)已知:CO (g)+2H2(g)⇌CH3OH (g)△H1=-116kJ/mol (反应1)
CO(g)+[1/2] O2(g)═CO2(g)△H2=-283.0kJ/mol(反应2)
2H2(g)+O2(g)=2H2O(l)△H4=-571.6KJ/mol(反应4)
根据盖斯定律,反应2-反应1+反应4得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-738.6KJ/mol
故答案为:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-738.6KJ/mol;
(3)反应热只与始态和终态能量有关,与反应途径无关,催化剂改变反应途径,不能改变化学反应始态和终态能量,加入催化剂对反应热没有影响;
故答案为:否,催化剂不能改变化学反应始态和终态的能量;
(4)已知:2H2(g)+O2(g)=2H2O(l)△H4=-571.6KJ•mol-1(反应4)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H5=-890KJ•mol-1(反应5)
根据盖斯定律,2×反应4-反应5得:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.2KJ•mol-1;
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.2KJ•mol-1.点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 考查反应热的计算、热化学方程式书写、盖斯定律等,难度中等,注意对盖斯定律的理解.1年前查看全部
- 在C、O2、H2、CO、CH4五种物质中:可用于汽车动力的高能无污染的燃料是______;能使带火星的木条复燃的是___
在C、O2、H2、CO、CH4五种物质中:可用于汽车动力的高能无污染的燃料是______;能使带火星的木条复燃的是______;既有可燃性又有还原性的气态化合物是______;天然气的主要成分是______.
 fansun5151年前1
fansun5151年前1 -
 sunsky2008 共回答了25个问题
sunsky2008 共回答了25个问题 |采纳率84%解题思路:物质的性质决定物质的用途,根据常见气体的性质与用途进行分析解答即可.氢气燃烧产物是水,燃烧放出大量的热,是可用于汽车动力的高能无污染的燃料.
氧气能支持燃烧,能使带火星的木条复燃.
一氧化碳既有可燃性又有还原性,属于气态化合物.
天然气的主要成分是甲烷,其化学式为:CH4.
故答案为:H2;O2;CO;CH4.点评:
本题考点: 常见气体的用途.
考点点评: 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.1年前查看全部
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H 2 化合制备甲醇,该反应的热化学方程式为: CO(g)+2H 2 (
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H 2 化合制备甲醇,该反应的热化学方程式为: CO(g)+2H 2 (g)
 CH 3 OH (g) △H 1 (反应Ⅰ)
CH 3 OH (g) △H 1 (反应Ⅰ)
该反应的原料CO和H 2 本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O 2 (g)=CO 2 (g) △H 2 =-283 kJ·mol -
O 2 (g)=CO 2 (g) △H 2 =-283 kJ·mol - 1 (反应Ⅱ)
1 (反应Ⅱ)
H 2 (g)+ O 2 (g)=H 2 O(g) △H 3 =-242 kJ·mol -1 (反应Ⅲ)
O 2 (g)=H 2 O(g) △H 3 =-242 kJ·mol -1 (反应Ⅲ)
某些化学键的键能数据如下表:
请回答下列问题:化学键 C-C C-H H-H C-O C 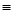 O
OH-O 键能/kJ·mol -1 348 413 436 358 1072 463
⑴反应Ⅰ的焓变△H 1 = 。
⑵CH 3 OH (g)燃烧生成CO 2 (g)和H 2 O(g)的热化学方程式为:
CH 3 OH(g)+ O 2 (g)=CO 2 (g)+2H 2 O(g) △H 4
O 2 (g)=CO 2 (g)+2H 2 O(g) △H 4
该反应的焓变△H 4 = 。
与CO和H 2 相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是 。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH 3 OH(l)+ O 2 (g)=CO 2 (g)+2H 2 O(l)。其工作原理示意图如下:
O 2 (g)=CO 2 (g)+2H 2 O(l)。其工作原理示意图如下: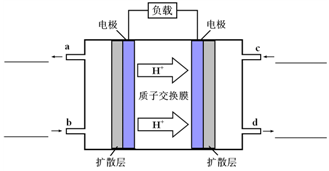
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化 学式)
学式)
②负极的电极反应式为 。 生产llsc1年前1
生产llsc1年前1 -
 丹丹angel 共回答了16个问题
丹丹angel 共回答了16个问题 |采纳率87.5%1年前查看全部
- 汽车动力和速度是什么区别?动力是不是指汽车的力量?速度就是汽车行驶的快慢呗?
汽车动力和速度是什么区别?动力是不是指汽车的力量?速度就是汽车行驶的快慢呗?
传动比和速比(速比一般是指后桥的吧)我感觉是成正比的啊.就是传动比大,汽车动力和载荷大,速度相对慢.而速比大,汽车业是载重大,这两个指标是不是一样啊? 打错了5201年前1
打错了5201年前1 -
 a63036 共回答了23个问题
a63036 共回答了23个问题 |采纳率91.3%动力就是发动机的功率,说通俗点就是发动机的劲,而速度则是该发动机做功在特定时间内所行驰的距离,也就是我们说的码,他们之间成正比.1年前查看全部
- 一辆汽车沿平直的公路行驶,汽车动力2000牛,它所受阻力1200牛.则汽车所受合力大小为多少牛
一辆汽车沿平直的公路行驶,汽车动力2000牛,它所受阻力1200牛.则汽车所受合力大小为多少牛
方向与汽车行驶的方向 相同还是不相同? yinling1年前1
yinling1年前1 -
 错爱zhe 共回答了15个问题
错爱zhe 共回答了15个问题 |采纳率86.7%两相加 相同1年前查看全部
- ( )不是汽车动力转向左右转向力不一致的原因是 A缺液压油或滤油器堵塞 B分配阀的滑阀偏离中间位置
( )不是汽车动力转向左右转向力不一致的原因是 A缺液压油或滤油器堵塞 B分配阀的滑阀偏离中间位置
C分配阀的滑阀虽然在中间但与阀体台阶的间隙大小不一致
D滑阀内有赃物阻滞 shengqi1年前1
shengqi1年前1 -
 tianguangjuna 共回答了21个问题
tianguangjuna 共回答了21个问题 |采纳率90.5%d1年前查看全部
- (2010•浙江)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO
(2010•浙江)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)⇌CH3OH (g)△H1(反应1)该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:CO(g)+
O2(g)=CO2(g)△H2=-283kJ•mol-1(反应2)H2(g)+1 2
O2(g)=H2O(g)△H3=-242kJ•mol-1(反应3)1 2
某些化学键的键能数据如下表:
请回答下列问题:化学键 C-C C-H H-H C-O C≡O H-O 键能/kJ•mol-1 348 413 436 358 1072 463
(1)反应1的焓变△H1=______.
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(g)△H4该反应的焓变△H4=______.与CO和H2相比,甲醇作为汽车动力燃料的优点是______.
(3)反应1的平衡常数表达式为K=c(CH3OH) c(CO)×c2(H2) K=.为提高甲醇的产率,可以采取的措施有______(写出3点).既能提高产率,又能提高反应速率的措施是______.c(CH3OH) c(CO)×c2(H2)
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l).其工作原理如示意图: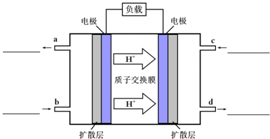
①在图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为______. songhandan1年前1
songhandan1年前1 -
 浮萍1986 共回答了18个问题
浮萍1986 共回答了18个问题 |采纳率83.3%解题思路:(1)反应CO(g)+2H2(g)
CH3OH (g)△H1 的焓变可以根据表内的化学键键能计算,焓变=反应物键能总和-生成物键能总和;高温 .
(2)依据(1)反应热化学方程式和题干一氧化碳燃烧热化学方程式、氢气燃烧热化学方程式,结合盖斯定律计算得到;
(3)依据平衡常数的概念分析写出,依据化学平衡影响因素和平衡移动原理分析判断;
(4)甲醇-空气燃料电池是甲醇和氧气反应的氧化还原反应,甲醇在反应中失去电子发生氧化反应在原电池中做负极,反应生成二氧化碳,氧气再正极上得到电子生成氢氧根离子,依据质子交换最终生成水;电极反应依据电池反应和正极电极反应计算得到.(1)CO(g)+2H2(g)
高温
.
CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,)△H1=C≡O+2H-H-(3C-H+C-O+H-O)=1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,故答案为:-116 kJ•mol-1;
(2)①CO(g)+2H2(g)⇌CH3OH (g),△H1=-116 kJ•mol-1 (反应Ⅰ)
②CO(g)+[1/2]O2(g)=CO2(g)△H2=-283kJ•mol-1 (反应Ⅱ)
③H2(g)+[1/2]O2(g)=H2O(g)△H3=-242kJ•mol-1 (反应Ⅲ)
根据盖斯定律③×2+②-①得到:
CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2O(l)△H4=-651 kJ•mol-1,
故答案为:-651 kJ•mol-1 ;与CO和H2相比,甲醇作为汽车动力燃料的优点是:单位体积供能量多;密度大易于运输;单位产能耗氧量较少;
故答案为:单位体积供能量多;密度大易于运输;单位产能耗氧量较少;
(3)CO(g)+2H2(g)⇌CH3OH (g),△H1=-116 kJ•mol-1 (反应Ⅰ)
平衡常数K=
c(CH3OH)
c(CO)×c2(H2);提高甲醇的产率需要平衡正向进行,反应是放热反应,是气体体积减小的反应,所以,降低温度;增加反应气体的压强;将反应生成的甲醇及时冷凝从反应体系中移去;
故答案为:K=
c(CH3OH)
c(CO)×c2(H2);降低温度、增加反应气体的压强、将反应生成的甲醇及时冷凝从反应体系中移去;增加反应气体的压强;
(4)①甲醇-空气燃料电池是甲醇和氧气反应的氧化还原反应,甲醇在反应中失去电子发生氧化反应在原电池中做负极,反应生成二氧化碳,氧气再正极上得到电子生成氢氧根离子,依据质子交换最终生成水;所以a放出CO2;b通入甲醇水溶液;c通入O2;d流出水;标注如图:
②电池反应为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);
电池正极反应为:O2+4H++4e-=2H2O;
电池反应-正极反应×3得到负极电极反应为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+;
故答案为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+.点评:
本题考点: 反应热和焓变;化学电源新型电池;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查了化学反应的反应热的计算、原电池的产物判断和电极判断,电极反应,盖斯定律的计算应用,理解概念是关键,原电池原理是常考重点,题目难度中等.1年前查看全部
- “汽车动力比阻力小1000N”是什么意思?
“汽车动力比阻力小1000N”是什么意思?
26、一辆汽车不小心陷进了泥潭中,司机按图11所示的甲、乙两种方法安装滑轮,均可将汽车从泥潭中拉出,如果汽车的动力比阻力小1000N,则甲图人匀速拉动汽车的拉力至少为 N,其中比较省力的是 图.(绳与滑轮间的摩擦不计)
tu
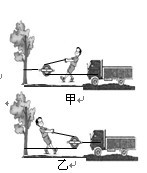
 yanlt0231年前1
yanlt0231年前1 -
 wsypy520 共回答了23个问题
wsypy520 共回答了23个问题 |采纳率91.3%甲图人匀速拉动汽车的拉力至少为1000 N,其中比较省力的是 乙 图
汽车动力比阻力小1000N,运动过程中,汽车的牵引力F=f+1000N,人要通过滑轮克服这1000N,
的力,甲图定滑轮,至少施加1000N,乙是动滑轮会省力.1年前查看全部
- 甲醇是一种新型的汽车动力燃料,工业上可通过CO(CO的结构式为C≡O)和H2化合制备甲醇,该反应的热化学方程式为:①CO
甲醇是一种新型的汽车动力燃料,工业上可通过CO(CO的结构式为C≡O)和H2化合制备甲醇,该反应的热化学方程式为:①CO (g)+2H2(g)⇌CH3OH(g)△H1
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:②CO(g)+[1/2]O2(g)═CO2(g)△H2=-283kJ•mol-1
③H2(g)+[1/2]O2(g)═H2O (g)△H3=-242kJ•mol-1,断开1mol某些化学键所需的最低能量数据如下表:
请回答下列问题:化学键 C-C C-H H-H C-O C O H-O 能量/kJ•mol-1 348 413 436 358 1072 463
(1)反应①的焓变△H1=______.
(2)CH3OH(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(g)△H4,该反应的焓变△H4=______.与CO的H2相比,甲醇作为汽车动力燃料的优点是______.
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的电动汽车的车载电池,该燃料电池的电池反应为CH3OH(1)+[3/2]O2(g)═CO2(g)+2H2O(1).已知电解质溶液为H2SO4溶液,则电池的负极反应式为______. 无病无灾1年前1
无病无灾1年前1 -
 lixueming304 共回答了13个问题
lixueming304 共回答了13个问题 |采纳率76.9%解题思路:(1)依据化学反应焓变=反应物键能总和-生成物键能总和计算;
(2)已知①CO (g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,
②CO(g)+[1/2]O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+[1/2]O2(g)═H2O (g)△H3=-242kJ•mol-1,
根据盖斯定律计算CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(g)△H4;甲醇易于运输,燃烧耗氧少;
(3)酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子.(1)CO(g)+2H2(g)⇌CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,△H═1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,
故答案为:-116 kJ•mol-1;
(2)已知①CO (g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,
②CO(g)+[1/2]O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+[1/2]O2(g)═H2O (g)△H3=-242kJ•mol-1,
根据盖斯定律②-①+③×2得CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(g)△H4=-283-(-116)+(-242)×2=-651kJ•mol-1,
常温下甲醇为液体,与CO、氢气相比较,甲醇易于运输,而且甲醇燃烧耗氧少;
故答案为:-651kJ•mol-1;易于运输,单位产能耗氧量较少;
(3)酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,则负极的电极反应式为CH3OH+H2O-6e-═CO2+6H+;
故答案为:CH3OH+H2O-6e-═CO2+6H+.点评:
本题考点: 有关反应热的计算;化学电源新型电池.
考点点评: 本题考查了键能和反应热的计算、盖斯定律的应用、燃料电池中电极方程式的书写,题目难度中等,注意把握负极上的反应物和产物以及盖斯定律的含义.1年前查看全部
- 甲醇(CH 3 OH)作为新型汽车动力燃料,以下是甲醇在工业上的制备和生活中的应用。 请填空:
甲醇(CH 3 OH)作为新型汽车动力燃料,以下是甲醇在工业上的制备和生活中的应用。 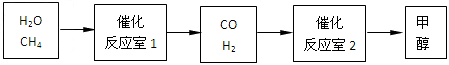
请填空:
(1)在压强为0.1MPa条件下,反应室2(容积为VL)中a mol CO与2a mol H 2 在催化剂作用下反应生成甲醇:CO (g) +2H 2 (g) CH 3 OH (g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH 3 OH (g),CO的平衡转化率与温度、压强的关系如图所示,则: 
①一定条件下的密闭容器中,该反应到达平衡,要提高CO的转化率可以采取的措施是_______ (填字母代号)
A.高温高压B.加入催化剂C.增加CO的浓度D.增大氢气的浓度 E分离出甲醇
②在压强P1、100℃时,CH 3 OH(g) CO(g) + 2H 2 (g)反应的平衡常数为________(用含a、V的代数式表示)
CO(g) + 2H 2 (g)反应的平衡常数为________(用含a、V的代数式表示)
③将一定量的NO 2 与SO 2 置于绝热恒容密闭容器中发生NO 2 (g)+SO 2 (g) SO 3 (g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
SO 3 (g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。 
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO 2 的消耗量:a~b段大于b~c段
(2)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H 2 和O 2 为原料制取过氧化氢的新工艺。原理如图所示:请写出甲电极的电极反应式:________________________。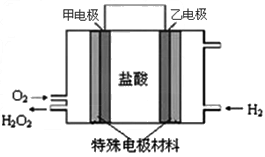
(3)若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇燃料电池利理论上可提供________mol电子的电量。(已知甲醇的燃烧热为725.76 kJ/mol)
(4)已知在常温常压下:
①2CH 3 OH (l)+3O 2 (g) == 2CO 2 (g)+4H 2 O (g) ΔH1=-1275.6 kJ/mol
②2CO (g)+O 2 (g) == 2CO 2 (g)ΔH2=-566.0 kJ/mol
③H 2 O (g) = H 2 O (l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________。 scleslie1年前1
scleslie1年前1 -
 fengying001 共回答了16个问题
fengying001 共回答了16个问题 |采纳率93.8%(1)①DE;② a 2 / V 2 ;③C
(2)2H + +O 2 +2e - =H 2 O 2
(3)12
(4)CH 3 OH(l)+O 2 (g) == CO(g)+2H 2 O(l)ΔH=-442.8 kJ/mol1年前查看全部
- 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3O
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH (g)△H1=-116kJ•mol-1
(1)下列措施中有利于提高反应速率的是______(双选,填字母).
A.移去部分CH3OHB.减小压强C.通入COD.加入催化剂
(2)已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ•mol-1H2(g)+1 2
O2(g)=H2O(g)△H3=-242kJ•mol-11 2
写出1mol甲醇燃烧生成CO2和水蒸气的热化学方程式CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1
(3)为研究合成气最合适的起始组成比,在1L容器中,分别在230℃、250℃和270℃下,改变CO和 H2的起始组成比(设起始时CO的物质的量为1mol ),结果如图:
①230℃的实验结果所对应的曲线是______(填字母).
②从图中可以得出的结论是______.(写一条)
③在270℃时,当CO的转化率为50%时,计算反应CO(g)+2H2(g)⇌CH3OH (g)的平衡常数(写出计算过程,保留2位小数)______. zhanlang10211年前1
zhanlang10211年前1 -
 NNDYE 共回答了12个问题
NNDYE 共回答了12个问题 |采纳率100%解题思路:(1)提高反应速率可增大浓度、压强、温度或加入催化剂;
(2)利用盖斯定律计算反应热;
(3)①正反应放热,则升高温度CO的转化率降低;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大;
③计算出平衡时各物质的浓度,结合K=
计算.c(CH3OH) c(CO)•c2(H2) (1)提高反应速率可增大浓度、压强、温度或加入催化剂,则C、D正确,而移去部分CH3OH、减小压强可减小反应速率,故答案为:CD;
(2))①根据反应①CO(g)+2H2(g)⇌CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+[1/2]O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+[1/2]O2(g)═H2O(g)△H3=-242kJ•mol-1,
根据盖斯定律:①-②-③×2得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(3)①根据该反应为放热反应,温度越高CO的转化率越小,所以曲线X为230℃,故答案为:X;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大,故答案为:温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大;
③由图象可知当270℃、CO的转化率为50%时,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)⇌CH3OH (g)
起始(mol/L) 1 1.5
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
c(CH3OH)
c(CO)•c2(H2)=
0.5
0.5×0.52=4.00,
故答案为:4.00.点评:
本题考点: 转化率随温度、压强的变化曲线;热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查化学平衡问题,侧重于学生的分析和计算能力的考查,为高考常见题型和高频考点,注意把握图象曲线的变化趋势,把握平衡常数的计算方法,难度中等.1年前查看全部
- 高一 化学 原电池燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为
高一 化学 原电池
燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为2H2-4e-+4OH-4H2O,O2+2H2O+4e-4OH-
燃料电池在发电的同时还合成了水,这正好解决了宇航员在太空中饮水的问题.若电池输出的电流强度为533 A,则每小时能合成多少克水?
求过程
问题补充: 每个电子所带的电量为1.6x10的负19次方。Q=It t37bl1年前1
t37bl1年前1 -
 过来过来 共回答了18个问题
过来过来 共回答了18个问题 |采纳率83.3%电流强度 I=533A
根据I=Q/t
Q=It=533x3600=1.92x10^6 C
转移电子的物质的量n=Q/F=1.92x10^6/96500mol=19.9mol
由于每生成1mol水需要2mol电子,则生成水9.95mol
则生成水180g1年前查看全部
大家在问
- 1括号里应该填个什么词?在下面括号中填一个英文单词..I ( ) you!如:I (love) you!
- 2求印度语学习入门,基本语法.1)在印度语中你我他/她分别是怎么写的.2)main tumse pyaar karti h
- 3已知:如图,BF⊥AC于点F,CE⊥AB于点E,且BD=CD
- 4《你曾去过哪个地方?那里都有什么景点或设施?你玩得高兴吗?你还想去吗?根据提示写一篇,60词的英语作文
- 5词语手拉手,搭配结对 词语手拉手,搭配结对子.我们一起试一试!
- 6若三角形ABC三边满足A的平方+B的平方+C的平方+50=10A+8B+6C,则三角形的面积为多少?
- 7某空瓶装满水的总质量为184克,如果在瓶中放入金属片,然后装满水,称得总质量为218克,取出金属片后,总
- 8幼儿园有三个班,大班有38名小朋友,中班有42名小朋友,一次把600块糕点按人数平均分给小朋友,三个班各分
- 9右图是正方体平面展开图,在这个正方体中:
- 10已知在梯形ABCD中,AB//CD,对角线AC、BD相交于点E,对角线BD=AD,AC=AB,且角ADB=90度,求(1
- 11已知正数x,y,z满足x+2y+3z=1,则[1/x+2y]+[4/2y+3z]+[9/3z+x]的最小值为______
- 12阅读下列材料按要求作文一只乌龟被海水冲到岸边的一块礁石旁,乌龟好奇地问,你待在这里一动不动.不孤独吗?礁石回答,我已在这
- 13某实验小组的同学在实验室处理含有硝酸银的废液时,他们利用金属和盐溶液反应的知识回收银,将一定量的锌粉和铁粉加入到废液中,
- 14求:英语五年级上pep版试卷
- 15场子里一片喧哗.台上,项碗少年呆呆地站着,脸上全是汗珠,他有些不知所措了.还是那一位姑娘,走出来扫