电导,磁场强度,磁通量,磁通量密度等使用符号(不是指单位符号).
 北海飘鱼2022-10-04 11:39:541条回答
北海飘鱼2022-10-04 11:39:541条回答
电导,磁场强度,磁通量,磁通量密度等使用符号(不是指单位符号).
电导,磁场强度,磁通量,磁通量密度,磁感应强度名称的符号,不是指单位名称的符号.
电导,磁场强度,磁通量,磁通量密度,磁感应强度名称的符号,不是指单位名称的符号.

已提交,审核后显示!提交回复
共1条回复
 zhebeilang 共回答了20个问题
zhebeilang 共回答了20个问题 |采纳率95%- 电导一个圆圈顶部有个小尾巴,
磁场强度:H
磁通量一个圆圈中间加一个竖线.
磁感应强度:B
打不出来很郁闷
楼上的说得是电阻率,电导是电阻率的倒数.
磁场强度和磁感应强度是两回事.不能乱说 - 1年前
相关推荐
- 1.为什么测定溶液的电导要用交流电源?
1.为什么测定溶液的电导要用交流电源?
2.标准电位和条件电位的区别?
3.影响电位的外界因素有哪些?
可以回答其中的任何一个问题.快者即可得分.
最好是多回答,多答一个加分50分!
如果回答全部3个问题,可以得到150分! fack0081年前1
fack0081年前1 -
 21013172 共回答了27个问题
21013172 共回答了27个问题 |采纳率96.3%测量电解质溶液的电阻时不能用直流电源,因为直流电通过电解质溶液时由于电解作用改变了电解质溶液的浓度和性质.一般采用Wheatstone(惠斯顿)交流电桥法测定电解质溶液的电阻1年前查看全部
- 在电工学中常用物理量“电导”(符号为 G )来表示导体的导电能力。导电能力强,则电导 G 的值大;导电能力弱,则电导 G
在电工学中常用物理量“电导”(符号为 G )来表示导体的导电能力。导电能力强,则电导 G 的值大;导电能力弱,则电导 G 的值小。对于同一导体,其电导 G 和电阻 R 的关系为 G =1/R。现有甲、乙两个导体,已知导体甲的电导为 G 1 ,导体乙的电导为 G 2 ,请推导出导体甲和导体乙串联时的总电导 G 总 .
 JerryZhi1年前1
JerryZhi1年前1 -
 QQ1stcup 共回答了14个问题
QQ1stcup 共回答了14个问题 |采纳率100%G 1 G 2 /(G 1 +G 2 )
由于电导和电阻是互为倒数关系,所以电阻R="1/G"
,则导体甲的电阻为R 1 ="1" /G 1 ;导体乙电阻为R 2 ="1" /G 2 .根据串联电阻的规律:在串联电路中,串联总电阻等于各串联电阻之和,即R 串 =R 1 +R 2 ,这样求出R串的表达式以后,再将它倒过来就可以了.由G=1/R得:G 1 =1/R 1 G 2 =1/R 2 (1分)
∴R 1 =1/G 1 R 2 =1/G 2 R 总 =1/G 总 (1分)
根据串联电路电阻关系:R 总 =R 1 +R 2 (2分)
∴1/G 总 =1/G 1 +1/G 2 (1分)
∴G 总 =G 1 G 2 /(G 1 +G 2 ) (1分)1年前查看全部
- 电导滴定时,为何要先用水稀释待测HCl,HAc溶液?
 美的心情1年前2
美的心情1年前2 -
 兔子不日鸡 共回答了13个问题
兔子不日鸡 共回答了13个问题 |采纳率84.6%如果不稀释HCl的话,开始的电导率很大,需要滴入大量的碱,浪费而且不容易滴定到滴定终点.1年前查看全部
- 现有一套反渗透,电导逐渐升高,是怎么回事?
现有一套反渗透,电导逐渐升高,是怎么回事?
现有一套反渗透50t/h,运行2年,起初产水电导在80左右,最近半年产水电导逐渐上升,现在已达到156,.具体数据如下:
原水电导 产水电导 膜前压力 膜中压力 膜后压力 回收率
2010.12 9999 135 1.25 1.0 0.95 69%
2011.03 9999 156 0.9 0.83 0.8 69%
进水电导在1万以上,表读不出来.水质为苦咸水,沿海.总硬1676 钙(CaCO3计)740总碱190 氯离子848,
整个系统电导逐渐上升,整体压力逐渐下降,请大家指教该如何抑制电导率继续上升, zj322690781年前4
zj322690781年前4 -
 我叫景飒 共回答了16个问题
我叫景飒 共回答了16个问题 |采纳率81.3%有两点建议:1、监测下原水水质,是否达到进入反渗透膜前的要求,查阅下12月的原水水质和3月的原水水质是否有变化;2、检查你的反渗透装置,看看元器件等是否良好,我看你的膜前压力和膜中压力差值减小,是否是由于部件损耗引起的.并且整体压力都有所下降.1年前查看全部
- 摩尔电导——有这个说法么若在相距一米的电极,面积为1平方米电极之间放置含有1摩尔的电解质溶液,此溶液的电导称为摩尔电导.
摩尔电导——有这个说法么
若在相距一米的电极,面积为1平方米电极之间放置含有1摩尔的电解质溶液,此溶液的电导称为摩尔电导.——这句话对么
当溶液浓度无限稀释是,正负离子之间的影响趋于零,摩尔电导率趋于最大值——这句话又该怎么理解 gjrboy1年前4
gjrboy1年前4 -
 寻找失去的时间 共回答了23个问题
寻找失去的时间 共回答了23个问题 |采纳率78.3%通过f(L,n,e)=0的导出,说明现行物理化学教材中关子摩尔电导定义的缺陷如同把速度常数和单位浓度时的反应速率混为一谈;并提出新的定义——单位梯度下单位线浓度(n/e)的电流强度叫摩尔电导.进而导出摩尔电导和当量电导是等同的物理量.1年前查看全部
- 溶液电导率问题测溶液电导率的时候,采用自来水配的溶液,测出来溶液的电导率为A,而自来水本身的电导率为B,那溶液实际的电导
溶液电导率问题
测溶液电导率的时候,采用自来水配的溶液,测出来溶液的电导率为A,而自来水本身的电导率为B,那溶液实际的电导率应该是多少?是A-B吗? 石鲁生1年前2
石鲁生1年前2 -
 执子之手_ 共回答了19个问题
执子之手_ 共回答了19个问题 |采纳率89.5%水溶液的电导率高低相依于其内含溶质盐的浓度,或其它会分解为电解质的化学杂质.由于自来水非纯净水,其内含有大量Cl离子,可以诱导水分子的水解,从而大大提高了溶液的电导率,由于离子诱导效应的出现,所以溶液实际的电导率不是A-B.1年前查看全部
- 反渗透产水电导较高.急求帮助采用2段 进水电导为1000左右 段间为1500左右 测浓水电导也为1500左右 浓水电导和
反渗透产水电导较高.急求帮助
采用2段 进水电导为1000左右 段间为1500左右 测浓水电导也为1500左右 浓水电导和二段差不多 二段每支膜电导都在300多 请问是什么原因 膜背压还是膜o型圈坏了 有室无家的30BOY1年前2
有室无家的30BOY1年前2 -
 delta0001 共回答了17个问题
delta0001 共回答了17个问题 |采纳率76.5%你的麻烦大了
膜被氧化的可能性比较大
做一下膜解剖分析就知道了1年前查看全部
- 电导率仪测出来的数据是电导值还是电导率?第三档用不用读数*量程?量程是多少?
 付小平1年前1
付小平1年前1 -
 catkuan 共回答了19个问题
catkuan 共回答了19个问题 |采纳率84.2%电导率仪测出来的数据是电导率.不用读数+量程.量程多少是可以设置的,看你电极的电极常数.电极常数不同,量程不同.可以咨询合肥卓尔1年前查看全部
- (2010•庐江县模拟)在电工学中常用物理量“电导”(符号为G)来表示导体的导电能力,导电能力强.则电导G的值大;导电能
(2010•庐江县模拟)在电工学中常用物理量“电导”(符号为G)来表示导体的导电能力,导电能力强.则电导G的值大;导电能力弱,则电导G的值小,对于同一导体,其电导G和电阻R的关系为G=1/R.现有甲、乙两个导体,已知导体甲的电导为G1,导体乙的电导为G2,则导体甲和导体乙串联时的总电导G串=______.
 sxlb9291年前0
sxlb9291年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 溶液稀释后电导值按比例降低吗溶液稀释后电导值变化某溶液用高纯水稀释10倍,其电导值就减少为原来的十分之一?
 3317756781年前1
3317756781年前1 -
 gfjy1125 共回答了13个问题
gfjy1125 共回答了13个问题 |采纳率84.6%不一定.
要看溶质的性质.有些物质在高浓度时不会完全解离,稀释后解离比例会增加,所以电导变化就不是线性的.1年前查看全部
- 电导的测定为什么用铂黑电极,使用时应注意哪些问题?
 xx雨夜12341年前1
xx雨夜12341年前1 -
 何义安 共回答了25个问题
何义安 共回答了25个问题 |采纳率96%实验原理:1.电离平衡常数Kc的测定原理在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务.在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为,可以用离子的极限摩尔电导率相加而得.而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力.二者之间有如下近似关系:(1)式中为弱电解质的电离度.对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:CH3COOH →CH3COO- + H+ 起始浓度 c 0 0 平衡浓度 c(1-α) cα cα则 (2) 以式(1)代入上式得:(3)因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc.将式(2)整理后还可得:(4)由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将∧mc对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内的平均值.2.摩尔电导率∧m的测定原理电导是电阻的倒数,用G表示,单位S(西门子).摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极1年前查看全部
- 求电导法测乙酸乙酯的速率常数的思考题 为什么G0可以是0.01mol的NAOH的电导?
求电导法测乙酸乙酯的速率常数的思考题 为什么G0可以是0.01mol的NAOH的电导?
用G0-Gt比Gt-Gt-G无穷,怎样求G无穷,用最简便的方法?
 pczhz1年前1
pczhz1年前1 -
 hl0330 共回答了16个问题
hl0330 共回答了16个问题 |采纳率100%G∞的测量 实验测定中,不可能等到t→∞,故通常以0.0100mol/LCH3COONa溶液的电导值作为G∞,G∞的测量方法与G0相同.必须注意,每次更换电导池中的溶液时,都要先用电导水淋洗电极和电导池,然后再用被测溶液淋洗三次.
在一定范围内,可以认为体系的电导值的减少量与CH3COONa的浓度x 的增加量成正比,即
t=t时,x=b(G0-Gt)
t=∞时,c=b(G0-G∞)
则kt=b(G0-Gt)/cb[(G0-G∞)-
(G0-Gt)]= (G0-Gt)/c (G0-G∞)
或 ckt= (G0-Gt)/(G0-G∞)
以(G0-Gt)/(G0-G∞)对t作图应得一直线,由斜率即可求出反应速率常数k值.1年前查看全部
- 摩擦生电 电导已知:丝绸摩擦过的玻璃棒所带的电,叫做正电;与用毛皮摩擦过的橡胶棒带的电,叫做负电.那就是说玻璃棒和毛皮都
摩擦生电 电导
已知:丝绸摩擦过的玻璃棒所带的电,叫做正电;与用毛皮摩擦过的橡胶棒带的电,叫做负电.
那就是说玻璃棒和毛皮都容易丢电子喽,而且电导体的一个属性是:有大量易丢失的电子,那么为什么玻璃棒和毛皮不是很好的电导体?
困扰了好长时间了 woaini13131313131年前5
woaini13131313131年前5 -
 zhusiqun 共回答了10个问题
zhusiqun 共回答了10个问题 |采纳率100%这里的易丢失是有前提的:就是得有其它材料与它接触并摩擦.
而导电只是在物体两端加上电压,在没有东西与它摩擦的情况下,玻璃中的电子并不能跳过分子之间的间隔,达到导电的目的.
就象一个里面冰冻的水管,从两端你都能捞到一点水,但是它还是通不了水.1年前查看全部
- 求 I1,I2,I3 等于多少?最上面一条支路(即电导为3S左边的箭头为I2),最左边和最右边的支路上箭头分别是I2和I
求 I1,I2,I3 等于多少?最上面一条支路(即电导为3S左边的箭头为I2),最左边和最右边的支路上箭头分别是I2和I3.还有那个电压受控源是 (1/8)I1 .I1=8A ..I2=0A..I3=2A.是用节点分析法吧?
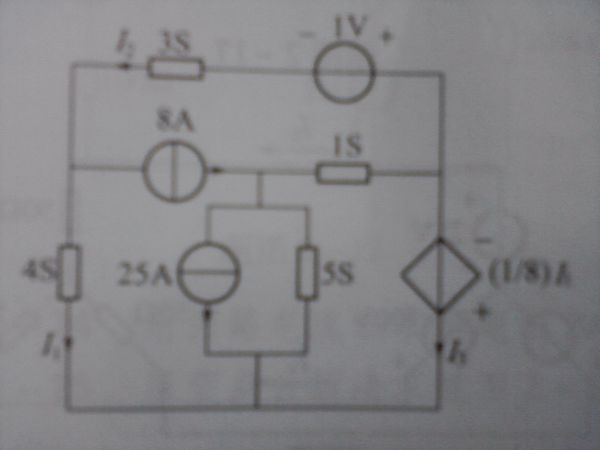
 秦屺1年前1
秦屺1年前1 -
 斑点星星 共回答了22个问题
斑点星星 共回答了22个问题 |采纳率86.4%为什么插入不了图?没有图可说不清楚 ,给我一个邮箱我把答案发给你1年前查看全部
- 电导是电阻的倒数,电纳是什么的倒数.它是电抗的倒数吗?好像不是吧.
 dahuan23451年前1
dahuan23451年前1 -
 春去春回来CC 共回答了17个问题
春去春回来CC 共回答了17个问题 |采纳率88.2%是的,正如电导是电阻的倒数一样,电纳是电抗的倒数,表示电容或电感对交流电的导电能力,单位是“西门子”(S).1年前查看全部
- 急,201×4(711)强碱性苯乙烯系阴离子交换树脂与上样溶液电导有关系吗?其吸附和解吸附的机理和条件各有
 偷走你的忧伤1年前3
偷走你的忧伤1年前3 -
 城市木头虫 共回答了14个问题
城市木头虫 共回答了14个问题 |采纳率78.6%与电导当然有关系,吸附原理就是通过官能团的OH根置换了溶液中的阴根离子,置换饱和后,再用4%NaOH料液再生1年前查看全部
- 关联参考方向下,电阻的电导各代表什么物理意义?希望能说出3条,
关联参考方向下,电阻的电导各代表什么物理意义?希望能说出3条,
说错了,是电导大于九十度的物理意义 yelland181年前1
yelland181年前1 -
 HIYOU就是你 共回答了22个问题
HIYOU就是你 共回答了22个问题 |采纳率95.5%电阻率的倒数为电导率
所以电导率越高 物体的导电性能越好
欧姆定律的微分形式用电导率联系了 电场与电流密度
电导率有微观意义吧,正比于载流子浓度和平均自由程的乘积1年前查看全部
- 电导率仪是可以测定电导值么,可以直接读出电导值么
电导率仪是可以测定电导值么,可以直接读出电导值么
如题 wangdongen1年前1
wangdongen1年前1 -
 xuhangcheng 共回答了25个问题
xuhangcheng 共回答了25个问题 |采纳率80%是的,只要调整好之后,直接测定读数,很简单的1年前查看全部
- 电导测定中蒸馏水的电导是否应考虑
 weiw19991年前1
weiw19991年前1 -
 南宫寒傲 共回答了21个问题
南宫寒傲 共回答了21个问题 |采纳率95.2%蒸馏水的电导为0.0002 S/m 如果你测量出的电导很大,可以忽略,如果这个数量级差不多就不能忽略1年前查看全部
- 电导法为什么不适合测非离子型表面活性剂的临界胶束浓度
 陈亦逸1年前1
陈亦逸1年前1 -
 xiajianbof 共回答了16个问题
xiajianbof 共回答了16个问题 |采纳率75%电导法测量表面活性剂临界胶束浓度的原理是:离子型表面活性剂在水中电离,生成离子可以导电,随着表面活性剂浓度的增加,电导率直线增大.
但离子型表面活性剂分子生成胶束后,由于胶束比表面活性剂分子大得多,在水中移动慢得多,故电导率虽仍随着表面活性剂浓度的增大而增大,但增大的幅度(即直线斜率)变小.故电导率随浓度变化曲线上,在临界胶束浓度处有一拐点.
对于非离子表面活性剂来说,表面活性剂分子在水中不电离,其溶液的电导率和表面活性剂浓度没有关系,故不能用电导法测定非离子表面活性剂的临界胶束浓度.1年前查看全部
- 一个电阻元件,电压的电流的参考方向相同,当外加电压U=10V时,其电流I=2MA,求其电阻和电导
一个电阻元件,电压的电流的参考方向相同,当外加电压U=10V时,其电流I=2MA,求其电阻和电导
希望大家说过程如何得来 可以完整的回答, 谢谢大家了 女儿飞燕女1年前2
女儿飞燕女1年前2 -
 yzfrsj 共回答了15个问题
yzfrsj 共回答了15个问题 |采纳率93.3%R=10/0.002=5千欧
G=1/R=0.2毫西门1年前查看全部
- 电导法如何测醋酸溶液的平衡电离常数
 意儿241年前1
意儿241年前1 -
 lost124125 共回答了20个问题
lost124125 共回答了20个问题 |采纳率95%实验原理:1.电离平衡常数Kc的测定原理在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务.在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为,可以用离子的极限摩尔电导率相加而得.而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力.二者之间有如下近似关系: (1)式中为弱电解质的电离度.对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下: CH3COOH →CH3COO- + H+ 起始浓度 c 0 0 平衡浓度 c(1-α) cα cα则 (2) 以式(1)代入上式得: (3)因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc.将式(2)整理后还可得: (4)由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将∧mc对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内的平均值.2.摩尔电导率∧m的测定原理电导是电阻的倒数,用G表示,单位S(西门子).电导率则为电阻率的倒数,用k表示,单位为G·m-1.摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率.摩尔电导率与电导率之间有如下的关系.∧m= κ/c (5)式中c为溶液中物质的量浓度,单位为mol·m-3.在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比.G = κA/ l (6)由(6)式可得κ=Kcell G (7)对于固定的电导池,l和A 是定值,故比值l/A为一常数,以Kcell表示,称为电导池常数,单位为m-1.为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数Kcell.当电导池常数Kcell确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率.在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即: (8)不同温度下醋酸的值见表1.表1 不同温度下醋酸的 (S·m2·mol-1)温度/K298.2303.2308.2313.2×1023.9084.1984.4894.7791年前查看全部
- 影响弱电解质溶液电导因素?
 灌水钦差1年前1
灌水钦差1年前1 -
 candytony 共回答了11个问题
candytony 共回答了11个问题 |采纳率81.8%原因大致有这两类中:
内因:电解质的本性:
弱电解质包括弱酸、弱碱、水与少数盐
其中
外因:温度和溶液的浓度
弱电解质溶液的浓度会直接影响溶液的电解出来的浓度,因此会影响电导性.
第二温度 一般而言 温度越高电解质电解出来的离子浓度越大,因而电导性越好.(只是相对而言弱电解液电导都比较弱)因为电离过程是吸热的,因此温度升高离子化倾向加强,又因大多数电解质电离时没有显著的热量变化,这就导致温度对电离度虽有影响,但影响并不大的必然结果.一般情况下,温度对电离度影响不大,但水的离解过程显著吸热,所以温度升高可以增大水的电离度.1年前查看全部
- 溶液稀释后电导值变化某溶液用高纯水稀释10倍,其电导值就减少为原来的十分之一?
 lysyb1年前2
lysyb1年前2 -
 sdhhzzg 共回答了19个问题
sdhhzzg 共回答了19个问题 |采纳率89.5%不一定,浓硫酸(98%以上)导电性弱,稀释后反而增强;稀释时的导电性变化主要看对离子浓度的影响.1年前查看全部
- 细胞膜外液钾离子浓度明显降低时,将引起 A.膜电位负值减小 B.钾离子电导加大 C钠离子内流驱动力增加D平衡
细胞膜外液钾离子浓度明显降低时,将引起 A.膜电位负值减小 B.钾离子电导加大 C钠离子内流驱动力增加D平衡
细胞膜外液钾离子浓度明显降低时,将引起
A.膜电位负值减小 B.钾离子电导加大 C钠离子内流驱动力增加D平衡电位负值减小E钠钾泵转运钠离子增多
解释一下为啥这道题选c 还有E选项是怎么回事 jickyan1年前2
jickyan1年前2 -
 jennylau2006 共回答了18个问题
jennylau2006 共回答了18个问题 |采纳率94.4%静息电位产生的基本原因是离子的跨膜扩散,和钠- 钾泵的特点也有关系.细胞膜内K+浓度高于细胞外.安静状态下膜对K+通透性大,K+顺浓度差向膜外扩散,膜内的蛋白质负离子不能通过膜而被阻止在膜内,结果引起膜外正电荷增多,电位变正;膜内负电荷相对增多,电位变负,产生膜内外电位差.这个电位差阻止K+进一步外流,当促使K+外流浓度差和阻止K+外流的电位差这两种相互对抗的力量相等时,K+外流停止.膜内外电位差便维持在一个稳定的状态,即静息电位.(静息电位钾离子外流大于钠离子内流)
当外膜钾离子浓度降低时,外面的正电荷也降低,动作电位上升支——Na+内流所致.
动作电位的幅度决定于细胞内外的Na+浓度差,细胞外液Na+浓度降低动作电位幅度也相应降低,而阻断Na+通道(河豚毒)则能阻碍动作电位的产生.1年前查看全部
- 细胞膜外液钾离子浓度明显降低时,将引起 A.膜电位负值减小 B.钾离子电导加大 C钠离子内流驱动力增加
细胞膜外液钾离子浓度明显降低时,将引起 A.膜电位负值减小 B.钾离子电导加大 C钠离子内流驱动力增加
每个选项 为什么对或者错! hkkcm1年前1
hkkcm1年前1 -
 晚安baby 共回答了23个问题
晚安baby 共回答了23个问题 |采纳率91.3%A膜电位负值减小,是对的.
因为细胞膜上因为有钠钾泵,没泵入2两个钾离子就会泵出3个钠离子,所以导致细胞内是负电荷.钾离子浓度减小,泵入的钠和泵出的钾都会少,所以膜电位负值减小.所以C钠离子内流驱动力因该减小.
钾离子因为浓度降低,所以电导自然减小.1年前查看全部
- 哪些溶液可以用电导仪测其电导
 逸寒-遗憾1年前2
逸寒-遗憾1年前2 -
 凌风逸云 共回答了23个问题
凌风逸云 共回答了23个问题 |采纳率95.7%有导电能力的溶液都可以测电导率1年前查看全部
- 测定HAc电导时,为什么要由低到高进行
 黄金O时代1年前1
黄金O时代1年前1 -
 骑机车要戴安全帽 共回答了19个问题
骑机车要戴安全帽 共回答了19个问题 |采纳率89.5%从小的开始测,仪器上残留部分对高浓度的影响小,反之,从高浓度开始测,残留的高浓度会对低浓度时的测定影响较大1年前查看全部
- 电压源与电流源等效变换什么时候用电导什么时候用电阻啊
 xuwenrr7308281年前1
xuwenrr7308281年前1 -
 QQChin 共回答了18个问题
QQChin 共回答了18个问题 |采纳率88.9%就是用戴维宁和诺顿等效电路代替,根据题意用电导还是用电阻,电导和电阻没有区别1年前查看全部
- 细胞膜具有电阻性和电导性这句话怎么理解?电阻和电导可以理解为物体的同一种性质表现吗?
 wudragon1681年前1
wudragon1681年前1 -
 谢寒冰 共回答了17个问题
谢寒冰 共回答了17个问题 |采纳率88.2%任何物体都没有绝对的导电,和绝对的绝缘.
比如空气,一般情况我们认为是绝缘体,但当电压达到一定程度时,就变成导体了.(闪电,还有你拔下插座时看到了火星,这时空气就是导体了).
生物学不太明白,不过从物理学的角度看,细胞膜具有一定的电阻.
电阻和电导其实是一回事.电导=电阻的倒数1年前查看全部
- 将长2m的通电导线放在匀强磁场中,匀强磁场的磁感应强度的大小为1.5T,当导线和磁场方向垂直时,通电导...
将长2m的通电导线放在匀强磁场中,匀强磁场的磁感应强度的大小为1.5T,当导线和磁场方向垂直时,通电导...
将长2m的通电导线放在匀强磁场中,匀强磁场的磁感应强度的大小为1.5T,当导线和磁场方向垂直时,通电导线所受磁场力为12N,则通电导线的电流大小为多少? 迷惘一生1年前3
迷惘一生1年前3 -
 liuyang0922 共回答了17个问题
liuyang0922 共回答了17个问题 |采纳率94.1%F=ILBsin(I,B),
本题sin(I,B)=sin90°=I,L=2(m),B=1.5(T).
F=12N
12=I^2*2*1.5
解得 I=2A1年前查看全部
- 为什么要测溶液的电导要用交流电
 jameyw1年前1
jameyw1年前1 -
 本我自我超我 共回答了14个问题
本我自我超我 共回答了14个问题 |采纳率100%为避免通电时化学反应和极化现象的发生,测量溶液电导时要使用交流电.1年前查看全部
- 电导法测乙酸乙酯皂化反应速率常数的实验,如果反应物溶液都为浓溶液,能否用此方法求反应速率常数?
 bt的cc1年前1
bt的cc1年前1 -
 bluespark33 共回答了19个问题
bluespark33 共回答了19个问题 |采纳率100%你问的是不能来求的.这因为实验原理中有一条:假定每种电解质的电导率与其浓度成正比.这个要求在稀溶液中才有效!浓溶液不存在这个规律.1年前查看全部
- 溶液稀释前后电导值的变化溶液稀释后电导值变化某溶液用高纯水稀释10倍,其电导值就减少为原来的十分之一?
 354211年前1
354211年前1 -
 coldsoul 共回答了17个问题
coldsoul 共回答了17个问题 |采纳率94.1%这个不一定吧
要是弱电解质溶液稀释后水解的越多 跟强电解质不同的1年前查看全部
- 试比较电解质的电导和导体的电导有何不同
 rh_yang19851年前2
rh_yang19851年前2 -
 CITIC2 共回答了26个问题
CITIC2 共回答了26个问题 |采纳率92.3%电解质的导电是通过正负离子的定向移动形成的电流,金属导电是由自由电子定向移动形成的电流1年前查看全部
- 电导法测定弱电解质的电离常数时为什么要恒温
 vivian-lall1年前1
vivian-lall1年前1 -
 大智慧ddyy 共回答了21个问题
大智慧ddyy 共回答了21个问题 |采纳率95.2%电离常数是温度的函数.1年前查看全部
- 配制乙酸乙酯溶液时为什么瓶子中要事先加入电导水
 英格兰ll1年前1
英格兰ll1年前1 -
 jsbdbjh 共回答了21个问题
jsbdbjh 共回答了21个问题 |采纳率95.2%电导水为纯水,除去乙酸乙酯中混有的易溶于水的杂质,且乙酸乙酯易溶于有机溶液,微溶于水,因此可以更容易分液得到乙酸乙酯的有机溶液1年前查看全部
- 电导法测乙酸乙酯皂化反应速率常数的实验,如果反应物溶液都为浓溶液,能否用此方法求反应速率常数?
 wildchicken1年前3
wildchicken1年前3 -
 andycyh1 共回答了22个问题
andycyh1 共回答了22个问题 |采纳率86.4%1.预先恒温,可以减少混合时温度的波动,减少试验误差,因为它们一混合,反应就 进行,所以先恒温,再混合,可以减少误差。
2.浓度相同可以比较好计算反应速率,因为最后反应物没有剩余。至于不同的浓度,你可以去看书本介绍的内容计算,我太久没做试验了。。。
3.二级反应,你可以设计相同温度下,不同浓度的乙酸乙酯与不同浓度的氢氧化钠反应,但是测量反应时间时候要改用其他的方法,如用滴定的方法测...1年前查看全部
- 溶液电导 意义溶液的电导值有什么意义,和物质溶解性 是否有关
 守侯火绒草1年前2
守侯火绒草1年前2 -
 亚热带的夏天 共回答了20个问题
亚热带的夏天 共回答了20个问题 |采纳率95%电导值是电阻的导数,是溶液导电能力或者说是溶液内离子活度的一个表征值,是物质本身性质决定的,和溶解度没有必然因果关联,两者关系是平行的,还受溶剂、温度等影响.1年前查看全部
- 电阻的电导与什么有关我现在是大学,书上没讲
 myqaq1231年前2
myqaq1231年前2 -
 zichang84 共回答了17个问题
zichang84 共回答了17个问题 |采纳率94.1%电阻率的倒数就是电导率
电阻率跟温度,材料的性质等有关.具体的要到大学的物理专业中才有学到(涉及固体物理学)
电阻率乘于长度除于横切面积即得该段电阻的电阻值.1年前查看全部
- 什么叫“电导”(电导的定义)?“电导”的单位是什么?“电导”在电路分析中如何应用?
 laomaodd1年前1
laomaodd1年前1 -
 novel77 共回答了8个问题
novel77 共回答了8个问题 |采纳率100%电阻的倒数.电阻不是R=U/I吗?反过来就是电导1年前查看全部
- 物理 :磁场对通电导体力的作用的方向与什么有关
物理 :磁场对通电导体力的作用的方向与什么有关
填空
磁场对通电导体具有力的作用,其作用的方向与_____、_____有关. 我是乖乖也1年前1
我是乖乖也1年前1 -
 心海浩淼 共回答了25个问题
心海浩淼 共回答了25个问题 |采纳率96%通电导体的电流方向、磁场方向1年前查看全部
- 已知铜的电阻率0.0175Ωmm2,求直径为0.5毫米的铜导线的电导是多少欧姆?电导是多少西门子?
 youminge1年前1
youminge1年前1 -
 dong011 共回答了15个问题
dong011 共回答了15个问题 |采纳率93.3%题目的电阻率ρ的单位错了(应是Ωm),前一问说的“电导”应是“电阻”才对,后面问的才是电导.
题目还少了一个物理量“铜导线的长度L”.
由电阻定律得导线的电阻是 R=ρ*L / S=ρ*L / [π*(0.5*d)^2] ,d是直径
只要再已知长度L,就能求得电阻R.
电导等于电阻的倒数.1年前查看全部
- 电导法如何测醋酸溶液的平衡电离常数
 江北侠客1年前1
江北侠客1年前1 -
 俞辛一起付远方 共回答了24个问题
俞辛一起付远方 共回答了24个问题 |采纳率100%实验原理:1.电离平衡常数Kc的测定原理在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务.在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为,可以用离子的极限摩尔电导率相加而得.而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力.二者之间有如下近似关系:(1)式中为弱电解质的电离度.对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:CH3COOH →CH3COO- + H+ 起始浓度 c 0 0 平衡浓度 c(1-α) cα cα则 (2) 以式(1)代入上式得:(3)因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc.将式(2)整理后还可得:(4)由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将∧mc对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内的平均值.2.摩尔电导率∧m的测定原理电导是电阻的倒数,用G表示,单位S(西门子).电导率则为电阻率的倒数,用k表示,单位为G·m-1.摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率.摩尔电导率与电导率之间有如下的关系.∧m= κ/c (5)式中c为溶液中物质的量浓度,单位为mol·m-3.在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比.G = κA/ l (6)由(6)式可得κ=Kcell G (7)对于固定的电导池,l和A 是定值,故比值l/A为一常数,以Kcell表示,称为电导池常数,单位为m-1.为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数Kcell.当电导池常数Kcell确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率.在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即:(8)不同温度下醋酸的值见表1.1年前查看全部
- 油罐车拖铁链子为什么能把电导到地上?我知道导出静电,但是铁链与地面摩擦也起电,铁链两头都有电荷,还怎么导出?
 武佳飞1年前7
武佳飞1年前7 -
 handaliang 共回答了28个问题
handaliang 共回答了28个问题 |采纳率85.7%因为铁链与大地有一个电势差,所以就有了电压,所以就可以导出电荷了1年前查看全部
- 测定HAC溶液的电导,溶液浓度为什么由稀到浓
测定HAC溶液的电导,溶液浓度为什么由稀到浓
RT alex8505161年前2
alex8505161年前2 -
 红袖添香_0 共回答了22个问题
红袖添香_0 共回答了22个问题 |采纳率90.9%因为先测稀溶液对浓溶液浓度影响比较小,可以减小误差.如果先测浓溶液,会对稀溶液浓度影响大,会增大误差.1年前查看全部
- 如何利用电导滴定确定强酸强碱滴定的终点?
 duoshoucainengd1年前1
duoshoucainengd1年前1 -
 Tpynv 共回答了17个问题
Tpynv 共回答了17个问题 |采纳率94.1%强酸强碱反应过程中,由于水,气体,沉淀的生成,导电能力基本不变,终点时,溶液中离子浓度开始上升,电流表示数开始上升,于是可以确定反应终点.1年前查看全部
- 电导法测量高纯水时,随试液在空气中的放置时间增长,电导而增大,可能影响的因素是
 可好了1年前4
可好了1年前4 -
 aucwxzpo 共回答了19个问题
aucwxzpo 共回答了19个问题 |采纳率84.2%可能的原因:
空气中的氧气和二氧化碳等气体会溶于水中,形成碳酸等电解质,水的电阻就会减小,电导增大.
空气中的杂质离子也会使其电阻减小,电导增大1年前查看全部
- 给水PH低锅炉炉水PH高是什么原因?除盐水PH4.57 电导16.6 导致除氧器PH9.27 炉水PH10.60 炉水碱
给水PH低锅炉炉水PH高是什么原因?除盐水PH4.57 电导16.6 导致除氧器PH9.27 炉水PH10.60 炉水碱度也高
 针尖与麦芒的区别1年前1
针尖与麦芒的区别1年前1 -
 azxdsl 共回答了22个问题
azxdsl 共回答了22个问题 |采纳率86.4%有没有加联氨啊,那个加多了,炉水中有其残余量较大时,也会使水质PH值偏高的.1年前查看全部
大家在问
- 1常微分的题求方程y^2dx+(x+1)dy=0的解,并求满足初值条件x=0,y=1的特解.
- 2求未知数x的值.4.5x-1.5×2=10.5 4(4x-6)=5(3x+1)
- 3如图,函数y=ax+b和y=kx的图象交于点P,则关于x,y的方程组y−ax=bkx−y=0的解是( )
- 4已知可逆反应 2SO2 (g)+O2(g)⇌2SO3(g);△H<0.现有甲、乙两个容器相同的恒容容
- 5形容模仿人不到家,反而把原来自己的东西忘了的词是什么
- 6电工操作中规定,不能把铜丝和铁丝拧在一起连接到电路中,这是因为
- 7下列各组物质的溶液相互反应后不产生沉淀的是( )
- 8描述酵母菌芽体的形态结构特征@.@切记(#.#|||要速度``不要风度!且不能太过简单!
- 9do a practice语法正确吗
- 10小学汉语拼音 韵母怎么加声调举个例子 比如 ou在哪个字母上加声调啊
- 11在pH=0的溶液中能大量共存,并且溶液为无色透明的是( ) A.K + 、ClO - 、Na + 、NO 3 - B.
- 12急 急 急.要以大局为重的作文的题目、开头、结尾.要照应,还要新颖.
- 13英语为什麼有时候不发最后一个音?比如right不发最后的t
- 14连词成句(题在下面)1.talk,the,you,quietly,should,in,music room
- 15你是如此可笑 怎么翻译成英语
