某制碱石用岩盐水精制后的食盐水为原料生产的纯碱产品中会含有少量氯化钠杂质,该制碱厂的产品包装袋上注明:碳酸钠含量≥96%
 坚持坚持坚持2022-10-04 11:39:541条回答
坚持坚持坚持2022-10-04 11:39:541条回答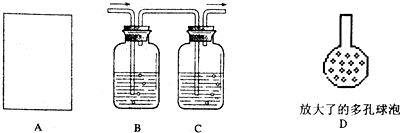
(1)A为溶解产品的装置(未画出),若已准备了长颈漏斗、双孔橡皮塞、导气管,为完成溶解至少还需要的实验仪器是______.
(2)B中所盛的试剂是______.
(3)根据上述装置进行实验,下列情况会使结果产生偏差的是______
A、进入C装置的气体中还混有少量HCl气体
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收
C、实验结束时,系统内还残留少量CO2气体
D、实验开始后连接A、B装置进行实验
(4)将B、C装置中插入溶液的导气管的下端改成具有多孔的球泡D,有利于提高实验的准确度,其理由是______.
(5)改进实验装置并进行正确操作可以准确测定出产品的纯度,若此时装置C的实验前后其质量增加了6.6g,该产品是否合格?(要求写出计算过程,结果精确到0.1%)

已提交,审核后显示!提交回复
共1条回复
 入夜三分 共回答了22个问题
入夜三分 共回答了22个问题 |采纳率77.3%- 解题思路:(1)欲知为了完成溶解至少还需要的实验仪器是什么,须知此实验共须哪些仪器;
(2)浓硫酸具有吸水性,可做干燥剂.
(3)欲正确选择,须牢记实验须注意的事项;
(4)将插入溶液的管子的下端改成具有多孔的球泡后可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)C瓶中多出的质量是吸收生成的CO2的质量,根据方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可计算出Na2CO3的质量,根据碳酸钠的质量分数可计算出其质量分数.(1)要完成此实验,需要的实验仪器有长颈漏斗、双孔橡胶塞、导气管、广口瓶(或锥形瓶、大试管、烧瓶),故答案为:广口瓶(或锥形瓶、大试管、烧瓶);
(2)浓硫酸具有吸水性,可做干燥剂.故B中所盛的试剂是浓硫酸;故填:浓硫酸;
(3)A、进入C装置的气体中还混有少量HCl气体,说明在前面的反应过程中没有完全反应,会使计算结果不准确;
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收,会使计算结果不准确;
C、实验结束时,系统内还残留有少量CO2气体,说明CO2没有被NaOH溶液全部吸收,会使计算结果不准确;
D、实验开始A、B装置以及导气管内残留有少量空气,这样溶液使实验不精确,不能正确计算反应物的生成;故选:ABCD;
(4)多孔的球泡可以增大气体与溶液的接触面积,使气体被充分吸收,有利于提高实验的准确度.故答案为:可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
[106/x=
44
6.6g]
解得x=15.9g
样品中碳酸钠的质量分数为[15.9g/18.0g]×100%=88.3%<96%,所以产品不合格.
答:该产品不合格.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;盐的化学性质;根据化学反应方程式的计算.
考点点评: 本题主要测试学生对实验操作的掌握和物质纯度的计算,学生必须牢记操作实验步骤和注意事项,并能熟练运用质量分数公式进行计算,才能正确解答. - 1年前
相关推荐
- 标准状况下6.72L烃在足量的氧气中完全燃烧.若将产物通入足量澄清石灰水中,得到白色沉淀质量为60.0g;若用足量的碱石
标准状况下6.72L烃在足量的氧气中完全燃烧.若将产物通入足量澄清石灰水中,得到白色沉淀质量为60.0g;若用足量的碱石灰吸收燃烧产物,碱石灰增重42.6g.
(1)计算燃烧产物中水的质量.
(2)通过计算推断烃的分子式.
(3)写出一种和该烃具有相同碳原子和氢原子数的烃的含氧衍生物的结构简式. 流星雨jh1年前1
流星雨jh1年前1 -
 liumengxue 共回答了21个问题
liumengxue 共回答了21个问题 |采纳率95.2%解题思路:根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,二氧化碳与足量的氢氧化钙完全反应,生成不溶于水的白色沉淀碳酸钙,利用生成碳酸钙的质量计算燃烧生成二氧化碳的质量;碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和,从而求出水的质量,根据生成二氧化碳和水的质量计算出可燃物中C、H元素的物质的量,再求出分子式.(1)设燃烧产物中CO2的质量为x.
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 60.0g
解得x=26.4g,
而碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和:m(CO2)+m(H2O)=42.6g,m(H2O)=42.6g-26.4g=16.2g,
答:燃烧产物中水的质量为16.2g;
(2)烃的物质的量为n(烃)=[6.72L/22.4L/mol]=0.3mol,n(CO2)=[26.4g/44g/mol]=0.6mol,则n(C)=0.6mol;n(H2O)=[16.2g/18g/mol]=0.9mol,则n(H)=n(H2O)×2=1.8mol,即0.3mol烃中含有0.6molC,1.8molH,所以1mol气体中含有2molC,6molH,所以该气体的分子式是C2H6,
答:烃的分子式为C2H6;
(3)和C2H6具有相同碳原子和氢原子数的烃的含氧衍生物为C2H60,其结构简式为:CH3CH2OH.
答:和该烃具有相同碳原子和氢原子数的烃的含氧衍生物的结构简式为CH3CH2OH.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查学生燃烧法确定有机物分子组成的知识,根据原子守恒法来解答,难度不大.1年前查看全部
- 有机物A是烃的含氧衍生物,在同温同压下,A蒸气对乙醇蒸气的相对密度是2,13.8g A完全燃烧后,若将燃烧的产物通过碱石
有机物A是烃的含氧衍生物,在同温同压下,A蒸气对乙醇蒸气的相对密度是2,13.8g A完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g.通过计算确定:
A的相对分子质量为______,分子式为______. 神一般的胖子1年前1
神一般的胖子1年前1 -
 爱上樱空释 共回答了17个问题
爱上樱空释 共回答了17个问题 |采纳率100%解题思路:在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92;
13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,故燃烧生成二氧化碳质量=30.6g-10.8g=19.8g,根据n=[m/M]计算有机物A、水、二氧化碳的物质的量,根据原子守恒计算有机物A分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物A的分子式.在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92;
13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,故燃烧生成二氧化碳质量=30.6g-10.8g=19.8g,
13.8g A的物质的量=[13.8g/92g/mol]=0.15mol,燃烧生成水的物质的量=[10.8g/18g/mol]=0.6mol,二氧化碳的物质的量=[19.8g/44g/mol]=0.45mol,
根据原子守恒,有机物A分子中C原子数目=[0.45mol/0.15mol]=3、H原子数目=[0.6mol×2/0.15mol]=8,故O原子数目=[92−12×3−8/16]=3,故有机物A的分子式为C3H8O3,
故答案为:92; C3H8O3.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式确定,难度不大,侧重对基础知识的巩固,注意利用原子守恒进行解答.1年前查看全部
- (2010•杨浦区二模)碱石灰是由CaO和NaOH组成的固体混合物,常用作干燥剂.现对实验室已开封的久置在空气中的“碱石
(2010•杨浦区二模)碱石灰是由CaO和NaOH组成的固体混合物,常用作干燥剂.现对实验室已开封的久置在空气中的“碱石灰”进行了如下探究:

①请写出“碱石灰”中CaO与水反应的化学方程式______.
②根据实验现象,请判断滤渣中一定含有的物质是______.
③取少许滤液进行焰色反应,观察到火焰呈______色.
④碱石灰在实验室里要______保存. dungdao1年前1
dungdao1年前1 -
 从不rr 共回答了23个问题
从不rr 共回答了23个问题 |采纳率95.7%①CaO与水反应的化学方程式 CaO+H2O═Ca(OH)2.
②加入稀盐酸有气泡产生,说明滤渣中含有碳酸盐,因为该碳酸盐不溶于水,所以应该是碳酸钙.
③反应物中含有钠元素,根据反应前后元素的种类不变,滤液中肯定含有钠离子,钠离子在颜色反应中显黄色;
④因为碱石灰容易吸收水和二氧化碳,所以应该密封保存.
故答案为:(1)CaO+H2O═Ca(OH)2
(2)CaCO3(或碳酸钙)
(3)黄(4)密封1年前查看全部
- 1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定),又知0.1mol该烃完全燃烧的产物被碱石
1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定),又知0.1mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39g,求该烃的分子式.(提示:可设该烃的分子式为CxHy )
 李小瓜1年前1
李小瓜1年前1 -
 爱的能量 共回答了19个问题
爱的能量 共回答了19个问题 |采纳率94.7%解题思路:根据“1体积某烃的蒸汽完全燃烧生成的CO2比水蒸气少1体积”可推知该烃为烷烃,设该烃分子式为CnH2n+2,碱石灰增重39g为0.1mol CnH2n+2完全燃烧生成的CO2和H2O的质量和,根据原子守恒计算CO2和H2O的质量,据此列方程计算n的值.根据“1体积某烃的蒸汽完全燃烧生成的CO2比水蒸气少1体积”可推知该烃为烷烃,碱石灰增重39 g为0.1 mol CnH2n+2完全燃烧生成的CO2和H2O的质量和,
设该烃分子式为CnH2n+2,根据原子守恒有:
0.1mol×n×44g/mol+0.1mol×(n+1)×18g/mol=39g,
解得n=6,
故该烃的分子式为C6H14,
答:该烃的分子式为C6H14.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定,难度不大,本题根据二氧化碳与水的关系确定该烃为烷烃,简化计算过程,可以利用烃的组成通式列方程组计算.1年前查看全部
- 1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定),又知0.1mol该烃完全燃烧的产物被碱石
1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定),又知0.1mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39g,求该烃的分子式.(提示:可设该烃的分子式为CxHy )
 流殇_1年前1
流殇_1年前1 -
 guoziyuan 共回答了19个问题
guoziyuan 共回答了19个问题 |采纳率89.5%解题思路:根据“1体积某烃的蒸汽完全燃烧生成的CO2比水蒸气少1体积”可推知该烃为烷烃,设该烃分子式为CnH2n+2,碱石灰增重39g为0.1mol CnH2n+2完全燃烧生成的CO2和H2O的质量和,根据原子守恒计算CO2和H2O的质量,据此列方程计算n的值.根据“1体积某烃的蒸汽完全燃烧生成的CO2比水蒸气少1体积”可推知该烃为烷烃,碱石灰增重39 g为0.1 mol CnH2n+2完全燃烧生成的CO2和H2O的质量和,
设该烃分子式为CnH2n+2,根据原子守恒有:
0.1mol×n×44g/mol+0.1mol×(n+1)×18g/mol=39g,
解得n=6,
故该烃的分子式为C6H14,
答:该烃的分子式为C6H14.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定,难度不大,本题根据二氧化碳与水的关系确定该烃为烷烃,简化计算过程,可以利用烃的组成通式列方程组计算.1年前查看全部
- (2010•杨浦区二模)碱石灰是由CaO和NaOH组成的固体混合物,常用作干燥剂.现对实验室已开封的久置在空气中的“碱石
(2010•杨浦区二模)碱石灰是由CaO和NaOH组成的固体混合物,常用作干燥剂.现对实验室已开封的久置在空气中的“碱石灰”进行了如下探究:
①请写出“碱石灰”中CaO与水反应的化学方程式CaO+H2O═Ca(OH)2CaO+H2O═Ca(OH)2.
②根据实验现象,请判断滤渣中一定含有的物质是CaCO3(或碳酸钙)CaCO3(或碳酸钙).
③取少许滤液进行焰色反应,观察到火焰呈黄黄色.
④碱石灰在实验室里要密封密封保存. ztily1年前1
ztily1年前1 -
 luomi8dan 共回答了24个问题
luomi8dan 共回答了24个问题 |采纳率95.8%解题思路:①根据反应物和生成物写出化学方程式;②根据滤渣不溶于水和与盐酸反应能放出气体判断;③滤液中含有钠离子,可判断颜色反应;④根据碱石灰在空气中易变质分析保存方法.①CaO与水反应的化学方程式 CaO+H2O═Ca(OH)2.
②加入稀盐酸有气泡产生,说明滤渣中含有碳酸盐,因为该碳酸盐不溶于水,所以应该是碳酸钙.
③反应物中含有钠元素,根据反应前后元素的种类不变,滤液中肯定含有钠离子,钠离子在颜色反应中显黄色;
④因为碱石灰容易吸收水和二氧化碳,所以应该密封保存.
故答案为:(1)CaO+H2O═Ca(OH)2
(2)CaCO3(或碳酸钙)
(3)黄(4)密封点评:
本题考点: 生石灰的性质与用途;实验探究物质的组成成分以及含量;碱的化学性质;空气中常见酸碱盐的质量或性质变化及贮存法;书写化学方程式、文字表达式、电离方程式.1年前查看全部
- 某无色气体可能含有一氧化碳、二氧化碳、氢气、水蒸气中的一种或几种,依次进行如下处理(假定每次处理均完全反应)1.通过碱石
某无色气体可能含有一氧化碳、二氧化碳、氢气、水蒸气中的一种或几种,依次进行如下处理(假定每次处理均完全反应)1.通过碱石灰时,气体体积变小;2、通过炽热的氧化铜粉末时,粉末变为红色;3、通过白色硫酸铜粉末时,粉末变为蓝色;4、通过澄清的石灰水时,石灰水变浑浊.由此可确定原气体中:
A、一定含有一氧化碳和氢气,还含有水蒸气和二氧化碳中的一种或两种
B、一定含有水蒸气和一氧化碳,可能含有氢气、二氧化碳
C、一定含有一氧化碳和二氧化碳,可能含有水蒸气、氢气
D、一定含有二氧化碳和水蒸气,可能含有一氧化碳、氢气 精灵鼠大哥1年前2
精灵鼠大哥1年前2 -
 abaoaz 共回答了16个问题
abaoaz 共回答了16个问题 |采纳率81.3%答案选A,气体通过碱石灰体积变小,说明含有水蒸气或是二氧化碳的一种或两种,但通过1后,气体之中就不含这两种气体了,通过2时,氧化铜被还原,可能是被一氧化碳和氢气中的一种或两种还原,由后面的3、4可以看出,还原后的产物中既含水又含二氧化碳,说明还原氧化铜的为一氧化碳和氢气并存,所以答案选A1年前查看全部
- 某有机物A有C、H、O三种元素组成,现取18g A在足量O2中充分燃烧,将燃烧产物全部依次通过无水氯化钙和碱石
某有机物A有C、H、O三种元素组成,现取18g A在足量O2中充分燃烧,将燃烧产物全部依次通过无水氯化钙和碱石灰后,固体质量的增加依次为10.8g和26.4g,求:
(1)A的最简式是______;
(2)若常温下A是气体,则A的结构简式是______;
(3)若A低于16℃时是无色晶体,且有酸性.则A的结构简式是______. billran1年前1
billran1年前1 -
 告诉我旅行的意义 共回答了19个问题
告诉我旅行的意义 共回答了19个问题 |采纳率89.5%解题思路:无水氯化钙增重的质量为水的质量,n(H2O)=[10.8g/18g/mol]=0.6mol,碱石灰增重的质量为CO2的质量,n(CO2)=[26.4g/44g/mol]=0.6mol,则有机物中m(C)=0.6mol×12g/mol=7.2g,m(H)=1.2g,m(O)=18g-7.2g-1.2g=9.6g,所以18g有机物中含有n(O)=[9.6g/16g/mol]=0.6mol,则有机物中N(C):N(H):N(O)=0.6:1.2:0.6=1:2:1,最简式为CH2O,最简式为CH2O的有甲醛、乙酸、葡萄糖等,结合对应有机物的性质解答该题,无水氯化钙增重的质量为水的质量,n(H2O)=[10.8g/18g/mol]=0.6mol,碱石灰增重的质量为CO2的质量,n(CO2)=[26.4g/44g/mol]=0.6mol,则有机物中m(C)=0.6mol×12g/mol=7.2g,m(H)=1.2g,m(O)=18g-7.2g-1.2g=9.6g,所以18g有机物中含有n(O)=[9.6g/16g/mol]=0.6mol,则有机物中N(C):N(H):N(O)=0.6:1.2:0.6=1:2:1,最简式为CH2O,最简式为CH2O的有甲醛、乙酸、葡萄糖等,
(1)由以上分析可知该有机物的最简式为CH2O,故答案为:CH2O;
(2)若常温下A是气体,应为甲醛,结构简式是HCHO,故答案为:HCHO;
(3)若A低于16℃时是无色晶体,且有酸性,应为乙酸,分子式为C2H4O2,结构简式为CH3COOH,故答案为:CH3COOH.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,侧重于有机物燃烧的规律的计算,注意最简式为CH2O的有机物的种类,结合对应有机物的性质解答该题,题目难度不大.1年前查看全部
- 实验室常用的干燥剂碱石灰是CaO和NaOH的固体混合物,极易与空气中的水蒸气和二氧化碳反应而变质。某同学对一瓶久置的碱石
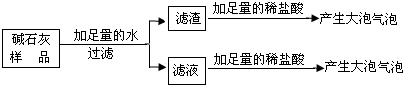
实验室常用的干燥剂碱石灰是CaO和NaOH的固体混合物,极易与空气中的水蒸气和二氧化碳反应而变质。某同学对一瓶久置的碱石灰作了如下探究:
【提出猜想】猜想一:没有变质,只有CaO和NaOH两种固体;
猜想二:已完全变质,碱石灰全部变成了CaCO 3 和Na 2 CO 3 。
【实验探究】实验过程与现象如下图所示:
【做出判断】(1)若把Ca(OH) 2 、CaCO 3 和Na 2 CO 3 加入水中不会放出热量,侧由操作b中的现象可判断猜想二_______(填“成立”或 “不成立”)。
(2)操作f中发生反应的化学方程式为_______________;由操作e、f中的现象可判断滤液里含有_________(填化学式),由此判断猜想一________(填“成立”或 “不成立”)。
(3)综合(1)、(2)中的结论,判断该碱石灰的变质情况为_______________。
【拓展应用】(4)由上述实验说明,在实验室存放碱石灰应__________保存。 woaimeiguo1年前1
woaimeiguo1年前1 -
 dfwy8802 共回答了15个问题
dfwy8802 共回答了15个问题 |采纳率86.7%(1)不成立
(2)Na 2 CO 3 +Ca(OH) 2 ==CaCO 3 +2NaOH;Na 2 CO 3 ;不成立
(3)部分变质
(4)密封、防潮1年前查看全部
- 某有机化合物仅由C,H,O三种元素组成,经测定相对分子质量为90.取有机物1.8g,完全燃烧,将产物先后通过浓硫酸和碱石
某有机化合物仅由C,H,O三种元素组成,经测定相对分子质量为90.取有机物1.8g,完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,求该有机物的分子式.
 SweetJane1年前2
SweetJane1年前2 -
 个性_Cilent 共回答了13个问题
个性_Cilent 共回答了13个问题 |采纳率100%H2O 为 1.08/18==0.06 mol H 为 0.12 mol
CO2为 2.64/44 ==0.06 mol C为0.06 mol
H+C 质量之和为 0.12+0.06*12==0.84 g
则O 质量为 1.8-0.84==0.96 g
O物质的量为 0.96/16==0.06 mol
又 有机物物质的量为 1.8/90==0.02 mol
则 1个有机物分子有 H 0.12/0.02==6 个 C 0.06/0.02= 3个 O 0.06/0.02=3 个
即 C3H6O31年前查看全部
- 0.2mol有机物和1.2molO2在一密闭容器中恰好完全燃烧,产物依次通过浓硫酸、碱石灰.浓硫酸的质量增加18g,碱石
0.2mol有机物和1.2molO2在一密闭容器中恰好完全燃烧,产物依次通过浓硫酸、碱石灰.浓硫酸的质量增加18g,碱石灰固体质量增加35.2g,通过计算回答:
1.此有机物的分子式
2.若该有机物能与金属钠反应放出氢气,且该有机物不能发生催化氧化反应,写出该有机物的结构简式并命名.
答好了再加分 zhengyuweiye1年前2
zhengyuweiye1年前2 -
 wxyth 共回答了18个问题
wxyth 共回答了18个问题 |采纳率88.9%我说一下思路吧
产物依次通过浓硫酸,就是检验水.通过碱石灰,就是检验二氧化碳.所以,水的质量是18克,二氧化碳的质量是35.2g.知道了质量,算出物质的量,答案是水:1mol二氧化碳0.8mol
所以,C 0.8mol
H 2mol
耗氧量:1.3大于1.2 可知分子中有氧.
然后确定分子式.1年前查看全部
- 如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石
 如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:
如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:
(1)C瓶中的溶液是______,其作用是______;D瓶中的溶液是______,其作用是______.F装置的作用有______.
(2)石英玻璃管E中发生反应的化学方程式为Cu+Cl2
CuCl2加热 .Cu+Cl2现象是______.
CuCl2加热 . 祖彦1年前1
祖彦1年前1 -
 分-寸 共回答了25个问题
分-寸 共回答了25个问题 |采纳率88%解题思路:浓盐酸和二氧化锰在加热条件下反应生成氯气,用饱和食盐水除去气体中的氯化氢,然后用浓硫酸干燥,在E中加热条件下与铜反应生成氯化铜,F防止空气中的水蒸气进入E,以此解答.(1)由于盐酸易挥发,则生成的氯气中混有氯化氢,可用饱和食盐水除杂,在D中用浓硫酸干燥,可得到干燥的氯气,为防止空气中的水蒸气进入E中而使氯化铜潮解,F中装有碱石灰,可起到吸收空气中的水蒸气的作用,
故答案为:饱和食盐水;除去HCl;浓硫酸;干燥;防止空气中的水蒸气进入E;
(2)氯气和铜在加热或点燃条件下反应生成氯化铜,反应的方程式为Cu+Cl2
加热
.
CuCl2,可观察到棕黄色烟生成,
故答案为:Cu+Cl2
加热
.
CuCl2;生成棕黄色烟.点评:
本题考点: 实验装置综合.
考点点评: 本题考查实验氯气的制取、对装置的理解、常用化学用语等,难度不大,理解原理是关键,注意干燥管的作用,要根据题目信息结合发生反应及物质性质进行解答,难度不大.1年前查看全部
- deng两种气态烃的混合物20mL,在过量的氧气中充分燃烧后,当燃烧产物通过浓硫酸时,体积减少了30mL,然后再通过碱石
deng
两种气态烃的混合物20mL,在过量的氧气中充分燃烧后,当燃烧产物通过浓硫酸时,体积减少了30mL,然后再通过碱石灰体积又减少了40mL(气体体积均在同温同压下测定),求混合物由什么物质组成 其体积各占多少? zhenai19861年前4
zhenai19861年前4 -
 风铃 共回答了18个问题
风铃 共回答了18个问题 |采纳率100%测定C:H=2:3
又因为是气态的,所以成分中必定有C2H2
所以另外一个烃就是C2H4
体积比为1:11年前查看全部
- 实验室常用的干燥剂碱石灰是CaO和NaOH的固体混合物,极易与空气中的水蒸气和二氧化碳反应而变质.某同学对一瓶久置的碱石
实验室常用的干燥剂碱石灰是CaO和NaOH的固体混合物,极易与空气中的水蒸气和二氧化碳反应而变质.某同学对一瓶久置的碱石灰作了如下探究:
【提出猜想】猜想一:没有变质,只有CaO和NaOH两种固体; 猜想二:已完全变质,碱石灰全部变成了CaCO3和Na2CO3.
【实验探究】实验过程与现象如下图所示:
【做出判断】(1)若把Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,侧由操作b中的现象可判断猜想二______(填“成立”或“不成立”).
(2)操作f中发生反应的化学方程式为______;
由操作e、f中的现象可判断滤液里含有______(填化学式),由此判断猜想一______(填“成立”或“不成立”).
(3)综合(1)、(2)中的结论,判断该碱石灰的变质情况为______.
【拓展应用】(4)由上述实验说明,在实验室存放碱石灰应______保存. 狗JB1年前1
狗JB1年前1 -
 红米411 共回答了15个问题
红米411 共回答了15个问题 |采纳率100%解题思路:(1)根据物质溶于水的温度变化情况进行分析,
(2)根据推导确定混合物的成分进行分析,
(3)根据实验现象进行分析,
(4)根据上面的实验结论进行分析.(1)混合物加水后试管壁发热,但是Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,所以C猜想二不成立.
(2)浑浊液中的滤渣中滴加盐酸,产生气泡,说明混合物中有碳酸钙,滤液中滴加盐酸有气泡,加澄清石灰水有沉淀生成,说明滤液中有碳酸钠,但是如果只有氧化钙和氢氧化钠就不会生成碳酸钙沉淀和碳酸钠.
(3)从(2)中的推导可知,混合物中既有CaO和NaOH,也有CaCO3和Na2CO3.
(4)通过实验可知,碱石灰在空气中极易变质.
故答案为:
(1)不成立,
(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 碳酸钠 不成立
(3)部分变质
(4)密封、防潮点评:
本题考点: 物质的鉴别、推断;空气中常见酸碱盐的质量或性质变化及贮存法;酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,先根据题中的现象推出确定的物质,对于不确定的物质要设计实验进行验证.1年前查看全部
大家在问
- 1初四数学函数问题,急求解,会的高手请进,有高分
- 2这个故事真让人感动改为比喻句
- 3用晃组词
- 4英语翻译HMD60/70 Humidity and TemperatureTransmitters for ducts
- 5化简1/2sin2x-1/2cos2x= (√2/2)sin(2x-π/4)
- 6下列图示实验操作中,错误的是 [ ] A.液体的倾倒
- 7帮我写篇作文2、根据下面提供的材料,以“送书”为题目,扩写成一篇不少于400字的记叙文.一天,小帆和雅婷一同到儿童书店买
- 8求函数f(x)=(x^2+3x+2)/x在[2,4]上的最值
- 9史上最难的题目-数学题
- 10应用生物科学到底做什么的、、出来能做什么、、
- 11x+y分之9=3,y+z分之9=3,则z+x分之9的值是?
- 12两个物理总结规律的题,我不知道怎么表达
- 13根据下面的对话情景,在每个空白处填商一个适当的句子,使对话的意思连贯、完整。
- 14drive( 名词)____cut( 过去式 )____ cut( 动名词 )____
- 15求一篇感恩老师的文章,要有具体事例,800字左右.
