12.铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,当外电路通过1mol电子时,理论上负极板的质量增加--g
 爱到风起2022-10-04 11:39:541条回答
爱到风起2022-10-04 11:39:541条回答48 为什么..
根据反应看不该是减少吗..怎么会是增加?

已提交,审核后显示!提交回复
共1条回复
 挥着棒棒的男 共回答了17个问题
挥着棒棒的男 共回答了17个问题 |采纳率100%- 这是重庆高考题
当外电路通过1mol电子时,理论上负极消耗0.5mol铅生成0.5mol硫酸铅,而硫酸铅不溶解,是沉积在负极的,所以负极板增加的质量实际是0.5mol硫酸根的质量,1摩硫酸根96克,所以0.5摩为48克. - 1年前
相关推荐
- (2013•天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.
(2013•天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (l)
电解池:2Al+3H2O
Al2O3+3H2↑电解 .
电解过程中,以下判断正确的是( )
电池 电解池 A H+移向Pb电极 H+移向Pb电极 B 每消耗3mol Pb 生成2mol Al2O3 C 正极:PbO2+4H++2e-═Pb2++2H2O 阳极:2Al+3H2O-6e-═Al2O3+6H+ D 

A.A
B.B
C.C
D.D 悠悠心情1年前1
悠悠心情1年前1 -
 renqishi 共回答了19个问题
renqishi 共回答了19个问题 |采纳率89.5%解题思路:A.原电池放电时,溶液中阳离子向正极移动;
B.串联电池中转移电子数相等;
C.原电池正极上生成硫酸铅;
D.原电池中铅电极上生成硫酸铅.A.原电池中,溶液中氢离子向正极二氧化铅电极移动,故A错误;
B.串联电池中转移电子数相等,每消耗3molPb,根据电子守恒生成lmolAl2O3,故B错误;
C.原电池正极上二氧化铅得电子生成硫酸铅,故C错误;
D.原电池中铅作负极,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以质量增加,在电解池中,Pb阴极,阴极上氢离子得电子生成氢气,所以铅电极质量不变,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,根据电极上得失电子、离子放电顺序来分析解答即可,难度中等.1年前查看全部
- 一.制铅蓄电池时往往要用到稀硫酸,先要配置500mL20%(密度为1.14g/cm^3)的硫酸,需要98%的浓硫酸(密度
一.制铅蓄电池时往往要用到稀硫酸,先要配置500mL20%(密度为1.14g/cm^3)的硫酸,需要98%的浓硫酸(密度为1.84g/cm^3)多少毫升?
二.黄铜是铜和锌的合金,向100g的黄铜样品加入50g稀硫酸,恰好完全反应,生成0.2g氢气
1)计算出所用稀硫酸的溶质质量分数
2)计算出所用黄铜中锌的质量分数
3)计算反应后溶液中溶质的质量分数 3153499131年前1
3153499131年前1 -
 woaijx 共回答了15个问题
woaijx 共回答了15个问题 |采纳率100%1.500ml=500cm3
要配置500ml20%的硫酸的质量:
由p=m/v得v=pv
v=pv
=1.14g/cm3×500cm3
=570g
需要浓硫酸的质量为;
570×20%/98%=116
需要浓硫酸的体积;
v=m/p
=116g/1.84g/cm3
=63cm3=63ml
2.1)19.6%
2)6.5%
3)14%(答案同上)1年前查看全部
- 用铅蓄电池作电源电解AgNO3溶液,阳极放出1.6g气体时电池内部消耗H2SO4 0.2mol 是否正确(有过程)
 star12star1年前1
star12star1年前1 -
 shili369 共回答了21个问题
shili369 共回答了21个问题 |采纳率95.2%1.6g气体为氧气,为0.05mol氧气,转移电子为0.2mol.
铅蓄电池放电过程!
负极:Pb -2e + SO4 2- == PbSO4
正极:PbO2 + 2e + SO4 2- + 4H+ == PbSO4 + 2H2O
显然,当转移2mol电子的时候,一共消耗2mol硫酸根和4mol氢离子,即为2mol硫酸!
所以电池内部消耗H2SO4 0.2mol ,是正确的!1年前查看全部
- 镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原...
镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原...
镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原因是? freya198210161年前1
freya198210161年前1 -
 我巍子 共回答了9个问题
我巍子 共回答了9个问题 |采纳率88.9%铅蓄电池极板电阻随极板上有效物质即参与化学反应的活性物质的变化而变化,充电时电阻变小,放电时电阻变大,特别是放电之后生成硫酸铅沉淀,使电阻大大增加1年前查看全部
- 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42-=PbSO4+2e-
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42-=PbSO4+2e- 正极PbO2+4H++SO42-+2e-=PbSO4+2H2O,今若制Cl2 0.5mol,这时电池内消耗H2SO4的物质的量至少是——
有人的回答是“制0.5摩尔Cl2要1mol电子.
据方程式,4molH+转移2mol电子,就是1mol硫酸转移1mol电子
所以需要1mol硫酸.”
我的问题是:电解液里的电子转移(就是CL-到CL2)和电池里的电子转移有什么关系啊?为什么0.5摩尔Cl2要1mol电子,电池里的电子转移也是4MOL啊?那个装置到底是什么样的啊?
shhhxjsh 说电子守恒 这个我知道啊
我就是想不通 电池里的原电池反应和电池外的电解池反应有什么关系啊?为什么这个也是遵守电子守恒的?
多等几天~ ot-2h1年前3
ot-2h1年前3 -
 vevwvq 共回答了16个问题
vevwvq 共回答了16个问题 |采纳率100%请记住:电子守恒是一个基本规律,电解池和蓄电池转移的电子是一样多的.所以1摩尔氯离子氧化成0.5摩尔氯气(1摩尔氯原子),需要1摩尔电子,那么蓄电池里电子转移也就是1摩尔.根据这个反应的化学方程式,消耗1摩尔硫酸转移2摩尔电子,所以制取0.5摩尔氯气,消耗0.5摩尔酸铅.1年前查看全部
- 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,下列有关说法正确的是( )
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向Pb电极区迁移
C.K与M连接时,所用电源的a极为正极
D.K与M相接时,阳极附近的pH逐渐减小 月ff舞1年前1
月ff舞1年前1 -
 007lxh 共回答了14个问题
007lxh 共回答了14个问题 |采纳率92.9%解题思路:K与N相接时,为原电池反应,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电解质溶液中阳离子向正极移动,阴离子向负极移动,K与M连接时,为电解池装置,电解池中的Pb为阴极连接电源的负极,阳极是PbO2,结合电极方程式解答该题.解;A.K与N相接时是原电池,Pb做负极,PbO2做正极,能量变化为化学能转化为电能,故A错误;
B.K与N相接时是原电池,Pb做负极,PbO2做正极,氢离子移向正极,故B错误;
C.K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极,故C错误;
D.K与M连接时,装置是电解池,阳极是PbO2,电解方程式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,阳极附近的pH逐渐减小,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,根据元素化合价变化确定正负极,再结合阴阳离子的移动方向、氢离子浓度的变化来分析解答,难度中等.1年前查看全部
- 电压是形成______的原因.一节干电池的电压是______V,一节铅蓄电池的电压是______V.家庭照明电路的电压为
电压是形成______的原因.一节干电池的电压是______V,一节铅蓄电池的电压是______V.家庭照明电路的电压为______V.  拂墙花影动1年前1
拂墙花影动1年前1 -
 qs01 共回答了19个问题
qs01 共回答了19个问题 |采纳率94.7%电压使电路中形成电流,一节普通干电池的电压为1.5V,一节铅蓄电池的电压是2V,家庭电路的电压为220V.
故答案为:电流,1.5;2;220.1年前查看全部
- 如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2SO42-=2PbSO4+2H2O
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2SO42-=2PbSO4+2H2O.下列有关说法正确的是( )
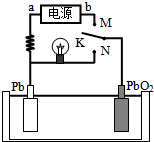 A. K与N相接时,能量由电能转化为化学能
A. K与N相接时,能量由电能转化为化学能
B. K与N相接时,H+向负极区迁移
C. K与M连接时,所用电源的a极为负极
D. K与M相接时,阳极附近的pH逐渐增大 aimeng1001年前1
aimeng1001年前1 -
 阿拉灯女神 共回答了22个问题
阿拉灯女神 共回答了22个问题 |采纳率90.9%解题思路:A、K与N相接时,是原电池;
B、K与N相接时,是原电池,Pb做负极,PbO2做正极,氢离子移向正极;
C、K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极;
D、K与M连接时,装置是电解池,阳极是PbO2,电极反应过程中生成氢离子.A、K与N相接时,是原电池,Pb做负极,PbO2做正极,能量变化为化学能转化为电能,故A错误;
B、K与N相接时,是原电池,Pb做负极,PbO2做正极,氢离子移向正极,故B错误;
C、K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极,故C正确;
D、K与M连接时,装置是电解池,阳极是PbO2,电极反应过程中生成氢离子,pH减小,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池和电解池的工作原理,主要考查铅蓄电池的放电和充电过程的电极反应特征和电极名称,题目难度中等.1年前查看全部
- 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:;Pb+SO42-=PbSO4+2H2O
正极PbO2+4H++SO42-+2e=PbSO4+2H2O
今若制得Cl2 0.80mol,这时电池内消耗的H2SO4的物质的量至少是:
A.0.4 mol B.1.6mol C.0.8mol D.3.20mol 田暮琴书1年前4
田暮琴书1年前4 -
 小城boy 共回答了13个问题
小城boy 共回答了13个问题 |采纳率76.9%生成0.8molcl2所以也生成了0.8molH2既转移了1.6mol电子又因为铅蓄电池中H离子=消耗硫酸的量所以选B1年前查看全部
- 电动自行车现在已经成为人们时尚的代步工具,其中的电池是铅蓄电池,用三块或四块铅蓄电池联后给电动自行车供电.某兴趣小组将一
电动自行车现在已经成为人们时尚的代步工具,其中的电池是铅蓄电池,用三块或四块铅蓄电池联后给电动自行车供电.某兴趣小组将一辆旧电动自行车的电池拆下后充满电,测量其中一块铅蓄电池的电动势和内阻.
(1)用多用电表直流电压50V挡测量该蓄电池的电动势,电表的指针如图甲所示,其读数为______V.
(2)用图乙所示的电路测量该蓄电池的电动势E和内阻r,图中R0为保护电阻,其阻值为5Ω.改变电阻箱的阻值R,测出对应的电流I,根据测量的数据作出该蓄电池的[1/1−R leon07061年前1
leon07061年前1 -
 毛毛吓 共回答了15个问题
毛毛吓 共回答了15个问题 |采纳率86.7%解题思路:电表读数时注意估读,本题应读到最小分度的110,解本题的关键是根据闭合电路欧姆定律写出表达式,然后再整理出1I与R的一次函数方程,根据图象求出斜率和截距即可求解,在分析误差时把电流表看做是电源的内阻即可.(1)根据电表读数规则可知电表读数为U=9.6V(9.4~9.7均可)
(2)根据闭合电路欧姆定律有E=I(r+
R 0]+R),整理为[1/I]=[1/E]R+
r
+R 0
E,可见图线的斜率K=[1/E]=[0.9/9]=0.1,故E=10V,
r
+R 0
E=0.9,解得r=4Ω.
(3)本实验中测得的内阻是电源与电流表的串联电阻,故测量值比真实值偏大.
故答案为(1)9.6(9.4~9.7均可)
(2)10,4
(3)大点评:
本题考点: 测定电源的电动势和内阻.
考点点评: 涉及到图象问题时应先根据物理规律写出表达式,再整理出关于纵轴与横轴物理量间的依次函数关系,求出斜率和截距即可;在进行误差分析时,要灵活运用等效思想.1年前查看全部
- 有关电化学的下列说法正确的是:A.铅蓄电池充电时,负极与电源的正极相连接.B.ZN-MnO2干电池,其电解质溶液是ZNC
有关电化学的下列说法正确的是:
A.铅蓄电池充电时,负极与电源的正极相连接.
B.ZN-MnO2干电池,其电解质溶液是ZNCl2-NH4Cl混合溶液,电池工作时,CL-流向负极,负极电极反应:2CL--2e-→Cl2↑
C.金属做原电池的负极和电解池的阴极都可以被保护,而且后者保护效果更好.
D.用含有Fe的粗铜电解精炼铜,当阴极质量增加32g,阳极质量减小28g
【这道题我选了B选项,老师打了叉号.但是我觉得剩下的哪个都不对,希望能讲解详细一点,】 嘬了一大口1年前1
嘬了一大口1年前1 -
 market58 共回答了18个问题
market58 共回答了18个问题 |采纳率77.8%A项错误,阴极(就是负极我觉得这里应该叫阴极了)与电源负极相连.
B项错误,电池内部是一个原电池,Cl-流向负极没错,但负极绝对不是氯离子在反应,原电池是个自发发生反应的装置,如果自己能产生氯气,那谁还敢用啊!电极方程式错了,如果我没记错的话应是Zn-2e-=Zn2+
C项错误,应是金属原电池的阳极和电解池的阴极都可以被保护
D项正确,电解精炼铜,粗铜做阳极,纯铜做阴极,电解硫酸铜溶液,题中说此铜中有铁杂质,因铁比铜还原性强,铁要先反应,电极方程式为:
阳极:Fe-2e-=Fe2+
阴极:Cu2++2e-=Cu
阳极极每消耗0.5mol铁28g,阴极也生成0.5mol铜32g,正确.
所以选D,有问题可以追问,满意请采纳.1年前查看全部
- 在使用一段时间后,常需补充电瓶水--30%的硫酸溶液,当铅蓄电池里剩余3.4Kg20%的硫酸溶液时
在使用一段时间后,常需补充电瓶水--30%的硫酸溶液,当铅蓄电池里剩余3.4Kg20%的硫酸溶液时
应该加入多少克98%的浓硫酸才能恰好配成30%的硫酸溶液呢? loser2oo41年前2
loser2oo41年前2 -
 要相信真话 共回答了16个问题
要相信真话 共回答了16个问题 |采纳率100%设加入x克浓硫酸
m(总硫酸)=x+3400
m(纯硫酸)=x*0.98+3400*0.2
0.3m(总硫酸)=m(纯硫酸)
解得x=5001年前查看全部
- 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+PbSO4+2e-
正极:PbO2+4H+++2e-PbSO4+2H2O
又知电解饱和食盐水时:2Cl--2e-Cl2↑
今若制得0.05 mol Cl2,这时电池内部消耗H2SO4的物质的量至少是( )
A.0.025 mol B.0.05 mol C.0.10 mol D.0.20 mol
C
解析:由电子守恒可知,制得0.05 mol Cl2时,需转移的电子物质的量为0.1 mol,由正极反应知消耗0.2 mol H+,故消耗H2SO4为0.1 mol.
为什么由正极的H+推知H2SO4,而不用SO42-推知H2SO4的物质的量? weirukanren1年前1
weirukanren1年前1 -
 就是lin 共回答了16个问题
就是lin 共回答了16个问题 |采纳率93.8%可以用SO42-推,但正负极反应都有SO42-的参与,用起来没有H+的简洁而已1年前查看全部
- 铅蓄电池电解液是否导电?如题.
 无事所所1年前1
无事所所1年前1 -
 人见人衰00 共回答了14个问题
人见人衰00 共回答了14个问题 |采纳率92.9%电解液是加有无水硫酸钠的稀硫酸,密度在(1.26-1.33)左右,由于稀硫酸是电解质,所以会导电.1年前查看全部
- 铅蓄电池在放电过程中 正负极质量都增加 哪些是天然污染物 单质硅有何实际用途 身为胶体的条件 碱石灰的成分 将铜片放入浓
铅蓄电池在放电过程中 正负极质量都增加 哪些是天然污染物 单质硅有何实际用途 身为胶体的条件 碱石灰的成分 将铜片放入浓硫酸中 无明显实验现象 说明铜在浓硫酸中发生钝化 生石灰能与水反应 用来干燥氯气 氯化钙不能干燥氨气 以上判断正误 急用
 米兰香1年前1
米兰香1年前1 -
 dgxgnsg 共回答了13个问题
dgxgnsg 共回答了13个问题 |采纳率100%铅蓄电池正极PbO2,负极Pb,反应变成PbSO4,质量都增加,硅可以作半导体,芯片等,胶体中微粒直径1-100nm,碱石灰是NaOH和CaO的混合物,铜和浓硫酸反应要加热,不然不反应,不是钝化,生石灰和水反应生成氢氧化钙会吸收氯气,漂白粉就这么制出来的,氯化钙会和氨气反应生成八氨合氯化钙,氨气也被吸收,所以不能1年前查看全部
- 关于原电池,不是说阳离子移向正极吗?为什么正极反应还有阴离子参加?例如铅蓄电池的正极反应.
 loftylv1年前3
loftylv1年前3 -
 xym_901020 共回答了9个问题
xym_901020 共回答了9个问题 |采纳率77.8%是说阳离子移向正极 又不是说正极附近就没有阴离子1年前查看全部
- 铅蓄电池在放电过程中硫酸的浓度变化
铅蓄电池在放电过程中硫酸的浓度变化
硫酸浓度变化~ 望霞池1年前2
望霞池1年前2 -
 行崖客 共回答了25个问题
行崖客 共回答了25个问题 |采纳率80%放电时浓度变稀
Pb+PbO2+2H2SO4=2PbSO4+2H2O1年前查看全部
- 铅蓄电池在放电过程中,负极质量减小,正极质量增加.这句话错!老师说负极质量增加!Pb+PbO2+2H2SO4=2PbSO
铅蓄电池在放电过程中,负极质量减小,正极质量增加.这句话错!老师说负极质量增加!Pb+PbO2+2H2SO4=2PbSO4+2H2O
 wanzhiguang1年前1
wanzhiguang1年前1 -
 qq26q4 共回答了16个问题
qq26q4 共回答了16个问题 |采纳率87.5%负极反应:
Pb + SO42- -2e == PbSO4
负极由Pb转化为PbSO4(固体,沉积在负极上),所以质量增加.
正极反应:
PbO2 + SO42- + 4H+ + 2e == PbSO4 + 2H2O
正极由PbO2变为PbSO4,所以正极质量也增加.1年前查看全部
- 一个小电动机工作时,要求电源电压是6V,如果用干电池作电源,需要______节串联起来;如果用铅蓄电池作电源,需要___
一个小电动机工作时,要求电源电压是6V,如果用干电池作电源,需要______节串联起来;如果用铅蓄电池作电源,需要______节串联起来.
 wolfQQQ1年前5
wolfQQQ1年前5 -
 tangxp 共回答了20个问题
tangxp 共回答了20个问题 |采纳率95%解题思路:电池是提供电压的装置,一节干电池电压为1.5V,一节铅蓄电池电压为2V,根据串联电池组电压特点(串联电池组的电压等于各节电池电压之和)计算.一节干电池电压为1.5V,所以需要4节干电池串联,一节铅蓄电池电压为2V,需要3节蓄电池串联.
故答案为:4;3.点评:
本题考点: 电压.
考点点评: 本题考查了串联电池组的电压特点,是一道基础题.需要注意的是:几个相同的电池串联后,总电压等于各电池电压之和;如果几个相同的电池并联后,总电压和每个电池的电压相同.1年前查看全部
- 铅蓄电池充电时,PbSO4( )
铅蓄电池充电时,PbSO4( )
A. 在阳极生成
B. 在阴极生成
C. 在两个电极上生成
D. 在两个电极上除去 atry1年前1
atry1年前1 -
 31号 共回答了16个问题
31号 共回答了16个问题 |采纳率93.8%解题思路:铅蓄电池充电,实质是电解反应,阳极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,阴极发生反应为:PbSO4=Pb-2e-+SO42-,据此分析.铅蓄电池放电时,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,充电是放电的逆反应,阳极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,阴极发生反应为:PbSO4=Pb-2e-+SO42-,
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查铅蓄电池充电过程中的物质变化,熟悉其电极反应式即可,题目难度不大.1年前查看全部
- 铅蓄电池放电时铅电极发生什么反应?氧化还是还原?
 似锦ff1年前1
似锦ff1年前1 -
 fujuntao1985 共回答了19个问题
fujuntao1985 共回答了19个问题 |采纳率68.4%放电时不就相当于是原电池嘛,铅是惰性电极那当然是正极了,发生还原反应!一般都是这样的,但也有特殊情况下,那就要考虑电解质的性质了.不过那种情况很少……1年前查看全部
- 铅蓄电池在一秒内将2焦耳的化学能转化为电能这句话对吗
铅蓄电池在一秒内将2焦耳的化学能转化为电能这句话对吗
是不是“一秒”错误? airohy1年前1
airohy1年前1 -
 vgoldboy 共回答了14个问题
vgoldboy 共回答了14个问题 |采纳率85.7%当铅蓄电池未接入电路中,也就是处于断路状态时,他并不发生能量的转化,也就是说,要发生原电池反应的前提是,他已经开始工作、充当电源了.另外,你算一下,按照题目的数据,言下之意也就是说电池有固定的功率,明显错误,他不是用电器,其功率由外电路决定,不是定值.
Over.1年前查看全部
- 汽车电瓶是一种铅蓄电池,在使用一段时间后常需要补充电瓶水———溶质质量分数30%的硫酸溶液.
汽车电瓶是一种铅蓄电池,在使用一段时间后常需要补充电瓶水———溶质质量分数30%的硫酸溶液.
某铅蓄电池需要补充180.32克溶质质量分数30%的硫酸溶液,应取用多少毫升溶质质量分数的浓硫酸(浓硫酸的密度1.84克/立方厘米) 二0二1年前1
二0二1年前1 -
 我本老实人 共回答了18个问题
我本老实人 共回答了18个问题 |采纳率88.9%比例为1:9!1年前查看全部
- 铅蓄电池的电池反应,写离子方程式,硫酸用不用拆开写?我记得硫酸好像是浓硫酸.
 白芷紫苏1年前3
白芷紫苏1年前3 -
 不顶不是狼 共回答了21个问题
不顶不是狼 共回答了21个问题 |采纳率95.2%Pb-2e=Pb2+
PbO2 + 2e + 4H+ + (SO4)2-=PbSO4 + 2H2O1年前查看全部
- 铅蓄电池反应方程式的解释负极材料:Pb 正极材料:PbSO4 电解质溶液:H2SO4负极:Pb - 2e- + SO42
铅蓄电池反应方程式的解释
负极材料:Pb 正极材料:PbSO4 电解质溶液:H2SO4
负极:Pb - 2e- + SO42- = PbSO4
正极:PbO2 + 2e- + SO42- + 4H+ = PbSO4 + 2H2O
总反应:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
阴极:PbSO4 + 2e- = Pb + SO42-
阳极:PbSO4 - 2e- + 2H2O = PbO2 + 4H+ + SO42-
总反应:2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4
不是说阴离子向负极走,为什么硫酸根还是出现在正极的反应方程中了呢 十九月1年前1
十九月1年前1 -
 儿女成双 共回答了17个问题
儿女成双 共回答了17个问题 |采纳率94.1%酸根什么的这种例子只是拿来补平电荷的,要是不用硫酸根补平电荷,你用什么负离子去补呢,亲爱的同学?1年前查看全部
- 铅蓄电池放电时铅电极发生什么反应?氧化还是还原?
 wtwt031年前1
wtwt031年前1 -
 shihuang203 共回答了14个问题
shihuang203 共回答了14个问题 |采纳率92.9%放电时不就相当于是原电池嘛,铅是惰性电极那当然是正极了,发生还原反应!一般都是这样的,但也有特殊情况下,那就要考虑电解质的性质了.不过那种情况很少……1年前查看全部
- 1.电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是 ▁▁▁▁ 能转化成了▁▁▁▁ 能;太空飞船所用的氢燃
1.电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是 ▁▁▁▁ 能转化成了▁▁▁▁ 能;太空飞船所用的氢燃料电池是一种将▁▁▁▁▁▁▁▁的装置(填能量形式转化)的装置
2.电灯可以照明,但在停电的时候,我们可以点燃蜡烛照明,聪明的你就这两种方法,用你知道的化学知识,找出二者3方面的差异.
1▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 2▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 3▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 回梦旧鸳机1年前1
回梦旧鸳机1年前1 -
 暗黑雾 共回答了13个问题
暗黑雾 共回答了13个问题 |采纳率92.3%1、充电是把电能转化为化学能储存起来,当然,当电动车在行驶时,就是把储存的化学能转化为电能了;燃料电池是把燃料中储存的化学能转化为电能
2、电灯照明虽然发光发热,但是没有生成新的物质,不是化学变化,而蜡烛燃烧是;
电灯照明利用的电能是其他形式的能转化过来的(如水能、风能、核能),是二级能源,而蜡烛是自己储存的化学能直接发光,算一级能源;
实在想不出第三种不同……
闪人先1年前查看全部
- 电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用.电瓶的正极材料是二
电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用.电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:PbO2 (固)+2H2SO4+Pb=2PbSO4↓+2H2O
当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电.
(1)电瓶在放电时,______能转化为电能.
(2)假如某个电瓶中铅的质量为1800克,内装36%的稀硫酸1200克,当有310.5克的铅参加反应时,需消耗稀硫酸中溶质多少克?此时电瓶中硫酸溶液溶质的质量分数是多少?(最后结果保留两位小数) 艾香香1年前1
艾香香1年前1 -
 心是雨点 共回答了20个问题
心是雨点 共回答了20个问题 |采纳率90%解题思路:(1)电瓶放电是由于发生了化学变化PbO2 (固)+2H2SO4+Pb=2PbSO4↓+2H2O的结果,因此,放电是化学能转化为电能;
(2)根据反应的化学方程式,由参加反应铅的质量310.5g计算消耗掉硫酸的质量及生成水的质量,原硫酸溶液中硫酸质量与消耗硫酸的质量差即反应后溶液中所剩余硫酸的质量,再利用反应后溶液由剩余稀硫酸和生成的水组成计算出反应后电瓶中硫酸溶液的质量,利用溶质质量分数计算公式求出此时电瓶中硫酸溶液溶质的质量分数.(1)放电时的电能由反应PbO2 (固)+2H2SO4+Pb=2PbSO4↓+2H2O的反应而产生,因此此过程为化学能转变为电能的过程;
故答案为:化学;
(2)设需消耗纯稀硫酸的质量为x,同时生成水的质量为y.
PbO2(固)+2H2SO4+Pb=2PbSO4↓+2H2O
196207 36
x 310.5g y
[196/x]=[207/310.5g] x=294g
[207/310.5g]=[36/y] y=54g
36%的稀硫酸1200克稀硫酸中硫酸的质量=1200g×36%=432g,则反应后还剩余硫酸的质量=432g-294g=138g
剩余硫酸溶液的质量=1200g-294g+54g=960g
硫酸溶液溶质的质量分数=[138g/960g]×100%=14.38%
答:需消耗稀硫酸中溶质为294克,此时电瓶中硫酸溶液中溶质的质量分数是14.38%.
(其他合理解法也给分)点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;物质发生化学变化时的能量变化.
考点点评: 解答本题时需要注意,反应只生成硫酸铅沉淀和水,所以反应完成后所得溶液为剩余稀硫酸的质量与生成水的质量和.1年前查看全部
- 铅蓄电池的电动势为2V,一节干电池的电动势为1.5V,将铅蓄电池和干电池分别接入电路,两个电路中的电流分别为0.1A和0
铅蓄电池的电动势为2V,一节干电池的电动势为1.5V,将铅蓄电池和干电池分别接入电路,两个电路中的电流分别为0.1A和0.2A.试求两个电路都工作20s时间,电源所消耗的化学能分别为多少?哪一个电源把化学能转化为电能的本领更大?
 mtzc1年前4
mtzc1年前4 -
 迈阿密 共回答了22个问题
迈阿密 共回答了22个问题 |采纳率86.4%(1)w=pt p=ui
w1=4 w2=6
因为w2大于w1,所以干电池转化的本领大
一问中只要知道公式就可以
第二问所谓转化本领就是两个在相同时间内所做功的多少1年前查看全部
- 原电池中电解质溶液的流向问题是不是电解质的阴离子流向负极 而阳离子流向正极?如果是 那铅蓄电池的正极反映怎么会有硫酸根离
原电池中电解质溶液的流向问题
是不是电解质的阴离子流向负极 而阳离子流向正极?
如果是 那铅蓄电池的正极反映怎么会有硫酸根离子的出现
注意是原电池 请2楼再说清楚一点 口木一了1年前1
口木一了1年前1 -
 zhua1101 共回答了20个问题
zhua1101 共回答了20个问题 |采纳率80%你要看哪一极发生的是什么反应:
像铅蓄电池正极Pb02+SO42-+4H++2e=PbS04+2H2O 负极Pb+SO42--2e=PbSO4
负极就不解释了,正极在这里氢离子被还原,而其他离子或分子没有发生氧化还原反应.这就符合了原电池的规律.而硫酸根为什么会跑到这呢,因为有个前提是正极要先发生还原反应才会有电流,这就是所谓的化学能转化为电能.而Pb02要跟硫酸发生还原反应才会有电流.所以在这里硫酸根才会跑到正极.
或者你可以这样理能与正极发生还原反应的阳离子跑到正极发生反应,而这时不发生还原反应的阴离子也可以跑过来(当需要反应时) 负极也是一个道理.
这样说懂了吗?1年前查看全部
- 铅蓄电池给某电学元件供电时,电流为0.5A,在某次接通开头的10S内,铅蓄电池中有多少化学能转化为电能?
 reback1年前1
reback1年前1 -
 井上大神 共回答了19个问题
井上大神 共回答了19个问题 |采纳率84.2%解
P=UI=2×0.5W=1W
W=Pt=1×10=10J
答10J1年前查看全部
- 在“测量小灯泡电功率”的实验中,已知电源为两节铅蓄电池串联,小灯泡的额定电压为2.5V,灯丝电阻约为10W,滑动变阻器上
在“测量小灯泡电功率”的实验中,已知电源为两节铅蓄电池串联,小灯泡的额定电压为2.5V,灯丝电阻约为10W,滑动变阻器上标有“20WlA”字样,小明已连接的部分电路如图甲.

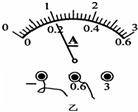
(1)小丽发现小明在连接电路时有错误,错误是 ______.
(2)请你用铅笔画线代替导线,在图甲中把电路连接完整.
(3)实验时,小明发现电流表有示数,电压表也有示数,而电灯不亮.出现这个现象的原因可能是:______.
(4)当把滑动变阻器滑片移到某位置时,小明发现电压表示数为2.5V,电流表示数如图乙所示,则此时通过小灯泡的电流是 ______A,此时小灯泡功率是 ______W.
(5)实验时,小丽认为应改变滑动变阻器滑片位置,测出三组小灯泡电压、电流数据,算出功率的平均值作为小灯泡的额定功率.小明指出小丽的想法是错误的,错误之处是:小灯泡在不同电压下的电功率 ______(填“不同”或“相同”),而只有在额定电压下的功率才是额定功率,即小灯泡的额定功率是 ______W. waterboy0081年前1
waterboy0081年前1 -
 a_ay 共回答了19个问题
a_ay 共回答了19个问题 |采纳率89.5%解题思路:(1)连接电路时,要注意开关要断开.
(2)根据小灯泡的额定电压选择电压表的量程,根据电压表、滑动变阻器的正确使用方法将电压表和滑动变阻器连入电路把电路连接完整.
(3)实验时,电流表有示数,电压表也有示数,这说明电路中没有断路现象,小灯泡也不短路,而电灯不亮,说明电路中电流太小,小灯泡的功率太小.
(4)读出电流表示数,利用电功率公式求出小灯泡的电功率.
(5)小灯泡的功率与小灯泡两端的电压有关.(1)连接电路时,开关应断开.由图可看出连接电路时开关没有断开.
故答案为:开关没有断开
(2)
小灯泡额定电压为2.5V,所以电压表应选0~3V量程.电路连接如图:
(3)实验时,电流表有示数,电压表也有示数,这说明电路中没有断路现象,小灯泡也不短路,而电灯不亮,说明电路中电流太小,小灯泡的功率太小.
故答案为:小灯泡的实际功率太小.(“小灯泡两端的电压太低”、“通过小灯泡的电流太小”也算对)
(4)电流表选择的是0~0.6A量程,读数为0.2A,小灯泡的额定功率为P=UI=2.5V×0.2A=0.5W.
故答案为:0.2;0.5.
(5)小灯泡在不同电压下的功率不同,在额定电压下的功率为额定功率.
故答案为:不同;0.5.点评:
本题考点: 探究用电器的电功率实验;实物的电路连接;电流表的读数方法;电功率的计算.
考点点评: 本题考查了测量小灯泡功率的实验,在该实验中要注意电压表、电流表、滑动变阻器的正确使用,要知道该实验的原理.1年前查看全部
- 铅蓄电池放电,正负两个电极板都会附着硫酸铅沉淀吗
 0--0--91年前1
0--0--91年前1 -
 梦中听涛 共回答了17个问题
梦中听涛 共回答了17个问题 |采纳率76.5%是的,通过化学公式就能得知呀1年前查看全部
- 铅蓄电池中含有硫酸,如果吧硫酸滴到大理石上,会发出声音,产生气体,这种气体是?
 kiarakiara1年前1
kiarakiara1年前1 -
 gaofenzi 共回答了17个问题
gaofenzi 共回答了17个问题 |采纳率88.2%产生的是二氧化碳
化学方程式:
H2SO4+CACO3(大理石里的主要物质)=CASO4+H2O+CO21年前查看全部
- 1 已知铅蓄电池放电时发生如下反应:
1 已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是 ( )
A.0.050mol B.0.075mol C.0.20mol D.0.40mol
27.烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[ 失水的产物].下列反应表示整个过程可能发生的变化,其中不符合事实的是
A.B.
C.D.
太给我面子了 红情子1年前1
红情子1年前1 -
 junjun34 共回答了13个问题
junjun34 共回答了13个问题 |采纳率84.6%1.B
由题知
铅蓄电池放电总反应式为:
Pb+PbO2+2H2SO4=2PbSO4+2H2O 期中转移电子2e-
n(Cu)=0.0375mol
Cu~2e-~2H2SO4
n(H2SO4)=2n(Cu)=0.075mol
2题你好像没打全
是铁发生吸氧腐蚀,是金属电化学腐蚀的一种
负极:2Fe-4e-=2Fe2+
正极:2H2O+O2+4e-=4OH-
总:2Fe+O2+2H2O=4Fe(OH)2
再与O2反应
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3失水生成Fe2O3棕红色1年前查看全部
- 已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电时发生的化学反应可用下式表示:Pb+PbO
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电时发生的化学反应可用下式表示:Pb+PbO 2 +2H 2 SO 4  2PbSO 4 +2H 2 O。据此判断下列叙述中正确的是 [ ]
2PbSO 4 +2H 2 O。据此判断下列叙述中正确的是 [ ]A.放电时铅蓄电池负极的电极反应为:PbO 2 +4H + +SO 4 2- +2e - ==PbSO 4 +2H 2 O
B.充电时铅蓄电池阴极的电极反应为:PbSO 4 +2e - ==Pb+SO 4 2-
C.用铅蓄电池来电解CuSO 4 溶液,要生成3.2gCu,电池内部要消耗0.05mol H 2 SO 4
D.铅蓄电池充电时,若要使3. 03kgPbSO 4 转变为Pb和PbO 2 ,需通过20mol电子 巴哥张飞飞1年前1
巴哥张飞飞1年前1 -
 栎音 共回答了17个问题
栎音 共回答了17个问题 |采纳率88.2%B1年前查看全部
- (2010•高淳县一模)铅蓄电池是应用广泛的可充电电池,电瓶车驱动、汽车等机动车发动都由其供电.铅蓄电池的正极材料为二氧
(2010•高淳县一模)铅蓄电池是应用广泛的可充电电池,电瓶车驱动、汽车等机动车发动都由其供电.铅蓄电池的正极材料为二氧化铅(PbO2),PbO2中Pb元素的化合价为( )
A.-4
B.+4
C.+3
D.+2 逆流的鱼1231年前1
逆流的鱼1231年前1 -
 uuu9 共回答了24个问题
uuu9 共回答了24个问题 |采纳率100%解题思路:根据在化合物中,元素化合价的代数和为零.在二氧化铅中,氧元素的化合价是-2价,根据化合物中元素化合价的代数和为零,可以求出铅元素的化合价为+4价.
故答案选B点评:
本题考点: 化学式的书写及意义;常见元素与常见原子团的化合价;有关元素化合价的计算.
考点点评: 在计算化合价代数和的过程中,注意不能漏掉元素符号右下角的数字.1年前查看全部
- 下列叙述正确的是( )A. 铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动B. 充电时,把铅蓄电池的负极接在外
下列叙述正确的是( )
A. 铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动
B. 充电时,把铅蓄电池的负极接在外电源的正极
C. 镀锌铁镀层破损后铁更易被腐蚀
D. 碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH- 小小荷才露尖尖角1年前1
小小荷才露尖尖角1年前1 -
 awang555 共回答了38个问题
awang555 共回答了38个问题 |采纳率94.7%解题思路:A.原电池中阳离子向正极移动,阴离子向负极移动;
B.充电时,把铅蓄电池的负极接在外电源的负极;
C.锌比铁活泼,为原电池的负极;
D.负极发生氧化反应,失电子.A.铜锌稀硫酸形成的原电池放电时,铜为正极,锌为负极,溶液中阳离子向正极移动,故A正确;
B.充电时,阴极发生还原反应,铅蓄电池的负极接在外电源的负极,故B错误;
C.锌比铁活泼,为原电池的负极,镀锌铁镀层破损后锌易被腐蚀,铁得到保护,故C错误;
D.碱性氢氧燃料电池工作时,负极发生氧化反应,失电子,而正极发生还原反应,正极反应为O2+2H2O+4e-=4OH-,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理,题目侧重于离子的定向移动、电解、金属的腐蚀以及电极反应等知识,题目难度中等.1年前查看全部
- 铅蓄电池的作用?
 jiangzhf1年前1
jiangzhf1年前1 -
 今天改吃馒头 共回答了16个问题
今天改吃馒头 共回答了16个问题 |采纳率93.8%铅酸蓄电池是电池中的一种,它的作用是能把有限的电能储存起来,它的工作原理就是把化学能转化为电能.
它用填满海绵状铅的铅板作负极,填满二氧化铅的铅板作正极,并用22~28%的稀硫酸作电解质.在充电时,电能转化为化学能,放电时化学能又转化为电能.电池在放电时,金属铅是负极,发生氧化反应,被氧化为硫酸铅;二氧化铅是正极,发生还原反应,被还原为硫酸铅.电池在用直流电充电时,两极分别生成铅和二氧化铅.移去电源后,它又恢复到放电前的状态,组成化学电池.铅蓄电池是能反复充电、放电的电池,叫做二次电池.它的电压是2v,通常把三个铅蓄电池串联起来使用,电压是6v.汽车上用的是6个铅蓄电池串联成12v的电池组.铅蓄电池在使用一段时间后要补充蒸馏水,使电解质保持含有22~28%的稀硫酸.
放电时,电极反应为:pbo2+4h++so42-+2e-=pbso4+2h2o
负极反应:pb+so42--2e-=pbso4
总反应:pbo2+pb+2h2so4===2pbso4+2h2o(向右反应是放电,向左反应是充电)
蓄电池的应用十分广泛,可用于ups,电动车,滑板车,汽车,风能太阳能系统,安全报警等等方面.
铅酸蓄电池产品主要有下列几种,其用途分布如下:
起动型蓄电池:主要用于汽车、摩托车、拖拉机、柴油机等起动和照明;
固定型蓄电池:主要用于通讯、发电厂、计算机系统作为保护、自动控制的备用电源;
牵引型蓄电池:主要用于各种蓄电池车、叉车、铲车等动力电源;
铁路用蓄电池:主要用于铁路内燃机车、电力机车、客车起动、照明之动力;
储能用蓄电池:主要用于风力、太阳能等发电用电能储存;1年前查看全部
- 若以铅蓄电池为电源,用惰性电极电解硫酸铜溶液,在点解过程中生成11.2L氧气,标况下,铅蓄电池中消耗硫酸的物质的量为多少
若以铅蓄电池为电源,用惰性电极电解硫酸铜溶液,在点解过程中生成11.2L氧气,标况下,铅蓄电池中消耗硫酸的物质的量为多少?
 lbewjhrj1年前1
lbewjhrj1年前1 -
 joe6000 共回答了20个问题
joe6000 共回答了20个问题 |采纳率85%0.5摩尔,电解槽里面生成等摩尔的铜和氧气,都是二价,电池里消耗铅和硫酸,也是二价,等摩尔,所以都是0.5摩尔1年前查看全部
- 下列叙述正确的是( )A.铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动B.充电时,把铅蓄电池的负极接在外电源
下列叙述正确的是( )
A.铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动
B.充电时,把铅蓄电池的负极接在外电源的正极
C.镀锌铁镀层破损后铁更易被腐蚀
D.碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH- shen4211年前1
shen4211年前1 -
 再生阿明 共回答了17个问题
再生阿明 共回答了17个问题 |采纳率94.1%解题思路:A.原电池中阳离子向正极移动,阴离子向负极移动;
B.充电时,把铅蓄电池的负极接在外电源的负极;
C.锌比铁活泼,为原电池的负极;
D.负极发生氧化反应,失电子.A.铜锌稀硫酸形成的原电池放电时,铜为正极,锌为负极,溶液中阳离子向正极移动,故A正确;
B.充电时,阴极发生还原反应,铅蓄电池的负极接在外电源的负极,故B错误;
C.锌比铁活泼,为原电池的负极,镀锌铁镀层破损后锌易被腐蚀,铁得到保护,故C错误;
D.碱性氢氧燃料电池工作时,负极发生氧化反应,失电子,而正极发生还原反应,正极反应为O2+2H2O+4e-=4OH-,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理,题目侧重于离子的定向移动、电解、金属的腐蚀以及电极反应等知识,题目难度中等.1年前查看全部
- 在铅蓄电池充电过程中,为啥正极负极质量减少
 栩栩依然1年前1
栩栩依然1年前1 -
 chen634751028 共回答了21个问题
chen634751028 共回答了21个问题 |采纳率90.5%化学反应造成的,电瓶使用后如果馈电了就逆向反应回来了1年前查看全部
- 做了一道化学题,说铅蓄电池使用一段时间后要补充浓硫酸,这到底对不对?我们生活中不是加蒸馏水吗?
 lovestyan1年前2
lovestyan1年前2 -
 romanticwang 共回答了21个问题
romanticwang 共回答了21个问题 |采纳率100%这是一道应用题.
按照蓄电池的化学反应原理:
正极:PbO2 + 2e + H2SO4→ PbSO4 + 2H2O
负极:Pb + HSO4- → PbSO4 + H+ + 2e
总反应:PbO2 + 2 H2SO4 + Pb == 2 PbSO4 + 2H2O
这是一个可逆的反应,从理论上讲,是不需要加硫酸的.这应该是该题目的答案.
但是在实际应用中,蓄电池在充电时会发生一个副反应:电解水:
2H2O→2H2↑+O2↑.
由于存在电解水,所有电池到一定时间要加入蒸馏水.
理论上水的电解后,损失的是水,但实际上在水被电解后,产生的气体会带走少量的硫酸,即我们在充电时闻到的酸味,时间长了,电池内部的硫酸就会减少,因此实际情况使用一段时间后除了加蒸馏水外,还要加入少量的硫酸,以补充硫酸的损失.
如果是化学题目,那就不需要考虑实际使用的情况了,按照物质守恒定律,直接回答不需要加入硫酸就可以了.如果是实际使用,可以根据实际情况,除了加入蒸馏水外,还可以加入少量的硫酸.注意硫酸不要加多,控制充电充足后电解液的比重在1.26~1.28g/cm^3就可以了1年前查看全部
- 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4
B.电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小
D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变小 WTYDT1年前1
WTYDT1年前1 -
 子gg 共回答了21个问题
子gg 共回答了21个问题 |采纳率81%解题思路:A、放电是原电池反应,根据电极反应计算;
B、电解硫酸钠溶液实质是电解水;
C、溶液是饱和溶液,电解水后有晶体析出,但温度不变,溶液浓度不变;
D、电解过程中消耗硫酸生成硫酸铅和水;A、负极:Pb-2e-+SO42-=PbSO4,正极:PbO2+2e-+4H++SO4=PbSO4+2H2O,蓄电池放电时,每消耗0.1molPb,转移电子物质的量为0.2mol,正负极生成硫酸铅共生成0.2mol PbSO4,故A错误;
B、电解硫酸钠溶液实质是电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,故B正确;
C、电解饱和硫酸钠溶液后,饱和硫酸钠溶液中有晶体析出,但c(Na2SO4)不变,故C错误;
D、蓄电池放电一段时间后,生成硫酸铅和水,其电解液中H2SO4的浓度变小、密度都变小,故D正确;
故选BD.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理,主要是原电池的电极反应,电子守恒应用,饱和溶液电解水后的浓度变化,关键是两个电解生成硫酸铅.1年前查看全部
- 一道化学必修2题已知电解饱和食盐水可制得Cl2,又已知铅蓄电池放电时发生如下反应:正极:PbO2+4H++SO4^2-+
一道化学必修2题
已知电解饱和食盐水可制得Cl2,又已知铅蓄电池放电时发生如下反应:正极:PbO2+4H++SO4^2-+2e-=PbSO4+2H2
,又已知铅蓄电池放电时发生如下反应:
正极:PbO2+4H++SO4^2-+2e-=PbSO4+2H2O
负极:Pb+SO^2-=PbSO4+2e-,
使用该电池电解CUSO4溶液,要想得到纯铜1.6克,这时铅蓄电池消耗H2SO4的物质的量是多少?
A 0.025mol B.0.05mol C.0.1mol D,0.2mol sddywll1年前2
sddywll1年前2 -
 区号0915 共回答了22个问题
区号0915 共回答了22个问题 |采纳率86.4%解析:Pb+PbO2+2H2SO4 = 2PbSO4 + 2H2O ------2e-
CUSO4---Cu ----2e-
所以有:Cu -----2H2SO4
64 2
1.6 n n = 0.05mol 所以选B1年前查看全部
- 下列说法不正确的是( )A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加B. 常温下,反应C(s)+CO2(g)
下列说法不正确的是( )
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 栖神静乐1年前1
栖神静乐1年前1 -
 小妖甲 共回答了15个问题
小妖甲 共回答了15个问题 |采纳率73.3%解题思路:根据铅蓄电池的总反应式为:PbO2+Pb+2H2SO4
2PbSO4 +2H2O,其中负极:Pb+SO42--2e-=PbSO4;正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,不难看出铅蓄电池在放电过程中,负极生成PbSO4质量增加,正极生成PbSO4质量也增加;反应C(s)+CO2(g)=2CO(g)中△S>0,不能自发进行,则该反应的△H>0;利用催化剂同等程度增加正逆反应速率,平衡不发生移动,并不能提高反应物的平衡转化率;按金属活动性顺序,金属性依次减弱,金属单质还原性也依次减弱,对应离子氧化性依次增强,同时Fe3+对应排在Cu2+之后.另外据Fe3++Cu=Fe2++Cu2+、通电 .
Fe+Cu2+=Fe2++Cu也不难看出溶液中的氧化性依次减弱次序为:Fe3+>Cu2+>Zn2+.A、铅蓄电池电极反应:负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O 不难看出铅蓄电池在放电过程中,负极生成PbSO4质量增加,正极生成PbSO4质量也增加,故A错误;
B、因熵增、焓减的化学反应可能自发进行,反应气体体积增大△S>0,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,故B正确;
C、因催化剂能同等程度地加快正逆反应速率,对平衡移动无影响,则不能提高反应物的平衡转化率;故C错误;
D、由Fe3++Cu=Fe2++Cu2+、Zn+Cu2+=Zn2++Cu可判断出溶液中的氧化性依次减弱次序为:Fe3+>Cu2+>Zn2+,故D正确.
故选:AC.点评:
本题考点: 常见化学电源的种类及其工作原理;氧化性、还原性强弱的比较;反应热和焓变;化学平衡的影响因素.
考点点评: 本题为小综合,主要属于基本理论的范畴,也带有元素化合物知识.做题时尤其要注意铅蓄电池的电极反应.1年前查看全部
- 铅蓄电池(放电) 正极方程式:PbO2+2e- 十4H+十硫酸根离子===~硫酸根离子是哪来的,不是正向正移,负向负移么
铅蓄电池(放电) 正极方程式:PbO2+2e- 十4H+十硫酸根离子===~硫酸根离子是哪来的,不是正向正移,负向负移么?
 爱上那片紫1年前1
爱上那片紫1年前1 -
 ticy1984 共回答了16个问题
ticy1984 共回答了16个问题 |采纳率81.3%原电池中的电解液是稀硫酸,阴离子朝阳极动,朝负极动~阳离子朝阴极动,朝正极动.硫酸根离子是来结合铅离子的.1年前查看全部
- 下列说法正确的是( )A. 铅蓄电池放电时铅电极发生还原反应B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠C. 给
下列说法正确的是( )
A. 铅蓄电池放电时铅电极发生还原反应
B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C. 给铁钉镀铜可采用CuSO4作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀 雪晶乐乐1年前1
雪晶乐乐1年前1 -
 persha 共回答了19个问题
persha 共回答了19个问题 |采纳率78.9%解题思路:A.铅蓄电池放电时铅电极为原电池的负极;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液;
D.生铁浸泡在食盐水中发生吸氧腐蚀.A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理;原电池和电解池的工作原理.
考点点评: 本题考查电化学知识,题目难度不大,注意原电池的工作原理、电镀以及金属的腐蚀及防护措施.1年前查看全部
- 下列电池中不能充电的:A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池
下列电池中不能充电的:A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池
下列电池中不能充电的:
A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池 misserick1年前1
misserick1年前1 -
 重头来过 共回答了17个问题
重头来过 共回答了17个问题 |采纳率82.4%C 【解析】充电电池之所以能够充电,原因是电池中的化学反应是可逆反应,能够通过外加电源,将电能转化为化学能,使放过电的电池恢复到原来的状态.如果其中的化学反应不可逆,电池就不能充电,普通干电池就是这样.故正确答案为C.1年前查看全部
大家在问
- 1一列特快列车和一列普快同时从上海与金华开出,特快每小时行86.5千米,普快每小时行41.5千米,经过3小时两
- 2勾股定理 在RT△ABC中,b=15,角A=45°,求c及斜边上的高
- 3he is just a boy.与he just is a boy.有什么不同呢?
- 4富勒烯足球状分子C50Cl50,碳碳单键和碳碳双键各是多少?怎么求
- 5How long will I leave with square times to love you
- 6利率的计算公式是什么?
- 7张强12分之5小时走了6分之5千米,照这样的速度,张强3小时可以走()千米,张强走8分之5千米需要多少小时?
- 8一只挂钟,它的分针长二十厘米,这分钟尖端移动12圈是( )厘米?
- 9It’s really true what people say about English politeness: i
- 10《小学生数学能力培养课例研究》读后感(一)
- 11赵一博先生演讲作文六百字
- 125又八分之三=4又八分之几=3又八分之几=八分之几?
- 13won‘t you take part in the meeting ————tomorrow.
- 14实验测得一氧化碳和氧气混合气体的密度是氢气的14、5倍,其中氧气的质量分数为
- 15等价无穷小有传递性吗?
