化学电源的正负极方程式,如何判断要加水还是氢氧根,或者是氢离子
 w2339232022-10-04 11:39:542条回答
w2339232022-10-04 11:39:542条回答写正极或负极方程式时.我要怎么判断该加氢氧根还是加水,或者是加氢离子阿

已提交,审核后显示!提交回复
共2条回复
 modernsky 共回答了30个问题
modernsky 共回答了30个问题 |采纳率93.3%- 酸性条件就是加氢离子 碱性条件下加氢氧根
- 1年前
 summerjob 共回答了65个问题
summerjob 共回答了65个问题 |采纳率- 酸性条件就是加氢离子 碱性条件下加氢氧根
- 1年前
相关推荐
- 铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸.放电时,该电池总反应式为:Pb+PbO2+2H
铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸.放电时,该电池总反应式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O.请根据上述情况判断:放电 充电
(1)该蓄电池的负极材料是______,放电时发生______(填“氧化”或“还原”)反应.
(2)该蓄电池放电时,电解质溶液的酸性______(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向______(填“正”或“负”)极.
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上.试写出该电池放电时,正极的电极反应______(用离子方程式表示).
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池.若电解质为KOH溶液,则氢氧燃料电池的负极反应式为______.该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气______m3. 不挑剔1年前1
不挑剔1年前1 -
 春雨阁楼 共回答了28个问题
春雨阁楼 共回答了28个问题 |采纳率82.1%解题思路:(1)铅蓄电池中,负极上金属失电子化合价升高;
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅,溶液中氢离子浓度降低,阴离子向负极移动;
(3)工作时,该铅蓄电池正极上PbO2得电子发生还原反应;
(4)碱性条件下,负极氢气失电子生成水;根据转移电子相等进行计算.(1)铅蓄电池中,根据原电池反应式中元素化合价变化知,Pb中Pb元素化合价由0价变为+2价,被氧化发生氧化反应,所以Pb作负极,故答案为:Pb;氧化;
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减小,原电池放电时阴离子向负极移动,故答案为:减小;负;
(3)工作时,该铅蓄电池正极上PbO2得电子发生还原反应,电极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过1×103 mol e-,消耗氧气为[1/4]×103 mol,所以氧气的体积为[1/4]×103 mol×22.4L/mol=5.6×103L=5.6m3;
故答案为:PbO2+SO42-+2e-+4H+═PbSO4+2H2O;
(4)燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O,
故答案为:2H2+4OH-=4H2O+4e-;5.6.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池工作原理的应用,题目难度中等,注意把握电极方程式的书写方法,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.1年前查看全部
- 电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是______能转化成了______能.
 yb21791年前1
yb21791年前1 -
 jordandulei 共回答了14个问题
jordandulei 共回答了14个问题 |采纳率92.9%解题思路:此题涉及了能量守恒定律的原则,物质的状态变化一般伴随着能量变化,化学变化不但生成新物质而且还会伴随着能量的变化,这种能量变化经常表现为热能、光能和电能的放出或吸收.反之其它形式的能也可以转化为化学反应存储起来.根据能量守恒定律,自然界中的能量既不能凭空产生,也不能凭空消失,而且不同形式的能量可以相互转化的规律.所以电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是可以实现电能向化学能的转变.
故答案为:电;化学.点评:
本题考点: 物质发生化学变化时的能量变化.
考点点评: 解答此类题型时的关键是正确运用能量守恒定律,对一些现象进行合理的解释.1年前查看全部
- 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(
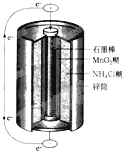 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-═2MnO(OH)+2OH-
F极:Zn+2NH4Cl═Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.只有自发的氧化还原反应才可能设计成原电池
C.从结构上分析,锌锰电池应属于二次电池
D.锌锰干电池工作一段时间后石墨棒变细 切割瓦拉1年前1
切割瓦拉1年前1 -
 倚树而眠 共回答了20个问题
倚树而眠 共回答了20个问题 |采纳率95%解题思路:A、原电池的正极发生得电子的还原反应,E极是电池正极,发生的是还原反应;
B、依据原电池形成条件分析,活泼型不同的电极,电解质溶液,闭合回路,自发进行的氧化还原反应分析;
C、锌锰电池应属于一次电池;
D、原电池中石墨做正极不发生变化.A、依据电池反应分析,E电极是原电池的正极,是得到电子发生的还原反应,故A错误;
B、只有自发进行的氧化还原反应才可以设计成原电池,实现化学能转化为电能的变化,故B正确;
C、从结构上分析,碱性锌锰电池电池中的活性物质消耗到一定程度就不能再使用了,不能多次重复使用,锌锰电池应属于一次电池,故C错误;
D、锌锰电池中石墨做原电池的正极不发生反应,所以石墨电极不变细,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生一次电池锌锰电池的工作原理,可以根据原电池原理来回答,属于教材知识的考查,难度不大.1年前查看全部
- 电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内有溶质质量分数为3
电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内有溶质质量分数为31%的硫酸溶液,若用98%(密度为1.84克/厘米 3 )的浓硫酸配制上述硫酸溶液,则浓硫酸和水的体积比约是( ) A.1:3 B.3:1 C.1:4 D.4:1  huqin511年前1
huqin511年前1 -
 ghifbsn 共回答了16个问题
ghifbsn 共回答了16个问题 |采纳率75%设配制时使用浓硫酸的体积为x,使用水的体积为y
x×1.84g/ cm 3 ×98%
y×1g/ cm 3 +x×1.84g/ cm 3 ×100%=31%
x:y=1:4
故选C.1年前查看全部
- 下列关于化学电源的说法正确的是( )
下列关于化学电源的说法正确的是( )
A.干电池放电之后还能再充电
B.氢氧燃料电池是一种环境友好电池
C.充电电池可以无限制地反复放电、充电
D.充电电池在放电和充电时都是将化学能转化为电能 曦凌1年前1
曦凌1年前1 -
 siwang_h 共回答了18个问题
siwang_h 共回答了18个问题 |采纳率77.8%解题思路:A.干电池为一次电池;
B.氢氧燃料电池产物为水;
C.充电电池可反复充电使用,但有使用寿命;
D.从能量变化的角度分析.A.干电池为一次电池,不能充电,二次电池还能在充电,故A错误;
B.氢氧燃料电池产物为水,没有产生污染性物质,为环境友好电池,故B正确;
C.充电电池可反复充电使用,但有使用寿命,不能无限制使用,当电解质和电极发生变质时,则电池不能在使用,故C错误;
D.充电时电能转化为化学能的过程,放电是化学能转化为电能的过程,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查综合考查电化学知识,侧重于原电池的使用,注意把握原电池工作原理,易错点为C,注意了解充电电池的使用.1年前查看全部
- 作为化学电源的电池有哪些其中可反复充放电的是
 月上心头5271年前2
月上心头5271年前2 -
 huzidaong 共回答了2个问题
huzidaong 共回答了2个问题 |采纳率锂电池1年前查看全部
- (2011•云南)铅蓄电池是一种电压稳定,使用方便、安全,又可以循环使用的化学电源.为测定某铅蓄电池所用硫酸溶液的溶质质
(2011•云南)铅蓄电池是一种电压稳定,使用方便、安全,又可以循环使用的化学电源.为测定某铅蓄电池所用硫酸溶液的溶质质量分数,取这种硫酸溶液100g,加入13g锌恰好完全反应.试计算:
(1)生成气体的质量为多少克?
(2)该铅蓄电池所用硫酸溶液的溶质质量分数是多少?
(反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑) 冰封之翼1年前1
冰封之翼1年前1 -
 mxmxh 共回答了13个问题
mxmxh 共回答了13个问题 |采纳率92.3%解题思路:稀硫酸为混合物,所以解答时根据锌的质量结合反应的化学方程式求出生成气体的质量、稀硫酸中硫酸的质量,进而求出硫酸溶液中溶质的质量分数;根据锌的质量求出反应后生成硫酸锌的质量,然后根据溶液正溶质的质量分数求出其溶质的质量分数即可.设生成气体的质量为x,参加反应的硫酸质量为y.
Zn+H2SO4=ZnSO4+H2↑
65982
13gyx
[65/13g=
98
y=
2
x]
x=0.4gy=19.6g
铅蓄电池所用硫酸溶液的溶质质量分数=[19.6g/100g]×100%=19.6%…1分
答案:
(1)生成的气体质量为0.4g;
(2)铅蓄电池所用硫酸溶液的溶质质量分数是19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据质量守恒定律,反应后所得溶液的质量=参加反应金属的质量+加入的稀硫酸的质量-放出气体的质量,并掌握方程式计算的解题格式,溶质的质量分数的计算方法.1年前查看全部
- 下列关于化学电源的叙述错误的是 [ ] A.普通锌锰干电池中碳棒为正极
下列关于化学电源的叙述错误的是 [ ]A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO 2 的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池的能量和储存时间比普通锌锰干电池高 sdatqwtwq7eq1年前1
sdatqwtwq7eq1年前1 -
 princessxuj 共回答了23个问题
princessxuj 共回答了23个问题 |采纳率82.6%B1年前查看全部
- 下列关于化学电源的说法正确的是( ) A.干电池放电之后还能再充电 B.氢氧燃料电池是一种环境友好电池 C.充电电池可
下列关于化学电源的说法正确的是( ) A.干电池放电之后还能再充电 B.氢氧燃料电池是一种环境友好电池 C.充电电池可以无限制地反复放电、充电 D.充电电池在放电和充电时都是将化学能转化为电能  adam13141年前1
adam13141年前1 -
 oqf0 共回答了20个问题
oqf0 共回答了20个问题 |采纳率100%A.干电池为一次电池,不能充电,二次电池还能在充电,故A错误;
B.氢氧燃料电池产物为水,没有产生污染性物质,为环境友好电池,故B正确;
C.充电电池可反复充电使用,但有使用寿命,不能无限制使用,当电解质和电极发生变质时,则电池不能在使用,故C错误;
D.充电时电能转化为化学能的过程,放电是化学能转化为电能的过程,故D错误.
故选B.1年前查看全部
- 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO 2 +2H 2 O+2e - ==2MnO(OH)+2OH -
F极:Zn+2NH 4 Cl==Zn(NH 3 ) 2 Cl 2 +2H + +2e -
总反应式:2MnO 2 +Zn+2NH 4 Cl === 2MnO(OH)+Zn(NH 3 ) 2 Cl 2
下列说法正确的是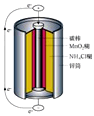 [ ]
[ ]A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的 装c装A1年前1
装c装A1年前1 -
 春风渡口 共回答了16个问题
春风渡口 共回答了16个问题 |采纳率81.3%B1年前查看全部
- 下列有关化学电源电极的叙述不正确的是( )
下列有关化学电源电极的叙述不正确的是( )
A.锌锰碱性电池的负极材料为锌
B.铅蓄电池的负极材料为铅
C.镍镉电池的负极材料为镍
D.锂电池的负极材料为锂 荔乡dd1年前1
荔乡dd1年前1 -
 ttkk77 共回答了20个问题
ttkk77 共回答了20个问题 |采纳率95%解题思路:在原电池中,较易失电子的金属或燃料所在电极作负极,得电子的电极是正极,正极上发生还原反应,负极上发生氧化反应.A.锌锰碱性电池中,锌易失电子作负极,电极反应式为Zn-2e-=Zn 2+,故A正确;
B.铅蓄电池放电时,铅易失电子作负极,电极反应式为:Pb(s)+SO42-(aq)-2e-=PbSO4(s),故B正确;
C.放电时的反应方程式:Cd+2NiO(OH)+2H2O=2Ni(OH)2+Cd(OH)2,Cd失电子而作负极,故C错误;
D.锂电池中,锂易失电子而作负极,电极反应式为:4Li-4e-=4Li+,故D正确,
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了原电池的电极材料,知道常见新型原电池正负极,并明确其原理,难度中等.1年前查看全部
- 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反
 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,NaOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
a极CH4-8e-+10OH-=CO32-+7H2Ob极2O2+8e-+4H2O=8OH-
关于此燃料电池的下列说法不正确的是( )
A.通入CH4的a极为电池的负极
B.电子由a极流入b极
C.电流由b极流入a极
D.该装置能将电能转化为化学能 层xx钗1年前1
层xx钗1年前1 -
 中了1000万 共回答了20个问题
中了1000万 共回答了20个问题 |采纳率95%解题思路:A.失电子发生氧化反应的电极为负极;
B.电子从负极沿导线流向正极;
C.电流从正极沿导线流向负极;
D.将化学能转化为电能的装置是原电池.A.根据电极反应式知,甲烷失电子发生氧化反应,所以通入甲烷的电极为负极,故A正确;
B.通入甲烷的电极a为负极,通入氧气的电极b为正极,电子从负极a流向正极b,故B正确;
C.电流的流向与电子流向相反,从b流向a,故C正确;
D.该装置属于原电池,是将化学能转化为电能的装置,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了氢氧燃料电池,根据电极上得失电子、电子流向、原电池的概念来分析解答即可,注意燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,题目难度不大.1年前查看全部
- 原电池与化学电源是什么关系?是并列还是包含?
 wjlovextt1年前1
wjlovextt1年前1 -
 wuzhibin 共回答了21个问题
wuzhibin 共回答了21个问题 |采纳率85.7%化学电源是利用原电池原理,只不过在我们研究的简单原电池的基础上更加复杂化.应该说原电池包含了化学电源1年前查看全部
- 关于化学电源的叙述,错误的是A.化学电源均是根据原电池的工作原理设计的B. 在干电池中,碳棒只起导电作用,并不参加化学反
关于化学电源的叙述,错误的是
A.化学电源均是根据原电池的工作原理设计的
B. 在干电池中,碳棒只起导电作用,并不参加化学反应
C. 镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D. 燃料电池是一种高效、环保的新型化学电源 hjqrbn1年前1
hjqrbn1年前1 -
 娃哈哈0afo 共回答了15个问题
娃哈哈0afo 共回答了15个问题 |采纳率100%C
分析:A、化学电源均是根据原电池的工作原理设计的;
B、在干电池中,碳棒为正极,正极上是二氧化锰得电子的反应;
C、根据废旧电池的污染性来回答;
D、根据燃料电池的特点来回答.
A、化学电源均是根据原电池的工作原理设计的,故A正确;
B、在干电池中,碳棒为正极,正极上是二氧化锰得电子的反应,碳棒不参与化学反应,故B正确;
C、因为废旧的镍镉电池有腐蚀性和污染性,不能随意丢弃,故C错误;
D、燃料电池是一种高效、环保的新型化学电源,故D正确.
故选C.1年前查看全部
- 用A元素的单质和B元素的单质可制成新型的化学电源,两个电极均为多孔性碳,请写出正负极的反应式
用A元素的单质和B元素的单质可制成新型的化学电源,两个电极均为多孔性碳,请写出正负极的反应式
负极:2H2 +4oH- -4e-=4H2O
正极:O2+2H2O+4e-=4oH-
这两个反应式从题目中是怎么写出的? 第一通缉犯1年前1
第一通缉犯1年前1 -
 鸡西市长带头ee 共回答了19个问题
鸡西市长带头ee 共回答了19个问题 |采纳率100%应该从新型的化学电源入手
常见的化学电源有铅蓄电池、锂电池、燃料电池等
只有燃料电池的两个电极均为多孔性碳
燃料电池除了H2和O2这种外,还有天然气那种,但是题目规定AB是单质
所以就是H2和O2燃料电池了
剩下的就是电极反应了
负极:2H2 +4oH- -4e-=4H2O
正极:O2+2H2O+4e-=4OH-1年前查看全部
- 原电池是化学电源的一种马吗?
 飘洋过海19971年前3
飘洋过海19971年前3 -
 冷翠滴 共回答了19个问题
冷翠滴 共回答了19个问题 |采纳率78.9%是利用原电池原理,只不过在我们研究的简单原电池的基础上更加复杂化.应该说原电池包含了1年前查看全部
- 关于化学电源的叙述,错误的是( )
关于化学电源的叙述,错误的是( )
A.化学电源均是根据原电池的工作原理设计的
B.在干电池中,碳棒只起导电作用,并不参加化学反应
C.镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D.燃料电池是一种高效、环保的新型化学电源 rr站客1年前1
rr站客1年前1 -
 屏障_oo 共回答了16个问题
屏障_oo 共回答了16个问题 |采纳率87.5%解题思路:A、化学电源均是根据原电池的工作原理设计的;
B、在干电池中,碳棒为正极,正极上是二氧化锰得电子的反应;
C、根据废旧电池的污染性来回答;
D、根据燃料电池的特点来回答.A、化学电源均是根据原电池的工作原理设计的,故A正确;
B、在干电池中,碳棒为正极,正极上是二氧化锰得电子的反应,碳棒不参与化学反应,故B正确;
C、因为废旧的镍镉电池有腐蚀性和污染性,不能随意丢弃,故C错误;
D、燃料电池是一种高效、环保的新型化学电源,故D正确.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查学生化学电源的有关知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久
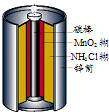 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
E极:2MnO2+2H2O+2e-═2MnO(OH)+2OH-
F极:Zn+2NH4Cl-2e-═Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的 qfgj1年前1
qfgj1年前1 -
 同为天崖沦落人 共回答了19个问题
同为天崖沦落人 共回答了19个问题 |采纳率94.7%解题思路:A、原电池的正极发生得电子的还原反应;
B、原电池的负极发生失去电子的氧化反应;
C、锌锰电池应属于一次电池;
D、一次电池内部发生的氧化还原反应是不可逆的.A、原电池的E极发生的是得电子的还原反应,是正极反应,故A错误;
B、原电池的F极发生失去电子的氧化反应,F电极应该是负极,故B正确;
C、从结构上分析,锌锰电池应属于一次电池,故C错误;
D、锌锰电池应属于一次电池,一次电池内部发生的氧化还原反应是不可逆的,故D错误.
故选B.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查学生一次电池锌锰电池的工作原理,可以根据所学知识来回答,属于教材知识的考查,难度不大.1年前查看全部
- 铅蓄电池是一种电压稳定,使用方便、安全、可靠,又可以循环使用的化学电源,应用非常广泛.为测定某铅蓄电池所用硫酸溶液中溶质
铅蓄电池是一种电压稳定,使用方便、安全、可靠,又可以循环使用的化学电源,应用非常广泛.为测定某铅蓄电池所用硫酸溶液中溶质的质量分数,做了如下实验:取24.5g这种硫酸溶液加入30g20%的NaOH溶液,两者恰好完全反应.请计算:
(1)该蓄电池所用的硫酸溶液中溶质的质量分数;
(2)用98%的浓硫酸配制196g上述硫酸溶液,需要水多少毫升?(水的密度按1g/cm 3 计算) zjdai1年前1
zjdai1年前1 -
 lanjunl 共回答了19个问题
lanjunl 共回答了19个问题 |采纳率89.5%(1)设所用的硫酸溶液中溶质硫酸的质量为x
H 2 SO 4 +2NaOH=Na 2 SO 4 +2H 2 O
98 80
x30g×20%
98:80=x:(30g×20%)
解之得 x=7.35g
所用的硫酸溶液中溶质硫酸的质量分数=
7.35g
24.5g ×100% =30%
答:该蓄电池所用的硫酸溶液中溶质硫酸的质量分数为30%;
(2)设需要水的质量为y
(196g-y)×98%=196g×30%
解之得 y=136mL(合136g)
答:需要水136毫升.1年前查看全部
- 我是高二的学生,现在在学化学电源,我想问一下铅蓄电池中负极pb+硫酸根+失电子=硫酸铅.正极pb02+4氢离子+硫酸根离
我是高二的学生,现在在学化学电源,我想问一下铅蓄电池中负极pb+硫酸根+失电子=硫酸铅.正极pb02+4氢离子+硫酸根离子+两个电子=硫酸铅+水.我想问一下,为什么电极反应中会有硫酸根离子和氢离子参见反应?还有碱性锌锰电池为什么负极负极有氢氧根离子,正极有水参加反应,而且还生成氢氧根~请问为什么呀?
 可爱小柠檬1年前1
可爱小柠檬1年前1 -
 418384708 共回答了24个问题
418384708 共回答了24个问题 |采纳率83.3%有H2SO4 参加反应这是因为铅蓄电池是以浓硫酸为电解质溶液的
Pb2+和SO42-反应得到PbSO4沉淀,因此SO42-要写在电极反应式中
有H+是因为PbO2 生成Pb2+后多余的O和H+形成水了,所以H+要写.
碱性锌锰电池是以KOH为电解质溶液的,有OH-
Zn和OH-反应得到ZnO和 H2O ,所以要写OH-
Zn和OH-的反应类似Al和OH-的反应
而正极H2O 中的H得到电子形成H2后就剩下OH-了,所以有OH-1年前查看全部
- 下列关于化学电源的叙述错误的是( )
下列关于化学电源的叙述错误的是( )
A. 普通锌锰干电池中碳棒为正极
B. 铅蓄电池中覆盖着PbO2的电极板是负极板
C. 氢氧燃料电池的正极是通入氧气的那一极
D. 碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 心髓我动16991年前1
心髓我动16991年前1 -
 huanglipin 共回答了17个问题
huanglipin 共回答了17个问题 |采纳率82.4%解题思路:A.普通锌锰干电池中锌为负极,碳棒为正极;
B.铅蓄电池中覆盖着PbO2的电极板为正极;
C.氢氧燃料电池的正极通入氧气;
D.碱性锌锰干电池与普通干电池比较,性能高,使用时间长.A.普通锌锰干电池中锌为负极,发生氧化反应,碳棒为正极,发生还原反应,故A正确;
B.铅蓄电池中覆盖着PbO2的电极板为正极,发生还原反应,铅为负极,故B错误;
C.氢氧燃料电池的正极通入氧气,发生还原反应,负极通入氢气,发生氧化反应,故C正确;
D.普通干电池电解质为酸性,易被腐蚀,而碱性锌锰干电池与普通干电池比较更加耐用,性能较好,故D正确.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,侧重于学生的基础知识的考查,为高频考点,注意把握常见原电池的工作原理以及相关基础知识的积累,难度不大.1年前查看全部
- 下列有关化学电源的叙述,正确的是 [ ] A.化学电源比火力发电对化学能
下列有关化学电源的叙述,正确的是 [ ]A.化学电源比火力发电对化学能的利用率高
B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C.化学电源均是安全、无污染的
D.化学电源即为可充电电池 zzzzz2z2z1年前1
zzzzz2z2z1年前1 -
 windcrane 共回答了13个问题
windcrane 共回答了13个问题 |采纳率76.9%A1年前查看全部
- 一道有关化学电源的选择LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+L
一道有关化学电源的选择
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是(CD)
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
请解释C为什么正确.
充电时,是电解池,则电池正极LiFePO4为阴极,阴极不是不反应的吗?
即使LiFePO4参与了反应,也是放电时产生的,而非电极呀…
为什么C对呢? acuilan1年前1
acuilan1年前1 -
 drabcd 共回答了16个问题
drabcd 共回答了16个问题 |采纳率93.8%充电时LiFePO4中Fe元素被氧化,所以了Li+跑出来,进入负极,被还原成了Li
所以正极质量减少 充电时原电池的正极接电源正极的1年前查看全部
- (8分)化学电源在通讯、交通及日常生活中有着广泛的应用。
(8分)化学电源在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H 2 O 2Ni(OH) 2 +Cd(OH) 2 ,已知Ni(OH) 2 和Cd(OH) 2 均难溶于水但能溶于酸,以下说法中正确的是 (填序号)
2Ni(OH) 2 +Cd(OH) 2 ,已知Ni(OH) 2 和Cd(OH) 2 均难溶于水但能溶于酸,以下说法中正确的是 (填序号)
①以上反应不是可逆反应②电解质溶液为硫酸
③充电时化学能转变为电能④镉(Cd)为负极,发生还原反应
⑤放电时正极区pH升高
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为: 则负极反应式为___ ____________ _ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”)
则负极反应式为___ ____________ _ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”) 宋凌子1年前1
宋凌子1年前1 -
 niushi0159 共回答了14个问题
niushi0159 共回答了14个问题 |采纳率100%(每空2分)(1)①⑤ (2)H 2 -2e – +2OH — =2H 2 O O 2 +2H 2 O+ 4e – =4OH – 变小
考查电化学的综合应用。
(1)应用放电和充电的反应条件不同,所以反应不是可逆反应,选项①正确;Ni(OH) 2 和Cd(OH) 2 均难溶于水但能溶于酸,所以电解质不能用硫酸,选项②不正确;充电相当于电解,电能转化为化学能,选项③不正确;放电是镉失去电子,发生氧化反应,作负极,选项④不正确;放电时正极电极反应式是2NiO(OH) - +2e - +2H 2 O=2OH - +2Ni(OH) 2 ,所以放电时正极区pH升高,选项⑤正确,答案选①⑤。
(2)原电池负极失去电子,所以氢气在负极通入,电极反应式是H 2 -2e – +2OH — =2H 2 O;氧气在正极通入,电极反应式是O 2 +2H 2 O+ 4e – =4OH – 。由于反应中有水生成,所以氢氧化钾的浓度降低,pH变小。1年前查看全部
- 电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是______能转化成了______能;太空飞船所用的氢燃料
电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是______能转化成了______能;太空飞船所用的氢燃料电池是一种将______的装置(填能量形式转化).
 大盘短线王1年前1
大盘短线王1年前1 -
 牛P57124 共回答了15个问题
牛P57124 共回答了15个问题 |采纳率100%解题思路:此题涉及了能量守恒定律的原则,物质的状态变化一般伴随着能量变化,化学变化不但生成新物质而且还会伴随着能量的变化,这种能量变化经常表现为热能、光能和电能的放出或吸收.反之其它形式的能也可以转化为化学反应存储起来.根据能量守恒定律,自然界中的能量既不能凭空产生,也不能凭空消失,而且不同形式的能量可以相互转化的规律.所以电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是可以实现电能向化学能的转变.而
氢燃料电池是一种将化学能转化成电能的过程.
故答案为:电;化学;化学能直接转化为电能.点评:
本题考点: 物质发生化学变化时的能量变化.
考点点评: 解答此类题型时的关键是正确运用能量守恒定律,对一些现象进行合理的解释.1年前查看全部
- 怎样书写化学电源正负极的反应方程式?
怎样书写化学电源正负极的反应方程式?
如:Zn—2e-==Zn2+ 负极(锌)发生的反应.是怎样写出来的? 将oo挤成微笑1年前1
将oo挤成微笑1年前1 -
 meimeizr 共回答了20个问题
meimeizr 共回答了20个问题 |采纳率90%分清原电池和电解池的区别就很清楚了
化学电池为原电池
原电池:将化学能转变成电能的装置,负极:氧化反应,金属失电子;正极:还原反应,溶液中的阳离子得电子或者氧气得电子(吸氧腐蚀).形成条件:① 活动性不同的两电极(连接)② 电解质溶液(电极插入其中并与电极自发反应)③ 形成闭合电路
电解池:将电能转变成化学能的装置;阳极:氧化反应,溶液中的阴离子失电子,或电极金属失电子;阴极:还原反应,溶液中的阳离子得电子.形成条件:①两电极接直流电源②两电极插入电解质溶液③形成闭合电路1年前查看全部
- (2004•湖州)电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内
(2004•湖州)电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内有溶质质量分数为31%的硫酸溶液,若用98%(密度为1.84克/厘米3)的浓硫酸配制上述硫酸溶液,则浓硫酸和水的体积比约是( )
A.1:3
B.3:1
C.1:4
D.4:1 h6gcogao1年前1
h6gcogao1年前1 -
 MengFanHu 共回答了21个问题
MengFanHu 共回答了21个问题 |采纳率90.5%解题思路:用98%的浓硫酸配制溶质质量分数为31%的硫酸溶液,可采取加水稀释的方法,在加水进行稀释时,所得溶液中溶质质量为浓硫酸中硫酸的质量,利用溶质的质量分数的计算公式,由稀释后所得溶液的溶质质量分数可求得浓硫酸和水的体积比.设配制时使用浓硫酸的体积为x,使用水的体积为y
x×1.84g/cm3×98%
y×1g/cm3+x×1.84g/cm3×100%=31%
x:y=1:4
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 对浓溶液加水稀释时,溶质质量不变而溶液质量随加水的量增加而使溶液中溶质质量分数减小.1年前查看全部
- 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
(1)a是______极(填“正”或“负”),其pH值______(填升高、降低或不变),b极的电极反应式______.
(2)某些碳氢化合物也可作为燃料电池的燃料,如天然气(甲烷)等.若将图中H2换成CH4时,电池内总的反应方程式为:CH4+2O2+2OH-=CO32-+3H2O.请写出a极的电极反应式______.在电池工作期间,CO32-流向______极(填a或b). 2006101818271年前1
2006101818271年前1 -
 word2003 共回答了20个问题
word2003 共回答了20个问题 |采纳率95%解题思路:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极经外电路流向正极,氢氧燃料电池的总反应为:2H2+O2=2H2O;
(2)依据燃料电池反应的原理分析,燃料被氧化做原电池的负极,氧气得到电子做原电池的正极反应还原反应;(1)氢氧燃料电池中,通入氢气的一极a为电源的负极,通入氧气的一极b为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),电极附近溶液PH降低;正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:负;降低;O2+4e-+2H2O=4OH-;
(2)电池内总的反应方程式为:CH4+2O2+2OH-=CO32-+3H2O,依据元素化合价变化得到,甲烷失去电子发生氧化反应,氧气得到电子发生还原反应,a电极是失电子发生氧化反应做负极,正极电极反应为:O2+4e-+2H2O=4OH-;总电池反应减去正极电极反应乘以2,得到负极电极反应为:CH4+10OH--8e-=CO32-+7H2O;原电池中阴离子移向负极,碳酸根离子移向负极a;
故答案为:CH4+10OH--8e-=CO32-+7H2O;a;点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池工作原理的应用,电极判断,电极反应是解题关键,题目难度中等.1年前查看全部
- 铅蓄电池是一种电压稳定,使用方便,安全,可靠,又可以循环使用的化学电源.广泛应用于国防 交通 生产 和生活中.铅蓄电池所
铅蓄电池是一种电压稳定,使用方便,安全,可靠,又可以循环使用的化学电源.广泛应用于国防 交通 生产 和生活中.铅蓄电池所以用硫酸溶液的溶质质量分数为31%(若用98%(密度为1.84gcm立方)的浓硫酸配置上述硫酸溶液,则浓硫酸雨水的体积约为?
 猫3000猫1年前1
猫3000猫1年前1 -
 涵梅子 共回答了16个问题
涵梅子 共回答了16个问题 |采纳率93.8%你问的应该是体积比吧,我们假设配1000克该容液,那么就需要310克纯硫酸,也就是310/0.98=316.3克98%的硫酸
也就是316.3/1.84=172毫升. 纯水要(1000-310)/1=690毫升水(水密度1克每毫升)
所以比为172/690=0.25=1:4
所以体积比酸比水为1比4. 祝学习进步! 望采纳1年前查看全部
- 原电池是化学电源的雏形,某同学设计了如下装置探究原电池原理.请你帮助他分析有关问题:
 原电池是化学电源的雏形,某同学设计了如下装置探究原电池原理.请你帮助他分析有关问题:
原电池是化学电源的雏形,某同学设计了如下装置探究原电池原理.请你帮助他分析有关问题:
(1)A装置中观察到碳棒上附着红色物质,原因是______(用电极反应式表示).此时锌片上发生______(填“氧化”或“还原”)反应.外电路上电子的流动方向是______.
(2)装置B中反应的离子方程式为______;与装置A相比,装置B的优点是______(写出一点即可). samuel7705831年前1
samuel7705831年前1 -
 jeff0564 共回答了16个问题
jeff0564 共回答了16个问题 |采纳率100%解题思路:(1)该装置为原电池,锌易失电子作负极,C作正极,正极上铜离子得电子发生还原反应,负极上Zn失电子发生氧化反应,电子从负极沿导线流向正极;
(2)B为原电池,负极上锌失电子,正极上铜离子得电子,据此书写离子方程式;含有盐桥原电池电流稳定.(1)该装置中,锌电极上电极反应式为Zn-2e-=Zn 2+,C电极上电极反应式为Cu2++2e-=Cu,Zn失电子发生氧化反应,电子从Zn沿导线流向Cu,
故答案为:Cu2++2e-=Cu;氧化;Zn---导线---C;
(2)B为原电池,负极上锌失电子,正极上铜离子得电子,离子反应为Zn+Cu2+=Cu+Zn 2+,与A相比,盐桥中阴阳离子分别向负极、正极移动,从而平衡电荷产生稳定电流,A中还产生热量,B中产生热量较少,所以能量转化率高,故答案为:Zn+Cu2+=Cu+Zn 2+;电流稳定、能量转化率高.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据两个原电池特点、正负极上发生的反应来分析解答,常常考查原电池设计,会根据原电池原理设计原电池,题目难度不大.1年前查看全部
- 在化学电源中,转化成电能的是 [ ] A.动能 &
在化学电源中,转化成电能的是 [ ]A.动能
B.热能
C.光能
D.化学能 zhaitaojk1年前1
zhaitaojk1年前1 -
 jackyeevivi 共回答了15个问题
jackyeevivi 共回答了15个问题 |采纳率86.7%D1年前查看全部
- 下列说法错误的是( )A.反应物能量高,生成物能量低,反应放热B.化学电源的本质是氧化还原反应C.1mol石墨转化为金
下列说法错误的是( )
A.反应物能量高,生成物能量低,反应放热
B.化学电源的本质是氧化还原反应
C.1mol石墨转化为金刚石,吸收1.895kJ的热量,说明金刚石比石墨稳定
D.酸与碱发生中和反应生成1mol水时所释放的热量称为中和热 x_1541年前1
x_1541年前1 -
 古典睡猫 共回答了15个问题
古典睡猫 共回答了15个问题 |采纳率86.7%解题思路:A、根据物质能量的变化分析;
B、氧化还原反应中存在电子转移;
C、物质具有的能量越高越不稳定;
D、根据中和热的概念分析.A、反应物能量高,生成物能量低,说明反应后物质具有的能量减少,所以反应放热,故A正确;
B、氧化还原反应中存在电子转移,所以化学电源的本质是氧化还原反应,故B正确;
C、1mol石墨转化为金刚石,吸收1.895kJ的热量,则金刚石的能量高,能量越高越不稳定,所以石墨比金刚石稳定,故C错误;
D、中和热是在稀溶液中强酸与强碱发生中和反应生成1mol水时所释放的热量,故D错误;
故选CD.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应中的能量变化、中和热的概念、物质稳定性与能量的关系等,侧重于基础知识的考查,题目难度不大.1年前查看全部
- 电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内有溶质质量分数为3
电动自行车以铅蓄电池为动力源,铅蓄电池是一种使用方便、安全、可靠,又可以循环使用的化学电源,铅蓄电池内有溶质质量分数为31%的硫酸溶液,若用98%(密度为1.84克/厘米3)的浓硫酸配制上述硫酸溶液,则浓硫酸和水的体积比约是( )
A. 1:3
B. 3:1
C. 1:4
D. 4:1 hia20041年前1
hia20041年前1 -
 再唱空城计 共回答了18个问题
再唱空城计 共回答了18个问题 |采纳率94.4%解题思路:用98%的浓硫酸配制溶质质量分数为31%的硫酸溶液,可采取加水稀释的方法,在加水进行稀释时,所得溶液中溶质质量为浓硫酸中硫酸的质量,利用溶质的质量分数的计算公式,由稀释后所得溶液的溶质质量分数可求得浓硫酸和水的体积比.设配制时使用浓硫酸的体积为x,使用水的体积为y
x×1.84g/cm3×98%
y×1g/cm3+x×1.84g/cm3×100%=31%
x:y=1:4
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 对浓溶液加水稀释时,溶质质量不变而溶液质量随加水的量增加而使溶液中溶质质量分数减小.1年前查看全部
- 甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,KOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应
甲烷燃料电池是一种新型化学电源,该电池是以铂丝为电极,KOH为电解质溶液,然后从两极分别通入甲烷和氧气,该电池的电极反应为:
X极CH4-8e-+10OH-=CO32-+7H2O
Y极2O2+8e-+4H2O=8OH-
关于此燃料电池的下列说法不正确的是( )
A.通入CH4的X极为电池的负极,通入O2的Y极为电池的正极
B.电池工作过程中溶液pH将下降
C.放电时每转移4mol电子,正极有1mol O2被氧化
D.该燃料电池的总化学方程式可表示为:CH4+2O2+2KOH=K2CO3+3H2O gbtfsdat1年前1
gbtfsdat1年前1 -
 我是活着还是gg了 共回答了17个问题
我是活着还是gg了 共回答了17个问题 |采纳率88.2%解题思路:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.A、碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,所以X极是负极,通入氧气的一极为原电池的正极,发生还原反应,Y极为正极,故A正确;
B、根据总反应:CH4+2O2+2OH-=CO32-+3H2O,则氢氧化钾被消耗,电池工作过程中溶液pH将下降,故B正确;
C、根据电极反应式:O2+2H2O+4e-=4OH-,每转移4mol电子,正极有1mol O2被还原,故C错误;
D、该电池工作时的总反应CH4+2O2+2KOH=K2CO3+3H2O,故D正确.
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应.1年前查看全部
- 电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是______能转化成了______能;太空飞船所用的氢燃料
电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是______能转化成了______能;太空飞船所用的氢燃料电池是一种将______的装置(填能量形式转化).
 billy141年前1
billy141年前1 -
 hbbdlg 共回答了17个问题
hbbdlg 共回答了17个问题 |采纳率88.2%解题思路:此题涉及了能量守恒定律的原则,物质的状态变化一般伴随着能量变化,化学变化不但生成新物质而且还会伴随着能量的变化,这种能量变化经常表现为热能、光能和电能的放出或吸收.反之其它形式的能也可以转化为化学反应存储起来.根据能量守恒定律,自然界中的能量既不能凭空产生,也不能凭空消失,而且不同形式的能量可以相互转化的规律.所以电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是可以实现电能向化学能的转变.而
氢燃料电池是一种将化学能转化成电能的过程.
故答案为:电;化学;化学能直接转化为电能.点评:
本题考点: 物质发生化学变化时的能量变化.
考点点评: 解答此类题型时的关键是正确运用能量守恒定律,对一些现象进行合理的解释.1年前查看全部
- 在化学电源中,转化成电能的是( )
在化学电源中,转化成电能的是( )
A. 动能
B. 热能
C. 光能
D. 化学能 q13641年前3
q13641年前3 -
 坐在 共回答了26个问题
坐在 共回答了26个问题 |采纳率96.2%解题思路:依据原电池原理分析,原电池是化学能转化为电能的装置.在化学电源中,电池工作时把化学能转化为电能,
故选D.点评:
本题考点: 常见的能量转化形式.
考点点评: 本题考查了原电池原理的应用和能量变化,掌握基础是关键,题目较简单.1年前查看全部
- (1)美国阿波罗宇宙飞船上使用的氢氧燃料电池(KOH溶液)是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化
(1)美国阿波罗宇宙飞船上使用的氢氧燃料电池(KOH溶液)是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形式。电极反应产生的水,经冷凝后又可作为宇航员的饮用水,发生的反应为:2H 2 +O 2 ==2H 2 O,则电极反应式分别为:负极___,正极___。
(2)如把KOH改为稀H 2 SO 4 作导电物质,则电极反应式为____、____。
(3)如把H 2 改为甲烷,KOH作导电物质,则电极反应式为____、____。如果用稀H 2 SO 4 作导电物质,则电极反应式为____、____。 真是vv啊1年前1
真是vv啊1年前1 -
 tianwensweet8652 共回答了15个问题
tianwensweet8652 共回答了15个问题 |采纳率86.7%(1)2H 2 +4OH - -4e - =4H 2 O ;O 2 +2H 2 O+4e - =4OH -
(2)2H 2 -4e - =4H + ;O 2 +4H + +4e - =2H 2 O
(3)CH 4 +10OH - -8e - =CO 3 2- +7H 2 O; O 2 +2H 2 O+4e - =4OH -
CH 4 +2H 2 O-8e - =CO 2 +8H + ;O 2 +4H + +4e - =2H 2 O1年前查看全部
- "化学电源均是根据原电池的工作原理设计的" 这句话是错误的.请举个例子,谢谢.
 lele美丽理想1年前1
lele美丽理想1年前1 -
 wenyi123 共回答了18个问题
wenyi123 共回答了18个问题 |采纳率94.4%化学电源可分为一次电源和二次电源(也叫蓄电池),其中二次电源有充电(电解池)放电(原电池)1年前查看全部
- 常见的化学电源举例子.多聚几个
 dahudahu1年前2
dahudahu1年前2 -
 nn的大黏糕 共回答了14个问题
nn的大黏糕 共回答了14个问题 |采纳率71.4%蓄电池,干电池,氢氧燃料电池,锂离子电池1年前查看全部
- 在化学电源中,转化为电能的是( ) A.动能 B.化学能 C.热能 D.太
在化学电源中,转化为电能的是()
A.动能 B.化学能 C.热能 D.太阳能  小城故事04031年前1
小城故事04031年前1 -
 加百列1314 共回答了20个问题
加百列1314 共回答了20个问题 |采纳率80%B
原电池中化学能转变成电能。1年前查看全部
- 跪求化学电源正负极上方程式的书写规律
跪求化学电源正负极上方程式的书写规律
有比如正极物质+得到的电子+?====?+离子
负极物质-失去的电子+正极生成的离子====?
这样的规律可寻吗?问号代表的物质要怎么判断? BTZXFJXE1年前4
BTZXFJXE1年前4 -
 两颗僵尸牙 共回答了22个问题
两颗僵尸牙 共回答了22个问题 |采纳率63.6%首先要拿准正极发生还原反应,得到电子;负极发生氧化反应,失去电子.总反应中氧化剂得到电子变成还原产物,该反应即为正极反应;总反应中还原剂失去电子变成氧化产物,该反应即为负极反应.每个电极反应写完这三部分后,当做离子方程式配平,溶液中有什么离子就用什么离子配平电荷,如酸性溶液一般用氢离子配平电荷等等.1年前查看全部
- 怎样正确的书写简单化学电源电极方程式
 dolphin_ming1年前1
dolphin_ming1年前1 -
 觅春宵 共回答了16个问题
觅春宵 共回答了16个问题 |采纳率87.5%首先找到正负极材料,确定得失电子1年前查看全部
- 1.电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是 ▁▁▁▁ 能转化成了▁▁▁▁ 能;太空飞船所用的氢燃
1.电动自行车常用的铅蓄电池是一种可充电的化学电源,当给它充电时是 ▁▁▁▁ 能转化成了▁▁▁▁ 能;太空飞船所用的氢燃料电池是一种将▁▁▁▁▁▁▁▁的装置(填能量形式转化)的装置
2.电灯可以照明,但在停电的时候,我们可以点燃蜡烛照明,聪明的你就这两种方法,用你知道的化学知识,找出二者3方面的差异.
1▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 2▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 3▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁▁ 回梦旧鸳机1年前1
回梦旧鸳机1年前1 -
 暗黑雾 共回答了13个问题
暗黑雾 共回答了13个问题 |采纳率92.3%1、充电是把电能转化为化学能储存起来,当然,当电动车在行驶时,就是把储存的化学能转化为电能了;燃料电池是把燃料中储存的化学能转化为电能
2、电灯照明虽然发光发热,但是没有生成新的物质,不是化学变化,而蜡烛燃烧是;
电灯照明利用的电能是其他形式的能转化过来的(如水能、风能、核能),是二级能源,而蜡烛是自己储存的化学能直接发光,算一级能源;
实在想不出第三种不同……
闪人先1年前查看全部
- 常见的_______是化学电源
 溢满酒杯1年前1
溢满酒杯1年前1 -
 凯斯米娅 共回答了18个问题
凯斯米娅 共回答了18个问题 |采纳率94.4%常见的___电池___是化学电源1年前查看全部
- 下列化学电源说法不正确的是:A.原电池发生的反应属于氧化还原反应,将化学能转化为电能 B.水果电池是高
下列化学电源说法不正确的是:A.原电池发生的反应属于氧化还原反应,将化学能转化为电能 B.水果电池是高
下列化学电源说法不正确的是:
A.原电池发生的反应属于氧化还原反应,将化学能转化为电能
B.水果电池是高效环保的家用电池
C.锌锰电池是一种一次性电池
D.燃料电池是一种高效、环境友好的发电装置,它可以提高燃料的利用率 hh航客服1年前1
hh航客服1年前1 -
 空心菜籽 共回答了13个问题
空心菜籽 共回答了13个问题 |采纳率107.7%答案应该是D
燃料电池是一种高效、环境友好的发电装置,这句话是对的,但燃料燃烧放出的能量是一定的,不会因为组成电池了,就放出更多的能量,只是把能量的释放过程延长了,我是这么理解的1年前查看全部
- 原电池中和化学电源中一般什么时候有h+和oh-参加正负级反应
 seth811年前1
seth811年前1 -
 lzxddn 共回答了17个问题
lzxddn 共回答了17个问题 |采纳率94.1%首先是水溶液中或是含有质子交换膜的原电池.熔融碳酸盐或氧化物中是不会有H+或OH-参与的.
其次酸性溶液中可以有H+参与反应,碱性溶液中可以有OH-参与反应,中性溶液中可以有H+或OH-的生成.具体要根据电荷守恒来配平.1年前查看全部
- 下列关于化学电源的说法正确的是( )
下列关于化学电源的说法正确的是( )
A.干电池放电之后还能再充电
B.充电电池在放电和充电时都是将化学能转化为电能
C.充电电池可以无限制地反复放电、充电
D.氢氧燃料电池是一种环境友好电池 yunheren8201年前1
yunheren8201年前1 -
 若稀儿 共回答了25个问题
若稀儿 共回答了25个问题 |采纳率92%解题思路:A.干电池为一次电池;
B.从能量变化的角度分析;
C.充电电池可反复充电使用,但有使用寿命;
D.氢氧燃料电池产物为水.A.干电池为一次电池,不能充电,二次电池还能在充电,故A错误;
B.充电时电能转化为化学能的过程,放电是化学能转化为电能的过程,故B错误;
C.充电电池可反复充电使用,但有使用寿命,不能无限制使用,当电解质和电极发生变质时,则电池不能在使用,故C错误;
D.氢氧燃料电池产物为水,没有产生污染性物质,为环境友好电池,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查综合考查电化学知识,侧重于原电池的使用,注意把握原电池工作原理,易错点为C,注意了解充电电池的使用.1年前查看全部
- 下列关于化学电源的叙述错误的是 [ ] A.普通锌锰干电池中碳棒为正极
下列关于化学电源的叙述错误的是 [ ]A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO 2 的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池单位质量输出的电能比普通锌锰干电池多 oo的季节SP1年前1
oo的季节SP1年前1 -
 SB客星 共回答了17个问题
SB客星 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 下列关于化学电源的说法不正确的是( )
下列关于化学电源的说法不正确的是( )
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极 wanght55331年前0
wanght55331年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1进行有关气体实验时一般需要进行尾气处理,对以下气体的处理方式分别有哪些?
- 2热带气候的特征还要温带的和寒带的
- 3运用所学经济生活知识分析我国支持小微企业发展的意义?
- 4如图,其中两圆没有的位置关系是( )
- 5out of the date反义词
- 6Her diligence and intelligence compensate for the lack of ex
- 7when you feel hope is gone,look inside and be strong,you'll
- 8如图所示是几种声音输入到示波器上时显示的波形,其中音调相同的是______;响度相同的是______,我们能辨别不同同学
- 9正常的男性体细胞的所有染色体可以表示为44+XY,则21三体综合征的女患者为什么?
- 10阅读题,一个一个回答,短文等会发,
- 11蚂蚁搬家晴必雨 蜘蛛结网雨必晴的意思
- 12people will do many things in the internet.有何错误?
- 13用方框内所给的单词适当形式填空die,part,customer,hop,quiet,catch1、Your answe
- 14甲`乙两人从A`B两地出发相向而行,两地之间的路程为11.7千米,甲每小时走3.6千米,乙每小时走4.2千米.
- 15一件小事400字
