过氧化钠具有漂白作用吗?为什么?
 123查查1232022-10-04 11:39:542条回答
123查查1232022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 woshiwap 共回答了18个问题
woshiwap 共回答了18个问题 |采纳率94.4%- 过氧化钠的漂白性是因为具有强氧化性,Na2O2与水反应生成过氧化氢,过氧化氢有强氧化性,这个漂白性不会还原
- 1年前
 yjm1860 共回答了4个问题
yjm1860 共回答了4个问题 |采纳率- 过氧化钠本身有氧化性,可以氧化有色物质使其褪色
- 1年前
相关推荐
- 某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况).以下是实验方案的一部分.
某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况).以下是实验方案的一部分.
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品中过氧化钠的含量.
①称取过氧化钠样品2.00 g ;
②把这些过氧化钠样品放入气密性良好的气体发生装置中;
③向过氧化钠样品中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容.
请回答下列问题:
⑴有1000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒.
⑵生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是
⑶据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (填“偏高”、“偏低”或“无影响”).
答案是(1)500ml(2)56ml(3)偏低 未知姓名1年前6
未知姓名1年前6 -
 星巴达 共回答了8个问题
星巴达 共回答了8个问题 |采纳率87.5%⑴ 500 mL
解析:量筒是量度液体体积的仪器.规格以所能量度的最大容量(ml)表示,常用的有10 ml、25ml、50 ml、100 ml、250 ml、500 ml、1000 ml等.外壁刻度都是以 ml为单位,10 ml量简每小格表示0.2 ml,而50 ml量筒每小格表示1ml.可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大.所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒.分次量取也能引起误差.如量取70ml液体,应选用 100ml量筒.
若2g为纯净Na2O2,则能生成287ml气体
2Na2O2 + 2H2O = 4NaOH + O2↑
那么2gNa2O2最多可以生成的O2体积为
2/78/2*22.4*1000=287.18ml
所以应该选用大于287ml的最小的量筒,也就是500ml的量筒!
⑵ 56 mL
解析:实际上就是110ml-54ml,也就是气体和液体总的体积110ml减去液体的体积54ml,就得到气体的体积!
使量筒内外液面持平;视线平视溶液凹液面底部,与刻度线相切
解析:眼睛是按直线方向看东西的,即读数时的视线方向是:眼睛-量筒刻度-液体凹液面最低处.假设量筒在左边,眼睛在右边,画图,将以上三个地方连成一条线,就可以发现:俯视时,视线是从右上方到左下方的,读出的刻度就比水平位置高;仰视时,视线是从右下方向左上方的,读出的刻度就比水平位置低了
这一题你还是画个图就一目了然了!
⑶ 偏低
解析:显然是偏低,Na2O2 + 2H2O 反应生成了H2O2,双氧水是液体,而不是气体,所以使得生成的O2↑的量减少了,从而测量结果偏低!
第二问补充:
首先你要理解一下为什么量筒内液面在110 mL处恰与水槽内液面相平?
那是因为制取气体前,烧瓶内有很多的空气,而且是大气压.该试验的基本原理是测定气体的增加量作为生成气体的体积.所以要消除原来空气的体积,必须保证空气的体积不变.压强必须调成大气压才行.
这就是量筒内液面在量筒内液面在110 mL处恰与水槽内液面相平量筒内液面在110 mL处恰与水槽内液面相平处恰与水槽内液面相平的原因.
假如量筒内液体高于水槽内,你可以想象外界大气压要比里面高,测量的气体体积就会偏大.同理,假如量筒内液体小于水槽内,外界大气压要比里面低,测量的气体体积就会偏小.
接着再谈为什么气体和液体总的体积是110ml.
这实验中有句话很重要“把这些过氧化钠样品放入气密性良好的气体发生装置中”,气密性良好说明原来烧瓶中的气体压力就是大气压,当加入液体后压力就大于大气压了.而在用排水法时还是要量筒内液面与水槽内液面相平,所以烧瓶内的液体的体积就可以看成是与生成气体体积同样性质的东西.必须用110 mL减掉54ML才能得到生成气体的体积.而得到的56ML是在标准大气压下生成气体的体积.这个问题关键就在一句话“气密性良好”.
这好像是个竞赛题吧!1年前查看全部
- 1 将2mol碳酸氢钠和一定量的过氧化钠固体混合,在加热条件下让其充分反应,反应后的固体经测定过氧化钠已无剩余,则最后固
1 将2mol碳酸氢钠和一定量的过氧化钠固体混合,在加热条件下让其充分反应,反应后的固体经测定过氧化钠已无剩余,则最后固体的物质的量为
A 1到2mol B 1到4mol C 2到4mol
2 等质量的钠,钾,锌,分别投入到含等物质的量HCL的稀盐酸中,产生氢气的多少不会出现
A锌大于钠大于钾 B钠大于钾大于锌 C钠大于锌大于钾
3 已知Cl2(氯气)+H2S=S+2HCl.常温下,向20L真空容器通入a mol H2S和b mol氯气(a和b都是正整数,且均≤5),反应完全后,容器内气体可能达到的最大密度是
A 19.25g/L B 35.5g/L C 17.85g/L D 18.25g/L
4 CS2能在O2中完全燃烧生成二氧化碳和二氧化硫,现有0.228g CS2液体在448L O2中完全燃烧,反应后混合气体的平均相对分子质量为( )
5 将同温同压下的氢气,氯气,氧气按9:4:1的体积比混合,在密闭容器中用电火花引燃,充分反应后使产物冷却液化,所得溶液的质量分数为( ) jayfeeling1年前1
jayfeeling1年前1 -
 102131314 共回答了16个问题
102131314 共回答了16个问题 |采纳率87.5%第一题答案选A
首先列出所有可能的方程式:条件都是加热,水就是水蒸气
2NaHCO3--->Na2CO3+CO2(箭头)+H2O(箭头)
2Na2O2+2H2O--->4NaOH+O2(箭头)
2NaOH+CO2--->Na2CO3+H2O(箭头)
由反应后无过氧化钠剩余,我们只要考虑2种临界情况
第一种情况:
只有2molNaHCO3,则生成的Na2CO3是1mol.
第二种情况:
Na2O2完全反应掉,将上面的方程式综合一下
对应关系式 4NaHCO3+2Na2O2-----4Na2CO3+O2(箭头)+2H2O
根据反应前后c(Na+)相等,可知所得的Na2CO3最多2mol1年前查看全部
- 氧化钠 的 化合物类型、用途、保存 过氧化钠 的 化合物类型、保存
 yushibingxin1年前2
yushibingxin1年前2 -
 jfh8112 共回答了15个问题
jfh8112 共回答了15个问题 |采纳率93.3%氧化钠 离子化合物 没有 密封
过氧化钠 离子化合物 制氧剂 密封1年前查看全部
- 除去过氧化钠中的氧化钠请写出反应的方程式.
 见习CEO1年前1
见习CEO1年前1 -
 ilyhasfe 共回答了23个问题
ilyhasfe 共回答了23个问题 |采纳率91.3%加热
2Na20+O2==2Na2O21年前查看全部
- 化学计算题,急用,一定量的的过氧化钠与二氧化碳反应后的固体物质,恰好与含0.8摩尔氯化氢的稀盐酸完全反应,并收集0.25
化学计算题,急用,
一定量的的过氧化钠与二氧化碳反应后的固体物质,恰好与含0.8摩尔氯化氢的稀盐酸完全反应,并收集0.25摩尔气体,则用物质的量表示该固体物质的组成为? lhchao19791年前1
lhchao19791年前1 -
 夏天0018 共回答了19个问题
夏天0018 共回答了19个问题 |采纳率68.4%过氧化钠与二氧化碳反应后生成碳酸钠 所以固体物质为碳酸钠和残余的过氧化钠 设未反应的过氧化钠为Y,碳酸钠为X .(过氧化钠与盐酸反应可以看成过氧化钠先和水反应生成氢氧化钠和氧气,然后氢氧化钠再和盐酸反应)
2Na2O2+2CO2=2Na2CO3+O2
NaCO3+2HCl=2NaCl+H2O+CO2
X 2X X
2Na2O2+2H2O=4NaOH+O2
Y 2Y 0.5Y
NaOH+HCl=NaCl+H2O
2Y 2Y
2X+2Y=0.8
X+0.5Y=0.25
解得 x=0.1mol y=0.3mol1年前查看全部
- 化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫磺相
化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫磺相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
查阅资料:过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气;还能与二氧化碳反应生成碳酸钠和氧气,在航空航天和潜水艇中常用作供氧剂.
设计实验:(1)过氧化钠与水反应;(2)过氧化钠与二氧化碳反应.
进行实验:
交流与讨论:通过实验,小池和小航同学知道了过氧化钠可用于航空航天和潜水艇中作为供氧剂的主要原因是:______.实验步骤 实验现象 结论 (1)①在试管中加入适量过氧化钠,再加入足量水;
②用______ 伸入试管中①黄色粉末溶解,有气泡产生
②木条复燃产物______(填“有”或“没有”)氧气;写出过氧化钠与水反应的化学方程式:
______(2)①向一定量的过氧化钠中通入适量的二氧化碳,再用实验(1)②的方法进行实验;
②向上述充分反应后的固体产物中加入稀盐酸;
③将生成的气体通入______①木条复燃
②有气泡产生
③溶液变浑浊a.气体产物与实验(1)相同;
b.实验①中______(填“有”或“没有”)碳酸钠生成.
写出碳酸钠与稀盐酸反应的化学方程式:
______ gracewater1年前1
gracewater1年前1 -
 wangoceanyang 共回答了21个问题
wangoceanyang 共回答了21个问题 |采纳率95.2%解题思路:(1)根据资料过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气可知,加水溶解有气泡产生,该气泡为氧气.为进一步确定,用带火星的木条检验,看是否复燃.根据以上信息完成化学方程式.
(2)根据资料过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气和实验现象木条复燃可知,向一定量的过氧化钠中通入二氧化碳,也生成了氧气.要确定另一种物质为碳酸钠,只要验证有碳酸根离子即可,其验证方法为:加稀盐酸产生能使石灰水变浑浊的气体.
(3)解决交流与讨论的问题思路:根据物质的性质决定物质的用途的原理,过氧化钠不但可以产生氧气,还能吸收二氧化碳.认真分析过氧化钠的性质与反应后生成物的性质,结合所学知识完成表格.
实验步骤 实验现象 结论
(1)①在试管中加入适量过氧化钠,在加入足量水;
②用带火星的木条伸入试管 ①黄色粉末溶解,有气泡产生②木条复燃 有氧气2Na2O2+2H2O═4NaOH+O2↑
(2)①向一定量的过氧化钠通入二氧化碳,再用(1)②的方法进行
②向上述充分反应后的固体产物中加入稀盐酸
③把②中产生的气体通入澄清的石灰水
①木条复燃
②有气泡产生
③溶液变浑浊 有碳酸钠
Na2CO3+2HCl═2NaCl+H2O+CO2↑因航天器和潜水艇内都是有限的空间,航天员和潜水员呼吸时需要氧气同时产生的二氧化碳,若不及时排除或反应掉,空间内二氧化碳浓度增高,航天员和潜水员会感到憋闷,影响健康.过氧化钠不但能吸收二氧化碳产生氧气,而且不需外界反应条件,不用负载过多的物质,因此过氧化钠可用于航空航天和潜水艇中作为供氧剂.
所以原因为:不需外界反应条件,过氧化钠能吸收人呼出的二氧化碳并转化成人所需的氧气,可以保持航天器和潜水艇内空气成分的稳定.点评:
本题考点: 化学实验方案设计与评价;实验探究物质的性质或变化规律;证明碳酸盐;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题根据查阅资料提供的信息并结合实验步骤和现象解决问题.主要考查读题能力,能把题目所给信息与所学知识进行牵连.知道性质决定用途,用途体现性质.1年前查看全部
- 下列有关量的比值一定等于2比1的是 A由氧化钠,过氧化钠组成的混合物中阳离子阴离子的数目
下列有关量的比值一定等于2比1的是 A由氧化钠,过氧化钠组成的混合物中阳离子阴离子的数目
下列有关量的比值一定等于2比1的是
A 由氧化钠,过氧化钠组成的混合物中阳离子与阴离子数目比
B 2摩尔/L 氯化钙溶液 与 1摩尔/L 氯化钙溶液 中溶质物质的量比
C等物质的量的钾,过氧化钠分别与足量的水反应产生气体的体积比
D100毫升 百分之98 硫酸溶液 与100毫升 百分之49的硫酸溶液中溶质质量比 hzx831年前1
hzx831年前1 -
 爱左情右 共回答了14个问题
爱左情右 共回答了14个问题 |采纳率100%答案啊 是A Na2O 中阴离子是O2-,过氧化钠中阴离子是过氧根离子 (O2 后面带2-)
所以不管怎么混合,阳离子比阴离子都是2:1
B 不告诉体积 无法求
C 1:1
D 密度不一样 所以质量比不是2:11年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 gaokeddk1年前3
gaokeddk1年前3 -
 clbdd 共回答了13个问题
clbdd 共回答了13个问题 |采纳率92.3%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
- 选择下列物质填空(填写序号): ①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜
选择下列物质填空(填写序号):
①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体
(1)固态时能导电的有_____________
(2)熔化时不破坏化学键的有_____________
(3)含有配位键的有_____________
(4)含有非极性共价键的有_____________ htsmc0051年前1
htsmc0051年前1 -
 spring89522 共回答了19个问题
spring89522 共回答了19个问题 |采纳率84.2%(1)⑧⑩
(2)②③④
(3)⑨
(4)①④⑥⑧1年前查看全部
- 五点六升二氧化碳气体迅速通过过氧化钠固体后得到四点四八升气体(气体体积均为标准状况下测定),这四点四八升气体的质量为?
 水色云轩1年前1
水色云轩1年前1 -
 文青0328 共回答了13个问题
文青0328 共回答了13个问题 |采纳率84.6%根据2Na2O2+2CO2=2Na2CO3+O2可知每1体积气体反应会产生半体积氧气
所以这里减少的体积为反应二氧化碳的一半,然后求出剩余气体中氧气和二氧化碳的质量一加即可1年前查看全部
- 某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积
某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水
试回答:
(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):___________。 (2)装置C中放入的反应物是__________和__________。
(3)装置A的作用是__________,装置B的作用是__________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意____________和____________(填写字母编号)。
a.视线与凹液面最低数相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙管液面相平 hankning1年前1
hankning1年前1 -
 奔跑_123456 共回答了21个问题
奔跑_123456 共回答了21个问题 |采纳率85.7%1年前查看全部
- 7.8克过氧化钠和二氧化碳反应生成多少氧气
 家有老狗1年前2
家有老狗1年前2 -
 lilyjyt 共回答了12个问题
lilyjyt 共回答了12个问题 |采纳率91.7%2NA2O2+ 2CO2= 2NA2CO3+ O2
156 32
7.8g x=1.6g可以产生氧气1.6克1年前查看全部
- 过氧化钠与氯化铁反应的实验现象最好附有分析.
 开发区nn1年前1
开发区nn1年前1 -
 没人来疼的小卡拉 共回答了13个问题
没人来疼的小卡拉 共回答了13个问题 |采纳率100%过氧化钠先于水反应,生成氢氧化钠和氧气,氢氧化钠与2价铁离子反应生成氢氧化铁.
先有气泡,后有红褐色沉淀.1年前查看全部
- 过氧化钠与足量的碳酸氢钠固体混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是()
过氧化钠与足量的碳酸氢钠固体混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是()
A.Na2O2.Na2CO3 B.Na2CO3
c.Na2CO3.NaOH D.Na2O2.NaOH.Na2CO3
有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成不可能是()
A.Fe.Zn B.Al.Cu C.Al.Mg D.Al.Fe 清茶R1年前3
清茶R1年前3 -
 季中权 共回答了22个问题
季中权 共回答了22个问题 |采纳率86.4%一题b
因为过氧化钠不足量,会反应完全,得到碳酸钠固体,而碳酸氢钠会完全分解和反应,得到碳酸钠和水二氧化碳,但他们以气体形式排出,所以只有碳酸钠固体..
二题选a
H2质量=11.2L*0.089g/L=1g,可求出单独用某金属的质量,Fe需28g,.Zn 需32.5g,A的最小反应量为28克才能满足题意,Mg需12g,Cu不反应需无穷大,Al需9g,混合物粉末10g,要满足条件:必要一个能在10克以下就能生成0.5摩尔气体的.BCD均符合题意.故选A.1年前查看全部
- 过氧化钠和二氧化碳反应生成碳酸钠和氧气啊是置换反应?
 此处我以走过1年前4
此处我以走过1年前4 -
 hhb92021 共回答了19个问题
hhb92021 共回答了19个问题 |采纳率89.5%不是的,置换反应反应物和生成物都有单质存在才行,但也有一例外:3O2==(静电)2O31年前查看全部
- 那种碱金属与水反应会爆炸碱金属中哪一种和水反应会爆炸,过氧化钠与水反应会爆炸吗?
 tk8905231年前4
tk8905231年前4 -
 uiui1204 共回答了22个问题
uiui1204 共回答了22个问题 |采纳率95.5%钾会的,我们老师给我们看过的.理论上钾往下的碱金属也会1年前查看全部
- 将10.6g硅和过氧化钠固体混合物加入水中,可发现剧烈反应且有气体产生,最终得到100mL只含一种溶质的澄清溶液.问:
将10.6g硅和过氧化钠固体混合物加入水中,可发现剧烈反应且有气体产生,最终得到100mL只含一种溶质的澄清溶液.问:
(1)混合物中m(Si)=_____g,n(Na2O2)=_____mol.
(2)固体混合物加入水中,所得气体在标准状况下的体积为_____L.
(3)澄清溶液中溶质的物质的量浓度=_____mol·L loveff21年前1
loveff21年前1 -
 清影独行 共回答了16个问题
清影独行 共回答了16个问题 |采纳率93.8%(1)2.8g 0.1mol
(2)1.12L
(3)1mol/L1年前查看全部
- 把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),则这3.36L气体的质量
把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),则这3.36L气体的质量是( )
A. 6.0g
B. 5.6g
C. 4.8g
D. 3.8g 清凉簿荷1年前2
清凉簿荷1年前2 -
 冰蓝啸 共回答了21个问题
冰蓝啸 共回答了21个问题 |采纳率100%解题思路:根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=
计算各组分气体的物质的量,利用m=nM计算质量.V Vm 令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2,气体体积减小△V
2 1 1
ab4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余,
所以:3.36L气体中CO2体积为4.48L-2.24L=2.24L,O2的体积为1.12L,
所以4.48L气体的质量为[2.24L/22.4L/mol]×44g/mol+[1.12L/22.4L/mol]×32g/mol=6.0g.
故选A.点评:
本题考点: 化学方程式的有关计算;钠的重要化合物.
考点点评: 本题考查根据方程式的计算,难度中等,本题采取差量法计算,可以避免单独讨论或计算判断最后气体的组成,注意差量法的理解与运用.1年前查看全部
- 取 a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加小于 a g。下列物质中能满
取 a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加小于 a g。下列物质中能满足上述结果的是
A.H 2 和 CO B.葡萄糖 C.蔗糖 D.甲酸  liumaoduo1年前1
liumaoduo1年前1 -
 深山小鼠 共回答了21个问题
深山小鼠 共回答了21个问题 |采纳率90.5%D
上述四个选项的物质完全燃烧后产物都是水和二氧化碳,
2Na 2 O 2 +2H 2 O==4NaOH+O 2 ↑ 每个Na 2 O 2 相当于增加了1个H 2
2Na 2 O 2 +2CO 2 ==2Na 2 CO 3 +O 2 ↑ 每个Na 2 O 2 相当于增加了1个CO
所以只要满足CO、H 2 、Cm(H 2 O)n这种最简式的化合物反应后固体的质量均不变,只有D不符合Cm(H 2 O)n1年前查看全部
- 过氧化钠与氯化铁溶液以1比2进行反应,化学方程式
 随便111年前1
随便111年前1 -
 阿朱掌柜的 共回答了15个问题
阿朱掌柜的 共回答了15个问题 |采纳率66.7%1.过氧化钠会和水反应,2Na2O2+2H2O=4NaOH+O2,
2.氢氧化钠跟氯化铁反应,3NaOH+FeCl3=3NaCl+Fe(OH)31年前查看全部
- 将CO2和NO的混合气体40毫升,通过足量的过氧化钠固体充分反应,剩下20毫升,则原一氧化氮体积不是
将CO2和NO的混合气体40毫升,通过足量的过氧化钠固体充分反应,剩下20毫升,则原一氧化氮体积不是
A10毫升 B20 C15 D30 aYi_1年前3
aYi_1年前3 -
 白ss 共回答了21个问题
白ss 共回答了21个问题 |采纳率90.5%2CO2+2Na2O2=2Na2CO3+O2↑
和2NO+O2=2NO2↑
两式相加得到CO2↑+Na2O2+NO↑ =Na2CO3 +NO2↑
A:NO10ml 那么CO2 30ml,则得到NO2 10ml 剩余CO2 20ml
但剩余的20mlCO2仍然可以Na2O2反应生成10ml的O2,于是剩余气体 20
B:NO15ml 那么CO2 25ml,则得到NO2 15ml 剩余CO2 5ml 20
C:NO20ml 那么CO2 20ml,则得到NO2 20ml 20
D:NO30ml 那么CO2 10ml,则得到NO2 10ml 剩余NO 20ml 30
选D1年前查看全部
- 在我们的化学课本上有这样一句话“金属钠在空气中燃烧生成过氧化钠”,但是下面的化学式是这样的:
在我们的化学课本上有这样一句话“金属钠在空气中燃烧生成过氧化钠”,但是下面的化学式是这样的:
2Na+O2〓Na2O2(2钠和1氧气加热生成1过氧化钠)
这个不是加热吗?上面说的“燃烧”应该指点燃吧? erwig1年前5
erwig1年前5 -
 19870523 共回答了24个问题
19870523 共回答了24个问题 |采纳率87.5%△ 高三后就代表点燃、加热.点燃就点一下,之后不管他,而加热是持续的.燃烧是一种现象,而点燃是过程.
△ 高三后就不那么有准确的含义了,高温煅烧、点燃、加热都用△ 表示,没必要太较真,但有的反应要注意可逆号、是否用催化剂(用就在等号上标出,没地方就标下边)1年前查看全部
- 求过氧化钠和水反应的方程式双线桥表示
 SMG导演1年前1
SMG导演1年前1 -
 利家舆松 共回答了17个问题
利家舆松 共回答了17个问题 |采纳率94.1%过氧化钠的O头上加个-1,水的O头上加个-2,氧气的O头上加个0,然后把“失2e”和“得2e”分别换成“升2”和“降2”1年前查看全部
- 过氧化钠(化学式为Na202)可用在呼吸面具中作为氧气来源.Na202能跟C02反应生成02和另一种固体化合物(用X表示
过氧化钠(化学式为Na202)可用在呼吸面具中作为氧气来源.Na202能跟C02反应生成02和另一种固体化合物(用X表示);它也能跟H20反应生成02,化学方程式为:2Na202+2H20=4NaOH+02↑.以下是某兴趣小组进行的探究活动.
(1)利用如图实验装置制取氧气,请回答有关问题.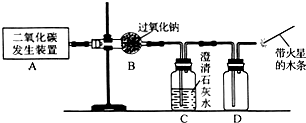
①实验室制取CO2的化学方程式为______.
②表明C02未被Na202完全吸收的实验现象为______.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的哪些性质?
答:______.
④若A装置产生的C02中混有水蒸气,要检验干燥的C02能否与Na202反应生成O2,以上实验装置应如何改进?
答:______.
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是______.
②同学们通过讨论和实验证明了X是Na2C03.以下是他们设计的有关Na2C03性质的探究实验,请根据所学知识,将表填写完整.
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是______,若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数是:______.实验操作 现象 有关的化学方程式 实验一:取少量固体样品,
____________
澄清石灰水变浑浊
Na2C03+2HCl=2NaCl+H20+C02↑
C02+Ca(OH)2=CaC03↓+H2 0实验二:取少量固体样品,
加水配成溶液,滴加适量
的______ 溶液
有白色沉淀产生______  一片椰子1年前1
一片椰子1年前1 -
 simplexueping 共回答了20个问题
simplexueping 共回答了20个问题 |采纳率90%解题思路:(1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,通常情况下,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能使澄清石灰水变浑浊;
氧气的密度比空气大,能够支持燃烧,能使带火星的木条复燃;
通过干燥装置可以干燥二氧化碳;
(2)酸和碱中都含有氢元素;
碳酸钠能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊;
碳酸钠能和氯化钙或氯化钡反应生成碳酸钙沉淀或碳酸钡沉淀;
(3)根据过氧化钠的质量、氢氧化钠溶液的质量可以计算生成氧氢氧化钠的质量,进一步可以计算生成氧气的质量氢氧化钠溶液中溶质的质量分数.(1)①实验室制取CO2的化学方程式为:CaC03+2HCl═CaCl2+H20+C02↑.
故填:CaC03+2HCl═CaCl2+H20+C02↑.
②表明C02未被Na202完全吸收的实验现象为澄清石灰水变浑浊.
故填:澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了氧气密度比空气的大,氧气有助燃性.
故填:氧气密度比空气的大,氧气有助燃性.
④改进方法是:在A、B装置之间增加气体干燥装置.
故填:在A、B装置之间增加气体干燥装置.
(2)①X肯定不是酸和碱的理由是:Na202和C02都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
故填:Na202和C02都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②实验一:
实验操作:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水中;
实验现象:有气泡产生,澄清石灰水变浑浊;
实验二:
实验操作:取少量固体样品,加水配成溶液,滴加适量的氯化钙或氯化钡溶液;
实验现象:产生白色沉淀;
反应的化学方程式为:Na2C03+CaCl2=CaC03↓+2NaCl或Na2C03+BaCl2=BaC03↓+2NaCl.
故填:滴加稀盐酸,然后将产生的气体通入澄清石灰水中;有气泡产生;氯化钙或氯化钡;
Na2C03+CaCl2=CaC03↓+2NaCl或Na2C03+BaCl2=BaC03↓+2NaCl.
(3)设生成氧气的质量为x,生成氢氧化钠的质量为y,
2Na202+2H20=4NaOH+02↑
156 16032
7.8gy x
[156/7.8g]=[160/y]=[32/x],
x=1.6g,y=8g,
氢氧化钠溶液中溶质的质量分数为:[8g/40g]×100%=20%,
故填:1.6g;20%.点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;二氧化碳的实验室制法;有关溶质质量分数的简单计算;盐的化学性质;根据化学反应方程式的计算.
考点点评: 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.1年前查看全部
- 为什么过氧化钠与水反应生成的氧气会导致溶液中氢氧根浓度增大
 camelyu1年前3
camelyu1年前3 -
 matthew_tianya 共回答了27个问题
matthew_tianya 共回答了27个问题 |采纳率88.9%2Na2O2+2H2O=4NaOH+O2
由于水解得到的NaOH是强碱,溶液只能是强碱性!1年前查看全部
- 有4克过氧化钠和碳酸钠的混合物溶于水,与100毫升物质的量浓度为1摩每升的盐酸恰好完全反应蒸干溶液,最终得到固体质量为
有4克过氧化钠和碳酸钠的混合物溶于水,与100毫升物质的量浓度为1摩每升的盐酸恰好完全反应蒸干溶液,最终得到固体质量为
A,8克
B,15.5克
C,5.85克D,无法计算 q65hg211年前2
q65hg211年前2 -
 传说天边流星 共回答了19个问题
传说天边流星 共回答了19个问题 |采纳率84.2%列方程组求设原样品中过氧化钠为x摩,碳酸钙为y摩,则:
78x+100y=4,0.5x+2y=0.1,求解即可得x,y,最终固体为氯化钠和氯化钙代其相对分子质量算即可.
望采纳!1年前查看全部
- 等质量的金属钠,氧化钠,过氧化钠和氢氧化钠分别投入100g水中,所得稀溶液的质量分数大小顺序为
等质量的金属钠,氧化钠,过氧化钠和氢氧化钠分别投入100g水中,所得稀溶液的质量分数大小顺序为
除了死算,我想问还有没有别的好的解题技巧,可以考试节约时间的那种. smweb1年前1
smweb1年前1 -
 ketav123 共回答了21个问题
ketav123 共回答了21个问题 |采纳率90.5%真是一个勤于思考的学生!
我认为可以这样来思考:钠的质量分数越大,所得稀溶液的质量分数越大.因为它们的产物都是氢氧化钠,钠的质量分数越大,等质量投入100g水中后生产的氢氧化钠的质量越大,有的虽然放出了气体,但是影响不大.从而可以较快的得到答案.1年前查看全部
- (2014•常州)过氧化钠(Na2O2)可用作呼吸面具中的供氧剂,实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其
(2014•常州)过氧化钠(Na2O2)可用作呼吸面具中的供氧剂,实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究.
【查阅资料】过氧化钠能与空气中的水和二氧化碳反应生成氧气:2Na2O2+2H2O═4NaOH+O2↑,2Na2O2+2CO2=2NaCO3+O2.
【提出问题】过氧化钠是否变质?
【猜想与假设】
假设1:过氧化钠未变质;假设2:过氧化钠部分变质;假设3:过氧化钠全部变质.
【实验探究】
【提出新问题】部分变质的过氧化钠样品中是否含有氢氧化钠呢?序号 实验步骤 实验现象 实验结论 ① 取部分固体于试管中,加入适量的水,在试管口插入带火星的木条 固体完全溶解,木条复燃 假设______不成立 ② 取少量①中溶液于试管中,滴加足量的______,振荡 有气泡生成 假设2成立
【实验探究】
实验③:取少量①中溶液于试管中,加入足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液变红.
【定性分析】
(1)由实验③可以确定①中溶液含有的溶质是______(填化学式).
(2)小明认为,由上述实验无法确定原固体药品中是否含有氢氧化钠,理由是______.
【定量分析】
称取6.04g过氧化钠药品于锥形瓶中,加入适量蒸馏水使固体完全溶解,共收集到0.64g气体;再向上述锥形瓶中加入足量的澄清石灰水,充分反应,经过滤、干燥等操作,称量固体质量为2.00g.
(1)写出加入澄清石灰水发生反应的化学方程式:______;
(2)6.04g上述样品中含有NaOH的质量为______g.
【反思提高】
过氧化钠长时间露置在空气中会全部变质,最终转化为______(填化学式). jeanvirgo1年前1
jeanvirgo1年前1 -
 gregli 共回答了22个问题
gregli 共回答了22个问题 |采纳率90.9%解题思路:【猜想与假设】根据气体的检验方法可知是氧气,根据有气泡产生,说明含有碳酸钠;
【定性分析】
(1)根据加入足量的氯化钙溶液,有白色沉淀生成,说明含有碳酸钠;静置,向上层清液中滴加2滴无色酚酞试液,溶液变红,说明含有氢氧化钠解答;
(2)根据过氧化钠与水反应能生成氢氧化钠,可推出结论是否正确;
【定量分析】
(1)根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠解答;
(2)根据氧气的质量利用化学方程式求出样品中过氧化钠的质量,利用碳酸钙的质量求出样品中碳酸钠的质量;
【反思提高】根据过氧化钠易与二氧化碳反应,还能和水反应变质解答.【猜想与假设】①取部分固体于试管中,加入适量的水,在试管口插入带火星的木条,固体完全溶解,木条复燃,可知是氧气,故假设3不正确;
②取少量①中溶液于试管中,滴加足量的稀盐酸,有气泡生成,说明含有碳酸钠;
【定性分析】
(1)加入足量的氯化钙溶液,有白色沉淀生成,说明含有碳酸钠;静置,向上层清液中滴加2滴无色酚酞试液,溶液变红,说明含有氢氧化钠,以确定①中溶液含有的溶质是NaOH、Na2CO3;
(2)滤液中滴加无色酚酞试液,若液体变红,不能证明原粉末中有NaOH,因为过氧化钠与水反应能生成氢氧化钠,不能说明原来是否存在.
【定量分析】
(1)石灰水的溶质是氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(2)设样品中含有Na2O2的质量为x,
2Na2O2+2H2O═4NaOH+O2↑
156 32
x 0.64g
[156/32=
x
0.64g]
x=3.12g
经过滤、干燥等操作后得到的固体是CaCO3,质量为2.00g,设样品中含有的Na2CO3的质量为y,
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
106100
y 2.00g
[106/100=
y
2.00g] y=2.12g
则样品中NaOH的质量=6.04g-3.12g-2.12g=0.8g
【反思提高】过氧化钠易与二氧化碳反应,还能和水反应变质,最终转化为Na2CO3
答案:
【猜想与假设】
序号实验步骤实验现象实验结论
①取部分固体于试管中,加入适量的水,在试管口插入带火星的木条固体完全溶解,木条复燃假设 3不成立
②取少量①中溶液于试管中,滴加足量的 稀盐酸,振荡有气泡生成假设2成立【定性分析】
(1)NaOH、Na2CO3;
(2)过氧化钠与水反应能生成氢氧化钠,不能说明原来是否存在;
【定量分析】
(1)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(2)0.8;
【反思提高】Na2CO3.点评:
本题考点: 药品是否变质的探究;氧气的检验和验满;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 该考点的命题方向主要是以实验探究题的形式,给出有关的信息提示和相关数据,让学生通过实验探究,分析推断出该物质的组成成分;中考的重点是考查学生通过实验的方法来研究物质的组成成分以及含量能力.1年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 angelalzn1年前1
angelalzn1年前1 -
 清醒糊涂 共回答了17个问题
清醒糊涂 共回答了17个问题 |采纳率88.2%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
- 请教:过氧化钠与碳酸氢钠共热的问题.
请教:过氧化钠与碳酸氢钠共热的问题.
过氧化钠与碳酸氢钠的混合物共热,最后得到的固体物质只有碳酸钠,请问过氧化钠与碳酸氢钠的最大比例为多少?
答案是1:2
为什么会是这样,能告诉做这种循环反应类型的题目吗?
碳酸氢钠加热 分解为碳酸钠.二氧化碳,水,
二氧化碳可以与过氧化钠反应,水也可以,然后生成的氢氧化钠又可以和碳酸氢钠反映,又生成水,又可以和过氧化钠反应....
我都晕了啊..可以告诉做这种题目的方法
 碎叶飞1年前1
碎叶飞1年前1 -
 发帖者的ww 共回答了21个问题
发帖者的ww 共回答了21个问题 |采纳率90.5%最简单的就是不管中间过程,应为得到的物质只有一个所以在最后的结果中Na+离子和CO32-离子的比例应该是2:1,而过氧化钠中有两个Na+离子,碳酸氢钠中有一个Na+离子一个CO32-离子,配平以后即可得到答案1:2
这一类的题目需要用离子来看,不需要关心中间过程就很容易得出答案
完整的解答可以这样看
2Na2O2---->加热 2Na2O+O2 换句话来说这里的过氧...1年前查看全部
- 把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A. 氧气
B. 二氧化氮
C. 二氧化氮和氧气
D. 二氧化氮和一氧化氮 爱上老虎的猫11年前1
爱上老虎的猫11年前1 -
 铁-剑 共回答了13个问题
铁-剑 共回答了13个问题 |采纳率100%解题思路:从反应的化学方程式分析,涉及的反应有:3NO2+H2O═2HNO3+NO,HNO3+NaHCO3═NaNO3+CO2↑+H2O,2Na2O2+2CO2═2Na2CO3+O2,2NO+O2═2NO2,设NO2为3mol,根据各步反应生成物的物质的量判断反应最终产物.设NO2为3mol,涉及的反应有:3NO2+H2O═2HNO3+NO,HNO3+NaHCO3═NaNO3+CO2↑+H2O,2Na2O2+2CO2═2Na2CO3+O2,2NO+O2═2NO2,则3molNO2生成2molHNO3和1molNO,通入小苏打后气体为2molCO2和1molNO,通入足量过氧化钠后生成1molO2和1molNO,1molO2和1molNO反应后生成1molNO2,剩余0.5molO2,故最后收集到的气体为1molNO2和0.5molO2,
故选C.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;钠的重要化合物.
考点点评: 本题考查物质的性质,本题题目难度不大,解答本题的关键为根据反应的化学方程式计算各步反应的物质的物质的量,最后确定气体的组成.1年前查看全部
- 请问那个反应原理是什么 为什么过氧化钠中氧元素-1价不是到氢氧化钠中的-2价 而是到水
请问那个反应原理是什么 为什么过氧化钠中氧元素-1价不是到氢氧化钠中的-2价 而是到水
请问那个反应原理是什么 为什么过氧化钠中氧元素-1价不是到氢氧化钠中的-2价 而是到水 南天31年前4
南天31年前4 -
 立青0331 共回答了22个问题
立青0331 共回答了22个问题 |采纳率90.9%氧化还原反应 元素化合价变化的特点是变到相邻价态 只靠近不交叉1年前查看全部
- 过氧化钠与二氧化碳反应生成碳酸钠和氧气的化学方程式 是?
 quyunan21711年前1
quyunan21711年前1 -
 enchantingsinger 共回答了22个问题
enchantingsinger 共回答了22个问题 |采纳率86.4%2Na2O2+2CO2=2Na2CO3+O2(一般情况下就可以反应了)这个反应一般用于潜水艇和航天制造氧气既能消耗潜水艇和航天器里的二氧化碳,又能生成氧气一举两得~~1年前查看全部
- 关于氧化还原反应的化学题过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都
关于氧化还原反应的化学题
过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都不做? 看图1年前3
看图1年前3 -
 fangkangzhen 共回答了12个问题
fangkangzhen 共回答了12个问题 |采纳率83.3%什么都不做.它的反应原理是:过氧化钠和水反应生成双氧水和氢氧化钠,然后双氧水再分解生成氧气1年前查看全部
- 16.8g碳酸氢钠和7.8g过氧化钠在密闭容器中灼烧 充分反应 将密闭容器保持温度500摄氏度 最后容器内的物质为
 2804121121年前1
2804121121年前1 -
 尹成斌 共回答了19个问题
尹成斌 共回答了19个问题 |采纳率89.5%2NaHCO3==Na2CO3+H2O+CO2
168 44
16.8 4.4
2Na2O2+2CO2===2Na2CO3+O2
156 88
7.8 4.4
由上我们可以知道,两种化合物在此条件下是恰好完全反应的,最后容器内的物质是Na2CO3
和O2,H2O1年前查看全部
- (1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______;
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______;
(2)工业上制取漂白粉的化学方程式为______.漂白粉露置于空气中失效的原因是(用化学方程式表示):
①______②2HClO
2HCl+O2↑光 .2HClO.
2HCl+O2↑光 . 油闷兔子1年前1
油闷兔子1年前1 -
 濯意儿 共回答了27个问题
濯意儿 共回答了27个问题 |采纳率88.9%解题思路:根据过氧化钠的性质和氯气的性质,以及次氯酸钙的性质即可写出化学方程式.(1)根据教材内容,过氧化钠与二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)制取漂白粉的使用的是氯气和消石灰,生成氯化钙和次氯酸钙、水,即2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,又漂白粉在空气中变质是因为其有效成分次氯酸钙与空气中的二氧化碳反应生成了次氯酸,并且次氯酸见光、受热分解,从而使漂白粉失效,即发生Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO
光
.
2HCl+O2↑,
故答案为:2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;2HClO
光
.
2HCl+O2↑.点评:
本题考点: 化学方程式的书写;氯、溴、碘及其化合物的综合应用;钠的重要化合物.
考点点评: 本题比较基础,但却因为不熟练而出错或用时过长,需要熟练掌握教材中出现的方程式,才能得心应手.1年前查看全部
- 过氧化钠和二氧化碳反应,氧化剂和还原剂分别是什么拜托各位了 3Q
 zsscool1年前1
zsscool1年前1 -
 悲伤的苹果 共回答了20个问题
悲伤的苹果 共回答了20个问题 |采纳率85%氧化剂和还原剂都是过氧化钠,这是个歧化反应
满意请采纳1年前查看全部
- 怎么证明过氧化钠和充分水反应后有过氧化氢生成
 JRlove1年前1
JRlove1年前1 -
 xubaoyoutianya 共回答了23个问题
xubaoyoutianya 共回答了23个问题 |采纳率91.3%这个是很难证明的,因为过氧化氢很不稳定,马上就分解出氧气了.1年前查看全部
- 过氧化钠与什么酸性气体反应生成氧化钠
 会唱歌的竹子1年前1
会唱歌的竹子1年前1 -
 沙锅炖小鱼 共回答了14个问题
沙锅炖小鱼 共回答了14个问题 |采纳率100%不肯能有这样的酸性气体,因为我们所谓的酸都是指的酸溶液,氧化钠只要有水就会变成氢氧化钠所以应该不存在这种可能.1年前查看全部
- 在120℃时.将2L水、1L一氧化碳、1L氧气和2L二氧化碳组成的混合气体依次缓缓通过过量的热铜粉、过量的过氧化钠和过量
在120℃时.将2L水、1L一氧化碳、1L氧气和2L二氧化碳组成的混合气体依次缓缓通过过量的热铜粉、过量的过氧化钠和过量的炽热木炭粉的三个反应管.经充分反应后,恢复到原来温度和压强.其气体体积是( )
A 6L B 5L C 3.5L D 2.5L Breepeng1年前1
Breepeng1年前1 -
 boc7 共回答了26个问题
boc7 共回答了26个问题 |采纳率92.3%过量热铜粉的反应式是:2Cu+O2=2CuO,这样,1L O2全部被吸收没有气体剩余
但是还有CO,别忘了,所以CuO+CO=Cu+CO2,所以1LCO产生1LCO2
再通过过量Na2O2,发生两个反应
2Na2O2+2H2O=4NaOH+O2 2L的H2O被吸收,生成0.5*2=1L 的氧气
2Na2O2+2CO2=2Na2CO3+O2 3L(原来有2L,后来CO生成1L)的CO2被吸收,生成0.5*3=1.5L的氧气
最后,过量炙热的木炭
2C+O2=2CO,2.5L的氧气,发生反应生成5L的CO
最后答案5L
估计是答案错了,我觉得是不太现实的1年前查看全部
- 一摩尔过氧化钠和两摩尔氢氧化钠固体在密闭容器里加热 充分反应后残留固体物质是什么
 unigrphics1年前1
unigrphics1年前1 -
 炎风血云 共回答了14个问题
炎风血云 共回答了14个问题 |采纳率100%没有反应
过氧化钠加热即使强热也不会分解
因为过氧化钠是钠在空气中燃烧生成的,如果高温下分解,燃烧的时候就分解了,就不会生成过氧化钠
过氧化钠和氢氧化钠不会反应,所以最后还是原来的混合物1年前查看全部
- 那位天才帮我解决几道化学题下列含有非极性键的共价化合物( )(1)HCI (2)过氧化钠 (3)CH4 (4)C2H2下
那位天才帮我解决几道化学题
下列含有非极性键的共价化合物( )
(1)HCI (2)过氧化钠 (3)CH4 (4)C2H2
下列说法正确的有( )
A.氢的同位素氚和氘可以大量从海里提取
B.1个质子的相对质量和1个中子的相对质量相等
C.共价化合物可能含有离子键
D.某元素的游离态为固态,化合态有可变化合价,若能形成简单阳离子则一定是过渡金属元素 vicentvip1年前3
vicentvip1年前3 -
 鼠标点点 共回答了14个问题
鼠标点点 共回答了14个问题 |采纳率100%方法:两个关键:1非极性键2共价化合物.
答案:(4).(1)(3)极性键共价化合物.(2)离子化合物.
答案:D.A氚和氘可以从海里提取但不是大量,B几乎相等.C共价化合物不可能含有离子键,离子化合物可能含有共价键.1年前查看全部
- 下列漂白原理相同的是A氯水A氯水B二氧化硫C过氧化钠D活性炭为什么?
 jiangxiqusi1年前1
jiangxiqusi1年前1 -
 94ai 共回答了14个问题
94ai 共回答了14个问题 |采纳率85.7%氯水和过氧化钠都是通过氧化还原反应达到漂白作用 ,而二氧化硫则是和有机物质生成不稳定物质,但并没有发生氧化还原反应,活性炭则是简单的通过结构上的物理吸附达到的,所以A和C相同1年前查看全部
- 将22gCO和O2的混合气体放入盛有足量的过氧化钠固体的容器中,用电火花不断点燃,充分反应后留下气体的质量为8g,则原混
将22gCO和O2的混合气体放入盛有足量的过氧化钠固体的容器中,用电火花不断点燃,充分反应后留下气体的质量为8g,则原混合气体中CO的质量为?
 hjxiou1年前1
hjxiou1年前1 -
 老木枯草 共回答了16个问题
老木枯草 共回答了16个问题 |采纳率93.8%充分反应后留下气体的质量为8g,即剩余氧气为8g;
2CO+O2=2CO2
2*28 32
x 32x/56 x+32x/56+8=22 x=8.91(g)1年前查看全部
- 氧的化合价有+1吗?我知道氧有-2的化合价,但过氧化氢和过氧化钠是怎么一回事呢?是不是特殊情况?
 知轩1年前4
知轩1年前4 -
 换个aa说xx 共回答了19个问题
换个aa说xx 共回答了19个问题 |采纳率89.5%没错氧是有-1价,H2O2就是!
不是特殊情况,而是本来就存在.这是个不争的事实,是物质世界的公理1年前查看全部
- 两种有机物以任意比例混合,一定条件下aL(标况)足量O2中充分燃烧,再将剩余的氧气和全部的生成物通过足量的过氧化钠,得到
两种有机物以任意比例混合,一定条件下aL(标况)足量O2中充分燃烧,再将剩余的氧气和全部的生成物通过足量的过氧化钠,得到气体的体积大于aL(标况),下列组合中符合此条件的是
A、CH4 C2H4
B、CH3OH CH3COOH
C、C6H6 HCOOCH3
D、HCOOH HOCH2CH2COOH 一棹春风1年前1
一棹春风1年前1 -
 低音提琴 共回答了29个问题
低音提琴 共回答了29个问题 |采纳率93.1%答案:D
答案解析:试题分析:根据题意可知,反应前后氧气的体积是不变的,这说明反应的实质相当于是CO+Na2O2=Na2CO3、H2+Na2O2=2NaOH.所以要满足条件,则物质的组成必须满足(CO)n(H2)m,因此根据物质的化学式可知,选项AC不可能,B中以任意比例混合均可以.D中二者按照1:1混合即可,所以答案选D.1年前查看全部
- 指示剂HIn(酸性显红色,碱性显黄色)中,为什么加过氧化钠不能显黄色?
 nice心情1年前2
nice心情1年前2 -
 2and3 共回答了18个问题
2and3 共回答了18个问题 |采纳率94.4%过氧化钠有强氧化性,因此具有漂白性,能将有色物质漂白.
所以加入过氧化钠的现象是先呈现黄色,然后黄色褪去.1年前查看全部
- 将质量为m 克的二氧化碳与过量过氧化钠固体充分反应,试分析固体质量的变化(谢谢大家)
 pretencer1年前3
pretencer1年前3 -
 楠喃 共回答了16个问题
楠喃 共回答了16个问题 |采纳率87.5%(1)差量法
2Na2O2+2CO2=2Na2CO3+O2 固体的分子量增大了(212-156=56)
88 56
m x
x=56m/88=7m/11 固体质量增加7m/11
(2)一般的设xy来解
2Na2O2+2CO2=2Na2CO3+O2
156 88 212
x m y x=156m/88 y=212m/88
固体质量增加=212m/88-156m/88=7m/111年前查看全部
- 过氧化钠怎样使酚酞褪色
 小傻瓜加笨1年前2
小傻瓜加笨1年前2 -
 larrylau 共回答了21个问题
larrylau 共回答了21个问题 |采纳率81%是这样的,酚酞的变色范围比较小,只能PH在8.2到10变色,所以褪色,只要大量的过氧化钠就行了
反应如下 2Na2O2+2H2O=4NaOH+O2↑
过量的过氧化钠可以增大氢氧化钠浓度,使得碱性增强1年前查看全部
大家在问
- 1(2009•蒲江县模拟)一个运动员打高尔夫球,若球的飞行高度y(m)与水平距离x(m)之间的函数表达式为,y=-[1/5
- 28克无水硫酸铜溶于水配制成0.1摩尔每升的溶液溶于几升水
- 3人以1.5m/s的速度沿平直的河堤上行走,他在平静的河水中的“倒影”相对于人的速度是( )
- 4一个根木料长七分之九米,用去了三分之七,用去了多少米?还剩多少米?
- 5船在静水中的航速为v 1 ,水流的速度为v 2 (v 1 > v 2 ).为使船行驶到河正对岸的码头,则v
- 6英语首字母题目
- 7已知两个不相同的自然数的最小公倍数是105,且两数都不为1,求出所有适合条件的自然数
- 8“山戋”合起来是什么字?
- 9英语翻译
- 10看图写一、两句话。 ______________________________________________
- 11英语翻译他正与商店老板就咖啡的价格讨价还价。为了多赚钱,我们努力工作。他比班里任何女生都高。不要翻译器。
- 12(2007•白下区二模)请你当医生.小李同学因发烧、腹泻,前往医院就诊.医生根据小李的病情,开出血常规和粪便检查的化验单
- 13在比例中,两个外项的积与两个内项的积的( )等于1.
- 14铁轨铺在路枕上是通过什么来减小压强的
- 15it's my book.(改为否定句)

