0.20mol/LNaOH与0.20mol/L醋酸等体积混合后溶液PH?0.20mol/L氨水与0.20mol/L盐酸等
 spider10272022-10-04 11:39:541条回答
spider10272022-10-04 11:39:541条回答我是医学检验大一学生,高中学过但是忘记了,最好可以用大学的知识~

已提交,审核后显示!提交回复
共1条回复
 无法没天 共回答了13个问题
无法没天 共回答了13个问题 |采纳率92.3%- 0.20mol/LNaOH与0.20mol/L醋酸等体积混合后生成0.1mol/L醋酸钠,溶液呈碱性.
[OH-]=√([醋酸钠]×Kb)=√(0.1×5.71×10^-10)=7.556×10^-6
PH=14-POH=14-5.12=8.88
☆☆☆☆☆
NH4^+的Ka=1.75×10^-5(印象中)
[H+]=√(0.1×1.75×10^-5)=1.32×10^-3
PH=2.88 - 1年前
相关推荐
- 溶液渗透压计算问题已知0.20mol · L-1蔗糖溶液的渗透压为P1 ,而0.10mol · L-1KCl溶液的渗透压
溶液渗透压计算问题
已知0.20mol · L-1蔗糖溶液的渗透压为P1 ,而0.10mol · L-1KCl溶液的渗透压为P2 ,它们之间的关系是 (1).P1 =P2 (2).P1 > P2
(3).P1 < P2 (4).无法确定 拈花不笑1年前5
拈花不笑1年前5 -
 fishmin 共回答了15个问题
fishmin 共回答了15个问题 |采纳率93.3%渗透压与绝对温度和溶液的渗透浓度成正比.渗透浓度是指单位体积溶液中溶质微粒(包括分子和离子)总数.因KCl在溶液中电离为k+和cl-,而蔗糖是非电解质,溶液中以分子态存在,所以0.10mol · L-1KCl溶液的渗透浓度等于0.20mol · L-1蔗糖溶液的渗透浓度,二者的渗透压相等,应选(1)项.1年前查看全部
- 配制pH=7.21的缓冲溶液500ml,0.10MOL.NAH2PO4和0.20MOL.LNAOH各多少ML?(H3PO
配制pH=7.21的缓冲溶液500ml,0.10MOL.NAH2PO4和0.20MOL.LNAOH各多少ML?(H3PO4:PKA2=7.21)
加急,麻烦帮忙做下, rcsc20061年前1
rcsc20061年前1 -
 bens808 共回答了12个问题
bens808 共回答了12个问题 |采纳率91.7%首先:pKa2=-lg([HPO4 2-][H+]/[H2PO4 -]) pH=-lg[H+]
所以:pKa2=pH+lg([HPO4 2-]/[H2PO4 -]) 对数的运算,
要求:pH=7.21=pKa2 则lg([HPO4 2-]/[H2PO4 -])=0;[HPO4 2-]/[H2PO4 -]=1
也就是要求加入碱后,[HPO4 2-]与[H2PO4 -]的浓度相等.
自己解一下方程,不列了
答案:400ml,0.10mol/L.NaH2PO4;100ml 0.20mol/L.NaOH1年前查看全部
- 求填空.. 0.10mol*L^-1NaCl和0.20mol*L^-1KBr混合溶液的离子强度为( )? 求大神解答..
 guweixiang1年前1
guweixiang1年前1 -
 金色指甲油 共回答了21个问题
金色指甲油 共回答了21个问题 |采纳率90.5%I=(0.1X1^2+0.1X1^2+0.2X1^2+0.2x1^2)=0.31年前查看全部
- 1.某一分解反应,当反应物浓度为0.20mol.L-1时反应速率为0.30mol.L-1.s-1.若该反应为二级反应,当
1.某一分解反应,当反应物浓度为0.20mol.L-1时反应速率为0.30mol.L-1.s-1.若该反应为二级反应,当反应物浓度为0.60 mol.L-1时,反应速率是
A.0.30mol.L-1.s-1
B.0.60mol.L-1.s-1
C.0.90mol.L-1.s-1
D.2.7mol.L-1.s-1
2.下列化合物中,所有碳原子共平面的是
A.2,3-二甲基-2-丁烯
B.3-己炔
C.叔丁基苯
D.1-丁烯
3.在一绝热箱中装有水,水中有一电阻丝,由蓄电池供电,通电后水及电阻丝的温度均略升高,若以水和电阻丝作为系统,其余为环境,则有
A.Q0
D.Q=0,W>0,ΔU0,ΔU>0
4.已知下列反应在标准态下均正向自发进行Cu2+ + Sn2+ = Cu + Sn4+;2Fe3+ + Cu = 2Fe2+ + Cu2+ 设 (Cu2+/ Cu)=(1),E0(Sn4+/ Sn2+)=(2),E0(Fe3+/ Fe2+)=(3),则由大到小顺序为
A..(3)>(2)>(1)
B..(2)>(1)>(3)
C..(3)>(1)>(2)
D..(1)>(3)>(2) 雨径清幽1年前2
雨径清幽1年前2 -
 xwx1238888 共回答了19个问题
xwx1238888 共回答了19个问题 |采纳率89.5%v=kcA^2,0.3=k(0.2)^2,k=7.5,v'=kcA'^2=7.5x(0.6)^2=2.7选D,2选A,3选C,4选B1年前查看全部
- 2体积0.20mol/L氨水和1体积的0.20mol/L盐酸混合,溶液的pH为多少
2体积0.20mol/L氨水和1体积的0.20mol/L盐酸混合,溶液的pH为多少
Kb=1.76*10-5 haohaojiang1年前1
haohaojiang1年前1 -
 阿里巴巴777 共回答了21个问题
阿里巴巴777 共回答了21个问题 |采纳率76.2%反应後是等浓度NH3·H2O和NH4Cl的混合物,即是缓冲溶液.
缓冲溶液pH=pKa+lg(堿/酸),这里酸和堿的浓度一样,对数部分为0,所以pH=pKa
氨水的Kb=1.76*10-5,那麼pKb=4.74,所以pKa=9.26,即pH=9.261年前查看全部
- 硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当硫酸根离子的浓度为0.20mol每升时,加入等体积的0.20mol每升的K
硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当硫酸根离子的浓度为0.20mol每升时,加入等体积的0.20mol每升的KOH溶液(混合溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么反应后溶液中钾离子的浓度为多少?
 tracy9898981年前3
tracy9898981年前3 -
 wpf84 共回答了17个问题
wpf84 共回答了17个问题 |采纳率94.1%反应后溶液中剩钾离子,硫酸根离子和偏铝酸根离子.
溶液混合瞬间,硫酸根离子的浓度为0.10mol每升,氢氧根的浓度为0.10mol每升.
由AL3+ + 4OH- === ALO2- + H2O
0.10mol每升 X
得反应后溶液中偏铝酸根离子的浓度为X=0.025mol每升
由溶液的电中性:钾离子的浓度=硫酸根离子的浓度*2 +偏铝酸根离子的浓度
所以钾离子的浓度为0.225mol每升1年前查看全部
- 0.1mol/LH2S溶液和0.20mol/LHCL溶液等体积混合,求混合溶液的pH和S2-的浓度
 1o9oe1年前3
1o9oe1年前3 -
 djjbaby 共回答了20个问题
djjbaby 共回答了20个问题 |采纳率85%0.1mol/LH2S溶液和0.20mol/LHCL溶液等体积混合,
此时H2S基本没有电离
混合溶液的[H+]=0.10mol/L
pH=-lg0.10=1
S2-,可用分布系数来解决,也可用方程式相加来计算
H2SHS- + H+ Ka1=9.1*10^-8
HS-S2- + H+ Ka2=1.1*10^-12
H2SS2- + 2H+ K=Ka1* Ka2=9.1*10^-8 *1.1*10^-12=1.00*10^-19
K=[H+]^2*[S2-]/[H2S]
[S2-]=K*[H2S]/[H+]^2=1.00*10^-19*0.05/[(0.1)^2]=5.00*10^-19
Ka1、Ka2数据来自张祖德《无机化学》1年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L 像在梦中1年前1
像在梦中1年前1 -
 sue9972 共回答了17个问题
sue9972 共回答了17个问题 |采纳率82.4%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 问个化学的缓冲溶液问题将0.20mol/dm立方 HAc 和0.20mol/dm立方NaAc等体积混合 求缓冲溶液的pH
问个化学的缓冲溶液问题
将0.20mol/dm立方 HAc 和0.20mol/dm立方NaAc等体积混合 求缓冲溶液的pH
pH=pKa(标准浓度)-lg{[Ca/c(标准浓度)]/[Cs/c(标准浓度)]}
=4.74-lg(0.1/0.1)
请问4.74是怎么来的?
是查表吗 那么查的应该是哪个?为什么我没有查到一个4.74?
或者麻烦一下是怎么计算出来的啊? cherry_vc1年前1
cherry_vc1年前1 -
 旺仔小憨头 共回答了14个问题
旺仔小憨头 共回答了14个问题 |采纳率85.7%查醋酸的平衡常数是1.75*10(-5次方),pKa=-log(Ka)=5-log1.75=4.741年前查看全部
- 重庆一中2014级高一期末化学18,含有0.20mol碳酸钠的溶液150ml和200ml盐酸,
重庆一中2014级高一期末化学18,含有0.20mol碳酸钠的溶液150ml和200ml盐酸,
不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A 2.0mol/L B 1.6 mol/L C 0.19 mol/L D 0.24 mol/L
请解析,谢谢! jy000198841年前2
jy000198841年前2 -
 省车站 共回答了27个问题
省车站 共回答了27个问题 |采纳率74.1%一楼“而向过量盐酸中滴加碳酸钠,一旦碳酸钠达到所有盐酸的量的一半,就不会再有反应了”回答有问题,因为是滴加,盐酸始终过量,所以碳酸钠与盐酸按一比二反应.更正如下:
碳酸钠与盐酸物质的量一比一时生成碳酸氢钠和氯化钠
Na2CO3+HCl=NaHCO3+NaCl
继续滴加盐酸时产生二氧化碳
NaHCO3+HCl=H2O+CO2+NaCl
一比二时生成水,二氧化碳和氯化钠
Na2CO3+2HCl=H2O+CO2+2NaCl
如果向过量碳酸钠中加盐酸,会先以一比一的比例生成碳酸氢钠再生成二氧化碳;
而向过量盐酸中滴加碳酸钠,碳酸钠与盐酸按一比二反应直接生成二氧化碳.
所以,无论如何A生成气体体积相同;B,将盐酸滴加到碳酸钠中生成二氧化碳0.12mol,将碳酸钠滴加到盐酸中生成二氧化碳0.16mol;C和D则是,将盐酸滴加到碳酸钠中不生成二氧化碳.所以答案是B.1年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L 陈新一1年前3
陈新一1年前3 -
 祈丰 共回答了18个问题
祈丰 共回答了18个问题 |采纳率88.9%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L gu-song1年前1
gu-song1年前1 -
 武林门外 共回答了19个问题
武林门外 共回答了19个问题 |采纳率100%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 100毫升0.20mol/LHAc和50毫升0.1mol/LNaOH混合后,稀释成1000ml,求溶液的pH为多少?
 吻火二次方1年前2
吻火二次方1年前2 -
 pjzkae 共回答了20个问题
pjzkae 共回答了20个问题 |采纳率90%HAc是弱酸啊,醋酸根离子是会水解的,
也就是说有15mmolch3cooh
和5mmolch3coona
我只知道以下关系
ph〈7
电荷守恒
物料守恒1年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0mol/L
B.1.5mol/L
C.0.18mol/L
D.0.24mol/L wff67891年前1
wff67891年前1 -
 wsh88188 共回答了13个问题
wsh88188 共回答了13个问题 |采纳率84.6%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 在一个5L的密闭容器中充入0.20mol二氧化硫和0.10mol氧气,半分钟后达到平衡.测得容器中含0.18mol三氧.
在一个5L的密闭容器中充入0.20mol二氧化硫和0.10mol氧气,半分钟后达到平衡.测得容器中含0.18mol三氧...
在一个5L的密闭容器中充入0.20mol二氧化硫和0.10mol氧气,半分钟后达到平衡.测得容器中含0.18mol三氧化硫,若继续通入0.20mol二氧化硫和0.10mol氧气,则平衡移动____(填正或负反应方向,或不)再次达到平衡后____mol 风卷云出1年前2
风卷云出1年前2 -
 lugia0039 共回答了20个问题
lugia0039 共回答了20个问题 |采纳率85%向正方向移动,因为气体多了,压力增大,反应向体积缩小的方向进行
介于0.36和0.4之间吧,因为按照原来的平衡可以达到0.36,考虑到压力的关系稍向正方向移动,但不可能完全反应,所以小于0.41年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L ajgaae1年前1
ajgaae1年前1 -
 alice00 共回答了13个问题
alice00 共回答了13个问题 |采纳率84.6%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 已知A(g)+B(s)⇌C(g)+D(g)△H<0,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B.回
已知A(g)+B(s)⇌C(g)+D(g)△H<0,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B.回答下列问题:
(1)如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则6s时c(A)=______mol•L-1,C的物质的量为______mol;若反应经一段时间后,达到平衡,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率______(填“变大”、“变小”或“不变”);
(2)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(3)100℃时,该反应达到平衡后,D的浓度为0.02mol/L,改变反应温度为T,c(A)以0.001mol/(L•s)的平均速率降低,经10s又达到平衡.
①T______100℃(填“大于”或“小于”),判断理由是______;
②温度T时,反应达到平衡后,将反应容器的体积减少一半.平衡向______(填“正反应”或“逆反应”)方向移动. 奔跑qq1年前1
奔跑qq1年前1 -
 赖军 共回答了18个问题
赖军 共回答了18个问题 |采纳率94.4%解题思路:(1)依据反应速率乘以时间得到消耗的浓度,起始浓度-消耗浓度=某时刻剩余浓度,结合化学方程式定量关系计算C的物质的量;恒温恒容容器中加入惰气总压增大分压不变,平衡不动;
(2)反应达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,结合反应特征和平衡原理分析判断选项;
(3)①改变反应温度为T,c(A)以0.001mol/(L•s)的平均速率降低,依据影响反应速率因素分析,说明温度降低,平衡正向进行;
②将反应容器的体积减少一半压强增大平衡向气体体积减小的方向进行,B为固体,反应前后气体体积减小;(1)反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,消耗A浓度=0.003mol•L-1•s-1×6s=0.018mol/L,6s时c(A)=起始浓度-消耗浓度=0.20mol5L-0.018mol/L=0.022mol/L,依据化学方程式定量关系,A(g)+B(...
点评:
本题考点: 化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查了化学平衡、反应速率影响因素的分析判断,平衡标志的理解应用,主要是平衡计算的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 将0.10L的0.20mol/LHAc和0.020L的0.20mol/LNaOH溶液混合,求混合溶液的PH值?
 sksk-sksk1年前3
sksk-sksk1年前3 -
 痛失乐园 共回答了21个问题
痛失乐园 共回答了21个问题 |采纳率100%需要知道醋酸的Ka值计算1年前查看全部
- (2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•
(2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-=2SO42-+I2(慢)I2+2S2O32-=2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)______.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx=______ ml,理由是______.实验
序号体积V/ml K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液 ① 10.0 0.0 4.0 4.0 2.0 ② 9.0 1.0 4.0 4.0 2.0 ③ 8.0 Vx 4.0 4.0 2.0
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).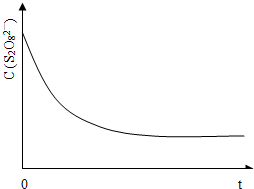
(4)碘也可用作心脏起捕器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2 (s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2 (g)=2I2 (s)+2Li2O(s)△H2
则电池反应的△H=△H1−△H2 2 ;碘电极作为该电池的______极.△H1−△H2 2  hjcmdl1年前1
hjcmdl1年前1 -
 狂爱JAY伦 共回答了19个问题
狂爱JAY伦 共回答了19个问题 |采纳率84.2%解题思路:(1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
(4)将第一个方程式与第二个方程式相减再除以2,焓变进行相应改变,正极上得电子发生还原反应.(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62...
点评:
本题考点: 探究影响化学反应速率的因素;原电池和电解池的工作原理.
考点点评: 本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,难度较大.1年前查看全部
- 帮忙解答一下 谢谢了急呀急0.20MOL每升氨水中同时含有0.10MOL每升氯化氨时的[OH]及PH值是多少?说下过程
帮忙解答一下 谢谢了
急呀急
0.20MOL每升氨水中同时含有0.10MOL每升氯化氨时的[OH]及PH值是多少?
说下过程 或者思路最好
谢谢大家了. 甘贞洁1年前1
甘贞洁1年前1 -
 huang-qiu 共回答了22个问题
huang-qiu 共回答了22个问题 |采纳率95.5%NH3 + H2O NH4+ + OH-
因为共二酸碱NH3/NH4+ 同时存在于体系中,这是一个缓冲溶液.
pH = pKa + log([NH3]/[NH4+]= 9.244 + log(0.2/0.1)= 9.551年前查看全部
- 在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0
在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0.1
若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,求n(SO3)的范围
解析:0.36 kengle1年前1
kengle1年前1 -
 深海里的泪 共回答了22个问题
深海里的泪 共回答了22个问题 |采纳率100%那么根据上述 三段式 SO2不是应该是0.18+02=0.38吗 怎么是0.4呢,这里的SO2应该是SO3吧.解析里说了:若继续通入同量的反应物,相当于增大压强,使平衡向正反应方向进行,这句话是关键,明白了这句话你就明白为什么n(SO3)>0.36mol,那个0.4是假设完全反应的结果,但是因为这个方程式是可逆反应,所以答案是所以0.361年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L guangyao_lgy1年前4
guangyao_lgy1年前4 -
 2682712 共回答了19个问题
2682712 共回答了19个问题 |采纳率100%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 计算20ml 0.20mol.l-1的HAC溶液的PH值 HAC的Ka=1.8*10^-5
 wijizi1年前1
wijizi1年前1 -
 bbhjl 共回答了14个问题
bbhjl 共回答了14个问题 |采纳率85.7%c(H+)=Ka*c开平方=(1.8*10^-5)*0.2开平方=3.5*10^-6开平方
pH=-lgc(H+)=5.41年前查看全部
- 120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0mol/L
B. 1.5mol/L
C. 0.18mol/L
D. 0.24mol/L BillWelchLAI1年前1
BillWelchLAI1年前1 -
 巴黎tt 共回答了11个问题
巴黎tt 共回答了11个问题 |采纳率81.8%解题思路:根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选B.点评:
本题考点: 有关范围讨论题的计算;钠的重要化合物.
考点点评: 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.1年前查看全部
- 将0.10mol*L-1的NaOH溶液和0.60mol*L-1的NaOH溶液混合成0.20mol*L-1的NaOH溶液.
将0.10mol*L-1的NaOH溶液和0.60mol*L-1的NaOH溶液混合成0.20mol*L-1的NaOH溶液.求2中溶液的体积比.
(忽略混合时体积变化) 缘分牛牛1年前2
缘分牛牛1年前2 -
 landmark_43 共回答了16个问题
landmark_43 共回答了16个问题 |采纳率93.8%0.1x+0.6y=0.2(x+y)
0.1x=0.4y
x:y=4:11年前查看全部
- 计算由0.080mol/LHAc溶液和0.20mol/LNaAc等体积混合成缓冲溶液的PH值.(Ka=1.810-5 (
 互助slmughelp881年前1
互助slmughelp881年前1 -
 浪子邪 共回答了17个问题
浪子邪 共回答了17个问题 |采纳率88.2%Ca=C(HAc)=0.080mol/L; Cb=C(NaAc)=0.20mol/L; PH=PKa-lg(Ca/Cb)=4.74-lg(0.08/0.2)=答案 很不好意思哦,我没带计算器,所以你自己算下哦!1年前查看全部
- 求Mn(OH)2在0.20mol/lMncl2溶液的溶解度...
 zhuchunyan5201年前1
zhuchunyan5201年前1 -
 riking1st 共回答了15个问题
riking1st 共回答了15个问题 |采纳率86.7%设溶解度为X,有
[Mn2+][OH-]^2=(X + 0.20)(2X)^2=Ksp
(忽略X^3项)求得X即可1年前查看全部
- 在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0
在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0.18mol
若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,求n(SO3)的范围 sizicaco1年前3
sizicaco1年前3 -
 coollyone 共回答了20个问题
coollyone 共回答了20个问题 |采纳率90%解析:0.361年前查看全部
- 在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得
在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:时间(s)
浓度(mol•L-1)0 20 40 60 80 100 c(N2O4) 0.20 C1 0.10 C3 A B c(NO2) 0.00 0.12 C2 0.22 0.22 0.22
(1)该反应的化学方程式为______;达到平衡时四氧化二氮的转化率为______%,表中C2______C3______A(填“<”、“>”=)
(2)20s时,四氧化二氮的浓度C1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______. 马申亚1年前1
马申亚1年前1 -
 blackcomet_711 共回答了18个问题
blackcomet_711 共回答了18个问题 |采纳率100%解题思路:(1)依据图表数据分析,反应物和生成物分析判断;由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)化学平衡的三段式列式计算,结合化学反应速率概念计算0~20s内N2O4的平均反应速率.(1)由表可知,60s时反应达平衡,c(NO2)=0.22mol/L,反应的N2O4浓度为0.11mol/L,反应的化学方程式为:N2O4⇌2 NO2,
N2O4⇌2 NO2,
浓度变化:0.11mol/L 0.22mol/L
所以平衡时N2O4的转化率为[0.11mol/L/0.20mol/L]×100%=55%;
60s后反应达平衡,反应混合物各组分的浓度不变,所以C3=A=B=0.20mol/L-0.11mol/L=0.09mol,40s时:
N2O4⇌2 NO2,
0.2mol/L 0
0.1mol/L 0.2mol/L
0.1mol/L C2=0.2mol/L
C2=0.2mol/L>C3=A=B=0.09mol/L;
故答案为:N2O4⇌2NO2;55%;>;=;
(2)进行到20s;
N2O4 ⇌2NO2
起始量(mol/L) 0.20 0
变化量(mol/L) 0.06 0.12
20S末(mol/L) 0.14 0.12
20s时,N2O4的浓度=C1=0.14mol/L;
0~20s内N2O4的平均反应速率=[0.06mol/L/20s]=0.003mol/(L•s),
故答案为:0.14;0.003mol/(L•s).点评:
本题考点: 化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查了化学反应速率的计算、化学平衡常数的含义等知识点,注意化学平衡常数只与温度有关,与物质的浓度无关.1年前查看全部
大家在问
- 1一个效率为50%的锅炉,正常工作每天耗煤400kg,现在将锅炉效率提高到80%,每天可节约煤( )
- 2甲乙两班共120人,甲班人数是乙班的二倍,求甲乙两班各有多少人?
- 3英语翻译When a person is curious about something,it means he is
- 4用I doubt whether/if
- 5算术题,特来求教一条铜线,16㎜2,长一米,问5条这样的铜线有多重,要计算步骤,不许直接出结果
- 6几道英语问题1 100 ______ four is twenty-five.A divided by B divide
- 71、as a matter of fact和in fact的区别2、a few和a little 的区别3、differ
- 8下列各句的句式不同于其他的一项是( ) A.肇锡余以嘉名 B.激于义而死焉者也 C.不能容于远近
- 9对于-2≤m≤2,不等式x2+2mx>x-m恒成立,则x的取值范围是什么?
- 10色彩( )填1词语
- 11在四边形ABCD中,从①AB∥CD;②AB=CD;③BC∥AD;④BC=AD中任选两个使四边形ABCD为平行四边形的选法
- 12在日常生活中,安全用电的基本原则是:不直接接触低压低压线路,不靠近高压高压线路.
- 13和别人交流时说不出词语来怎么办
- 14与大自然有关的诗句有哪些?
- 15(2014•百色)制作酸奶必需的微生物及处理方法是( )
