用含氯消毒剂进行餐具消毒时,其有效氯浓度是多少毫克,消毒时间多少分钟?
 傻丫头傻丫头2022-10-04 11:39:542条回答
傻丫头傻丫头2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 了不得的猪 共回答了14个问题
了不得的猪 共回答了14个问题 |采纳率92.9%- 含氯消毒剂进行餐具消毒时,其有效氯浓度 20g/L,消毒饮食具:用原液按照1:10的比例兑水(半盆水倒入6盖),将需要消毒的器具置于稀释好的液体中浸泡20分钟.根据消毒的对象不同可浓可稀.你要是消毒时间短一些,可在消毒时的溶液里加少许家用醋.上述浓度大体可以通用.
- 1年前
 ezan 共回答了18个问题
ezan 共回答了18个问题 |采纳率88.9%- 200mg/L,消毒时间一刻钟即可
- 1年前
相关推荐
- 证明消毒剂中什么起消毒作用需要设计一个实验,证明含氯消毒剂中起消毒作用的是次氯酸(最好是一个控制变量法的对比实验)
 thbi1年前2
thbi1年前2 -
 酉水钓翁 共回答了18个问题
酉水钓翁 共回答了18个问题 |采纳率100%含氯消毒剂中有次氯酸钙和氯化钙,遇水中或空气中的二氧化碳变为次氯酸.因此起消毒作用有可能是次氯酸、碳酸钙和氯化钙.消毒作用可以通过漂白性来表示.
证明:有色布条放入氯化钙(碳酸钙、氯水、盐酸)溶液中,只有氯水中布条褪色1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于工业生产的漂白及消毒。
亚氯酸钠(naclo 2 )是一种重要的含氯消毒剂,主要用于工业生产的漂白及消毒。
下图是过氧化氢法生产亚氯酸钠的工艺流程图:
相关物质的性质如下:
① clo 2 沸点低易气化;浓度较高的clo 2 气体易分解***。
② naclo 2 溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 ·3h 2 o。
(1).在clo 2 发生器中通入so 2 的同时鼓入空气,其作用是________(填序号)。
a.将so 2 氧化成so 3 ,增强酸性
b.稀释clo 2 以防止***
c.将naclo 3 氧化成clo 2
(2)为确保h 2 o 2 充分参与反应,吸收塔内温度不宜较高,其原因是______________。
(3)160 g·l-1 naoh溶液的物质的量浓度为______________,在实验室若要配制450ml该物质的量浓度naoh溶液,应称取naoh的质量为__________克。
(4)写出吸收塔内反应的化学方程式_____________________________________。
(5)从滤液中得到naclo 2 ·3h 2 o粗晶体的实验操作依次是____________(填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的naclo 2 ·3h 2 o晶体必须进一步的操作是________(填操作名称)。 九月荷香1年前1
九月荷香1年前1 -
 俞过天晴 共回答了18个问题
俞过天晴 共回答了18个问题 |采纳率83.3%(1)B(2分)
(2)H 2 O 2 受热易分解(2分)
(3)4mol/L、80克(2分)
(4)2ClO 2 + H 2 O 2 + 2NaOH = 2NaClO 2 + 2H 2 O + O 2 ↑(2分)
(5)B、E、D(2分) 重结晶(2分)
1年前查看全部
- 含氯消毒剂是一种用途广,效果好的消毒剂,我市常用84消毒剂,使用方法是:取1两84消毒液加
 hjqrbn1年前1
hjqrbn1年前1 -
 tsljz 共回答了14个问题
tsljz 共回答了14个问题 |采纳率78.6%84消毒液是一种以次氯酸钠为主的高效消毒剂
用于多种医疗器械、布类、墙壁、地面、便器等的消毒
现在市面上到处可买到84消毒液
它被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒
84消毒液有一定的刺激性与腐蚀性,必须稀释以后才能使用
一般稀释浓度为千分之二到千分之五
即1000毫升水里面放2到5毫升84消毒液
浸泡时间为10到30分钟
被消毒物品应该全部浸没在水中
消毒以后应该用清水冲洗干净后才能使用.1年前查看全部
- 使用含氯消毒剂消毒餐具、杯具,有效氯浓度通常应在多少以上 使用含氯消毒剂消毒餐
 关心老rr1年前1
关心老rr1年前1 -
 laaa123 共回答了17个问题
laaa123 共回答了17个问题 |采纳率88.2%含氯消毒液,有残留,容易产生致癌物,换用食品级二氧化氯消毒吧,安全广谱高效,无残留1年前查看全部
- 工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:
[1]NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出.
[2]高氯酸是至今为止人们已知酸中的最强酸,沸点90℃.
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为______,冷却的目的是______,能用蒸馏法分离出高氯酸的原因是______.
(2)反应器Ⅱ中发生反应的离子方程式为______.
(3)通入反应器Ⅱ中的SO2 用另一物质H2O2 代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2 的原因是______
(4)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有______请写出工业上用氯气和NaOH溶液生产另一种消毒剂NaClO的离子方程式______. zjh985481年前1
zjh985481年前1 -
 ttdowndown 共回答了15个问题
ttdowndown 共回答了15个问题 |采纳率100%解题思路:本题是化工生产过程中框图流程题,解决这类问题要根据题中的信息找到做题的题眼,分析出最终要解决的问题.
(1)要写出反应器Ⅰ中发生反应的化学方程式,根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸,生成物有ClO2气体、NaHSO4、HClO4溶液.依据书写化学方程式的规则书写出化学反应方程式:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O.同时将反应后的容器内的溶液冷却,有NaHSO4晶体析出,又得到HClO4溶液,说明硫酸氢钠的溶解度随温度的降低而减小,使硫酸氢钠从溶液中结晶析出,过滤后再将滤液蒸发既得到纯净的HClO4,说明高氯酸的沸点低;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,书写出氧化还原反应方程式:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2;
(4)消毒剂和漂白剂的消毒原理和漂白原理是利用它们的强氧化性来达到目的.根据教材知识工业上制取漂白粉是用氯气与氢氧化钠溶液反应得到的,其反应原理为:
Cl2+2OH-=ClO-+Cl-+H2O.(1)根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸,生成物有ClO2气体、NaHSO4、HClO4溶液.依据书写化学方程式的规则,即发生化学反应时满足原子的种类和数目不变,书写出化学反应方程式为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;然后将反应生成物的溶液冷却得到NaHSO4晶体,说明硫酸氢钠的溶解度随温度的降低而减小,过滤后,将滤液蒸发得到纯净的HClO4,说明高氯酸的沸点低,
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,则氧化还原反应方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2,故答案为:H2O2有还原性也能把ClO2还原为NaClO2;
(4)消毒剂和漂白剂的消毒原理和漂白原理是利用它们的强氧化性来达到目的.根据教材知识工业上制取漂白粉是用氯气与氢氧化钠溶液反应得到的,其反应原理为:
Cl2+2OH-=ClO-+Cl-+H2O,故答案为:强氧化性;Cl2+2OH-=ClO-+Cl-+H2O.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题是一道化工生产过程中的工艺流程,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中.1年前查看全部
- 氯气是一种非常重要的化工原料,含氯消毒剂在生产生活中有着广泛的用途。
氯气是一种非常重要的化工原料,含氯消毒剂在生产生活中有着广泛的用途。
(1)用氯气可制取“84消毒液”(有效成分为NaClO)。
①该制备反应的离子方程式为 。
②下列措施能增强“84消毒液”杀菌能力的是 。
A.加入适量醋酸
B.加入适量亚硫酸
C.加入少量NaOH粉末
③“84消毒液”不能对钢铁(含Fe、C)制品进行消毒,原因是 。
(2)二氧化氯(ClO 2 )是一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前,工业上开发出用电解法制取ClO 2 的新工艺,生产原理如图所示。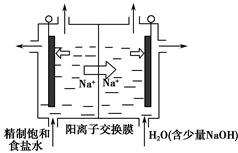
上述示意图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO 2 。写出阳极产生ClO 2 的电极反应式: 。 a983121年前1
a983121年前1 -
 suild1515 共回答了20个问题
suild1515 共回答了20个问题 |采纳率85%(1)①Cl 2 +2OH - =Cl - +ClO - +H 2 O
②A
③“84消毒液”显碱性,钢铁在碱性条件下会发生电化学腐蚀
(2)Cl - -5e - +2H 2 O=ClO 2 ↑+4H +
(1)①氯气与NaOH溶液反应可制备“84消毒液”。②加入适量醋酸,可促使ClO - 转化为HClO,增强“84消毒液”的杀菌能力;加入适量亚硫酸,H 2 SO 3 会与ClO - 发生氧化还原反应,不正确。③钢铁在碱性条件下能发生吸氧腐蚀,不能用“84消毒液”对钢铁制品进行消毒。(2)①电解饱和食盐水时,阳极Cl - 发生氧化反应生成ClO 2 ,根据元素守恒,可知水参与了反应,产物中应有H + 。1年前查看全部
- 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②160g/L NaOH溶液是指160gNaOH固体溶于水所得溶液的体积为1L.
(1)吸收塔内的反应的化学方程式为
2NaOH+2ClO2+H2O2═2NaClO2+2______+______,
若1mol ClO2参加反应,则转移电子的物质的量是______mol;
(2)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是______(选填序号),
a.蒸馏b.蒸发浓缩c.灼烧d.过滤e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是______(填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是______;
(4)160g/L NaOH溶液的物质的量浓度为______,若要计算该溶液的质量分数,
还需要的一个条件是______(用文字说明). 一刻永远1年前1
一刻永远1年前1 -
 烈火精灵111 共回答了19个问题
烈火精灵111 共回答了19个问题 |采纳率100%解题思路:ClO2在二氧化硫和空气混合气体中不易爆分解炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O;
(1)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式,结合化学方程式定量关系计算电子转移总数;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;(3)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH.
(4)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=[n/V]计算氢氧化钠溶液的物质的量浓度.(1)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,2molClO2反应的转移为2mol,若1mol ClO2参加反应,则转移电子的物质的量是1mol;
故答案为:H2O;O2;1;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为bed.
得到的粗晶体经过重结晶可得到纯度更高的晶体.
故答案为:bed;重结晶;
(3)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH;
故答案为:连续测定吸收塔内溶液的pH;
(4)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,则160gNaOH的物质的量为[160g/40g/mol]=4mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=[4mol/1L]=4mol/L,若计算溶质质量分数结合物质的量浓度和溶质质量分数换算分析可知,需要溶液密度;
故答案为:4mol/L;该溶液的密度.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,在碱性溶液中NaClO 2 比较稳定,主要用于水的消毒以及砂糖、油脂
亚氯酸钠(naclo 2 )是一种重要的含氯消毒剂,在碱性溶液中naclo 2 比较稳定,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①naclo 2 的溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 ·3h 2 o。
②纯clo 2 易分解***,一般用稀有气体或空气稀释到10%以下安全。
③160 g/l naoh溶液是指160 g naoh固体溶于水所得溶液的体积为1l。
(1)160 g/l naoh溶液的物质的量浓度为____。若要计算该溶液的质量分数,还需要的一个条件是____(用文字说明)。
(2)发生器中鼓入空气的作用可能是____(选填序号)。
a.将so 2 氧化成so 3 ,增强酸性;
b.稀释clo 2 以防止***;
c.将naclo 3 氧化成clo 2
(3)吸收塔内的反应的化学方程式为____。吸收塔的温度不能超过20℃,其目的是 。
(4)吸收塔中应维持naoh稍过量,理由是____。
(5)吸收塔中能否用fecl 2 代替h 2 o 2 ____(填能.否)?理由是____。
(6)从滤液中得到naclo 2 ·3h 2 o粗晶体的实验操作依次是____(选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的naclo 2 ·3h 2 o晶体必须进行的操作是____(填操作名称)。 木蕊质地1年前1
木蕊质地1年前1 -
 阿宜 共回答了20个问题
阿宜 共回答了20个问题 |采纳率85%(1)4mol/L(1分) 溶液的密度(1分)
(2)b(1分)
(3)2NaOH+2ClO 2 +H 2 O 2 =2NaClO 2 +2H 2 O+O 2 (3分)防止H 2 O 2 的分解(1分)
(4)NaClO 2 在碱性溶液中比较稳定(2分)
(5)否(1分) FeCl 2 可以跟NaClO 2 进一步发生氧化还原反应引进杂质离子(2分)
(6)b、e、d(3分) 重结晶(1分)
1年前查看全部
- 使用含氯消毒剂,有效氯浓度及消毒时间是多少?
 rong841年前1
rong841年前1 -
 yczxyz 共回答了14个问题
yczxyz 共回答了14个问题 |采纳率92.9%浓度为100mg/L至250mg/L,时间为3分钟至5分钟1年前查看全部
- 工业上生产高氯酸.同时生产一种常见含氯消毒剂和漂白剂亚氯酸钠NaClO2.流程:反应器I<NaClO3+浓硫酸>---C
工业上生产高氯酸.
同时生产一种常见含氯消毒剂和漂白剂亚氯酸钠NaClO2.流程:
反应器I<NaClO3+浓硫酸>---ClO2气体并在冷却过滤后有NaHSO4和滤液
ClO2在反应器II中和NaOH,H2O和SO2反应生成NaClO2,滤液则在蒸馏后得到HClO4纯品
请写出上述过程中涉及的有关化学方程式 xindexue1年前1
xindexue1年前1 -
 ceson 共回答了25个问题
ceson 共回答了25个问题 |采纳率84%反应器I:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O
反应器II:2ClO2+4NaOH+SO2=2NaClO2+Na2SO4+2H2O1年前查看全部
- 氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途.
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途.
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑通电 .
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为______.
(3)下列措施能增强84消毒液杀菌能力的是______.
A.加入适量醋酸B.加入适量亚硫酸C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是______.
A.c(Na+)+c(H+)=c(OH-)+c(Cl-)
B.c(Na+)=c(ClO-)+c(Cl-)
C.c(Na+)=2c(ClO-)+c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀.正极反应为______. diamonds86881年前1
diamonds86881年前1 -
 hainankafei 共回答了23个问题
hainankafei 共回答了23个问题 |采纳率82.6%解题思路:(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠;
(3)和次氯酸钠反应生成次氯酸就能增强84消毒液杀菌能力;
(4)根据物料守恒和电荷守恒判断;
(5)正极上次氯酸根离子得电子发生还原反应.(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,电池反应式为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑;
(2)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)和次氯酸钠反应生成次氯酸就能增强84消毒液杀菌能力,
A.加入适量醋酸,醋酸和次氯酸钠反应生成次氯酸,所以增强其杀菌能力,故正确;
B.加入适量亚硫酸,次氯酸钠被亚硫酸钠还原生成氯化钠,所以降低其杀菌能力,故错误;
C.加入少量NaOH粉末,抑制次氯酸钠水解,所以降低其杀菌能力,故错误;
故选A;
(4)混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,所以c(Na+)+c(H+)=c(OH-)+c(ClO-)+c(Cl-),所以得c(Na+)=c(ClO-)+c(Cl-),根据物料守恒得c(Cl- )=c(ClO-)+c(HClO)
,所以得c(Na+)=2c(ClO-)+c(HClO),所以BC正确,
故选BC;
(5)碳、铁、84消毒液构成原电池,铁作负极,碳作正极,正极上次氯酸根离子得电子生成氯离子和氢氧根离子,电极反应式为:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查氯气及其化合物的性质,涉及知识点较多,易错选项是(4)题C,注意氯气和氢氧化钠的反应中,c(Cl- )=c(ClO-)+c(HClO),为易错点.1年前查看全部
- 下列说法不正确的是( )A.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂B.Na2O2能与CO2反应产生O2,可用作高
下列说法不正确的是( )
A.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
B.Na2O2能与CO2反应产生O2,可用作高空飞行或潜水的供氧剂
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属钠
D.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 chschschs1年前1
chschschs1年前1 -
 6hag1ow5 共回答了23个问题
6hag1ow5 共回答了23个问题 |采纳率95.7%解题思路:A.氯气与烧碱溶液或石灰乳反应都生成次氯酸盐,可用于杀菌消毒;B.Na2O2能与CO2反应产生O2,可用作供氧剂;C.海水富含氯化钠,可用电解法冶炼钠;D.蒸馏法进行海水淡化需要不断进行加热,成本较大.A.氯气与烧碱溶液或石灰乳反应可生成漂白液、漂白精或漂白粉,可用于杀菌消毒,故A正确;
B.过氧化钠Na2O2因能与CO2反应生成氧气,故可作为呼吸面具中的氧气的来源.潜水艇紧急情况时,也使用过氧化钠来供氧,有关反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,故B正确;
C.海水富含氯化钠,因钠为活泼金属,通常用电解法冶炼钠,故C正确;
D.蒸馏法进行海水淡化需要不断进行加热,成本较大,不是海水淡化技术发展的新方向,故D错误.
故选D.点评:
本题考点: 氯气的化学性质;海水资源及其综合利用;钠的重要化合物.
考点点评: 本题考查较为综合,为高频考点,侧重于学生的分析能力和知识的综合运用的考查,题目侧重化学与生活、生成的考查,有利于培养学生的良好科学素养、提高学习的聚集,难度不大.1年前查看全部
- 有效氯含氯消毒剂可以用于餐具的消毒吗?要如何正确使用该消毒剂?
 好心情2681年前1
好心情2681年前1 -
 飞翔的烤鱼 共回答了21个问题
飞翔的烤鱼 共回答了21个问题 |采纳率95.2%可以的连自来水都是用次氯酸消毒的.1年前查看全部
- 含氯消毒剂到底是高效消毒剂还是低效消毒剂
 fuse021221年前1
fuse021221年前1 -
 若涩桃子 共回答了21个问题
若涩桃子 共回答了21个问题 |采纳率95.2%用量与用法1 洗手 以0.2%~0.5%溶液浸2分钟.
2 塑料、玻璃制品 以0.2%溶液浸2小时.3 地面、家具等 以0.5%溶液喷雾.
注意点
1 “原液”刺激性、腐蚀性较强,不可直接用手接触.
2 对金属有腐蚀性,不可用于金属器械的消毒.
3 “原液”贮存放置可分解,注意有效期限,应贮存于塑料桶内,凉暗处保存,远离可烯性物质.1年前查看全部
- 下列有关物质的性质、制取或应用等的说法中不正确的是( ) A.与其他含氯消毒剂相比,用二氧化氯作饮用水消毒剂不易形成致
下列有关物质的性质、制取或应用等的说法中不正确的是( ) A.与其他含氯消毒剂相比,用二氧化氯作饮用水消毒剂不易形成致癌物质 B.由于铜盐能杀死某些细菌,可以用硫酸铜作游泳场馆的池水消毒剂 C.硅是一种常用的半导体材料,可以用于制光导纤维 D.镧镍合金能大量吸收H 2 形成金属氢化物,可用作储氢材料  princess11161年前1
princess11161年前1 -
 zeaphson 共回答了15个问题
zeaphson 共回答了15个问题 |采纳率86.7%A.二氧化氯在水中形成无机盐,一般不具有致癌性质,但量过多为对人体有害,故A正确;
B.铜离子为重金属,可使蛋白质变性,可用于游泳场馆的池水消毒剂,故B正确;
C.光导纤维的主要原料为二氧化硅,而不是硅,故C错误;
D.镧镍合金能大量吸收H 2 形成金属氢化物,具有储氢作用,具有氢气的性质,可用作还原剂,故D正确.
故选C.1年前查看全部
- 下列说法正确的是( )A.针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒
下列说法正确的是( )
A.针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心
B.肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后均可得到氨基酸
C.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体
D.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 jamespage1年前1
jamespage1年前1 -
 xuyaofeng1987 共回答了9个问题
xuyaofeng1987 共回答了9个问题 |采纳率88.9%解题思路:A、含氯消毒剂、活性银离子有毒,污染环境、危害人体健康;
B、肌红蛋白、蚕丝、过氧化氢酶为蛋白质,鱼油主要成分为脂肪;
C、10微米=10000纳米,胶体微粒直径在1纳米到100纳米之间;
D、某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等.A、含氯消毒剂、活性银离子虽然能杀菌消毒,但是其本身有毒,能够污染环境、危害人体健康,不符合绿色化学理念,故A错误;B、肌红蛋白、蚕丝、过氧化氢酶为蛋白质,水解产物为氨基酸;鱼油主要成分为脂肪,水解产物...
点评:
本题考点: 绿色化学;分散系、胶体与溶液的概念及关系;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题与社会生产生活密切相关,涉及到能量的转化、环境的污染与治理,题材新颖,是高考的热点,题目难度不大,注意相关知识的积累,解题时把握绿色化学的理念.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯
亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO 3 )等为原料制备亚氯酸钠的工艺流程如下:

(1)提高“反应1”反应速率的措施有 。(回答一点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO 2 - +4I - +4H + =2H 2 O+2I 2 +Cl - )
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L -1 Na 2 S 2 O 3 标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2- )
①达到滴定终点时的现象为 。
②该样品中NaClO 2 的质量分数为 (用含m、c、V的代数式表示,结果化成最简。) 君临天下-0071年前1
君临天下-0071年前1 -
 vanny13148 共回答了24个问题
vanny13148 共回答了24个问题 |采纳率95.8%1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯
亚氯酸钠(naclo 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:


已知:①naclo 2 的溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 •3h 2 o。
②纯clo 2 易分解***,一般用稀有气体或空气稀释到10%以下安全。
③160 g/l naoh溶液是指160 gnaoh固体溶于水所得溶液的体积为1l。
(1)160 g/l naoh溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将so 2 氧化成so 3 ,增强酸性; b.稀释clo 2 以防止***;c.将naclo 3 氧化成clo 2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中naclo 2 比较稳定,所以吸收塔中应维持naoh稍过量,判断naoh是
否过量的简单实验方法是 。
(5)吸收塔中为防止naclo 2 被还原成nacl,所用还原剂的还原性应适中。除h 2 o 2 外,还可以选择的还原剂是 (选填序号)。
a.na 2 o 2 b.na 2 s c.fecl 2
(6)从滤液中得到naclo 2 •3h 2 o粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的naclo 2 •3h 2 o晶体必须进行的操作是 (填操作名称)。 luyohu1年前1
luyohu1年前1 -
 最高用户 共回答了14个问题
最高用户 共回答了14个问题 |采纳率71.4%(1)①4mol/L(1分,未写单位不给分),该溶液的密度(1分);
(2)b(2分);
(3)2NaOH+2ClO 2 +H 2 O 2 →2NaClO 2 +2H 2 O 2 +O 2 (2分);防止H 2 O 2 分解(1分);
(4)连续测定吸收塔内溶液的pH值(2分);(5)a (1分);
(6)b、e、d(2分);重结晶(1分)
略1年前查看全部
- (2013•西城区二模)雅安地震后紧急调运了含氯消毒剂等防疫药品,含氯消毒剂中的“氯”是指( )
(2013•西城区二模)雅安地震后紧急调运了含氯消毒剂等防疫药品,含氯消毒剂中的“氯”是指( )
A.单质
B.元素
C.分子
D.离子 airv137ie75df1年前1
airv137ie75df1年前1 -
 淹uu科学家 共回答了22个问题
淹uu科学家 共回答了22个问题 |采纳率90.9%解题思路:含氯消毒剂中的“氯”指的是含有氯元素的物质,存在于化合物中,以化合态的形式存在;分子、原子、离子都是构成物质的微粒,而元素是指具有相同核电荷数的一类原子的总称,是宏观概念;而单质指的是只含有一种元素的纯净物.含氯消毒剂中的“氯”不是以单质、分子、离子等形式存在,这里所指的“氯”是强调存在的元素,存在于化合物中,与具体形态无关.
故选B.点评:
本题考点: 元素的概念.
考点点评: 本题难度不大,主要考查了分子、原子、离子、元素、单质的不同,加深学生对这些知识的理解.1年前查看全部
- 用含氯消毒剂浸泡过的衣服一般清洗几次
用含氯消毒剂浸泡过的衣服一般清洗几次
三倍含氯消毒剂呢,清洗几次. 01900281dy1年前1
01900281dy1年前1 -
 compai 共回答了14个问题
compai 共回答了14个问题 |采纳率78.6%只要将衣服上残留的消毒剂基本去除,也就是衣服上没有明显的氯味,就可以了,漂洗的次数可根据具体情况而定,如每次使用的水足够多,清洗的次数可能就少一些.1年前查看全部
- 有效含氯量为20%的消毒净要分别配置成500mg/L,200mg/L,1000mg/L的含氯消毒剂应如何配置
 afei751年前1
afei751年前1 -
 醉酒的小黑 共回答了21个问题
醉酒的小黑 共回答了21个问题 |采纳率95.2%以200mg/L为例,每升容量瓶中需要加入200mg氯,用20%的消毒净来提供需要1000mg(200/20%),即1g消毒净.称重加入容量瓶,加水稀释即可.当然,通常一次稀释不宜超过20倍,因此更合理的办法是先配10g/L的中间稀释液,然后稀释液再次稀释成为目标溶液.1年前查看全部
- 使用含氯消毒剂,有效浓度及消毒时间是多少?
 ff__7212071年前1
ff__7212071年前1 -
 angel_zjc123 共回答了11个问题
angel_zjc123 共回答了11个问题 |采纳率100%100~200毫克/升,5分钟1年前查看全部
大家在问
- 1小泉的水泡还会有哪些姿态,请仿照《趵突泉》第四段接下去写比喻句
- 2采组词?乙乙乙
- 3英语翻译我们会按照收到的A文件来REMAKE 相关的invoice和P/L.在我们收到的A文件上的G.W为50KG.现在
- 4一道化学计算小强为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数
- 5下列分数化成循环小数,并求出小数点后第100位的数字:七分之二,十三分之四,二十七分之十六,七十四分之二十
- 6接着课文《楚王好细腰》的结尾续写故事
- 7下列四句话中,不正确的是 ( )
- 8(a+bi)(a−bi)=?
- 9根据要求在下面横线上写出相应的内容。
- 10开关与电灯是()连接的,插座是()接到家庭电路上的,插座和灯是()连接的
- 11某工程队爆破石方,导火线燃烧的速度为每秒0.8厘米,点火工人跑开的速度是每秒5米,已知安全区域在离点火地
- 12一列火车长80米,以每分钟13米的速度通过一座440米的大桥,需多长时间
- 13明天要上学了啊!1用/straight/hospital/there/to/minutes/the/for/go/造一个
- 14三乙醇胺是否属于危险化学品的范畴
- 15sin cos tan cot出现在数学计算题中是什么意思?

