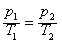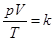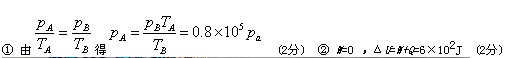等容等压的两种气体,氦气温度为T1,,氧气温度为T2,求二者混合后的温度,答案详细点
 zg1h2022-10-04 11:39:541条回答
zg1h2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 melancy 共回答了24个问题
melancy 共回答了24个问题 |采纳率66.7%- 理想状态气体方程。PV=NRT【n指的是物质的量。r一个常数。t温度。p压强。v体积】我觉得条件不足剩下的自己算。
- 1年前
相关推荐
- 一定质量的理想气体由状态1经等容过程到状态3,再经过等压过程到状态2,也可先经等
一定质量的理想气体由状态1经等容过程到状态3,再经过等压过程到状态2,也可先经等
一定质量的理想气体由状态1经等容过程到状态3,在经等压过程到状态2,也可先经等压过程到状态4,在经等容过程到状态2,状态1和状态2温度相同,状态3温度为T3,状态4温度为T4,则状态1的温度为_______ tzy20081年前1
tzy20081年前1 -
 糖小米77 共回答了15个问题
糖小米77 共回答了15个问题 |采纳率86.7%νRT3 = p3V1,νRT4 = p1V2
νRT1 = νRT2 = p1V1 = p3V2
= p1V2 * p3V1 / ( p3V2)
= νRT4*νRT3 / (νRT2)
T1 = T4*T3 / T2 =T4*T3 / T1
T1 = √(T4*T3 )1年前查看全部
- 一定质量理想气体的p-V图象如图所示,气体由状态A→B→C→D→A变化,以下说法正确的是( ) A.A→B为等容变化,
一定质量理想气体的p-V图象如图所示,气体由状态A→B→C→D→A变化,以下说法正确的是( ) A.A→B为等容变化,温度降低 B.B→C为等压变化,温度升高 C.C→D为等容变化,温度升高 D.D→A为等压变化,温度降低 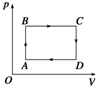
 szsisiwawa1年前1
szsisiwawa1年前1 -
 星星知我欣 共回答了11个问题
星星知我欣 共回答了11个问题 |采纳率100%A、由图象知,A→B为等容变化,且压强增加,由
P
T =常数 知,温度应升高,故A错误
B、B→C为等压变化,由于体积在增加,由
V
T =常数 知,温度应升高,故B正确
C、C→D为等容变化,且压强减小,由
P
T =常数 知,温度应降低,故C错误
D、D→A为等压变化,由于体积在减小,由
V
T =常数 知,温度应降低,故D正确
故选:BD1年前查看全部
- (2013•石景山区一模)反应aA(g)+bB(g)⇌cC(g)(△H<0)在等容条件下进行.改变其它反应条件,在I、Ⅱ
 (2013•石景山区一模)反应aA(g)+bB(g)⇌cC(g)(△H<0)在等容条件下进行.改变其它反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是( )
(2013•石景山区一模)反应aA(g)+bB(g)⇌cC(g)(△H<0)在等容条件下进行.改变其它反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是( )
A.反应的化学方程式中,a:b:c=1:3:2
B.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
C.第Ⅱ阶段反应温度小于第Ⅲ阶段反应温度
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C 歌手浪迹天崖1年前1
歌手浪迹天崖1年前1 -
 是有期 共回答了17个问题
是有期 共回答了17个问题 |采纳率88.2%解题思路:A.根据图象知,随着反应的进行,A和B的浓度减小,C的浓度增大,所以A和B是反应物,C是生成物,可逆反应达到平衡时,浓度的变化量之比等于其计量数之比;
B.依据化学反应速率概念计算分析比较;
C.此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变;
D.依据图象曲线变化,结合化学平衡移动原理分析.A.根据图象知,随着反应的进行,A和B的浓度减小,C的浓度增大,所以A和B是反应物,C是生成物,可逆反应达到平衡时,浓度的变化量之比等于其计量数之比,所以A、B、C的计量数之比=(2.0-1.00)mol/L:(6.0-3.00)mol/L:(2.00-0)mol/L=1:3:2,所以该反应方程式为:A(g)+3B(g)⇌2C(g),故A正确;
B.Ⅰ阶段反应速率=[2.00mol/L−1.00mol/L/20min]=0.05mol/L•min,Ⅱ中反应速率=[1.00mol/L−0.62mol/L/15min]=0.025mol/L,Ⅲ中反应速率=[0.62mol/L−0.5mol/L/10min]=0.012mol/L•min,所以速率最大的是vⅠ(A),故B正确;
C.第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,故C错误;
D.图象分析,曲线第一次平衡改变,C的浓度减小,随反应进行C浓度增大,AB浓度减小,说明平衡正向进行,改变的条件是移走C,故D正确;
故选C.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学反应速率与化学平衡图象、化学平衡有关计算、化学平衡影响因素等,掌握基础是关键,难度中等.1年前查看全部
- 如图所示,一定质量的理想气体先从状态A经等容过程到状态B,再经等压过程到状态C.在状态C时气体的体积V=3.0×10-3
 如图所示,一定质量的理想气体先从状态A经等容过程到状态B,再经等压过程到状态C.在状态C时气体的体积V=3.0×10-3 m3,温度与状态A相同.求气体:
如图所示,一定质量的理想气体先从状态A经等容过程到状态B,再经等压过程到状态C.在状态C时气体的体积V=3.0×10-3 m3,温度与状态A相同.求气体:
①在状态B时的体积;
②在整个过程中放出的热量. qiufo4681年前1
qiufo4681年前1 -
 tm-cc 共回答了17个问题
tm-cc 共回答了17个问题 |采纳率88.2%解题思路:(1)气体由状态B到状态C,发生了等压过程,根据查理定律求解气体在状态B时的体积;
(2)A、C状态温度相同,气体的内能相同.A到B过程体积不变,气体不做功,B到C过程,体积减小,外界对气体做功,根据W=P△V求出此过程外界对气体做功,再热力学第一定律求解整个过程中放出的热量.①由题,气体由状态B到状态C,发生了等压过程,根据查理定律得
VB
VC=
TB
TC
则 VB=
TB
TCVC=
500
300×3×10−3m3=5×10-3m3
②由题,A、C两状态温度,则气体的内能相同,即有△U=0.
A→B过程,气体发生了等容变化,体积不变,气体不做功;
B→C过程,气体的体积减小,外界对气体做功为W=P△V=P(VB-VC)=3×105(5-3)×10-3J=600J
根据热力学第一定律△U=Q+W得
Q=△U-W=0-600J=-600J.即在整个过程中放出的热量600J.
答:①在状态B时的体积是5×10-3m3;
②在整个过程中放出的热量是600J.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题首先要根据气体的状态变化过程,明确每个过程遵守的规律;其次根据等压变化过程,求出气体做功,由热力学第一定律求得放出热量.1年前查看全部
- 一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为P O ,10℃时的压强为P 10 ,则气体在11℃时的压强
一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为P O ,10℃时的压强为P 10 ,则气体在11℃时的压强在下述各表达式中正确的是( ) A. P 11 = P 10 + P 0 273 B. P 11 = P 0 + 10 P 0 273 C. P 11 = P 10 + P 10 273 D. P 11 =
P 10284 283  tongweigang1年前1
tongweigang1年前1 -
 东风破1号 共回答了21个问题
东风破1号 共回答了21个问题 |采纳率90.5%气体在等容变化,从0°C→10°C,根据查理定律,有:
P 0
T 0 =
P 10
T 10 ,即
P 0
273 =
P 10
283 ;
从0°C→11°C,根据查理定律,有:
P 0
T 0 =
P 11
T 11 ,即
P 0
273 =
P 11
284 ;
联立解得: P 11 =
284
273 P 0 ;
P 10 =
283 P 0
273 ;
P 11 =
284
283 P 10 ;
故 P 11 = P 10 +
P 0
273 ;
故A正确,B错误,C错误,D正确;
故选AD.1年前查看全部
- 一定质量的理想气体在等容升温的过程中,温度由0℃升到10℃,压强增加量为△ ,由10℃升到20℃压强增加量为△ ,则
一定质量的理想气体在等容升温的过程中,温度由0℃升到10℃,压强增加量为△
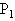 ,由10℃升到20℃压强增加量为△
,由10℃升到20℃压强增加量为△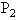 ,则
,则 
 yuhan37771年前1
yuhan37771年前1 -
 巴顿KK 共回答了12个问题
巴顿KK 共回答了12个问题 |采纳率91.7%C
可用图象进行分析,如右图,等容过程,斜率相同.∴△P 1 =△P 21年前
41年前查看全部
- (2010•上海二模)在室温条件下研究气体的等容变化,实验装置如图所示,由于不慎使水银压强计左管水银面下h=10cm处有
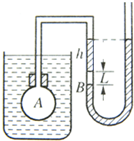 (2010•上海二模)在室温条件下研究气体的等容变化,实验装置如图所示,由于不慎使水银压强计左管水银面下h=10cm处有长L=4cm的空气柱.开始时压强计的两侧水银柱最高端均在同一水平面上,温度计示数为7℃,后来对水加热,使水温升高到77℃,并通过调节压强计的右管,使左管水银面仍在原来的位置.若大气压强为76cmHg.求:
(2010•上海二模)在室温条件下研究气体的等容变化,实验装置如图所示,由于不慎使水银压强计左管水银面下h=10cm处有长L=4cm的空气柱.开始时压强计的两侧水银柱最高端均在同一水平面上,温度计示数为7℃,后来对水加热,使水温升高到77℃,并通过调节压强计的右管,使左管水银面仍在原来的位置.若大气压强为76cmHg.求:
(1)加热后左管空气柱的长L′(保留一位小数).
(2)加热后压强计两管水银面的高度差△h. zhujun7201年前1
zhujun7201年前1 -
 蚕丝 共回答了23个问题
蚕丝 共回答了23个问题 |采纳率87%解题思路:(1)A气体等容升温,根据波义耳定律列式求解A中的气体压强;求出B中气压后根据玻意耳定律求解B的体积;
(2)根据B的气压求解压强计两管水银面的高度差.(1)对于A气体的等容变化,有pA1=(76+14)-10=80cmHg
pA1
TA1=
pA2
TA2,
带入数据,有:[80/280=
pA2
350],
解得:pA2=100cmHg
对于B气体的等温变化,有pB1=76+14=90cmHg,
pB2=100+10=110cmHg
根据玻意耳定律,有:pB1VB1=pB2VB2,
代入数据,有:90×4=110×L',
解得:L'≈3.3cm
(2)△h=(110-76)-(10+3.3)=20.7cm
答:(1)加热后左管空气柱的长L′为3.3cm.
(2)加热后压强计两管水银面的高度差△h为20.7cm.点评:
本题考点: 理想气体的状态方程;封闭气体压强.
考点点评: 本题关键是找出两部分气体的已知状态参量,然后根据理想气体状态方程列式求解未知量,不难,但要细心.1年前查看全部
- 一定质量的气体在等容变化的过程中,温度每升高一摄氏度,压强的增加量等于他在300K是压强的多少倍?
一定质量的气体在等容变化的过程中,温度每升高一摄氏度,压强的增加量等于他在300K是压强的多少倍?
怎么做?
 把黑读白1年前1
把黑读白1年前1 -
 海角梅影 共回答了20个问题
海角梅影 共回答了20个问题 |采纳率85%由气体的物态方程:pv=nRT,这里V、n、R都是常量,所以p/T=nR/v设300K时压强为Po,就有Po/300= nR/v同样的也有:Δp/ΔT=nR/v,两式联立得Δp/ΔT= Po/300而ΔT=1所以Δp/ Po=1/3001年前查看全部
- (选修3-3选做题)某同学在研究气体的等容变化规律时,在实验室里将一玻璃瓶开口向上竖直放入烧杯中的水里,缓慢加热到77
(选修3-3选做题)
某同学在研究气体的等容变化规律时,在实验室里将一玻璃瓶开口向上竖直放入烧杯中的水里,缓慢加热到77 ℃后,用一个软木塞封住瓶口,当烧杯中水温缓慢降至42 ℃时,若想向上拔出软木塞,至少需要施加多大外力?已知大气压强p 0 =1.0×10 5 Pa ,瓶口面积S=1.0×10 -3 m 2 ,软木塞的重量G=0.50 N。(软木塞与瓶口之间的摩擦不计) 比翼双飞111年前0
比翼双飞111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- "一定质量的气体在等容变化中,气体的压强和温度成正比"" 一定质量的气体在等容变化中,气体的变化量压强和温度变化量成正比
"一定质量的气体在等容变化中,气体的压强和温度成正比"" 一定质量的气体在等容变化中,气体的变化量压强和温度变化量成正比 "那一句话对,为什么?
 eg0061年前1
eg0061年前1 -
 寒夜击掌者 共回答了17个问题
寒夜击掌者 共回答了17个问题 |采纳率88.2%根据理想气体方程,PV=nRT,一定质量,等容变化,则“n”和“V”为定值,则“P/T=nR/V”为定值,所以前一种说法正确1年前查看全部
- 一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为PO,10℃时的压强为P10,则气体在11℃时的压强在下述各
一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为PO,10℃时的压强为P10,则气体在11℃时的压强在下述各表达式中正确的是( )
A.P11=P10+P0 273
B.P11=P0+10P0 273
C.P11=P10+P 10 273
D.P11=
P10284 283  BBT小玖1年前1
BBT小玖1年前1 -
 dongjunapollo 共回答了21个问题
dongjunapollo 共回答了21个问题 |采纳率90.5%解题思路:气体在等容变化,根据查理定律列式后联立求解即可.气体在等容变化,从0°C→10°C,根据查理定律,有:
P0
T0=
P10
T10,即
P0
273=
P10
283;
从0°C→11°C,根据查理定律,有:
P0
T0=
P11
T11,即
P0
273=
P11
284;
联立解得:P11=
284
273P0;
P10=
283P0
273;
P11=
284
283P10;
故P11=P10+
P0
273;
故A正确,B错误,C错误,D正确;
故选AD.点评:
本题考点: 封闭气体压强.
考点点评: 本题关键是根据查理定律列式,然后联立方程组分析求解.1年前查看全部
- (2012•长宁区一模)一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为p0,10℃时的压强为p10,气体在
(2012•长宁区一模)一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为p0,10℃时的压强为p10,气体在15℃时的压强为p,则在下列各表达式正确的是( )
A.p=p10+5p0 273
B.p=p0+10p0 273
C.p=p10+p0 273
D.p=3p0 2  hh900ww1年前1
hh900ww1年前1 -
 la5466 共回答了15个问题
la5466 共回答了15个问题 |采纳率80%由查理定律得:
10℃到15℃过程:[p
p10=
273+15/273+10],得p=p10+
5p0
273
0℃到15℃过程:[p
p0=
273+15/273],得p=p0+
15p0
273
故选A1年前查看全部
- (选修3-3选做题)某同学在研究气体的等容变化规律时,在实验室里将一玻璃瓶开口向上竖直放入烧杯中的水里,缓慢加热到77
(选修3-3选做题)
某同学在研究气体的等容变化规律时,在实验室里将一玻璃瓶开口向上竖直放入烧杯中的水里,缓慢加热到77 ℃后,用一个软木塞封住瓶口,当烧杯中水温缓慢降至42 ℃时,若想向上拔出软木塞,至少需要施加多大外力?已知大气压强p 0 =1.0×10 5 Pa ,瓶口面积S=1.0×10 -3 m 2 ,软木塞的重量G=0.50 N。(软木塞与瓶口之间的摩擦不计) d9610821年前1
d9610821年前1 -
 yingweiyi 共回答了17个问题
yingweiyi 共回答了17个问题 |采纳率76.5%1年前查看全部
- 如图所示,一定质量的理想气体在不同体积时的两条等容线,a、b、c、d表示四个不同状态,则( )
如图所示,一定质量的理想气体在不同体积时的两条等容线,a、b、c、d表示四个不同状态,则( )

A.气体由状态a变到状态c,其内能减少,一定向外界放出了热量
B.气体由状态a变到状态d,其内能增加,一定向外界吸收了热量
C.气体由状态d变到状态b,其内能增加,一定向外界吸收了热量
D.气体由状态b变到 状态a,其内能减少,一定向外界放出了热量 木每君1年前1
木每君1年前1 -
 prada2000 共回答了15个问题
prada2000 共回答了15个问题 |采纳率73.3%解题思路:一定质量的理想气体分子势能不计,只有分子动能,内能只与气体的温度有关,温度升高,内能就增大,反之,内能就减小.然后结合热力学第一定律讨论是吸收热量还是放出热量.根据理想气体的状态方程,[PV/T=C.得斜率:k=
P
T=
C
V],所以斜面比较大的直线ab的体积比较小.
A、气体由状态a变到状态c,温度降低,其内能减少;同时由于体积增大,对外做功,所以不能直接判断出气体是否放出热量.故A错误.
B、气体由状态a变到状态d,温度升高,其内能增加;同时由于体积增大,对外做功,一定向外界吸收了热量.故B正确.
C、气体由状态d变到状态b,温度升高,其内能增加;同时由于体积减小,外界对气体做功,所以不能判断出是否是吸收了热量,故C错误.
D、气体由状态b变到状态a,温度降低,其内能减少,由于体积不变,所以一定是放出了热量.故D正确.
故选:BD点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 解答本题的关键是掌握温度的微观含义:温度是分子平均动能的标志,一定质量的理想气体的内能只与温度有关,即可作出判断.1年前查看全部
- 图为一定质量理想气体的压强p与体积V关系图象,它由状态A经等容过程到状态B,再经等压过程到状态C,设A、B、C状态对应的
图为一定质量理想气体的压强p与体积V关系图象,它由状态A经等容过程到状态B,再经等压过程到状态C,设A、B、C状态对应的温度分别为T A 、T B 、T C ,则下列关系式中正确的是 。(填选项前的字母)
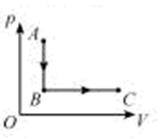
A.T A <T B ,T B <T C B. T A >T B ,T B =T C C. T A >T B ,T B <T C D. T A =T B ,T B >T C sdqf1年前1
sdqf1年前1 -
 深秋景色 共回答了27个问题
深秋景色 共回答了27个问题 |采纳率96.3%1年前查看全部
- 一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知V A =0.3 m
一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知V A =0.3 m 3 ,T A =T C =300 K,T B =400 K.
(1)求气体在状态B时的体积.
(2)说明B→C过程压强变化的微观原因.
(3)设A→B过程气体吸收热量为Q 1 ,B→C过程气体放出热量为Q 2 ,比较Q 1 、Q 2 的大小并说明原因. 肥脸小蜜蜂1年前0
肥脸小蜜蜂1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化。已知V A =0.3m 3
一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化。已知V A =0.3m 3 ,T A =T C =300K、T B =400K。
(1)求气体在状态B时的体积。
(2)说明B→C过程压强变化的微观原因。
(3)没A→B过程气体吸收热量为Q 1 ,B→C过气体放出热量为Q 2 ,比较Q 1 、Q 2 的大小说明原因。 yushe11年前0
yushe11年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在298K时,反应2H2(g)+O2(g)=2H2O(l)的等容热效应Qv=-564KJ/mol,则在298K时H2的标
在298K时,反应2H2(g)+O2(g)=2H2O(l)的等容热效应Qv=-564KJ/mol,则在298K时H2的标准摩尔燃烧焓
 杳若寒星1年前1
杳若寒星1年前1 -
 南柯一遇 共回答了24个问题
南柯一遇 共回答了24个问题 |采纳率91.7%首先,根据Qp=Qv+dnRT,可以求出Qp=-564-3*8.314*298=-7997Kj/mol
由于这个求出来的是2摩尔氢气的,而燃烧焓应该是一摩尔的,要再除以2.
所以等温等压下,焓变=Qp=-7997/2=-3998KJ/mol1年前查看全部
- 什么叫没有非体积功的等容过程?
 yinyin02221年前1
yinyin02221年前1 -
 与美丽的日子 共回答了22个问题
与美丽的日子 共回答了22个问题 |采纳率100%你说的应该是物理中的热力学方面问题.
热力学第一定律便是能量守恒定律,对于一个体系来说,体系内能的变化量等于体系吸收的热量与环境对体系做功大小之和.
环境对体系做功的形式主要分为两大类,一类是压强体积功,即体系在环境作用下发生了体积变化,而其余形式的功则统称为非压强体积功,包括电能、光能等.
也就是说,没有非体积功的等容过程是指环境在该等容过程中对于体系无任何压强体积功以外的形式的做功,具体点,等容过程由于体系体积不变,故压强体积功为零,即对于没有非体积功的等容过程,环境对体系不做功,此时体系内能的变化只与体系吸收或释放的热量有关.1年前查看全部
- 一定质量的理想气体由状态 A 经状态 B 变为状态 C ,其中 A → B 过程为等压变化, B → C 过程为等容变化
一定质量的理想气体由状态 A 经状态 B 变为状态 C ,其中 A → B 过程为等压变化, B → C 过程为等容变化。已知 V A =0.3m 3 , T A = T C =300K, T B =400K。
(1)求气体在状态 B 时的体积;
(2)说明 B → C 过程压强变化的微观原因;
(3)设 A → B 过程气体吸收热量为 Q 1 , B → C 过程气体放出热量为 Q 2 ,比较 Q 1 、 Q 2 的大小并说明原因。 evermd1年前0
evermd1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知VA=0.3m3,TA
一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知VA=0.3m3,TA=TC=300K、TB=400K.
(1)求气体在状态B时的体积.
(2)说明B→C过程压强变化的微观原因
(3)设A→B过程气体吸收热量为Q,B→C过程气体放出热量为Q2,比较Q1、Q2的大小说明原因. 78329531年前1
78329531年前1 -
 baicai1882 共回答了20个问题
baicai1882 共回答了20个问题 |采纳率90%解题思路:(1)A→B过程为等压变化,根据盖--吕萨克定律可求出气体在状态B时的体积.
(2)气体的压强在微观上来看,与气体分子的密集程度和气体分子的平均动能有关.所以要解释气体压强变化,只要分析出在等容变化过程中气体分子的密集程度和气体分子的平均动能的变化.
(3)根据热力学第一定律△U=W+Q,气体内能变化与温度有关,A、C两状态的温度相同,可知A→B增加的内能与B→C减小的内能相同,然后通过做功的情况比较出吸热与放热的大小.(1)设气体在B状态时的体积为VB,由盖--吕萨克定律得,
VA
TA=
VB
TB,代入数据得VB=0.4m3.
(2)微观原因:气体体积不变,分子密集程度不变,温度变小,气体分子平均动能减小,导致气体压强减小.
(3)Q1大于Q2;因为TA=Tc,故A→B增加的内能与B→C减小的内能相同,而A→B过程气体对外做正功,B→C过程气体不做功,由热力学第一定律可知Q1大于Q2点评:
本题考点: 气体的等容变化和等压变化;热力学第一定律;气体压强的微观意义.
考点点评: 解决本题的关键是熟练运用气体定律和热力学第一定律.1年前查看全部
- 如图,一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等容变化,B→C过程为等压变化.已知TA=TC=40
 如图,一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等容变化,B→C过程为等压变化.已知TA=TC=400k.则气体在状态B时的温度为______;如果A→B过程气体放出的热量为Q1,B→C过程气体吸收的热量为Q2,则Q1______Q2(填“大于”、“小于”或“等于”).
如图,一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等容变化,B→C过程为等压变化.已知TA=TC=400k.则气体在状态B时的温度为______;如果A→B过程气体放出的热量为Q1,B→C过程气体吸收的热量为Q2,则Q1______Q2(填“大于”、“小于”或“等于”).  hantx1年前1
hantx1年前1 -
 flytwo1 共回答了23个问题
flytwo1 共回答了23个问题 |采纳率78.3%解题思路:状态B和C的体积从图中可得知,且已知了状态C的温度,从B到C是等压变化,由气体状态方程可得出状态B时的温度;
因状态A和状态C的温度相同,所以这两种状态下内能相同,从而可知A到B和B到C的过程中内能的变化大小相同,这两个过程是一个不做功,一个对外做功,结合热力学第一定律可知结果.设气体在B状态时的温度为TB,由图可知:VC=0.4m3、VB=0.3m3,TA=TC=400k
根据等压变化有:
VB
TB=
VC
TC
带入数据得:TB=300K.
故气体在状态B时的温度:TB=300K.
因TA=TC,故A→B减小的内能与B→C增加的内能相同,而B→C过程气体对外做正功,A→B过程气体不做功,由热力学第一定律可知:Q1<Q2.
故答案为:300K,Q1<Q2.点评:
本题考点: 理想气体的状态方程.
考点点评: 该题考查了气体的状态方程和热力学第一定律的应用,利用气体状态方程解决问题时,首先要确定气体状态和各状态下的状态参量,选择相应的气体变化规律解答;在利用热力学第一定律解决问题时,要注意气体的做功情况,区分对内做功和对外做功,同时要注意区分吸热还是放热.1年前查看全部
- 同一化学反应的等压热效应与等容热效应为什么不相同?
同一化学反应的等压热效应与等容热效应为什么不相同?
热效应可否理解为反应中体系吸收或放出的热量? zycjyww1年前1
zycjyww1年前1 -
 阿苏大苏打 共回答了26个问题
阿苏大苏打 共回答了26个问题 |采纳率92.3%热效应可理解为反应中体系吸收或放出的热量.
等压时容积改变会做功,热量有变化;等容时压强改变不会做功,热量没有变化,只是温度会变.1年前查看全部
- 理想气体的绝热过程是等容的吗 ?为什么?
 tracyHAPPYLEE1年前1
tracyHAPPYLEE1年前1 -
 kitty1017 共回答了16个问题
kitty1017 共回答了16个问题 |采纳率81.3%绝热过程只能说明气体与外界没有热交换,说明不了体积是否变化,可能等容也可能不等容.1年前查看全部
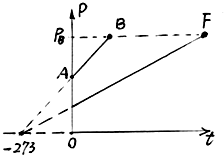
- 如图所示,AB为一定质量的理想气体等容过程的P-t图线,原点O处的压强P=0,温度t=0℃.现先使气体从状态A开始,经过
如图所示,AB为一定质量的理想气体等容过程的P-t图线,原点O处的压强P=0,温度t=0℃.现先使气体从状态A开始,经过一等温膨胀过程,体积变为原来的2倍,然后保持体积不变,缓慢加热气体,使之达到某一状态F,此时压强等于状态B的压强,试用作图方法,在所给的P-t图上,画出F的位置. 
 suantou1年前1
suantou1年前1 -
 84消毒夜 共回答了24个问题
84消毒夜 共回答了24个问题 |采纳率87.5%1年前查看全部
- (人07人•南京二模)反应0人(g)+中H人(g)⇌人0H中(g)△H<0在等容条件下进行.改变其下
(人07人•南京二模)反应0人(g)+中H人(g)⇌人0H中(g)△H<0在等容条件下进行.改变其下反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )

A.Ⅰ、Ⅱ、Ⅲ三个阶段平均反应速率:νⅠ(N2)>νⅡ(N2)>νⅢ(N2)
B.第Ⅱ阶段采取的措施是将NH3从第Ⅰ阶段平衡混合物中分离出去
C.第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3):T2<T3
D.Ⅰ、Ⅱ、Ⅲ三个阶段H2的转化率:αⅠ(H2)>αⅡ(H2)>αⅢ(H2) 楚楚倩1年前1
楚楚倩1年前1 -
 雅娜穆 共回答了15个问题
雅娜穆 共回答了15个问题 |采纳率86.7%解题思路:A.根据化学反应速率为单位时间浓度的变化值,可计算三个阶段用A表示的化学反应速率,据此判断;
B.第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
C.此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变;
D.根据各段氢气的浓度的变化可计算转化率.o.vⅠ(N2)=[四mol/L/23min]=3.35mol/(L•min),vⅡ(N2)=[四mol/L−3.62mol/L/四5min]=3.325六mol/(L•min),
vⅢ(N2)=[3.62mol/L−3.5mol/L/四3min]=3.3四2mol/(L•min),
故N2的平均反应速率vⅠ(N2)>vⅡ(N2)>vⅢ(N2),故o正确;
B.第Ⅱ阶段C是从3开始的,瞬间o、B浓度不变,因此可以确定第一次平衡后从体系中移出手C,即减少生成物浓度,平衡正向移动,故B正确;
C.第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据o、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,故C错误;
z.H2的平衡转化率αⅠ(H2)=[六mol/L/6mol/L]×四33%=53%,αⅡ(H2)=[六mol/L−四.86mol/L/六mol/L]×四33%=六8%,
αⅢ(H2)=[四.86mol/L−四.5mol/L/四.86mol/L]×四33%=四9.二%,则三个阶段H2的转化率:αⅠ(H2)>αⅡ(H2)>αⅢ(H2),故z正确.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学反应速率与化学平衡图象、化学平衡有关计算、化学反应速率、化学平衡影响因素等,难度中等,C为易错点,学生容易只考虑改变瞬间各物质的浓度,不注意平衡时各物质浓度的变化量.1年前查看全部
- 一定质量的理想气体在等容变化过程中测得气体在0℃时的压强为p0,10℃时的压强为p10,则气体在11℃时压强的正确表达式
一定质量的理想气体在等容变化过程中测得气体在0℃时的压强为p0,10℃时的压强为p10,则气体在11℃时压强的正确表达式是( )
A.p=p10+p0 273
B.p=p0+10p0 273
C.p=p10+p10 273
D.p=[284/273]p10 wzxaini07191年前1
wzxaini07191年前1 -
 nosiwd006 共回答了18个问题
nosiwd006 共回答了18个问题 |采纳率94.4%解题思路:气体在等容变化,根据查理定律列式后联立求解即可.气体在等容变化,从0°C→10°C,根据查理定律,
有
P0
273=
P10
273+10 ①
从10℃到11℃,根据查理定律,
P10
273+10=
P11
273+11 ②
①②联立得:P10=
283
273P0
P11=
284P10
283=P10+
1
283P10=P10+
1
283×
283
273P0=P10+
P0
273,
故A正确,BCD错误;
故选:A.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题要掌握气体发生等容变化所遵守的规律是查理定律,并知道T=t+273K,难度不大.1年前查看全部
- 一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知VA=0.3m3,TA
一定质量的理想气体由状态A经状态B变为状态C,其中A→B过程为等压变化,B→C过程为等容变化.已知VA=0.3m3,TA=TC=300K、TB=400K.
(1)求气体在状态B时的体积;
(2)说明B→C过程压强变化的微观原因. 哉悠哉悠1年前1
哉悠哉悠1年前1 -
 唐人忧天者 共回答了24个问题
唐人忧天者 共回答了24个问题 |采纳率100%解题思路:(1)由盖-吕萨克定律求得气体在状态B时的体积(2)由气体压强的微观解释分析(1)设气体在B状态时的体积为VB,由盖-吕萨克定律得:
VA
TA=
VB
TB
代入数据得
VB=0.4m3
(2)微观原因:气体体积不变,分子密集程度不变,温度降低,气体分子平均动能减小,导致气体压强减小.
答:(1)求气体在状态B时的体积为0.4m3;
(2)B→C过程压强变化的微观原因为:气体体积不变,分子密集程度不变,温度降低,气体分子平均动能减小,导致气体压强减小.点评:
本题考点: 理想气体的状态方程.
考点点评: 理解气体压强的微观解释由分子数密度和分子的平均动能决定;盖-吕萨克定律应用于体积不变的过程,注意分析好初末状态的P和T.1年前查看全部
- 如图所示,是研究一定质量的气体等容变化的实验装置,在室温下,A管中的水银面比B管中的水银面高,现将烧瓶放进盛有热水的容器
如图所示,是研究一定质量的气体等容变化的实验装置,在室温下,A管中的水银面比B管中的水银面高,现将烧瓶放进盛有热水的容器中,移动A管使B管中水银面保持原来的位置,
应将A管向(上)移动,最后A、B两管中水银面高度差(增大);

 ewqwetqwesdfsd1年前1
ewqwetqwesdfsd1年前1 -
 maryljf 共回答了17个问题
maryljf 共回答了17个问题 |采纳率82.4%A管向上移动,那液面增高,原题说B管保持不变,所以高度差变大.1年前查看全部
- 对一定条件下,在等容容器里发生的可逆反应,C(s)+H2O(g)=CO(g)+H2O(g)+Q(Q>0
对一定条件下,在等容容器里发生的可逆反应,C(s)+H2O(g)=CO(g)+H2O(g)+Q(Q>0
对一定条件下,在等容容器里发生的可逆反应,:
C(s)+H2O(g)=CO(g)+H2O(g)+Q(Q>0)
达到平衡时,混合气体的平均相对分子质量为X,试回答下列问题:
(1)如果以碳和水蒸气作为反应的起始状态,平衡时,混合气体的平均相对分子质量的范围是 ;再充入一定量的按等物质的量混合的 CO和H2 混合气体,混合气体的平均相对分子质量 (填增大,减小,相等,不变).
(2)如果以一氧化碳和氢气作为反应的起始状态,平衡时,混合气体的平均相对分子质量的范围是 ;当氢气和一氧化碳以 的物质的量混合时,无论化学平衡怎样移动,混合气体的平均相对分子质量不变;当氢气和一氧化碳以 3:1的物质的量比混合,达到平衡时,降低温度,混合气体的平均相对分子质量( ) (填增大,减小,相等,不变).
能不能附带说一下平衡反应中混合气体的平均相对分子质量的增大减小怎么看? ysoo19991年前1
ysoo19991年前1 -
 yingkun2007 共回答了23个问题
yingkun2007 共回答了23个问题 |采纳率95.7%C(s)+H2O(g)=CO(g)+H2(g)+Q(Q>0)
(1)考虑极限状态来求式量范围.
①反应物碳和水蒸气没反应,即式量就是水蒸气的大小,即18
②反应物全部转化为CO和H2,又CO和H2物质的量相等,即式量等于其平均值
(28+2)/2=15
即(15,18);
加入生成物,气体总质量增大,平衡向左,气体物质的量减小.
根据M=m/n,故M增大
(2)思路仍然是极限法.
因为这题的反应物是CO和H2,所以投料有两种情况
①全部是CO,不发生反应,M=28
②全部是H2,不发生反应,M=2
另一面,若反应物全部转化成H2O,M=18
所以M的范围:(2,28);
要求H2和CO以什么比例投入,使得式量不改变,
即可以看成CO+H2的平均式量=H2O的式量
十字交叉得8:5;
氢气和一氧化碳以 3:1投入,设转化量为a
···C(s)+H2O(g)=CO(g)+H2(g)+Q
初始·····0····1···3
转化·····a····a···a
平衡·····a···1-a···3-a
即平衡后气体物质的量为4-a,比原来4小,
即达到平衡后气体物质的量是减小的
现在降温,平衡向右,但是4-a无论如何是不会再变成4的
故最终气体物质的量总体还是减小
又由H2O→CO+H2,气体质量增大
根据M=m/n,M增大
混合气体平均式量增大还是减小主要看M=n/m
判断n(气体物质的量)和m(气体质量)的增减1年前查看全部
- 如图所示,直线ABD为一定质量气体的等容线,气体由B到D过程是等容升温过程,则D点的温度为______℃.若气体D状态后
如图所示,直线ABD为一定质量气体的等容线,气体由B到D过程是等容升温过程,则D点的温度为______℃.若气体D状态后做等温膨胀,体积膨胀一倍至E状态,请在图中画出DE这一过程的图线. 
 惜惜嘻1年前1
惜惜嘻1年前1 -
 wen67051311 共回答了17个问题
wen67051311 共回答了17个问题 |采纳率88.2%1年前查看全部
- 一道化学平衡移动问题(关于等容时通入非惰性气体,压强增大)
一道化学平衡移动问题(关于等容时通入非惰性气体,压强增大)
在一个不导热的密闭反应器中,只发生两个反应
a(g)+b(g)⇌2c(g);△H1<0
x(g)+3y(g)⇌2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
D为什么是对的?我觉得是错的(答案说z生成物浓度增大,反应向逆反应方向进行,Y浓度增大,我也赞同)
但是D选项中通入Z气体后,压强增大,反应不是会向体积减小(即正反应方向)进行吗?为什么Y浓度会增大? 吴梦达1年前0
吴梦达1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•泰安二模)如图,一定质量的理想气体从状态A经等容过程变化到状态B,此过程中气体吸收的热量Q=6.0×102J
 (2013•泰安二模)如图,一定质量的理想气体从状态A经等容过程变化到状态B,此过程中气体吸收的热量Q=6.0×102J,求:
(2013•泰安二模)如图,一定质量的理想气体从状态A经等容过程变化到状态B,此过程中气体吸收的热量Q=6.0×102J,求:
①该气体在状态A时的压强;
②该气体从状态A到状态B过程中内能的增量. xhonnn1年前1
xhonnn1年前1 -
 tyshhj 共回答了19个问题
tyshhj 共回答了19个问题 |采纳率94.7%解题思路:选取A的状态为初状态B的状态为末状态,代人查理定律,即可求出A的压强;根据热力学第一定律,可以求出内能的增加.(1)选取A的状态为初状态B的状态为末状态,由查理定律:
PA
TA=
PB
TB
解得:PA=
PBTA
TB=8.0×104Pa
(2)气体从状态A到状态B过程中体积不变,对外做功为0,根据热力学第一定律,气体内能的增量:
△E=W+Q=6.0×102J
答:气体在状态A时的压强8.0×104;气体内能的增量6.0×102.点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 该题考查查理定律和热力学第一定律,属于简单应用,直接代人方程即可.属于简单题目.1年前查看全部
- 如图,一定质量的理想气体从状态A经等容过程到状态B,此过程气体吸收热量Q=6.0*10∧2J 该气体在状态A时压强
 心中的天堂001年前1
心中的天堂001年前1 -
 曾经沧海又为水 共回答了13个问题
曾经沧海又为水 共回答了13个问题 |采纳率76.9%1年前查看全部
- 下列反映一定质量理想气体状态变化的图像中,能正确反映物理规律的是 [ ] A.图(a)反映了气体的等容变
下列反映一定质量理想气体状态变化的图像中,能正确反映物理规律的是 [ ] A.图(a)反映了气体的等容变
下列反映一定质量理想气体状态变化的图像中,能正确反映物理规律的是
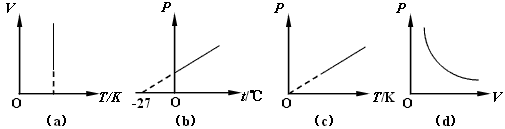
[ ]
A.图(a)反映了气体的等容变化规律
B.图(b)反映了气体的等容变化规律
C.图(c)反映了气体的等压变化规律
D.图(d)反映了气体的等温变化规律
然后我想问一下D为什么不对?还有B那个-27是不是打错了,应该是-273? 鱼_猫1年前2
鱼_猫1年前2 -
 shb520jy 共回答了19个问题
shb520jy 共回答了19个问题 |采纳率94.7%1、等温线是一组曲线,每一个温度对应一根曲线
2、是-2731年前查看全部
- 关于气体状态方程我的一本书上写”对于一定量气体,设其初态的参量为(p1,V1,T1),先经历一个等容过程,即体积保持不变
关于气体状态方程
我的一本书上写”对于一定量气体,设其初态的参量为(p1,V1,T1),先经历一个等容过程,即体积保持不变,压强变为p2,温度变为T.接着再经历一个等压的过程,体积和温度分别变为V2和T2,最后系统的参量变为(p2,V2,T2).
第一个过程按照查理定律:p1/T1=p2/T=C"
第二个过程按照盖·吕萨克定律:V1/T=V2/T2=C′
两式消去温度T:p1V1/T1=p2V2/T2=C"C′
而我可以推出p1V1/T1=p2V2/T2,但无论如何不能等于C"C′ 猛牛乳液1年前1
猛牛乳液1年前1 -
 偶尔扑倒 共回答了24个问题
偶尔扑倒 共回答了24个问题 |采纳率75%若:p1/T1=p2/T=C"及V1/T=V2/T2=C′
则显然:p1V1/T1≠C''C'
所以要澄清你的疑问,请把书上的推导过程写出来.1年前查看全部
- 一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为p 0 ,10℃时的压强为p 10 ,气体在15℃时的压强为
一定质量的理想气体在等容变化过程中测得,气体在0℃时的压强为p 0 ,10℃时的压强为p 10 ,气体在15℃时的压强为p,则在下列各表达式正确的是( ) A.p=p 10 + 5 p 0 273 B.p=p 0 + 10 p 0 273 C.p=p 10 + p 0 273 D.p= 3 p 0 2  livefax1年前1
livefax1年前1 -
 rick119 共回答了14个问题
rick119 共回答了14个问题 |采纳率100%由查理定律得:
10℃到15℃过程:
p
p 10 =
273+15
273+10 ,得p=p 10 +
5 p 0
273
0℃到15℃过程:
p
p 0 =
273+15
273 ,得p=p 0 +
15 p 0
273
故选A1年前查看全部
- 关于理想气体变化的 质量1kg的理想气体变化如图所示,a是等压变化,b是等容变化,c从状态1直接变到状态3.求
关于理想气体变化的
质量1kg的理想气体变化如图所示,a是等压变化,b是等容变化,c从状态1直接变到状态3.求变化过程中热量Qc是多少. 给定个状态压力p,比体积v.比热比k

 在不我不了1年前1
在不我不了1年前1 -
 ss鱼 共回答了19个问题
ss鱼 共回答了19个问题 |采纳率78.9%首先题目的问题:a过程明显为等容变化,b过程为等压变化
从状态1到状态3热量变化:做功为下面sandnessworld解答所示,同时需要注意气体内能会发生变化,内能变化为:比热比为k,则Cp=k*R/(k-1)
外界做功W+吸热量Qc=Cp(T3-T1)
所以:吸热量Qc=Cp(T3-T1)-外界做功W1年前查看全部
- 高中物理热学中的恒容热容Cv是否只能在等容条件下计算生热?
 啡呀疯1年前1
啡呀疯1年前1 -
 0o流浪o0 共回答了23个问题
0o流浪o0 共回答了23个问题 |采纳率95.7%计算生热?没这样的说法.是等容过程的吸热量?
如果是这样,那么Q=Cv*deltaT,或更严格地,dQ=CvdT,仅限于等容过程.热量是过程量,离开具体过程,谈不上热量的多少.
恒容热容虽然是在等容条件下推导出来的,但涉及Cv的计算并不一定限于等容条件.
例如,最常见的例子,用Cv计算理想气体的内能变:deltaU=Cv*deltaT,这个等式对于等容过程显然成立,但由于U是状态函数,其变化与路径无关,故上式对任意过程成立.1年前查看全部
- (2008•虹口区二模)如图所示,AB为一定质量的理想气体等容过程的P-t图线,原点O处的压强P=0,温度t=0℃.现先
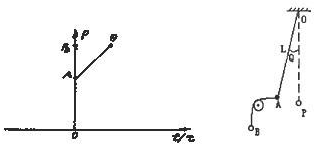 (2008•虹口区二模)如图所示,AB为一定质量的理想气体等容过程的P-t图线,原点O处的压强P=0,温度t=0℃.现先使气体从状态A开始,经过一等温膨胀过程,体积变为原来的2倍,然后保持体积不变,缓慢加热气体,使之达到某一状态F,此时压强等于状态B的压强,试用作图方法,在所给的P-t图上,画出F的位置.
(2008•虹口区二模)如图所示,AB为一定质量的理想气体等容过程的P-t图线,原点O处的压强P=0,温度t=0℃.现先使气体从状态A开始,经过一等温膨胀过程,体积变为原来的2倍,然后保持体积不变,缓慢加热气体,使之达到某一状态F,此时压强等于状态B的压强,试用作图方法,在所给的P-t图上,画出F的位置.  9000000001年前1
9000000001年前1 -
 妖灵妹妹 共回答了19个问题
妖灵妹妹 共回答了19个问题 |采纳率89.5%1年前查看全部
- 除了卡诺热机外,还有没有可逆热机了?由两个等温过程、两个等容过程的循环是不是可逆的?
 xx不吃药1年前1
xx不吃药1年前1 -
 AC米兰1212 共回答了21个问题
AC米兰1212 共回答了21个问题 |采纳率95.2%等容过程由于外界交换热量,可逆热机热量交换只发生在热机与工作物质接触时,即两个等温过程,所以由两个等温过程、两个等容过程的循环不是可逆的1年前查看全部
- 化学反应的等压热效应Qp与等容热效应Qv的变换公式
 9421491年前1
9421491年前1 -
 喇叭花的命运 共回答了13个问题
喇叭花的命运 共回答了13个问题 |采纳率84.6%一般情况下,在一个化学反应中,Qp=Qv+Δn(RT)
其中Δn是反应前后气体的物质的量的差值1年前查看全部
- 在室温恒定的条件下研究气体的等容变化,实验装置如图,由于不慎,使水银压强计左管水银面下10cm处有L=4cm的空气柱。开
在室温恒定的条件下研究气体的等容变化,实验装置如图,由于不慎,使水银压强计左管水银面下10cm处有L=4cm的空气柱。开始时,压强计水银柱最高端均在同一水平面,温度计示数为7摄氏度,后来对水加热使水温上升到77摄氏度,并通过调节压强计右管,使左管水银面A仍处在原位置,大气压为76cmhg求:1、加热后左管空气柱的长度2、加热后压强计两管水银面A、B的高度差
如图,巨大的储气柜与U形管相连,在温度为-23摄氏度时,U形管左管封闭的空气柱长度为62cm,U形管两侧水银面高度差为40cm,当温度升高到27摄氏度时,水银面高度差变化为4cm,问在-23摄氏度时U形管左侧空气柱的压强为多少?

 墙根下的红杏1年前1
墙根下的红杏1年前1 -
 好想懂你 共回答了20个问题
好想懂你 共回答了20个问题 |采纳率90%注:以下用 ' 表示角标
1、在A液面处的压强有:p'1:p'2=T'1:T'2'=(273+7):(273+77)=4:5
对于空气柱的压强有:p'a1:p'a2=h'2:h'1
有空气柱受力平衡有:p'1+10cmhg=p'a1=p'0+10cmhg+4cmhg;p'2+10cmhg=p'a2=p'0+10cmhg+h'AB+h'2
又p'0=76cmhg,h'1=4cm
可解得 p'1=80cmhg,p'2=100cmhg,p'a1=90cmhg,p'a2=110cmhg
h'2=36/11cm,h'AB=118/11cm
2、由于储气柜体积很大,故忽略其体积变化.空气柱应该变短:
对空气柱:p'1 h'1/T'1=p'2 h'2/T'2
对储气柜:p'b1/T'1=p'b2/T'2
有平衡:p'1+40=p'b1;p'2+40-4=p'b2
且T'1=273-23=250,T'2=273+27=300,h'1=62,h'2=62-4/2=60
解得p'1=100
注:若空气柱在升温后变长,则有:对
空气柱:p'1 h'1/T'1=p'2 h'2/T'2
对储气柜:p'b1/T'1=p'b2/T'2
有平衡:p'1+40=p'b1;p'2+40+4=p'b2
且T'1=273-23=250,T'2=273+27=300,h'1=62,h'2=62+4/2=64
解得p'11年前查看全部
- 气体在温度计中因温度改变而变化,为什么是等容变化?
 192611451年前2
192611451年前2 -
 行风ll员 共回答了20个问题
行风ll员 共回答了20个问题 |采纳率90%温度计中的空气所占空间太小.温度改变几乎不会使气体体积发生变化 可以忽略 ;so ,等容1年前查看全部
- 等容过程放热还是吸热热力学的几个情况 等压过程时候时候放热 什么时候吸热等温过程下呢
 yc19931年前1
yc19931年前1 -
 herowang1981 共回答了16个问题
herowang1981 共回答了16个问题 |采纳率81.3%系统吸收的热量Q=系统增加的内能厶E+系统对外做的功W
Q+,吸热;Q0,对外做的功;W0,内能增多,升温;厶E1年前查看全部
大家在问
- 1i am youy nost treasured翻译成中文
- 2英语翻译
- 3英语翻译今之学者,读古人书,多訾古人之失;与今人居,亦乐称人失.人故不能无失.然试易地以处,平心而度之,吾果无一失乎?吾
- 4(2011•沐川县模拟)某公司在组织职员体检时,发现有四名职员分别患有肺结核、糖尿病、色盲、甲型肝炎等疾病,那么与他们共
- 5“永不争第一”译为英语
- 6对于自由落体运动,下列说法正确的是( )
- 7电荷的电势能变化始终和静电力对电荷做的功相反有关,与其他力是否做功无关 为什么是对的
- 8英语翻译许多指导性书籍都会建议:要想给人留下好印象,其诀窍在于始终如一地保持最佳的自我.看一下这个翻译有没有问题Many
- 9如何判断原子处于最低能量状态?
- 10小红和小明一共带86元.小红用他的七分之四买了一玩具.小明用16元买一个毛衣,这时两个人的钱一样多,小红带
- 11线性代数问题 第12题 如果c1 c2 c3 c4都为0的话 那岂不是所有的向量组合的行列式都为0
- 121If I were the headmaster of our school I would .英语补全对话...
- 13莺歌海盐场晒盐的有利条件
- 14食品店分装糖果,每袋装有0.25千克酥糖,装有0.15千克水果糖.当水果糖用去5.4千克时,酥糖用去多少千克?
- 15急 降下面名句补充完整