褐铁矿怎么到生铁要化学方程式
 qq狂歌2022-10-04 11:39:541条回答
qq狂歌2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 休闲新食代 共回答了19个问题
休闲新食代 共回答了19个问题 |采纳率89.5%- 2C+O2=2CO
Fe2O3+3CO=2Fe+3CO2 - 1年前
相关推荐
- 有一种褐铁矿主要成分是Fe 2 O 3 ,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,进行了以下实验。
有一种褐铁矿主要成分是Fe 2 O 3 ,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,进行了以下实验。
(1)检验矿物样品中是否有Fe 3+
实验用品:锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
实验步骤: ①取样:将样品用锤子敲碎,再在研钵中研细备用。
②溶解:将样品粉末倒入烧杯,加入___________,用玻璃棒充分搅拌。
③ ___________(填操作名称)。
④检验:取少许溶液,___________。实验现象:____________。
实验结论:矿物样品中含有Fe 3+ 。
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)__________,反应的离子方程式是 ____________ 。
②对于①中过量的的固体试剂是否需要除去,同学们产生了两种观点。
甲组:认为需要过滤。
乙组:认为不需要过滤。
你支持的是组_________(填“甲”或“乙”),理由是 ____________。
③同学们在新制得的亚铁盐溶液中加入适量新制的氢氧化钠溶液,制出的氢氧化亚铁呈__________色。为使试管中的氢氧化亚铁保存的时间更长,请在图中画出你的设计(可以加必要的文字说明)。
 ljy1301年前1
ljy1301年前1 -
 乐乐的心声 共回答了10个问题
乐乐的心声 共回答了10个问题 |采纳率90%(1)稀盐酸(其他合理答案也可);过滤; 滴加KSCN溶液;溶液变为红色
(2)① Fe ; 2Fe 3+ +Fe=3Fe 2+
② 乙 ;过量的铁粉可以防止Fe 2+ 被氧化为Fe 3+ ;
③白;可覆盖一层植物油、苯等1年前查看全部
- 铝土矿褐铁矿铝土矿和褐铁矿的地质学指示意义分别是什么?
 蓝冰之剑1年前1
蓝冰之剑1年前1 -
 ╮芸╭ 共回答了17个问题
╮芸╭ 共回答了17个问题 |采纳率76.5%铝土矿是三氧化二铝形成的系列矿物的统称,主要包括一水铝石(AI2O3.H2O)、二水铝石(AI2O3.2H2O)和三水铝石(AI2O3.3H2O)的混合物及少量粘土矿物;褐铁矿是三氧化二铁的含水矿物,含水数不定,Fe2O3.nH2O.两种矿物均为风化残积形成,由铁和铝的胶体沉积形成,一般共生在一起产出.1年前查看全部
- 要冶炼含杂质为4%的生铁1600千克,铁损耗量为3%,则需要含(2Fe3O2.3H2O)80%的褐铁矿多少千克?
 Alfa_fiat1年前3
Alfa_fiat1年前3 -
 liuliu5254 共回答了13个问题
liuliu5254 共回答了13个问题 |采纳率92.3%设需要褐铁矿为x千克;
则其中含有的2Fe3O2.3H2O的质量为0.8x;
其中含铁质量为0.8x*((2*56*3)/(2*(56*3+16*2+3*18);
(此时可列方程)
0.8x*((2*56*3)/(2*(56*3+16*2+3*18)=1600*0.96*0.97
(解此方程可得出答案)
(不好意思,没带草稿纸,不能替你算了)1年前查看全部
- 铝土矿、褐铁矿是矿物种吗?为什么?
 蓝色的悦1年前1
蓝色的悦1年前1 -
 无奈懦爱 共回答了20个问题
无奈懦爱 共回答了20个问题 |采纳率85%是,一种是提取氧化铝,变成铝锭
一个是炼铁的1年前查看全部
- 用50t褐铁矿(2Fe2O3·3H20)作原料炼铁,在冶炼过程中损失铁2%,问能生成含杂志4%的生铁质量是多少?
 sammytan19791年前3
sammytan19791年前3 -
 2920870 共回答了22个问题
2920870 共回答了22个问题 |采纳率81.8%2Fe2O3·3H2O中铁元素的质量是 224/374 ×50t = 29.94 t
由于损失2%,所以只有98%进入铁中 29.94 t×98% =29.35 t
含杂质4%的生铁质量 = 29.35 t ÷(1-4%) = 30.6 t
答案:30.6 t1年前查看全部
- 岩金矿地质勘查我矿区露天发现铁锰氧化、褐铁矿化,打钻孔2米-4米是氧化赤铁品位25%.到20米-26米是磁铁矿,含铁品位
岩金矿地质勘查
我矿区露天发现铁锰氧化、褐铁矿化,打钻孔2米-4米是氧化赤铁品位25%.到20米-26米是磁铁矿,含铁品位30%-35%.磁法测量含铁矿化带长200米,宽80米.在距离100米处电法测量极化率3左右.打钻孔280米验证连续发现含金矿脉,化验品位含金量0.15克/吨-0.82克/吨.根据电法测量安照极化率走向布钻孔12处,经采岩芯化验分析均发现含金矿层.请教各位尊师我矿现状岩金矿有继续投资开发的价值吗! rangxinruzhishui1年前1
rangxinruzhishui1年前1 -
 ee想结婚 共回答了25个问题
ee想结婚 共回答了25个问题 |采纳率92%已经发现含金的矿层,布置钻孔12个,没有发现工业品位和工业矿体,建议你在倾向上再布置一到两个孔,如果还是像原来的低品位的贫矿,就没有必要再做工作了.
另外,有一个问题要请问,含金的矿石,是不是和磁铁矿的矿石共生,如果是共生的,又是露天可以开采的,是可以考虑作为贫矿综合开采的,在选矿的过程中分离出铁和金,这样才能够有利可图.
另一个问题就是,你打钻孔280米,是单孔的孔深,还是12个孔加起来的孔深,如果是总的孔深,就必须再进一步勘察深部矿藏的情况.
要是距离我这里近,我可以去看看,免费的提供看法吧.1年前查看全部
- 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
(1)检验矿物样品中是否有Fe3+
实验用品:锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
实验步骤:
①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入______,用玻璃棒充分搅拌.
③______(填操作名称).
④检验:取少许溶液,______.
实验现象:______.
实验结论:矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)______,反应的离子方程式是______.
②对于①中过量的固体试剂是否需要除去,同学们产生了两种观点.
甲组:认为需要过滤. 乙组:认为不需要过滤.
你支持的是组______(填“甲”或“乙”),理由是______
③同学们在新制得的亚铁盐溶液中加入适量新制的氢氧化钠溶液,制出的氢氧化亚铁呈______色.为使试管中的氢氧化亚铁保存的时间更长,请在右图中画出你的设计(可以加必要的文字说明). issn_1661年前1
issn_1661年前1 -
 最爱洗澡 共回答了19个问题
最爱洗澡 共回答了19个问题 |采纳率100%解题思路:(1)氧化铁可以和酸反应生成三价铁盐和水,三价铁遇到硫氰酸钾显示红色;
(2)①金属铁可以和三价铁之间发生反应生成亚铁离子;
②亚铁离子很容以被氧化为三价铁,为了防止被氧化,需加入金属铁;
③亚铁离子和氢氧根反应生成氢氧化亚铁白色沉淀,易被氧化为氢氧化铁.(1)氧化铁可以和盐酸反应生成氯化铁和水,将氯化铁和难溶物质分离的方法可以采用过滤法,三价铁遇到硫氰酸钾显示红色,可以用硫氰酸钾检验三价铁离子的存在,
故答案为:稀盐酸;过滤; 滴加KSCN溶液;溶液变为红色;
(2)①金属铁可以和三价铁之间发生反应生成亚铁离子,为了得到亚铁盐的溶液,可以在剩余的氯化铁溶液中加入过量的铁,发生反应:2Fe3++Fe=3Fe2+,
故答案为:Fe;2Fe3++Fe=3Fe2+;
②在氯化铁和金属铁反应生成氯化亚铁的反应中,过量的铁不必除去,因为亚铁离子很容以被氧化为三价铁,为了防止被氧化,需加入金属铁,
故答案为:乙;过量的铁粉可以防止Fe2+被氧化为Fe3+;
③氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,为了防止被氧化,必须隔绝氢氧化亚铁和空气的接触,可覆盖一层和水互不相溶且密度小于水的液体乳:植物油、苯等,
故答案为:白;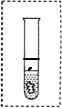 .
.点评:
本题考点: 检验三价铁与二价铁;制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查学生亚铁离子和三价铁离子的性质和检验知识,注意平时知识的积累是解题的关键,难度中等.1年前查看全部
- 从效益和环保的角度分析,下列铁矿石中最不适宜炼铁的是() A.赤铁矿 B.磁铁矿C.黄铁矿D.褐铁矿
 yicai07581年前1
yicai07581年前1 -
 拖鞋跑丢了 共回答了15个问题
拖鞋跑丢了 共回答了15个问题 |采纳率86.7%黄铁矿是铁的二硫化物.纯黄铁矿中含有46.67%的铁和53.33%的硫.一般将黄铁矿作为生产硫磺和硫酸的原料,而不是用作提炼铁的原料,因为提炼铁有更好的铁矿石.1年前查看全部
- 理论上用100吨褐铁矿(2Fe2O3.3H2O,式量为374)能冶炼出多少吨含铁96%的生铁,设冶炼过程中损铁为20%
 穿青云过林海1年前1
穿青云过林海1年前1 -
 东阳人蔡一平 共回答了14个问题
东阳人蔡一平 共回答了14个问题 |采纳率100%假设可以冶炼出X吨,则
100*(56*4/374)*(1-20%)=X*96%
算出x≌49.910873440285204991087344028521年前查看全部
- 区别:磁铁矿、赤铁矿、褐铁矿和黄铁矿
 dai1977131年前2
dai1977131年前2 -
 佩枪小zz 共回答了20个问题
佩枪小zz 共回答了20个问题 |采纳率85%磁铁矿主要成分是Fe3O4,具有磁性,其他三种没有磁性,可以用磁铁分出来.
黄铁矿主要成分是铁的硫化物,高温灼烧有二氧化硫的刺激性气味.其他三种不含硫,灼烧没有刺激气味.
赤铁矿是a-氧化铁,褐铁矿是氧化铁的水合物,如果单纯从此考虑,可隔绝空气加热,有水珠的是褐铁矿.但是考虑到赤铁矿不可能绝对无水,因此由于褐铁矿的铁含量比赤铁矿低得多,可考虑酸溶解后重新沉淀的方法根据铁含量区别.
仅供参考1年前查看全部
- 赤铁矿.褐铁矿.磁铁矿.菱铁矿.的化学式是怎么?它们难易还原程度怎么排列?为什么?
赤铁矿.褐铁矿.磁铁矿.菱铁矿.的化学式是怎么?它们难易还原程度怎么排列?为什么?
绝对正确的告诉我个.难易还原程度怎么排列. 虎皮沙拉1年前2
虎皮沙拉1年前2 -
 lnyj 共回答了23个问题
lnyj 共回答了23个问题 |采纳率100%赤铁矿中主要成分为Fe2O3,即氧化铁;褐铁矿实际上并不是一个矿物种,而是针铁矿、纤铁矿、水针铁矿、水纤铁矿以及含水氧化硅、泥质等的混合物.化学成分变化大,含水量变化也大.磁铁矿:主要成分为Fe3O4,即四氧化三铁;菱铁矿主要成分为FeCO3,即碳酸亚铁.
准确地说它们的难易还原程度无法确切地比较,Fe2O3中Fe为亚铁离子即Fe2+,Fe3O4中可以看成是一个Fe2O3和一个FeO组成,Fe2+既有氧化性又有还原性,Fe3+只有氧化性,所以Fe2+的氧化性不如Fe3+,而Fe3+的还原性不如Fe2+,即含Fe2+的化合物更容易被还原.1年前查看全部
- 用重铬酸钾标准溶液滴定0.4000g褐铁矿,若所用的重铬酸钾溶液的体积与试样中的氧化铁质量分数相同,求重铬酸钾对铁的滴定
用重铬酸钾标准溶液滴定0.4000g褐铁矿,若所用的重铬酸钾溶液的体积与试样中的氧化铁质量分数相同,求重铬酸钾对铁的滴定度
 l灵灵1年前1
l灵灵1年前1 -
 高温低温常温 共回答了13个问题
高温低温常温 共回答了13个问题 |采纳率84.6%X=[(T*V)/(0.4000*1000)]*100
当X=V时,T=4.000mg/ml1年前查看全部
- 用重铬酸钾法测定褐铁矿中铁含量,整个反应过程如何?定出测定过程中各反应的反应式
 等你忘了我是谁1年前1
等你忘了我是谁1年前1 -
 颓废的种子 共回答了22个问题
颓废的种子 共回答了22个问题 |采纳率81.8%(1)加入盐酸 氧化铁和盐酸的反应
(2)过量SnCl2 还原三价铁 Sn2++Fe3+---Fe2++Sn3+(没配平)
(3)多出来的SnCl2用Hgcl2氧化 这是个两部反应先是 HgCl2+SnCl2----Hg2Cl2(白色)+SnCl4 然后Hg2Cl2(白色)+SnCl2----Hg(黑色)+SnCl4 即出现黑色停止滴定
(4)指示剂:二苯磺酸钠和硫酸磷酸配在一起 然后就是重铬酸钾滴定二价铁的反应了.
差不多就这些了吧.呼呼.1年前查看全部
大家在问
- 1英语翻译Marr believed that it was important to establish scienti
- 2高数定积分应用某平面图形由曲线y=x^2与直线x=1及y=0围成,试求,该平面图形绕y轴旋转所得的旋转体的体积
- 3列竖式计算,带*号的要验算 116×28= *3276÷84= 962÷28= *240×38=
- 4(2011•黄浦区二模)某小型工厂安排甲乙两种产品的生产,已知工厂生产甲乙两种产品每吨所需要的原材料A、B、C的数量和一
- 5this keeps your eyes closed allowing them to blink correctly
- 6sb was doing sth
- 7离子氧化性强弱顺序表
- 8有一只蜗牛从一个深30厘米的井底往上爬,每爬5厘米要3分钟,然后休息1分钟,那么它爬出井口至少需要()分
- 9《繁星春水》里面的优美的语句诗词。十处左右。^O^
- 10( )义()生 ( )此( )彼
- 11cheap的比较极是什么?far的比较级是什么?最高级是什么?单项选择:⑴ The world is becoming
- 12四年级应用题(难)
- 13若对心肌细胞施用某种霉素,结果钙离子吸收明显减少,而钾离子、葡萄糖的物质的吸收量不受影响,其原因
- 14把一个小数的小数点向右移动一位后,得到的数比原来的数大61.2,这个数原来是______.
- 15光敏电阻的特性光敏电阻5537的最大电阻跟最小电阻是多少.
