氮族元素关于氨气计算的.3Q标准状况下,用一定量水吸收氨气后制得12mol/L,密度为0.915g/cm3的氨水.试计算
 咖啡罐頭2022-10-04 11:39:541条回答
咖啡罐頭2022-10-04 11:39:541条回答标准状况下,用一定量水吸收氨气后制得12mol/L,密度为0.915g/cm3的氨水.试计算1体积水需吸收多少体积的氨气才能制得上述氨水.

已提交,审核后显示!提交回复
共1条回复
 cgq5604991 共回答了22个问题
cgq5604991 共回答了22个问题 |采纳率95.5%- MS见过该题,记得是730多体积
可以算一下,设一体积吸收x体积,假如是1L水,就是xL氨气
12=1000×0.915ω/17
ω(质量分数)=一个数
ω=(17x/22.4)/(1+17x/22.4)
解出答案就是 - 1年前
相关推荐
- (2014•泸州模拟)某研究性学习小组的同学学习完氮族元素之后,对氮元素的氢化物和氧化物的性质进行了更深入的探究.
(2014•泸州模拟)某研究性学习小组的同学学习完氮族元素之后,对氮元素的氢化物和氧化物的性质进行了更深入的探究.
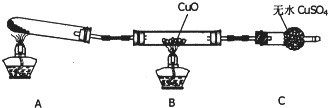
I.NH3性质的探究
(1)实验室制取氨气的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O△ .2NH4Cl+Ca(OH)2.
CaCl2+2NH3↑+2H2O△ .
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.你认为他能否达到目的?______ (填“能”或“否”),理由是______.
(3)该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
①该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是______.
②利用改进后的装置进行实验,观察到B装置中CuO变为红色物质,C装置中无水CuSO4变为蓝色,同时生成一种无污染的气体.写出氨气与CuO反应的化学方程式3CuO+2NH3
3Cu+N2+3H2O△ .3CuO+2NH3.
3Cu+N2+3H2O△ .
③有同学认为:NH3与CuO反应生成的红色物质中可能含有红色的Cu20.
已知:Cu20是一种碱性氧化物,在酸性溶液中Cu+
Cu+Cu2+.请你设计一个简单的实验检验该红色物质中是否含有Cu20.______.H+
Ⅱ.NO2性质的探究
该小组的同学还设计了如图所示装置用以制取NO2并验证NO2能否支持木条燃烧(忽略N2O4的存在,图中铁架台等夹持仪器均已略去).已知:硝酸铜加热分解的化学方程式为2Cu(NO3)2═2CuO+4NO2↑+O2↑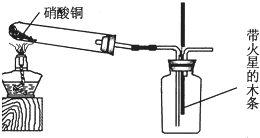
(4)当集气瓶中充满红棕色气体时,带火星的木条复燃了,有的词学得出“N02能支持木条的燃烧”的结论.你认为这一结论是否正确?______ (填“正确”或“不正确”),理由是______. ylily09211年前1
ylily09211年前1 -
 zmr2008 共回答了18个问题
zmr2008 共回答了18个问题 |采纳率100%解题思路:(1)实验室用氯化铵和消石灰反应制备氨气;
(2)氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(3)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
②由题意可知生成物为铜、氮气和水,以此书写化学方程式;
③依据氧化亚铜在酸溶液中发生自身氧化还原反应生成铜和铜离子,盐城蓝色证明氧化亚铜的存在;
(4)根据该反应中氧气所占的体积分数与空气中氧气所占的体积分数比较来进行判断.(1)实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(3)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
故答案为:在装置A与B之间增加装有碱石灰的U型管;
②CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为:3CuO+2NH3
△
.
3Cu+N2+3H2O;
故答案为:3CuO+2NH3
△
.
3Cu+N2+3H2O;
③Cu20是一种碱性氧化物,在酸性溶液中Cu+
H+
Cu+Cu2+,据此反应设计实验验证是否含有氧化亚铜,步骤为:取少量样品,加入稀硫酸,若溶液出现蓝色,说明含有Cu2O,否则不含有;
故答案为:取少量样品,加入稀硫酸,若溶液出现蓝色,说明含有Cu2O,否则不含有;
2Cu(NO3)2
△
.
2CuO+4NO2↑+O2↑,该反应中氧气占总气体体积的 四分之一.与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃,根据实验现象知,二氧化氮支持燃烧,故正确.
故答案为:正确,理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃.点评:
本题考点: 氨的制取和性质;性质实验方案的设计.
考点点评: 本题考查了氨气实验室制备方法,氨气的性质验证实验设计用于分析判断,化学方程式的书写即实验方案的设计,难度较大,注意根据实验目的设计实验方案,掌握基础是关键.1年前查看全部
- 氮族元素与同周期的碳族,氧族元素相比较,下列变化规律正确的是( ) A.原子半径:e<N<OB. B.非金属性si<P
氮族元素与同周期的碳族,氧族元素相比较,下列变化规律正确的是( ) A.原子半径:e<N<OB. B.非金属性si<P<S C.还原性:SiH 4 <PH 3 <HClD. D.酸性:H 4 SiO 4 <H 3 PO 4 <H 2 SO 4 .  弱智看ww1年前1
弱智看ww1年前1 -
 fcgal 共回答了12个问题
fcgal 共回答了12个问题 |采纳率83.3%A.同周期元素从左到右,原子半径逐渐减小,应为C>N>O,故A错误;
B.同周期元素从左到右,非金属性逐渐增强,则非金属性:Si<P<S,故B正确;
C.非金属性:Si<P<Cl,元素的非金属性越强,单质的氧化性越强,则对应的氢化物的还原性越弱,所以SiH 4 >PH 3 >HCl,故C错误;
D.非金属性:Si<P<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H 4 SiO 4 <H 3 PO 4 <H 2 SO 4 ,故D正确;
故选BD.1年前查看全部
- 高二化学题(氮族元素)0.03mol铜完全溶于稀硝酸,产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol.
高二化学题(氮族元素)
0.03mol铜完全溶于稀硝酸,产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol.该气体的平均分子质量可能是
A.30 B.46 C.50 D.66
上面应该是“硝酸”不是“稀硝酸” 喜欢发言1年前2
喜欢发言1年前2 -
 PUCCA123 共回答了17个问题
PUCCA123 共回答了17个问题 |采纳率94.1%0.03mol铜可以提供0.06mol电子.
生成1molNO得到3mol电子.
生成1molNO2得到1mol电子.
生成1molN2O4得到2mol电子.
混合气体共0.05mol,设NO的物质的量为x,NO2的为y,N2O4的为z.则可得不定方程组:3x+y+2z=0.06 x+y+z=0.05.
(1)设混合气体中没有NO,解得y=0.04 z=0.01
(2)设混合气体中没有NO2,此时方程无两个正数解.
(3)设混合气体中没有N2O4,解得x=0.005 y=0.045
(1)情况的平均相对分子质量为55.2
(3)情况的平均相对分子质量为44.4
所以44.4<M<55.2
所以选 BC1年前查看全部
- 高二化学,氮族元素?在一支容积为30ml的试管内充满二氧化氮和氧气的混合气体,把试管倒置于水中,充分反应后剩余5ml气体
高二化学,氮族元素?
在一支容积为30ml的试管内充满二氧化氮和氧气的混合气体,把试管倒置于水中,充分反应后剩余5ml气体,则原混合气体中二氧化氮和氧气的体积各是多少?(气体体积在相同条件下测定). chenke6681年前4
chenke6681年前4 -
 付出与收获1 共回答了18个问题
付出与收获1 共回答了18个问题 |采纳率94.4%若剩余的是5毫升氧气,则有25毫升的二氧化氮和氧气的混合气体充分反应,依据方程式4NO2+O2+2H2O==4HNO3可知道,二氧化氮和氧气按4:1的比例反应,故混合气体中二氧化氮的体积为V(二氧化氮)=(4/5)×25=20ml ,V(氧气)=(1/5)×25=5ml,故原混合气体中二氧化氮有20ml,氧气有5ml+5ml=10ml
若剩余的是5毫升一氧化氮,依据方程式3NO2 + H2O = NO +2HNO3,生成5毫升一氧化氮则需要15mlNO2,那么则有30ml - 15ml=15ml的二氧化氮和氧气的混合气体充分反应,由4NO2+O2+2H2O==4HNO3同理可得NO2有12ml,O2有3ml,故原混合气体中二氧化氮有12ml + 15ml=27ml,氧气有3ml1年前查看全部
- 氮族元素实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为NaNO2+NH4Cl=NaCl+N2↑+2H
氮族元素
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为
NaNO2+NH4Cl=NaCl+N2↑+2H2O↑+Q
实验装置如图(自己画的,可能不清楚),回答:
(1)装置中A部分分液漏斗与蒸馏瓶之间连接的导管所起的作用是
( )
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
C.使饱和NaNO2溶液容易滴下
(2)B部分的作用是( )
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行的一个步骤是( )加热片刻后,即应移去酒精灯以防止反应物冲出,其原因是( )
(4)收集氮气前,必须进行的步骤是( )
尤其是第一问,谢谢
还有最后一问,
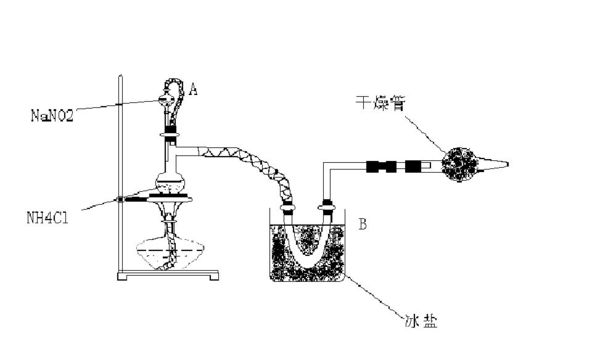
 alicejy1年前2
alicejy1年前2 -
 了了477 共回答了16个问题
了了477 共回答了16个问题 |采纳率93.8%有导管连接过后,分液漏洞中压强就恒定了,所以液体能顺利滴下.1年前查看全部
- 将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
不用太仔细 hy8381年前1
hy8381年前1 -
 漂泊咴念 共回答了21个问题
漂泊咴念 共回答了21个问题 |采纳率85.7%这四族的性质是相似的,以O族为例:
1.非金属性:从上到下,非金属性越来越弱,
2.金属性:越来越强.
3.原子半径:由于电子层不同,所以电子层多的原子半径越大.即从上到下依次半径增大.
反正根据元素周期律来归纳了,建议先精通元素周期律.1年前查看全部
- 关于化学中氮族元素的问题NO,NO2均可与NH3反应转化为无害的N2和H2O,现有3.0L NO和NO2的混合气体,当耗
关于化学中氮族元素的问题
NO,NO2均可与NH3反应转化为无害的N2和H2O,现有3.0L NO和NO2的混合气体,当耗用3.0L NH3时,可全部转化为N2和H2O,则NO和NO2的体积之比为?(体积均为同温同压下测定) ftaps1年前1
ftaps1年前1 -
 你好吗98312 共回答了19个问题
你好吗98312 共回答了19个问题 |采纳率84.2%NO和NO2的混合气体体积:NH3的体积=1:1
NH3到氮气将3价
NO,NO2的化合价为+2和+4,
所以平均化合价为+3
所以为1:1,
若不是1:1则 NH3的体积就不是3L了
NO+NO2+2NH3=2N2+3H2O1年前查看全部
- 求高二化学氮族元素【典型例题】!谢谢!
 奶茶慕斯K1年前1
奶茶慕斯K1年前1 -
 vkaa23097 共回答了21个问题
vkaa23097 共回答了21个问题 |采纳率95.2%NO2、NO、O2混合气体溶于水的有关计算.
(1) NO和NO2混合气体溶于水,NO不溶于水,所以用于计算的化学式为:3NO2+H2O=2HNO3+NO
(2) NO和O2混合溶于水,反应分两步:
2NO+O2=2NO2;
3NO2+H2O+2HNO3+NO
总反应试为:4NO+3O2+2H2O==4HNO3,该反应有以下三种情况:
1)NO和O2的体积比为4:3时完全反应,没有气体剩下.
2)NO和O2的体积比小于4:3时,O2过量,剩下的气体是O2.
3) NO和O2的体积比大于4:3时,NO过量,剩下的气体是NO
(3)NO2和O2混合气体溶于水.有关反应为:
3NO2+H20=2HNO3+NO
2NO+O2=2NO2
总反应式为:4NO+O2+2H2O=4HNO3.该反应也有三种可能
1) NO2和O2的体积比为4:1时完全反应,无剩余气体.
2) NO2和O2的体积比小于4:1时,O2过量,剩下的气体是O2
3) NO2和O2的体积比大于4:1时,NO2过量,剩下的气体是NO,NO的体积=1/3【NO2的体积—4(O2的体积)】
(4)NO2、NO、O2混合气体溶于水.
2NO+O2=2NO2 ①
3NO2+H2O=2HNO3+NO ②
①+②*2,消去NO:4NO2+O2+H2O==4HNO3 ③
①*3+②*2,消去NO2得:4NO+3O2+2H2O==4HNO3 ④1年前查看全部
- 氮族元素气态氢化物的化学式氮族元素(N,P,As,Sb,Bi)气态氢化物的化学式
 燕飞雪1年前1
燕飞雪1年前1 -
 wilhelmvv 共回答了20个问题
wilhelmvv 共回答了20个问题 |采纳率90%氨:NH3
瞵:PH3
胂:AsH3
SbH3
BiH31年前查看全部
- 氮族元素习题在一定条件下,某元素氢化物X可完全分解为两种单质Y与Z,若反应前的X与反应后生成的Z的物质的量之比为2比3,
氮族元素习题
在一定条件下,某元素氢化物X可完全分解为两种单质Y与Z,若反应前的X与反应后生成的Z的物质的量之比为2比3,且Y为正四面体构型,则单质Y和Z是什么~Y单质中含几个共价键 kaerping1年前1
kaerping1年前1 -
 丁丁99999 共回答了23个问题
丁丁99999 共回答了23个问题 |采纳率100%氢化物X可完全分解为两种单质:Y和Z( 其中一个一定是氢气)
单质Y的分子为正四面体构型.(单质分子是正四面体型的只有白磷P4)
反应前的X与反应后生成的Z的物质的量之比n(X):n(Z)=2:3
所以方程式
4PH3=加热=P4+6H2
Y白磷P4(4个原子6个棱)1年前查看全部
- 关于氮族元素的一道化学选择题,请好心人帮忙!
关于氮族元素的一道化学选择题,请好心人帮忙!
0.03摩尔的铜完全溶于硝酸,产生氮的氧化物NO,NO2,N2O4共0.05摩尔,该混合气体的平均相对分子质量是( )
A.30 B.46 C.50 D.66
是一道多选题,参考书上有解答,但不太懂,望详细解答! keaen1年前3
keaen1年前3 -
 shihao85646973 共回答了11个问题
shihao85646973 共回答了11个问题 |采纳率90.9%0.03摩尔的铜参于反应失去0.06摩尔电子,全生成NO为0.02摩尔、全为NO2为0.06摩尔、全为N2O4为0.03摩尔,根据氮的氧化物NO,NO2,N2O4共0.05摩尔可知若只有两种氧化物混合则一定有NO2,用极值法,假设0.05物质为NO与NO2可求出一个平均分子量,0.05物质为N2O4与NO2又可求出一个平均分子量,而实际三种物质都有,所以平均分子量介于这两个数值之间,答案为BC1年前查看全部
- 氮族元素氢化物溶沸点高低?还有哪些分子间有氢键
 小莽夫1年前2
小莽夫1年前2 -
 郭秀峰 共回答了14个问题
郭秀峰 共回答了14个问题 |采纳率85.7%沸点 SbH3 > NH3 > AsH3 > PH3.BiH3极不稳定不列入.
正常分子间作用力规则按照 N → Sb 沸点依次升高.但 NH3 分子中存在氢键,沸点大大提高发生反常.
除 NH3 外,常见有氢键的物质包括 H2O、HF、H2SO4等含氧酸.1年前查看全部
- 氮族元素:随着核电菏数的递增,其最高价氧化物的水化物的酸性逐渐( ).
氮族元素:随着核电菏数的递增,其最高价氧化物的水化物的酸性逐渐( ).
请说明原因 ppp000ppp00099991年前3
ppp000ppp00099991年前3 -
 米米妞 共回答了19个问题
米米妞 共回答了19个问题 |采纳率89.5%降低,因为他们的非金属性逐渐减弱,金属性逐渐增强,铅不是变成金属了么?非金属的最高价氧化物对应的水化物是酸,金属对应的是碱1年前查看全部
- 关于氮族元素Sb,Bi 是金属,它们也对应有气态氢化物和H3XPO4或HPO3的酸麽?为什麽?请详细说明,
 那楼1年前2
那楼1年前2 -
 fengyun梓轩 共回答了14个问题
fengyun梓轩 共回答了14个问题 |采纳率100%金属没有酸,也没有气态氢化物,只有一个特列:偏铝酸.1年前查看全部
- 【化学】同为氮族元素为什么硝酸是HNO3而磷酸是H3PO4
【化学】同为氮族元素为什么硝酸是HNO3而磷酸是H3PO4
N和P都是+5价,为什么HNO3与H3PO4一个是一元酸,一个是三元酸呢? zhouwl20011年前2
zhouwl20011年前2 -
 zhang_jing_20 共回答了23个问题
zhang_jing_20 共回答了23个问题 |采纳率91.3%这个涉及到原子的结构了
两个虽然都是5价,那是单指他们最外层电子数为5,但是要考虑到他们的电子层数不一样,层数多的对外层电子的吸引能力就有所下降了1年前查看全部
- 关于氮族元素化学反应方程式的配平
关于氮族元素化学反应方程式的配平
__CuS+__HNO3=__Cu(SO3)2+__H2SO4+__H2O mideaKT1年前1
mideaKT1年前1 -
 chrislee_dragon 共回答了23个问题
chrislee_dragon 共回答了23个问题 |采纳率87%3CUS+14HNO3=3CU(NO3)2+3H2SO4+8NO+4H20
S开始显-2价,后来显+6价,上升8价
N开始+5价,后来NO中的N为+2价,下降3价,
所以CUS和NO前面的系数肯定是3:8的关系,得出CUS,NO,H2SO4前面的系数后,其他的就好配了.1年前查看全部
- 化学,氮族元素题工业上制备HNO3的尾气中,尚含有少量未被吸收的NO、NO2,如果不加处理就排放到空气中,会造成污染.为
化学,氮族元素题
工业上制备HNO3的尾气中,尚含有少量未被吸收的NO、NO2,如果不加处理就排放到空气中,会造成污染.为消除氮的氧化物对大气的污染,变废为宝,常用碱液吸收尾气中氮的氧化物,使之转化为相应的硝酸盐、亚硝酸盐和水.依据上述原理,判断下列混合气体不可能被NaOH溶液完全吸收的是
A 1MOL的O2 和4MOL的NO2
B 1MOL的O2和4MOL的NO2
C 1MOL的NO和4MOL的NO2
D 4MOL的NO和1MOL的NO2
单选,我选了B,就我学过的来说B的氧气不足.但如果CD两项也真的可吸收,他的原理是什么呢?不太了解亚硝酸.
打错了B是1MOL的O2和4MOL的NO C燕子Y1年前1
C燕子Y1年前1 -
 盱眙饭桶 共回答了19个问题
盱眙饭桶 共回答了19个问题 |采纳率100%选D.
AB相同: 4NO2+O2+2H2O==4HNO3 所以能够完全被碱液吸收.
C D: NO+NO2+2NaOH==2NaNO2 2NO2+2NaOH==NaNO3+NaNO2+H2O
所以只要满足n(NO2):n(NO)大于或等于1:1 ,就可完全被碱液吸收.1年前查看全部
- 关于氮族元素的化学题将盛有25mlNO.NO2混合气体倒立于水槽中,反应后气体体积缩小为15ml,则原混合气体中NO,N
关于氮族元素的化学题
将盛有25mlNO.NO2混合气体倒立于水槽中,反应后气体体积缩小为15ml,则原混合气体中NO,NO2的体积比是多少? aiilion1年前4
aiilion1年前4 -
 肯认同 共回答了17个问题
肯认同 共回答了17个问题 |采纳率82.4%3NO2+H2O=2HNO3+NO
3毫升 1毫升 体积减少2毫升
x毫升 体积减少:25-15=10毫升
x毫升=10*3/2=15(毫升)
原混合气体中NO,NO2的体积比是15:10=3:21年前查看全部
- 氮族元素问题铋是氮族元素中原子序数最大的元素,推测铋单质或其化合物最有可能的性质是铋的两种常见的氧化物Bi2O3和Bi2
氮族元素问题
铋是氮族元素中原子序数最大的元素,推测铋单质或其化合物最有可能的性质是
铋的两种常见的氧化物Bi2O3和Bi2O5是碱性氧化物.为什么不对啊 hshbte1年前1
hshbte1年前1 -
 xianyuzc 共回答了18个问题
xianyuzc 共回答了18个问题 |采纳率94.4%铋单质具有金属性,在化合物中化合价为+3,+5
Bi2O3是碱性氧化物,Bi2O5是酸性氧化物
NaBiO3,铋酸钠是著名的氧化剂,氧化性比高锰酸钾还强.1年前查看全部
- 氮族元素1、3L NO2气体依次通过下列三个分别装有足量的①NaHCO3饱和溶液②浓H2SO4③Na2O2,然后用排水法
氮族元素
1、3L NO2气体依次通过下列三个分别装有足量的①NaHCO3饱和溶液②浓H2SO4
③Na2O2,然后用排水法收集残留气体是(同温同压) ( )
A 、1L NO B、1L NO2和0.05L O2 C、2L O2 D、0.25L O2
2、NH3、N2、H2O之间有哪些反应? 4680958011年前1
4680958011年前1 -
 fjlin0594 共回答了12个问题
fjlin0594 共回答了12个问题 |采纳率83.3%1:NO2通过饱和碳酸氢钠溶液 3NO2+H2O=2HNO3+NO HNO3+NaHCO3=NaNO3+CO2+H2O 气体成分为:1LNO,2LCO2,少量水蒸气
气体通过浓硫酸 浓硫酸具有强烈的吸水性,少量水蒸气被除去,此时气体成分为:1LNO,2LCO2
通过过氧化钠 2CO2+2Na2O2=2Na2CO3+O2 2NO+O2=2NO2 气体成分为:1LNO2,0.5LO2
排水法收集:4NO2+2H2O+O2=4HNO3 最后气体成为是:0.25LO2.所以选D
2:NH3+H2O=NH3.H2O1年前查看全部
- 优化设计的,氮族元素,桂壮红皮书系列化学 13氨\磷及其化合物14硝酸16 影响化学平衡的条件\合成氨
 chenjw1011年前4
chenjw1011年前4 -
 wanghaobay 共回答了14个问题
wanghaobay 共回答了14个问题 |采纳率85.7%16 影响化学平衡的条件合成氨
温度,压强,接触面.1年前查看全部
- 氮族元素测试题1常温下放置久的浓硝酸往往显黄色,这是因为什么(用化学方程式回答)?
 说灌就灌1年前3
说灌就灌1年前3 -
 婉玉 共回答了16个问题
婉玉 共回答了16个问题 |采纳率87.5%无色的浓硝酸久置变黄——部分硝酸见光分4HNO3=(光)2H2O+4NO2↑+O2↑,NO2溶解在溶液中呈黄色.1年前查看全部
- 原子结构与元素周期例如:氮族元素中依N P As Sb Bi的顺序原子半径依次为75 110 112 143 152(p
原子结构与元素周期
例如:氮族元素中依N P As Sb Bi的顺序原子半径依次为75 110 112 143 152(pm)这其中氮与磷之差为35 以后相邻两元素间原子半径之差依次为12 21和9.这是为什么呢?请从原子结构方面解释. sunkiss_8312031年前1
sunkiss_8312031年前1 -
 浅笑为你 共回答了15个问题
浅笑为你 共回答了15个问题 |采纳率80%在大学化学中有解释,有钻穿效应.1年前查看全部
- 还是氮族元素的一道题当向试管内通入21毫升氧气时,最后试管中的液面仍在原来的位置,则原试管中NO为多少毫升?
 112736121年前1
112736121年前1 -
 cecilia72 共回答了13个问题
cecilia72 共回答了13个问题 |采纳率100%2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
将两式子合并是:4NO2+3O2+2H2O=4HNO3
要最后的液面不变,即最后肯定是剩下O2,且剩下O2的体积等于原来NO的体积.因此通过最后一条合并方程式NO与O2的物质的量的比4:3,可以列出式子n(NO)【必须剩下的O2】+3/4n(NO)【消耗了的】=21,求得NO是12ML.1年前查看全部
- 制取氨气为什么能不用碳酸氢铵氮族元素
 深水微谰1年前1
深水微谰1年前1 -
 依缘 共回答了26个问题
依缘 共回答了26个问题 |采纳率96.2%NH4HCO3=加热=NH3气标+CO2气标+H2O
制出的NH3中含有CO21年前查看全部
- 某瓶中的混合气体呈红棕色(化学氮族元素)
某瓶中的混合气体呈红棕色(化学氮族元素)
集气瓶内装的混气体呈红棕色,加入足量水,盖上玻璃片振荡,溶液为橙色,再打开玻璃片后,瓶中气体又变为红棕色.(答案说气体不可能是NO2,NO,N2)为什么不可能呢? zq14661年前1
zq14661年前1 -
 xianehehe_003 共回答了18个问题
xianehehe_003 共回答了18个问题 |采纳率88.9%肯能是溴蒸气和NO得混合气体吧,因为加水后,溶液有溴水,呈橙色,因为有NO所以打开玻璃片后,瓶中气体又变为红棕色.1年前查看全部
- 卤族元素和氮族元素气态氢化物的稳定性
 别了我曾经疯子1年前3
别了我曾经疯子1年前3 -
 希望天天开心 共回答了24个问题
希望天天开心 共回答了24个问题 |采纳率87.5%也就是非金属性
所以可通过元素周期律来判断
总体来说
从上到下氢化物的稳定性减弱
同一周期从左到右氢化物的稳定性增强1年前查看全部
- 氮族元素中,气态氢化物的稳定性从上到下逐渐____.
 fsi1726781年前4
fsi1726781年前4 -
 蜀山弯曲之木 共回答了24个问题
蜀山弯曲之木 共回答了24个问题 |采纳率100%氮族元素中,气态氢化物的稳定性从上到下逐渐__减弱__.
(主要原因:非金属强弱变化,越靠右上非金属性越强.1年前查看全部
- 设R为氮族元素可能形成的含氧酸根有RO3负一价、RO2负一价 、RO4负三价 、R2O7负四价,为什么?
 土豆19741年前1
土豆19741年前1 -
 CH-L-M 共回答了24个问题
CH-L-M 共回答了24个问题 |采纳率87.5%除了RO2-中的R是+3价外,其余三个离子中的R都是+5价.举例:
NO3-硝酸根,NO2-亚硝酸根,PO43-磷酸根,P2O74-焦磷酸根1年前查看全部
- 氮族元素最高价氧化物水化物化学式
氮族元素最高价氧化物水化物化学式
求助:氮族元素(N,P,As,Sb,Bi)最高价氧化物水化物的化学式
谢谢,可为什么金属对应的不是碱 0v8a1年前2
0v8a1年前2 -
 听雨寻星 共回答了16个问题
听雨寻星 共回答了16个问题 |采纳率68.8%HXO3 (X:N ,P AS Sb Bi )1年前查看全部
- 关于氮族元素的几道化学题1.下列各组离子在水溶液中可以大量共存的是A.H+,K+,Fe2+,NO3-B.OH-,Na+,
关于氮族元素的几道化学题
1.下列各组离子在水溶液中可以大量共存的是
A.H+,K+,Fe2+,NO3-
B.OH-,Na+,NH4+,Cl-
C.NO3-,OH-,H2PO4-,K+
D.Mg2+,NO3-,H+,Al3+
2.一定条件下,将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中(水槽中有足量水),充分反应后剩余气体的体积约为原混合气体总体积的
A.1/4 B.3/4 C.1/8 D.3/8
3.什么气体和澄清石灰水反应会产生白色沉淀和NO?
请说明原因, 人何必认真1年前3
人何必认真1年前3 -
 游子杉 共回答了20个问题
游子杉 共回答了20个问题 |采纳率95%1.D A是硝酸根和氢离子组成硝酸有强氧化性氧化二价铁离子到三价 B是氨根和氢氧根生成一水合铵 C好像氢氧根和H2PO4-能反应
2.C 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO 找最小公倍数加一块得4NO+3O2+2H2O=4HNO3 NO和O2是四比三的关系 题中是等体积的剩了八分之一的氧气
三题我不会1年前查看全部
大家在问
- 1丢沙包 作文
- 2某气体可能由O2、CO2、CO中的两种或三种气体组成.经测定该组气体中含碳、氧元素质量比为3:8.该气体可能是...
- 3a^2+b^2+4a-2b+5=0,求(a^2+b^2)/2-ab.
- 4Where's the hospital?It's_____ _____the bank.
- 5我家的小院 作文
- 6一瓶矿泉水瓶上标有净含量400ml字样,这瓶水中水的质量是___kg,如果用它来装密度为0.9×10³kg/m
- 7小明和小彬在解方程组时,小明和小彬在解方程组ax+5y=15.和4x-by=-2.时,由于小明看错了方程ax+5y=15
- 8气焊作业时应注意的主要安全事项是什么?
- 9英语翻译好长时间不见了,我好想你啊!你现在生活好吗?有没有发生一些好玩的事啊?我们就要期末考了,马上可以放假了,好开心哦
- 10一件小事给我的启示 作文
- 11_________ for a quick decision,the chairman called for a vot
- 12左右结构含木的字
- 13全能运动员,在跳远和标枪比赛中,每人有几次试跳机会?
- 144道物理题,关于小孔成像的1.像的大小是否可以变化,如有变化是如何变化的 2.像的大小取决与什么 3.孔的多少是否影响像
- 15I feel like a duck 中duck是贬义词还是褒义词
