把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用b mol烧碱刚好把NH3全部赶
 南山雨农2022-10-04 11:39:541条回答
南山雨农2022-10-04 11:39:541条回答A. [b−2c/a]mol•L-1
B. [2b−4c/a]mol•L-1
C. [2b−c/a]mol•L-1
D. [b−2c/2a]mol•L-1

已提交,审核后显示!提交回复
共1条回复
 yunfei119 共回答了10个问题
yunfei119 共回答了10个问题 |采纳率90%- 解题思路:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=[n/V]计算.
mol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.
令每份中NO3-的物质的量为n,根据溶液不显电性,则:
bmol×1=cmol×2+n×1
解得n=(b-2c)mol
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=
(b−2c)mol
0.5aL=[2b−4c/a]mol/L.
即原溶液中硝酸根的浓度为[2b−4c/a]mol/L.
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查学生利用离子方程式的简单计算,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒. - 1年前
相关推荐
- 现有一固体混合物A的成分,已知其中可能含有NH4Cl、Na2CO3、(NH4)2SO4、KNO3、Fe2O3五种物质中的
现有一固体混合物A的成分,已知其中可能含有NH4Cl、Na2CO3、(NH4)2SO4、KNO3、Fe2O3五种物质中的两种或多种,按下图所示进行实验,出现的现象如下图中所述(设过程中所有可能发生的反应均恰好完全反应).

试根据实验过程和发生的现象填写以下空白:(请用化学用语答题)
(1)产生的气体B是(写化学式,下同)______; 混合物A中,肯定存在的物质是(写化学式)______; 溶液E中,一定存在的溶质是(写化学式)______.
(2)写出实验过程④中发生的化学反应的化学方程式:______. 一颗郁闷之心1年前1
一颗郁闷之心1年前1 -
 CASLee 共回答了17个问题
CASLee 共回答了17个问题 |采纳率100%解题思路:根据铵态氮肥和碱混合会生成氨气,氨气能使紫色石蕊试液变蓝,钡离子和硫酸根离子、碳酸根离子会生成白色的硫酸钡沉淀、碳酸钡沉淀,铁离子在溶液中显黄色等知识进行分析.(1)固体混合物A加入氢氧化钠溶液加热后过滤,生成的气体B通入紫色石蕊试液中,溶液变蓝色,说明该气体是碱性气体,铵态氮肥中加碱会生成氨气,氨气溶于水显碱性,会使紫色的石蕊变蓝色,所以气体B是:NH3,滤液C中加氯化钡没有明显的现象,所以原混合物中不含碳酸根离子和硫酸根离子,但是也要生成氨气,所以固体中一定有氯化铵,溶液F显黄色,一定存在铁离子,所以沉淀D就是氧化铁,所以肯定含有的物质是:NH4Cl,Fe2O3,氢氧化钠和氯化铵反应生成氯化钠、氨气和水,然后又加入了氯化钡,所以E中的溶质为:NaCl、BaCl2;
(2)氧化铁和盐酸反应生成氯化铁和水,化学方程式为:6HCl+Fe2O3=2FeCl3+3H2O.
故答案为:(1)NH3,NH4Cl,Fe2O3,NaCl、BaCl2;
(2)6HCl+Fe2O3=2FeCl3+3H2O.点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.1年前查看全部
- 小明家的农田出现土壤酸化板结现象,经调查,该农田长期施用化肥(NH4)2SO4,下列推测中错误的是( )
小明家的农田出现土壤酸化板结现象,经调查,该农田长期施用化肥(NH4)2SO4,下列推测中错误的是( )
A. (NH4)2SO4属于铵态氮肥,能促进植物生长茂盛,叶色浓绿
B. 长期施用(NH4)2SO4会导致土壤酸化板结
C. 草木灰(主要含K2CO3)可改良酸性土壤,说明K2CO3的溶液呈碱性
D. 为了防止土壤酸化,施用(NH4)2SO4的同时应加入Ca(OH)2 幻影在线1年前4
幻影在线1年前4 -
 哭了的天 共回答了20个问题
哭了的天 共回答了20个问题 |采纳率90%解题思路:氮肥能促进植物生长茂盛,叶色浓绿;长期施用(NH4)2SO4会导致土壤酸化板结;碳酸钾的水溶液显碱性;铵态氮肥不能和显碱性的物质混合使用,因为这样能够降低肥效.A、(NH4)2SO4是含有氮元素的化肥,属于铵态氮肥,能促进植物生长茂盛,叶色浓绿.正确;
B、长期施用(NH4)2SO4会导致土壤酸化板结.正确;
C、草木灰可改良酸性土壤,说明K2CO3的溶液呈碱性.正确;
D、硫酸铵和氢氧化钙混合时能反应生成氨气,从而降低肥效.错误.
故选D.点评:
本题考点: 常见化肥的种类和作用.
考点点评: 解答本题要充分理解各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 1、用饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液吗 为什么
1、用饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液吗 为什么
2、不溶于水是物理性质吗 为什么
3、干燥的PH试纸能测定浓硫酸的PH吗?为什么?
4、一氧化碳与氧气反应吗 生成二氧化碳吗?
以上问题请认真回答,说明理由, 心水的爱1年前4
心水的爱1年前4 -
 香巴佬 共回答了18个问题
香巴佬 共回答了18个问题 |采纳率94.4%1蛋白质溶液中加入(NH4)2SO4溶液,蛋白质沉淀 这是盐析 和食盐水没反应
2溶于水既可能是物理性质 例如 co2溶于水是它的物理性质,CO2溶解的这一变化为物理变化
至于溶解时少部分的CO2与水反应生成碳酸,则是另外一个现象与性质了,不能混为一谈
所以只能这样说,CO2溶解过程既有化学变化,又有物理变化
3不能 因为浓硫酸腐蚀性大,滴上之后使试纸变黑 无法测试
4一氧化碳和氧气反应生成二氧化碳必须要点燃.
方程式:2CO + O2 ==点燃== 2CO2
不点燃的话,常温下是不会反应的.1年前查看全部
- (2009•潍坊一模)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4&
(2009•潍坊一模)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程

请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4.
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是BCDBCD(填写序号)
A.加热蒸干 B.蒸发浓缩C.冷却结晶 D.过滤 E.萃取F分液
(3)该生产过程中可以循环使用的X是CO2CO2.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用AEAE(填写序号)
A.浓盐酸B.湿润的蓝色石蕊试纸C.湿润的淀粉碘化钾试纸D.稀硫酸E.湿润的红色石蕊试纸. indiasinoaa1年前1
indiasinoaa1年前1 -
 飞跃的轩辕 共回答了16个问题
飞跃的轩辕 共回答了16个问题 |采纳率93.8%(1)将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4.
(2)从溶液中获取晶体应采取蒸发浓缩、冷却结晶、过滤等操作,所以必须操作步骤是BCD.
故答案为:BCD.
(3)由工艺流程可知,CaCO3在煅烧炉中分解生成CO2和CaO,CO2循环使用.
故答案为:CO2.
(4)A、浓盐酸挥发出的氯化氢与氨气生成氯化铵,有白烟产生,可以检验氨气,故A正确;
B、氨气遇湿润的蓝色石蕊试纸,无明显现象,不能检验氨气,故B错误;
C、氨气遇湿润的淀粉碘化钾试纸,无明显现象,不能检验氨气,故C错误;
D、氨气遇稀硫酸,无明显现象,不能检验氨气,故D错误;
E、氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,可以检验氨气,故E正确.
故选:AE.1年前查看全部
- 现有NaCl、K2SO4、NH4NO3、(NH4)2SO44种无色溶液,如只用一种试剂经一步实验就能将它们加以鉴别,则该
现有NaCl、K2SO4、NH4NO3、(NH4)2SO44种无色溶液,如只用一种试剂经一步实验就能将它们加以鉴别,则该试剂可用( )
A. AgNO3溶液
B. BaCl2溶液
C. NaOH溶液
D. Ba(OH)2溶液 天汉云柏1年前1
天汉云柏1年前1 -
 孤独飞鸿 共回答了16个问题
孤独飞鸿 共回答了16个问题 |采纳率75%解题思路:所选物质与四种物质反应,发生的现象应各有不同.根据选项中的四种物质与所给的四种物质反应的现象逐一分析,即可正确选择.A、AgNO3溶液与这些物质反应可生成两种白色沉淀,即氯化银和硫酸银,故A不适合;
B、BaCl2溶液与K2SO4和(NH4)2SO4反应都生成硫酸钡沉淀.故B不适合;
C、NaOH溶液与NH4NO3和(NH4)2SO4反应都有气体生成,故C不适合;
D、Ba(OH)2溶液与NaCl反应没有明显现象;Ba(OH)2溶液与K2SO4反应生成BaSO4沉淀;Ba(OH)2溶液与NH4NO3反应有气体生成;Ba(OH)2溶液与(NH4)2SO4反应有气体和沉淀生成.故D适合.
故选D.点评:
本题考点: 物质的鉴别、推断.
考点点评: 此题主要是考查同学们的综合分析能力,不但要求同学们具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.1年前查看全部
- 区别Na2SO4、NH4NO3、KCl、(NH4)2SO4 四瓶无色溶液,应该加什么试剂?必要时可以加热
区别Na2SO4、NH4NO3、KCl、(NH4)2SO4 四瓶无色溶液,应该加什么试剂?必要时可以加热
说明原因 别拿版猪不当干粮1年前2
别拿版猪不当干粮1年前2 -
 宝宝LQ 共回答了17个问题
宝宝LQ 共回答了17个问题 |采纳率94.1%只能加一种吗?Ba(OH)2
加入Ba(OH)2之后出现白色沉淀的是Na2SO4和(NH4)2SO4,然后再加热这两个溶液,瓶口有刺激性气味的是 (NH4)2SO4
加入Ba(OH)2之后无现象的是NH4NO3、KCl,也是加热,瓶口有刺激性气味的是NH4NO31年前查看全部
- 已知硫酸铵的化学式为(NH4)2SO4计算(要求列式并计算)
已知硫酸铵的化学式为(NH4)2SO4计算(要求列式并计算)
(1)(NH4)2SO4中各元素的原子个数比
(2)(NH4)2SO4中的各元素质量比
(3)(NH4)2SO4中氮元素的质量分数
(4)132克硫酸铵中氮元素的质量与多少克尿素的氮元素质量相等?尿素化学式为NO(CH2)2. az7321年前0
az7321年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有三种化肥:①硝酸铵NH4NO3,②氯化铵NH4Cl,③硫酸铵(NH4)2SO4中,按含氮的质量分数从大到小顺序排列正确
有三种化肥:①硝酸铵NH4NO3,②氯化铵NH4Cl,③硫酸铵(NH4)2SO4中,按含氮的质量分数从大到小顺序排列正确的是( )
A.①>②>③
B.②>③>①
C.③>①>②
D.②>①>③ xingqitia1年前1
xingqitia1年前1 -
 xyz0098 共回答了18个问题
xyz0098 共回答了18个问题 |采纳率83.3%解题思路:分别根据元素质量分数的计算方法求出这三种物质中含碳元素的质量分数,比较大小即可.(注:也可以在分子相同的情况下比较分母的大小得到质量分数的大小关系)①硝酸铵NH4NO3的相对分子质量是14+4+14+48=80,
②氯化铵NH4Cl的相对分子质量是14+4+35.5=53.5,
③硫酸铵(NH4)2SO4的相对分子质量是(14+4)×2+32+64=132
含氮的质量分数分别是
①[28/80]×100%=35%,
②[14/53.5]×100%≈26.2%,
③[28/132]×100%≈21.2%,
(或[28/80],[14/53.5]=[28/107],[28/132]三者直接比较大小为[28/80]>[28/107]>[28/132])
所以按含氮的质量分数从大到小顺序排列为①>②>③.
故选A.点评:
本题考点: 元素的质量分数计算.
考点点评: 主要考查了相对分子质量,元素质量分数的计算.
某元素的质量分数=[该元素分子的相对原子质量×原子个数/相对分子质量]×100%.
化学式中各原子的相对原子质量的总和,就是相对分子质量.1年前查看全部
- (2012•广州二模)对于0.1mol•L-1 (NH4)2SO4溶液,下列说法正确的( )
(2012•广州二模)对于0.1mol•L-1 (NH4)2SO4溶液,下列说法正确的( )
A.溶液中存在电离平銜:(NH4)2SO4⇌NH4++SO42-
B.向溶液中滴加少量浓硫酸,c(NH4+ )、c( SO42-)均增大
C.加水稀释,溶液中所有离子的浓度均减小
D.溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) 婷婷的狗狗1年前1
婷婷的狗狗1年前1 -
 xxieyying 共回答了20个问题
xxieyying 共回答了20个问题 |采纳率80%解题思路:A、强电解质能完全电离,用等号连接;
B、根据水解平衡移动知识来回答判断;
C、加水稀释对水解平衡起到促进作用,但是稀释过程会导致溶液体积增大;
D、根据溶液中的物料守恒知识来回答.A、硫酸铵是强电解质能完全电离,用等号连接,即(NH4)2SO4═NH4++SO42-,故A错误;
B、向溶液中滴加少量浓硫酸,电离出氢离子和硫酸根离子,其中氢离子对铵根离子的水解平衡NH4++H2O⇌NH3•H2O+H+产生抑制作用,所以c(NH4+)、c(SO42-)均增大,故B正确;
C、加水稀释对水解平衡NH4++H2O⇌NH3•H2O+H+起到促进作用,但是稀释过程会导致溶液体积增大,所以酸性减弱,但是氢氧根离子浓度会增大,故C错误;
D、该溶液中的物料守恒:2c(SO42-)=c(NH4+)+c(NH3•H2O),故D错误.
故选:B.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查学生影响盐的水解平衡移动的因素知识,注意越稀越水解规律的应用,难度不大.1年前查看全部
- 把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用b mol烧碱刚好把NH3全部赶
把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2,则原溶液中c(NO3-)为( )
A. [b−2c/a]mol•L-1
B. [2b−4c/a]mol•L-1
C. [2b−c/a]mol•L-1
D. [b−2c/2a]mol•L-1 bach191年前1
bach191年前1 -
 zhangdp_sh 共回答了14个问题
zhangdp_sh 共回答了14个问题 |采纳率100%解题思路:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=[n/V]计算.mol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.
令每份中NO3-的物质的量为n,根据溶液不显电性,则:
bmol×1=cmol×2+n×1
解得n=(b-2c)mol
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=
(b−2c)mol
0.5aL=[2b−4c/a]mol/L.
即原溶液中硝酸根的浓度为[2b−4c/a]mol/L.
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查学生利用离子方程式的简单计算,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒.1年前查看全部
- 只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2
B.H2SO4
C.NaOH
D.AgNO3 morpheus1001年前1
morpheus1001年前1 -
 aa89528390 共回答了25个问题
aa89528390 共回答了25个问题 |采纳率92%解题思路:五种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色、氢氧化铝的两性等角度判断.A.加入Ba(OH)2,Na2SO4和MgCl2都生成白色沉淀,不能鉴别,故A错误;
B.加入H2SO4,以上五种物质都不反应,不能鉴别,故B错误;
C.加入NaOH,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色,Al2(SO4)3生成白色沉淀,NaOH过量时,沉淀逐渐溶解,
(NH4)2SO4生成刺激性气体,五种物质现象各不相同,可鉴别,故C正确;
D.加入AgNO3,以上物质都生成白色沉淀,不能鉴别,故D错误.
故选C.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别的基本方法,题目难度不大,本题注意把握五种物质的组成上的异同,从反应具有不同现象的角度考虑.1年前查看全部
- (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为( )
A. BaSO4
B. BaSO3
C. BaS
D. BaSO4和BaSO3 羽若即-思翼1年前2
羽若即-思翼1年前2 -
 三十男人未成熟 共回答了18个问题
三十男人未成熟 共回答了18个问题 |采纳率88.9%解题思路:根据反应生成的产物量和性质分析,二氧化硫溶于水和水反应生成亚硫酸,三氧化硫溶于水和水反应生成硫酸,氨气溶于水生成一水合氨,硫酸和氯化钡反应生成硫酸钡沉淀,亚硫酸和氨水反应生成亚硫酸铵,所以通入氯化钡溶液中,关键分解反应生成的气体物质的量进行计算分析判断,生成沉淀有亚硫酸钡和硫酸钡.反应后的混合气体通入到BaCL2溶液中发生的是复分解反应
SO2+H2O+2NH3=(NH4)2SO3
(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl
SO3+H2O+2NH3 =(NH4)2SO4
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
依据反应定量关系,结合分解生成的气体物质的量可知,二氧化硫转化为亚硫酸铵,1mol三氧化硫转化为硫酸铵消耗氨气2mol,则4mol氨水和2mol二氧化硫反应生成亚硫酸铵,所以得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余二氧化硫和亚硫酸钡反应生成亚硫酸氢钡,最后得到沉淀为1mol硫酸钡,1mol亚硫酸钡,因此得到沉淀为BaSO3和BaSO4,
故选D.点评:
本题考点: 含硫物质的性质及综合应用.
考点点评: 本题考查了物质反应的定量计算及物质性质的综合应用,关键是分析反应过程反应判断沉淀生成的实质,题目难度中等.1年前查看全部
- 要使(NH4)2SO4和8Kg NH4NO3所含氮元素的质量相等,需要(NH4)2SO4多少Kg?
要使(NH4)2SO4和8Kg NH4NO3所含氮元素的质量相等,需要(NH4)2SO4多少Kg?
 geniusyao1年前1
geniusyao1年前1 -
 violetx 共回答了20个问题
violetx 共回答了20个问题 |采纳率90%解题思路:利用一定量化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数,由MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,计算出M的值.根据(NH4)2SO4和8kgNH4NO3中所含氮元素相等,
设硫酸铵的质量为x
x×[14×2/132]×100%=8kg×[14×2/80]×100%
x=13.2kg
答:需要(NH4)2SO413.2kg点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 根据化合物的化学式,化合物中某组成元素的质量分数=[该元素的相对原子质量×原子个数/化合物的相对分子质量]×100%.1年前查看全部
- 硫酸铵的化学式为(NH4)2SO4,试计算:
硫酸铵的化学式为(NH4)2SO4,试计算:
(1)硫酸铵的相对分子质量.
(2)硫酸铵中各元素的质量比.
(3)200kg含硫酸铵90%的硫铵化肥中含氮元素多少千克? limururu1年前3
limururu1年前3 -
 风雨飘摇℡ 共回答了17个问题
风雨飘摇℡ 共回答了17个问题 |采纳率76.5%解题思路:(1)根据相对分子质量的计算方法计算即可.
(2)一个硫酸铵(NH4)2SO4分子中含有2个N,8个H,,1个S,4个O,求出相对质量比即为硫酸铵中N、H、S、O元素的质量比.
(3)先求出硫铵化肥中硫酸铵的质量为200×90%,再根据氮元素在硫酸铵中的质量分数计算公式计算即可.即200×90%×氮元素在硫酸铵中的质量分数=氮元素的质量.(1)硫酸铵(NH4)2SO4的相对分子质量为(14+1×4)×2+32+16×4=132;
(2)硫酸铵中各元素的质量比N:H:S:O=28:8:32:64=7:2:8:16;
(3)200kg×90%×[28/132]≈38.2kg
答:200kg含硫酸铵90%的硫铵化肥中含氮元素38.2千克.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 主要考查了相对分子质量的计算方法,元素质量分数的求法以及利用相对质量求物质中所含元素的比值的方法,这些基本计算要求掌握.注意:第(3)问中要先求得纯净硫酸铵的质量再根据氮元素在硫酸铵中的质量分数求氮元素的质量.
化学式中各原子的相对原子质量的总和,就是相对分子质量.
某元素的质量分数=[该元素分子的相对原子质量×原子个数/相对分子质量]×100%.1年前查看全部
- 某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4(NH4)2SO46H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4(NH4)2SO46H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmol FeOFeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为 nxx092 mo1
C.反应中发生转移的电子的物质的量为6nx mol
D.在FeOFeyCrxO3中3x=y ruian20041年前2
ruian20041年前2 -
 悟风 共回答了21个问题
悟风 共回答了21个问题 |采纳率71.4%因为重铬酸根离子具有强氧化性,与硫酸亚铁铵发生反应.
必然会有 正6价的铬离子 氧化亚铁离子 转化为正3价的铬离子和 正三价的铁离子.
但是干燥物中通过结构式可知 亚铁离子仍然存在,这就说明了是亚铁离子过量,从而得出正6价的铬离子全部参与了氧化还原反应转变为了正3价的铬离子.
那么由此 一个亚铁离子四个氧 化合价就是负6价,那么综合三价的铁和铬离子就是 3x+3y+(-6)=0 从而 3x+3y=6
因此D是错误的.
全是手打,避免回答者空手而归.1年前查看全部
- 尿素【co(nh2)2】也是常用的一种氮肥,某市场中硫酸铵【(nh4)2so4】和尿素每千克售价分别为1.3元和1.8元
尿素【co(nh2)2】也是常用的一种氮肥,某市场中硫酸铵【(nh4)2so4】和尿素每千克售价分别为1.3元和1.8元
根据他们含氮的质量分数分析肥效,购买那种化肥更经济?请写出计算过程 yusheng185961年前1
yusheng185961年前1 -
 张道达 共回答了20个问题
张道达 共回答了20个问题 |采纳率95%尿素的含氮量=28/60=46.7%
硫酸铵的含氮量=28/132=21.2%
含有1千克氮的两种化肥需要的钱数分别是:
尿素:1*1.8/46.7%=3.85元
硫酸铵:1*1.3/21.2%=6.13元
尿素更便宜.1年前查看全部
- 硫酸铵的化学式为(NH4)2SO4,计算
硫酸铵的化学式为(NH4)2SO4,计算
(1)氮元素的质量分数
(2)26.4克硫酸铵中所含氮元素的质量
(3)多少克尿素【CO(NH2)2】中所含氮元素质量与上述氮元素的质量相等 幸福流浪1年前1
幸福流浪1年前1 -
 风已吹过 共回答了27个问题
风已吹过 共回答了27个问题 |采纳率81.5%(1) (14*2)/(14*2+4*2+32+64) 自己算吧
(2)26.4乘以上一小问的答案
(3) 第二小题的答案 除以 (28)/(28+4+12+16)这个式子 你自己按计算机吧
速度给分谢谢1年前查看全部
- 某化肥的主要成分是硫酸铵(NH4)2SO4,化肥中含氮20% ,求该化肥中硫酸铵的纯度为
某化肥的主要成分是硫酸铵(NH4)2SO4,化肥中含氮20% ,求该化肥中硫酸铵的纯度为
尽量是 wjz9611年前3
wjz9611年前3 -
 koutaku1023 共回答了14个问题
koutaku1023 共回答了14个问题 |采纳率100%纯硫酸铵中氮元素的质量分数为:
14*2/132=21.2%
化肥中硫酸铵的纯度为:
20%/21.2%=94.34%
纯度=不纯物质中某元素质量分数/纯化合物中该元素质量分数1年前查看全部
- HCOOH氢氧元素质量比NH4NO氮氧元素质量比(NH4)2SO4氢硫元素质量比
 ayu4ever1年前2
ayu4ever1年前2 -
 cclida 共回答了21个问题
cclida 共回答了21个问题 |采纳率90.5%对这类求元素质量比的题,只要求出各元素的总原子量,再比即可.
1、HCOOH(甲酸)氢元素的总原子量为2*1=2
氧元素的总原子量为2*32=32
氢氧元素质量比就是2:32=1:16
2、NH4NO这个物质没有的,应该是氮肥硝酸铵吧,NH4NO3
氮元素的总原子量为2*14=24
氧元素的总原子量为3*16=48
氮氧元素质量比为28:48=7:12
3、(NH4)2SO4(硫酸铵)
氢元素的总原子量为2*4*1=8
硫元素的总原子量为32*1=32
氢硫元素质量为8:32=1:4
方法如此,1年前查看全部
- 请问(NH4)2SO4溶液中,铵根离子的浓度与硫酸根离子的浓度之比为2:1为什么不正确?
 syd23701年前1
syd23701年前1 -
 lighter001 共回答了12个问题
lighter001 共回答了12个问题 |采纳率100%实际上是小于2:1
因为NH4+发生水解1年前查看全部
- 经测定一种不纯的(NH4)2SO4氮肥,含氮量为20%,则其中混有另一种氮肥是( )
经测定一种不纯的(NH4)2SO4氮肥,含氮量为20%,则其中混有另一种氮肥是( )
A、NH4Cl B、CO(NH2)2 C、NH4HCO3 D、NH4NO3 wenfan8703231年前1
wenfan8703231年前1 -
 雪舞轻尘 共回答了20个问题
雪舞轻尘 共回答了20个问题 |采纳率100%答案为C
(NH4)2SO4中N的质量分数为:28/132 =7/33 >20%
因而杂质的含氮量一定要小于 20%
从而可以推知为C.1年前查看全部
- (NH4)2SO4\NH4HSO4\NH4NO3,ph值由小到大怎么排.为什么?
 bettywu011年前2
bettywu011年前2 -
 qbatw 共回答了15个问题
qbatw 共回答了15个问题 |采纳率93.3%NH4HSO4为强酸酸式盐,溶于水可电离出H+,所以其溶液酸性较强,pH最小
NH4NO3和(NH4)2SO4都为强酸弱碱盐,溶于水后电离出的NH4+会水解,
方程式为:H2O+NH4+=可逆=NH3·H2O+H+,所以他们的水溶液都呈酸性,
但是每一摩尔(NH4)2SO4中含有两摩尔NH4+,所以其水解程度强于NH4NO3,所以最终pH顺序为:
NH4HSO4<(NH4)2SO4<NH4NO3<71年前查看全部
- (NH4)2SO4是目前农村常用的一种化肥,现有一样品,经检验,样品中的含氮量为22.5%,这样品中的杂质不可能是( )
(NH4)2SO4是目前农村常用的一种化肥,现有一样品,经检验,样品中的含氮量为22.5%,这样品中的杂质不可能是( )
A.NH4HCO3 B.NH4NO3 C.CO(NH2)2 D.NH4Cl DieAnotherDay1年前1
DieAnotherDay1年前1 -
 james-gong 共回答了21个问题
james-gong 共回答了21个问题 |采纳率85.7%看N的百分比.首先看22.5%是比硫酸铵中N的百分比大了还是小了.然后看以下4种物质的N百分比比硫酸铵的大还是小,取那个不一样的就是了.我忘了元素的原子量了,不能帮你计算.但是就是这种方法.1年前查看全部
- 若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A. 1:4
B. 1:2
C. 2:1
D. 4:1 紫色夜行衣1年前1
紫色夜行衣1年前1 -
 haomm 共回答了21个问题
haomm 共回答了21个问题 |采纳率90.5%解题思路:先根据氧化还原反应中得失电子相等配平方程式,再根据化合价变化的和化合价不变的氮原子判断.该反应中,NH4+→N2氮元素的化合价由-3价→0价,生成一个氮气分子需要铵根离子失去6个电子,生成一个二氧化硫分子需要硫酸根离子得到2个电子,所以其最小公倍数是6,然后其它元素根据原子守恒进行配平方程式,所以该方程式为3(NH4)2SO4
强热
.
3SO2↑+N2↑+4NH3↑+6H2O,该方程式中铵根离子和氨气分子中氮原子的化合价都是-3价,化合价不变,所以则该反应中化合价发生变化和未发生变化的N原子数之比为1×2:4×1=1:2,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查了根据方程式进行有关计算,难度不大,注意该方程式中氧化剂和还原剂是同一种物质,但氧化产物和还原产物不同,所以从生成物进行配平较简便.1年前查看全部
- 能用一种试剂通过化学反应区别(NH4)2SO4、K2SO4、NH4Cl吗?
 斜阳若影1年前1
斜阳若影1年前1 -
 小鬼侃车 共回答了16个问题
小鬼侃车 共回答了16个问题 |采纳率93.8%用Ba(OH)2,与(NH4)2SO4生成氨气和沉淀,与K2SO4生成沉淀,与NH4Cl生成氨气1年前查看全部
- 浓度越高,那为什么NH4Cl和(NH4)2SO4按理说前者水解程度高,但酸性确实后者大于前者?浓度越高,
 yolos1年前2
yolos1年前2 -
 黎黎黎黎 共回答了24个问题
黎黎黎黎 共回答了24个问题 |采纳率95.8%水解是很微弱的,他远小于电离,你看后者可以电离出2个铵根,所以要有2个氢离子使硫酸根离子平衡,比前者多一个H+,在其他具体条件下后者酸性大.好好学吧,平衡很抽象的,祝你成功要多问老师啊1年前查看全部
- 氢氧化铝制备(离子方程式)化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成
氢氧化铝制备(离子方程式)
化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成离子方程式.顺便问一下,NH3·H2O离子方程式时能拆么?怎么拆? 2834199961年前1
2834199961年前1 -
 jskaaa 共回答了27个问题
jskaaa 共回答了27个问题 |采纳率85.2%2Al3+ + 6NH3·H2O = 2Al(OH)3↓ + 6NH4+
NH3·H2O离子方程式时不能拆1年前查看全部
- 有四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2中,哪种含氮量最高,哪种最低,10Kg尿素
有四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2中,哪种含氮量最高,哪种最低,10Kg尿素中含氮多少千克
 秋天1号1年前2
秋天1号1年前2 -
 88lk 共回答了13个问题
88lk 共回答了13个问题 |采纳率84.6%含N量:
(NH4)2SO4:21.21%
NH4HCO3:17.72%
NH4NO3:35%
CO(NH2)2:46.67%
可见,CO(NH2)2含氮量最高,NH4HCO3最低
10Kg尿素中含氮:10kg×46.67%=4.667kg1年前查看全部
- 已知一定条件下硫酸铵分解反应为4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气
已知一定条件下硫酸铵分解反应为4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入氯化钡溶液中,下列判断正确的是( )
A.得到的沉淀是BaSO4
B.得到的沉淀是BaSO4和BaSO3
C.一定无BaSO3生成
D.无沉淀生成 我要干掉豆豆1年前1
我要干掉豆豆1年前1 -
 wtw_mvp 共回答了17个问题
wtw_mvp 共回答了17个问题 |采纳率94.1%解题思路:根据反应生成的产物量和性质分析,二氧化硫溶于水和水反应生成亚硫酸,三氧化硫溶于水和水反应生成硫酸,氨气溶于水生成一水合氨;硫酸和氯化钡反应生成硫酸钡沉淀,亚硫酸和氨水反应生成亚硫酸铵,所以通入氯化钡溶液中,关键分解反应生成的气体物质的量进行计算分析判断;生成沉淀有亚硫酸钡和硫酸钡.硫酸铵分解反应为4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,反应后的混合气体通入到BaCL2溶液中发生的是复分解反应,
SO2+H2O+2NH3=(NH4)2SO3 ;(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl;SO3+H2O+2NH3 =(NH4)2SO4;(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl.
依据反应定量关系,结合分解生成的气体物质的量可知,设4mol(NH4)2SO4分解,生成1molN2,6molNH3,3molSO2,1molSO3,
二氧化硫转化为亚硫酸铵,1mol三氧化硫转化为硫酸铵消耗氨气2mol,则4mol氨水和2mol二氧化硫反应生成2mol亚硫酸铵,
所以得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余二氧化硫和亚硫酸钡反应生成亚硫酸氢钡,
最后得到沉淀为1mol硫酸钡,1mol亚硫酸钡,
因此得到沉淀为BaSO3和BaSO4;
故选B.点评:
本题考点: 铵盐;含硫物质的性质及综合应用.
考点点评: 本题考查了物质反应的定量计算及物质性质的综合应用,关键是分析反应过程反应判断沉淀生成的实质,题目难度中等.1年前查看全部
- 六水硫酸亚铁硫酸铵是不是配合物即(NH4)2SO4 FeSO4 6H2O
 人不为己oh1年前1
人不为己oh1年前1 -
 qkp0h9b 共回答了8个问题
qkp0h9b 共回答了8个问题 |采纳率100%复盐
由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子.例如,明矾(硫酸铝钾)是KAl (SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.复盐溶于水时,电离出的离子,跟组成它的简单盐电离出的离子相同.使两种简单盐的混合饱和溶液结晶,可以制得复盐.例如,使CuSO4和(NH4)2SO4的溶液混合结晶,能制得硫酸铜铵[(NH4)2SO4·CUSO4·6H2O].
纯净物的定义是由同一种物质组成的稳定结构就象胆矾是结晶水和物但是它是纯净物复盐也是的但是它的最小组成是一个又一个的原子团胆矾也是一个又一个的原子团组成的只有一种物质即5水硫酸铜组成了它所以是纯洁物复盐也一样 里面的水只是纯净物的一部分 所以复盐也是纯净物1年前查看全部
- 200gNH4HCO3与多少克(NH4)2SO4所含氮元素的质量相同
 青岛211年前1
青岛211年前1 -
 wulitouderen 共回答了14个问题
wulitouderen 共回答了14个问题 |采纳率92.9%2NH4HCO3----2N-------(NH4)2SO4
158 132
200g x
158/200g=132/x
x=167.1g1年前查看全部
- 计算20t尿素{CO(NH2)}与多少吨硫酸铵{(NH4)2SO4}的肥效相当
 yiyiaichao1年前1
yiyiaichao1年前1 -
 甜葡萄0314 共回答了13个问题
甜葡萄0314 共回答了13个问题 |采纳率92.3%就是计算N元素,让它们的N元素质量相等
20t x (28/60) ÷(28/132) == 44t1年前查看全部
- rt 某农田原计划施用198kg的(NH4)2SO4追加化肥,若改用尿素〔CO(NH2)2〕,计算需要尿素多少千克?
 zhangyzgh12211年前1
zhangyzgh12211年前1 -
 ysf999 共回答了15个问题
ysf999 共回答了15个问题 |采纳率80%分析:用(NH4)2SO4与改用尿素〔CO(NH2)2〕,两者的肥效应该一样,也就是两者中氮元素的质量相等.
设需要尿素的质量为X
198kg*14*2/(14*2+1*4+32+16*4)=X*14*2/(12+16+14*2+1*4)
X=1年前查看全部
- 有ch3ch2br、苯、na2so3、(nh4)2so4用下面的一种试剂一次区分
有ch3ch2br、苯、na2so3、(nh4)2so4用下面的一种试剂一次区分
A.bacl2
B.naoh
C.na2so4
D.水 jiafly1年前1
jiafly1年前1 -
 D_J_W 共回答了14个问题
D_J_W 共回答了14个问题 |采纳率100%B1年前查看全部
- 能一步将Na2SO4、NHH4NO3、KCL、(NH4)2SO4四瓶无色溶液加以区别(可以加热)的一种试剂
能一步将Na2SO4、NHH4NO3、KCL、(NH4)2SO4四瓶无色溶液加以区别(可以加热)的一种试剂
1、BaCL2 2、Ba(NO3)2 3、Ba(OH)2 4、AgNO3
1为什么不行? 竹子裂了1年前2
竹子裂了1年前2 -
 枯藤败叶 共回答了15个问题
枯藤败叶 共回答了15个问题 |采纳率93.3%答案应选3
因为氢氧化钡与硫酸钠反应只有沉淀生成、与硝酸铵反应只有气体(氨的气味)生成、与氯化钾不反应、与硫酸铵反应既有沉淀又有气体生成,四种不同的现象,所以选3,
而1、2是一样的,它们分别与硫酸钠、硫酸铵反应都只生成沉淀,与硝酸铵、氯化钾不反应,所以无法加以区别四瓶无色溶液.1年前查看全部
- 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到n mol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁的物质的量为n(2-x)mol
B. 处理废水中的Cr2O72-的物质的量为[nx/2]mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO•FeyCrxO3中,3x=y 山下1年前1
山下1年前1 -
 有的枫叶 共回答了22个问题
有的枫叶 共回答了22个问题 |采纳率100%解题思路:A、由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B、反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C、Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D、根据失电子守恒计算.A、由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A错误;
B、根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2],故B正确;
C、得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C正确;
D、FeO•FeyCrxO3中,Cr为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选A.点评:
本题考点: 电解原理.
考点点评: 考查原子守恒、电子守恒,难度较大,注意在计算中守恒思想的应用,使计算简单化.1年前查看全部
- 只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是( )
只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是( )
A. AgNO3
B. NaOH
C. BaCl2
D. Ba(OH)2 小喇叭啊啊1年前3
小喇叭啊啊1年前3 -
 haze34 共回答了21个问题
haze34 共回答了21个问题 |采纳率95.2%解题思路:Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液分别与Ba(OH)2反应,反应现象依次为:白色沉淀、无现象、白色沉淀和刺激性气体、刺激性气体,以此来解答.A.四种溶液均与AgNO3反应生成白色沉淀,不能区分,故A错误;
B.(NH4)2SO4、NH4Cl均与NaOH溶液反应生成刺激性气体,不能区分,故B错误;
C.Na2SO4、(NH4)2SO4均与BaCl2反应生成白色沉淀,不能区分,故C错误;
D.Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液分别与Ba(OH)2反应,反应现象依次为:白色沉淀、无现象、白色沉淀和刺激性气体、刺激性气体,现象不同,能区分,故D正确;
故选D.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的区分,明确物质的性质及发生的化学反应中的现象是解答本题的关键,注意现象相同的不能区分,题目难度不大.1年前查看全部
- 相同温度、相同物质的量浓度的下列溶液:①Na2CO3 ②NaHCO3 ③NH4Cl ④(NH4)2SO4,按照pH由大到
相同温度、相同物质的量浓度的下列溶液:①Na2CO3 ②NaHCO3 ③NH4Cl ④(NH4)2SO4,按照pH由大到小的顺序排列应是( )
A.③②④①
B.①②④③
C.①②③④
D.②④③① xifengxf1年前1
xifengxf1年前1 -
 326hong326 共回答了17个问题
326hong326 共回答了17个问题 |采纳率76.5%解题思路:先判断溶液的酸碱性,一般情况是pH:强碱>弱碱>水解呈碱性的盐>强酸强碱盐>水解呈酸性的盐>弱酸>强酸,以此解答该题.①Na2CO3、②NaHCO3溶液呈碱性,③NH4Cl、④(NH4)2SO4呈酸性,Na2CO3水解程度大于NaHCO3,铵根离子浓度越大,溶液酸性越强,则
按照pH由大到小的顺序排列应是①②③④,
故选C.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查盐类的水解及应用,注意把握水解规律和影响盐类水解的因素,难度不大,该题是基础性试题的考查,侧重对教材基础知识的巩固和训练,旨在培养学生灵活运用水解原理解决实际问题的能力,有利于培养学生的应试能力,激发学生学习化学的兴趣.1年前查看全部
- (2012•达州)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥.
(2012•达州)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥.为了给农民朋友提供技术指导,小明对这两种肥料作了相关性质的探究.
【友情提示】:碳酸钾与纯碱具有相似的化学性质;
【实验探究】:并完成以下各题
【交流共享】:①硫酸铵不宜长期使用,易造成土壤酸化而板结;草木灰的使用既实现了变废为宝,还起到了改良酸性土壤的作用;探究过程 K2CO3 (NH4)2SO4 结论及化学方程式 ①、分别取碳酸钾和硫酸铵固体,加足量水搅拌,测其温度变化情况 得到澄清溶液;
温度无明显变化得到澄清溶液;
温度明显降低都易溶于水;
硫酸铵溶于水时吸收的热量大于放出的热量.②、取①中溶液分别滴入紫色石蕊试液,观察溶液颜色变化,并判断其酸碱性 ______ 变红 碳酸钾溶液显______性
硫酸铵溶液显______性③、另取①中溶液分别加入足量稀盐酸,观察现象 ______ 无明显现象 写出相关反应的化学方程式:
______④、再取①中溶液分别加入Ba(OH)2溶液,观察现象 产生
白色沉淀______ (NH4)2SO4与Ba(OH)2溶液反应的化学方程式:
(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑
②草木灰和硫酸铵能否混合使用?(填“能“或“否”)______
【知识拓展】:若要鉴别失去标签的碳酸钾和硫酸铵固体,下列试剂不可用的是:______.
A、水B、稀盐酸C、氯化钡溶液D、无色酚酞试液. wazxap1年前1
wazxap1年前1 -
 shiigloo 共回答了14个问题
shiigloo 共回答了14个问题 |采纳率92.9%解题思路:【实验探究】:②根据碳酸钾与纯碱具有相似的化学性质,呈碱性,使石蕊试液变蓝,硫酸铵使石蕊试液变红,说明呈酸性;
③根据碳酸钾与盐酸反应生成氯化钾、水和二氧化碳解答;
④根据氢氧化钡和硫酸铵反应生成硫酸钡、氨气和水解答;
【交流共享】:②铵态氮肥和显碱性物质混合能生成氨气,从而降低肥效;
【知识拓展】:A、根据碳酸钾和硫酸铵溶于水溶液显酸碱性分析;
B、根据碳酸钾与盐酸反应生成二氧化碳气体,硫酸铵与盐酸不反应分析;
C、氯化钡与碳酸钾和硫酸铵反应都生成白色沉淀分析;
D、根据无色酚酞遇碱性物质碳酸钾变红,遇酸性的硫酸铵不显色分析;【实验探究】:②碳酸钾与纯碱具有相似的化学性质,所以碳酸钾溶液呈碱性,使石蕊试液变蓝,硫酸铵使石蕊试液变红,说明呈酸性,故填:变蓝;碱;酸;
③碳酸钾与盐酸反应生成氯化钾、水和二氧化碳,反应的化学方程式为2HCl+K2CO3=2KCl+CO2↑+H2O,故填:产生大量气泡;2HCl+K2CO3=2KCl+CO2↑+H2O;
④氢氧化钡和硫酸铵反应生成硫酸钡、氨气和水,硫酸钡是不溶于水的白色物质,氨气有刺激性气味,故填:产生白色沉淀、有刺激性气味的气体生成
【交流共享】:②铵态氮肥和显碱性物质混合能生成氨气,从而降低肥效,故填:否;
【知识拓展】:A、把碳酸钾和硫酸铵固体溶于水形成溶液,测其温度就能区分,故A可用;
B、碳酸钾与盐酸反应生成二氧化碳气体,硫酸铵与盐酸不反应,能区分,故B可用;
C、氯化钡与碳酸钾反应生成白色沉淀碳酸钡,氯化钡与硫酸铵反应生成白色沉淀硫酸钡,现象一样,不能区分,故C不可用;
D、无色酚酞遇碱性物质碳酸钾变红,遇酸性的硫酸铵不显色,能区分,故D可用;
故选C.点评:
本题考点: 实验探究物质的性质或变化规律;酸碱指示剂及其性质;盐的化学性质;酸、碱、盐的鉴别.
考点点评: 本题主要考查氮肥、钾肥的判断和使用时的注意事项,难度稍大,须熟练运用酸碱盐的性质进行解答;1年前查看全部
- 化学,用一种试剂鉴别三种物质BaCl2、NaCl、K2CO3NaNO3、MgCl2、(NH4)2SO4CaCl2、NaN
化学,用一种试剂鉴别三种物质
BaCl2、NaCl、K2CO3
NaNO3、MgCl2、(NH4)2SO4
CaCl2、NaNO3、H2SO4
NaCl、H2SO4、Ca(OH)2 caizitou1年前4
caizitou1年前4 -
 fz1919 共回答了26个问题
fz1919 共回答了26个问题 |采纳率96.2%1、H2SO4 硫酸钡沉淀,氯化钠没现象,碳酸钾出现气体二氧化碳,酸性气体,不助燃.
2、NaOH 硝酸钠没反应,氯化镁沉淀,硫酸铵会有氨气出现,刺激性,碱性气体.
3、Na2CO3氯化钡有沉淀,硝酸钠没反应,硫酸会出现气体二氧化碳,酸性气体,不助燃.
4、紫色石蕊试剂
如果试液显红色,则说明液体显酸性;
如果试液显蓝色,则说明液体显碱性;
如果显紫色,则是中性.1年前查看全部
- 尿素CO(NH2)2,硝酸铵NH4NO3,硫酸铵(NH4)2SO4都含有什么元素?[数字都是小写的]
尿素CO(NH2)2,硝酸铵NH4NO3,硫酸铵(NH4)2SO4都含有什么元素?[数字都是小写的]
为什么?
是!一定!含有什么元素?
为什么? 天行一健1年前1
天行一健1年前1 -
 pp127 共回答了12个问题
pp127 共回答了12个问题 |采纳率91.7%其实你列举的这些都是化肥的主要成分.
NH3+是氨基,在水中这些东西会以离子的形态在水中存在,作为小分子物质容易被植物吸收.
N是元素氮,是植物生长的必要元素.
所以作为化肥,他们要选择易溶于水的盐类来做为主要成分.
又因为这3种物质的含氮量不同,而分植物或分时间对植物使用.
含氮量根据分子量计算得出的.
计算公式为:含氮量(100%)=(氮原子量X氮原子个数)/分子量1年前查看全部
- nh4cl nh4no3 (nh4)2so4受热分解,可制氨气吗?
nh4cl nh4no3 (nh4)2so4受热分解,可制氨气吗?
说明原因,产物,反应方程~ 寂惺1年前2
寂惺1年前2 -
 maomaold 共回答了17个问题
maomaold 共回答了17个问题 |采纳率88.2%氯化铵和硫酸铵在理论上可能,但没有什么实际价值.
理论上氯化铵热分解后形成的氨气和氯化氢气体扩散速率不一样.
(NH4)2SO4=NH3+NH4HSO4
硝酸铵受热阴阳离子间会发生氧化还原反应.
2NH4NO3=2N2+4H2O+O2 (热分解反应也会有其他产物)1年前查看全部
- 经化验,一包(NH4)2SO4样品的含氮量为22.5%,则样品中的杂质不可能是() A.NH4NO
经化验,一包(NH4)2SO4样品的含氮量为22.5%,则样品中的杂质不可能是() A.NH4NO
经化验,一包(NH4)2SO4样品的含氮量为22.5%,则样品中的杂质不可能是()
A.NH4NO3 B.NH4HCO3 C.CO(NH2)2 D.NH4Cl 逆风的吻1年前2
逆风的吻1年前2 -
 missimiss 共回答了9个问题
missimiss 共回答了9个问题 |采纳率100%B1年前查看全部
- (2014•宁夏一模)Ⅰ、(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口
(2014•宁夏一模)Ⅰ、(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a______.

(2)将装置C中两种液体分离开的操作名称是______.装置D的作用是______.
Ⅱ、为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺.某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl
MgOHCl+NH3↑+H2O△ .Mg(OH)2+NH4Cl,装置B中碱石灰的作用是______.
MgOHCl+NH3↑+H2O△ .
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是______.
(3)装置C的试管中反应的离子方程式为______.
Ⅲ、如图表示各物质之间的转化关系,其中A、B、C、G为单质.②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀.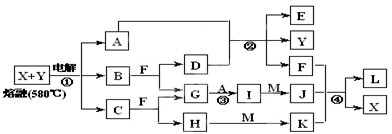
试回答下列有关问题:
(1)M的化学式______,Y在实验室中的用途______(列举一例).
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:______.工业生产中,还常常利用电解X和F的混合物制取______.
(3)反应②的化学方程式是______.
(4)反应④的离子反应方程式是______. qxw_0001年前1
qxw_0001年前1 -
 玲玲0452 共回答了26个问题
玲玲0452 共回答了26个问题 |采纳率88.5%解题思路:Ⅰ.制备硫酸铵,用碱石灰和浓氨水反应生成氨气,氨气与硫酸反应生成硫酸铵,多余氨气不能排放到空气中,应进行尾气吸收;
Ⅱ.在加热条件下氢氧化镁和氯化铵反应生成碱式氯化镁、氨气,通入氨气,可使氨气全部被氯化铝溶液吸收,并防止倒吸;
Ⅲ.由图中表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,推断为Ca(ClO)2;Y易潮解,常用作干燥剂,推断为CaCl2;结合转化关系可知,F为H2O,A为Cl2,D为Ca(OH)2;B+F(H2O)=D(Ca(OH)2)+G,推断B为Ca,G为H2,I为HCl,M是一种两性化合物,L是一种白色胶状沉淀;判断L为Al(OH)3,M为Al2O3,J为AlCl3,依据离子性质推断K为偏铝酸盐;H为碱,C为Na,H为NaOH,电解熔融物得到金属Ca、Na、Cl2;说明X、Y为NaCl、CaCl2,然后结合物质的性质及化学用语来解答.Ⅰ(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为:a→d→e→f,故答案为:def;
(2)分离互不相溶的液体的方法是:分液;
氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸,
故答案为:分液;吸收多余的NH3防止污染空气,防止倒吸;
Ⅱ(1)根据题意:利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl),发生的反应为:Mg(OH)2+NH4Cl
△
.
MgOHCl+NH3↑+H2O,碱石灰可以用来干燥氨气,故答案为:Mg(OH)2+NH4Cl
△
.
MgOHCl+NH3↑+H2O;干燥氨气;
(2)由于氨气是极易溶于水的,反应过程中持续通入N2,可以使反应产生的氨气完全导出并被稀硫酸充分吸收,并还能防止装置C中的氯化铝溶液倒吸入装置B,
故答案为:防止装置C中的AlCl3溶液倒吸入装置B;
(3)氨水和氯化铝反应生成氯化铵和氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
Ⅲ.由图中表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,推断为Ca(ClO)2;Y易潮解,常用作干燥剂,推断为CaCl2;结合转化关系可知,F为H2O,A为Cl2,D为Ca(OH)2;B+F(H2O)=D(Ca(OH)2)+G,推断B为Ca,G为H2,I为HCl,M是一种两性化合物,L是一种白色胶状沉淀;判断L为Al(OH)3,M为Al2O3,J为AlCl3,依据离子性质推断K为偏铝酸盐;H为碱,C为Na,H为NaOH,电解熔融物得到金属Ca、Na、Cl2;说明X、Y为NaCl、CaCl2,
(1)由上述分析可知M为Al2O3,Y为CaCl2,具有吸水性,常用作干燥剂,故答案为:Al2O3;用作干燥剂;
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,工业上这样做的目的是:降低X、Y熔化时的温度,节约能源; 常常利用电解X和F的混合物为饱和食盐水,制取Cl2、H2和NaOH,
故答案为:降低X、Y熔化时的温度,节约能源;Cl2、H2和NaOH;
(3)分析判断反应②是工业制漂白粉的反应,反应的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应④是铝盐和偏铝酸盐在水溶液中的双水解反应生成氢氧化铝沉淀,反应的离子反应方程式是:
Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.点评:
本题考点: 无机物的推断;制备实验方案的设计.
考点点评: 本题为拼盘改编题,较为综合,涉及物质的制备和无机物的推断,侧重于学的分析能力和实验能力的考查,注意把握物质转化关系的、物质性质的应用和判断,涉及了电解原理反应的应用、工业制漂白粉的反应、氯碱工业的反应、金属与水的反应等,其中,两性物质和漂白粉的制备是解题关键,题目难度较大.1年前查看全部
- 下列溶液中与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
下列溶液中与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A.10mL1mol/L(NH4)2SO4溶液
B.50mL0.2mol/LNH4Cl溶液
C.10mL0.2mol/L(NH4)2SO4溶液
D.200mL0.1mol/LNH4NO3溶液 sophia17843471年前1
sophia17843471年前1 -
 sying111 共回答了19个问题
sying111 共回答了19个问题 |采纳率94.7%解题思路:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol•L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol•L-1;
C、10mL0.2mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.4mol•L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol•L-1;
故选:B.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,所含微粒的物质的量浓度与所取溶液的体积大小无关.1年前查看全部
- 与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A. 10mL 1mol/L (NH4)2SO4溶液
B. 50mL 0.2mol/L NH4Cl溶液
C. 10mL 0.1mol/L(NH4)2SO4溶液
D. 200mL 0.1mol/L NH4NO3溶液 herry黄1年前3
herry黄1年前3 -
 为了vv来vv 共回答了21个问题
为了vv来vv 共回答了21个问题 |采纳率81%解题思路:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为:c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol•L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol•L-1;
C、10mL0.1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.2mol•L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol•L-1;
故选:BC.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,题目难度不大,注重了基础知识的考查,注意溶液中所含微粒的物质的量浓度与所取溶液的体积大小无关.1年前查看全部
- 某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为[nx/2]mo1
C.反应中发生转移的电子的物质的量为6nx mol
D.在FeO•FeyCrxO3中3x=y 丝巾1年前1
丝巾1年前1 -
 sll6886 共回答了17个问题
sll6886 共回答了17个问题 |采纳率82.4%解题思路:A.由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B.反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C.Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D.根据失电子守恒计算.A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A正确;
B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2]mol,故B正确;
C.得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C错误;
D、FeO•FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选C.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意原子守恒、电子守恒在计算中的应用,使计算简单化.1年前查看全部
- 几个化学式的读法H2S、 K2S、 Al2O3(三氧化二铝,能不能读成氧化铝?为什么呢?)HOH、 (NH4)2SO4
 yy即是生1年前3
yy即是生1年前3 -
 549879277 共回答了19个问题
549879277 共回答了19个问题 |采纳率94.7%硫化氢 硫化钾 三氧化二铝 HOH看不懂
硫酸氨1年前查看全部
- 混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为( )mol (用含m,n的代数式表示). 废物点心161年前1
废物点心161年前1 -
 ihivw 共回答了22个问题
ihivw 共回答了22个问题 |采纳率81.8%K2SO4的分子量为174,(NH4)2SO4的分子量为132.
设有K2SO4 a mol,(NH4)2SO4 b mol
混合物质量即为158a+114b=m g
又沉淀的物质的量为nmol,即SO4为 nmol,也就是a+b=n
联立两个方程得a=(m-132n)/421年前查看全部
大家在问
- 1用“共看明月应垂泪,一夜乡心五处同.”写一段完整的话
- 2读完《入木三分》,你受到了什么启发?
- 3测量小灯泡的电功率家庭电路中有一只标有名牌的灯泡正常发光,现给的器材有电能表、电流表、电压表、钟表,请用三种方法测出这只
- 4在如图装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是( )
- 5高中数学的一些基本概念
- 6求形容一望无际的二字叠词 不用多 但要精
- 7液态CO2灭火器为什么能灭火?是因为汽化吸热吗那为什么叫液态co2灭火器???求解答
- 8春 这文章 一共描绘了几福画
- 9当-1小于等于X小于等于1时,-2小于等于Y小于等于4,求一次函数解析式 各位哥哥姐姐们,
- 10根据句意及首字母提示完成下列句子.Mike d_______have a volleyball .
- 11请求大家帮帮我解开下面的九宫格数字,..
- 12可以只写一题'初一英语
- 13.Our team was ahead during the first half, but we _____ in t
- 14谁住得离你家最近-----------用英语怎么说
- 15阿伏伽德罗定律对于混合气体成立吗?
