铬渣的安全措施是什么
 心中的日月L晓2022-10-04 11:39:541条回答
心中的日月L晓2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 cgxfmabi9 共回答了22个问题
cgxfmabi9 共回答了22个问题 |采纳率77.3%- 要建一个专门堆放的渣场,要求是地板和四周是全密封,不能外漏.装满后要覆土植被.
- 1年前
相关推荐
- (2013•安徽模拟)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、
(2013•安徽模拟)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理.
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O2-7,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程.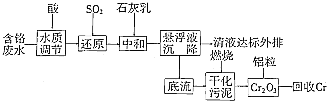
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是:______.
(2)在含Cr2O2-7废水中存在着平衡:Cr2
+H20⇌2CrO 2−7
+H+,请写出该平衡的平衡常数表达式k=O 2−4c2(C
)c(H+)rO 2−4c(
)Cr2O 2−7,若继续加水稀释,平衡将______移动(填“正向”、“逆向”“不”).c2(C
)c(H+)rO 2−4c(
)Cr2O 2−7
(3)请写出通入SO2时发生的离子反应方程式:______.
(4)写出加入铝粒在高温下发生反应制取铬的化学方程式2Al+Cr2O3
Al2O3+2Cr高温 .2Al+Cr2O3.
Al2O3+2Cr高温 .
Ⅱ.还有一种净化处理方法是将含+6价Cr的废水放人电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O2-7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31].
①电解过程中NaCI的作用是______.
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为______mol•L-1. 寻找过客1年前1
寻找过客1年前1 -
 蓓蓓贝贝 共回答了14个问题
蓓蓓贝贝 共回答了14个问题 |采纳率92.9%解题思路:Ⅰ(1)在测定PH值时,不能湿润、稀释,需要用干燥结晶的玻璃棒;
(2)根据化学平衡常数的定义可解;加入水稀释,平衡向浓度增的方向移动;
(3)二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
(4)根据铝热反应的概念进行解答;
Ⅱ①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).Ⅰ(1)在测定PH值时,不能湿润、稀释,正确的是将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
故答案为:将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)⇌2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(C
rO2−4)c(H+)
c(
Cr2O2−7);
加入水稀释,平衡向浓度增的方向移动,左边的离子稀释为1,右边的离子系数为3,加水平衡正向移动;
故答案为:
c2(C
rO2−4)c(H+)
c(
Cr2O2−7);正;
(3)重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(4)根据铝热反应的概念,铝与氧化铬在高温下生成铬和氧化铝,反应方程式为2Al+Cr2O3
高温
.
Al2O3+2Cr;
故答案为:2Al+Cr2O3
高温
.
Al2O3+2Cr;
Ⅱ①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电性;
②溶液中c(OH-)=
3
KspFe(OH)3
c(Fe3+)
=
3
4.0×10−38
2.0×10−13
mol/L=
32.0×10−25
mol/L,则溶液中c(Cr3+)=
KspCr(OH)3
C3(OH点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了PH值测定、化学平衡常数的计算以及Ksp的有关计算等内容,题目难度中等,注意对图象的分析和数据的处理.1年前查看全部
- (2014•顺义区一模)铬污染主要产生于铬矿的开采和冶炼.工厂排出的铬渣成分为SiO2、A12O3、MgO、Fe2O3、
(2014•顺义区一模)铬污染主要产生于铬矿的开采和冶炼.工厂排出的铬渣成分为SiO2、A12O3、MgO、Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7.已知:①Na2Cr2O7易溶于水,是强氧化剂.②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小.下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
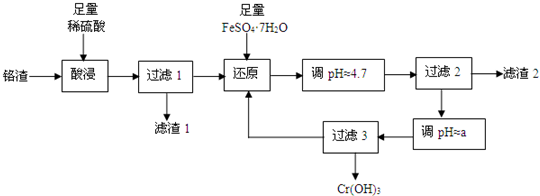
(1)在酸浸过程中,稀H2SO4溶解Al2O3的离子方程式是______.
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+此时溶液应呈现的颜色是______.
(3)用FeSO4•7H2O还原 Na2Cr2O7的离子方程式是______.
(4)已知:生成氢氧化物沉淀的pH
根据表中数据,流程中的a为______.物质 Fe(OH)3 Al(OH)3 Cr(OH)3 Fe(OH)2 Mg(OH)2 开始沉淀 1.5 3.4 4.9 6.3 9.6 完全沉淀 2.8 4.7 5.5 8.3 12.4
(5)分离滤渣2中物质,发生反应的离子方程式是______.
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是______. 且听风的歌1年前1
且听风的歌1年前1 -
 sanmu208 共回答了19个问题
sanmu208 共回答了19个问题 |采纳率89.5%解题思路:由流程可知,铬渣成分为SiO2、A12O3、MgO、Fe2O3、Na2Cr2O7,酸浸时A12O3、MgO、Fe2O3与酸反应生成硫酸铝、硫酸镁、硫酸铁,Na2Cr2O7溶于水,过滤1后的滤液中存在硫酸铝、硫酸镁、硫酸铁,Na2Cr2O7,用FeSO4•7H2O还原 Na2Cr2O7,Cr2O72-变为Cr3+,调pH≈4.7使铁离子、铝离子沉淀,经过滤2后调pH为5.5≤a<6.3使铬离子完全沉淀而亚铁离子不沉淀,经过滤3得Cr(OH)3 和滤液.
(1)氧化铝是两性氧化物溶于强酸强碱;(2)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(3)根据依据原子守恒和电荷守恒配平书写离子方程式;
(4)根据表中生成氢氧化物沉淀的pH数据分析,流程中的a为5.5≤a<6.3,以保证铬离子完全沉淀而亚铁离子不沉淀.
(5)分离滤渣2中物质Fe(OH)3、Al(OH)3,可用强碱溶液;.
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是使还原剂FeSO4循环利用.铬渣成分为SiO2、A12O3、MgO、Fe2O3、Na2Cr2O7,酸浸时A12O3、MgO、Fe2O3与酸反应生成硫酸铝、硫酸镁、硫酸铁,Na2Cr2O7溶于水,过滤1后的滤液中存在硫酸铝、硫酸镁、硫酸铁,Na2Cr2O7,用FeSO4•7H2O还原 Na2Cr2O7,Cr2O72-变为Cr3+,调pH≈4.7使铁离子、铝离子沉淀,经过滤2后调pH为5.5≤a<6.3使铬离子完全沉淀而亚铁离子不沉淀,经过滤3得Cr(OH)3 和滤液.
(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)c(H+)增大,平衡2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙色;
(3)FeSO4•7H2O还原 Na2Cr2O7,亚铁离子生成铁离子,Cr2O72-变为三价铬离子,依据原子守恒和电荷守恒配平书写离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)根据表中生成氢氧化物沉淀的pH数据分析,流程中的a为5.5≤a<6.3,以保证铬离子完全沉淀而亚铁离子不沉淀,故答案为:5.5≤a<6.3;
(5)经分析,滤渣2的成分为Fe(OH)3、Al(OH)3,分离滤渣2中物质,可用强碱溶液,发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 使还原剂FeSO4循环利用,故答案为:使还原剂FeSO4循环利用.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 作为反应流程题,本题思路比较清晰,题项设置简单,同时考查学生分析问题和解决问题能力,难度中等.1年前查看全部
- 从化工厂铬渣中提取硫酸钠的工艺如下:
从化工厂铬渣中提取硫酸钠的工艺如下:
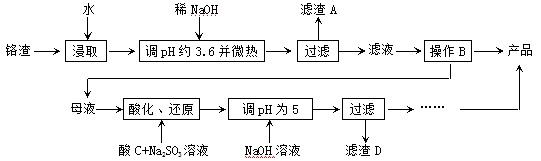
已知:①铬渣含有Na 2 SO 4 及少量Cr 2 O 7 2- 、Fe 3+ ;②Fe 3+ 、Cr 3+ 完全沉淀(c ≤1.0×10 -5 mol·L -1 )时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤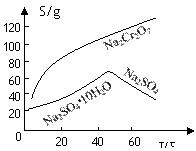
(3)酸化后Cr 2 O 7 2 - 可被SO 3 2- 还原成Cr 3+ ,离子方程式为:
;酸C为 ,Cr(OH) 3 的溶度积常数Ksp[Cr(OH) 3 ]= 。
(4)根据2CrO 4 2 - +2H + Cr 2 O 7 2 - +H 2 O设计图示装置(均为惰性电极)电解Na 2 CrO 4 溶液制取Na 2 Cr 2 O 7 ,图中右侧电极连接电源的 极,其电极反应式为 。
Cr 2 O 7 2 - +H 2 O设计图示装置(均为惰性电极)电解Na 2 CrO 4 溶液制取Na 2 Cr 2 O 7 ,图中右侧电极连接电源的 极,其电极反应式为 。
 madelaine1年前1
madelaine1年前1 -
 celina张 共回答了14个问题
celina张 共回答了14个问题 |采纳率100%(1)促进Fe 3+ 水解生成Fe(OH) 3 而除去;Fe(OH) 3
(2)A
(3)3SO 3 2- +Cr 2 O 7 2- +8H + =2Cr 3+ +3SO 4 2- +4H 2 O;H 2 SO 4 ;1.0×10 -32 mol/L
(4)正极 ,4OH - -4e - =O 2 +2H 2 O
(1)盐类的水解反应是吸热反应,所以微热能促进Fe 3+ 水解生成Fe(OH) 3 而除去,A为Fe(OH) 3 ;
(2)根据溶解度曲线,可以看出温度较高时,随着温度的升高,Na 2 SO 4 的逐渐减少,所以采用蒸发浓缩,趋热过滤的方法,所以A正确;
(3)酸化后,3SO 3 2- +Cr 2 O 7 2- +8H + =2Cr 3+ +3SO 4 2- +4H 2 O;因为最终产品是Na 2 SO 4 ,为避免产生杂质,酸C为酸;恰好完全沉淀时离子深度为c ≤1.0×10 -5 mol·L -1 ,Cr 3+ 完全沉淀时pH=5,c(OH - )=1.0×10 -9 mol·L -1 ,所以Cr(OH) 3 的浓度积常数为Ksp=1.0×10 -5 ×1.0×10 -9 ) 3 =1.0×10 -32
(4)根据示意图知,图中右侧Na 2 CrO 4 转化为Na 2 Cr 2 O 7 ,需要H + ,说明右侧电极发生OH - 放电,使H2O的电离平衡向右移动,H + 增多,所以右侧电极是连接电源的正极,电极方程式为4OH - -4e - =O 2 +2H 2 O1年前查看全部
大家在问
- 1甲、乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸.
- 2刮龙卷风时,大气压能达到90000帕.在一座面积200平方米的厂房中,当时大气压强是100000,如果此时龙卷风
- 3地球的卫星(包括同步和非同步卫星)所受重力=万有引力=向心力,赤道上的物体所受重
- 41.today it is whay day 2.which do like one you 连词成句
- 5提一个非常简单的英语问题:_____ can I write on the computer?You can use t
- 6数学题某事出租车收费标准如下表:三千米8元,以上单程每加一千米1.6元,往返每加一千米1.2元.
- 7求 这是未知的世界 的英文翻译
- 8hardiy ever意为几乎从不,具有什么意义
- 9“有朋自远方来,不亦乐乎.”中的“乐”是念le,还是yue?
- 10六年级一道数学题(百分数)的,如果加上分析的我会加分.
- 11已知齐次线性微分方程的通解,求对应的非齐次线性微分方程的通解怎么求
- 12英语翻译Complex programming has often detered manufactrers from
- 13大班(语言)句式练习"有的……有的……还有的……"教案
- 14绿叶在红花旁默默地陪衬,是一种爱;细雨对泥土温柔地滋润,是一种爱;
- 15因为1900÷4=475,所以1900年是闰年.______.(判断对错)
