(2009•兖州市模拟)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜的反应情况,回答下列问题:
 错枝2022-10-04 11:39:540条回答
错枝2022-10-04 11:39:540条回答(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______
A.40.32LB.30.24LC.20.16LD.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?______若不可行,请说明原因.若可行,请写出反应的离子方程式______.
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是______.则反应中所消耗的硝酸的物质的量可能为______
A.0.1molB.0.15molC.0.2molD.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.则在该反应中,H2O2的作用是______剂,该反应的化学方程式为______.
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中.请写出该反应的化学方程式:
| ||
| ||

已提交,审核后显示!提交回复
共0条回复
相关推荐
- (2009•兖州市模拟)在一无色未知溶液中检验出有Ba2+、Ag+同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存
(2009•兖州市模拟)在一无色未知溶液中检验出有Ba2+、Ag+同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在:①Cu2+②Fe3+③Cl- ④NO3-⑤S2-⑥CO32-⑦NH4+⑧Mg2+⑨Al3+⑩[Al(OH)4]-离子.其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是( )
A.③⑤⑥⑦⑩
B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨
D.①②③⑤⑥⑩ youyoug1年前1
youyoug1年前1 -
 意源16 共回答了15个问题
意源16 共回答了15个问题 |采纳率100%解题思路:根据题意可知:和氢离子反应的离子不能存在,和钡离子以及银离子反应的离子不能存在,据此来回答.未知溶液中检验出有Ba2+、Ag+,则和钡离子、银离子反应的③Cl-⑤S2-⑥CO32-不能存在,无色溶液中①Cu2+②Fe3+不能存在,未知溶液酸性很强,所以和氢离子反应的⑩[Al(OH)4]-不能存在.
故选D.点评:
本题考点: 常见阳离子的检验;常见阴离子的检验.
考点点评: 本题考查学生离子反应和离子共存的有关知识,可以根据教材知识来回答,难度不大.1年前查看全部
- (2009•兖州市模拟)如图:图中的两条射线分别表示甲、乙两名同学运动的一次函数图象,图中S和T分别表示运动路程和时间,
(2009•兖州市模拟)如图:图中的两条射线分别表示甲、乙两名同学运动的一次函数图象,图中S和T分别表示运
 动路程和时间,已知甲的速度比乙快,下列说法:
动路程和时间,已知甲的速度比乙快,下列说法:
①射线AB表示甲的路程与时间的函数关系;
②甲的速度比乙快1.5米/秒;
③甲让乙先跑了12米;
④8秒钟后,甲超过了乙
其中正确的说法是( )
A.①②
B.②③④
C.②③
D.①③④ 67gb8ra1年前1
67gb8ra1年前1 -
 bsyyy32 共回答了20个问题
bsyyy32 共回答了20个问题 |采纳率100%解题思路:根据函数图象上特殊点的坐标和实际意义即可作出判断.根据函数图象的意义,①已知甲的速度比乙快,故射线OB表示甲的路程与时间的函数关系;错误;
②甲的速度比乙快1.5米/秒,正确;
③甲让乙先跑了12米,正确;
④8秒钟后,甲超过了乙,正确;
故选B.点评:
本题考点: 函数的图象.
考点点评: 正确理解函数图象横纵坐标表示的意义,理解问题的过程,能够通过图象得到随着自变量的增大,知道函数值是增大还是减小,通过图象得到函数是随自变量的增大或减小的快慢.1年前查看全部
- (2011•兖州市三模)请完成以下两小题.
 (2011•兖州市三模)请完成以下两小题.
(2011•兖州市三模)请完成以下两小题.
(1)某探究学习小组的同学欲验证“动能定理”,他们在实验室组装了一套如图所示的装置,另外他们还找到了打点计时器所用的学生电源、导线、复写纸、纸带、小木块、细沙.当滑块连接上纸带,用细线通过滑轮挂上空的小沙桶时,释放小桶,滑块处于静止状态.若你是小组中的一位成员,要完成该项实验,则:
①你认为还需要的实验器材有______.
②实验时为了保证滑块受到的合力与沙和沙桶的总重力大小基本相等,沙和沙桶的总质量应满足的实验条件是______,实验时首先要做的步骤是______.
③在②的基础上,某同学用天平称量滑块的质量M.往沙桶中装入适量的细沙,用天平称出此时沙和沙桶的总质量m.让沙桶带动滑块加速运动,用打点计时器记录其运动情况,在打点计时器打出的纸带上取两点,测出这两点的间距L和这两点的速度大小v1与v2(v1<v2).则本实验最终要验证的数学表达式为mgL=
M1 2
−v 22
M1 2 v 21mgL=用题中的字母表示实验中测量得到的物理量).
M1 2
−v 22
M1 2 v 21
(2)2010年世博会在上海举行,本次世博会大量采用低碳环保技术,太阳能电池用作照明电源是其中的亮点之一.硅光电池是太阳能电池的一种,某同学为了测定该电池的电动势和内电阻,设计了如图甲所示电路.图中与A1串联的定值电阻的阻值为R0,电流表视为理想电表,在一定强度的光照下进行下述实验(计算结果保留两位有效数字)
①闭合开关,调节滑动变阻器,读出电流表A1、A2的值I1、I2.为了作出此电池的
U-I曲线,需要计算出电路的路端电压U,则U=______(用题中所给字母表示)
②根据测量数据作出该硅光电池的U-I图象如图乙所示,该电池的电动势E=______V,在流过电流表A2的电流小于200mA的情况下,此电池的内 阻r=______Ω;
③若将该硅光电池两端接上阻值为6Ω的电阻,此时对应的电池内 阻r=______Ω.
 zyg72487071年前0
zyg72487071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•兖州市)下列关于济宁市气候特征的说法,错误的是( )
(2014•兖州市)下列关于济宁市气候特征的说法,错误的是( )
A.降水量的分布由东南向西北递减
B.气候四季分明、雨热同期
C.最为突出的气候灾害是洪涝和干旱
D.夏季盛行偏北风,冬季盛行偏南风 19831113311年前1
19831113311年前1 -
 ozlin 共回答了13个问题
ozlin 共回答了13个问题 |采纳率100%解题思路:济宁市位于山东省,该城市属于温带季风气候,夏季高温多雨,冬季寒冷干燥.A、济宁市降水量由东南向西北递减,叙述正确,不符合题意;
B、济宁市气候四季分明,雨热同期,叙述正确,不符合题意;
C、济宁市气候灾害是洪涝和干旱,叙述正确,不符合题意;
D、济宁市夏季盛行偏北风,冬季盛行偏南风,叙述错误,不符合题意.
故选:D.点评:
本题考点: 山东省.
考点点评: 本题考查山东省的气候,理解解答即可.1年前查看全部
- (2011•兖州市三模)下列说法正确的是( )
(2011•兖州市三模)下列说法正确的是( )
A.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料,所以钯催化剂能催化所有类型的有机反应
B.把CO中毒的病人放入高压氧仓中解毒,其原理符合勒夏特列原理
C.日常生活中无水乙醇常用于杀菌消毒
D.2011年日本地震引发核危机,食盐中的碘单质可以防止核辐射,故市民应当抢购食盐 rye守望者1年前1
rye守望者1年前1 -
 mimi5273 共回答了21个问题
mimi5273 共回答了21个问题 |采纳率85.7%解题思路:A、催化剂有选择性.
B、根据浓度对化学平衡的影响分析.
C、75%的乙醇能杀菌消毒.
D、食盐中含有碘元素不含碘单质.A、催化剂有选择性,所以钯催化剂能不催化所有类型的有机反应,故错误.
B、一氧化碳中毒的反应原理为:CO+Hb•O2⇌O2+Hb•CO,当增大氧气的浓度时,使化学反应平衡向逆反应方向移动,从而使一氧化碳和血红蛋白分离而解毒,所以符合勒夏特列原理,故正确.
C、杀菌消毒用的是医用酒精(75%),不是无水乙醇,故错误.
D、加碘食盐中的碘是碘酸钾中的碘元素不是单质碘,故错误.
故选B.点评:
本题考点: 化学平衡的影响因素;生活中的有机化合物.
考点点评: 本题考查了化学与生活,题目难度不大,注意相关知识的积累,特别是加碘食盐的存在形式,为易错选项.1年前查看全部
- (2009•兖州市模拟)某同学在实验室中称取20gNaOH固体,来配制500mL 1mol•L-1的氢氧化钠溶
(2009•兖州市模拟)某同学在实验室中称取20gNaOH固体,来配制500mL 1mol•L-1的氢氧化钠溶液.
(1)该同学准备的实验用品有:托盘天平(带砝码)、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有______;
(2)下列有关实验操作,正确的是______;
A.称量氢氧化钠固体时,要在天平的左右两个托盘上分别放置两个相同规格的小烧杯
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
(3)在溶液的配制过程中,有以下基本实验步骤,其中,需要进行2次及以上的操作步骤是(填写操作步骤的代号)______.
①转移②洗涤③溶解④称量⑤定容⑥冷却
(4)玻璃棒在该实验中的作用有①______,②______.
(5)若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不蛮”)
①称量氢氧化钠时,直接放到托盘天平上称量.______;
②定容摇匀后,有少量溶液外流,所配溶液的浓度______. xiaottjj0081年前1
xiaottjj0081年前1 -
 alfra 共回答了23个问题
alfra 共回答了23个问题 |采纳率95.7%解题思路:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器分析;
(2)根据实验操作的方法分析;
(3)根据实验操作的方法分析;
(4)玻璃棒所起的作用常见的有搅拌、引流、转移固体等;
(5)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)配制顺序是:计算→称量→溶解、冷却→移液→洗涤仪器(将洗涤液倒入容量瓶) 定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、烧杯、胶头滴管;
(2)A、氢氧化钠为易潮解的固体,应放在玻璃器皿中称量,但不需要在另一盘上放上烧杯,故A错误;
B、因氢氧化钠固体溶解水放热,应并冷却至室温,然后转移到容量瓶中,否则会引起误差,故B正确;
C、某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线,导致部分溶质被吸出,导致配制的浓度偏低,故C错误.
D、某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中,这样确保溶质全部转移到容量瓶中,故D正确;
故选:BD;
(3)①转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故①正确;
②洗涤时要洗涤烧杯及玻璃棒2-3次,故②正确;
③将称量好的药品放到烧杯中溶解,只有1次,故 ③错误;
④称量时先称空烧杯的质量再称烧杯和药品的质量,故④正确;
⑤定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故⑤错误;
⑥固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故⑥错误;
故选:①②④;
(4)用玻璃棒搅拌加速氢氧化钠的溶解,转移液体时用玻璃棒引流.故答案为:搅拌;引流;
(5)①称量氢氧化钠时,直接放到托盘天平上称量,因氢氧化钠潮解,吸水,称得的氢氧化钠质量偏小,浓度偏小,故答案为:偏低;
②定容摇匀后,有少量溶液外流,因漏出的液体和瓶中液体的浓度一致,故答案为:不影响.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度的配制.要注意溶质的性质、同时要记住操作步骤,规范操作.1年前查看全部
- (2013•兖州市一模)化学用语是学习化学的基本工具,请用化学符号或化学式填空:
(2013•兖州市一模)化学用语是学习化学的基本工具,请用化学符号或化学式填空:
(1)3个硝酸根离子______;2个甲烷分子______;
(2)在H、O、C、S、Cl、Na、Ca七种元素中选择适当的元素组成符合下列要求的物质,并在空格中写出化学式
①焙制糕点所用发酵粉主要成分之一______
②由三种元素组成且能使紫色石蕊试液变红色的一种化合物______. 悠悠居士19861年前1
悠悠居士19861年前1 -
 zhouxiaojie_456 共回答了21个问题
zhouxiaojie_456 共回答了21个问题 |采纳率85.7%解题思路:本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.(1)①离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,符号前面的数字,表示离子个数,一个硝酸根离子带一个单位的负电荷,故答案为:3NO3-;
②由分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,2个甲烷分子可表示为:2CH4;
(2)①焙制糕点所用的发酵粉的主要成分之一的是碳酸氢钠,化学式为NaHCO3;
②酸使紫色石蕊试液变红色,所以由三种元素组成且能使紫色石蕊试液变红色的一种化合物可以为H2SO4;
故答案为:(1)3NO3-;2CH4 (2)①NaHCO3②H2SO4;点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- (2009•兖州市模拟)如图所示,在△ABC中,∠C=90°,AD平分∠BAC,BC=10cm,BD=6cm,则点D到A
 (2009•兖州市模拟)如图所示,在△ABC中,∠C=90°,AD平分∠BAC,BC=10cm,BD=6cm,则点D到AB的距离为______cm.
(2009•兖州市模拟)如图所示,在△ABC中,∠C=90°,AD平分∠BAC,BC=10cm,BD=6cm,则点D到AB的距离为______cm.  悄悄是别离de笙箫1年前1
悄悄是别离de笙箫1年前1 -
 fgjgxfghkhg66 共回答了18个问题
fgjgxfghkhg66 共回答了18个问题 |采纳率88.9%解题思路:要求点D到AB的距离,利用角的平分线上的点到角的两边的距离相等可知,只要求得D到AC的距离即可,而D到AC的距离就是CD的值.∵∠C=90°,AD平分∠BAC,
∴CD是点D到AB的距离,
∵CD=10-6=4,
∴点D到AB的距离为4.
故答案为:4.点评:
本题考点: 角平分线的性质.
考点点评: 本题主要考查了角平分线上的一点到两边的距离相等的性质.做题前,要有分析过程,培养自己的分析能力.1年前查看全部
- (2009•兖州市模拟)T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃
(2009•兖州市模拟)T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,H2的体积分数与时间的关系如图(Ⅱ)所示.则下列结论正确的是( )
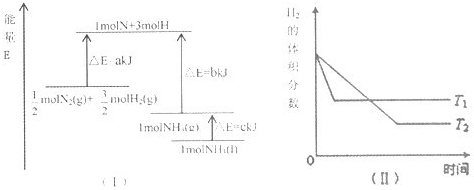
A.该反应的热化学方程式是:[1/2]N2(g)+[3/2H2(g) ilovemyp1年前0
ilovemyp1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•兖州市一模)苯甲酸(C6H5COOH)是一种酸性比醋酸更强的有机酸,能使紫色石蕊试液变红,常用作食品防腐剂.
(2013•兖州市一模)苯甲酸(C6H5COOH)是一种酸性比醋酸更强的有机酸,能使紫色石蕊试液变红,常用作食品防腐剂.
请回答:
(1)苯甲酸含有______种元素.
(2)苯甲酸中氧元素的质量分数为______(结果保留到0.1%). 水心13141年前1
水心13141年前1 -
 来包个ww 共回答了22个问题
来包个ww 共回答了22个问题 |采纳率81.8%(1)苯甲酸(C6H5COOH)是由碳、氢、氧三种元素组成的.
(2)苯甲酸中氧元素的质量分数为
16×2
12×7+1×6+16×2×100%≈26.2%.
故答案为:(1)三;(2)26.2%.1年前查看全部
- 英语翻译山东省兖州市文化西路57号 兖州中医院求英文翻译
 xiaobao501年前3
xiaobao501年前3 -
 彩色生活 共回答了16个问题
彩色生活 共回答了16个问题 |采纳率87.5%Yanzhou traditional Chinese medicine (TCM) hospitals
NO 57 of west Wenhua road,Yanzhou,Shandong province1年前查看全部
- (2014•兖州市)下列有关济宁市土地资源的说法,正确的是( )
(2014•兖州市)下列有关济宁市土地资源的说法,正确的是( )
①土地面积较小,人均占有量却大②地形复杂,有利于农业多种经营
③土壤类型多样,水土流失严重④土地开发利用率较低,后备土地资源充足.
A.①②
B.②③
C.③④
D.①④ abdomen1年前1
abdomen1年前1 -
 花格子布 共回答了27个问题
花格子布 共回答了27个问题 |采纳率85.2%解题思路:(1)济宁市位于我国四大地理区域中的北方地区,从干湿地区来说属于半湿润地区;
(2)济宁市处于华北平原,森林覆盖率较低.①济宁市植被较少,土地面积较小,人口稠密,人均占有量少.故①错误.②济宁市地形复杂,以平原、丘陵为主,有利于农业多种经营.故②正确.③济宁市耕地以旱地为主,土壤类型多样,由于人们的过度开垦,水土流失严重.故③正确.④济宁市经济发达,土地开发利用率较高,后备土地资源不足.故④错误.
故选:B.点评:
本题考点: 山东省.
考点点评: 本题考查济宁市土地资源的利用状况.1年前查看全部
- (2011•兖州市三模)下列装置所示的实验中,能达到实验目的是( )
(2011•兖州市三模)下列装置所示的实验中,能达到实验目的是( )
A.
除去Cl2中的HCl杂质
B.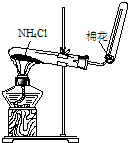
实验室制取NH3
C.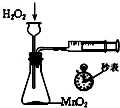
定量测定H2O2分解化学反应速率
D.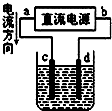
c为粗铜,d为纯铜,溶液为硫酸铜溶液,电解精炼铜 cc我来披101年前1
cc我来披101年前1 -
 bufangqi022 共回答了16个问题
bufangqi022 共回答了16个问题 |采纳率87.5%解题思路:A、洗气装置中导气管应该“长进短出”.
B、加热时氯化铵能分解生成氨气和氯化氢,但冷却时氨气和氯化氢能立即反应生成氯化铵.
C、反应速率不易控制.
D、电解精炼时,粗金属作阳极,纯金属作阴极,电解质溶液含有与阳极材料相同的金属元素.A、氯化氢极易溶于水,食盐水中含有氯离子能抑制氯气的溶解,所以饱和食盐水能洗去氯气中的氯化氢气体,但洗气装置中导气管应该“长进短出”,故A错误.
B、加热时氯化铵能分解生成氨气和氯化氢,这两种气体会在导管中再次化合,堵塞导管,引起爆炸,故B错误.
C、应该用分液漏斗而不是长颈漏斗,分液漏斗可控制液体滴入的量,从而调节反应产生气体的量,故C错误.
D、电解精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液应该含有铜元素,根据图片知,a是电源正极,c是阳极d是阴极,所以c是粗铜,d为纯铜,溶液为硫酸铜溶液,电解精炼铜,故D正确.
故选A.点评:
本题考点: 气体的净化和干燥;原电池和电解池的工作原理;气体发生装置;测定某些化学反应的速率.
考点点评: 本题考查了气体的净化、气体的制取、化学反应速率的测定等知识点,难度不大,注意不能用加热氯化铵的方法制取氨气.1年前查看全部
- (2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3S
 (2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
(2009•兖州市模拟)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)高温 .
(1)该反应的平衡常数表达式为K=K=
,[c(CO)]6 [c(N2)]2 K=;
,[c(CO)]6 [c(N2)]2
(2)若知上述反应为放热反应,则升高温度,其平衡常数值______(选填“增大”、“减小”
或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
(3)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:
若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是______;图中t6时引起变化的条件是______;图中表示平衡混合物中CO的含量最高的一段时间是______. zcqmig1年前1
zcqmig1年前1 -
 yanmingth 共回答了24个问题
yanmingth 共回答了24个问题 |采纳率95.8%解题思路:(1)根据平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积计算;
(2)反应放热,△H<0,根据升高温度平衡移动的方向判断平衡常数的变化;根据速率之比等于化学计量数之比计算反应速率;
(3)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在反应向逆反应之前衡混合物中CO的含量最高;(1)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=
[c(CO)]6
[c(N2)]2,故答案为:K=
[c(CO)]6
[c(N2)]2;
(2)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=[1/3]×v(CO)=[1/3]×18mol•L-1.min‑1=6 mol•L-1.min‑1,
故答案为:减小;6 mol•L-1•min-1;
(3)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,
故答案为:升高温度或缩小体积;加入了催化剂;t3~t4.点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义;用化学平衡常数进行计算.
考点点评: 本题考查化学平衡的移动,难度不大,做题时注意外界条件对化学平衡的影响.1年前查看全部
- (2011•兖州市三模)(1)用质子轰击锂核37Li生成2个α粒子.己知质子质量mp=1.0078u,α粒子的质量ma=
 (2011•兖州市三模)(1)用质子轰击锂核37Li生成2个α粒子.己知质子质量mp=1.0078u,α粒子的质量ma=4.0026u,锂核质量mLi=7.0160u,已知 lu的质量对应的能量为931.5MeV.
(2011•兖州市三模)(1)用质子轰击锂核37Li生成2个α粒子.己知质子质量mp=1.0078u,α粒子的质量ma=4.0026u,锂核质量mLi=7.0160u,已知 lu的质量对应的能量为931.5MeV.
①写出该反应的核反应方程式______,
②核反应中释放出的能量为______.
(2)如图1所示,在光滑水平面上的两小球发生正碰.小球的质量分别为m1和m2.图2为它们碰撞后的s-t 图象.已知m1=0.1kg.求m2的质量. StabbingTea1年前1
StabbingTea1年前1 -
 wgh1975 共回答了15个问题
wgh1975 共回答了15个问题 |采纳率93.3%解题思路:(1)根据质量数和电荷数守恒可正确书写出该核反应方程,算出亏损质量,依据E=mc2,可以求得释放的核能.
(2)两球碰撞过程中动量守恒,根据它们碰撞前后的s-t 图象可以求出碰撞前后速度大小关系,然后根据动量守恒方程即可正确求解.(1)根据题意可知该反应的核反应方程式:37Li+11H→224He;
根据质能方程得:E=(mLi+mp−2mα) c2
代入数据得:E=17.3MeV
故答案为:37Li+11H→224He,17.3MeV.
(2)图2可以计算出碰前m1的速度v1=4m/s
碰后的速度v1′=-2m/s
由动量守恒m1v1+m2v2=m1v′1+m2v2′
解之得m2=0.3 kg
故m2的质量为 m2=0.3 kg.点评:
本题考点: 动量守恒定律;匀变速直线运动的图像;原子核的人工转变.
考点点评: 本题比较简单考查了核反应方程、核能计算、动量守恒等基础知识,越是简单基础问题,越要加强理解和应用,为解决复杂问题打下基础.1年前查看全部
- (2011•兖州市三模)如图所示,质量为m的质点静止地放在半径为R的半球体上,质点与半球体间的动摩擦因数为μ,质点与球心
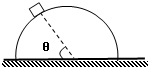 (2011•兖州市三模)如图所示,质量为m的质点静止地放在半径为R的半球体上,质点与半球体间的动摩擦因数为μ,质点与球心的连线与水平地面的夹角为θ,则下列说法正确的是( )
(2011•兖州市三模)如图所示,质量为m的质点静止地放在半径为R的半球体上,质点与半球体间的动摩擦因数为μ,质点与球心的连线与水平地面的夹角为θ,则下列说法正确的是( )
A.地面对半球体的摩擦力方向水平向左
B.质点对半球体的压力大小为mgcosθ
C.质点所受摩擦力大小为mgsinθ
D.质点所受摩擦力大小为mgcosθ killyouxp1年前1
killyouxp1年前1 -
 sigma38 共回答了15个问题
sigma38 共回答了15个问题 |采纳率100%解题思路:以整体为研究对象可得出地面对半球体的摩擦力;以质点为研究对象,对质点进行受力分析,由共点力的平衡可得出质点受到的摩擦力及支持力,由牛顿第三定律可得出半球体受到的压力.A、以整体为研究对象,整体处于静止状态,而水平方向不受外力,故半球体不受地面的摩擦力;故A错误;
B、对质点受力分析,质点受重力、支持力及摩擦力,三力作用下物体处于平衡状态,则合力为零,质点对球面的压力为mgsinθ,故B错误;
C、摩擦力沿切线方向,在切线方向重力的分力与摩擦力相等,即f=mgcosθ,故C错误,D正确;
故选D.
点评:
本题考点: 共点力平衡的条件及其应用;静摩擦力和最大静摩擦力;力的合成与分解的运用.
考点点评: 对于圆面上的物体,此支持力沿径向方向,摩擦力沿切线方向.1年前查看全部
- (2009•兖州市模拟)具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
(2009•兖州市模拟)具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
A.
B.
C.
D.
 yishuihan3121年前1
yishuihan3121年前1 -
 冬天里的懒虫 共回答了15个问题
冬天里的懒虫 共回答了15个问题 |采纳率86.7%解题思路:A、酒精灯必须用火柴点燃,千万不能用燃着的酒精灯去点燃另一只酒精灯;
B、根据天平称量物质数值的准确度来回答;
C、根据加热试管中液体的方法来回答;
D、根据量取液体的体积来选择合适规格的量筒.A、用燃着的酒精灯去点燃另一只酒精灯,火焰会进入灯内,引起危险事故,应用火柴点燃酒精灯,故A错误;
B、天平只能读到小数点后面一位,不会精确到小数点后面两位,故B错误;
C、给液体加热时,试管内液体超过其体积的三分之一,否则加热可能沸腾溅出,影响实验结果,并且试管要和桌面成45°角倾斜,故C正确;
D、量取9.5mL的液体应该用10mL的量筒,用100mL的量同时会导致误差太大,故D错误.
故选C.点评:
本题考点: 物质的溶解与加热;计量仪器及使用方法.
考点点评: 本题主要考查一些实验操作注意事项的知识,要求学生在平时的学习过程中多积累多动手,熟练应用.1年前查看全部
- (2011•兖州市三模)(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生
(2011•兖州市三模)(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g)⇌2SO3 (g);△H=-196kJ•mol-1.2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ.请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化
D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为______;该条件下反应的平衡常数K=______(精确到小数点后两位)
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
再通入1.6molSO2、0.8molO2、0.4molSO3,______;再通入0.2molSO2、0.2molSO3,______.
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等.已知25℃时,Ksp(CaSO4)=7.10×10-5.向0.100L 含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将______. 耶律撒冷1年前1
耶律撒冷1年前1 -
 drunkard_yj 共回答了15个问题
drunkard_yj 共回答了15个问题 |采纳率93.3%解题思路:(1)①化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
②平均反应速率v=[△c/△t],平衡常数K=
;[SO3]2 [SO2]2[O2]
③根据化学平衡的影响因素来回答;
④根据Qc和K之间的关系来回答;
(2)根据沉淀溶解平衡和Ksp的影响因素来回答.(1)①化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变.
A.对于反应前后体积变化的反应,容器内压强不再发生变化,说明反应达到平衡状态,故A正确;
B.SO2的体积分数不再发生变化,说明反应达到平衡状态,故B正确;
C.反应前后气体质量守恒,容器内气体质量不再发生变化,不能说明达到平衡状态,故C错误;
D.反应前后气体质量守恒,容器内气体质量不发生变化,容器体积保持不变,所以容器内气体密度不会发生变化,故D错误.
故选AB;
②根据热化学方程式知道,当放出热量为39.2kJ时,生成三氧化硫的量为[2×39.2/196]=0.4mol,则消耗二氧化硫和氧气的量分别是0.4mol和0.2mol,所以生成SO3平均反应速率为v=[△c/△t]=
0.4mol
2L
2min=0.1mol/(L/min),达到化学平衡时二氧化硫、氧气、三氧化硫的量分别是:[2mol-0.4mol/2L]=0.8mol/L,[1mol-0.2mol/2L]=0.4mol/L,[0.4mol/2L]=0.2mol/L,所以K=
[SO3]2
[SO2]2[O2]=
0.22
0.82•0.4≈0.16L/mol,故答案为:0.1mol/(L•min);0.16L/mol;
③A.向容器中通入少量O2,即增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,故A正确;
B.向容器中通入少量SO2,即增大二氧化硫的浓度,能使平衡正向移动但是能降低了SO2转化率,故B错误;
C.使用催化剂,不会影响化学平衡的移动,也不会改变二氧化硫的转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高SO2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误;
故选AD;
(4)再通入1.6molSO2、0.8molO2、0.4molSO3,和原来平衡的量一样再投料,则相当于压缩体系为原体积的一半,所以体系的压强增大,平衡正向移动,故答案为:向右;
②再通入0.2molSO2、0.2molSO3,则Qc=
C(SO3)2
C(SO2)2•C(O2)=
(
0.6
2)2
(
1.8
2)2×
0.8
2≈1.39L/mol>K,所以平衡向左移动,故答案为:向左;
(2)根据沉淀溶解平衡:CaSO4(s)⇌Ca2+(aq)+SO42-(aq),当增大钙离子的浓度时,平衡向逆反应方向移动,所以硫酸钙的固体质量减小,但是Ksp(CaSO4)只受温度的影响,所以此时Ksp(CaSO4)不变,故答案为:增大;不变.点评:
本题考点: 化学平衡状态的判断;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查学生化学平衡的移动以及沉淀溶解平衡的移动知识,可以根据所学内容来回答,难度不大.1年前查看全部
- (2014•兖州市)读某地区等高线地形图,回答4~5题.
(2014•兖州市)读某地区等高线地形图,回答4~5题.

4.图中①的海拔大约在( )米以上.
5.图中公路的走向是( )
A.南北走向
B.东西走向
C.东北-西南走向
D.西北-东南走向 瑞江花园1年前1
瑞江花园1年前1 -
 浮华and童话 共回答了21个问题
浮华and童话 共回答了21个问题 |采纳率85.7%解题思路:地图上的方向有不同的表示方式.在有指向标的地图上,用指向标指示方向,指向标箭头的指向一般为北方;在有经纬网的地图上,用经纬网定向,纬线指示东西方向,经线指示南北方向;没有指向标与经纬网的地图,通常采用“上北下南,左西右东”的规定确定方向.在有指向标的地图上,用指向标指示方向,指向标箭头的指向一般为北方;据此读图可知,图中公路的走向是南北走向.
故选:A.点评:
本题考点: 等高线地形图的判读.
考点点评: 本题主要考查了地图上判断方向的方法,属基础题.1年前查看全部
- (2011•兖州市三模)下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
(2011•兖州市三模)下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素o的基态原子电子排布式______,g元素的价电子的四个量子数依次是3,0,0,+[1/2](或-[1/2])3,0,0,+[1/2](或-[1/2]).
(2)d的氢化物中心原子的杂化方式是______.
(3)o元素所在族的符号是______.
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是______.
(5)f、l、q的氢化物中沸点最高的是______.(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点______jc晶体的熔点(填“大于”“等于”“小于”)原因是______. windgod_sz1年前1
windgod_sz1年前1 -
 Katey_onion 共回答了10个问题
Katey_onion 共回答了10个问题 |采纳率100%解题思路:根据元素所在周期表中的位置可知元素的种类,根据元素对应的结构、单质及化合物的性质解答:
(1)o为Sc元素,原子序数为21,根据能量最低原理书写电子排布式,g为Na元素,价层电子为3s1,以此判断价电子的四个量子数;
(2)d为N元素,氢化物为NH3,根据价层电子对判断杂化类型;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物;
(5)f为F元素,HF中中含有氢键,沸点最高;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,根据共价键的键能大小比较熔点.(1)o为Sc元素,原子序数为21,基态原子的电子排布式为1s22s22p63s23p63d14s2,g为Na元素,价层电子为3s1,
其中n=3,l=0,m=0,ms=+[1/2](或-[1/2]),
故答案为:1s22s22p63s23p63d14s2;3,0,0,+[1/2](或-[1/2]);
(2)d为N元素,氢化物为NH3,分子中含有3个δ键,一个孤电子对,所以为sp3杂化,故答案为:sp3;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族,故答案为:ⅢB;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物,并且含有配位键,
故答案为:离子键,共价键,配位键;
(5)f为F元素,HF中中含有氢键,沸点最高,故答案为:HF;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高,
故答案为:小于;因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表与元素周期律的综合应用,题目难度中等,本题注意杂化轨道和晶体熔沸点的比较,易错点为配位键,注意不要漏答.1年前查看全部
- (2011•兖州市三模)下列说法正确的是( )
(2011•兖州市三模)下列说法正确的是( )
A.某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COO-)
C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大
D.0.2mol•L-1NH4NO3和0.lmol•L-1NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) 达罗科血橙1年前1
达罗科血橙1年前1 -
 蚂蚁的洞穴 共回答了20个问题
蚂蚁的洞穴 共回答了20个问题 |采纳率90%解题思路:A.H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),说明HA-水解程度大于电离程度;
B.CH3COOH为弱电解质,不能完全电离;
C.加入一定量的生石灰,消耗水,析出Ca(OH)2,在相同温度下仍为饱和溶液;
D.应为c(NO3-)>c(NH4+).A.H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),说明HA-水解程度大于电离程度,则溶液呈碱性,故A正确;
B.CH3COOH为弱电解质,不能完全电离2c(Na+)>c(CH3COO-),故B错误;
C.加入一定量的生石灰,消耗水,析出Ca(OH)2,在相同温度下仍为饱和溶液,溶液浓度不变,故C错误;
D.0.2mol•L-1NH4NO3和0.lmol•L-1NaOH溶液等体积混合后,生成NH2•H2O部分电离,应为c(NO3-)>c(NH4+),故D错误.
故选A.点评:
本题考点: 离子浓度大小的比较;盐类水解的应用.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意把握弱电解质的电离特点,注意C项饱和溶液的特点.1年前查看全部
- (2011•兖州市三模)如图所示,质量分别为m1和m2的两个小球A、B,带有等量异种电荷,通过绝缘轻弹簧相连接,置于绝缘
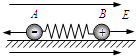 (2011•兖州市三模)如图所示,质量分别为m1和m2的两个小球A、B,带有等量异种电荷,通过绝缘轻弹簧相连接,置于绝缘光滑的水平面上,突然加一水平向右的匀强电场后,两小球A、B将由静止开始运动,在以后的运动过程中,对两小球A、B和弹簧组成的系统,下列说法中正确的是(设整个过程中不考虑电荷间库仑力的作用且弹簧不超过弹性限度)( )
(2011•兖州市三模)如图所示,质量分别为m1和m2的两个小球A、B,带有等量异种电荷,通过绝缘轻弹簧相连接,置于绝缘光滑的水平面上,突然加一水平向右的匀强电场后,两小球A、B将由静止开始运动,在以后的运动过程中,对两小球A、B和弹簧组成的系统,下列说法中正确的是(设整个过程中不考虑电荷间库仑力的作用且弹簧不超过弹性限度)( )
A.由于电场力对球A和球B做功为0,故小球电势能总和始终不变
B.由于两个小球所受电场力等大反向,故系统机械能守恒
C.当弹簧长度达到最大值时,系统机械能最大
D.当小球所受电场力与弹簧的弹力大小相等时,系统动能最大 己由于1年前1
己由于1年前1 -
 shraohui 共回答了16个问题
shraohui 共回答了16个问题 |采纳率93.8%解题思路:加电场后,A小球受到向左的电场力,B小球受到向右的电场力,电场力做正功,电势能减小,小球的动能和弹簧的弹性势能都变大.A、加电场后,A小球受到向左的电场力,B小球受到向右的电场力,电场力做正功,电势能减小,故A错误;
B、加电场后,A小球受到向左的电场力,B小球受到向右的电场力,两小球远离过程中,电场力做正功,电势能减小,小球的动能和弹簧的弹性势能都变大,故B错误;
C、当弹簧长度达到最大值时,电场力做功最多,电势能减小最大,故系统机械能最大,故C正确;
D、两小球远离过程,先做加速度不断减小的加速运动,再做加速度不断变大的减速运动,故当电场力与弹力平衡时,加速度为零,动能最大,故D正确;
故选CD.点评:
本题考点: 机械能守恒定律;功能关系;电势能.
考点点评: 本题关键要明确两个小球的速度的变化情况,两小球都是先做加速度不断减小的加速运动,再做加速度不断变大的减速运动.1年前查看全部
- (2014•兖州市)观察地理实验地理实验可以通过演示过程、观察现象,获得生动而直观的感性认识.用打开的手电筒模拟“太阳”
 (2014•兖州市)观察地理实验地理实验可以通过演示过程、观察现象,获得生动而直观的感性认识.用打开的手电筒模拟“太阳”,将地球仪放置在手电筒前方,拨动地球仪,演示地球自转.据此完成1~3题.
(2014•兖州市)观察地理实验地理实验可以通过演示过程、观察现象,获得生动而直观的感性认识.用打开的手电筒模拟“太阳”,将地球仪放置在手电筒前方,拨动地球仪,演示地球自转.据此完成1~3题.
1.关于实验过程,叙述正确的是( )
2.此实验能较好地演示( )
3.拨动时还可以发现世界海陆分布的规律是( )
A.七分陆地三分海洋
B.北半球陆地面积大于海洋面积
C.北极周围是一片海洋
D.东半球陆地面积大于海洋面积 风格_9731年前1
风格_9731年前1 -
 宇峰狂 共回答了14个问题
宇峰狂 共回答了14个问题 |采纳率85.7%解题思路:人们常用“七分海洋,三分陆地”粗略地说明全球海洋和陆地面积的比例.由于海洋面积比陆地面积大得多,宇航员从太空看到的地球表面,大部分是蔚蓝色的.因此,把地球称为“水的行星”,一点儿也不过分.人们常用“七分海洋,三分陆地”粗略地说明全球海洋和陆地面积的比例.不管是南北半球,还是东西半球,陆地面积都小于海洋面积.北极地区指北极圈以北的区域,以北冰洋为中心、还包括亚欧大陆和北美大陆的北部及一些岛屿.
故选:C.点评:
本题考点: 四大洋的的地理分布和概况.
考点点评: 考查世界的海陆分布,要理解记忆.1年前查看全部
- (2009•兖州市模拟)如果把分式[10x/x+y]中的x、y都扩大到原来的10倍,则分式的值( )
(2009•兖州市模拟)如果把分式[10x/x+y]中的x、y都扩大到原来的10倍,则分式的值( )
A.扩大100倍
B.扩大10倍
C.不变
D.缩小到原来的[1/10] ronaxu1年前1
ronaxu1年前1 -
 gojorare 共回答了21个问题
gojorare 共回答了21个问题 |采纳率85.7%解题思路:把分式[10x/x+y]中的x、y都扩大到原来的10倍,就是用x变成10x,y变成10y.分别用10x,10y代替式子中的x、y,看所得的式子与原式之间的关系.分别用10x,10y代替式子中的x、y
得[10×10x/10x+10y]=[10×10x
10(x+y)=
10x/x+y],
可见新分式与原分式相等.
故选C.点评:
本题考点: 分式的基本性质.
考点点评: 解题的关键是抓住分子、分母变化的倍数.规律总结:
解此类题首先把字母变化后的值代入式子中,然后约分,再与原式比较,最终得出结论.1年前查看全部
- (2011•兖州市三模)菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,
(2011•兖州市三模)菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,
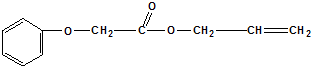
其的合成路线如下: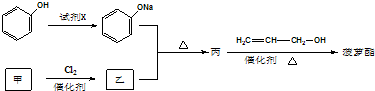
提示: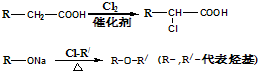
(1)有机物乙中所含有的官能团是______
(2)上述合成菠萝酯的过程中,下列反应类型中未涉及到的是______.
A.取代反应B.加成反应C.消去反应D.中和反应
(3)菠萝酯有多种同分异构体,写出同时满足下列三个条件的同分异构体的结构简式______.(写出其中的一种即可)
①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色
②除苯环外无其他环状基团
③能与NaOH溶液反应,且1mol该同分异构体最多能与2molNaOH反应
(4)写出由丙→菠萝酯的化学化学方程式.______. mntuku1231年前1
mntuku1231年前1 -
 ketav123 共回答了21个问题
ketav123 共回答了21个问题 |采纳率90.5%解题思路:由菠萝酯和丙烯醇的反应可知丙为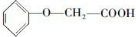 ,由题给信息可知乙为ClCH2COOH,甲为CH3COOH,结合有机物官能团的性质和题目要求可解答该题.
,由题给信息可知乙为ClCH2COOH,甲为CH3COOH,结合有机物官能团的性质和题目要求可解答该题.
由菠萝酯和丙烯醇的反应可知丙为
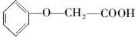 ,由题给信息可知乙为ClCH2COOH,甲为CH3COOH,
,由题给信息可知乙为ClCH2COOH,甲为CH3COOH,
(1)乙为ClCH2COOH,含有的官能团为羧基和氯原子,故答案为:羧基和氯原子;
(2)述合成菠萝酯的过程中,涉及到的反应有取代反应(包括酯化反应)、苯酚和碱的中和反应,不涉及消去和加成反应,故答案为:BC;
(3)①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色,说明分子中不含酚羟基;
②除苯环外无其他环状基团,则侧链为链状;
③能与NaOH溶液反应,说明含有羧基或酯基,且1mol该同分异构体最多能与2molNaOH反应,说明应含有酯基,水解能生成酚羟基,则可能的结构为 ,
,
故答案为: ;
;
(4)丙为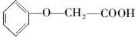 ,与CH2=CH-CH2OH发生酯化反应,反应的方程式为
,与CH2=CH-CH2OH发生酯化反应,反应的方程式为 ,
,
故答案为: .
.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,题目难度不大,本题注意以丙为解答该题的突破口,答题时注意把握题给信息,注意养成仔细审题的良好习惯.1年前查看全部
- (2009•兖州市模拟)浓H2SO4和木炭在加热时发生反应的化学方程式是
 (2009•兖州市模拟)浓H2SO4和木炭在加热时发生反应的化学方程式是
(2009•兖州市模拟)浓H2SO4和木炭在加热时发生反应的化学方程式是
2H2SO4(浓)+C
CO2↑+2H2O+2SO2↑△ .
请从图中选择所需用的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置.现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选.(连接和固定仪器用的玻璃管、胶管、铁管、铁架台及加热装置等均略去)将所选的仪器按连接顺序由上至下依次填入下表,并完成表格相应内容
所选用仪器的名称(填字母) 加入的试剂名称 该装置作用 反应器(或发生气体) 检出水 检出二氧化硫 酸性高锰酸钾溶液 检出二氧化碳  nfsli1年前1
nfsli1年前1 -
 莫说船已漏 共回答了22个问题
莫说船已漏 共回答了22个问题 |采纳率90.9%解题思路:该反应为固液加热,故选用C带有支管的试管做反应容器,加入浓硫酸和木炭;检验产物水可用无水硫酸铜;检验二氧化硫,可用品红溶液;在洗气瓶中装有酸性高锰酸钾溶液用来吸收余下二氧化硫;在洗气瓶中装有澄清石灰水溶液用来检验二氧化碳.该反应为固液加热,故选用C做反应容器,加入浓硫酸和木炭;检验产物水可选用B(U形管),内装无水硫酸铜;
检验二氧化硫,可用洗气瓶A装有品红溶液;在洗气瓶中装有酸性高锰酸钾溶液用来吸收余下二氧化硫;在洗气瓶中装有澄清石灰水溶液用来检验二氧化碳.
故答案为:
所选用仪器的名称(填字母) 加入的试剂名称 该装置作用
C 浓硫酸和木炭
B 无水硫酸铜
A 品红溶液
A 吸收余下二氧化硫
A 澄清石灰水点评:
本题考点: 浓硫酸的性质实验.
考点点评: 本题考查浓硫酸的性质,掌握相关产物的检验是解题的关键.1年前查看全部
- (2009•兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
(2009•兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
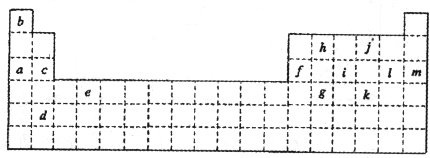
(1)写出g元素在周期表中的位置:______.
(2)下列______(填写编号)组元素的单质可能都是电的良导体.
①a、c、h②b、g、k③c、h、l④d、e、f
(3)现有下列短周期元素性质的数据:
试回答下列问题:元素编号
元素性质① ② ③ ④ ⑤ ⑥ ⑦ 原子半径(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 最高增化合价 +2 +1 +5 +7 +1 +5 最低化合价 -2 -3 -1 -3
I.上述元素中①、②、⑥分别为______,上述元素中处于第二周期的有______(以上均用元素符号表示).
II.元素④与元素⑦相比较,气态氢化物较稳定的是______(填化学式).
III.工业上获取⑤单质的主要化学反应方程式为:2NaCl+2H2O
2NaCl+Cl2↑+H2↑通电 .2NaCl+2H2O.
2NaCl+Cl2↑+H2↑通电 .
IV.⑤和⑥形成的化合物中化学键是______.
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明). 唏嘘哦1年前1
唏嘘哦1年前1 -
 QQ28440 共回答了19个问题
QQ28440 共回答了19个问题 |采纳率78.9%解题思路:(1)根据元素周期表中元素的分布知识来回答;
(2)根据元素周期表中元素周期和族的分布知识来回答;
(3)Ⅰ、元素的最高正价=最外层电子数,最高正价+|最低负价|=8,结合原子半径的递变规律来确定元素,并确定所在的周期;
Ⅱ、同周期元素原子,从左到右氢化物的稳定性逐渐增强,同主族从下到上氢化物的稳定性逐渐增强;
Ⅲ、电解饱和食盐水获得氢氧化钠、氯气以及氢气;
Ⅳ、根据形成化合物的成键元素来确定化学键类型:活泼金属和活泼非金属间形成的化学键大多为离子键;
Ⅴ、硝酸铵中的铵根离子水解,导致溶液显酸性.(1)在周期表中,g位于第四行,第14列,所以是第四周期,第ⅣA族的元素,故答案为:第四周期,第ⅣA族;
(2)根据元素在周期表中的分布,可知a是Na,c是Mg,f是Al,h是C,e是Ti,d是Sr,这些均能导电,故答案为:①④;
(3)+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;⑧最高正价+3价,无负价,只能是IIIA族元素,而原子半径⑧>④,故⑧只能是位于第三周期第IIIA族的Al元素;①的最低负价为-2价,无正价,则①应为第二周期的O元素,②最高正价+2价,无负价,只能是ⅡA族元素,且原子半径⑧<②<⑥,为第三周期的Mg元素.
Ⅰ、上述元素中①、②、⑥分别为O、Mg、Na,处于第二周期的有Li、N、O,故答案为:O、Mg、Na;Li、N、O;
Ⅱ、同一主族元素原子氢化物的稳定性从上到下逐渐减弱,所以稳定性是NH3>PH3,故答案为:NH3;
Ⅲ、工业上获取氯气是通过电解饱和食盐水的方法来获得,化学反应方程式为:2NaCl+2H2O
通电
.
2NaCl+Cl2↑+H2↑,故答案为:2NaCl+2H2O
通电
.
2NaCl+Cl2↑+H2↑;
Ⅳ、氯化钠是含有离子键的离子化合物,故答案为:离子键;
Ⅴ、N最高价氧化物的水化物硝酸和其氢化物氨气反应生成的硝酸铵盐溶液因为铵根离子水解显酸性,故答案为:该盐是硝酸铵,因为其中的铵根离子发生水解反应NH4++H2O⇌NH3•H2O+H+而导致溶液显酸性.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查学生元素周期表中元素的分布和元素周期律知识,可以根据所学知识进行回答,难度不大.1年前查看全部
大家在问
- 1以爱为题写一篇作文,400字左右
- 2Not until yesterday ______ anything about the project that w
- 3在一元二次方程ax2+bx+c=0中,若a+b+c=0,则方程必有一根为______;若a-b+c=0,则方程必有一根为
- 4一个长40厘米的长方体,他的横截面是正方形,如果长增加5厘米,表面积就增加80平方厘米.
- 5whatdoesthewordrisemean什么意思
- 62009年12月7日至18日,世界气候大会在丹麦首都哥本哈根举行,发展低碳经济成为各国的共识。低碳经济是以低能耗、低污染
- 7某校高一的新同学分别乘两辆汽车去市公园游玩.两辆汽车在平直公路上运动,甲车内一同学看见乙车没有运动,而乙车内一同学看见路
- 8球状干燥剂遇水为什么会炸开
- 9The Zhang family ___(live) in a flat in Nanjing.
- 10小明从家骑自行车去县城,去时是上坡,平均每小时行12千米,2.5小时到达,回来时,每小时行20千米,求小明往返一次的平均
- 11(多选题)X、Y、Z为三种不同的短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y
- 12当南极圈及其以南地区出现极夜时,下列城市日出最早的是 [ ] A.乌鲁木
- 13特殊句式:倒装句:何为不可.( )
- 14八月十五 月最圆与潮水最大之间的原因与联系
- 15他喜欢躺在床上听古典音乐.(翻译为英语)
