国防建设必须以( ),( )为基础,要服从国家经济建设大局?A 军事斗争 b综合国力 c d经济实
 sdrsa2022-10-04 11:39:541条回答
sdrsa2022-10-04 11:39:541条回答1军事战略是指()和()a全民皆兵的部署 b战争全局方针 c军事斗争方法 d 指导武装力量建设
2

已提交,审核后显示!提交回复
共1条回复
 M冷酷之心Y 共回答了31个问题
M冷酷之心Y 共回答了31个问题 |采纳率93.5%- 答案是B,D.即综合国力和经济实力
- 1年前
相关推荐
- 金属材料在国防建设中起着重要的作用,如图1为歼-15飞机在辽宁舰上起飞.
 金属材料在国防建设中起着重要的作用,如图1为歼-15飞机在辽宁舰上起飞.
金属材料在国防建设中起着重要的作用,如图1为歼-15飞机在辽宁舰上起飞.
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是______.
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的______共同作用的结果.铁锈的成分主要是______(填化学式).
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是______.
②实验二中,若出现______现象,可证明铁的活动性强于铜,该反应的化学方程式为______.
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,CO2被充分吸收,氧化铁反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为Wg).
①装置A中生成铁的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3,装置C的作用是______.
2Fe+3CO2高温 .
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是______或______.
③设计实验证明锌、铁、铜三种金属的金属活动性强弱,要求写出实验步骤、现象和结论.实验步骤 实验现象 实验结论 ______ ______ ______  wenpi_01年前1
wenpi_01年前1 -
 风铃心语 共回答了15个问题
风铃心语 共回答了15个问题 |采纳率93.3%解题思路:(1)根据铝合金的性质分析;(2)根据铁生锈的条件及锈的主要成分分析回答;(3)①从控制变量的角度进行分析;②根据铁与硫酸铜溶液反应的现象分析回答;(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳;根据一氧化碳能污染空气分析装置C的作用;②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.③根据锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较三种金属的活泼性的大小,采取“三取中”的方法,即取铁丝分别放入硫酸锌溶液和硫酸铜溶液,铁丝不能与硫酸锌溶液发生反应,说明铁的活动性不如锌强;铁丝能置换出硫酸铜中的铜,说明铁的活动性比铜强.(1)因铝合金材质强度大、质量轻,所以铝合金可用于制造飞机的外壳;
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;锈的主要成分是Fe2O3•xH2O.
(3)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
②实验二中,若铁丝表面出现红色物质,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
高温
.
2Fe+3CO2;由于一氧化碳能污染空气,所以装置C的作用是:将CO燃烧防止其污染空气.
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
③由于锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较锌、铁、铜三种金属的活动性强弱关系,常采用“三取中”的方法,即取两根光亮的铁丝,然后分别放入盛有硫酸锌和硫酸铜溶液的两支试管中,放入硫酸锌溶液的铁丝无明显变化,说明铁的活动性不如锌强;放入硫酸铜溶液的铁丝表面出现红色物质,说明铁的活动性比铜强.可以得出活动性由强到弱为锌>铁>铜.故实验方案如下:
实验步骤实验现象实验结论
分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象.浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化.金属活动性顺序:
Zn>Fe>Cu故答案为:(1)强度大、质量轻;(2)氧气、水;Fe2O3•xH2O;(3)①选取的酸的种类不同;②铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;(4)Fe2O3+3CO
高温
.
2Fe+3CO2;将CO燃烧防止其污染空气.②反应后装置A中药品的质量;测出反应前后装置B增加的质量. ③见上表.点评:
本题考点: 合金与合金的性质;金属活动性的探究;一氧化碳还原氧化铁;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度较大,综合性较强.掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.1年前查看全部
- Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
(1)在恒温恒容密闭容器中进行的合成氨反应,N2(g)+3H2(g)⇌2NH3(g),下列能表示达到平衡状态的是______(填序号).
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
Ⅱ、能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为______;
②100℃时反应的平衡常数为______.
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应CO(g)+2H2(g)⇌CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的[1/2],其他条件不变,对平衡体系产生的影响是______(填字母序号).
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(3)已知:反应:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-116kJ/mol,H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
Ⅱ.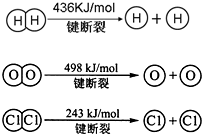
请回答:
①H2与O2反应生成气态水的热化学方程式是______.
②断开1mol H-O 键所需能量约为______kJ. zmcj1年前1
zmcj1年前1 -
 浊飘 共回答了18个问题
浊飘 共回答了18个问题 |采纳率83.3%解题思路:I、(1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不再发生变化,由此衍生的一些物理性不变,以此解答该题;
II、(1)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,依据反应速率概念计算;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的[1/2],其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行;(3)①依据热化学方程式的方法和注意问题书写;标注物质聚集状态和焓变;
②依据氢气和氧气反应生成水的焓变和化学键的键能计算,△H=拆化学键吸收的能量-形成化学键放出的能量.I、(1)a.该反应随反应进行,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡,故a正确;
b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确;
d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,故d错误;
e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,故e错误;
故答案为:a c;
II、(1)①)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H2表示该反应的平均反应速率=
1.2mol
100L
5min=0.0024mol/L•min;故答案为:0.0024mol/L•min;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
[CO][H 2]3
[CH4][H2O]=
0.004×0.0123
0.006×0.016=7.2×10-5(mol/L)2
故答案为:7.2×10-5(mol/L)2;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的[1/2],其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行.
A、体积减小,c(H2)增大,故A错误;
B、压强增大,正逆反应速率都加快,故B错误;
C、体积减小,压强增大,平衡正向进行,CH3OH的物质的量增加,故C正确;
D、体积减小,压强增大,平衡正向进行,重新平衡时
c(H2)
c(CH3OH)减小,故D正确;
E、平衡常数K只随温度的而变化,故E错误;
故选CD;
(3)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol,
依据盖斯定律:①+②×2得到热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol;
②依据反应的热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,
则得到H-O的键能=463.5kJ,故答案为:463.5.点评:
本题考点: 工业合成氨;热化学方程式;化学平衡常数的含义;化学平衡的影响因素;化学反应速率和化学计量数的关系.
考点点评: 本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,键能计算焓变的方法,电子式的书写方法,难度较大.1年前查看全部
- 金属材料在国防建设中起着重要的作用,图1为歼-15飞机在辽宁舰上起飞.
金属材料在国防建设中起着重要的作用,图1为歼-15飞机在辽宁舰上起飞.

(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是_______
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的_____________共同作用的结果.工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为___________________
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是____________________②实验二中,若出现___________________现象,可证明铁的活动性强于铜,该反应的化学方程式为____________________
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg).
①装置A中生成铁的化学方程式为__________,装置B中发生反应的化学方程式为____________.
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是____________或___________. 我是哈哈1211年前1
我是哈哈1211年前1 -
 圆布隆冬 共回答了18个问题
圆布隆冬 共回答了18个问题 |采纳率94.4%1年前查看全部
- 英语翻译新时期提高军人教育水平对我国国防建设的重要意义【摘要】 “实现军队建设转型,关键是人才素质转型”.造就高素质新型
英语翻译
新时期提高军人教育水平对我国国防建设的重要意义
【摘要】 “实现军队建设转型,关键是人才素质转型”.造就高素质新型军事人才,是新时期军队培养军人面临的新的课题和发展机遇.新世纪新阶段加强我国国防建设要树立大国防观念、贯彻积极防御的国防战略方针、国防建设要以提高军队现代化为中心、走独立自主、自力更生的“跨越式”发展道路.
【关键字】创新型军事人才;现代化;国防教育 wsjnjp1年前1
wsjnjp1年前1 -
 --Macrohard-- 共回答了18个问题
--Macrohard-- 共回答了18个问题 |采纳率83.3%New period improves level of military education for our country national defence construction significance[ Abstract ] "the military construction transformation,the key is a talent quality transformation".Creating high-quality military personnel of a new type,is new period Army soldiers in training new problem and opportunity of development.The new stage of the new century to strengthen our national defense construction to establish a major defense concept,carry out active defense defense strategy,national defence construction to improve the military modernization as the center,go stand on one's own,rely through one's own efforts "span type" development road.[ Key words ] innovative military talents; modernization; national defense education1年前查看全部
- 【初二中国历史下】中国现代国防建设的重点是什么?
 louisxia1年前1
louisxia1年前1 -
 鸟飞f 共回答了17个问题
鸟飞f 共回答了17个问题 |采纳率94.1%国防现代化建设的重点是武装力量的现代化建设.武装力量是国防的主体,是保障国家安全的支柱.
国防现代化的关键是科学技术的现代化.1年前查看全部
- 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N 2 O 4 反应生成N 2 和水蒸气。
已知:①N 2 (g)+2O 2 (g)=N 2 O 4 (l) ΔH 1 =-19.5 kJ·mol -1
②N 2 H 4 (l)+O 2 (g)=N 2 (g)+2H 2 O(g) ΔH 2 =-534.2 kJ·mol -1
写出肼和N 2 O 4 反应的热化学方程式________________________;
(3)已知H 2 O(l)=H 2 O(g) ΔH 3 =+44 kJ·mol -1 ,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。 182yes1年前1
182yes1年前1 -
 wangkun88 共回答了23个问题
wangkun88 共回答了23个问题 |采纳率95.7%(1)5(2)2N 2 H 4 (l)+N 2 O 4 (l)=3N 2 (g)+4H 2 O(g)ΔH=-1 048.9 kJ·mol -1 ;(3)N 2 H 4 (l)+O 2 (g)=N 2 (g)+2H 2 O(l)ΔH=-622.2 kJ·mol -1 (4)N 2 H 4 ...1年前查看全部
- (2014•闵行区二模)氮元素广泛存在于自然界中,对人类生命和生活具有重要意义.含氮元素的化合物在工业生产和国防建设中都
(2014•闵行区二模)氮元素广泛存在于自然界中,对人类生命和生活具有重要意义.含氮元素的化合物在工业生产和国防建设中都有广泛的应用.
(1)氮元素原子核外有______个未成对电子,最外层有______种能量不同的电子.PH3分子的空间构型为______,是______分子.(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是______(填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体. 宇宙飞鸟1年前1
宇宙飞鸟1年前1 -
 7594592 共回答了15个问题
7594592 共回答了15个问题 |采纳率93.3%(1)N原子核外有3个未成对电子;原子核外电子有几种能级就有几种不同能量的电子,该原子核外有1s、2s、2p三种能量的电子,所以该原子最外层有2种不同能量的电子;PH3分子的空间构型和氨气分子构型相同,为三角锥形结构,该分子的正负电荷重心不重合,则为极性分子,故答案为:3;2;三角锥形;极性;
(2)a.氢化物的稳定性越强,则非金属的非金属性越强,NH3比PH3稳定性强,则N元素非金属性大于P,故正确;
b.元素最高价氧化物的水化物酸性越强,该元素的非金属性越强,与其氧化性无关,故错误;
c.非金属单质与氢气反应越容易,则该非金属的非金属性越强,氮气与氢气能直接化合,磷与氢气很难直接化合,所以N元素的非金属大于P,故正确;
d.非金属单质的状态与非金属元素的非金属性强弱无关,故错误;
故选a c.1年前查看全部
- 结合军事理论课,谈谈你对我国国防建设的认识
结合军事理论课,谈谈你对我国国防建设的认识
听说你怀孕了
1.谈一谈我国国防建设的历史作用和意义.
2.谈一谈我国国防建设面临的复杂环境.
3谈一谈我国国防建设对实现伟大中国梦的重要作用和意义.
4.不少于1000字 diaodiaoing1年前1
diaodiaoing1年前1 -
 kunjie01 共回答了17个问题
kunjie01 共回答了17个问题 |采纳率100%巩固国防,抵抗侵略,制止武装颠覆,保卫国家的主权、统一、领土完整和安全.这是中国国防政策的基本目标,也是宪法赋予中国武装力量的主要职责.中国努力避免和制止战争,努力用和平方式解决国际争端和历史遗留问题.但是,在霸权主义和强权政治依然存在的情况下,国家必须具有用军事手段捍卫主权、统一、领土完整和安全的能力.中国的国防现代化建设完全是为了自卫,是保障国家现代化建设和安全的需要.中国武装力量的规模是与保卫国家安全和利益的需要相适应的.中国独立自主、自力更生地建设和巩固国防.国防建设服从和服务于国家经济建设大局,国防建设与经济建设协调发展.这是中国国防建设一个长期的基本方针.国防现代化需要国家的经济力量和技术力量的支持,国防现代化水平只能随着国家经济实力的增强而逐步提高.国家坚持以经济建设为中心,国防建设必须服从和服务于这个大局,军队积极参加和支援国家经济建设.国家在集中力量进行经济建设的同时,加强国防建设,促进国防建设与经济建设协调发展.贯彻积极防御的军事战略方针.中国在战略上实行防御、自卫和后发制人的原则,坚持“人不犯我,我不犯人,人若犯我,我必犯人.”中国拥有少量核武器完全是出于自卫的需要.中国坚持全民自卫原则和人民战争的战略思想,增强全民国防观念,完善国防动员体制,加强国防后备力量建设;立足现有武器装备,继承和发扬优良传统;适应世界军事领域的深刻变革,做好现代技术特别是高技术条件下的防卫作战准备.走有中国特色的精兵之路.中国军队努力加强质量建设,走有中国特色的精兵之路,目标是建设一支有中国特色的革命化、现代化、正规化的人民军队.减少数量,提高质量,是军队现代化建设的一条基本方针.中国军队依靠科技强军,实现军队由数量规模型向质量效能型、由人力密集型向科技密集型的转变;按照现代战争的特点,努力提高武器装备现代化建设的水平,改革和完善军队的体制编制,改进部队的训练和院校教育的内容与方法.维护世界和平,反对侵略扩张行为.中国坚持和平共处五项原则,独立自主地处理对外军事关系,开展军事交流与合作,不搞霸权主义,不搞军事集团,不进行军事扩张,不在国外驻军或建立军事基地.中国反对军备竞赛,主张根据公正、合理、全面、均衡的原则,实行有效的军备控制和裁军.中国支持国际社会采取的有利于维护世界和地区和平、安全、稳定的活动,支持国际社会为公正合理地解决国际争端、军备控制和裁军所做的努力.1年前查看全部
- 改革开放以来,我国在政治、经济、国防建设、外交、科技教育、文化、社会生活等方面均发生了巨大的变化,
改革开放以来,我国在政治、经济、国防建设、外交、科技教育、文化、社会生活等方面均发生了巨大的变化,
取得了卓越的成就,请你选两个方面,举例用五个事件来说明我国改革开放的成就. 无声快语话满楼1年前1
无声快语话满楼1年前1 -
 275545681 共回答了13个问题
275545681 共回答了13个问题 |采纳率69.2%加入WTO
举办08奥运会
港澳回归
神舟上天
蛟龙入海
“上合”成立1年前查看全部
- 我国国防建设的主要任务是什么
 wendy_hdx1年前1
wendy_hdx1年前1 -
 12101920 共回答了19个问题
12101920 共回答了19个问题 |采纳率94.7%中国的国防的主要任务是由中国的国家利益、社会制度、对外政策和历史文化传统等因素所决定的.
维护国家利益,一是要始终把维护国家的主权、统一、领土完整和安全放在第一位,把保卫祖国、抵抗侵略、维护统一、反对分裂、作为国防政策的出发点和立足点;二是要为国家的改革开放和发展提供一个和平稳定的内外环境.中国是社会主义国家,并处在社会主义的初级阶段.中国根据自己的国情所选择的社会制度、发展战略和生活方式,不会产生对外侵略扩张的因素,因而也就不会制定扩张性的国防政策.中国始终不渝地奉行独立自主的和平外交政策,不同任何国家或国家集团结盟,主张通过协商和平解决国家间的纠纷和争端,主张在和平共处五项原则基础上同所有国家发展友好合作关系.因此,中国不会对任何别的国家构成威胁,而只能是维护世界和平和地区稳定的重要力量.另外,在中国几千年的历史中,爱和平,重防御,求统一,促进民族团结,共御外侮,始终是中国国防观念的主题.中国的国防政策渊源于这种优良的历史文化传统.中国国防政策对国防的领导力量、国防的基本目标、国家军事战略方针、国防和军队建设的途径、防卫活动的指导原则、对外军事交往及合作的宗旨都作了明确规定.1年前查看全部
- .(2013·大连)洋务运动中,在近代化军事与国防建设的带动下,交通和通讯事业有了一定的发展,下列史实能反映这一发展的是
.(2013·大连)洋务运动中,在近代化军事与国防建设的带动下,交通和通讯事业有了一定的发展,下列史实能反映这一发展的是(D)
①1865年,江南制造总局在上海设立②1872年,轮船招商局在上海成立
③1880年,电报总局在天津设立 ④1893年,唐胥铁路通车
A.①②④ B.②③ C.①②③ D.③④
为什么不选轮船招商局 李的大腿21年前1
李的大腿21年前1 -
 363360744 共回答了25个问题
363360744 共回答了25个问题 |采纳率96%要看题干,把握关键词:近代军事与国防带动,招商局属于官督商办的民用企业,不属于军事与国防带动,纯属民用商业事项.1年前查看全部
- (1)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
(1)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
①氮元素原子的L层电子数为______;
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______;
③肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为______.
(2)一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2 (g)═XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是______.
②化合物XY2的摩尔质量是______.
③XY2分子中X、Y两元素质量比是3:16,X、Y两元素分别为______ (写元素符号) yejilang1年前1
yejilang1年前1 -
 牧场主 共回答了19个问题
牧场主 共回答了19个问题 |采纳率73.7%解题思路:(1)①氮原子有两个电子层,最外层有5个电子;②氨气和次氯酸钠发生氧化反应生成肼、氯化钠和水;③碱性燃料电池中,正极上氧化剂得电子发生还原反应;(2)①根据方程式计算氧气的体积;②从质量守恒的角度分别计算XY2的物质的量和质量,进而计算摩尔质量;③根据XY2的摩尔质量和X、Y两元素的质量之比计算X、Y的相对原子质量,进而可判断元素的种类.(1)①氮原子核外有7个电子,K层有2个电子,L层有5个电子,故答案为:5;
②氨气和次氯酸钠发生氧化反应生成肼、氯化钠和水,反应方程式为:2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
③肼、氧气碱性燃料电池中,肼所在电极为负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)生成物总物质的量为n(XO2)+n(YO2)=[0.672L/22.4L/mol]=0.03mol,
由方程式可知,n(XO2):n(YO2)=1:2,
则n(XO2)=0.01mol,n(YO2)=0.02mol,
总质量为:m(XO2)+m(YO2)=0.672L×2.56g/L=1.72g,
①设消耗的氧气的体积为V,则
XY2(l)+3O2(g)=XO2(g)+2YO2(g)
1mol 67.2L 1mol 2mol
n V 0.01mol 0.02mol
n=0.01mol,
V=0.672L,即672ml,
故答案为:672ml;
②根据质量守恒可知:m(XY2)+m(O2)=m(XO2)+m(YO2)=1.72g,
m(O2)=0.03mol×32g/mol=0.96g,
m(XY2)=1.72g-0.03mol×32g/mol=0.76g
又:n(XY2)=0.01mol,
则:M(XY2)=[0.76g/0.01mol]=76g/mol,
故答案为:76 g/mol;
③在XY2分子中,X、Y两元素的质量之比为3:16,
则1molXY2分子中,X的质量为76g×[3/19]=12g,Y的质量为76g-12g=64g,
有1molXY2分子中含有1molX、2molY,
所以:X的相对原子质量为12,Y的相对原子质量为[64/2]=32,
则X为C元素,Y为S元素,
故答案为:C、S.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;化学电源新型电池;化学平衡的计算;氨的化学性质.
考点点评: 本题考查化学方程式的计算、原电池原理等,题目难度中等,注意从物质的量应用于化学方程式的角度计算,并把握有关物质的量的计算公式.1年前查看全部
- 氮元素 广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
氮元素 广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH 3 分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH 3 比PH 3 稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K 2 Cr 2 O 7 酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr 2 O 7 2 - + NO 2 - + → Cr 3+ + NO 3 - +
(4)上题反应中每消耗0.6mol NO 2 - ,转移电子数为 。
(5)氮氧化物(NO和NO 2 )污染环境。若用Na 2 CO 3 溶液吸收NO 2 可生成CO 2 ,9.2gNO 2 和Na 2 CO 3 溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。 龙颜萧萧剑1年前1
龙颜萧萧剑1年前1 -
 E型2006 共回答了11个问题
E型2006 共回答了11个问题 |采纳率63.6%(1)3 2 三角锥形 极性
(2)a c
(3)Cr 2 O 7 2 - + 3NO 2 - + 8H + →2Cr 3+ + 3NO 3 - + 4H 2 O
(4)1.2N A
(5)2NO 2 +CO 3 2 - → NO 2 - +NO 3 - +CO 2
1年前查看全部
- (2013•河南模拟)合成氨对农业生产及国防建设均具有重要意义.
 (2013•河南模拟)合成氨对农业生产及国防建设均具有重要意义.
(2013•河南模拟)合成氨对农业生产及国防建设均具有重要意义.
N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/mol
(1)在恒温恒容密闭容器中进行的合成氨反应,当反应达到平衡时______(填序号).
a.混合气体的压强不再发生变化
b.反应物不再转化为生成物
c.v正(N2)=3v逆(H2)
d.2v(N2)=v(NH3)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.请回答下列问题:
①表示N2 的浓度变化的曲线是______(选填曲线代号“A”、“B”或“C”).
②前25min内,用H2 的浓度变化表示的化学反应平均速率是______mol/(L•min).
③在25min末反应刚好达到平衡,则该温度下反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=______.
(3)在第25min末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35min末再次达到平衡.平衡移动过程中H2浓度变化了1.5mol/L,请你在图中画出第25min~40min NH3浓度变化曲线.
(4)在一定温度下,将1mol N2和2mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得N2的转化率α1,NH3体积分数为φ1.此时向该容器中再通入一定量的H2,一段时间后再次达到平衡,测得N2的转化率α2,NH3体积分数为φ2,则α2______ α1(填序号)、φ2______ φ1(填序号).
a.大于b.小于c.等于d.以上均有可能. youdong211年前1
youdong211年前1 -
 不傻也不乖 共回答了16个问题
不傻也不乖 共回答了16个问题 |采纳率93.8%(1)a.混合气体的压强不再发生变化,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡,故a正确;
b.反应物不再转化为生成物,化学平衡是动态平衡,故b错误;
c.v正(N2)=3v逆(H2),速率之比不等于计量数之比,故c错误;
d.2v(N2)=v(NH3),未体现正逆,故d错误;
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,不能说明浓度不变,故e错误;
故答案为:a;
(2)①、由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,故答案为:C;
②、所以v(H2)=[3mol/L/25min]=0.12 mol•L-1•min-1,
故答案为:0.12;
③、由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,
平衡常数k′=
22
1×33=0.15,所以反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=[1
K′=
1/0.15]=6.75,
故答案为:6.75;
(3)升高温度,平衡向吸热反应方向移动,也就量向平衡向氨气浓度减小的方向移动,平衡移动过程中H2浓度变化了1.5mol/L,则氨气浓度变化1mol/L,由此作出图象为 ,故答案为:
,故答案为: ;
;
(4)增加一种反应物的量,另一种物质的转化率增加,本身的转化率降低;平衡正向移动,NH3体积分数受通入氢气的量不同,可能变大,可能变小,也有可能不变,故答案为:a,d.1年前查看全部
- (2012•海南)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(2012•海南)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______;
(3)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2H4 (1)△H1=-19.5kJ•mol-1
②N2O4(1)+O2(g)=N2(g)+2H2O△H2=-534.2kJ•mol-1写出肼和N2O4反应的热化学方程式______;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反为______. 糖糖霜1年前1
糖糖霜1年前1 -
 kgjh58 共回答了26个问题
kgjh58 共回答了26个问题 |采纳率96.2%解题思路:(1)根据核外电子排布规律解答;
(2)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(3)根据盖斯定律,②×2-①可得目标热化学方程式;
(4)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2;(1)N原子的核外电子排布式为1s22s22p3,所以氮元素原子的L层电子数为5,故答案为:5;
(2)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2-①得肼和N2H4 反应的热化学方程式,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O.点评:
本题考点: 用盖斯定律进行有关反应热的计算;电极反应和电池反应方程式.
考点点评: 本题考查盖斯定律、电极反应式的书写等知识点,这些都是高考的热点,注意电极反应式的书写要结合电解质溶液的酸碱性,难度较大.1年前查看全部
- 阅读下面的图表,然后回答问题。表一:高中生对国防建设重要性的认识 表二:高中毕业生是否填报军事院校 请根据上面两幅图
阅读下面的图表,然后回答问题。
表一:高中生对国防建设重要性的认识
表二:高中毕业生是否填报军事院校
请根据上面两幅图表综合反映的情况,按下面的形式写出一条结论:高中生__________________,但___________________,这表明___________________________________。 tgbnji5651年前1
tgbnji5651年前1 -
 将承大同 共回答了14个问题
将承大同 共回答了14个问题 |采纳率92.9%对国防建设的重要性认识程度较高 又普遍不打算为之献身 国防教育并没有真正深入人心1年前查看全部
- 我国正处在和平时期,为什么还要加强国防建设?解放军在维护和平中起到什么作用?
我国正处在和平时期,为什么还要加强国防建设?解放军在维护和平中起到什么作用?
请说的清楚一点. 老飞船1年前1
老飞船1年前1 -
 战斗机ww04 共回答了14个问题
战斗机ww04 共回答了14个问题 |采纳率100%可以避免叛乱,不法分子捣乱与个国家的欺负,解放军是巩固国防、维护国家领土完整与安全的坚实基础1年前查看全部
- 金属材料在国防建设中起着重要的作用
金属材料在国防建设中起着重要的作用

(1)改装前的“辽宁舰”锈迹斑斑,钢铁锈蚀主要是铁与______的结果.工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为______
(2)为避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2所示的两个实验:
①实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是______
②通过实验2,可证明铁的活动性比铜强,反应的化学方程式是______
(3)某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程.
该回收流程中:固体A的成分是______;含铁元素的物质(污水除外)有______(填字母序号). 沮丧的豆芽1年前1
沮丧的豆芽1年前1 -
 sevsun 共回答了27个问题
sevsun 共回答了27个问题 |采纳率96.3%解题思路:(1)铁与水和氧气同时接触时容易生锈;稀盐酸能和氧化铁反应;
(2)①从控制变量的角度进行分析;②若铁的活动性强于铜,则铁可置换出硫酸铜中的铜.(1)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;故填:氧气、水;
稀盐酸和铁锈中的氧化铁反应能生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;故填:Fe2O3+6HCl=2FeCl3+3H2O;
(2)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;故填:酸不同;
②实验二中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu,故填:Fe+CuSO4=FeSO4+Cu;
(3)向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体A,其中含有铜、铁和锌,滤液B是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体D--铁;故填:Cu、Fe、Zn,A C D.点评:
本题考点: 金属锈蚀的条件及其防护;金属的化学性质;金属活动性顺序及其应用;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.1年前查看全部
- 结合军事理论教学,谈谈对国际形势,国防建设这些问题的认识和思考?
 banba1年前0
banba1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 合成氨对农业生产及国防建设均具有重要意义.
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.
N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ•mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是______(填序号).
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.请回答下列问题:
①表示N2的浓度变化的曲线是______(选填曲线代号“A”、“B”或“C”).
②前25min内,用H2的浓度变化表示的化学反应平均速率是______.
③在25min末反应刚好达到平衡,则该温度下反应的平衡常数K=[4/27][4/27](计算结果可用分数表示).
若升高温度,该反应的平衡常数值将______(填“增大”、“减小”或“不变”).
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=______.
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时n(NH3)=______mol. rickzmh1年前1
rickzmh1年前1 -
 你的无所谓 共回答了21个问题
你的无所谓 共回答了21个问题 |采纳率100%解题思路:(1)达到平衡时,正逆反应速率相等,各物质的浓度不变,以此衍生的一些物理量也不变,以此判断是否达到平衡状态;
(2)①依据达到平衡状态消耗物质的量浓度分析判断;
②根据图象中的浓度变化及时间计算出用H2的浓度变化表示的化学反应平均速率;
③根据平衡常数表达式计算出该反应的平衡常数;升高温度,平衡逆向移动,该反应的平衡常数值将减小;
(3)①设平衡时有x molN2转化,计算出转化的氮气的物质的量,再计算出氮气的转化率;
②α1 +α2 =1,说明这两个反应达到平衡时的状态完全相同,即加入的氨气为2mol.(1)a.混合气体的压强不再发生变化,在恒温恒容密闭容器中,因为合成氨是气体分子数目减小的反应,混合气体的压强不再发生变化,说明达到平衡状态,故a正确;
b.混合气体的密度一直不发生变化,故b错误;
c.反应容器中N2、NH3的物质的量的比值不再发生变化,说能达到平衡,故c正确;
d.无论是否达到平衡状态,都存在单位时间内断开3a个H-H键的同时形成6a个N-H键,不能说明达到平衡状态,故d错误;
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比可能只是某一时刻的比值,不能证明是否达到平衡,故e错误;
故答案为:ac;
(2)①图象分析可知在25min反应达到平衡状态,A消耗物质的量浓度=6.0mol/L-3.0mol/L=3.0mol/L,B为生成浓度为2mol/L,C的浓度消耗2.0mol/L-1.0mol/L=1.0mol/L,结合化学方程式定量关系可知,表示N2的浓度变化的曲线是C;
故答案为:C;
②根据图象可知曲线A代表氢气,v(H2)=[6.0mol/L−3.0mol/L/25min]=0.12mol•L-1•min-1,故答案为:0.12 mol•L-1•min-1;
③在25 min 末反应刚好达到平衡,K=
c2(NH3)
c(N2)c3(H2)=[4
1×33=
4/27];该反应是放热反应,若升高温度,平衡逆向移动,该反应的平衡常数值将减小,
故答案为:[4/27];减小;
(3)①设平衡时有x molN2转化,
N2(g)+3H2(g)⇌2NH3(g)
起始物质的量:1mol 3mol 0
变化的物质的量:x 3x 2x
平衡物质的量:1-x 3-3x 2x
列式可得:4-2x=2.8,
解得x=0.6mol,α1 =[0.6mol/1mol]×100%=60%,
故答案为:60%;
②由α1 +α2 =1,说明这两个反应达到平衡时的状态完全相同,即加入的氨气为2mol,故答案为:2.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查较综合,涉及知识点较多,注意通过图象分析化学反应速率、化学平衡及计算问题,需要学生较强的观察能力及思维能力,难度较大1年前查看全部
- 经济发展对国防建设有何重要的作用
 wuwenmex1年前1
wuwenmex1年前1 -
 dfegb233gf 共回答了21个问题
dfegb233gf 共回答了21个问题 |采纳率100%一国的经济发展状况直接关系到国防力量的强弱.只有经济实力的强大才有资本投入到国防建设中.财政的 一个相当大的职能就是国防建设,只有经济的发展才有更多的财政收入.如西方的资本主义国家他们既是经济强国又是军事大国.
经济的发展可以为国防建设提供大量的资金和技术,以经济来补充国防建设所需要1年前查看全部
- Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
(1)氮元素原子的L层电子数为______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ∙mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式______;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为______.
Ⅱ、一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)═XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g•L-1,则:
(1)反应前O2的体积是______.
(2)化合物XY2的摩尔质量是______.
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为______和______ (写元素符号). zuoyongli1年前1
zuoyongli1年前1 -
 黑鸢尾的暗暗 共回答了17个问题
黑鸢尾的暗暗 共回答了17个问题 |采纳率94.1%Ⅰ、(1)氮元素原子的原子序数为7,原子的L层电子数为5;故答案为:5;
(2)NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O;
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ∙mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9KJ/mol;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,肼失电子被氧化发生负极反应,依据反应②写出负极的反应式为:N2H4+4OH--4e-=4H2O+N2↑;
故答案为:N2H4+4OH--4e-=4H2O+N2↑;
Ⅱ、一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)═XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g•L-1,反应前后气体体积不变;
(1)由方程式XY2+3O2══XO2+2YO2可以看出,V(O2)=V(XO2)+V(YO2)=672ml,即0.672 L,反应前氧气的体积是反应后气体的体积为:672ml;故答案为:672ml;
(2)化合物XY2的摩尔质量计算,可以依据标准状况下气体的密度和气体体积计算得到质量:混合气体的质量=0.672L×2.56g/L=1.72g;化学反应遵循质量守恒定律,则m(XY2)+m(O2)=m(XO2)+m(YO2)=1.72g,
m(XY2)=1.72g-m(O2)=1.72g-[0.672L/22.4L/mol]×32g/mol=0.76g,
m(XY2)=0.76g,n(XY2)=[1/3]×n(O2)=[0.672L/22.4L/mol]×[1/3]=0.01mol,
M(XY2)=[0.76g/0.01mol]=76g/mol,
故答案为:76g/mol;
(3)若XY2分子中X、Y两元素的质量比为3:16,
则1molXY2中含有X的质量为76g×[3/3+16]=12g,Y的质量为76g-12g=64g,
1molXY2中含有X1mol,Y2mol,
所以X的相对原子质量为12,Y的相对原子质量为32,
X为碳元素,Y为硫元素,
故答案为:C(碳);S(硫).1年前查看全部
- (本题共12分)Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH 3 与NaClO反应可得到肼(N 2 H 4 ),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N 2 O 4 反应生成N 2 和水蒸气。
已知:①N 2 (g)+2O 2 (g) = N 2 O 4 (l) ΔH 1 =-19.5kJ∙mol - 1
②N 2 H 4 (l) + O 2 (g)=N 2 (g)+2H 2 O(g) ΔH 2 ="-534.2" kJ·mol - 1
写出肼和N 2 O 4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
Ⅱ、一定质量的液态化合物 在标准状况下的一定质量的
在标准状况下的一定质量的 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: ===
=== 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56  则:
则:
(1)反应前 的体积是 。 (2)化合物
的体积是 。 (2)化合物 的摩尔质量是 。
的摩尔质量是 。
(3)若 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。 shyjc1年前1
shyjc1年前1 -
 康大宁 共回答了16个问题
康大宁 共回答了16个问题 |采纳率87.5%I、(1)5 (2)2NH 3 +NaClO==N 2 H 4 +NaCl+H 2 O
(3)2N 2 H 4 (1)+N 2 O 4 (1)==3N 2 (g)+4H 2 O(g) △ H =-1048.9kJ·mol -1
(4)2N 2 H 4 -4e - +4 OH - ==2N 2 +4H 2 O
Ⅱ、 (1)672 mL (2)76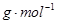 (3)C 、 S
(3)C 、 S
I、 (1)N原子的原子结构示意图为: ,故其L层上有5个电子;
,故其L层上有5个电子;
(2)NH 3 +NaClO——N 2 H 4 ,根据元素守恒还应生成NaCl和H 2 O,观察法可配平方程式为 2NH 3 +NaClO==N 2 H 4 +NaCl+H 2 O;
(3)肼与N 2 O 4 反应生成N 2 和水蒸气:2N 2 H 4 +N 2 O 4 ==3N 2 +4H 2 O,观察已知的两个热方程式可知,②×2-①得:2N 2 H 4 (1)+N 2 O 4 (1)==3N 2 (g)+4H 2 O(g) △ H = △ H 2 ×2- △ H 1 ="=" -1048.9kJ·mol -1
(4)“肼—空气燃料电池是一种碱性电池”中O 2 在正极反应,故负极是肼发生反应:2N 2 H 4 -4e - +4 OH - ==2N 2 +4H 2 O。
Ⅱ、(1)由反应 ===
===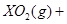
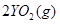 可知,反应前后气体的体积没有发生变化,故V
可知,反应前后气体的体积没有发生变化,故V ="672" mL。
="672" mL。
(2)由m V,生成物的质量m="0.672"
V,生成物的质量m="0.672" 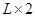 .56
.56 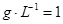 .72 g,
.72 g, 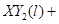
 ===
===
0.01 mol 0.03 mol
所以M 76
76 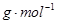
(3)由 A r (X)+ 2A r (Y)=76,得A r (X)="12," A r (Y)=32,则X为C,Y为S。
1年前查看全部
A r (X)+ 2A r (Y)=76,得A r (X)="12," A r (Y)=32,则X为C,Y为S。
1年前查看全部
- (8分)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)氮元素原子的L层电子数为
(8分)
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH 3 与NaClO反应可得到肼(N 2 H 4 ),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N 2 O 4 反应生成N 2 和水蒸气。
已知:①N 2 (g)+2O 2 (g)= N 2 O 4 (1)△H 1 = -19.5kJ·mol -1
②N 2 H 4 (1) + O 2 (g)= N 2 (g) + 2 H 2 O(g)△H 2 = -534.2kJ·mol -1
写出肼和N 2 O 4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。 好笨的猪1年前1
好笨的猪1年前1 -
 feng168168 共回答了23个问题
feng168168 共回答了23个问题 |采纳率91.3%:(1)5;(2)2NH 3 +NaClO=N 2 H 4 +NaCl+H 2 O;(3)2N 2 H 4 (l)+ N 2 O 4 (l)="3" N 2 (g)+ 4H 2 O(g) △H=-1048.9kJ/mol;(4)N 2 H 4 + 4OH - -4e - =4H 2 O +N 2 ↑。 :(1)氮原子的L层...1年前查看全部
- 近代化的军事与国防建设带来了交通和通讯的发展,据此结合下列材料提供的信息,列出相关内容。
近代化的军事与国防建设带来了交通和通讯的发展,据此结合下列材料提供的信息,列出相关内容。
(1)洋务运动中最大的军事工业为_____________;
(2)洋务运动中成立的三支海军为__________、___________、__________;
(3)1872年在上海成立的当时***规模最大的民用企业为_____________;
(4)***人自己设计和修建的第一条铁路为______________。 web8tv1年前1
web8tv1年前1 -
 Horizon7125 共回答了21个问题
Horizon7125 共回答了21个问题 |采纳率95.2%(1)江南制造总局
(2)北洋海军;南洋海军;福建海军
(3)轮船招商局
(4)京张铁路1年前查看全部
- 中国国防建设的主要内容是什么?
 gfzg1年前1
gfzg1年前1 -
 maxiaotai 共回答了17个问题
maxiaotai 共回答了17个问题 |采纳率100%国防建设的内容主要包括:武装力量建设:战场建设,人力物力的多种动员准备:边防、海防,空防和人防建设,战略物资的储备,国防工业建设和国防科学技术研究:对人民群众和学生进行国\防教育和军事训练,发展国防体育事业,建立,健全国防法规体系:军事理论研究,发展军事科学,制定并完善符合实际的战略战术原则:后备力量的建设,以及与国防相关的铁路、公路、水运、民航、邮电、能源、水利、造林、气象、卫生、航天等方面的建设.重点是武装力量建设.1年前查看全部
- 世界新军事变革给我国国防建设带来了哪些启示
 xb23913461年前1
xb23913461年前1 -
 心新向荣 共回答了20个问题
心新向荣 共回答了20个问题 |采纳率95%一是新军事变革极大地冲击了传统战争理念,改变了现代战争面貌,促使各国重新审视安全环境和战略策略,依据客观环境和主观需求积极主动地进行战略调整.20世纪90年代以来,美国出于维护其霸权的需要,已进行过三次军事战略调整:1992年布什政府首先提出"地区防务"战略;1995年,克林顿政府制定了"灵活选择和参与"战略;1997年,又提出"塑造、反应、准备"战略.俄、英、法、德、日等国不甘落后,为谋求在国际舞台上的有利地位,积极顺应世界新军事变革发展的潮流,纷纷进行战略调整.一些发展中国家基于维护自身安全的考虑,在战略上也作出了必要凋整.可以预见,随着新军事革命的深入发展各国还会进行新的战略调整 并促进国际战略格局进行新的整合.
二是新军事变革有可能加剧战略力量对比的失衡,使各国已经存在的差距不仅不容易缩小,反而有可能扩大.可能会诱发新一轮军备竞赛,甚至导致发达国家和发展中国家军事系统特别是武器装备的新的更大的"时代差",从而对世界和平、发展和安全构成新的威胁.
三是新军事变革不仅使军事手段的地位和作用明显上升,而且会刺激新干涉主义进一步抬头,给世界和平与地区安全带来新的威胁.新军事变革为运用军事手段达成政治目的,提供了低风险、高效能、多样化的可能选择.如一枚导弹携带228枚精确制导反坦克子弹,攻击敌坦克群的能力与l000吨当量的核弹相当.现在,高新技术使战争的可控性显著增强,也使军事手段的运用空间进一步拓展.据统计,冷战时期发生的局部战争和武装冲突年均为4次,而冷战后年均却达10次之多.以美国为首的西方发达国家认为,拥有绝对军事优势是处理国际危机的前提.自l990年以来,美国对外出兵达60次,占二战后对外出兵总数的一半以上.
四是发展中国家战略选择的难度进一步增大.新军事变革对发展中国家的国防建设也有一定的促进作用.比如,可以吸收和运用世界军事科技的成果,推动本国国防科技事业的发展;可以借鉴发达国家军事变革的经验,使本国的军事改革少走弯路.但是,世界军事发展的强劲势头是一把双刃剑,发展中国家在战略选择上面临两难困境:如果不顺应世界潮流.积极推进本国的军事变革,大力提高国防实力,与发达国家军队存在的差距就会越来越大,国家安全就没有保障;如果把主要力量用在军事发展上,就会影响国家经济建设,从根本上削弱国家的综合竞争能力.面对世界新军事变革的挑战,发展中国家何去何从,怎样决断,是一个关系重大、非常复杂的战略难题.1年前查看全部
大家在问
- 1有一个棱长为5cm的正方体木块,从它的每个面看都有一个穿透的完全相同孔(如图),求这个立方体图形的内,外表面的总面积之和
- 2(2014•吉林二模)如图所示,质量为m=1kg的滑块,以υ0=5m/s的水平初速度滑上静止在光滑水平面的平板小车,若小
- 3waits 什么情况下加s【请教】不好意思我英语是从0开始,可不可以请教个英语界比较低级の问题啊~He waits fo
- 4综合61.Some people would rather ride bicycles as bicycle ridin
- 5小亮在做一道减法题时,把被减数十位上的8看成了3,把减数个位上的7看成了1,结果得13.正确的得数是什么?
- 6求函数f(x)=log2(x平方-x-2)的单调减区间
- 7我会选择.1.蓝 我会选择. 1.蓝色 [ ] A.blue B.purple 2.黄色 [
- 8下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
- 9有100个包子,一百个和尚,大和尚吃3个包子,中和尚吃2个包子,3个小和尚吃1个包子.
- 10我们把圆心在一条直线上且相邻两圆彼此外切的一组圆 叫做“串圆”.在如图所示的“串圆”中,⊙C1和⊙C3的方程分别为x2
- 11跪求变色龙中人的笑与孔乙己中人的笑的区别(深入)
- 12英语怎么样写 湖南省永州市新田县梘头镇老山溪村5组00号
- 13小强今年9岁,爷爷今年73岁,当爷爷的年龄是小强的年龄的5倍时,小强和爷爷各几岁
- 14下列关于分子力的表述中,下列说法正确的是( )
- 15根据答句写问句.A:B:The rain comes from the c

