粉碎;成语里有这两个字有那些成语
 大海rb2022-10-04 11:39:541条回答
大海rb2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 dreamtrue01 共回答了21个问题
dreamtrue01 共回答了21个问题 |采纳率100%- 有:粉身碎骨。
- 1年前
相关推荐
- 我有一批通信电缆粉碎的料里面含有少量铜,请问怎样分别提取塑料和铜?
 liangziha1年前5
liangziha1年前5 -
 habor 共回答了18个问题
habor 共回答了18个问题 |采纳率88.9%将其加入热的浓硫酸中,充分反应后用铁粉置换,O1年前查看全部
- 场景一:中学生小张参加数学考试,因一道题没解出来,一怒之下把试卷撕得粉碎,离开了考场。
场景一:中学生小张参加数学考试,因一道题没解出来,一怒之下把试卷撕得粉碎,离开了考场。
场景二:某班同学小王在一次期中考试时,本属自己强项的数学考砸了,他难过得流下了眼泪。试卷发下后,他冷静地分析原因,认真地把试卷重新做了一遍。为了加深印象,他还在笔记本上记下了做错的题目及原因,用来鞭策自己。请你回答:
(1)以上两位同学受到了什么挫折?
_ (2)他们对待挫折的态度和方法谁对谁错?为什么?
(3)两种对待挫折的不同态度和方法,会产生什么样的不同结果?
 6070051年前1
6070051年前1 -
 凋凌的心 共回答了13个问题
凋凌的心 共回答了13个问题 |采纳率100%(1)考试失败的挫折。
(2)小张同学用撕试卷来否定失败,他撕碎的是自己的信心和面对失败的勇气;小王同学考试失败后,能分析原因,正视失败,把承受挫折的压力变为进取的动力,重新树立信心,这种对待挫折的态度和方法是正确的。
(3)小张同学的做法,只能是错上加错,会造成更大的挫折;小王同学的做法会促使他认真总结经验教训,奋起迎接挫折的挑战,一定会不断进步。1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10-3 mol•L-1•min-1) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+△ .2Cu2++SO32-+2Cl-+H2O.
2CuCl↓+SO42-+2H+△ . stone22581年前1
stone22581年前1 -
 厌倦oo 共回答了19个问题
厌倦oo 共回答了19个问题 |采纳率100%解题思路:(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应;
(2)根据环境保护时不会产生污染环境的因素来判断;
(3)酸性环境下双氧水具有氧化性,能将金属铜氧化;
(4)根据图示信息,当温度升高时反应速率加快来回答;
(5)根据反应物和生成物来书写离子反应.(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H2O2分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生铜的化合物的性质,是一道综合题目,难度较大,要求学生具有分析和解决问题的能力.1年前查看全部
- (8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
(8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋  iMiki1年前0
iMiki1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 英语翻译有的人一生是用来粉碎的,有的人一生是用来成全的 .今天的我,仍然保留着昨夜的痕迹
 peaceying1年前3
peaceying1年前3 -
 失落的荒原 共回答了20个问题
失落的荒原 共回答了20个问题 |采纳率90%有的人一生是用来粉碎的,有的人一生是用来成全的 .今天的我,仍然保留着昨夜的痕迹
Someone tear their lives apart,someone fulfill over,but today,I ,still perserve the memories of last night
勒个翻译好老,注意逗号位置,特意加的1年前查看全部
- 现取10g黄铜(Cu,Zn合金)粉碎,加足量稀硫酸恰好完全反应,剩余的固体3.5g
现取10g黄铜(Cu,Zn合金)粉碎,加足量稀硫酸恰好完全反应,剩余的固体3.5g
①生成氢气多少g
②黄铜中铜的质量分数 fit001年前1
fit001年前1 -
 duenxing 共回答了17个问题
duenxing 共回答了17个问题 |采纳率76.5%(1)铜不与稀硫酸反应 所以剩下的3.5克是铜 所以Zn为6.5克 由Zn+H2SO4=ZnSO4+H2求的 H2为0.2克 (2)3.5/10=0.35=35%1年前查看全部
- 两天打碎了两个镜子,都摔的粉碎,是不是有不好的事情发生?
 zzjjffzjf1年前1
zzjjffzjf1年前1 -
 wjntyxy 共回答了14个问题
wjntyxy 共回答了14个问题 |采纳率92.9%是因为你心不在蔫,什么事儿都不会有,你要调整好自己的心态,希望健康永远与你相伴.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用q2O2和q2SOw的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
C得(s)+2q+(a它)=C得2+(a它)+q2(g)△q=一w.得9kJ•mol-1
2q2O2(l)=2q2O(l)+O2(g)△q=-19一.w一kJ•mol-1
q2(g)+[1/2]O2(g)=q2O(l)△q=-28w.8wkJ•mol-1
在 q2SOw溶液中C得与q2O2反应生成C得2+和q2O的热化学方程式为______.
(得)控制其他条件相同,印刷电路板的金属粉末用14%q2O2和得.4mol•L-1q2SOw的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于w4℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 24 得4 w4 w4 一4 中4 84 铜平均溶解
速率(×14-得
mol•L-1•m五n-1)中.得w 8.41 9.2w 中.98 中.2w 一.中得 w.中一
(w)在提纯后的C得SOw溶液中加入一定量的Na2SO得和NaCl溶液,加热,生成C得Cl沉淀.制备C得Cl的离子方程式是2C得2++SO得2-+2Cl-+q2O
2C得Cl↓+SOw2-+2q+△ .2C得2++SO得2-+2Cl-+q2O.
2C得Cl↓+SOw2-+2q+△ .
(w)已知相同条件下:
wCaw(POw)得F(s)+得S五O2(s)=一Ca得(POw)2(s)+2CaS五O得(s)+S五Fw(g);△q1
2Ca得(POw)2(s)+14C(s)=Pw(g)+一CaO(s)+14CO(g);△q2
S五O2(s)+CaO(s)=CaS五O得(s);△q得
wCaw(POw)得F(s)+21S五O2(s)+得4C(s)=得Pw(g)+24CaS五O得(s)+得4CO(g)+S五Fw(g); q
用△q1、△q2和△q得表示 q,q=______.
(一)已知1g FeS2(s)完全燃烧生成放出中.1 kJ热量,FeS2燃烧反应的热化学方程式为wFeS2(s)+11O2(g)
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 .wFeS2(s)+11O2(g).
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 . 爱情这个东西1年前1
爱情这个东西1年前1 -
 ddxs204g 共回答了18个问题
ddxs204g 共回答了18个问题 |采纳率100%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据已知的热化学反应方程式和盖斯定律来计算;
(6)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,写出热化学方程式.(一)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,故答案为:BD;(2)已知:①Cu(s)+25+(aq)...
点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式、Ksp等高考中常考考点的考查,要熟练掌握常考知识点的解题思路和方法方法.1年前查看全部
- 在测定黄铜(铜锌合金)中铜元素的含量时,小明设计如图实验:取一定质量的黄铜粉碎后向其中加入过量的稀硫酸,测定产生气体的体
在测定黄铜(铜锌合金)中铜元素的含量时,小明设计如图实验:取一定质量的黄铜粉碎后向其中加入过量的稀硫酸,测定产生气体的体积,经过计算先测定锌的含量,试回答:
(1)实验中发生的化学反应方程式为:______;
(2)预测观察到A中的现象是______
;用理化知识解释此实验能测定生成气体体积的原因______;小霞认为将导管a插入水中,测定气体的体积更准确一些,她的理由是______;
(3)测定黄铜中铜的含量,你还有简单的方案是______.
 jyqhz1年前1
jyqhz1年前1 -
 侬是yy 共回答了27个问题
侬是yy 共回答了27个问题 |采纳率96.3%(1)铜锌合金中的铜不能与稀硫酸反应,而锌能,所以实验中发生反应的方程式为:Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑;
(2)由于该反应有气体放出,所以观察到A中的现象是金属表面有气泡产生;实验能测定生成气体体积的原因是氢气难溶于水,随着生成的氢气量的不断变大,导致B瓶内气压增大,在一定压强差的作用下,将水压入量筒,且量筒中的水量与该气体的体积相等;将导管a插入水中的好处是:该反应放热,导管a插入水中,水能吸热,减小温度对气体体积的影响(其它答案合理均可);
(3)要想测定黄铜中铜的含量,还可以利用合金中锌能与稀硫酸反应而铜不能的原理,将一定质量的黄铜粉溶解在过量的稀硫酸中,过滤称量铜的质量,便能测出铜的含量;
故答案为:(1)Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑;
(2)产生的气体难溶于水,B瓶内气压增大,在一定压强差的作用下,将水压入量筒;该反应放热,导管a插入水中,水能吸热,减小温度对气体体积的影响(其它答案合理均可);(3)将一定质量的黄铜粉溶解在过量的稀硫酸中,过滤称量铜的质量,便能测出;1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是__________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知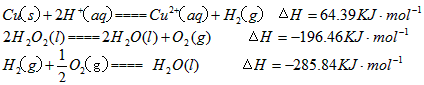
在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的热化学方程式为__________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H 2 O 2 和3.0mol/L H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。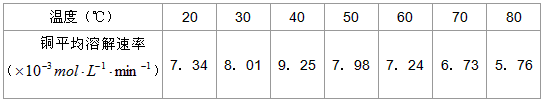
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是___________________。
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备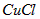 的离子方程式是______________________________。
的离子方程式是______________________________。  娃哈哈m291年前1
娃哈哈m291年前1 -
 发展中的第三条腿 共回答了18个问题
发展中的第三条腿 共回答了18个问题 |采纳率77.8%1年前查看全部
- 在鉴定骨的成分实验时,将一段骨放在酒精灯上煅烧后,轻敲这段骨便会粉碎,这是因为煅烧后的骨,只剩下______,它使骨具有
在鉴定骨的成分实验时,将一段骨放在酒精灯上煅烧后,轻敲这段骨便会粉碎,这是因为煅烧后的骨,只剩下______,它使骨具有______特性;将鱼的一根肋骨浸泡在盐酸中,经过一段时间后,骨变柔软,这是因为骨脱钙后,剩下的是______,它使骨具有______特性.
 换个ll来吵架1年前1
换个ll来吵架1年前1 -
 cindy9989 共回答了15个问题
cindy9989 共回答了15个问题 |采纳率80%解题思路:骨的成分包括有机物和无机物,其物理特性表现为弹性和硬度,据此答题.骨的成分包括有机物和无机物,将鱼骨用火烧,有机物能燃烧,无机物不易燃烧,会变得脆硬,为骨的煅烧;将鱼的肋骨浸泡在15%的盐酸中,无机物在与盐酸发生化学反应是能被溶解出来,剩余物为有机物,会变柔软,称为骨的脱钙.
故答案为:无机物硬脆有机物柔软(韧性、弹性)(4分)点评:
本题考点: 探究骨的成分和特性.
考点点评: 熟知有机物能燃烧,无机盐溶于某些酸.1年前查看全部
- 玉米→粉碎→水解→发酵→酒精(1)粉碎玉米的目的是:()(2)生产过程玉米沉淀最终水解成为葡萄糖,生产过程中为了检验淀粉
玉米→粉碎→水解→发酵→酒精
(1)粉碎玉米的目的是:()
(2)生产过程玉米沉淀最终水解成为葡萄糖,生产过程中为了检验淀粉水解是否完全,可使用的试剂是()
(3)发酵阶段需要的菌种是(),在产生酒精是要控制的必要条件是() yuxuan20061年前1
yuxuan20061年前1 -
 Annie_yl 共回答了13个问题
Annie_yl 共回答了13个问题 |采纳率92.3%1.使胚乳中的淀粉与溶剂充分混合.
2.碘水(如果有淀粉则会呈蓝色)
3.酵母菌 保持容器密闭,保持适宜温度1年前查看全部
- 对于在一密闭容器中进行如下反应:C(S)+O2(g)=CO2(g)下列说法错误的是( ).A 将木炭粉碎成粉末状可以加
对于在一密闭容器中进行如下反应:C(S)+O2(g)=CO2(g)下列说法错误的是( ).A 将木炭粉碎成粉末状可以加
8.对于在一密闭容器中进行如下反应:C(S)+O2(g)=CO2(g)下列说法错误的是(
A 将木炭粉碎成粉末状可以加快化学反应速率
B 升高温度可以加快化学反应速率
C 增加压强可以加快化学反应速率
D 增加木炭的量可以加快化学反应速率 fly30721年前1
fly30721年前1 -
 11111爱 共回答了14个问题
11111爱 共回答了14个问题 |采纳率100%题目不完整,请补充.
ABC都正确,因为都能够增加反应物的浓度,那么化学反应速率就加快了.
D不可以,因为木炭是固体,增加固体的量对有气体参加的反应反应速率几乎无影响.1年前查看全部
- 矿泉水瓶清洗增光增亮的配方是用水洗的,粉碎成片的,要加一些化学剂.
 阳光团团1年前1
阳光团团1年前1 -
 卓群 共回答了22个问题
卓群 共回答了22个问题 |采纳率86.4%加盐酸
把水垢一次清除1年前查看全部
- 粗盐和粉碎洗涤盐一样么?
 fujunhuai1年前1
fujunhuai1年前1 -
 王玲儿 共回答了12个问题
王玲儿 共回答了12个问题 |采纳率75%粉碎洗涤盐,就是原料盐经粉碎、洗涤工艺制得的食盐 补充:粗盐为海水或盐井、盐池、盐泉中的盐水经煎晒而成的结晶,即天然盐,是未经加工的大粒盐,能刺激和促进皮脂腺的分泌,有助于排出体内老化物和去除表面死皮层,从而令肌肤得以更新.
粗盐营养分析:
1.粗盐有发汗的作用,它可以排出体内的废物和多余的水分,促进皮肤的新陈代谢,还可以软化污垢、补充盐分和矿物质;
2.用来清洗创伤可以防止感染;
3.撒在食物上可以短期保鲜,用来腌制食物还能防变质.
粗盐适合人群:
一般人群均可食用,高血压患者和儿童不宜多食.补充:粉碎洗涤盐是以大颗粒海盐为原料,经过1--3次机械粉碎、水洗、筛选、烘干等工艺,氯化钠含量95%以上,水分2%--3%,广泛适用于锅炉软水、制革、制皂、玻璃、冶金等行业用盐1年前查看全部
- 为加速固体物质的溶解可以采用粉碎吗?
 zdp211年前1
zdp211年前1 -
 ling8128 共回答了18个问题
ling8128 共回答了18个问题 |采纳率94.4%不能
例如碳酸钙不溶于水,是因为碳酸钙在水中不能电离出钙离子和碳酸根离子.你再怎么粉碎,也不能改变物质的化学性质.1年前查看全部
- 怎样提高反应物转化率?A.使用催化剂B.增大其他反应物的浓度C.固体粉碎.增大接触面积D.增大气体反应物的压强.请说明A
怎样提高反应物转化率?
A.使用催化剂
B.增大其他反应物的浓度
C.固体粉碎.增大接触面积
D.增大气体反应物的压强.
请说明ABCD四选项中错的原因.对的原因.以及提高转化率的本质是什么? xuanlina5211年前1
xuanlina5211年前1 -
 czl2468 共回答了22个问题
czl2468 共回答了22个问题 |采纳率86.4%B选项正确
A,催化剂只是改变化学反应的反应速度,不改变化学平衡,也就不能提高转化率
B,增大其他反应物的浓度 ,将使化学平衡向正反应方向移动,可以增大目标反应物的转化率!
C,固体粉碎.增大接触面积,同样也 只是改变化学反应的反应速度,不改变化学平衡
D,增大气体反应物的压强,由于不知道这是一个分子数减少还是增加的反应所以不能确定反应平衡的移动方向,有可能提高,也有可能降低转化率!
本质:提高转化率,就是让反应平衡向正反应方向移动!1年前查看全部
- 小琳和他的同学取一块石灰石(杂质不与盐酸反应)样品,将其粉碎后,称出6g放入烧杯内,然后加入50g足量稀盐酸,用玻璃棒搅
小琳和他的同学取一块石灰石(杂质不与盐酸反应)样品,将其粉碎后,称出6g放入烧杯内,然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应后烧杯内所盛物质的总质量为53.8k 求(1)生成CO2气体的质量(2)参加反应的碳酸钙的质量
 sznxxx1年前3
sznxxx1年前3 -
 sinobase 共回答了21个问题
sinobase 共回答了21个问题 |采纳率100%(1)生成CO2气体的质量为50+6-53.8=2.2克
(2)设参加反应的碳酸钙的质量为x克
CaCO3+2HCl=CaCl2+H2O+CO2
100------------------44
x--------------------2.2
100:44=x:2.2
x=100*2.2/44=5
参加反应的碳酸钙的质量为5克1年前查看全部
- 要使煤炉中的煤燃烧的更旺;可以将煤粉碎·也可鼓入大量空气,原理是什么
 pancake_real1年前1
pancake_real1年前1 -
 AYA真 共回答了16个问题
AYA真 共回答了16个问题 |采纳率87.5%将煤粉碎能够增加煤与空气的接触面积,鼓入大量空气,能够使其有效的跟空气中氧气反应,这样可以使煤更充分的燃烧,释放出更多的能量1年前查看全部
- 黄铜是铜锌合金,它可以用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫
黄铜是铜锌合金,它可以用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5g.计算:
(1)黄铜样品中铜的质量分数.
(2)稀硫酸中溶质的质量分数. 贫苦dd的泪1年前1
贫苦dd的泪1年前1 -
 znmao 共回答了21个问题
znmao 共回答了21个问题 |采纳率85.7%样品中铜的质量为3.5g,锌的质量=10g-3.5g=6.5g
所以 黄铜样品中铜的质量分数=3.5g/10g=35%
设稀硫酸中溶质的质量分数为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98
6.5g 50g*x
65/6.5g=98/50g*x
x=19.6%1年前查看全部
- 小明同学为测定某铜锌合金的组成,取10g该合金经粉碎后放入烧杯中,然后加入100g溶质质量分数为20%的过量的稀硫酸,充
小明同学为测定某铜锌合金的组成,取10g该合金经粉碎后放入烧杯中,然后加入100g溶质质量分数为20%的过量的稀硫酸,充分反应后烧杯中剩余物质总质量为109.8g.试回答下列问题:
(1)写出加入稀硫酸的过程中观察到的一项实验现象______.
(2)实验过程中,小红同学提出了一个观点:“反应前后,烧杯中物质的总质量发生了变化,所以此反应不符合质量守恒定律”.你认为她的观点正确吗?______(填“正确”“不正确”之一),简述你的理由______.
(3)试通过计算,求最后所得溶液的质量(写出相应计算过程,结果精确到0.1g). gaiying1年前1
gaiying1年前1 -
 109493227 共回答了23个问题
109493227 共回答了23个问题 |采纳率95.7%解题思路:(1)铜锌合金中的锌可以和稀硫酸反应,所以能够观察到气体生成,固体减少,可以据此解答该题;
(2)该反应中生成了氢气,而氢气逸散到空气中没有称量,所以不能仅仅根据表面现象来判断该反应不符合质量守恒定律,可以据此解答;
(3)根据质量守恒定律可以知道反应前后减少的质量即为生成的氢气的质量,然后结合反应的化学方程式可以计算出消耗的锌的质量,进而完成解答即可.(1)铜锌合金中的锌可以和稀硫酸反应,所以能够观察到气体生成,固体减少;
(2)该反应中生成了氢气,而氢气逸散到空气中没有称量,所以不能仅仅根据表面现象来判断该反应不符合质量守恒定律,所以小红的观点不正确;
(3)根据质量守恒定律,由题意可知反应中生成氢气的质量:10g+100g-109.8g=0.2g;
设铜锌合金中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
652
x0.2g
[65/x]=[2/0.2g]
解得:x=6.5g
反应后所得溶液的质量为:6.5g+100g-0.2g=106.3g
答:最后所得溶液的质量为106.3g
故答案为:(1)固体减少,生成气体;
(2)不正确;产生的气体散失到空气中;
(3)106.3g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 关于燃料充分燃烧的题A.空气愈多越好B硬挨通入适量空气C固体燃料烧前要粉碎D液体燃料绕少是可以以雾状喷出
 我恨我心痴1111年前1
我恨我心痴1111年前1 -
 ying1689 共回答了16个问题
ying1689 共回答了16个问题 |采纳率87.5%A是错的1年前查看全部
- 两个质量、速度都相同的物体碰撞后粉碎了,如何计算其能量?
 我来说几句005441年前1
我来说几句005441年前1 -
 一个昆明的ss 共回答了11个问题
一个昆明的ss 共回答了11个问题 |采纳率90.9%碰撞前的动能和.1年前查看全部
- 5台粉碎机3小时可粉碎饲料37.5吨.照这样计算,12台同样的粉碎机每小时可粉碎饲料多少吨?
 whmeer1年前1
whmeer1年前1 -
 无了居士 共回答了15个问题
无了居士 共回答了15个问题 |采纳率100%解题思路:先求出1台粉碎机每小时可粉碎饲料的吨数,再求出12台同样的粉碎机每小时可粉碎饲料的吨数.37.5÷5÷3×12,
=7.5÷3×12,
=2.5×12,
=30(吨),
答:12台同样的粉碎机每小时可粉碎饲料30吨.点评:
本题考点: 简单的归一应用题.
考点点评: 关键是先求出1台同样的粉碎机每小时可粉碎饲料的吨数,进而得出答案.1年前查看全部
- 5台粉碎机3小时可粉碎饲料37.5吨照这样计算12台同样的机子每小时可粉碎饲料多少吨?
 sdjmslj1年前1
sdjmslj1年前1 -
 考试全过 共回答了12个问题
考试全过 共回答了12个问题 |采纳率83.3%先算出5台每小时粉碎饲料多少吨:
37.5/3=12.5(吨)
再算每台每小时粉碎饲料多少吨:
12.5/5=2.5(吨)
最后求出12台同样的机子每小时可粉碎饲料多少吨:
2.5*12=30(吨)1年前查看全部
- 为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.7
为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g.计算贝壳中碳酸钙的质量分数.
 XHY7610081年前1
XHY7610081年前1 -
 拔剑依沧海 共回答了29个问题
拔剑依沧海 共回答了29个问题 |采纳率93.1%解题思路:由生成二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出贝壳中碳酸钙的质量分数.设贝壳中碳酸钙的质量分数为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10g×x 1.76g
[100/44]=[10g×x/1.76g],x=40%
答:贝壳中碳酸钙的质量分数为40%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 本题主要考查有关含杂质物质的化学方程式计算,难度稍大.1年前查看全部
- 英语翻译以机械方法分离出含β-葡聚糖高的燕麦麸为原料,测定燕麦麸中β- 葡聚糖的含量.经过粉碎、淀粉酶水解、碱液提取、干
英语翻译
以机械方法分离出含β-葡聚糖高的燕麦麸为原料,测定燕麦麸中β- 葡聚糖的含量.经过粉碎、淀粉酶水解、碱液提取、干燥等工艺,研究提取β- 葡聚糖最佳提取工艺和提取条件.研究结果表明:燕麦提取β-葡聚糖的最佳工艺条件为燕麦粉糊化的料水比为 1:10,加酶量为 40U/ml,2h,PH为9,提取温度为 75℃. 较真的人21年前1
较真的人21年前1 -
 ubi07 共回答了21个问题
ubi07 共回答了21个问题 |采纳率90.5%By mechanical means of containing beta - sugar portuguese high oats. oats wheat beta - determination of the portuguese sugar content. after the downfall of the enzymes water, starch, the withdrawal of alkali, dry and technology, research from beta, portuguese sugar best extraction process and extracting condition. results showed: oats from beta, portuguese sugar process is the best oats to powder paste material than 1: 10, the enzymes 40u of ml, enzyme 2h, the ph of 9, the temperature of 75 ℃1年前查看全部
- 选出正确答案1.下列变化属于化学变化的是()A酒精燃烧,酒精挥发 B铜表面变绿,钢铁生锈C木炭燃烧,矿石粉碎 D灯泡亮了
选出正确答案
1.下列变化属于化学变化的是()
A酒精燃烧,酒精挥发 B铜表面变绿,钢铁生锈
C木炭燃烧,矿石粉碎 D灯泡亮了,水结冰了
2.下列各组变化中,前者是化学变化的,后者是物理变化的是()
A玻璃熔化,食物变质 B铁矿石炼铁,干冰升华
3.下列物质的用途利用了物质的化学性质的是()
A活性炭用于除去冰箱异味 B 氧气可以供给呼吸
C氢气用于充灌空气球 D干冰用于人工降雨 4月的窦娥1年前7
4月的窦娥1年前7 -
 piaoborong 共回答了16个问题
piaoborong 共回答了16个问题 |采纳率81.3%1.下列变化属于化学变化的是(B
)
A酒精燃烧,酒精挥发 B铜表面变绿,钢铁生锈
C木炭燃烧,矿石粉碎 D灯泡亮了,水结冰了
2.下列各组变化中,前者是化学变化的,后者是物理变化的是(B
)
A玻璃熔化,食物变质 B铁矿石炼铁,干冰升华
3.下列物质的用途利用了物质的化学性质的是(B
)
A活性炭用于除去冰箱异味 B 氧气可以供给呼吸
C氢气用于充灌空气球 D干冰用于人工降雨1年前查看全部
- 离子晶体粉碎是否破坏化学键?离子晶体通过物理粉碎的方式是否会破坏其中的离子键?这个问题我问过老师,老师说不会,但是我感到
离子晶体粉碎是否破坏化学键?
离子晶体通过物理粉碎的方式是否会破坏其中的离子键?这个问题我问过老师,老师说不会,但是我感到疑惑,离子晶体不同于分子晶体,分子晶体破坏结构是拆分子间作用力,而离子晶体的结构是阴阳离子通过离子键相接而成的.这样的话,分开离子晶体不是必然会破坏其中的离子键吗?希望有权威能够解答一下.
化学键破坏不代表发生化学变化!我问的是是否发生化学键断裂!
三楼bjwzx2说的比较靠谱,但是同样是破坏离子键,为什么物理破坏不会产生离子而溶于水中会产生离子呢? 乐东林碧1年前1
乐东林碧1年前1 -
 kepy 共回答了24个问题
kepy 共回答了24个问题 |采纳率83.3%一定破坏了离子键.
因为,离子晶体是构成晶体的阴阳离子通过相互作用形成的在空间按一定规则排列的网状结构.由于这样,我们说构成这些物质的不是单个分子的大量聚集,它们没有分子式,表示这些物质的式子叫化学式.如果非要它们与分子概念联系,可认为一个完整晶体是一个巨型分子.那么如果物理粉碎它,一定破坏了阴阳离子之间的作用力,不然阴阳离子是不会被分开的.尽管破坏了部分离子之间的作用——离子键,但由于保持离子晶体化学性质的粒子——离子,没有变化,因此离子晶体破碎不是化学变化.是物理变化,比如硫酸铜晶体的破碎.
提问朋友,离子晶体中本来就形成了离子,即本来就存在着阴阳离子.只是这些离子由于离子键的相互作用聚集在一起不能自由移动.物理破坏只是把大离子团体破坏成小离子团体,不可能把每个离子一一分开,因为当单独的阴阳离子相遇时就会自动形成离子键而呈现为宏观上所说的离子晶体这样的物质.而溶于水时,由于离子的大小与水分子的大小相当,能够非常均匀地分散在水分子之间,(也就是形成了均一稳定的溶液),这样产生的是单个的自由移动的离子,而且严格地说,这些离子是被水分子包围着的,它们已经形成了水合离子了.1年前查看全部
- 煅烧粉碎的硫铁矿有利二氧化硫的生成为什么不能用勒沙特列原理解释
 dafwe3321年前1
dafwe3321年前1 -
 cchoonrain 共回答了11个问题
cchoonrain 共回答了11个问题 |采纳率81.8%勒沙特列原理是讲平衡反应的,而硫铁矿燃烧不是一个平衡反应,这个反应很彻底.
粉碎硫铁矿只加速了燃烧过程,没有影响平衡.
另外,通常认为固相的浓度是恒定的,与加入数量无关.因此,即便是一个平衡反应,改变固相的数量和形态通常都不会影响化学平衡.1年前查看全部
- 全自动豆浆机,如图1甲所示.图1乙是豆浆机的主要结构:中间部位是一个带动刀头的电动机,用来将原料进行粉碎打浆;外部是一个
全自动豆浆机,如图1甲所示.图1乙是豆浆机的主要结构:中间部位是一个带动刀头的电动机,用来将原料进行粉碎打浆;外部是一个金属圆环形状的电热管,负责对液体加热煮沸.下表是这个豆浆机的主要技术参数;图2所示是豆浆机正常工作一次过程中电热管和电动机交替工作的“P-t”图象.

型号 SYL-624
额定电压 220V
额定频率 50Hz
电机功率 120W
加热功率 1210W
容量 100mL
(1)由图乙可知豆浆机中的电动机和电热管的连接方式是------(为什么?)
(2)加热过程中,通过豆浆机的电流多大?
(3)豆浆机正常工作一次,总共消耗的电能是多少?
 ahicq5551年前1
ahicq5551年前1 -
 eiqqie 共回答了16个问题
eiqqie 共回答了16个问题 |采纳率81.3%(1)由图可知,电流分别流经电动机和电热管,所以电动机和电热管的连接方式是并联;
加热时:电能转化为内能,打浆时:电能转化为机械能.
(2)由题知,加热功率P1=1210W,U=220V,
∵P=UI所以I=P1/U=1210W/220v=
(3)由图象可知,豆浆机正常工作一次电热管工作时间t1=9min,电动机工作时间t2=2min,
∵P=
W
t
,
∴豆浆机正常工作做一次豆浆消耗的电能:
W=P1t1+P2t2=1210W×9×60s+120W×2×6
故答案为:(1)并联(2)豆浆机的加热电流是;
(3)豆浆机正常工作做一次豆浆,总共消耗的电能是667800J.0s=667800J.1年前查看全部
- 硅的有关计算已知单质硅与强碱溶液反应,生成硅酸盐并放出氧气,今有一种不含其他杂质的硅铁合金,取部分粉碎后分为质量相等的两
硅的有关计算
已知单质硅与强碱溶液反应,生成硅酸盐并放出氧气,今有一种不含其他杂质的硅铁合金,取部分粉碎后分为质量相等的两份,一份加入足量的NaOH溶液,另一份加入足量的盐酸,充分反应后,前者放出气体的体积是后者的1/6倍(同温、同压下测定的),此硅铁合金中硅与铁的物质的量之比为_______ 惜抱轩1年前1
惜抱轩1年前1 -
 沉衣 共回答了18个问题
沉衣 共回答了18个问题 |采纳率94.4%Si+2NaOH+H2OFeCl2+H2
气体比是1比6
所以硅的物质量与硅铁物质量比为1:12
注意单质硅与强碱溶液反应,生成硅酸盐放出的应该是氢气否则氧和硅元素化合价都是升高的是不可能的1年前查看全部
- 取粉碎的石灰样品15克与足量的稀盐酸反应共收集气体质量为5.5克,求碳酸钙的质量分数
取粉碎的石灰样品15克与足量的稀盐酸反应共收集气体质量为5.5克,求碳酸钙的质量分数
气体被NaOH吸收则产生多少克NaOH 返朴M归真1年前1
返朴M归真1年前1 -
 韩天定 共回答了29个问题
韩天定 共回答了29个问题 |采纳率96.6%CaCO3+2HCl===CaCl2+CO2↑+H2O
100 44
X 5.5
X=12.5g
12.5÷15×100%=83.3%
2NaOH+CO2===Na2CO3+H2O
2×80 44
Y 5.5
Y=10g1年前查看全部
- 英语 摔碎 打碎 撞碎 粉碎 打破 的单词
英语 摔碎 打碎 撞碎 粉碎 打破 的单词
同上 有故事的人1年前3
有故事的人1年前3 -
 三潭 共回答了20个问题
三潭 共回答了20个问题 |采纳率90%eak (sth)up(将某物)割碎,击碎,打碎,撞碎.
smash V.(使某物)粉碎,破碎.;n.破碎;破碎时发出的声音
pulverize V.将(某物)磨成粉或捣成末;粉碎,摧毁(某物).成为粉状,成末.(口或谑)彻底粉碎或摧毁(某人[某事物]).
break 打破 ,smash亦有打破之意.1年前查看全部
- (2014•嘉定区二模)工业上常将固体燃料粉碎或把液体燃料喷成雾状再燃烧,其目的是( )
(2014•嘉定区二模)工业上常将固体燃料粉碎或把液体燃料喷成雾状再燃烧,其目的是( )
A.增加空气中氧气的体积分数
B.降低可燃物的着火点
C.延迟燃料燃烧的时间
D.增加燃料与氧气的接触面积 yangmy20041年前1
yangmy20041年前1 -
 ceccgt 共回答了18个问题
ceccgt 共回答了18个问题 |采纳率94.4%解题思路:根据物质充分燃烧时需要足够的氧气,增大可燃物与氧气的接触面积,达到可燃物燃烧需要的温度等因素来分析燃烧是否充分.将固体燃料粉碎或把液体燃料喷成雾状在燃烧,是为了增大可燃物与氧气的接触面积,促进燃料的燃烧.
故选D.点评:
本题考点: 完全燃烧与不完全燃烧.
考点点评: 本题考查学生利用充分燃烧需要的条件来分析生活中常见的燃烧现象,明确常见的做法是否有利于充分燃烧,并注意在生活中做到燃烧充分及合理利用能源.1年前查看全部
- 下列关于燃料充分燃烧的说法,不正确的是( ) A.通人适量的空气 B.固体燃料燃烧前要粉碎 C.液体燃料燃烧时可以以雾
下列关于燃料充分燃烧的说法,不正确的是( ) A.通人适量的空气 B.固体燃料燃烧前要粉碎 C.液体燃料燃烧时可以以雾状喷出 D.化石燃料在任何条件下都能充分燃烧  leemmnnmail1年前1
leemmnnmail1年前1 -
 muzhuang_cb 共回答了16个问题
muzhuang_cb 共回答了16个问题 |采纳率87.5%A.通人适量的空气,能使燃料充分燃烧,故A正确;
B.固体燃料燃烧前要粉碎,能增大与空气的接触面积,能使燃料充分燃烧,故B正确;
C.液体燃料燃烧时可以以雾状喷出,能增大与空气的接触面积,能使燃料充分燃烧,故C正确;
D.化石燃料需在足量的氧气中能充分燃烧,氧气量不足,会不完全燃烧生成一氧化碳等气体,故D错误.
故选D.1年前查看全部
- 为测定某黄铜样品中铜的质量分数,现取10克该样品粉碎,加入到50克稀硫酸中,恰好完全反应测得剩余固体质量
为测定某黄铜样品中铜的质量分数,现取10克该样品粉碎,加入到50克稀硫酸中,恰好完全反应测得剩余固体质量
测得剩余固体质量为3.5克 求稀硫酸中溶质的质量分数.黄铜样品中的铜的质量分数 冷风雪1年前1
冷风雪1年前1 -
 wuyin27 共回答了20个问题
wuyin27 共回答了20个问题 |采纳率90%10g-3.5g=6.5g
Zn + H2SO4 === ZnSO4 + H2↑
65 98
6.5g x
65/98=6.5g/x
x=9.8g
稀硫酸中溶质的质量分数 9.8g/50g*100%=19.6%.
黄铜样品中的铜的质量分数 3.5g/10g*100%=35%1年前查看全部
- 关于硫酸的制法的一些问题..1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?2沸腾炉出来的炉气必须净化,因为杂质
关于硫酸的制法的一些问题..
1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?
2沸腾炉出来的炉气必须净化,因为杂质会和SO2反应..为什么错?
3SO2氧化成SO3时需要使用催化剂,因为要提高SO2的转化率...为什么错? wwxtu241年前1
wwxtu241年前1 -
 heqing1980 共回答了17个问题
heqing1980 共回答了17个问题 |采纳率70.6%黄铁矿可以燃烧,粉碎是为了彻底完全燃烧;
杂质气体会使催化剂钝化;
催化剂不能提高转化率.1年前查看全部
- 为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品10克,与足量的稀盐酸充分反应,杂质不与盐酸反应,
为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品10克,与足量的稀盐酸充分反应,杂质不与盐酸反应,
生二氧化碳1.76克,计算贝壳中的碳酸钙的质量分数 小安最靓1年前1
小安最靓1年前1 -
 wufanghao 共回答了19个问题
wufanghao 共回答了19个问题 |采纳率94.7%CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 1.76g
100/x=44/1.76g
x=4g
4g/10g*100%=40%1年前查看全部
- 下列做法不能提高燃烧效率的是A.煤的气化与液化B.液体燃烧成雾状喷出C.通入大大过量的空气D.将煤粉碎请说明道理,说法不
下列做法不能提高燃烧效率的是
A.煤的气化与液化
B.液体燃烧成雾状喷出
C.通入大大过量的空气
D.将煤粉碎
请说明道理,
说法不能提高煤的燃烧效率的是? jebelle1年前3
jebelle1年前3 -
 jimjianglm 共回答了14个问题
jimjianglm 共回答了14个问题 |采纳率85.7%D.将煤粉碎1年前查看全部
- 事实是毫无情面的东西,它能将空言打得粉碎是什么意思 急
 达利的秘密生活1年前1
达利的秘密生活1年前1 -
 m16ll 共回答了14个问题
m16ll 共回答了14个问题 |采纳率100%意思是任何空口说出来的话都敌不过事实的现实1年前查看全部
- 粉碎机粉碎的颗粒多少,大小有没有相关的规定,怎样来区分粉碎的程度,80--100目是什么意思?
 小人物one1年前1
小人物one1年前1 -
 V洛洛V 共回答了25个问题
V洛洛V 共回答了25个问题 |采纳率84%目一般指筛网在固定的平方面积内的孔数,80-100目就是每平方吋有80到100个孔的意思.1年前查看全部
- 贝壳的主要成分是碳酸钙,为测定贝壳中碳酸钙的含量,小明将贝壳粉碎后,取样品25g,与100g稀盐酸恰好完全反应(杂志不溶
贝壳的主要成分是碳酸钙,为测定贝壳中碳酸钙的含量,小明将贝壳粉碎后,取样品25g,与100g稀盐酸恰好完全反应(杂志不溶于水,且不与稀盐酸反应),产生二氧化碳8.8g,根据题意计算:
(1)稀盐酸中溶质的质量分数
(2)当碳酸钙恰好完全反应时所得溶液中溶质的质量分数.(结果精确到0.0001) xia7778881年前1
xia7778881年前1 -
 影隨aiq風飄 共回答了10个问题
影隨aiq風飄 共回答了10个问题 |采纳率100%对待这样的题目,我们首先得明确:这是一个利用化学方程式的计算题.解这样的题目时,我们的一般思路是:
1、先写出反应的化学方程式(草稿纸上):CaCO3+2HCl=CaCl2+H2O+CO2↑
2、从问题出发,分析解决这个问题需要哪些量:
(1)稀盐酸中溶质的质量分数=溶质质量(HCl质量)÷溶液质量
(2)明确恰好完全反应时所得的溶液是CaCl2溶液,求这个质量分数就得:CaCl2质量÷所得溶液质量
3、找解决问题所需要的量:
(1)已知100g稀盐酸,即溶液质量;HCl质量不知道,怎么来?从化学方程计算而来.要计算100g稀盐酸中HCl的质量,得从其他物质中找个已知量:其中有25g贝壳样品,这个质量不纯净,不是参加反应的CaCO3的质量,不能用;还有个CO2 8.8g,这个质量全部是反应生成的,能用.所以可以根据HCl和CO2的反应质量比,算出HCl的质量.这个问题就能解决了.
(2)所需要的两个质量都不是已知,想办法:
CaCl2是反应生成的,所以根据CaCl2和CO2的反应质量比,就能算出;
“所得溶液的质量”麻烦点儿,如果考虑用“溶质质量+溶剂质量”来算的话,溶质就是CaCl2的质量,溶剂(水)的质量有两个来源:①稀盐酸中的水,用100g减去第一问中的HCl的质量即得.②反应生成的水,用H2O和CO2的反应质量比算出;也可以根据质量守恒,把原料的质量都加起来,再减去不属于溶液的质量(包括杂质、生成的气体、生成的沉淀).
所以,解题过程可以这样:
设HCl的质量为x,生成的CaCl2质量为y,H2O的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 111 18 44
x y z 8.8g
73:x=111:y=18:z=44:8.8g
x=14.6g y=22.2g z=3.6g
(1)14.6g÷100g×100%=14.6%
(2)22.2g÷(22.2g+100g-14.6g+3.6g)×100%=19.96%
答:略
第二问还以可算CaCO3质量(为20g),不算水的质量,那么最后的算式可变为:
(2)22.2g÷(20g+100g-8.8g)×100%=19.96%1年前查看全部
- 下列句子中加点的成语使用有误的一项是( ) A.你可以想像得到那真是 振聋发聩 。船如离弦之箭,稍差分厘,便会撞个粉碎
下列句子中加点的成语使用有误的一项是()
A.你可以想像得到那真是 振聋发聩 。船如离弦之箭,稍差分厘,便会撞个粉碎。 B.抬头望处,已是巫山。上面阳光垂照下来,下面浓雾滚涌上去, 云蒸霞蔚 ,颇为壮观。 C.峡中,强烈的阳光与乳白色云雾交织一处,数步之隔,这边是阳光,那边是云雾,真是 神妙莫测 。 D.原来崆岭滩一条狭窄航道只能过一只船,这时有一只江轮正在上行,我们只好等着,谁知竟等了那么久,可见那上行的船只是如何 小心翼翼 了。  苦难是mm1年前1
苦难是mm1年前1 -
 天山雪莲2 共回答了22个问题
天山雪莲2 共回答了22个问题 |采纳率95.5%A
1年前查看全部
- 选择恰当的词秩序 阴谋 缺点 收入 眉头 信心 质量 粉碎() 维持()解决() 皱紧() 改正() 增加() 提高()
选择恰当的词
秩序 阴谋 缺点 收入 眉头 信心 质量
粉碎() 维持()解决() 皱紧() 改正() 增加() 提高()树立() 风中碎片片1年前1
风中碎片片1年前1 -
 csj28 共回答了18个问题
csj28 共回答了18个问题 |采纳率83.3%粉碎阴谋 维持秩序 解决问题 皱紧眉头 改正缺点 增加收入 提高质量 树立信心1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol•L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10 -3 mol•L -1 •min -1 ) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 天行罪星1年前1
天行罪星1年前1 -
 妫子 共回答了21个问题
妫子 共回答了21个问题 |采纳率90.5%(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ,故答案为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O,故答案为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H 2 O 2 分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu 2+ +SO 3 2- +2Cl - H 2 O
△
.
2CuCl↓+SO 4 2- +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O
△
.
2CuCl↓+SO 4 2- +2H + .1年前查看全部
- 白灰立方米和吨如何换算粉碎成面状的
 sallysunln1年前2
sallysunln1年前2 -
 ravemuster 共回答了18个问题
ravemuster 共回答了18个问题 |采纳率88.9%生石灰块11KN/立方米
生石灰粉12KN/立方米
熟石灰膏13.5KN/立方米
《施工手册》缩印本能查到.1年前查看全部
- 一台粉碎机四分之一时可粉碎八分之一饲料,要粉碎八分之七吨饲料要多少小时
 melody88341年前2
melody88341年前2 -
 小果子0 共回答了11个问题
小果子0 共回答了11个问题 |采纳率90.9%时间=7/8÷1/8×1/4=7/4小时1年前查看全部
- 一台饲料粉碎机,每小时可粉碎饲料四分之三吨,五分之三小时能粉碎多少吨
 海之炎1年前1
海之炎1年前1 -
 钟亿 共回答了17个问题
钟亿 共回答了17个问题 |采纳率88.2%3/4×3/5=9/20吨
答五分之三小时能粉碎9/20吨1年前查看全部
大家在问
- 1一头牛一天吃草6.5千克,三头牛一周(7天)吃草多少千克
- 2根据首字母填空:It look us at l___ five hours to finish the work las
- 3常量指针和指针常量有什么区别
- 4英语翻译我知道这有点专业性比较强,但我也只是作业用,不需要那么讲究,但也不能让老师看起来我在乱写~相生:相克:五脏与五行
- 5为什么下雪后周围很安静 作文
- 6AC为正方形ABCD的对角线AQ平分
- 7主将从现,主过从也过 .到底是什么啊
- 8(1+(2n+1))*(n+1)/2=(n+1)^2中^是什么?
- 9(2009•崇文区模拟)一辆汽车在平直的公路上行驶,下图中能够表示该汽车做匀减速直线运动的图象是( )
- 10他什么时候准备去?英文翻译
- 11在下图所示的长方形ABCO中,三角形ABD的面积比三角形BCD的面积大4平方厘米,求阴影部分的面积.
- 12某时刻以20m/s的初速度将一小球从地面竖直向上抛出,同时将另一小球以10m/s的初速度从离地面高10m的平台上
- 13已知椭圆C以坐标轴为对称轴,并与直线|:x+2y=7相交于P、Q两点,点R的坐标为(2,5),若PQR成等腰三角形,角P
- 14第四个,我疯了
- 15甲乙两站相距900千米,一列货车和一列客车分别同时从甲乙两站相对开出.货车每小时行80千米,客车每小时行120千米,经过

