碱式硫酸铁的化学式为什么有这么两种?Fe4(OH)2(SO4)5 Fe(OH)SO4
 娃哈哈kgdc2022-10-04 11:39:541条回答
娃哈哈kgdc2022-10-04 11:39:541条回答Fe4(OH)2(SO4)5 Fe(OH)SO4 是反应条件不同吗?为什么这两种物质名称是一样的?

已提交,审核后显示!提交回复
共1条回复
 玛雅可夫斯基 共回答了20个问题
玛雅可夫斯基 共回答了20个问题 |采纳率85%- Fe4(OH)2(SO4)5 Fe(OH)SO4 二种代表相同的意思.
- 1年前
相关推荐
- 电解碱式硫酸铁溶液生成什么?
 changyongg1年前3
changyongg1年前3 -
 靠岸蹬船 共回答了17个问题
靠岸蹬船 共回答了17个问题 |采纳率88.2%碱式硫酸铁化学式为Fe(OH)SO4,因氢氧根还原性强于硫酸根所以先在阳极放电被氧化为氧气.三价高铁氧化性强于氢离子所以先在阴极放电被还原为二价亚铁,随后氢离子被还原为氢气.电解时溶液转为硫酸亚铁,水被消耗.1年前查看全部
- 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO 2 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO 2 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO 4 ·7H 2 O),其过程如下:

(1)过程①中,FeS和O 2 、H 2 SO 4 反应的化学方程式为 。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的 吸收。
a.浓H 2 SO 4 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是
(4)过程④的实验操作是
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO 4 ] n ,则该聚铁中铁元素的质量分数为 。 hank89161年前1
hank89161年前1 -
 zhew 共回答了19个问题
zhew 共回答了19个问题 |采纳率100%(1)4FeS+3O 2 +6H 2 SO 4 =2Fe 2 (SO 4 ) 3 +6H 2 O+4S(2分)
(2)c(2分) (3)铁(2分)
(4)蒸发(浓缩)、(冷却)结晶、过滤、洗涤(4分,浓缩、冷却不写可以不扣分)
(5)促进Fe 3+ 的水解(2分)
(6)31.11%(3分)
1年前查看全部
- 如果碱式硫酸铁的化学式为Fe(OH)SO4那化学方程式怎么些写?
如果碱式硫酸铁的化学式为Fe(OH)SO4那化学方程式怎么些写?
原题是说,绿矾晶体在空气中变成铁锈色的碱式硫酸铁,其反应的化学方程式是什么,后者的化学式就是那个 muse821年前1
muse821年前1 -
 jeneg 共回答了16个问题
jeneg 共回答了16个问题 |采纳率81.3%如果碱式硫酸铁的化学式为Fe(OH)(SO4)2
应该是这样
8FeSO4·7H2O +4O2=4Fe(OH)(SO4)2+2Fe2O3+54H2O1年前查看全部
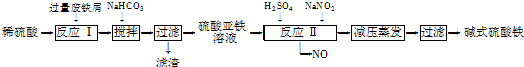
- (2012•泰州一模)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
(2012•泰州一模)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[fe(oh)so4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的ph如下表:
回答下列问题:沉淀物 fe(oh)3 fe(oh)2 al(oh)3 开始沉淀 2.3 7.5 3.4 完全沉淀 3.2 9.7 4.4
(1)加入少量nahco3的目的是调节ph,使溶液中的______(填“fe3+”“fe2+”或“al3+”)沉淀,该工艺中“搅拌”的作用是______.
(2)在实际生产中,反应Ⅱ常同时通入o2以减少nano2的用量,o2与nano2在反应中均作______.若参与反应的o2有11.2l(标准状况),则相当于节约nano2的物质的量为______.
(3)碱式硫酸铁溶于水后产生的fe(oh)2+离子,可部分水解生成fe2(oh)
聚合离子.该水解反应的离子方程式为______.2+4
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据***质量标准,产品中不得含有fe2+及no
.为检验所得产品中是否含有fe2+,应使用的试剂为______(填字母).−3
a.氯水 b.kscn溶液 c.naoh溶液 d.酸性kmno4溶液. nutoo1年前1
nutoo1年前1 -
 邓旭 共回答了11个问题
邓旭 共回答了11个问题 |采纳率100%解题思路:(1)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;
(2)依据流程分析判断,反应Ⅱ是氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;依据电子守恒计算;
(3)根据反应物和生成物判断离子方程式;Fe(OH)2+水解显酸性,据电荷守恒可写出该反应的离子方程式;
(4)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子;
B、KSCN溶液和亚铁离子不反应,无现象发生;
C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子;
D、在含有Fe3+的溶液中检验Fe2+,应选用酸性KMnO4溶液,因现象明显,酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色.(1)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;工艺中搅拌作用是加快反应速率,
故答案为:Al3+加快反应沉淀,加快反应速率;
(2)反应Ⅱ是氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=[11.2L/22.4L/mol]=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到2mol电子,NaNO2的物质的量为 2mol,
故答案为:氧化剂;2mol;
(3)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+;
(4)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;
B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;
C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;
D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合;
故选D.点评:
本题考点: 铁的氧化物和氢氧化物;镁、铝的重要化合物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查制备原理的设计,题目难度中等,注意根据物质的性质和题给信息判断可能发生的反应,方程式的书写为解答该题的难点,也是易错点,注意体会书写方法.1年前查看全部
- 聚合硫酸铁,由称碱式硫酸铁,简称PFS,
聚合硫酸铁,由称碱式硫酸铁,简称PFS,
是一种新型高效无极高分子凝聚剂,某化学实验小组通过查阅资料了解工业制备PFS
求解实验题.

能否说下 实验原理.谢谢、、
 asdflkhwkajrgerg1年前1
asdflkhwkajrgerg1年前1 -
 倒飞的猪 共回答了16个问题
倒飞的猪 共回答了16个问题 |采纳率87.5%原理特别简单,实际上就是Fe3+的不完全水解,或者说Fe3+的不完全沉淀.
步骤1肯定是加水溶解,由于最终铁是+3价,所以步骤2是氧化.
为什么要加KOH呢?因为要使得Fe3+部分变为Fe(OH)3,Fe(OH)3和Fe2(SO4)3按一定比例混合,就是碱式硫酸铁了.1年前查看全部
- (2014•安庆三模)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)
(2014•安庆三模)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是______;
A.品红溶液B.紫色石蕊溶液C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:______;
(3)过程③中,需加入的物质是______;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架,还需要的仪器有______;
(5)过程⑤调节pH可选用下列试剂中的______(填选项序号);
A.稀硫酸B.CaCO3C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70-80℃,目的是______;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验.
①用分析天平称取2.700g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥,称量,得固体质量为3.495g.若该聚铁主要成分为[(Fe(OH)(SO4)]n;
则该聚铁样品中铁元素的质量分数为______.(假设杂质中不含铁元素和硫元素) yiyi8051年前1
yiyi8051年前1 -
 孤岛火山 共回答了23个问题
孤岛火山 共回答了23个问题 |采纳率73.9%解题思路:(1)过程②产生的气体为SO2,具有还原性和漂白性;
(2)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行;
(7)根据n(Fe3+)=n(SO42-)计算.(1)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,故答案为:ACD;
(2)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,
反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,故答案为:蒸发皿、玻璃棒;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成,
A.加入硫酸不能使溶液PH增大,故A错误;
B.加入碳酸钙生成微溶的硫酸钙,会引入新的杂质,故B错误;
C.加入NaOH可使溶液碱性增强,生成的聚铁中不引入新的杂质,故C正确.
故答案为:C;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:促进Fe3+的水解;
(7)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,
n(BaSO4)=[3.495g/233g/mol]=0.015mol,
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=
0.84g
2.7g×100%=31.1%,
故答案为:31.1%点评:
本题考点: 探究物质的组成或测量物质的含量;含硫物质的性质及综合应用;物质检验实验方案的设计.
考点点评: 本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度较大,注意常见化学实验操作方法.1年前查看全部
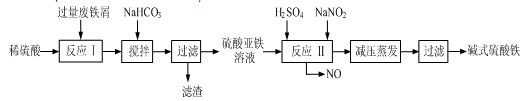
- 9月18日文档步步高第3章3讲12题请教:12、碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,
9月18日文档步步高第3章3讲12题请教:12、碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,
12、碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,
在医药上也可用于治疗消化性溃疡出血,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
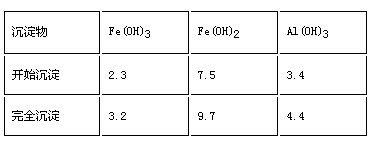
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的____________沉淀,该工艺中“搅拌”的作用是____________.
(3)碱式硫酸铁[Fe(OH)SO4]溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+ ,该水解反应的离子方程式是__________________________
我的问题是:(1)调节PH的目的答案说是使Al3+沉淀,Al3+沉淀了的话,Fe3+也沉淀了啊,为什么是这样?为什么搅拌可加快反应速率?为什么不是让它们充分反应?
我不理解(3)答案为什么是那样,这题中的水解是盐类的水解吗?为什么?
请一定帮忙解答哈,非常感谢!
 zjgmir1年前1
zjgmir1年前1 -
 nioii 共回答了17个问题
nioii 共回答了17个问题 |采纳率94.1%(1)这里调节PH是加入碱.当PH升到4.4向上时,铝已经完全沉淀了.但是注意,这是溶液中是没有铁离子的,有的是亚铁离子.所以铁元素全部在溶液中.至于搅拌这个你直接记住除了一些特殊场合,搅拌都是加快反应速率的.
(3)2 Fe(OH)2 2+ + 2 H2O~~~~Fe2(OH)4 2+
+ 2 H+1年前查看全部
- 硫酸亚铁溶液被氧气氧化成硫酸铁溶液还是碱式硫酸铁?
 snr192567241年前2
snr192567241年前2 -
 liumangdp111 共回答了11个问题
liumangdp111 共回答了11个问题 |采纳率90.9%硫酸铁溶液 12FeSO4+3O2+6H2O=4Fe2(SO4)3+4Fe(OH)31年前查看全部
大家在问
- 1已知抛物线y=x 2 +px+q与x轴交于A、B两点,且过点(-1,-1),设线段AB的长为d.
- 2分子式为C 3 H 6 Cl 2 的有机物发生一元氯代反应后,可生成2种同分异构体,则分子式为 C 3 H 6
- 3若正数x,y满足x+3y=5xy,则3x+4y的最小值
- 4how long this factory (开办)
- 5(2014•射阳县三模)下列实验设计方案合理的是( )
- 6在用竖式计算小数乘法时,小数点一定要对齐.______.(判断对错)
- 7如图,已知BD,CD分别是△ABC的外角∠EBC,∠FCB的平分线.求证:∠EBC+∠FCB=∠A+180
- 8新制氯水注入氯化钠溶液化学方程式
- 9描写秋天景色的诗句有哪些小学二年级
- 10A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-
- 11let me konw what works best for
- 12地球内部结构名称?急用
- 13初二科学第三章难题下列属于向性运动的例子是()A.在种植香蕉时,把肥料施在人们希望长苗的空旷地方,使香蕉植株分布均匀.B
- 14陈太丘与友期中元方对友人态度变化的词语有哪些
- 15已知多项式2x2+my-12与多项式nx2-3y+6的和中不含有x,y,试求mn的值.
