苛性钾的学名叫什么?有机物还是无机物?五水硫酸铜指的就是硫酸铜的结晶吗?十二水和硫酸铝钾是什么
 wcg76052022-10-04 11:39:543条回答
wcg76052022-10-04 11:39:543条回答十二水合硫酸铝钾········错字真可怕··········

已提交,审核后显示!提交回复
共3条回复
 ljm7788 共回答了20个问题
ljm7788 共回答了20个问题 |采纳率95%- 苛性钾的学名叫氢氧化钾,化学式为KOH,是强碱,是典型的无机物.
五水硫酸铜就是硫酸铜的结晶水合物,就是硫酸铜晶体,化学式为CuSO4.5H2O,
十二水硫酸铝钾是典型的复盐,就是说它是硫酸铝,硫酸钾和水的复合物或化合物,也可以说是硫酸铝钾的水合物,化学式为KAl(SO4)2.12H2O . - 1年前
 ygp12 共回答了9539个问题
ygp12 共回答了9539个问题 |采纳率0.2%- 氢氧化钾
无机物
是的
就是明矾 - 1年前
 墙上的猫78 共回答了2个问题
墙上的猫78 共回答了2个问题 |采纳率- 苛性钾是氢氧化钾,无机物
五水硫酸铜也被称作硫酸铜晶体
十二水合硫酸铝钾又称:明矾、白矾、钾矾、钾铝矾、钾明矾,是含有结晶水的硫酸钾和硫酸铝的复盐。KAl(SO4)2·12H2O(有时亦可写作K2SO4·Al2(SO4)3·24H2O) - 1年前
相关推荐
- 写一些这三个方程式二氧化锰放在氨气流中加热,得到棕黑色的三氧化二锰;二氧化锰与浓硫酸反应有氧气生成二氧化锰与熔融苛性钾在
写一些这三个方程式
二氧化锰放在氨气流中加热,得到棕黑色的三氧化二锰;
二氧化锰与浓硫酸反应有氧气生成
二氧化锰与熔融苛性钾在空气中反应生成锰酸钾(K2MnO4). ttghsegse1年前1
ttghsegse1年前1 -
 wangxiaokun122 共回答了18个问题
wangxiaokun122 共回答了18个问题 |采纳率83.3%6MnO2 + 2NH3 = 3Mn2O3 + N2 + 3H2O 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O 2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O1年前查看全部
- 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中Cl
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
A.反应中转移电子的物质的量是0.21mol
B.ClO3-的生成是由于温度升高引起的
C.苛性钾溶液中KOH的质量是16.8g
D.氯气被还原成0.06molClO-和0.03molClO3- yunzhongfan11年前1
yunzhongfan11年前1 -
 偶是养猪滴 共回答了21个问题
偶是养猪滴 共回答了21个问题 |采纳率95.2%解题思路:A.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化价和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,由ClO-、ClO3-的物质的量,结合Cl元素化合价变化计算转移电子数目;
B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾;
C.根据电子转移守恒计算n(Cl-),根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-),结合m=nM计算KOH质量;
C.ClO-、ClO3-都是氧化产物.A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故A正确;
B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故B正确;
C.根据电子转移守恒可知n(Cl-)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故C正确;
D.ClO-、ClO3-都是氧化产物,故D错误;
故选D.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查氧化还原反应的计算,注意根据原子守恒、转移电子守恒来分析解答,题目难度中等.1年前查看全部
- 将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中
将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO - 和ClO 3 - 两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是

A.苛性钾溶液中KOH的物质的量是0.09mol B.ClO 3 - 的生成是由于氯气的量的多少引起的 C.在酸性条件下ClO - 和ClO 3 - 可生成Cl 2 D.反应中转移电子的物质的量是0.21mol  当当迷茫1年前1
当当迷茫1年前1 -
 种田先生 共回答了23个问题
种田先生 共回答了23个问题 |采纳率87%D
根据图像可知反应后,生成KClO和KClO 3 分别是0.06mol和0.03mol,则根据电子的都是守恒可知,生成氯化钾是0.06mol×1+0.03mol×5=0.21mol。所以D正确,A不正确,应该是0.3mol。B不正确,应该和温度有关系;C不正确,两种离子不可能都得到电子,答案选D。1年前查看全部
- 13、某苛性钾样品中含有不与酸反应的杂质,
13、某苛性钾样品中含有不与酸反应的杂质,
为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液.取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL,则苛性钾的质量分数为( )
A、96%x05x05x05x05B、48%x05x05x05C、9.6%x05x05x05D、56% mystery11年前1
mystery11年前1 -
 zhousilei 共回答了28个问题
zhousilei 共回答了28个问题 |采纳率96.4%应该是24.00ml吧
25.00ml溶液中有0.14g样品,其中KOH质量m=0.005×24.00÷1000×2×56g
∴ω=9.6
答案选C1年前查看全部
- 为熔制钾玻璃准备如下熔料:360份重的石英砂,67.2份重的苛性钾和88.8份重的熟石灰 .假定这些熔料不含杂质.?
为熔制钾玻璃准备如下熔料:360份重的石英砂,67.2份重的苛性钾和88.8份重的熟石灰 .假定这些熔料不含杂质.?
(1)计算在制得的钾玻璃中各氧化物的质量分数.?
(2)用氧化物的形式表示钾玻璃的组成.
请写出过程!
答案是(1)K2O%:11.7% CaO%:13.9% SiO2%:74.4%
(2)K2O•2CaO•10SiO2
 孔夫子之师1年前1
孔夫子之师1年前1 -
 睿丫头 共回答了12个问题
睿丫头 共回答了12个问题 |采纳率83.3%67.2份重的苛性钾含氧化钾67.2/(112/94)=56.4份,
88.8份重的熟石灰中含氧化钙88.8/(74/56)=67.2份
总份数=360+56.4+67.2=483.6
(1)K2O%:56.4/483.6=11.7% CaO%:67.2/483.6=13.9%
SiO2%:67.2/483.6=74.4%
(2)
56.4/94:67.2/56:360/60=0.6:1.2:6=1:2:10
用氧化物的形式表示钾玻璃的组成为 :K2O•2CaO•10SiO21年前查看全部
- 写出这些物质的化学式纯碱,烧碱,乙醇,醋酸钠,苛性钾
 喜乐蒂乔丹1年前1
喜乐蒂乔丹1年前1 -
 萧骚 共回答了13个问题
萧骚 共回答了13个问题 |采纳率92.3%Na2CO3 NaOH C2H5OH CH3COONa KOH1年前查看全部
- 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中Cl
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示.下列说法正确的是( )
 A. 苛性钾溶液中KOH的质量是4.94g
A. 苛性钾溶液中KOH的质量是4.94g
B. 反应中转移电子的物质的量是0.21mol
C. 氧化性ClO-<ClO3-
D. ClO3-的生成是由于温度升高引起的 ajtkfbb1年前2
ajtkfbb1年前2 -
 olazy2007 共回答了20个问题
olazy2007 共回答了20个问题 |采纳率95%解题思路:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,结合m=nM计算氢氧化钾质量.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A错误;
B.该反应中转移电子的物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B正确;
C.根据已知条件无法判断次氯酸根离子和氯酸根离子氧化性强弱,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;
故选BD.点评:
本题考点: 氧化还原反应的计算;氯气的化学性质.
考点点评: 本题考查了氧化还原反应的计算,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,难度中等.1年前查看全部
- 苛性钠里的苛性是什么意思?学化学的时候发现KOH叫苛性钾,NAOH叫苛性钠,
 perfectdou1年前4
perfectdou1年前4 -
 195378618 共回答了23个问题
195378618 共回答了23个问题 |采纳率87%基本字义
1. 过于严厉:~刻.~毒.~求.~责.~待.
2. 繁重,使人难以忍受:~重(zhòng ).~捐杂税.
3. 腐蚀性:~性(如氢氧化钾、氢氧化钠等能腐蚀皮肤及纤维之类的化学性质).~性钠(烧碱).
苛性钠是人们对它的俗称,并不能说明所有带苛性的物质腐蚀性都比较强,就像笑气N2O,并非带着笑字就说明什么1年前查看全部
- 下列物质的归类是否正确单甘油脂——纯净物混甘油脂——混合物苛性钾———强电解质氢氯酸———弱电解质三氧化硫——非电解质
 bill_wenny1年前3
bill_wenny1年前3 -
 frenchxo 共回答了22个问题
frenchxo 共回答了22个问题 |采纳率81.8%单甘油脂——纯净物 对
混甘油脂——混合物 错,纯净物
苛性钾———强电解质 对
氢氯酸———弱电解质 错,强电解质
三氧化硫——非电解质 对1年前查看全部
- 苛性钾能与氢氧化镁或是氢氧化铝反应吗
 paralyzed1年前0
paralyzed1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中
将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO - 和ClO 3 - 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是 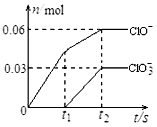 [ ]
[ ]A.苛性钾溶液中KOH的质量是4.94g
B.反应中转移电子的物质的量是0.42mol
C.氧化性ClO - <ClO 3 -
D.ClO 3 - 的生成是由于温度升高引起的 njhbgvfcdxs1年前1
njhbgvfcdxs1年前1 -
 jiaxiubig 共回答了16个问题
jiaxiubig 共回答了16个问题 |采纳率87.5%D1年前查看全部
- 配制易水解的钾盐溶液时,为什么加苛性钾溶液
 li017607091年前1
li017607091年前1 -
 bede2003 共回答了13个问题
bede2003 共回答了13个问题 |采纳率84.6%易水解的钾盐,一定是强碱弱酸盐,水解生成OH-,加入苛性钾后,溶液里面就会有大量的OH-,抑制水解,使钾盐溶液保持稳定.1年前查看全部
- 福尔马林是纯净物还是混合物?烧碱就是指氢氧化钠还是其水溶液?苛性钾是什么?乙醇是非电解质吗?
 abb2331年前7
abb2331年前7 -
 jonchou 共回答了16个问题
jonchou 共回答了16个问题 |采纳率93.8%福尔马林是甲醛的水溶液,所以是混合物
烧碱是指氢氧化钠固体,又叫火碱、苛性钠
苛性钾是氢氧化钾KOH
乙醇是非电解质,其化学式为CH3CH2OH或C2H5OH1年前查看全部
- 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中Cl
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
A.苛性钾溶液中KOH的物质的量是0.09mol
B.ClO3-的生成是由于氯气的量的多少引起的
C.在酸性条件下,ClO-和ClO3-可生成Cl2
D.反应中转移电子的物质的量是0.21mol shwy3471年前1
shwy3471年前1 -
 料理师 共回答了17个问题
料理师 共回答了17个问题 |采纳率82.4%解题思路:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,故A错误;
B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故B错误;
C.ClO-中Cl元素的化合价是+1价,ClO3-中Cl元素的化合价是+5价,因此两者反应不可能生成Cl2,故C错误;
D.根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,故D正确;
故选D.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;化学方程式的有关计算.
考点点评: 本题考查了氧化还原反应的计算,为高频考点,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.1年前查看全部
- (4)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其
(4)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应
时间(t)的变化示意图如右图所示.该苛性钾溶液中KOH的质量是——————,该反应中转移电子的物质的量是————————.
Y推出来是Cl,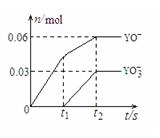
 joecy19871年前3
joecy19871年前3 -
 shurkey 共回答了15个问题
shurkey 共回答了15个问题 |采纳率93.3%1次氯酸根:1氯离子 1氯酸根:5氯离子
0.06mol 0.06mol 0.03mol 0.15mol
根据溶液电中性可知上述阴离子物质的量之和等于苛性钾的物质的量即0.3mol即16.8g
转移的电子全生成了氯离子即转移的电子的物质的量等于氯离子的物质的量即0.21mol1年前查看全部
- 在碳酸氢钙溶液中加入少量苛性钾溶液的离子方程式
 一泓深潭1年前1
一泓深潭1年前1 -
 olsscn 共回答了18个问题
olsscn 共回答了18个问题 |采纳率94.4%Ca2++HCO3-+OH-=CaCO3+H2O1年前查看全部
- 物质的量浓度问题为测定苛性钾(KOH)的纯度,取样品0.5600 g溶于水配制成1 L溶液,取此溶液25.00mL,用去
物质的量浓度问题
为测定苛性钾(KOH)的纯度,取样品0.5600 g溶于水配制成1 L溶液,取此溶液25.00mL,用去0.0050mol/L H2SO4溶液24.00mL,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)多少? wywyzx2221年前1
wywyzx2221年前1 -
 qiniade 共回答了19个问题
qiniade 共回答了19个问题 |采纳率89.5%设纯度为X
2KOH + H2SO4 == K2SO4 + 2H2O
112g 1mol
0.56X*25/1000 0.005*0.024
X=0.96=96%1年前查看全部
大家在问
- 1读等高线地形图,按要求完成: (1)填出图中字母表示的地形名:A、______B、______C、______E、___
- 2Don't____until tomorrow what can be done today.
- 3土星5号火箭升和现代航天飞机升空时,宇航员所承受的压力和哪个更大?为什么?
- 4Never put ——what you should get down ——doing today until tom
- 5氢 氮 氧三种元素组成的化合物都是共价键吗
- 64乘以a的平方乘以(x-y)+b的平方乘以(y-x)分解因式
- 7翻译:熊猫长期以来被列为濒危物种.(list as,an endangered species)
- 8一桶油连桶共重85kg 到出油的五分之三后,连桶重40千克,桶重多少千克?
- 9坐标 X 和Y各代表什么,怎么能知道是在哪个角上呢
- 10有一头熊,在世界上的某一点向南走了5米,再向东走5米,再向北走5米,回到原点.问这熊是什么颜色的.
- 11求解一道高中等效平衡的题氮氢合成氨⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol
- 12比喻受恩而给予厚报.——一( )千金
- 13have a discussion about=
- 14英语翻译当然我存在一些不足、不过我会正视缺点、坚持原则不断努力、选择这个职业除了对口外、本人也十分喜欢这个职业、相信它能
- 15如图表示撑杆跳高运动的几个阶段:助跑、撑杆起跳、越横杆.在这几个阶段中能量的转化情况是:①助跑阶段,运动员消耗体内的化学
