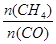合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH 4 (g)+H
 xlucky2022-10-04 11:39:541条回答
xlucky2022-10-04 11:39:541条回答 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH 4 (g)+H 2 O(g)⇌CO(g)+3H 2 (g)△H 1 =+206.1kJ/mol 请回答下列问题: (1)在一密闭容器中进行反应①,测得CH 4 的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______. (2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH 4 和CO 2 ,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH 4 的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH 4 的转化率随时间变化的图象. (3)反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)800℃时,反应的化学平衡常数K=1.0. ①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断 ②800℃时,向体积为2L的密闭容器中充入2molCO和4molH 2 O,求达到平衡时CO的转化率. |

已提交,审核后显示!提交回复
共1条回复
 wuweiguowwg 共回答了17个问题
wuweiguowwg 共回答了17个问题 |采纳率82.4%- (1)由图可知,由图可知,在5~10分钟、12分钟后,甲烷浓度不变,是平衡状态;10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:5~10分钟、12分钟后;升高温度;
(2)甲、乙两容器中分别充入等物质的量的CH 4 和CO 2 ,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH 4 +CO 2 ⇌2CO+2H 2 ,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH 4 的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH 4 的转化率随时间变化的图象为: ,
,
故答案为: ;
;
(3)由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Qc=
2.0×2.0
2.0×8.5 <K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:a;
②800℃时,反应的化学平衡常数K=1.0,向体积为2L的密闭容器中充入2mol CO和4mol H 2 O,设参加反应的CO为xmol;
CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)
起始量(mol):2 4 0 0
转化量(mol):x x x x
平衡量(mol):2-x 4-x xx
K=
c(C O 2 )c( H 2 )
c(CO)c( H 2 O) =
x
2 •
x
2
2-x
2 •
4-x
2 =1,
所以x=
4
3 mol,
所以平衡时CO的转化率为:
4
3 mol
2mol ×100%=66.7%,
答:达到平衡时CO的转化率66.7%. - 1年前
相关推荐
- 解下化学题目二甲醚(CH3OCH3)沸点-24.91.相同条件下,二甲醚与乙烯的燃烧热是否一样?理由2.二甲醚可有合成气
解下化学题目
二甲醚(CH3OCH3)沸点-24.9
1.相同条件下,二甲醚与乙烯的燃烧热是否一样?理由
2.二甲醚可有合成气(CO+H2)在一定条件下制得.
方程式:
3.以二甲醚、空气、氢氧化钾溶液为原料,以石墨为电极可构成燃料电池.负极电极反应式:
要求详细解析 rene12111年前3
rene12111年前3 -
 nbdflqn 共回答了15个问题
nbdflqn 共回答了15个问题 |采纳率100%1.相同条件下,二甲醚与乙烯的燃烧热是否一样?
理由:CH3-O-CH3可以写作是C2H4·H2O
C2H4+3O2→2CO2+2H2O
C2H4·H2O+3O2→2CO2+3H2O
明显可以看出二甲醚多生成了一份水,水气化要从反应中吸热,所以相同条件下,二甲醚与乙烯的燃烧热不一样.
2.二甲醚可由合成气(CO+H2)在一定条件下制得.
方程式:2CO + 4H2 → CH3OCH3 + H2O
3.以二甲醚、空气、氢氧化钾溶液为原料,以石墨为电极可构成燃料电池.
负极电极反应式:负极,C2H6O - 12e- + 16OH- = 2CO3^2- + 11H2O
正极电极反应式:正极,6H2O+3O2+12e-=12OH-
总反应,C2H6O + 3O2 + 4OH- = 2CO3^2- + 5H2O1年前查看全部
- 一碳化学是指以研究分子中只含一个碳原子的化合物[如甲烷(CH 4 )、合成气(CO和H 2 )、CO 2 、CH 3 O
一碳化学是指以研究分子中只含一个碳原子的化合物[如甲烷(ch 4 )、合成气(co和h 2 )、co 2 、ch 3 oh等]为原料来合成一系列化工原料和燃料的化学。科学家提出一种“绿色***”构想:把空气吹入碳酸钾溶液,然后再把co 2 从溶液中提取出来,经化学反应后使空气中的co 2 转变为其它化工原料,如下图所示。 
(1)碳酸钾溶液所起的作用是__________。
(2)目前工业上有一种方法是用co 2 来生产燃料甲醇。一定条件下发生反应:co 2 (g)+3h 2 (g) ch 3 oh(g)+h 2 o(g)
ch 3 oh(g)+h 2 o(g)
① 下图表示该反应过程中能量(单位为kj/mol)的变化,关于该反应的下列说法中,正确的是__________ (填字母)。
a.△h>0,△s>0b.△h>0,△s<0
c.△h<0,△s<0d.△h<0,△s>0
在上图中,曲线_______ (填:a或b)表示使用了催化剂。
② 在压强为5mpa,体积为vl的反应室中,bmolco 2 与 3bmolh 2 在催化剂作用下反应生成甲醇,co 2 的转化率与某物理量的关系如下图。则表中横坐标的物理量为__________,r1时该反应的平衡常数k=________________(用含字母的代数式表示)。当该物理量从r1到 r2进行改变,平衡常数k将________(填“增大”、“不变”或“减小”)。
(3)过氧化尿素合成反应式如下:co(nh 2 ) 2 +h 2 o 2 → co(nh 2 ) 2 ·h 2 o 2 △h<0。当n (过氧化氢):n (尿素) 为 1.3∶1,反应时间45 min,用水杨酸作为稳定剂,分别考察反应温度对反应效果的影响如下图所示(活性氧含量可视为co(nh 2 ) 2 ·h 2 o 2 产量的直观表示) 
从图中可以看出,在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少。
① 根据图中信息,最佳反应温度为__________________。
② 如何说明该反应中在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少_________________ 。 ka399901年前1
ka399901年前1 -
 mingmei70 共回答了15个问题
mingmei70 共回答了15个问题 |采纳率93.3%1年前查看全部
- (2011•南京一模)以天然气为原料经由合成气(C0、H2)制化学品是目前天然气转化利用的主导技术路线. 以甲
(2011•南京一模)以天然气为原料经由合成气(C0、H2)制化学品是目前天然气转化利用的主导技术路线. 以甲烷的部分氧化为基础制备甲醚(CH3OCH3)和甲醇的工业流程如下:

(1)甲烷的部分氧化反应如下:
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71.2kJ•mol-1
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ•mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ•mol-1
则△H2=______.
(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H______0 (填“<”、“>”或“=”)
(3)催化反应室2中发生如下反应:CO(g)+2H2(g)═CH30H(g)△H<0
在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器分别充入a mol C0和2a mol H2,三个容器的反应 温度分别为T1、T2、T3且恒定不变,在其他条件相同情况下.实验测得反应均进行到t min 时CO 的体积分数如下图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______;都达到化学平衡状态时,C0转化率最小的是______.
(4)如下图为熔融碳酸盐燃料电池的工作原理示意图. 熔融碳酸盐燃料电池的正极反应可表示为:______.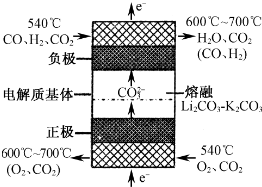
 quming101年前1
quming101年前1 -
 nn的nn 共回答了19个问题
nn的nn 共回答了19个问题 |采纳率73.7%解题思路:(1)根据盖斯定律[1/2]×(①+②+③×2)得2CH4(g)+O2(g)═2CO(g)+4H2(g),据此计算△H2;
(2)该反应为熵值减小的反应,根据△G=△H-T△S,△G<0反应自发进行,据此判断;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,根据温度与体积分数的关系判断是否处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低;
(4)电池的工作原理示意图可知,氧气在正极放电,在二氧化碳条件下,反应生成碳酸根.(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ•mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ•mol-1
根据盖斯定律[1/2]×(①+②+③×2)得2CH4(g)+O2(g)═2CO(g)+4H2(g),
故[1/2]×(△H1+△H2+△H3)=-71.2kJ•mol-1,
所以[1/2]×(-890.3kJ•mol-1+△H2+2×250.3kJ•mol-1)=-71.2kJ•mol-1,
解得△H2=+247.3kJ•mol-1,
故答案为:+247.3kJ•mol-1;
(2)该反应为熵值减小的反应,△G=△H-T△S,△G<0反应自发进行,故△H<0,
故答案为:<;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,由图可知温度T2>T1,体积分数φ(Ⅰ)>φ(Ⅱ),故Ⅰ未到达平衡.T3>T2,体积分数φ(Ⅲ)>φ(Ⅱ),故Ⅲ处于平衡状态,容器Ⅱ不能确定是否处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低,故Ⅲ的转化率最低,
故答案为:Ⅲ;Ⅲ;
(4)氧气在正极放电,在二氧化碳条件下,反生成碳酸根,正极反应式为:O2+4e-+2CO2═2CO32-,
故答案为:O2+4e-+2CO2═2CO32-.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡的调控作用.
考点点评: 本题考查根据盖斯定律进行反应热的计算、反应方向的判断、化学平衡图象与影响因素、原电池原理等,难度中等,(3)中注意根据温度与体积分数判断是否处于平衡状态,本质是温度对化学平衡的影响.1年前查看全部
- 二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=______kJ•mol-1.
(2)下列措施中,能提高CH3OCH3产率的有______.
A.使用过量的COB.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是______.
(4)将合成气以
=2通入1L的反应器中,一定条件下发生反应:n(H2) n(CO)
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是______.
A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时
=3,则达到平衡时,CO转化率小于50%n(H2) n(CO)
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚.观察图2回答问题.催化剂中
约为______时最有利于二甲醚的合成.n(Mn) n(Cu)
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为______.
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4.与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是______. hzylxz1年前1
hzylxz1年前1 -
 风雨涛 共回答了13个问题
风雨涛 共回答了13个问题 |采纳率100%解题思路:(1)依据热化学方程式和盖斯定律计算得到;
(2)提高CH3OCH3产率,则平衡正向移动,根据影响平衡的因素分析;
(3)根据提高CH3OCH3产率,则平衡正向移动,根据反应③对反应②的影响分析;
(4)A.根据温度对CO的转化率的影响分析;
B.该反应正方向为体积减小的方向,根据压强对CO转化率的影响分析;
C.若在P3和316℃时,起始时
=3,则增大了氢气的量;n(H2) n(CO)
(5)根据图中生成二甲醚的最大值分析;
(6)酸性条件下,二甲醚失电子生成二氧化碳;
(7)根据硫酸的性质分析.(1)已知①CO( g)+2H2(g)⇌CH3OH( g)△H1=-90.7kJ•mol-1,
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1,
故答案为:-246.1;
(2)A.增大反应物的浓度平衡正移,所以使用过量的CO,能提高CH3OCH3产率,故A正确;
B.该反应为放热反应,升高温度平衡逆移,则CH3OCH3产率会降低,故B错误;
C.该反应正方向为体积减小的方向,所以增大压强平衡正移,能提高CH3OCH3产率,故C正确;
故答案为:AC;
(3)已知反应③CO(g)+H2O(g)⇌CO2(g)+H2(g),能消耗水,使反应②中生成为水的量减少,平衡正向移动,所以CH3OCH3的量增加;
故答案为:消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;
(4)A.由图可知随温度升高,CO的转化率降低,说明升高温度平衡逆移,则正方向为放热反应,故△H<0,故A正确;
B.该反应正方向为体积减小的方向,增大压强CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时
n(H2)
n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,故C错误;
故答案为:A;
(5)由图可知当催化剂中
n(Mn)
n(Cu)约为2时,CO的转化率最大,生成二甲醚的最多;
故答案为:2;
(6)酸性条件下,二甲醚在负极失电子生成二氧化碳,其电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
故答案为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
(7)该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备;
故答案为:H2SO4腐蚀设备或有硫酸废液产生.点评:
本题考点: 化学平衡的调控作用;热化学方程式;原电池和电解池的工作原理;化学平衡的影响因素.
考点点评: 本题考考查了热化学方程式和盖斯定律计算应用,影响平衡的因素分析判断,原电池原理的分析应用,题目涉及的知识点较多,综合性较强,题目难中等.1年前查看全部
- 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料
 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
①CO(g)+2H2(g )⇌CH3OH(g);△H1=90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g);△H2=23.5kJ•mol-1
③CO(g)+H2O⇌(g)CO2(g)+H2(g);△H3=41.2kJ•mol-1
(1)-步法合成二甲醚的总反应可表示为3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),该反应的AH=______.平衡常数表达式为K=c(CH3OCH3)•c(CO2) c3(CO)•c3(H2) K=.c(CH3OCH3)•c(CO2) c3(CO)•c3(H2)
(2)另一种合成二甲醚的方法称为“二步法”,该工艺为让反应①和反应②分别在不同的反应器中进行,无反应③发生,而“一步法”的反应③的发生提高了CH3OCH3的产率,原因是______.
(3)由CO2加氢直接合成二甲醚可以消除过度CO2排放对环境的影响.当在合成反应器中加入碳氢比[n(CO2)/n(H2)]为1:3的混合气体,在一定条件下反应得到二甲醚和水蒸气,实现了CO2的减排目的.该反应的反应方程式为2CO2+6H2
CH3OCH3+3H2O一定条件 .2CO2+6H2;判断该反应在一定温度下,体积恒定的密闭容器中下列不能作为达到化学平衡状态的依据是______
CH3OCH3+3H2O一定条件 .
A.容器的密度不变
B.容器内压强保持不变
C,平均摩尔质量保持不变
D.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
(4)以二甲醚为燃料的燃料电池工作原理如图所示:则正极为______(填A极或B极),写出A电极反应式______. 狂欢七晚上1年前1
狂欢七晚上1年前1 -
 aiya129 共回答了12个问题
aiya129 共回答了12个问题 |采纳率100%解题思路:(1)依据热化学方程式和盖斯定律计算得到,根据平衡常数概念写出计算表达式,平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(3)当在合成反应器中加入碳氢比[n(CO2)/n(H2)]为1:3的混合气体,在二定条件下反应得到二甲醚和水蒸气,依据原子守恒写出化学方程式;化学平衡状态的标志是正逆反应速率相同,各组分浓度保持不变,分析选项判断;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,A极为负极,二甲醚放电生成二氧化碳与氢离子.(1)已知①CO( g)+2H2(g)⇌CH3OH( g)△H1=-90.7KJ•mol-1,
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-23.5KJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2KJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1KJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以k=
c(CH3OCH3)•c(CO2)
c3(CO)•c3(H2),
故答案为:-246.1KJ•mol-1;
c(CH3OCH3)•c(CO2)
c3(CO)•c3(H2);
(2)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(3)当在合成反应器中加入碳氢比[n(CO2)/n(H2)]为1:3的混合气体,在二定条件下反应得到二甲醚和水蒸气,实现了CO2的减排目的.该反应的反应方程式为:2CO2+6H2
一定条件
.
CH3OCH3+3H2O,在一定温度下,体积恒定的密闭容器中下列不能作为达到化学平衡状态的依据是:
A.反应前后气体质量守恒,体积固定,所以过程中密度不变,容器的密度不变不能证明反应达到平衡,故A错误;
B.反应前后气体体积变化,容器内压强保持不变说明反应大平衡,故B正确;
C,气体在数和,反应前后气体物质的量发生变化,平均摩尔质量保持不变说明反应达到平衡,故C正确;
D.单位时间内消耗2mol CO2,同时消耗1mol二甲醚证明反应的正逆反应速率相同,能说明反应达到平衡,故D正确;
故答案为:2CO2+6H2
一定条件
.
CH3OCH3+3H2O;A;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,A极为负极,B为正极,二甲醚放电生成二氧化碳与氢离子,A电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:B;CH3OCH3+3H2O-12e-=2CO2+12H+.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考考查了热化学方程式和盖斯定律计算应用,平衡常数计算,影响平衡的因素分析判断,原电池原理的分析应用,题目难中等.1年前查看全部
- 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚
 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式______.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示.
3min时改变条件,反应进行到4min时,体系中各物质的物质的量如下表所示:
则3~4min之间,平衡向______(填“正”或“逆”)反应方向移动,3min时改变的条件是______.t/min n(CH4)/mol n(H2O)/mol n(CO)/mol n(H2)/mol 4 0.18 0.38 0.22 0.66
(3)已知温度、压强和碳水比[
]对该反应的影响如图所示.n(CH4) n(H2O) 
①图l中,两条曲线所示温度的关系:t1______t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1______x2.
③图3中,两条曲线所示压强的关系:p1______p2.
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示.
①放电时,正极的电极反应式为______.
②假设装置中盛装100.0mL 3.0mol•L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960mL.放电完毕后,电解质溶液中各离子浓度的大小关系为______. xxxmly1年前1
xxxmly1年前1 -
 cc欲男 共回答了19个问题
cc欲男 共回答了19个问题 |采纳率100%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;(2)根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;②碳水比[n(CH4)n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高;③根据压强对平衡移动影响,结合图象分析解答;(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子;②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.(1)已知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ•mol-1;
(2)根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.20.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度t1<t2,故答案为:<;
②碳水比[
n(CH4)
n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为[8.96L/22.4L/mol]=0.4mol,根据电子转移守恒可知,生成二氧化碳为[0.4mol×4/8]=0.2mol,n(NaOH)=0.1L×3.0mol•L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,介于1:1与2:1之间,故生成碳酸钾、碳酸氢钾,令碳酸钾、碳酸氢钾的物质的量分别为xmol、ymol,则x+y=0.2,2x+y=0.3,解得x=0.1,y=0.1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).点评:
本题考点: 物质的量或浓度随时间的变化曲线;热化学方程式;化学电源新型电池;体积百分含量随温度、压强变化曲线.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,难度中等,是对基础知识与学生能力的综合考查.1年前查看全部
- 煤制烯烃中的合成气?写论文用要求详细些明煤制烯烃中的合成气的主要产品和产品所需的必要条件,能提供案例就更好了
 敦厚kk热乎乎1年前2
敦厚kk热乎乎1年前2 -
 雨上景 共回答了18个问题
雨上景 共回答了18个问题 |采纳率94.4%煤制烯烃的关键是先把煤制成甲醇,那么煤经过前期的汽化和净化后得到的合成气主要就是用来制造甲醇的.而用于生产甲醇的合成气要求是(H2-CO2)/(CO+CO2)≈2 惠生清洁能源南京工厂为满足园区煤制合成气装置的氧气和氮气所需,与空气产品公司签署了40000立方米/小时氧气和12000立方米/小时氮气的气体供应合同,目前能够提供30万吨/年甲醇和21000立方米/小时氢气等化工原料,同时作为甲醇制烯烃的示范项目也将甲醇转化为生产高品质多碳醇等化工产品的原料,每年将生产29.5万吨乙烯和丙烯中间产品.1年前查看全部
- 合成气与Fe2O3反应的一个化学方程式
 北极星831年前4
北极星831年前4 -
 杨蓝蓝蓝 共回答了13个问题
杨蓝蓝蓝 共回答了13个问题 |采纳率84.6%合成气主要是H2和CO
3H2+Fe2O3=高温=2Fe+3H2O
3CO+Fe2O3=高温=2Fe+3CO21年前查看全部
- Ⅰ、CO和H 2 的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH 4 )、重油、煤在高温下均
Ⅰ、CO和H 2 的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH 4 )、重油、煤在高温下均可与水蒸气反应制得合成气.
(1)已知某反应的平衡常数表达式为:K=
,它所对应的化学方程式为:______.c( H 2 )•c(CO) c( H 2 O)
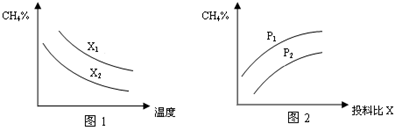
(2)向体积为2L的密闭容器中充入CH 4 和H 2 O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔
)对该反应的影响如图所示.n(C H 4 ) n( H 2 O) 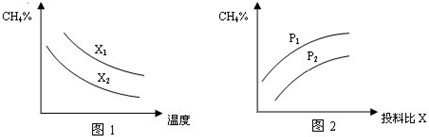
①图1中的两条曲线所示投料比的关系X 2 ______X 1 (填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P 2 ______P 1
(3)以CH 4 、O 2 为原料可设计成燃料电池:
①设装置中盛有150.0mL1.0mol/LKOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,放电过程中转移电子的物质的量为______.
②以H 2 SO 4 溶液代替KOH溶液为电解质溶液,则燃料电池的负极反应式为:______.
Ⅱ、(1)有一种用CO 2 生产甲醇燃料的方法:
已知:CO 2 (g)+3H 2 (g)⇌CH 3 OH(g)+H 2 O(g)△H=-akJ•mol -1 ;
CH 3 OH(g)═CH 3 OH(l)△H=-bkJ•mol -1 ;
2H 2 (g)+O 2 (g)═2H 2 O(g)△H=-ckJ•mol -1 ;
H 2 O(g)═H 2 O(l)△H=-dkJ•mol -1 ,
则表示CH 3 OH(l)燃烧热的热化学方程式为:______.
(2)已知某温度下Mg(OH) 2 的Ksp=6.4xl0 -12 ,当溶液中c(Mg 2+ )≤1.0×10 -5 mol•L -1 可视为沉淀完全,则应保持溶液中c(OH - )≥______mol•L -1 . Arjoewi1年前1
Arjoewi1年前1 -
 oiaa 共回答了20个问题
oiaa 共回答了20个问题 |采纳率95%Ⅰ、(1)平衡表达式为:K=
c( H 2 )•c(CO)
c( H 2 O) ,生成物为CO、H 2 ,反应物含有H 2 O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H 2 O(g)⇌CO(g)+H 2 (g),
故答案为:C(s)+H 2 O(g)⇌CO(g)+H 2 (g);
(2)CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g);
①碳水比
n(C H 4 )
n( H 2 O) 值越大,平衡时甲烷的转化率越低,含量越高,故x 2 <x 1 ,故答案为:<;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p 2 <p 1 ,故答案为:<;
(3)①参与反应的氧气在标准状况下体积为4.48L,物质的量为
4.48L
22.4L/mol =0.2mol,氢转移电子的物质的量为0.2mol×4=0.8mol,故答案为:0.8mol;
②以H 2 SO 4 溶液代替KOH溶液为电解质溶液,失电子的做负极发生氧化反应,CH 4 +2H 2 O-8e - =CO 2 +8H + ,故答案为:CH 4 +2H 2 O-8e - =CO 2 +8H + ;
Ⅱ、(1)已知①CO 2 (g)+3H 2 (g)⇌CH 3 OH(g)+H 2 O(g)△H=-a kJ•mol -1 ;
②CH 3 OH(g)═CH 3 OH(l)△H=-b kJ•mol -1 ;
③2H 2 (g)+O 2 (g)═2H 2 O(g)△H=-c kJ•mol -1 ;
④H 2 O(g)═H 2 O(l)△H=-d kJ•mol -1 ,
由盖斯定律,(-①×2-②×2+③×3+④×4)÷2得CH 3 OH(l)+
3
2 O 2 (g)=CO2(g)+2H 2 O(l),故△H=(a+b-
3
2 c-2d) kJ∕mol,
故答案为:CH 3 OH(l)+
3
2 O 2 (g)=CO2(g)+2H 2 O(l),故△H=(a+b-
3
2 c-2d) kJ∕mol;
(2)Mg(OH) 2 的Ksp=6.4×10 -12 ,当溶液中c(Mg 2+ )≤1.0×10 -5 mol•L -1 可视为沉淀完全,则Ksp=c(Mg 2+ )×c 2 (OH - )=6.4×10 -12 ,c(OH - )≥8×10 -4 mol/L,故答案为:8×10 -4 .1年前查看全部
- (2013•长春一模)以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物
 (2013•长春一模)以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013•长春一模)以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”).
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1______0 (填“>”、“=”或“<”).温 度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______.
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
①该电池工作时,c口通入的物质为______;该电池负极的电极反应式为:______.
②工作一段时间后,当6.4g甲醇完全反应生成CO2时,有______NA个电子转移.
③若该电池通入O2的量为1L(标准状况),且反应完全,则用此电池来电解NaCl溶液(惰性电极),最多能产生Cl2的体积为______L(标准状况). guest99251年前1
guest99251年前1 -
 3396868 共回答了18个问题
3396868 共回答了18个问题 |采纳率94.4%解题思路:(1)①“原子经济”原则是:原子经济性是绿色化学以及化学反应的一个专有名词.绿色化学的“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②依据平衡常数随温度变化分析,结合平衡移动原理分析热量变化;
③依据化学平衡的三段式列式计算,依据转化率概念计算得到;根据浓度计算出平衡常数,再判断温度;
(2)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
(3)①在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应;
②根据电极反应以及电子守恒来计算转移电子的量;
③根据电子守恒找出氧气与氯气的关系式,据此计算出标况下氯气的体积.(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
分析反应可知反应Ⅰ符合,
故答案为:Ⅰ;
②依据图表数据分析,随温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)⇌CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=[1.6mol/2mol]×100%=80%,
此时的平衡常数为:K=
1.6
2
0.4
2×(
2.8
2)2≈2.041,所以温度为250℃,
故答案为:80%;250;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
利用盖斯定律将[①−②/2]+③×2可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5 kJ∕mol;
(3)①在甲醇燃料电池中,燃料甲醇作负极,氧气作正极,电解质中的阳离子移向正极,所以c口通入的物质为氧气,b口通入的物质为甲醇;负极甲醇除去电子生成二氧化碳,电极反应式为:CH3OH+H2O-6e-=CO2+6H+,
故答案为:O2;CH3OH+H2O-6e-=CO2+6H+;
②当6.4g即0.2mol甲醇完全反应生成CO2时,根据总反应:2CH3OH+3O2=2CO2+4H2O,消耗氧气0.3mol,转移电子1.2mol,即个数为1.2NA,
故答案为:1.2;
③1mol氧气完全反应得到4mol电子,生成1mol氯气需要失去2mol电子,氧气与氯气的关系式为:O2~2Cl2,所以消耗标况下1L氧气会得到2L氯气,
故答案为:2.点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;化学电源新型电池;电解原理.
考点点评: 本题考查了化学平衡的有关计算、热化学方程式的书写、电解池原理等知识点,题目难度较大,本题是一道较综合知识题目,试题考查的角度较广,注意掌握电解原理,能够根据盖斯定律书写热化学方程式.1年前查看全部
- 利用合成气(H 2 +CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可转化成醛、酸、酯等多种产物:下列表述正确的是
利用合成气(H 2 +CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可转化成醛、酸、酯等多种产物:下列表述正确的是 [ ]①以合成气为原料的反应都是化合反应
②改变合成气中CO与H 2 的体积比,可以得到不同产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
④从合成气出发生产液态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有稀烃或水
A ①②④
B ②③④
C ②④⑤
D ③④⑤ 刘芸1年前1
刘芸1年前1 -
 漫步地球村 共回答了17个问题
漫步地球村 共回答了17个问题 |采纳率82.4%B1年前查看全部
- 工业上制备合成气的工艺主要是水蒸气重整甲烷: CH 4 ( g )+ H 2 O ( g ) CO ( g )+ 3H
工业上制备合成气的工艺主要是水蒸气重整甲烷: CH 4 ( g )+ H 2 O ( g )
 CO ( g )+ 3H 2 ( g ); △ H =+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH 4 和1 mol H 2 O,测得CH 4 (g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是()
CO ( g )+ 3H 2 ( g ); △ H =+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH 4 和1 mol H 2 O,测得CH 4 (g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是()
A.10min时用CH 4 表示的反应速率为0.075 mol•L - 1 •min - 1 B.使用高效催化剂能够增大CO的产率 C.该条件下反应的平衡常数为0.1875 D.升高温度能使 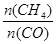 增大
增大 梅雨雁雁1年前1
梅雨雁雁1年前1 -
 迢迢织女星 共回答了16个问题
迢迢织女星 共回答了16个问题 |采纳率93.8%1年前查看全部
- (2010•梅州一模)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.
(2010•梅州一模)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.

请回答下列问题:
(1)在一密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=+247.3kJ/mol,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是______(填序号).CO H2O CO2 H2 0.5mol 8.5mol 2.0mol 2.0mol
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断. lovekingshikong1年前1
lovekingshikong1年前1 -
 喝西北风的猫 共回答了21个问题
喝西北风的猫 共回答了21个问题 |采纳率100%解题思路:(1)根据V=[△C/△t]求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
(2)由于CH4(g)+CO2(g)⇌2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动;
(3)根据浓度熵Q与平衡常数K的大小来判断v(正)和v(逆)的大小.(1)CH4的化学反应速率为V=[△C/△t]=[0.5mol/L/5min]=0.1mol/(L•min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L•min),故答案为:0.3mol/(L•min);
根据图象可知化学反应速率加快,化学平衡正向移动,根据外界条件对化学反应速率的影响和对化学平衡的影响,可用升高温度或充入水蒸气来达到目的,故答案为:升高温度或充入水蒸气;
(2)因CH4(g)+CO2(g)⇌2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动,所以到达平衡的时间长,甲烷的转化率提高,其图象为: ,故答案为:
,故答案为: .
.
(3)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在某时刻的浓度幂之积为Q=
C(H2)×C(CO2)
C(CO)×C(H2O)=[2×2/0.5×8.5]=0.94<1.0,反应正向进行,v(正)>v(逆),故选:a.点评:
本题考点: 化学平衡的影响因素;物质的量或浓度随时间的变化曲线;化学平衡的计算.
考点点评: 本题主要考查了化学反应速率的计算、外界条件对化学反应速率和平衡的影响等,难度中等.1年前查看全部
- 合成气(CO+H 2 )是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃
合成气(CO+H 2 )是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH 3 OCH 3 )等物质。其工艺流程如下:
(1)写出用合成气生产二甲醚的化学方程式 。 (2)尾气循环中涉及到以下反应:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g),请写出某温度下该反应的平衡常数表达式 。
(2)尾气循环中涉及到以下反应:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g),请写出某温度下该反应的平衡常数表达式 。
(3)工业上一般采用下列两种反应合成甲醇: 反应Ⅰ: CO(g)+2H 2 (g) CH 3 OH(g)
反应Ⅰ: CO(g)+2H 2 (g) CH 3 OH(g) 
 反应Ⅱ:CO 2 (g)+3H 2 (g) CH 3 (g)+H 2 O(g)
反应Ⅱ:CO 2 (g)+3H 2 (g) CH 3 (g)+H 2 O(g)
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
由表中数据判断温度 250 300 350 K 2.041 0.270 0.012  0(填“>”、“=”、“<”)。
0(填“>”、“=”、“<”)。
②已和:
CH 3 OH(g)+ O 2 (g)
O 2 (g) =-192.9kJ·mol -1
=-192.9kJ·mol -1
H 2 (g)+ O 2 (g)
O 2 (g) =-241.8kJ·mol -1
=-241.8kJ·mol -1
则 = 。
= 。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式 。 zhilmh19821年前1
zhilmh19821年前1 -
 luqingchun 共回答了16个问题
luqingchun 共回答了16个问题 |采纳率100%1年前查看全部
- (2014•淮南二模)煤化工的产品很多,如合成气(CO、H2)、甲醇等对煤炭工业转型具有重要意义.下列说法不正确的是(
(2014•淮南二模)煤化工的产品很多,如合成气(CO、H2)、甲醇等对煤炭工业转型具有重要意义.下列说法不正确的是( )
A.煤转化为气态燃料,可以降低碳的排放
B.甲醇的沸点是64.5℃,甲醇中的水分可采用蒸馏法分离
C.工业上利用饱和的K2CO3溶液分离回收废气中的CO2,符合低碳经济理念
D.采用内衬聚四氟乙烯的钢管输送合成气,可有效减缓钢管的腐蚀 美-美1年前1
美-美1年前1 -
 小小泥鳅 共回答了18个问题
小小泥鳅 共回答了18个问题 |采纳率88.9%解题思路:A.碳燃烧生成二氧化碳;
B.甲醇的沸点和水的沸点不同;
C.用饱和的K2CO3溶液分离回收废气中的CO2可减少二氧化碳的排放;
D.聚四氟乙烯性质稳定.A.碳燃烧生成二氧化碳,生成二氧化碳的量不变,故A错误;
B.甲醇的沸点和水的沸点不同,可用蒸馏法分离,故B正确;
C.用饱和的K2CO3溶液分离回收废气中的CO2可减少二氧化碳的排放,符合低碳经济理念,故C正确;
D.聚四氟乙烯性质稳定与合成气不反应,可有效减缓钢管的腐蚀,故D正确.
故选A.点评:
本题考点: 煤的干馏和综合利用;化石燃料与基本化工原料.
考点点评: 本题考查化石燃料与基本化工原料,题目难度不大,本题注意相关物质的性质的异同,为解答该题的关键.1年前查看全部
- “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H 2 为主的合成气,合成气有广泛应用。试回答
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H 2 为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO 2 (g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO 2 (g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO 2 )="0.025" mol·L -1 ,c(CO)="0.1" mol·L -1 ,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO 2 来生产燃料甲醇,有关反应为:CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g) ΔH=-49.0 kJ·mol -1 ,现向体积为1 L的密闭容器中,充入1 mol CO 2 和3 mol H 2 ,反应过程中测得CO 2 和CH 3 OH(g)的浓度随时间的变化如图所示。
CH 3 OH(g)+H 2 O(g) ΔH=-49.0 kJ·mol -1 ,现向体积为1 L的密闭容器中,充入1 mol CO 2 和3 mol H 2 ,反应过程中测得CO 2 和CH 3 OH(g)的浓度随时间的变化如图所示。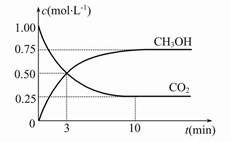
①从反应开始到平衡,氢气的平均反应速率v(H 2 )= 。
②反应达到平衡后,下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
E.充入He(g)A.升高温度 B.再充入H 2 C.再充入CO 2 D.将H 2 O(g)从体系中分离  牧马人20051年前1
牧马人20051年前1 -
 事事非非中 共回答了19个问题
事事非非中 共回答了19个问题 |采纳率89.5%(1)①增大
②右因为c(CO 2 )/c(CO)=0.25<0.263
(2)①0.225 mol/(L·min)②B、D
(1)①因为炼铁反应为吸热反应,升高温度,平衡常数增大。
②FeO(s)+CO(g) CFe(s)+CO 2 (g)在1 100 ℃时的平衡常数为0.263,此时Q c =c(CO 2 )/c(CO)="0.025" mol·L - 1 /0.1 mol·L - 1 =0.25<0.263,说明反应没有达到平衡,反应向右进行。
CFe(s)+CO 2 (g)在1 100 ℃时的平衡常数为0.263,此时Q c =c(CO 2 )/c(CO)="0.025" mol·L - 1 /0.1 mol·L - 1 =0.25<0.263,说明反应没有达到平衡,反应向右进行。
(2)①根据反应过程中CO 2 的浓度变化可知,从反应开始到达平衡,CO 2 的浓度变化为0.75 mol·L - 1 ,所以H 2 的浓度变化为3×0.75 mol·L - 1 ="2.25" mol·L - 1 ,H 2 的反应速率为2.25 mol·L - 1 /10 min="0.225" mol·L - 1 ·min - 1 。
②使 增大,需要使平衡向正反应方向移动,升高温度,平衡向逆反应方向移动,A错;再充入H 2 ,CH 3 OH的浓度增大,CO 2 浓度减小,比值增大,B对;再充入CO 2 ,CO 2 的转化率减小,CO 2 浓度增大,CH 3 OH浓度虽然增大,但是不如CO 2 浓度增大的多,比值减小,C错;将H 2 O(g)从体系中分离出来,平衡向右移动,CH 3 OH浓度增大,CO 2 浓度减小,比值增大,D对;充入He对平衡无影响,比值不变,E错
1年前查看全部
增大,需要使平衡向正反应方向移动,升高温度,平衡向逆反应方向移动,A错;再充入H 2 ,CH 3 OH的浓度增大,CO 2 浓度减小,比值增大,B对;再充入CO 2 ,CO 2 的转化率减小,CO 2 浓度增大,CH 3 OH浓度虽然增大,但是不如CO 2 浓度增大的多,比值减小,C错;将H 2 O(g)从体系中分离出来,平衡向右移动,CH 3 OH浓度增大,CO 2 浓度减小,比值增大,D对;充入He对平衡无影响,比值不变,E错
1年前查看全部
- (14分)合成气是以H 2 、CO等为主要组成的供化学合成的原料气,回答有关问题:
(14分)合成气是以H 2 、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为 L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)
CO 2 (g)+H 2 (g)  H=-41.16kJ/mol,对于该反应有关表述正确的是 。
H=-41.16kJ/mol,对于该反应有关表述正确的是 。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H 2 O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO 2 体积比l:9,则该条件下的平衡常数为 (保留两位有效数字)
(3)为除去(2)中生成的CO 2 ,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH - 的物质的量浓度为 ,碳酸氢钾溶液中离子浓度大小顺序为
(4)CO 2 和NH 3 在一定条件下反应生成尿素[CO(NH 2 ) 2 ]:CO 2 (g)+2NH 3 (1)=H 2 O(1)+CO(NH 2 ) 2 (1),CO 2 的转化率随温度变化曲线如下,则该反应 H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO 2 、NH 3 ,应如何处理 。
H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO 2 、NH 3 ,应如何处理 。
 seoul07521年前1
seoul07521年前1 -
 y282292742 共回答了19个问题
y282292742 共回答了19个问题 |采纳率89.5%(14分,每空2分)(1)17.92L
(2)b d 2.0
(3)10 -4 mol/L[K + ]>[HCO 3 ]>[OH]>[H + ]
(4)< 净化后重新充入合成塔内,循环利用,提高原料利用率
(1)甲烷在一定条件下与水反应的方程式为CH 4 +H 2 O→CO+3H 2 ,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为 。
。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该体系温度不再改变,说明此时正逆反应速率相等,即达到平衡状态,b正确。正反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,c不正确。增加水蒸气用量虽然可降低自身的转化率,但会提高其它反应物的转化率,d正确。
(3)碳酸钾水解显碱性,促进了水的电离,所以下pH=10的碳酸钾溶液中水电离的OH - 的物质的量浓度为1×10 -4 mol/L。碳酸氢钾溶液显碱性是因为碳酸氢钾的水解程度大于其电离程度,所以溶液中离子浓度大小顺序为c(K + )>c(HCO 3 - )>c(OH - )>c(H + )>c(CO 3 2 - )。
(4)由图像可看出,在等压时温度越高,二氧化碳的转化率越低,所以正反应是放热反应。为了提高原料的利用率,必须循环使用。1年前查看全部
- (2013•江西二模)Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油
(2013•江西二模)Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气.
(1)已知某反应的平衡常数表达式为:K=
它所对应的化学方程式为:______.c(H2)•c(CO) c(H2O)
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔
〕对该反应的影响如图所示.n(CH4) n(H2O) 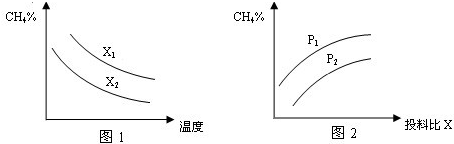
①图1中的两条曲线所示投料比的关系X2______X1(填“=”“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P2______P1.
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:______.
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6,则燃料电池的负极反应式为:______.
Ⅱ、(1)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=______.
(2)在25℃时,将cmol•L-1的醋酸溶液与0.02mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10−9 c−0.02 .2×10−9 c−0.02  lich9991年前1
lich9991年前1 -
 lrj1102 共回答了17个问题
lrj1102 共回答了17个问题 |采纳率88.2%解题思路:(1)化学平衡常数指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写方程式;
(2)①碳水比
值越大,平衡时甲烷的转化率越低,含量越高;n(CH4) n(H2O)
②根据压强对平衡移动影响,结合图象分析解答;
(3)①计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(KOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断;
②依据原电池的原理分析判断,失电子的做负极发生氧化反应,正极上得到电子发生还原反应;反应中C6H12O6失电子生成氢离子,注意电解质溶液是酸溶液;
Ⅱ、(1)c(H+)×c(OH-)=Kw,混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等;
(2)根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),根据溶液的pH值计算溶液中c(H+),根据钠离子浓度计算c(CH3COO-),利用物料守恒计算溶液中c(CH3COOH),溶液中存在平衡CH3COOH⇌CH3COO-+H+,代入CH3COOH的电离常数表达式Ka=
计算;c(CH3COO−)×c(H+) C(CH3COOH) Ⅰ、(1)平衡表达式为:K=
C(H2)•C(CO)
C(H2O),生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)⇌CO(g)+H2(g),
故答案为:C(s)+H2O(g)⇌CO(g)+H2(g);
(2)CH4(g)+H2O(g)=CO(g)+3H2(g);
①碳水比
n(CH4)
n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x2<x1,故答案为:<;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p2<p1,故答案为:<;
(3)①参与反应的氧气在标准状况下体积为4.48L,物质的量为 [4.48L/22.4L/mol]=0.2mol,根据电子转移守恒可知,生成二氧化碳为 [0.2mol×4/8]=0.1mol,n(KOH)=0.15L×1.0mol•L-1=0.15mol,n(KOH):n(CO2)=0.15mol:0.1mol=3:2,发生发生2CO2+3KOH=K2CO3+KHCO3+H2O,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②原电池中失电子的做负极发生氧化反应,正极上得到电子发生还原反应;在硫酸溶液中,C6H12O6失电子生成氢离子,反应为C6H12O6-24e-+6H2O=6CO2+24H+,
故答案为:C6H12O6-24e-+6H2O=6CO2+24H+;
Ⅱ、(1)0.01mol•L-1的NaOH溶液的pH=11,则c(H+)=10-11 mol/L,氢氧化钠是强碱,完全电离,所以氢氧根离子浓度等于氢氧化钠浓度=0.01mol/L,则Kw=c(H+)×c(OH-)=10-11×10-2=1.0×10-13,混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=12的NaOH溶液中氢氧根离子浓度=10 12-13mol/L=0.1mol/L,pH=2的H2SO4溶液氢离子浓度=10-2 mol/L,
0.01 mol/L×VaL=0.1mol/L×VbL,则Va:Vb=10:1,
故答案为:10:1;
(2)根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),溶液中c(OH-)=10-7mol/L,溶液中c(CH3COO-)=c(Na+)=[1/2]×0.02mol•L-1=0.01mol•L-1,故混合后溶液中c(CH3COOH)=[1/2]×cmol•L-1-0.01mol•L-1=(0.5c-0.01)mol/L,CH3COOH的电离常数Ka=
10−7×0.01
0.5c−0.01=
2×10−9
c−0.02,
故答案为:
2×10−9
c−0.02.点评:
本题考点: 体积百分含量随温度、压强变化曲线;pH的简单计算.
考点点评: 本题综合性较大,涉及化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养,题目难度较大.1年前查看全部
- “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0.已知在1 100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值______(填“增大”、“减小”或“不变”);
②1 100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,该反应向______进行(填“左”或“右”),判断依据是浓度商Qc=
=[0.025mol/L/0.1mol/L]=0.25<0.263c(CO2) c(CO) 浓度商Qc=.
=[0.025mol/L/0.1mol/L]=0.25<0.263c(CO2) c(CO)
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
△H=-49.0kJ•mol-1,现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______.
②反应达到平衡后,下列措施能使
增大的是______(填符号).c(CH3OH) c(CO2)
A.升高温度B.再充入H2C.再充入CO2D.将H2O(g)从体系中分离E.充入He(g) 娜吧1年前1
娜吧1年前1 -
 xxxxxxor 共回答了21个问题
xxxxxxor 共回答了21个问题 |采纳率90.5%解题思路:(1)①升高温度平衡向吸热方向移动,根据平衡移动的方向判断平衡常数K值变化;
②计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态;
(2)①根据CO2和CH3OH(g)的浓度随时间的变化的图示,先根据甲醇的浓度变化计算出消耗的氢气的浓度,再计算出氢气的平均反应速率;
②使
增大,反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)向着正向移动,据此根据平衡移动原理进行分析.c(CH3OH) c(CO2) (1)①反应吸热,升高温度平衡向正反应方向移动,则高炉内CO2和CO体积比值增大,平衡常数K值增大,
故答案为:增大;
②1100℃时测得高炉中c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,在这种情况下,浓度商Qc=
c(CO2)
c(CO)=[0.025mol/L/0.1mol/L]=0.25<0.263,所以此时反应未达到化学平衡,反应向着正向进行,正反应速率大于逆反应速率;
故答案为:右; 浓度商Qc=
c(CO2)
c(CO)=[0.025mol/L/0.1mol/L]=0.25<0.263;
(2)①根据图示可知,10min达到平衡状态,甲醇浓度为0.75mol/L,由反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)可知,消耗氢气的浓度为:0.75mol/L×3=2.25mol/L,氢气平均反应速率为:[2.25mol/L/10min]=0.225mol/(L•min),
故答案为:0.225mol/(L•min);
②
c(CH3OH)
c(CO2)增大,反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)向着正向移动,
A.升高温度,该反应放热,升高温度,平衡向着逆向移动,
c(CH3OH)
c(CO2)减小,故A错误;
B.再充入H2,平衡向着正向移动,
c(CH3OH)
c(CO2)增大,故B正确;
C.再充入CO2,平衡向着正向移动,但是二氧化碳浓度增加的大于甲醇增大浓度,
c(CH3OH)
c(CO2)减小,故C错误;
D.将H2O(g)从体系中分离,平衡向着正向移动,
c(CH3OH)
c(CO2)增大,故D正确;
E.充入He(g),各组分浓度不变,平衡不移动,
c(CH3OH)
c(CO2)不变,故E错误;
故选B、D.点评:
本题考点: 化学平衡常数的含义;反应热和焓变;化学平衡建立的过程.
考点点评: 本题考查了化学平衡常数的计算判断,关键理解平衡常数是随温度变化,平衡常数的计算应用,浓度商和平衡常数比较判断反应是否平衡,反应进行的方向,题目难度中等.1年前查看全部
- 下列说法正确的是( )A.一碳化学常指以合成气(CO+H2)等为原料的化工合成.当前的一种有效应用是以合成气生产甲醇,
下列说法正确的是( )
A.一碳化学常指以合成气(CO+H2)等为原料的化工合成.当前的一种有效应用是以合成气生产甲醇,再由甲醇生产汽油,这种技术可以用于煤的液化
B. 碳纳米管是由碳原子构成的一种新材料,如图所示,由此可知,碳纳米管与石墨互为同位素
碳纳米管是由碳原子构成的一种新材料,如图所示,由此可知,碳纳米管与石墨互为同位素
C.海水是卤族元素氯、溴、碘等的主要来源,也是金属元素钠、镁、铝的主要来源
D.合成氨工厂用水将1molCH4转化为4molH2,符合节约资源和保护环境的循环经济和绿色化学原理,但违反了质量守恒定律 Benzino1年前1
Benzino1年前1 -
 微笑青瞳 共回答了25个问题
微笑青瞳 共回答了25个问题 |采纳率88%解题思路:A.一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料合成一系列化工原料和燃料的化学,根据这一原理可制取甲醇;
B.同位素是指同种元素的不同原子;
C.海水是一种化学成分复杂的混合物,包括水、溶解于水中的多种化学元素,含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、硼、氟等;
D.合成氨工厂用水将1molCH4转化为4molH2,符合节约资源和保护环境的循环经济和绿色化学原理,任何化学反应,都遵循质量守恒定律.A.煤的液化,先用一碳化学的原理制取气体,C+H2O
高温
.
CO+H2,CO+H2O
高温
.
CO2+H2,C+CO2
高温
.
2CO,后以合成气生产甲醇:CO+2H2
一定条件
.
CH3OH,故A正确;
B.碳纳米管是由碳原子构成的一种新材料,是单质,石墨也是单质,它们都是碳元素组成的单质,属于同素异形体,故B错误;
C.海水含有氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、碘、硼、氟等,是卤族元素氯、溴、碘等的主要来源,但铝海水中含量不多,且冶炼金属铝通常从铝土矿中冶炼,故C错误;
D.合成氨工厂用水将1molCH4转化为4molH2,氢气是生产氨气的原料,用甲烷生成和水生产氢气,符合节约资源,但任何化学反应均遵循质量守恒定律,故D错误;
故选A.点评:
本题考点: 煤的干馏和综合利用;同位素及其应用;质量守恒定律;海水资源及其综合利用.
考点点评: 该题考查了元素化合物的知识,解答须熟悉同素异形体的概念、一些金属的冶炼方法等相关知识,平时应多注意积累.1年前查看全部
- 合成气(CO+H 2 )是一种重要的化工原料,在化工生产中具有十分广泛的用途. 可以生产被称为21
合成气(CO+H 2 )是一种重要的化工原料,在化工生产中具有十分广泛的用途.可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH 3 OCH 3 )等物质.其工艺流程如下:
(1)写出用合成气生产二甲醚的化学方程式______.
(2)尾气循环中涉及到以下反应:CH 4 (g)+H 2 O(g)⇌CO(g)+3H 2 (g),请写出某温度下该反应的平衡常数表达式______.
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H 1
反应Ⅱ:CO 2 (g)+3H 2 (g)⇌CH 3 (g)+H 2 O(g)△H 2
①下表所列数据是反应在不同温度下的化学平衡常数(K).
由表中数据判断△H 1 ______0(填“>”、“=”、“<”).温度 250 300 350 K 2.041 0.270 0.012
②已和:CH 3 OH(g)+
O 2 (g)═CO 2 (g)+2H 2 (g)△H 3 =-192.9kJ•mol -11 2
H 2 (g)+
O 2 (g)═H 2 O(g)△H 4 =-241.8kJ•mol -11 2
则△H 2 =______.
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池.写出该电池负极的电极反应式______.
 forever_xu1年前1
forever_xu1年前1 -
 chenwanzhou161 共回答了18个问题
chenwanzhou161 共回答了18个问题 |采纳率94.4%(1)一氧化碳和氢气在一定的条件下合成甲醇的化学方程式为:2CO+4H 2
一定条件
.
CH 3 OCH 3 +H 2 O,故答案为:2CO+4H 2
一定条件
.
CH 3 OCH 3 +H 2 O;
(2)反应的平衡常数表达式=
各个生成物平衡浓度系数次方的乘积
各个反应物平衡浓度系数次方的乘积 ,即表达式: K=
c(CO)• c 3 ( H 2 )
c( H 2 O)•c(C H 4 ) ,故答案为: K=
c(CO)• c 3 ( H 2 )
c( H 2 O)•c(C H 4 ) ;
(3)①根据表中数据可以看出:温度越高,化学平衡常数越小,而对于放热反应,该结论成立,故答案为:<;
②根据盖斯定律来计算化学反应的焓变得出△H 2 =-48.9kJ•mol -1 ,故答案为:-48.9kJ•mol -1 ;
(4)燃料电池中,负极上是燃料甲醚发生失电子的氧化反应,在碱性环境下,即为:CH 3 OCH 3 +160H - -12e - ═2CO 3 2- +11H 2 O,故答案为:CH 3 OCH 3 +160H - -12e - ═2CO 3 2- +11H 2 O.1年前查看全部
- (2014•虹口区一模)工业生产合成气,反应的化学方程式是X+H2O 高温 . CO+3H
(2014•虹口区一模)工业生产合成气,反应的化学方程式是X+H2O
CO+3H2,其中x为( )高温 .
A.CH4
B.H2CO3
C.CO2
D.4CH4O 小睛21年前1
小睛21年前1 -
 ff聆风 共回答了15个问题
ff聆风 共回答了15个问题 |采纳率93.3%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式X+H2O
高温
.
CO+3H2,反应物中氧、氢原子个数分别为1、2,反应后的生成物中碳、氧、氢原子个数分别为1、1、6,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和4个氢原子构成,则物质X的化学式为CH4.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- (2010•合肥三模)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.
 (2010•合肥三模)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质.其工艺流程如下:
(2010•合肥三模)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质.其工艺流程如下:
(1)写出用合成气生产二甲醚的化学方程式2CO+4H2
CH3OCH3+H2O一定条件 .2CO+4H2.
CH3OCH3+H2O一定条件 .
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式K=c(CO)•c3(H2) c(H2O)•c(CH4) K=.c(CO)•c3(H2) c(H2O)•c(CH4)
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3(g)+H2O(g)△H2
①下表所列数据是反应在不同温度下的化学平衡常数(K).
由表中数据判断△H1______0(填“>”、“=”、“<”).温度 250 300 350 K 2.041 0.270 0.012
②已和:CH3OH(g)+[1/2]O2(g)═CO2(g)+2H2(g)△H3=-192.9kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(g)△H4=-241.8kJ•mol-1
则△H2=______.
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池.写出该电池负极的电极反应式______. 亿厘1年前1
亿厘1年前1 -
 特别的爱给你 共回答了17个问题
特别的爱给你 共回答了17个问题 |采纳率76.5%解题思路:(1)根据循环流程图可以知道是一氧化碳和氢气在一定的条件下合成甲醇;
(2)反应的平衡常数表达式=[各个生成物平衡浓度系数次方的乘积/各个反应物平衡浓度系数次方的乘积]来回答;
(3)①对于放热反应,温度越高,化学平衡常数越小;
②根据盖斯定律来计算化学反应的焓变;
(4)燃料电池中,负极上是燃料发生失电子的氧化反应.(1)一氧化碳和氢气在一定的条件下合成甲醇的化学方程式为:2CO+4H2
一定条件
.
CH3OCH3+H2O,故答案为:2CO+4H2
一定条件
.
CH3OCH3+H2O;
(2)反应的平衡常数表达式=[各个生成物平衡浓度系数次方的乘积/各个反应物平衡浓度系数次方的乘积],即表达式:K=
c(CO)•c3(H2)
c(H2O)•c(CH4),故答案为:K=
c(CO)•c3(H2)
c(H2O)•c(CH4);
(3)①根据表中数据可以看出:温度越高,化学平衡常数越小,而对于放热反应,该结论成立,故答案为:<;
②根据盖斯定律来计算化学反应的焓变得出△H2=-48.9kJ•mol-1,故答案为:-48.9kJ•mol-1;
(4)燃料电池中,负极上是燃料甲醚发生失电子的氧化反应,在碱性环境下,即为:CH3OCH3+160H--12e-═2CO32-+11H2O,故答案为:CH3OCH3+160H--12e-═2CO32-+11H2O.点评:
本题考点: 用盖斯定律进行有关反应热的计算;电极反应和电池反应方程式;化学平衡常数的含义.
考点点评: 本题考查学生有关化学平衡以及热化学知识,可以根据所学知识来回答,难度较大.1年前查看全部
- (2013•上海模拟)合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:
(2013•上海模拟)合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:
2H2(g)+CO(g)⇌CH3OH(g)+181.6kJ.
已知:某温度下(设温度为T1℃)此反应的平衡常数为160.
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如下表:
比较此时正、逆反应速率的大小:v正______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=______ mol/(L•min);物质 H2 CO CH3OH 浓度/(mol/L) 0.2 0.1 0.4
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是______(选填序号);
a.2v逆(CO)=v正(H2) b.c(CO):c(H2):c(CH3OH)=1:2:1
c.混合气体的平均式量保持不变d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是______(选填序号);
a.其他条件不变,增大压强,平衡常数K<160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题.现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:______. 黄-蓉1年前1
黄-蓉1年前1 -
 kk的猫爪 共回答了28个问题
kk的猫爪 共回答了28个问题 |采纳率92.9%解题思路:(1)计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=[△c/△t]计算v(CH3OH);
(2)依据反应特征和平衡标志分析,正逆反应速率相同,各组分含量保持不变分析;
(3)a.其他条件不变,增大压强,平衡常数不变;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行;
d.其他条件不变,增大甲醇的物质的量,平衡逆向进行,正逆反应速率也会随之逐渐增大;
(4)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;(1)由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=[0.4
0.22×0.1=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,依据图表计算起始量;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.80.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
0.3mol/L/10min]=0.03mol/(L•min),
故答案为:>;0.03;
(2)2H2(g)+CO(g)⇌CH3OH(g)+181.6kJ,反应是气体体积减小的放热反应
a.反应速率之比等于化学方程式计量数之比,2v逆(CO)=v正(H2),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故a正确;
b.c(CO):c(H2):c(CH3OH)=1:2:1,只能说明浓度比等于反应比,和起始量变化量有关,不能说明反应达到平衡,故b错误;
c.反应前后气体物质的量减小,质量不变,混合气体的平均式量保持不变,说明反应达到平衡状态,故c正确;
d.反应前后气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故d错误;
故答案为:a c;
(3)a.其他条件不变,增大压强,平衡常数不变,故a错误;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小,故b正确;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行,故c错误;
d.其他条件不变,增大甲醇的物质的量,增大生成物浓度,平衡逆向进行,正逆反应速率也会随之逐渐增大,故d正确;
故答案为:b d;
(4)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低:点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法;化学平衡状态的判断.
考点点评: 本题考查化学平衡常数、化学平衡影响因素、反应速率计算、反应中能量变化等,难度中等,注意理解掌握平衡常数和平衡标志的理解应用.1年前查看全部
- (2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广
 (2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
(2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
CO(g)+H2(g),此反应是吸热反应.高温
①此反应的化学平衡常数表达式为c(CH3OH) c(CO)×c(H2) ;c(CH3OH) c(CO)×c(H2)
②下列能增大碳的转化率的措施是______;
A.加入C(s)B.加入H2O(g)C.升高温度D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+[3/2]O2(g)⇌CO(g)+2H2O(g)△H=-519KJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是______(填“X”或“Y”或“Z”),选择的理由是______;
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)⇌CH3OH(g);△H=-90.8kJ•mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正______v逆 (填“>”、“<”或“=”).物质 H2 CO CH3OH 浓度/(mol•L-1) 0.2 0.1 0.4
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=______mol-1•(L•min)-1.
(4)生产过程中,合成气要进行循环,其目的是______. 1215930541年前1
1215930541年前1 -
 在迈阿 共回答了19个问题
在迈阿 共回答了19个问题 |采纳率94.7%解题思路:(1)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②增大碳的转化率,应采取措施使平衡向正反应移动,结合外界条件对平衡移动影响分析;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;
(3)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=[△c/△t]计算v(CH3OH);
(4)合成气进行循环,可以提高原料利用率.(1)①C(s)+H2O(g)
高温
.
CO(g)+H2(g)的平衡常数K=
c(CH3OH)
c(CO)×c(H2),故答案为:
c(CH3OH)
c(CO)×c(H2);
②A.加入固体C(s),不影响平衡移动,故A错误;
B.加入H2O(g),水蒸气的浓度增大,平衡向正反应方向移动,碳的转化率增大,故B正确;
C.正反应是吸热反应,升高温度平衡向正反应方向移动,碳的转化率增大,故C正确;
D.增大压强,平衡向逆反应方向移动,碳的转化率降低,故D错误;
故答案为:BC;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低;
(3)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=[0.4
0.22×0.1=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②依据图表计算起始量;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.80.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
0.3mol/L/10min]=0.03mol/(L•min),
故答案为:0.03;
(4)生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).点评:
本题考点: 化学平衡常数的含义;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数、化学平衡影响因素、反应速率计算、反应中能量变化等,难度中等,注意理解掌握平衡常数的用途.1年前查看全部
- 合成气不但是重要的燃料也是重要化工原料制备合成气的方法有多种
 千年女巫1年前1
千年女巫1年前1 -
 go_boys 共回答了14个问题
go_boys 共回答了14个问题 |采纳率100%合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:①CH4(g)+O2(g)====CO(g)+2H2(g) ΔH1=-36kJ·mol-1②CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH...1年前查看全部
- 甲烷转化为合成气的方程式怎么写
 cindy7691年前1
cindy7691年前1 -
 418293631 共回答了19个问题
418293631 共回答了19个问题 |采纳率94.7%二氧化碳与甲烷反应可以反应.
一种用于甲烷与二氧化碳重整反应的微波催化剂,由载体和活性成分组成.其特征在于:催化剂活性组分为氧化镍,其担载量为3wt%-20wt%;所用的催化剂载体为表面涂覆γ-Al2O3的泡沫陶瓷,泡沫陶瓷的主组分为碳化硅、铁氧体的吸波材料,次组分为用作粘接剂的二氧化硅,载体的重量组成为2%-25%的粘接剂,70%-90%的吸波材料,5%-25%的γ-Al2O3.本发明可以使反应在温和的条件下进行,并且具有较高的合成气收率,很低的反应积炭.CH4+CO2=2CO+2H21年前查看全部
- 工业上可利用合成气(CO和H 2 的混合气体)生产甲醇.已知:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H=-
工业上可利用合成气(CO和H 2 的混合气体)生产甲醇.已知:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H=-92.9kJ/mol 一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是( ) A.该反应的△S<0 B.该反应在任何温度下均能自发进行 C.向容器中充入少量He,平衡向正反应方向移动 D.升高温度平衡向正反应方向移动  湖水的影子1年前1
湖水的影子1年前1 -
 常思艳 共回答了26个问题
常思艳 共回答了26个问题 |采纳率84.6%A、已知:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H=-92.9kJ/mol,由方程式中气体的计量数可知反应后气体物质的量减小,所以熵减小,即△S<0,故A正确;
B、化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自发进行;已知△H<0,△S<0所以反应的在高温时能自发进行,故B错误;
C、向容器中充入少量He,容器体积不变,反应物浓度不变,正逆反应速率不变,所以平衡不移动,故C错误;
D、已知该反应△H<0,所以升高温度平衡逆移,故D错误;
故选A.1年前查看全部
- 将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域.除去水蒸气后的水煤气主要含H2、CO、CO2及
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域.除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气.
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
CO(g)+H2(g),此反应是吸热反应.高温 .
①此反应的化学平衡常数表达式为c(CO)•c(H2) c(H2O) ;c(CO)•c(H2) c(H2O)
②下列能增大碳的转化率的措施是______;
A.加入C(s)B.加入H2O(g)C.升高温度D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+[3/2]O2(g)⇌CO(g)+2H2O(g)△H=-519kJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是______(填“X”或“Y”或“Z”),选择的理由是______;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)⇌CH3OHg);△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如表:
①该时间段内反应速率v(H2)=______mol-1•L-1•min-1.物质 H2 CO CH3OH 浓度/(mol•L-1) 0.2 0.1 0.4
②比较此时正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是______. shinru1年前0
shinru1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一道高二化学题用甲醇替代作为汽车燃料可降低汽车尾气污染。已知用合成气(CO和H2)合成1mol液态甲醇吸收热量为131.
一道高二化学题
用甲醇替代作为汽车燃料可降低汽车尾气污染。已知用合成气(CO和H2)合成1mol液态甲醇吸收热量为131.9KJ,2H2(g)+CO(g)+3/2 O2(g)=CO2(g)+2H2O(g) △H=594.1KI/mol,请写出液态甲醇燃烧声成一氧化碳和水蒸气的热化学方程式
 我是青春无敌1年前2
我是青春无敌1年前2 -
 ff来的 共回答了13个问题
ff来的 共回答了13个问题 |采纳率92.3%CH3OH(l)=CO(g)+2H2(g) H=131.9KJ/mol1年前查看全部
- (1)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,甲烷的部分氧化的热化学反应式如下
(1)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,甲烷的部分氧化的热化学反应式如下:
2CH4(g)+O2 (g)═2CO (g)+4H2(g);△H=-71.2kJ•mol-1.
有研究认为甲烷部分氧化的机理如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1=-890.3kJ•mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g);△H2=+247.3kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=______ 250.3kJ•mol-1
(2)电浮选凝聚法是工业上采用的一种污水处理方法.实验室模拟该方法设计的装置如图所示.
①图中燃料电池是以熔融碳酸盐为电解质,以甲烷为燃料,空气为氧化剂,稀土金属材料为电极.下列物质可用做电池中熔融碳酸盐的是______(填字母). A.MgCO3B.Na2CO3C. NaHCO3 D.(NH4)2CO3
②电解前污水的pH为5.0~6.0,电解一段时间可形成此金属氢氧化物胶体而使污水净化,电解池阳极反应式是______和4OH--4e-→2H2O+O2↑,则阳极产物相互反应生成某金属氢氧化物胶体的离子方程式是______.
③根据图示信息,已知正极的电极反应式是O2+2CO2+4e-=2CO32-,则电池负极反应式是______.
④实验过程中,测得电解池阴极产生44.8L气体(标况),该气体把悬浮物带到水面形成浮渣层,同时在电池的负极通入16.8LCH4(标况),则该电浮选凝聚装置的能量利用率为______. shuizhidao1年前1
shuizhidao1年前1 -
 单丛凤凰 共回答了22个问题
单丛凤凰 共回答了22个问题 |采纳率90.9%解题思路:(1)根据盖斯定律来计算化学反应的焓变;
(2)活泼金属电极做电解池的阳极,通空气的一端是原电池的正极,连接的铁做电解池的阳极,所以铁电极本身放电;,电极反应为:Fe-2e-=Fe2+,燃料电池中,正极发生的反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-),电池是以熔融碳酸盐为电解质,二氧化碳(CO2)可以循环利用.以因为污水的pH在5.0~6.0之间,所以阴极的电极反应为:2H++2e-=H2↑,根据此分析解题.
①燃料电池中,正极上氧化剂得电子发生还原反应;熔融碳酸盐性质要稳定,高温时不能分解;
②铁作阳极,阳极上生成Fe2+,阳极附近生成亚铁离子被氧化为铁离子,反应生成胶体Fe(OH)3;
③燃料电池中,正极上氧化剂得电子发生还原反应,负极上是甲烷失电子发生氧化反应;
④污水的pH在5.0~6.0之间,所以阴极的电极反应为:2H++2e-=H2↑,CH4+4CO32-→5CO2+2H2O+8e-;依据电子守恒计算.(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1=-890.3kJ•mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g);△H2=+247.3kJ•mol-1
③2CH4(g)+O2 (g)═2CO (g)+4H2(g);△H=-71.2kJ•mol-1.
CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=
根据盖斯定律,利用题干所给的热化学方程式,结合盖斯定律计算,[③×2-(①+②)]×[1/2]得到CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=+250.3KJ/mol;
故答案为:+250.3;
(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;熔融碳酸盐性质要稳定,高温时不能分解生成其它物质,
A.MgCO3高温下分解生成氧化镁和二氧化碳而得不到碳酸根离子,故错误;
B.Na2CO3性质较稳定,熔融状态下只发生电离而不发生分解反应,故正确;
C.NaHCO3性质不稳定,易分解而得不到碳酸根离子,故错误;
D.(NH4)CO3性质不稳定,易分解而得不到碳酸根离子,故错误;
故选B;
②阳极上Fe失电子生成亚铁离子,阴极上生成氢氧根离子,电解反应为:2Fe-4e-═2Fe2+,阳极附近生成亚铁离子被氧化为铁离子,反应生成胶体Fe(OH)3;离子反应方程式为:4Fe2++O2+10H2O═4Fe(OH)3(胶体)+8H+;
故答案为:2Fe-4e-═2Fe2+;4Fe2++O2+10H2O═4Fe(OH)3(胶体)+8H+;
③燃料电池中甲烷在负极失电子发生 氧化反应在碱溶液中生成碳酸盐,电极反应式为:CH4+4CO32-→5CO2+2H2O+8e-;
故答案为:CH4+4CO32-→5CO2+2H2O+8e-;
④实验过程中,测得电解池阴极产生44.8L气体(标况)物质的量为2mol,2H++2e-=H2↑,电子转移4mol,该气体把悬浮物带到水面形成浮渣层,同时在电池的负极通入16.8LCH4(标况)物质的量=[16.8L/22.4L/mol]=0.75mol,CH4+4CO32-→5CO2+2H2O+8e-,电子转移0.75mol×8=6mol,则该电浮选凝聚装置的能量利用率[4mol/6mol]×100%=66.7%;
故答案为:66.7%.点评:
本题考点: 热化学方程式;电解原理.
考点点评: 本题考查较综合,涉及了盖斯定律、原电池原理等知识点,明确燃烧热的内涵、原电池原理内涵即可解答,这些知识点都是高考热点,常常以综合题大题出现,涵盖了化学反应原理所有知识,利用教材基础知识采用知识迁移的方法进行解答,难度中等.1年前查看全部
- (2012•宿迁三模)甲醇被称为21世纪的新型燃料,甲烷可制成合成气(CO、H2),再制成甲醇,
(2012•宿迁三模)甲醇被称为21世纪的新型燃料,甲烷可制成合成气(CO、H2),再制成甲醇,
代替日益供应紧张的燃油.
(1)已知:①CH4(g)+H2O (g)=CO (g)+3H2(g)△H1=+206.2kJ•mol-1
②CH4(g)+[1/2]O2(g)=CO(g)+2H2(g)△H2=-35.4kJ•mol-1
③CH4(g)+2H2O (g)=CO2(g)+4H2(g)△H3=+165.0kJ•mol-1
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为______.
(2)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac+CO+NH3[Cu(NH3)3]Ac•CO△H<0,Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是______,该反应的△S______0(填“>”、“=”或“<”)
(3)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g)△H2<0
①对于反应A,某温度下,将4mol CO2和12mol H2,充入2L的密闭容器中,充分反应达到平衡后,测得c(CO2)=0.5mol•L-1,则该温度下该反应的平衡常数______
②对于反应B,若容器容积不变,下列措施可提高CO的转化率是______
A.降低温度B.增加CO的量
C.充入He,使体系总压强增大 D.再充入1mol CO和2mol H2
(4)某种甲醇-空气燃料电池是采用铂作为电极,氢氧化钾作电解质溶液.其工作时负极的电极反应式可表示为______
(5)用上述碱性甲醇-空气燃料电池电解硫酸钠溶液(均为铂电极),标准状况下阳极得到VL的气体,计算消耗甲醇的质量为______g. hhayy1年前1
hhayy1年前1 -
 连云港宅 共回答了17个问题
连云港宅 共回答了17个问题 |采纳率94.1%解题思路:(1)根据盖斯定律结合热化学方程式的意义来回答即可;
(2)已知正反应是气体物质体积减小的放热反应,据此分析;
(3)①根据化学平衡三行式计算化学平衡常数;
②根据化学平衡移动原理,提高CO的转化率,即让化学平衡正向移动即可;
(4)燃料电池中,负极上发生失电子的氧化反应;
(5)根据电子守恒结合两极上的电极反应进行计算即可.(1)根据盖斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2-(+165.0)]kJ•mol-1=+247.4 kJ•mol-1,所以CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H3=+247.4 kJ•mol-1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H3=+247.4 kJ•mol-1;
(2)已知正反应是气态物质体积减小的放热反应,因此熵变是小于零的,且采用降低温度、增大压强能使平衡右移,提高CO的转化率,故答案为:低温、高压;
低温、高压,<;
(3)①将4mol CO2和12mol H2,充入2L的密闭容器中,充分反应达到平衡后,测得c(CO2)=0.5mol•L-1,则该温度下该反应的平衡常数
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
初始浓度:2 60 0
变化浓度:1.54.51.5 1.5
平衡浓度:0.51.5 1.5 1.5
化学平衡常数K=
c(CH3OH)•c(H2O)
c(CO2)•c3(H2)=[1.5×1.5
0.5×1.53=
1/3](或者0.33)
②对于反应B:CO(g)+2H2(g)⇌CH3OH(g)△H2<0,若容器容积不变,使化学平衡正向移动的措施可提高CO的转化率.
A.降低温度能使化学平衡正向移动,可提高CO的转化率,故a正确;
B.增加CO的量,使得CO的转化率减小,故b错误;
C.充入He,使体系总压强增大,但是各组分浓度不变,平衡不移动,故c错误;
D.再充入1mol CO和2molH2,即相当于在增大压强,所以化学平衡正向移动,可提高CO的转化率,故d正确;
故选:a、d;
(4)甲醇-空气燃料电池中,负极上是燃料发生失电子的氧化反应,在碱性环境下,电极反应为:CH3OH-6e+8OH-=CO32-+6H2O,故答案为:CH3OH-6e+8OH-=CO32-+6H2O;
(5)碱性甲醇-空气燃料电池电解硫酸钠溶液(均为铂电极),标准状况下阳极得到的VL气体是氧气,根据电极反应式,设消耗甲醇的量是n,得出:
2CH3OH~12e-~3O2,
2 3
n [V/22.4]
[2/n=
3
V
22.4],解得n=[V/33.6]mol,所以消耗甲醇的质量:m=[V/33.6]mol×32g/mol=0.95V,故答案为:0.95V.点评:
本题考点: 用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了运用盖斯定律计算焓变、热化学方程式的书写、评价物质合成方案、影响化学平衡的因素、燃料电池等重要考点,涉及的知识点较多,综合性较强,难度较大.1年前查看全部
- 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=______.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是______(填代号).CO H2O CO2 H2 0.5mol 8.5mol 2.0mol 2.0mol
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)⇌2SO3(g);△H=-96.56kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①达到平衡时,平衡常数K(甲)______K(乙)______K(丙)(填“>”、“<”或“=”).
②达到平衡时SO2的浓度C(SO2)(甲)______C(SO2)(乙______C(SO2)(丙)(填“>”、“<”或“=”). moonbox3251年前1
moonbox3251年前1 -
 myrun 共回答了17个问题
myrun 共回答了17个问题 |采纳率70.6%解题思路:(1)由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,费用是吸热反应;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2⇌2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长;
(3)根据盖斯定律可知,①-②可得反应③,再利用Q与K的关系判断反应进行的方向,从而确定正逆反应速率的关系.
(4)①800℃时,平衡常数不变,甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小;
②达到平衡甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫浓度减小,乙容器保持体积不变,丙容器维持绝热反应过程则 温度升高平衡逆向进行二氧化硫浓度增大;(1)由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:升高温度;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2⇌2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH4的转化率随时间变化的图象为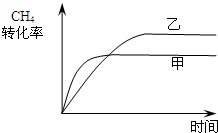 ,故答案为:
,故答案为: ;
;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q=[2.0×2.0/2.0×8.5]<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:-41.2 kJ/mol;a.
(4)①800℃时,平衡常数不变,甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小;
故答案为:=;>;
②达到平衡时都和乙容器中的二氧化硫浓度比较,依据平衡移动原理,甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫浓度减小,乙容器保持体积不变,丙容器维持绝热反应过程则 温度升高平衡逆向进行二氧化硫浓度增大.
故答案为:<;<;点评:
本题考点: 化学平衡建立的过程;化学平衡常数的含义.
考点点评: 本题考查化学反应速率的计算,化学平衡的移动及反应方向的判断,难度较大,(2)是学生解答中的难点,注意利用思维转化的方法来解答.1年前查看全部
- 二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H 2 (g) CH 3 OH(g)△H 1 =-90.7 kJ·mol -1
CH 3 OH(g)△H 1 =-90.7 kJ·mol -1
② 2CH 3 OH(g) CH 3 OCH 3 (g)+H 2 O(g)△H 2 =-23.5 kJ·mol -1
CH 3 OCH 3 (g)+H 2 O(g)△H 2 =-23.5 kJ·mol -1
③ CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)△H 3 =-41.2kJ·mol -1
CO 2 (g)+H 2 (g)△H 3 =-41.2kJ·mol -1
回答下列问题:
(1)则反应3H 2 (g)+3CO(g) CH 3 OCH 3 (g)+CO 2 (g)的△H= kJ·mol -1 。
CH 3 OCH 3 (g)+CO 2 (g)的△H= kJ·mol -1 。
(2)下列措施中,能提高CH 3 OCH 3 产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH 3 OCH 3 的产率,原因是 。
(4)将合成气以n(H 2 )/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H 2 (g)+2CO(g) CH 3 OCH 3 (g)+H 2 O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH 3 OCH 3 (g)+H 2 O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0
B.P 12
3
C.若在P 3 和316℃时,起始时n(H 2 )/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H 2 制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
图1图2 图3
(7)甲醇液相脱水法制二甲醚的原理是:CH 3 OH +H 2 SO 4 →CH 3 HSO 4 +H 2 O,
CH 3 HSO 4 +CH 3 OH→CH 3 OCH 3 +H 2 SO 4 。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。 蓬蓬裙摆1年前1
蓬蓬裙摆1年前1 -
 万戈 共回答了14个问题
万戈 共回答了14个问题 |采纳率92.9%(1)-246.1 (2)AC
(3)消耗了反应②的H 2 O (g) 有利于反应②正向进行,同时生成了H 2
(4)A (5)2.0
(6)CH 3 OCH 3 -12e - +3H 2 O=2CO 2 ↑+12H +
(7)H 2 SO 4 腐蚀设备或有硫酸废液产生
1年前查看全部
- (2010•江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几
 (2010•江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(2010•江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化.其反应式如下:
CH4(g)+[1/2]O2 (g)═CO (g)+2H2(g);△H=-35.6kJ•mol-1.
则该反应的△S______0(填“>”、“<”或“=”).
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1=-890.3kJ•mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g);△H2=247.3kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=______kJ•mol-1
(2)甲烷水蒸汽催化重整.如右上图所示热氦气从下部流入提供能量.由甲烷和水蒸汽混合气从催化管的上部流入,从下端出来后再向上进入中心管.根据下表数据计算甲烷的转化率为______.
(3)甲烷二氧化碳催化重整.高温下,该反应速率明显降低的原因可能是______.气体 进口温度/℃ 进口压强/MPa 进口流量/g•s-1 出口流量/g•s-1 甲烷 464 4.26 12 5.4
(4)甲烷的部分氧化与重整耦合.以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气.下列说法错误的是______(填序号).
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.发电尾气的出口温度较高,可以利用以节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.因发电尾气反应中包含甲烷燃烧,可实现部分热量自供,可降低成本. vanya771年前1
vanya771年前1 -
 美人狮 共回答了28个问题
美人狮 共回答了28个问题 |采纳率100%解题思路:(1)根据产物和反应物之间气体物质的量之间的关系来回答,根据盖斯定律来计算化学反应的焓变;
(2)根据出口流量和进口流量来计算甲烷的转化率;
(3)根据催化剂受温度的影响来判断反应速率明显降低的原因;
(4)根据反应中二氧化碳的量的控制以及催化剂不会改变化学平衡的移动来回答.(1)反应CH4(g)+[1/2]O2 (g)═CO (g)+2H2(g)前后气体体积增大的反应,熵变减少大于0;根据盖斯定律,利用题干所给的热化学方程式,结合盖斯定律得到CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=250.3KJ/mol,故答案为:>;250.3;
(2)甲烷的转化率=[12−5.4/12]×100%=55%,故答案为:55%;
(3)温度过高,会使得催化剂失去活性,影响该反应速率,此外甲烷在高温条件下分解产生炭黑也影响该反应速率,故答案为:温度过高催化剂失去活性或甲烷在高温条件下分解产生炭黑影响该反应速率;
(4)A.直接利用烟气中的CO2,可以大规模地减少CO2的排放量,故A正确;
B.发电尾气的出口温度较高,可以利用此温度以节约能量,故B正确;
C.使用催化剂只可以改变化学反应速率,不可以改变甲烷的转化率,故C错误;
D.发电尾气反应中包含甲烷燃烧,该燃烧过程会放出大量的热,利用这些能量这样可实现部分热量自供,可降低成本,故D正确.
故选C.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的计算.
考点点评: 本题目是一道有关热化学知识的综合考查题,要求学生具有分析和解决问题的能力,难度大.1年前查看全部
- 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
反应①2H2(g)+CO(g)⇌CH3OH(g)△H1=-90kJ•mol-1
反应②2CH3OH (g)⇌CH3OCH3 (g)+H2O(g)△H2=-24kJ•mol-1
反应③CO(g)+H2O (g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1
(1)反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g) 的△H=______.(用△H1、△H2、和△H3表示).
(2)写出由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为______.
(3)有研究者在催化剂、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是______.
(4)已知某温度下反应②平衡常数K=400.此温度下向恒容密闭容器中充入CH3OH,10min后反应②达到平衡,c平衡(CH3OH)=0.04mol•L-1,计算CH3OH转化率(写出计算过程,结果保留两位有效数字).计算10min内CH3OH的平均反应速率v(CH3OH)=______. guanp12201年前1
guanp12201年前1 -
 q1234qwer1 共回答了18个问题
q1234qwer1 共回答了18个问题 |采纳率83.3%解题思路:(1)由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g);
(2)依据盖斯定律①×2+②得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g);
(3)H2和CO直接制备二甲醚的反应是放热反应,升高温度,平衡向左移动,CO转化率降低;
(4)到平衡时CH3OCH3的浓度为x mol•L-1,依据化学平衡三段式表示出平衡浓度,带入K计算x,带入相应公式计算.(1)①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=2△H1+△H2+△H3,
故答案为:2△H1+△H2+△H3;
(2)①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ•mol-1,
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24kJ•mol-1,
依据盖斯定律①×2+②得到:2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)△H=-204kJ•mol-1,
故答案为:2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)△H=-204kJ•mol-1;
(3)2CO(g)+4H2(g)⇌CH3OCH3+H2O(g)是一个可逆反应,反应是放热反应,升高温度,平衡向左移动,CO转化率降低,
故答案为:H2和CO直接制备二甲醚的反应是放热反应,升高温度,平衡向左移动,CO转化率降低;
(4)设达到平衡时CH3OCH3的浓度为x mol•L-1
2CH3OH (g) CH3OCH3 (g)+H2O(g)
CH3OCH3 (g)+H2O(g)
c开始(mol•L-1)0.04+2x 00
变化(mol•L-1) 2xx x
c平衡(mol•L-1)0.04xx
K=
x2
0.042=400,x=0.8mol•L-1,
CH3OH转化率=[2×0.8/0.04+2×0.8]×100%=97.56%,
v(CH3OH)=[2×0.8mol/L/10min]=0.16 mol•L-1min-1,
故答案为:0.16 mol•L-1min-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算;热化学方程式;化学平衡的计算.
考点点评: 本题考查较为综合,涉及化学平衡的移动、反应速率、平衡常数的计算,为高频考点,题目难度中等,注意把握平衡常数的意义.1年前查看全部
- 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡
 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
则天然气与水蒸气在高温下反应制备合成气的热化学方程式为______.
(2)在一定条件下,向2L的恒容密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间的变化曲线如图甲所示.
①0~2min内,一氧化碳的平均反应速率
v(CO)=______mol•L-1•min-1.
②3min时改变条件.反应进行到4min时,体系中各物质的物质的量如下表所示:
则3~4min平衡向______方向移动,改变的条件可能是______t/min n(CH4)/mol n(H20)/mol n(CO)/mol n(H2)/mol 4 0.18 0.38 0.22 0.66
(3)已知温度、压强和碳水比[n(CH4):n(H2O)=x]对该反应的影响如图乙
①图乙1中,两条曲线所示温度的关系:T1______T2 (填“>”、“<”或“=”,下同)
②图乙2中,两条曲线所示碳水比(x)的关系:x1______x2
③图乙3中,两条曲线所示压强的关系:p1______2. 工9601年前1
工9601年前1 -
 板板559 共回答了14个问题
板板559 共回答了14个问题 |采纳率100%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;
(2)①依据图象计算甲烷的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到一氧化碳的反应速率;
②根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;
(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;
②碳水比[
]值越大,平衡时甲烷的转化率越低,含量越高;n(CH4) n(H2O)
③根据压强对平衡移动影响,结合图象分析解答.(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
依据盖斯定律计算(①-②×3)×[1/2]得到天然气与水蒸气在高温下反应制备合成气的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ•mol-1;
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ•mol-1;
(2)①0~2min内,V(CH4)=[0.2mol/L−0.1mol/L/2min]=0.05mol/L•min;
一氧化碳的平均反应速率v(CO)=V(CH4)=0.05mol/L•min,
故答案为:0.05;
②根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.20.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正反应;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度T1<T2,故答案为:<;
②碳水比[
n(CH4)
n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>.点评:
本题考点: 热化学方程式;反应速率的定量表示方法;化学平衡的影响因素;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、化学计算、离子浓度比较等,难度中等,是对基础知识与学生能力的综合考查.1年前查看全部
- 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象______.
(3)反应③中△H3=______.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是______(填代号).CO H2O CO2 H2 0.5mol 8.5mol 2.0mol 2.0mol
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断. zyhang20991年前1
zyhang20991年前1 -
 小妖的无名指 共回答了19个问题
小妖的无名指 共回答了19个问题 |采纳率94.7%解题思路:(1)根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,以此计算v(H2),由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2⇌2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长;
(3)根据盖斯定律可知,①-②可得反应③,再利用Q与K的关系判断反应进行的方向,从而确定正逆反应速率的关系.(1)根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,则v(CH4)=[1.00mol/L−0.50mol/L/5min]=0.1mol/(L•min),由化学计量数之比等于反应速率之比,
则v(H2)=3×0.1mol/(L•min)=0.3mol/(L•min),由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:0.3 mol/(L•min);升高温度;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2⇌2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH4的转化率随时间变化的图象为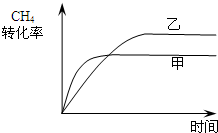 ,故答案为:
,故答案为: ;
;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q=[2.0×2.0/0.5×8.5]<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:-41.2 kJ/mol;a.点评:
本题考点: 化学反应速率的影响因素;用盖斯定律进行有关反应热的计算;化学平衡的影响因素.
考点点评: 本题考查化学反应速率的计算,化学平衡的移动及反应方向的判断,难度较大,(2)是学生解答中的难点,注意利用思维转化的方法来解答.1年前查看全部
- (12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g)⊿H 1 ="+206.1" kJ/mol
CO(g)+3H 2 (g)⊿H 1 ="+206.1" kJ/mol
②CH 4 (g)+CO 2 (g) 2CO(g)+2H 2 (g)⊿H 2 ="+247.3" kJ/mol
2CO(g)+2H 2 (g)⊿H 2 ="+247.3" kJ/mol
③CO(g)+H 2 O(g) CO 2 (g)+ H 2 (g)⊿H 3
CO 2 (g)+ H 2 (g)⊿H 3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正)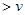 (逆) b.
(逆) b.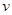 (正)<
(正)<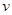 (逆) c.
(逆) c.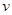 (正)=
(正)=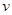 (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO 2 、1mol O 2 ,其反应是2SO 2 (g)+O 2 (g) 2SO 3 (g);△H=-96.56 kJ•mol -1 ,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO 3 (g);△H=-96.56 kJ•mol -1 ,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO 2 的浓度C(SO 2 )(甲) C(SO 2 ) (乙) C(SO 2 ) (丙)(填“>”、“<”或“=”)。 nywangshan1年前1
nywangshan1年前1 -
 草原穆色 共回答了21个问题
草原穆色 共回答了21个问题 |采纳率95.2%(1)升高温度
(2)
(3) —41.2 KJ/mol a(4) 【1】 = > 【2】< <
(1)分析图1,得:10min时,C(CH 4 )减小,则要求①中的平衡正向移动,而升温,可使该平衡正向移动;
(2)甲、乙在相同温度下发生反应②,且均向正向开始反应,甲中保持恒容,乙中保持恒压:
对乙而言,随着反应的正向进行,容积增大,则:P 乙甲 ,而压强越小,反应速率越小,即:υ 乙 <υ 甲 ,则用时:t 乙 >t 甲 ;而压强减小,平衡②将正向移动,则CH 4 的转化率:乙>甲;
(3)① - ②= ③,则 1 ⊿H 2 -⊿H 1 =(206.1-247.3)=—41.2 kJ/mol;
1 ⊿H 2 -⊿H 1 =(206.1-247.3)=—41.2 kJ/mol;
利用表中数据,得浓度积Q=[C(CO 2 )×C(H 2 )]/[C(CO)×C(H 2 O)]=(2×2)/(0.5×8.5)=0.94,
而K=1.0,即Q 3 (正)
3 (正) 4 (逆);
4 (逆);
(4)【1】甲、乙中温度相等,故K (甲)="K" (乙);
△H=-96.56 kJ•mol -1 <0,说明正向是放热反应,丙保持绝热,则反应放出的热量致使体系温度升高,而升温时,该平衡逆向移动,则K值减小,故K (甲)="K" (乙) > K(丙);
【2】甲、乙中比较:初始条件相同,甲保持压强不变,乙容器保持体积不变,则乙中:随着反应的正向进行,气体的量减少,则P 乙甲 ,而压强减小时,平衡将逆向移动,故C(SO 2 ) ( 甲)
2 ) ( 乙) ;
乙、丙中比较:初始条件相同,乙容器保持体积不变,丙容器维持绝热,则丙中:反应放出的热量致使体系温度升高,而升温时,该平衡逆向移动,故C(SO 2 ) ( 乙)2 ) ( 丙) ; 1年前查看全部
- 合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.其制备及运用的一种工艺流程如图所示(其中X与X
合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.其制备及运用的一种工艺流程如图所示(其中X与X′的主要成分类似)

(1)在合成气冶炼金属铁的流程中,向燃烧室中通入甲烷与氧气的目的是______,其最佳体积配比V(CH4):V(O2)为______.
(2)甲醇、二甲醚(CH3OCH3)等物质被称为21世纪的新型燃料,具有清洁、高效等优良的性能.
①写出用合成气生产甲醇的化学方程式:______,
用该方法合成甲醇的最大优点是______.
②用合成气为原料生产二甲醚,随着原料配比的不同反应产物不尽相同,但产生的尾气可循环使用,试写出以CO、H2为原料制取二甲醚的两种不同的化学方程式:______、______.
(3)某化工厂试图使用上图所示流程联合生产甲醇、二甲醚、生铁,你认为是否可行?若不可行,请说明理由;若可行,联合生产有什么优点?______. ttee1年前1
ttee1年前1 -
 懒人酒吧 共回答了22个问题
懒人酒吧 共回答了22个问题 |采纳率95.5%解题思路:(1)甲烷与氧气反应放出大量热;根据反应方程式判断;
(2)①氢气与一氧化碳反应生成甲醇,根据原子守恒书写;
②以CO、H2为原料生成二甲醚,同时生成二氧化碳或水,根据原子守恒书写;
(3)图中所示流程联合生产甲醇、二甲醚、生铁是可行的,从原料利用率等方面分析.(1)甲烷与氧气反应放出大量热,所以向燃烧室中通入甲烷与氧气的目的是为还原铁矿石提供热量;甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2
点燃
.
CO2+2H2O,所以最佳体积配比V(CH4):V(O2)为1:2;
故答案为:为还原铁矿石提供热量;1:2;
(2)①氢气与一氧化碳反应生成甲醇,其反应的方程式为:CO+2H2=CH3OH;反应物全部转化为目标产物,所以该反应的原子利用率为100%;
故答案为:CO+2H2=CH3OH;原子利用率为100%;
②以CO、H2为原料生成二甲醚,同时生成二氧化碳或水,根据原子守恒书写其反应的方程式为:2CO+4H2=CH3OCH3+H2O;3CO+3H2=CH3OCH3+CO2;
故答案为:2CO+4H2=CH3OCH3+H2O;3CO+3H2=CH3OCH3+CO2;
(3)图中所示流程联合生产甲醇、二甲醚、生铁是可行的,因为原料为甲烷、氧气等容易得到、从反应方程式可知原料利用率高、中间产物能有效地循环利用;
故答案为:可行,因为原料易得、原料利用率高、中间产物能有效地循环利用.点评:
本题考点: 化石燃料与基本化工原料.
考点点评: 本题考查了工艺流程图,注意把握工业生产的原理,根据反应物的性质分析,题目难度不大.1年前查看全部
- (2012•丹徒区三模)如图是形成“合成气”的化学反应过程的微观示意图,下列说法中正确的是( )
(2012•丹徒区三模)如图是形成“合成气”的化学反应过程的微观示意图,下列说法中正确的是( )

A.图中的反应物都是单质
B.该反应属于复分解反应
C.化学反应前后氧元素化合价没有改变
D.仅用合成气为原料可合成草酸(H2C2O4) zz_kos1年前1
zz_kos1年前1 -
 NikoRos 共回答了28个问题
NikoRos 共回答了28个问题 |采纳率89.3%解题思路:根据图示进行分析,单质是含有一种元素的纯净物,化合物是含有多种元素的纯净物,复分解反应是指由两种化合物互相交换成分生成两种新的化合物的反应.A、据图可知,反应物有单质和化合物,故A错误;
B、参加反应的物质有单质,不是复分解反应,故B错误;
C、反应前氧元素在水中,反应后氧元素在一氧化碳中,氧元素的化合价都是-2,没有改变,故C正确;
D、使用生成的一氧化碳和氢气不能生成草酸,因为一氧化碳中碳氧原子的个数比为1:1,而草酸中碳氧原子的个数比为1:2,不符合质量守恒定律,故D错误;
故选C.点评:
本题考点: 微粒观点及模型图的应用;单质和化合物的判别;有关元素化合价的计算;反应类型的判定.
考点点评: 本题考查了微观模拟图的应用,完成此题,可以依据题干提供的模拟反应示意图进行.1年前查看全部
- (2014•山东一模)工业上制备合成气的工艺主要是水蒸气重整甲烷:
 (2014•山东一模)工业上制备合成气的工艺主要是水蒸气重整甲烷:
(2014•山东一模)工业上制备合成气的工艺主要是水蒸气重整甲烷:
CH4 (g)+H20(g)═C0(g)+3H2(g)△H>0,在一定 条件下,向体积为1L的密闭容器中充入1mol CH4 ( g)和1mol H20(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如右图所示,下列说法正确的是( )
A.达平衡时,CH4(g)的转化率为75%
B.O-10 min 内,v(CO)=0.075 mol•L-1.min-1
C.该反应的化学平衡常数K=O.1875 mol•L-1
D.当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 ooolll1年前1
ooolll1年前1 -
 hairb 共回答了19个问题
hairb 共回答了19个问题 |采纳率78.9%解题思路:A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,利用浓度变化量之比等于化学计量数之比计算CH4的浓度变化量,再根据转化率=[浓度变化量/起始浓度]×100%计算.
B.利用浓度变化量之比等于化学计量数之比计算CO的浓度变化量,再根据v=[△c/△t]计算v(CO);
C.利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态.A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CH4)=[1/3]△c(H2)=[1/3]×0.75mol/L=0.25mol/L,故甲烷的转化率为:[0.25mol/L/1mol/L]×100%=25%,故A错误;
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=[1/3]△c(H2)=[1/3]×0.75mol/L=0.25mol/L,则v(CO)=[0.25mol/L/10min]=0.025 mol•L-1•min-1,故B错误;
C.平衡时H2的浓度变化量为0.75mol/L,则:
CH4 (g)+H20(g)═C0(g)+3H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.25 0.250.250.75
平衡(mol/L):0.75 0.75 0.25 0.75
故该温度下平衡常数k=
0.25×0.753
0.75×0.75=O.1875 mol2•L-2,故C错误;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确;
故选D.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的计算.
考点点评: 本题考查化学平衡图象、反应速率计算、平衡常数计算、化学平衡有关计算、平衡状态的判断等,难度中等,C选项为易错点,容易忽略平衡常数的单位.1年前查看全部
- (2014•宁波二模)二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
(2014•宁波二模)二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:温度/K 反应I 反应Ⅱ 已知:
K1>K2>K1′>K2′298 K1 K2 328 K1′ K2′
(1)反应Ⅰ的△S______0(填“>”或“<”);反应Ⅱ的平衡常数表达式为K=[CH3OCH3][H2O] [CH3OH] K=,反应Ⅲ是______反应(填“吸热”或“放热”).[CH3OCH3][H2O] [CH3OH]
(2)在合成过程中,因为有CO(g)+H2O(g)⇌CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是______.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数
是______.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是______或______.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在上图中画出t4-t6的变化曲线. neorion1年前1
neorion1年前1 -
 水月果儿 共回答了14个问题
水月果儿 共回答了14个问题 |采纳率92.9%解题思路:(1)根据反应中气体的体积减小可判断反应的焓变;平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;从图中数据可知温度升高反应ⅠⅡ的平衡常数均减小,所以反应ⅠⅡ均是放热反应,△H1、△H2小于0,利用盖斯定律Ⅰ×2+Ⅱ得反应Ⅲ,根据,△H1、△H2判断△H3的正负,确定反应Ⅲ的热效应;
(2)依据化学平衡移动的原理:减小生成物浓度平衡向正方向移动,增大反应物浓度平衡向正方向移动,分析解答;
(3)增大压强,平衡向正反应方向移动,结合图象,判断A、B两条曲线对应的压强,然后利用三段式法解答该题;
(4)①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度.(1)CO(g)+2H2(g)⇌CH3OH(g)是一个气体体积减小的反应,所以熵值减小,△S<0;
依据方程式2CH3OH(g)⇌CH3OCH3(g)+H2O(g)可知K=
[CH3OCH3][H2O]
[CH3OH];
从图中数据可知温度升高反应ⅠⅡ的平衡常数均减小,所以反应ⅠⅡ均是放热反应,△H1、△H2都小于0,利用盖斯定律Ⅰ×2+Ⅱ得反应Ⅲ,则△H3=2×△H1+△H2,△H1、△H2都小于0,所以△H3=2×△H1+△H2<0,故反应Ⅲ是放热反应;
故答案为:<;K=
[CH3OCH3][H2O]
[CH3OH];放热;
(2)依据化学平衡移动原理:减小生成物浓度平衡向正方向移动,增大反应物浓度平衡向正方向移动,在CO(g)+H2O(g)⇌CO2(g)+H2(g)中反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
故答案为:此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
(3)从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,故A曲线对应压强为5.0MPa,曲线对应压强为0.1MPa,从图中可知压强为0.1MPa、温度为200℃时CO的转化率为0.5,设加入COamol,则有H22amol
CO(g)+2H2(g)⇌CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.5a a 0.5a
平衡时(mol) 0.5a a 0.5a
可求得[0.5a/0.5a+a+0.5a]×100%=25%
故答案为:25%;
(4)①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度;
故答案为:增大生成物C浓度或升高温度;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度,所以其图象为: ,
,
故答案为: .
.点评:
本题考点: 反应热和焓变;化学平衡建立的过程;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了熵变焓变的判断、化学平衡常数表达式的书写、外界条件对反应速率的影响等知识点,看清图象表达的含义是解题的关键所以,题目难度中等.1年前查看全部
- 高中化学 工业上制备合成气的工艺主要是水蒸气重
高中化学 工业上制备合成气的工艺主要是水蒸气重


想问一下C选项 解析中K=0.25*0.75^3/0.75*0.75 算完之后化简等于0.25*0.75=3/16=0.1875也不等于0.1575mol^2/L^2 那么C就是对的了 答案说C是错误的 为什么呢
谢谢!
 polo20041年前1
polo20041年前1 -
 站在屋顶上 共回答了8个问题
站在屋顶上 共回答了8个问题 |采纳率87.5%这题和答案别处都对,可能是数据印错了吧,你圈的那个肯定不对1年前查看全部
- 反应热方程式用甲醇替代作为汽车燃料可降低汽车尾气污染.已知用合成气(CO和H2)合成1 mol液态甲醇吸收热量为131.
反应热方程式
用甲醇替代作为汽车燃料可降低汽车尾气污染.已知用合成气(CO和H2)合成1 mol
液态甲醇吸收热量为131.9 kJ,2H2(g)+CO(g)+ O2(g)=CO2(g)+2H2O(g)
△H=—594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1452 kJ mol-
但是为什么CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O(g)ΔH =-726 kJ mol-1.不行呢? 430021年前4
430021年前4 -
 juicy2006 共回答了20个问题
juicy2006 共回答了20个问题 |采纳率90%如果2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1452 kJ mol-
是对的 那么你的答案就是对的.老师有问题.1年前查看全部
- (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机
 (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式______.
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3-4min之间,化学平衡向______反应方向移动(填“正”或“逆”).时间/min
物质
浓度0 1 2 3 4 CH4 0.2mol•L-1 0.13mol•L-1 0.1mol•L-1 0.1mol•L-1 0.09mol•L-1 H2 0mol•L-1 0.2mol•L-1 0.3mol•L-1 0.3mol•L-1 0.33mol•L-1
②3min时改变的反应条件是______(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示.
①图1中的两条曲线所示投料比的关系X1______X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式______
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为______. qinglaixia1年前1
qinglaixia1年前1 -
 beyond_chu 共回答了13个问题
beyond_chu 共回答了13个问题 |采纳率92.3%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;(2)反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高;②根据压强对平衡移动影响,结合图象分析解答;(4)①甲烷燃料电池工作时,正极发生还原反应,氧气得电子被还原;②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.(1)已知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),由表中数据可知3-4min之间,CH4浓度减小,H2浓度增大,则反应向生产氢气的方向移动,即向正方向进行,故答案为:正;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p1>p2,故答案为:>;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为[8.96L/22.4L/mol]=0.4mol,根据电子转移守恒可知,生成二氧化碳为[0.4mol×4/8]=0.2mol,n(NaOH)=0.1L×3.0mol•L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,发生发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+).点评:
本题考点: 化学平衡的计算;热化学方程式;化学电源新型电池;化学平衡建立的过程;离子浓度大小的比较.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.1年前查看全部
大家在问
- 1生(某人的)气的英文怎么写
- 2如图,E为AB上一点,以AE为斜边作的腰直角三角形ADE,P是BE的中点,连接PD、PO,证明:PD=PO且PD⊥PO.
- 3下列说法中正确的是 [ ] A.照相机、摄影机镜头表面涂有增透膜,利用了
- 441减x等于14减x的和的方程怎么做
- 5用一根长12.56厘米的铁丝围成一个正方形,正方形的面积是______平方厘米;如果用这根铁丝围成一个圆,这个圆的面积是
- 6baby.i lose myself,i didn't want to say goodbay! 是什么意思?
- 7哪个益智玩具能开拓6岁孩子思维?
- 8英文缩写 a.k.后面通常接人的称呼之类的
- 9溴化锂中央空调中溴化锂的作用?溴化锂中央空调利用水在真空下蒸发吸热原理制冷,那为什么不直接利用真空泵,水在真空蒸发器里变
- 10which cake do you like better ?
- 11作文《我的新学校》500,以上快!!!
- 12英文句子歧义求解Fifty pense is a small price to pay for an apple.A.用
- 13如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
- 14二氧化硫和二氧化氮混合气体如何除去二氧化氮?
- 15混合溶液的PH值计算将0.02mol/L HCl 300mL与 0.01mol/L的盐酸200mL混合,求混合溶液PH.