化学平衡常数K大小比较问题1.温度相同时,对于同一个反应,系数不同时可否比较K的大小2.温度相同时,对与两个不同反应,可
 是人就要ORZ2022-10-04 11:39:541条回答
是人就要ORZ2022-10-04 11:39:541条回答1.温度相同时,对于同一个反应,系数不同时可否比较K的大小
2.温度相同时,对与两个不同反应,可否比较K的大小

已提交,审核后显示!提交回复
共1条回复
 zhizaolove 共回答了22个问题
zhizaolove 共回答了22个问题 |采纳率86.4%- 1 K只与温度有关,与系数无关,温度相同K相同
2 这样比较似乎没什么实际意义 - 1年前
相关推荐
- 当化学平衡常数K大于10的5次方,是不是可逆反应?
 i545781年前1
i545781年前1 -
 finalwish 共回答了23个问题
finalwish 共回答了23个问题 |采纳率95.7%所有反应都是可逆,K大的表示向正反应的程度大于逆反应的,大于10的5次方可以认为不可逆.1年前查看全部
- 为什么化学平衡常数用浓度表示
 toxture1年前3
toxture1年前3 -
 xudfc 共回答了22个问题
xudfc 共回答了22个问题 |采纳率90.9%化学平衡常数不是用浓度表示的,是一个比值…1年前查看全部
- 化学平衡常数变小说明什么?反应物增加还生成物增加
 zlx1094311年前1
zlx1094311年前1 -
 dodoMonica 共回答了16个问题
dodoMonica 共回答了16个问题 |采纳率87.5%根据平衡常数表达式,分子是产物的幂积,分母是反应物的幂积,所以K变小,说明产物浓度变小,反应逆向进行1年前查看全部
- 温度升高化学平衡常数变大平衡移动
温度升高化学平衡常数变大平衡移动
平衡向哪移动 说明正反应吸热还是放热 L-jay1年前1
L-jay1年前1 -
 pf886 共回答了18个问题
pf886 共回答了18个问题 |采纳率88.9%向左移 说明正反应放热 向右则反之1年前查看全部
- 化学平衡常数随温度的升高而增大还是减小
 adishijie81年前3
adishijie81年前3 -
 泰山老王 共回答了17个问题
泰山老王 共回答了17个问题 |采纳率76.5%增大1年前查看全部
- 化学平衡常数,压强为什么不改变它的值?
化学平衡常数,压强为什么不改变它的值?
对于一个反应物系数和大于生成物的可逆反应,增大压强,正向移动,生成物浓度一定增大啊,那为什么化学平衡常数不变?
对于一个反应物系数和大于生成物的可逆反应,增大压强,正向移动,生成物浓度一定增大,那反应物浓度一定就减小啊那为什么不变啊还是没明白 redian1231年前4
redian1231年前4 -
 powerwater 共回答了18个问题
powerwater 共回答了18个问题 |采纳率83.3%化学平衡常数只与温度有关,与压强,体积等因素无关,这是众多实验得来的结论,对于一个反应物系数和大于生成物的可逆反应,增大压强,正向移动,生成物浓度一定增大,确实是如此.
增大压强只是使单位体积内的有效活化分子增多,但百分数不变,而增加温度,增加分子的能量,使许多未活化分子转变为活化分子,百分数增加,大大增加了反应的几率.换句话说,增大压强只是缩小了体积,把活化分子数聚到了一起,增加温度,是把未活化的也转换了活化的,百分比增加.
所以平衡常数只与温度相关.1年前查看全部
- 只有可逆反应才有化学平衡常数吗?
 qq来qq1年前1
qq来qq1年前1 -
 dashman 共回答了26个问题
dashman 共回答了26个问题 |采纳率92.3%是的.如果是单先反应,如Cao+H2O=Ca(OH)2.只要一方没消耗完,反应就继续进行.直到以防消耗完为止.当然这是理论.1年前查看全部
- 为什么在水的电离平衡常数表达式中有水的浓度出现啊 不是说纯液体不在化学平衡常数表达式中出现吗?
为什么在水的电离平衡常数表达式中有水的浓度出现啊 不是说纯液体不在化学平衡常数表达式中出现吗?
这是在鲁科版的教科书中的啊
所以想不明白啊 小翔20031年前1
小翔20031年前1 -
 刚极柔至 共回答了15个问题
刚极柔至 共回答了15个问题 |采纳率86.7%水的浓度可以忽略啊1年前查看全部
- 为什么化学平衡常数只受温度影响
 我们爱落叶1年前1
我们爱落叶1年前1 -
 sws19860613 共回答了19个问题
sws19860613 共回答了19个问题 |采纳率89.5%浓度平衡常数和压强平衡常数.
由于总压强增加,再次达到平衡时,用于计算平衡常数的,反应物与生成物的分压都增加了,所以这样并不能说明K一定增大
平衡常数只与温度有关,这是通过化学热力学得到的结果
ΔG=-RTlnk
一定温度下的吉布斯自由能ΔG是不变的,因此,平衡常数k只与温度有关1年前查看全部
- 求化学平衡常数的微观解释
 qq51281171年前2
qq51281171年前2 -
 绝影寻伯乐 共回答了17个问题
绝影寻伯乐 共回答了17个问题 |采纳率94.1%化学等温式的表达式
△rGm=-RT LnK + RT LnQ
温度一定时,物质标准化学势一定,标准吉布斯函数变也就恒定,标准平衡常数K就是定值了.它是一个量纲值.K越大表示正反应越完全.1年前查看全部
- 化学平衡常数和化学反应速率有什么区别
 又能挣钱了1年前4
又能挣钱了1年前4 -
 joanna881 共回答了20个问题
joanna881 共回答了20个问题 |采纳率90%平衡常数的大小体现一个可逆反应进行的程度大小,平衡常数越大,则表示反应物的转化率越高,它是一个只随温度改变而改变的量,只在可逆反应中才会出现;
速率是指任何一个化学反应都具有的反应进行的速度快慢,它受到很多外界因素的影响,比如:温度、压强(这个条件要求反应中必须有气体参加,而且是密闭容器)、反应物浓度、催化剂等等.
这是两个基本没有关联的量1年前查看全部
- 为什么化学平衡常数跟压强,浓度等无关而只与温度有关?
 an_31年前1
an_31年前1 -
 zgzzpz 共回答了20个问题
zgzzpz 共回答了20个问题 |采纳率100%化学平衡常数是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是...1年前查看全部
- 怎样用化学平衡常数判断反应限度
 倩倩1年前1
倩倩1年前1 -
 coscogreen 共回答了16个问题
coscogreen 共回答了16个问题 |采纳率87.5%△G=△G(标)+RTlnQ,△G(标)=-RTlnK(标),故△G=RTln[Q/K(标)].
△G=0时反应达到化学平衡,即要Q=K(标)1年前查看全部
- 化学平衡常数,电离平衡常数,溶度积都只与温度有关吗?
 球神不败佛1年前3
球神不败佛1年前3 -
 mwd223 共回答了17个问题
mwd223 共回答了17个问题 |采纳率100%对1年前查看全部
- 如果将容器体积扩大一倍或缩小一半,平衡如何移动?用化学平衡常数来说明
 d8fdlog91qdfed1年前2
d8fdlog91qdfed1年前2 -
 龙泉道士 共回答了18个问题
龙泉道士 共回答了18个问题 |采纳率88.9%容器体积扩大一倍,体积增大,压强减小,对于反应前后气体分子数不变的反应,平衡不移动移动;对于反应前后气体分子数改变的反应,平衡向气体分子数增大的方向移动.
容器体积缩小一半,体积减小,压强增大,对于反应前后气体分子数不变的反应,平衡不移动移动;对于反应前后气体分子数改变的反应,平衡向气体分子数减小的方向移动.1年前查看全部
- 化学平衡常数k为什么不受浓度影响?
 D调节奏1年前1
D调节奏1年前1 -
 天天天想我1 共回答了16个问题
天天天想我1 共回答了16个问题 |采纳率87.5%化学平衡常数
是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数
对于化学反应mA+nBpC+qD
在一定温度下达到化学平衡时,其平衡常数表达式为:
K={[C]^p*[D]^q}/{[A]^m*[B]^n}
1)在应用平衡常数表达式时,稀溶液中的水分子浓度可不写.因为稀溶液的密度接近于1 g/mL.水的物质的量浓度为55.6 mol/L.在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去.
2)当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度.
3)化学平衡常数表达式与化学方程式的书写方式有关.同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同.但是这些平衡常数可以相互换算.
化学平衡常数K与反应物和生成物的浓度无关,意思是对于同一个反应,改变反应物或生成物的浓度,平衡虽然按勒夏特列原理的方向移动,但达到新平衡后,平衡常数并未改变.从数学角度看,由于平衡常数是浓度系数次幂的比值,平衡移动造成分子和分母都改变,分数值就可能不变.你可以用具体的数据代入试一下该结论是否成立.如果是改变压强的话,其实道理也是一样的,对于气体,压强变大或者变小多少,气体的体积就想对应的减少多少倍,浓度也就增加或者减少多少倍.所以可以用浓度的角度来理解.1年前查看全部
- 温度改变,化学平衡常数一定改变么?
 root117321年前2
root117321年前2 -
 luoluosuo 共回答了11个问题
luoluosuo 共回答了11个问题 |采纳率90.9%一定会变.鉴于你应该是高中生,这么跟你说吧:就目前人类已经发现的所有反应都伴随着热量的变化,对于一个可逆反应,要么是正向吸热逆向放热,要么就是正向放热逆向吸热.假设一个可逆反应已经达到平衡了,有了一个平衡常数,当你升高温度,反应就朝着吸热的方向进行;当你降低温度了,反应就朝着放热的方向进行;总之,改变温度,平衡就会移动,那么生成物与反应物一边增大一边减小,按照平衡常数的算法,平衡常数是一定会变的.我今年刚刚大一,在我们的书本里面关于平衡常数有这样一个公式:-△Gm=RTLnK △Gm表示吉布斯自由能的变化,R是常数,T表示温度,K表示平衡常数,从这里面就可以看出其中的关系.其实高中应该是会学到:△G=△H-T*△S的,△H表示反应的焓变,△S表示熵变.具体的一些东西还是有待于以后的学习.但是不管怎么说,高中的知识还是可以大致解决这个问题的1年前查看全部
- 压强为什么不能影响化学平衡常数
 helengu11291年前2
helengu11291年前2 -
 meteor_fly 共回答了17个问题
meteor_fly 共回答了17个问题 |采纳率82.4%化学平衡常数,是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数.看它的概念你就能明白了,在一定温度下,它是个常数,只跟温度有关.
精锐教育长宁天山1年前查看全部
- 化学平衡常数小于1或大于1 各代表什么?
 oceanyan1年前1
oceanyan1年前1 -
 lifangwen 共回答了18个问题
lifangwen 共回答了18个问题 |采纳率77.8%想这个没有什么意义吧...
只有反应进度相对于化学平衡常数这一说,
从没听过化学平衡常数和1比较这一说...1年前查看全部
- 如何用化学平衡常数解释勒夏特列原理啊?
 leonge1年前2
leonge1年前2 -
 一个人躲一躲 共回答了14个问题
一个人躲一躲 共回答了14个问题 |采纳率100%某时刻的浓度商Q与平衡常数K的大小关系来判断平衡移动,
Q>K 逆向移动
Q0
K=[NH3]^2 / [N2][H2]^3(只受温度的影响)
Q=c(NH3)^2 / c(N2)c(H2)^3
(1)升高温度 吸热反应温度升高,平衡常数增大 Q1年前查看全部
- 为什么化学平衡常数只和温度有关比如这个反应 N2+6H2=2NH3 ,温度,压强,反应物浓度一定时,当这个反应平衡时,可
为什么化学平衡常数只和温度有关
比如这个反应 N2+6H2=2NH3 ,温度,压强,反应物浓度一定时,当这个反应平衡时,可以求得此时的平衡常数,但是如果加压,反应向正方向进行,当在达到平衡时,各物质的量浓度就不一样了,此时的平衡常数又是一个,但温度没有变,怎么能说明化学平衡常数只和温度有关? 最后的最后的电影1年前1
最后的最后的电影1年前1 -
 月人 共回答了20个问题
月人 共回答了20个问题 |采纳率95%平衡常数表达式表明在一定温度下,体系达成平衡的条件.对于一般可逆反应mA+nB⇋pC+qD 平衡时K=( (C)^p * (D)^q )/( (A)^m * (B)^n )其中(C)(D)等表示 物质C、D的浓度K是平衡常数上述:在一定温度下,可逆反应达到...1年前查看全部
- 化学平衡常数为什么只与温度有关?
 xukejun8911年前1
xukejun8911年前1 -
 xuyue94518 共回答了15个问题
xuyue94518 共回答了15个问题 |采纳率80%根据热力学关系:
RTlnK=△Gθ (θ为上标)
由于对于特定的反应,标准自由能变△Gθ仅是温度的函数,因此平衡常数K也只是温度T的函数,也即K只与温度T有关.1年前查看全部
- K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
A.25℃时,pH均为4的盐酸和NH4I(aq)中,前者KW一定等于后者
B.室温下K(HCN)<K(CH3COOH),说明相同浓度的溶液CH3COONa溶液的pH值一定比NaCN小
C.在500℃、20MPa、5L的密闭容器中进行合成氨的反应,使用催化剂后K值增大
D.2SO2+O2⇌2SO3平衡后,改变某条件K值不变,SO2的转化率就一定不变 luoye4191年前1
luoye4191年前1 -
 夏天的黄昏 共回答了16个问题
夏天的黄昏 共回答了16个问题 |采纳率100%解题思路:A.温度相同,水的离子积常数相同,与溶液酸碱性无关;
B.相同温度下,酸的电离平衡常数越小,其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变;
D.可逆反应中,化学平衡常数不变,说明其温度不变,但不能说明平衡不移动.A.水的离子积常数只与温度有关,与溶液酸碱性无关,温度相同,所以水的离子积常数相同,故A错误;
B.相同温度下,酸的电离平衡常数越小,其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,室温下K(HCN)<K(CH3COOH),则水解程度:CN->CH3COO-,所以相同浓度的溶液CH3COONa溶液的pH值一定比NaCN小,故B正确;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变,催化剂只改变化学反应速率不改变平衡移动,温度不变,其化学平衡常数不变,所以使用催化剂后K值不变,故C错误;
D.2SO2+O2⇌2SO3平衡后,改变某条件K值不变,说明改变条件不是温度,只要改变条件后平衡移动,则SO2的转化率就一定改变,故D错误;
故选B.点评:
本题考点: 离子积常数;化学平衡常数的含义;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查平衡常数含义,平衡常数只与温度有关,与物质浓度、电解质强弱等都无关,知道催化剂不影响平衡移动,只影响反应速率,为易错点.1年前查看全部
- 英语翻译针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独
英语翻译
针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独立方程并进行了热力学平衡计算,研究了水醚比、温度、压力等对平衡的影响.结果表明,发动机的排气温度能够满足二甲醚水蒸气重整所需要的温度,并且在温度大于473K、水醚比为2~4、常压条件下能够获得较高的二甲醚转化率和氢气产率.重整气中主要包含氢气、二氧化碳和过量的水,还含有少量的一氧化碳. 逸盫1年前2
逸盫1年前2 -
 l_nn 共回答了20个问题
l_nn 共回答了20个问题 |采纳率85%According to the steam reforming of dimethyl ether hydrogen reaction system,the calculation of main reaction in the reaction system chemical equilibrium constant temperature relations; Established the reaction system independent equation and thermodynamic equilibrium calculation,the ether,temperature,water than pressure on the influence of the balance.The results show that the engine exhaust temperature can meet steam reforming of dimethyl ether to temperature,and in the temperature than 473 K,water ether than for 2 4,atmospheric pressure conditions can obtain higher dimethyl ether conversion and hydrogen production rate.Reforming gas hydrogen,carbon dioxide,mainly includes and excess water,still contain a small amount of carbon monoxide.1年前查看全部
- 温度变平衡常数一定变吗对于反应物生成物都是固体或纯液体的反应的化学平衡常数又是什么?若果不能表达那这问题不就都不成立了吗
温度变平衡常数一定变吗
对于反应物生成物都是固体或纯液体的反应的化学平衡常数又是什么?若果不能表达那这问题不就都不成立了吗? 曾经不羁的风1年前3
曾经不羁的风1年前3 -
 老把哥 共回答了16个问题
老把哥 共回答了16个问题 |采纳率100%反应物生成物都是固体或者纯液体时是没有平衡常数这一说的,因为固体和液体的密度是一定的,也就是说它没有了物质的量浓度这一说,自然也没有平衡常数这一说了
要是普通的反应物生成物含有气体的反应,温度变化,平衡常数也就变化了1年前查看全部
- 已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到
已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到
已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002 mol/L, c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L ,c(H2)=0.0025mol/L,此时可逆反应是否达到平衡状态? 改名狂人1年前3
改名狂人1年前3 -
 猫的脚印 共回答了17个问题
猫的脚印 共回答了17个问题 |采纳率88.2%k=[c(CO2)*c(H2)]/[c(CO)*c(H2O)]
=(0.0025*0.0025)/(0.002*0.003)=0.0000063/0.000006>1
反应朝逆方向1年前查看全部
- 化学平衡常数公式是怎么得来的,我是说为什么是这样的公式,有什么道理么
化学平衡常数公式是怎么得来的,我是说为什么是这样的公式,有什么道理么
包括对其单位的解释,及其道理(如转化率=反应掉的浓度/原有的浓度,很显而易见的)望详细解释,谢谢! 失却的巫山云雨1年前2
失却的巫山云雨1年前2 -
 cciwczcn 共回答了11个问题
cciwczcn 共回答了11个问题 |采纳率100%化学平衡常数是化学热力学计算所得到的结果,因为任何反应都具有一定的可逆性,所以任何反应都有进行的限度.化学平衡常数就表示了一个反应进行的限度度.
平衡常数的公式应该是由实验测出来的~~最终通过总结得出的~~ 先考虑基元反应,简单处理,设为
aA--bB
正反应速率常数为k1,逆反应速率常数为k-1
达到平衡时,正逆反应速率相等
即k1[A]^a=k-1[B]^b
所以[B]^b/[A]^a=k1/k-1=常数
对于非基元反应aA+bB--dD+eE,它总可以拆成若干个基元反应,最后相乘得到的结果就是[D]^d[E]^e/[A]^a[B]^b=常数
所以会有平衡常数
通常的平衡常数数据都是实验测得的
而ΔG(标准)=-RTlnK是从公式推导的(具体过程我忘了)
其中关键的一步是
G(A)=G(A,标准)+RTln[A]
所以ΔG=ΔG(标准)+RTln[D]^d[E]^e/[A]^a[B]^b
平衡时ΔG=0
故ΔG(标准)=-RTlnK 从物理化学的角度讲,就是△G=0的状态.可以推导就是这个平衡式子;也可以从动力学角度推导,正反应的速度就是各物料的指数幂的积乘以一个常数K+;逆反应也是一样.当正逆反应速度一样时就是说体系到达平衡状态.两个式子相等,整理就得到我们常见的反应平衡公式.可逆反应如此,其他反应都可以分解为一些基元反应,也是可以叠加得到这个式子.这个是很基础的东西,你看看大学物理化学就知道了1年前查看全部
- 化学平衡常数 活化能用阿伦尼乌斯公式求活化能时,可以用压力速率常数吗?请详细说明原因
 昙花而立1年前3
昙花而立1年前3 -
 qieqian 共回答了25个问题
qieqian 共回答了25个问题 |采纳率96%http://www.***.com.cn/Article/CJFD1994-DXHX406.020.htm
我今天查活化能的时候看到这个问题的,我也不是很懂..但是在网上搜到的..你可以看看..很详细..
不过..知网是要收费的..1年前查看全部
- 第一题的化学平衡常数是多少
第一题的化学平衡常数是多少

 bloy91781年前1
bloy91781年前1 -
 作家网 共回答了15个问题
作家网 共回答了15个问题 |采纳率93.3%CO + 2H2===CH3OH
起:1mol/L 3mol/L 0
变:0.9mol/L 1.8mol/L 0.9mol/L
平:0.1mol/L 1.2mol/L 0.9mol/L
平衡常数K==生成物浓度幂的乘积/反应物的浓度幂的乘积
==0.9/(0.1*1.2^2)
=6.251年前查看全部
- 对于一个特定的化学反应,反应物按比例投料,是不是化学平衡常数越大,反应物的转化率越大呢?
 紫妱1年前5
紫妱1年前5 -
 titanman 共回答了19个问题
titanman 共回答了19个问题 |采纳率89.5%不是,在温度一定的条件下,一个反应的平衡常数是定值;但随着起始反应物浓度的不同,转化率不同;即转化率还与起始反应物浓度有关.
❤您的问题已经被解答~(>^ω^1年前查看全部
- 我想知道,化学平衡常数与电离常数有什么相似处和差异?
 叼那省1年前1
叼那省1年前1 -
 wxp2216680 共回答了21个问题
wxp2216680 共回答了21个问题 |采纳率90.5%化学平衡常数适用一切可逆反应,K为温度常数,K值的大小,表示一定温度下,该反应达到平衡时,反应进行的程度.K值越大,表示反应进行的程度越大.电离平衡常数适用弱电解质在一定条件下的电离平衡.影响电离平衡的因素:a.内因:电解质分子内共价键的键能.键能越大,电离常数越小,键能越小,电离常数越大.b.外因:其他条件一定时,温度越高电离常数越大;温度越低电离常数越小.两个常数都受温度影响,这些公式推导过程相似,同属于物理热力学范畴.多元弱酸(多元弱碱)的各级电离常数逐渐减小且一般差别很大,所以其水溶液中的氢离子(或氢氧根离子)主要是由第一步电离产生.1年前查看全部
- 为什么化学平衡常数只与温度有关用原理分析,详细的有追分
 静兰雨哀1年前3
静兰雨哀1年前3 -
 五钟茶 共回答了20个问题
五钟茶 共回答了20个问题 |采纳率75%对于一般可逆反应
aA + b B ======可逆==== gG + hH
平衡时
K=( (G)^g * (H)^h )/( (A)^a * (B)^b )
其中
(G)(H)等表示 物质G、H的浓度
K是平衡常数
上述:
在一定温度下,可逆反应达到平衡时,生成物浓度幂的连乘积与反应物浓度幂的连乘积之比,是一个常数,幂指数为化学计量数
改变温度,K的值会发生变化.
根据热力学关系:
RTlnK=△Gθ (θ为上标)
由于对于特定的反应,标准自由能变△Gθ仅是温度的函数,因此平衡常数K也只是温度T的函数,也即K只与温度T有关.1年前查看全部
- 计算化学平衡常数N2O4(g)= 2NO2(g) 的化学平衡常数怎么算,与"2"有关吗?
 善良不是我的错1年前3
善良不是我的错1年前3 -
 seek100 共回答了14个问题
seek100 共回答了14个问题 |采纳率92.9%有关,前面的化学计量数,就是相应浓度的次幂.使用生成物的的浓度除以反应物浓度,当然不要忘记次幂.只写溶液和气体的浓度,纯固体和纯液体不要写出来.1年前查看全部
- 这题化学平衡题在体积一定的密闭容器中,进行化学反应CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数和温
这题化学平衡题
在体积一定的密闭容器中,进行化学反应CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数和温度的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
为什么这个反应时吸热反应?随着温度增,平衡常数增大,生成物的占的比例大,这就能说明是吸热反应?
能判断该反应是否达到化学平衡状态的依据是
a容器中压强不变 b混合气体中c(CO)不变
c、v正(H2)=v逆(H2O) d、c(CO2)=c(CO)
在830℃时,若CO2的转化率为83%,则H2的转化率是( )83%,大于,小于,还是无法判断. batzone1年前4
batzone1年前4 -
 小迈士 共回答了23个问题
小迈士 共回答了23个问题 |采纳率73.9%化学平衡移动原理三——温度对化学平衡的影响:
在其他条件不变时,升高温度平衡向吸热反应方向移动.
温度升高,生成物比例增大,所以反应是吸热反应~
选择题答案:
BC
首先,化学平衡的定义就是生成物的转化率等于对应的反应物的转化率;其次,在平衡的时候,系统中各个组分的分压或者浓度是不变的,所以选bc.
当830℃时,K=1,即(cCO*cH2O)/(cCO2*H2)=1,设上述反应式中各个物质从左到右的初始浓度分别为a,b,c,d,设H2的转化率为x,并根据物质守恒定律带入上式得到
[17%a·(1-x)b]/[(83%a+c)·(xb+d)]=1
由上述式子可将,由于c,d的值未知,也就是CO和H2O的初始值未知,无法算出x.
当c,d都为零,即系统中一开始没有CO和H2O时,x=17%.
所以,看清题目,大于小于你看着填.1年前查看全部
- 请问你有关“压强改变,化学平衡常数不变”的问题弄明白了吗?
请问你有关“压强改变,化学平衡常数不变”的问题弄明白了吗?
但是比如氮气和氢气生成氨气的反应,增大压强后氨气浓度增大,氮气与氧气浓度减小,按表达式看应该是k变大才对啊? 媚女与日出1年前4
媚女与日出1年前4 -
 小积极 共回答了19个问题
小积极 共回答了19个问题 |采纳率89.5%化学平衡常数是温度的函数.压强、浓度等只能改变一个可逆反应中反应物或生成物的量,也就是平衡浓度抑或是转化率,但生成物的浓度幂比上反应物的浓度幂仍是定值,这个定值就是化学平衡常数.1年前查看全部
- 化学平衡常数和浓度商在公式上有什么区别?
 孙珂0011年前1
孙珂0011年前1 -
 雪梨1084 共回答了16个问题
雪梨1084 共回答了16个问题 |采纳率81.3%格式完全一样.平衡常数中的浓度都是平衡浓度,而浓度商中的浓度是任意浓度.
请参考.1年前查看全部
- 化学平衡常数的公式是什么啊?快告诉我啊谢谢啊
 同一片星空1年前1
同一片星空1年前1 -
 非常低调 共回答了19个问题
非常低调 共回答了19个问题 |采纳率84.2%平衡常数的表达式:① 溶液中的反应:[A] 、[B] 、[C] 、[D] :表示 A 、B 、G 、D 在平衡时的浓度;Kc 为浓度平衡常数;单位:Δn =( x + y )–( m + n ) Δn= 0 时,Kc 无量纲,Δn ≠ 0 时,Kc 有量纲 ,② 气相反应:...1年前查看全部
- co(g)+2h2(g)可逆ch3oh(g) △h=-90.8kj·mol 该反应的化学平衡常数
 爱已腐坏1年前4
爱已腐坏1年前4 -
 namoW-O 共回答了20个问题
namoW-O 共回答了20个问题 |采纳率90%化学平衡常数,是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数.平衡常数一般有浓度平衡常数和压强平衡常数.所以就是
c(CH3OH)/c(CO)c2(H2)
然后你可以自己算了!
有不懂的问我!1年前查看全部
- 化学平衡常数的由来我是一名高二的学生,我们刚刚学习了化学平衡,学习了平衡常数,我想知道平衡常数是怎么发现的,另外,为什么
化学平衡常数的由来
我是一名高二的学生,我们刚刚学习了化学平衡,学习了平衡常数,我想知道平衡常数是怎么发现的,另外,为什么各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数(也就是为什么K值是一定的),能不能解释一下?
请不要直接拷贝百度知道上的词条,因为我之所以问就是因为词条里没有 最爱的aa爱131年前1
最爱的aa爱131年前1 -
 yu04ren 共回答了18个问题
yu04ren 共回答了18个问题 |采纳率88.9%化学平衡常数 是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。平衡常数一般有浓度平衡常数和压强平衡常数。
(1)平衡常数表达式及其意义
对于化学反应 mA+nB(可逆号)pC+qD
在一定温度下达到化学平衡时,其平衡常数表达式为:
k=[c(C)^p*c(D)^q]/[c(A)^m*c(B)^n],
在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
(2)平衡常数的测定
平衡常数可以用实验方法测定,也可以利用热力学数据计算而得。
实验方法通常有化学方法和物理方法。
化学方法是通过化学分析法测定反应达到平衡时各物质的浓度。但必须防止因测定过程中加入化学试剂而干扰了化学平衡。因此,在进行化学分析之前必须使化学平衡“冻结”在原来平衡的状态。通常采用的方法是采取骤冷、稀释或加入阻化剂使反应停止,然后进行分析。例如,要测定反应2H2+O2(可逆号)2H2O在2 000 ℃达到平衡时的平衡常数,可以将一定量的水置于耐高温的合金管中加热,在2 000 ℃时保持一段时间,使之达到化学平衡。然后,将管子骤然冷却,再分析其中H2O、H2、O2的含量,便可计算出在2 000 ℃时这个反应的平衡常数。
物理方法就是利用物质的物理性质的变化测定达到平衡时各物质浓度的变化,如通过测定体系的折光率、电导、颜色、压强或容积的改变来测定物质的浓度。物理方法的优点是在测定时不会干扰或破坏体系的平衡状态。
(3)平衡常数的单位
平衡常数有标准平衡常数和非标准平衡常数之分,前者的量纲为一,后者的量纲取决于平衡常数的表达式。
根据标准热力学函数算得的平衡常数是标准平衡常数,记作K?,又称之为热力学平衡常数;用平衡时生成物对反应物的压力商或浓度商表示的平衡常数是经验平衡常数(Kp或Kc),或称作非标准平衡常数。中学教材中涉及的平衡常数是经验平衡常数。
大家知道,一些重要的热力学函数,如U、H、F、G等的绝对值是无法确定的。为了计算它们的相对大小,需要统一规定一个状态作为比较的标准,这样才不致引起混乱。所谓标准状态是指在温度T和标准压力 (101 325 Pa)下物质的特定状态,简称标准态。热力学数据表中的标准态,国际上都已有明确规定。
对于反应物计量系数之和等于生成物计量系数之和的反应,其经验平衡常数是无量纲的纯数,与压力、浓度所用的单位无关,而且也等于标准平衡常数之值。
对于反应物计量系数之和不等于生成物计量系数之和的反应,则其经验平衡常数是有量纲的量,其数值就与压力、浓度所用的单位有关。也只有当压力、浓度的单位与热力学数据表中对应标准态的单位相同时,所计算的经验平衡常数数值才能与标准平衡常数数值相同。
催化剂对反应速率、化学平衡的影响
对于一个确定的可逆反应来说,由于反应前后催化剂的化学组成、质量不变,因此,无论是否使用催化剂,反应的始、终态都是一样的,则反应的标准吉布斯函数变化是相等的,催化剂对化学平衡无影响。
一个化学反应采用同一种催化剂,可以同等程度改变正、逆反应速率。1年前查看全部
- 关于化学平衡常数的叙述正确的是( )
关于化学平衡常数的叙述正确的是( )
A.无论什么情况下,一个化学反应的平衡常数都是一个定值
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc时,v正<v逆 玉麒麟11年前1
玉麒麟11年前1 -
 dongbo1983 共回答了18个问题
dongbo1983 共回答了18个问题 |采纳率55.6%解题思路:平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,注意同一反应化学计量数不同,平衡常数不同.A、化学平衡常数只与温度有关,当温度一定时,一个化学反应的平衡常数是定值,故A错误;
B、温度一定,同一反应化学计量数不同,平衡常数不同,故B错误;
C、温度一定时,对于给定的化学反应,正反应的反应物和生成物分别为逆反应的生成物和反应物,所以平衡常数互为倒数,故C正确;
D、浓度商Qc<Kc,平衡向正反应进行,v(正)>v(逆),故D错误;
故选:C.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了化学平衡常数及应用,难度不大,注意化学平衡常数只与温度有关,同一反应化学计量数不同,平衡常数不同.1年前查看全部
- 关于化学平衡常数的计算碘与氢气反应生成碘化氢,已知平衡时氢气浓度0.00183摩尔每升,碘的浓度0.003129摩尔每升
关于化学平衡常数的计算
碘与氢气反应生成碘化氢,已知平衡时氢气浓度0.00183摩尔每升,碘的浓度0.003129摩尔每升,碘化氢的浓度0.001767摩尔每升,我分别取小数点后3,4,5位来计算平衡常数,可是为甚麽都算不出老师给的数54.49呢 武竹1年前1
武竹1年前1 -
 小资哥哥 共回答了16个问题
小资哥哥 共回答了16个问题 |采纳率81.3%不要太拘泥于老师给的答案啦,我算出来的是54.53,差一点点不要紧的1年前查看全部
- 算化学平衡常数什么时候不用加水,老师说水当溶剂所以不用加,可是有的反应中反应物或生成物有水啊
算化学平衡常数什么时候不用加水,老师说水当溶剂所以不用加,可是有的反应中反应物或生成物有水啊
请分别给予特例 wzhhui09131年前1
wzhhui09131年前1 -
 nLeafV 共回答了20个问题
nLeafV 共回答了20个问题 |采纳率95%在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必列入平衡关系式中.如:
NH3+H2O==(可逆)NH4+ OH-
K=[NH4+][OH-]/[NH3]
如反应不在水中进行,而水又为生成物时,则水的浓度须列入平衡常数的表达式中,如:
CH3COOH+CH3CH2OH==(可逆)CH3COOCH2CH3+H2O (非水溶剂中)
K=[CH3COOCH2CH3][H2O]/{[CH3COOH][CH3CH2OH]}1年前查看全部
- 在有气体和溶液的情况下,化学平衡常数要不要计算溶液,如何计算
在有气体和溶液的情况下,化学平衡常数要不要计算溶液,如何计算
如题 海市蜃楼19901年前1
海市蜃楼19901年前1 -
 micelikerice 共回答了22个问题
micelikerice 共回答了22个问题 |采纳率95.5%要算,标准平衡常数要求:
气体用分压表示,溶液用浓度表示,平衡常数的表达式为:
例如反应:
Zn (s) + H2SO4 (aq) = H2 (g) + ZnSO4 (aq)
Kθ = [P(H2)/Pθ ][C(ZnSO4)/Cθ] / C(H2SO4) / Cθ]
Pθ = 100 kPa Cθ = 1 mol/L1年前查看全部
- 化学平衡常数K受什么影响?记得老师说是只与温度有关,但是课本上是说:改变浓度,若Q>K,平衡逆向移动;若Q<K,平衡正向
化学平衡常数K受什么影响?
记得老师说是只与温度有关,但是课本上是说:改变浓度,若Q>K,平衡逆向移动;若Q<K,平衡正向移动.改变压强,若Q>K,平衡逆向移动;Q<K,平衡正向自动.升高温度,有利于平衡向吸热方向移动.Why?
 我不是格罗索1年前1
我不是格罗索1年前1 -
 adyduu 共回答了19个问题
adyduu 共回答了19个问题 |采纳率94.7%只受温度和反应内在机理影响.Q为浓度熵,只是通过Q来判断反应是正向还是逆向进行,只是人为判断工具,不影响K值.1年前查看全部
- 下列关于化学平衡常数的说法正确的是( ) A.化学平衡发生移动,平衡常数必发生变化 B.平衡常数发生变化,化学平衡必发
下列关于化学平衡常数的说法正确的是( )
A.化学平衡发生移动,平衡常数必发生变化 B.平衡常数发生变化,化学平衡必发生移动 C.改变浓度,平衡常数一定改变 D.催化剂改变达到平衡的时间,必引起平衡常数的改变  蝶舞飞儿1年前1
蝶舞飞儿1年前1 -
 almondroca 共回答了16个问题
almondroca 共回答了16个问题 |采纳率93.8%B
化学平衡常数只与温度有关,与浓度、压强、催化剂无关;平衡发生移动,是由于Q≠K,可能是Q发生了变化,平衡常数不一定发生变化,但平衡常数发生变化,化学平衡必发生移动。1年前查看全部
- 化学平衡常数 ,是指化学反应可进行的程度 那么在不同的温度下平衡常数是不是不相同啊?
 lanlei1年前1
lanlei1年前1 -
 jsxwj 共回答了19个问题
jsxwj 共回答了19个问题 |采纳率78.9%化学反应与温度有很大的关系,不同的温度平衡常数绝大多数是不同的1年前查看全部
- 化学平衡常数与反应难易度有关吗?
化学平衡常数与反应难易度有关吗?
K值越小,是容易反应还是难反应?
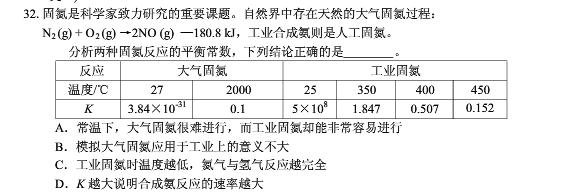
选BC 我想问A为什么错了 还有K与反应速率有关么?
 nzbpngrd1年前2
nzbpngrd1年前2 -
 lsq7902 共回答了17个问题
lsq7902 共回答了17个问题 |采纳率100%K值越大,说明达到平衡时,反应物能更多的转化为产物.
需要注意的是,K值大小只能表示达到平衡时,反应物的转化程度,但不能说明达到平衡所需的时间
A、大气固氮是通过闪电,使N2与O2反应生成NO,进而生成硝酸、硝酸盐,
工业固氮通常利用合成氨,N2+3H2=2NH3,这个反应的条件是高温高压加催化剂,一点也不容易.
K值大小,只反映反应能进行的程度,与反应速率没有关系.
希望对你有所帮助,亲!欢迎追问!1年前查看全部
- 化学平衡常数不是只和温度有关吗 那么在相同温度下为什么对于一个前面系数不同的反应K的值不同? 例如
化学平衡常数不是只和温度有关吗 那么在相同温度下为什么对于一个前面系数不同的反应K的值不同? 例如
H2+I2=2HI 和 1/2H2+1/2 碘 =HI不同啊
 kangtaniubi1年前2
kangtaniubi1年前2 -
 jha578qtr 共回答了20个问题
jha578qtr 共回答了20个问题 |采纳率90%因为在相同温度下物质的量不同【系数的不同】反应所产生的热量不同1年前查看全部
- 关于化学平衡常数K的叙述正确的是( )
关于化学平衡常数K的叙述正确的是( )
A. K值越大,表示化学反应速率越大
B. 对任一可逆反应,温度升高,则K值增大
C. 一般情况下K值越大,可逆反应进行的越彻底
D. 加入催化剂或增大反应物的浓度时,K值均增大 藏尤1年前1
藏尤1年前1 -
 mcj251x 共回答了20个问题
mcj251x 共回答了20个问题 |采纳率90%解题思路:平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,与浓度、压强无关,平衡常数越大,说明可逆反应进行的程度越大.A、K表示可逆反应进行的程度,与速率大小无关,故A错误;
B、K与温度有关,温度升高,则K值可能增大也可能减小,故B错误;
C、K表示可逆反应进行的程度,平衡常数越大,说明可逆反应进行的程度越大,故C正确;
D、同一反应,化学衡常数只受温度影响,与催化剂或反应物的浓度无关,故D错误;
故选C.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了化学平衡常数、影响因素及应用,难度不大,注意化学平衡常数只与温度有关.1年前查看全部
大家在问
- 1英语翻译I feel very sod dhaf you will not work here any mare you
- 2there is an o___ saying,'' A woman 's place is in the home.'
- 3猜谜语 二画大,二画小。(打一字)
- 4亚硫酸钠和硫酸的反应方程式 亚硫酸钠和氧气的反应方程式
- 5一个圆柱体的侧面积是 942cm2,体积是 2355cm3,它的底面积是______ cm
- 6英语,根据答句写问句1 It's about 2300kilometers from here.2 It only to
- 7地心引力的原理牛顿的万有引力定律,任何有质量的两种物质之间都有引力。
- 8地震最高等级最高等级听说是里氏震级10级 可是我怎么看到一本书上说有个丙氏震级十二级啊 听说是智利9.5级地震的一百万倍
- 9哪个是简单句哪个是复合句I wanted to go to the movies tonight,but my husb
- 101、为什么科学家的求知欲这么强?
- 11相同条件下,由1H(含1个质子1个电子)和2H(含1个质子1个中子和1个电子)分别构成的两种气体单质,如果质量相同,下列
- 12在“探究功与速度变化的关系”的试验中,橡皮筋对原来静止的小车做的功为W,小车获得的速度为v,则下列关系式正确的是( )
- 13在1个三角形中,有1个内角是159度,其余2个内角的度数是互质数,这2个内角的度数共有几种不同的答案
- 14已知椭圆x^2/a^2+y^2/b^2=1(a>b>0)的长、短轴端点分别为A、B,从此椭圆上一点M(在x轴上方)向x轴
- 15已知在△ABC中,∠A=80°,∠ABC、∠ACB的角平分线交于点O,则∠BOC=______.
